Method Article
Partikel-Template-Emulgierung ermöglicht mikrofluidsäurefreie Tröpfchen-Assays
In diesem Artikel
Zusammenfassung
Wasser-in-Öl-Tröpfchen-Assays sind nützlich für die analytische Chemie, die Enzymevolution und die Einzelzellanalyse, erfordern jedoch typischerweise Mikrofluidik, um die Tröpfchen zu bilden. Hier beschreiben wir die Partikel-Template-Emulgierung, einen mikrofluidikfreien Ansatz zur Durchführung von Tröpfchenassays.
Zusammenfassung
Reaktionen, die in monodispersierten Tröpfchen durchgeführt werden, bieten eine verbesserte Genauigkeit und Empfindlichkeit im Vergleich zu gleichwertigen Reaktionen, die in großen Mengen durchgeführt werden. Die Anforderung der Mikrofluidik, kontrollierte Tröpfchen zu bilden, stellt jedoch eine Barriere für Nicht-Experten dar, die ihre Verwendung einschränkt. Hier beschreiben wir die Partikel-Template-Emulgierung, einen Ansatz zur Erzeugung monodisperser Tröpfchen ohne Mikrofluidik. Mit Hilfe von Templating-Hydrogelkugeln verkapseln wir Proben in monodispersierten Tröpfchen durch einfaches Vortexieren. Wir demonstrieren den Ansatz, indem wir damit eine mikrofluidikfreie digitale PCR durchführen.
Einleitung
Die Tröpfchenmikrofluidik nutzt die Kompartimentierung in Pikolitertröpfchen, um die Empfindlichkeit und Genauigkeit von Assays im Vergleich zu Massenreaktionen zu erhöhen, und hat zahlreiche Anwendungen im chemischen Screening, Protein-Engineering und next generation sequencing1,2,3. Beispielsweise bietet die digitale Tröpfchenpolymerase-Kettenreaktion (ddPCR) im Vergleich zur quantitativen Massenpolymerase-Kettenreaktion (qPCR) eine erhöhte Genauigkeit mit Anwendungen für genetische Variation bei Krebserkrankungen, den Nachweis krankheitsverursachender Mutationen und die pränatale Diagnostik4,5,6. Eine Herausforderung der Tröpfchenmikrofluidik ist jedoch die Anforderung an mikrofluidische Geräte, Proben zu partitionieren. Während die Mikrofluidik eine ausgezeichnete Kontrolle über die Tröpfcheneigenschaften bietet, erfordert sie spezielles Fachwissen, um zu bauen und zu betreiben7,8. Folglich sind Tröpfchen-basierte Methoden weitgehend auf Expertenlabore oder in seltenen Fällen auf Anwendungen beschränkt, in denen ein kommerzielles Instrument verfügbar ist9,10. Um den Einsatz von Tröpfchenassays zu erweitern, ist die Anforderung an spezialisierte mikrofluidische Instrumente eine Hürde, die überwunden werden muss.
In diesem Artikel beschreiben wir die Particle Templated Emulsification (PTE), eine mikrofluidikfreie Methode zur Durchführung von Reaktionen in monodispersierten Tröpfchen. Bei PTE verschlingen Templatationspartikel die Probe durch einfaches Wirbeln in Tröpfchen im Trägeröl (Abbildung 1). Während sich das System vermischt, fragmentiert sich der wässrige Teil in Tröpfchen von reduzierender Größe, bis die Tröpfchen einzelne Partikel enthalten, an diesem Punkt ist eine weitere Fragmentierung nicht möglich, da die Partikel gebrochen werden müssen. Die verschlungene Probe umgibt die Partikel als Hülle in den Tröpfchen und umschließt dadurch alle dispergierten Zellen, Reagenzien oder funktionellen Einheiten (Abbildung 1D). Daher erfordert PTE keine Ausrüstung oder Fachkenntnisse, um Tröpfchenreaktionen durchzuführen, die über einen gewöhnlichen Vortexer hinausgehen. Darüber hinaus dauert die Tröpfchenerzeugung Sekunden im Vergleich zu Minuten oder Stunden mit Mikrofluidik, und die erzeugte Menge ist proportional zum Behältervolumen, nicht zur Betriebszeit des Geräts, was sie äußerst skalierbar macht. Diese Vorteile machen PTE ideal für die Durchführung von Tröpfchenassays unter einer Vielzahl von Umständen, in denen die Mikrofluidik nicht praktikabel ist. Hier demonstrieren wir PTE und verwenden es, um ddPCR durchzuführen.
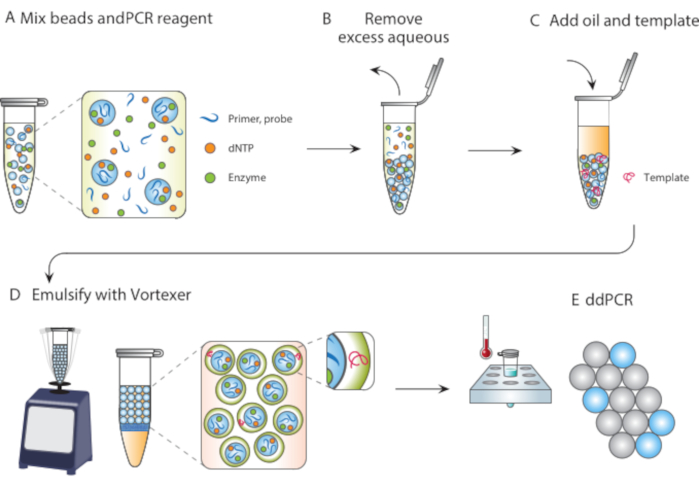
Abbildung 1. Überblick über den Emulgierungsprozess mit Partikelschablonen. (A) Templating-Partikel werden mit Reagenzien gemischt. (B) Überschüssige Reagenzien werden nach der Zentrifugation entfernt. (C) Die Zugabe von Template-Molekülen erfolgt vor der Zugabe von Öl. (D) Vortexing erzeugt Tröpfchen, die ein einzelnes Template-Molekül enthalten. (E) Das anschließende Thermocycling und die Bildgebung ermöglichen eine digitale Tröpfchenanalyse der Zielschablone. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
1. Herstellung von Hydrogelpartikeln für die Emulgierung mit Partikelschablonen.
Hydrogelpartikel, die für die Emulgierung von Partikeln verwendet werden, können mit zwei verschiedenen Methoden hergestellt werden.
- Herstellung mit handelsüblichen Partikeln
- 0,5 g getrocknete Polyacrylamidpartikel, die mit PTE kompatibel sind (z. B. Bio-Gel P-60 Gel (Bio-Rad), 45-90 μm Durchmesser), zu 30 ml sterilem Wasser in einem 50 mL konischen Röhrchen geben und gut mischen. Bei Raumtemperatur 30 min inkubieren.
- Herstellung durch mikrofluidische Herstellung von Partikeln
HINWEIS: Polyacrylamidpartikel, die mit PTE kompatibel sind, können mit handelsüblichen Tropfenmachern (z. B. QX200 Drop Generator (Bio-Rad), RayDrop (Fluigent) usw.) oder durch kundenspezifisches mikrofluidisches Design hergestellt werden.- Herstellung von kundenspezifischen Mastern
- Entwerfen Sie eine weiche Fotolithographiemaske mit CAD-Software (Computer Aided Design). Drucken Sie die Fotomaske mit einer Auflösung von 10 μm auf Leiterplattenfilm.
- Gießen Sie 1 ml Fotolack auf die Mitte eines 3-In-Siliziumwafers. Verwenden Sie einen Spin Coater, um eine 50 μm Dicke aus Fotolack zu erzeugen, indem Sie sie 30 Sekunden lang mit 500 U / min drehen, gefolgt von 1250 U / min für 30 Sekunden. Legen Sie den Wafer für 15 min auf eine auf 95 °C eingestellte Kochplatte, um das Lösungsmittel zu verdampfen.
- Befestigen Sie die Fotomaske mit einem Deckglasobjektträger auf dem Siliziumwafer und belichten Sie den Wafer unter einer kollimierten 190 mW, 365 μm UV-LED für 2,5 min. Legen Sie die Waffel für 5 minuten auf eine auf 95 °C eingestellte Kochplatte für das Backen nach der Belichtung.
- Entwickeln Sie den Fotolack-Silizium-Wafer, indem Sie ihn für bis zu 15 min in ein Bad aus 100% Propylenglykolmonomoethyletheracetat (PGMEA) tauchen. Spülen Sie den Wafer mit frischem 100% PGMEA gefolgt von 100% Isopropanol. Trocknen Sie den Wafer an der Luft.
- Entfernen Sie alle Isopropanolreste, indem Sie den Wafer auf einer auf 95 °C eingestellten Kochplatte für 1 min trocknen. Legen Sie die Waffel in eine saubere 3 in Petrischale.
- Herstellung des kundenspezifischen mikrofluidischen Geräts
- Mischen Sie die Polydimethylsiloxan (PDMS) Siliziumbasis und das Aushärtungsreagenz im Verhältnis 10: 1 nach Masse. Entgasen Sie das gemischte PDMS mit einem Exsikkator unter Hausvakuum, bis keine Luftblasen mehr sichtbar sind.
- Gießen Sie das entgaste PDMS über den Master in der Petrischale, um sicherzustellen, dass der Siliziumwafer vollständig untergetaucht ist. Entgasen Sie den Siliziumwafer und pdMS, um Luftblasen zu entfernen, die sich während des Gießens gebildet haben könnten.
- Härten Sie das PDMS aus, indem Sie den Siliziumwafer und das PDMS für mindestens 60 min in einen auf 65 °C eingestellten Ofen geben. Schneiden Sie einen PDMS-Block mit den mikrofluidischen Merkmalen mit einem Skalpell aus der Petrischale aus. Achten Sie besonders darauf, dass die auf dem Silizium-Master vorhandenen Funktionen nicht beschädigt werden.
- Stanzen Sie die Einlässe und Auslässe mit einem 0,75 mm Biopsiestempel in den PDMS-Block, der den Ein- und Auslässen im mikrofluidischen Gerät entspricht. Entfernen Sie Staub und Partikel durch wiederholtes Auftragen und Entfernen von Verpackungsband auf die Oberfläche des PDMS-Blocks.
- Reinigen Sie einen 50 mm x 75 mm großen Glasobjektträger, indem Sie ihn mit 100% Isopropanol abspülen und anschließend die Oberfläche an der Luft trocknen. Plasma behandelt sowohl den Glasobjektträger als auch das PDMS (Merkmale nach oben) mit 1 mbar O2-Plasma für 1 min mit einem Plasma-Bonder.
- Befestigen Sie das PDMS auf dem Glasobjektträger, indem Sie das plasmabehandelte PDMS mit den Merkmalen nach unten auf den Glasobjektträger legen, die plasmabehandelte Seite nach oben. Legen Sie den Schlitten für mindestens 30 min in einen auf 65 °C eingestellten Ofen, um die Verklebung abzuschließen.
- Behandeln Sie alle mikrofluidischen Kanäle mit einer fluorierten Oberflächenbehandlung, um die Oberflächenhydrophobie zu gewährleisten und eine Benetzung zu verhindern. Backen Sie das Gerät bei 65 °C für mindestens 10 min.
- Herstellung von Vorlagenpartikeln
- Herstellung einer Polyacrylamid (PAA)-Lösung bestehend aus 6,2% Acrylamid, 0,18% N,N′-Methylenbis (Acrylamid) und 0,3% Ammoniumpersulfat. Laden Sie diese Lösung mit einer 28G-Nadel in eine 1-ml-Spritze.
- Herstellen einer unlöslichen kontinuierlichen Phase bestehend aus 5% (w/w) Fluortensid und 1% N,N,NN-Tetramethylethylendiamin (TEMED) in Teilfluoretheröl (HFE) zur Erzeugung und Stabilisierung von Tröpfchen. Laden Sie die Lösung in eine neue 1 ml Spritze.
- Laden Sie sowohl PAA- als auch HFE-Lösung enthaltende Spritzen in Spritzenpumpen (z. B. NE-501). Verbinden Sie beide Spritzen mit dem mikrofluidischen Gerät über einen Polyethylenschlauch, der auf die Spritze und in das Gerät eingesetzt wird. Bereiten Sie vor dem Anschließen die Pumpen an, um die Luft aus dem Schlauch zu entfernen.
HINWEIS: Je nach Modell können Spritzenpumpen mit integriertem Eingang, Herstellungssoftware oder einem benutzerdefinierten Skript (verfügbar unter https://github.com/AbateLab/Pump-Control-Program) gesteuert werden. - Betreiben Sie das Tropfenerzeugungsgerät mit PAA- und HFE-Öleingängen bei 300 μL/h bzw. 500 μL/h. 1 mL der Tröpfchen in einem 15 mL Auffangröhrchen sammeln und für 3 h bei Raumtemperatur zur Polymerisation inkubieren. Entfernen Sie nach der Inkubation die untere Ölschicht durch Pipettieren.
- 1 mL 20% (v/v) Perfluor-1-octanol (PFO) in HFE-Öl als chemischer Demulifikator in das 15 mL Auffangröhrchen geben. Nach dem Mischen das 15 ml Auffangröhrchen bei 2000 x g für 2 min nach unten drehen. Entfernen Sie den PFO/HFE-Überstand durch Pipettieren. Wiederholen Sie 1x.
- Geben Sie 2 ml 2% Sorbitanmonooleat in Hexan in das 15 ml Auffangröhrchen und den Wirbel zum Mischen. Drehen Sie die Röhre bei 3000 x g für 3 min. Entfernen Sie den Überstand durch Pipettieren, um Tensid/ Hexanlösung zu entfernen. Wiederholen Sie 2x.
- Fügen Sie 5 ml TEBST-Puffer (20 mM Tris-HCl pH 8,0, 274 mM NaCl, 5,4 mM KCl, 20 mM EDTA, 0,2% Triton X-100) hinzu und mischen Sie gut. Drehen Sie sich bei 3.000 x g für 3 min. Entfernen Sie den Überstand durch Pipettieren. Wiederholen Sie 3x.
- Resuspend in 5 mL TEBST. Diese Lösung kann unbegrenzt bei 4 °C gelagert werden.
- Herstellung von kundenspezifischen Mastern
2. Emulgierung mit Partikelschablonen.
Nach der Herstellung von Templating-Partikeln wird PTE verwendet, um die Probe und reagenzien in Tröpfchen zu verkapseln.
- Bereiten Sie die Polyacrylamidpartikel für die Partikel-Template-Emulgierung vor, indem Sie bei 6000 x g für 1 min zentrifugieren, um die Partikel zu pelletieren, dann entfernen Sie den Überstand durch Pipettieren und resuspendieren Sie mit sterilem Wasser. Wiederholen Sie 3x, um sicherzustellen, dass alle TEBST-Reste entfernt werden.
- Bestimmen Sie die Konzentration und den Durchmesser der Templating-Partikel mit einem Hämozytometer (oder gleichwertig). Berechnen Sie den einzelnen Partikeldurchmesser, indem Sie die Durchmesser in Pixeln messen und in Mikrometer umrechnen. Die Umrechnung von Pixeln in Mikrometer kann unter Verwendung des Hämozytometers (oder eines gleichwertigen Objektträgers) als Kalibrierungsdia und zur Messung des bekannten Gitterabstands in Pixeln berechnet werden.
- Bereiten Sie die disperse Phase in einem frischen 1,5 ml Mikrozentrifugenröhrchen unter Verwendung einer PCR-Mastermischung, der entsprechenden Primer und einer Fluorescein-Hydrolysesonde gemäß Tabelle 1 vor. Bei Raumtemperatur 5 min unter schonender Bewegung (10 U/min) mit einem Rohrrotator inkubieren, um eine homogene Verteilung der Komponenten zu gewährleisten.
HINWEIS: Das Volumen und die Zielkonzentration der Partikel basieren auf der Poisson-Belastung. In der Regel sollte die Anzahl der Partikel um eine Größenordnung höher sein als die Anzahl der zu verkapselnden Proben. Für Proben unbekannter Konzentrationen ist eine Verdünnungsreihe erforderlich, um die Poisson-Beladung sicherzustellen.
| Volumen | Reagenz |
| 100 μL | Partikel (450 Partikel / μL) |
| 200 μL | 2x PCR Master Mix |
| 18 μL | 10 μM Vorwärtsprimer |
| 18 μL | 10 μM Reverse Primer |
| 18 μL | 10 μM Sonde |
| 0,8 μL | Triton X100 |
| 45,2 μL | Nukleasefreies Wasser |
Tabelle 1. Herstellung des mit PTE verwendeten PCR-Mastermixes für die digitale Tröpfchen-PCR.
- Zentrifugieren Sie die disperse Phase bei 6000 x g für 1 min und entfernen Sie den Überstand. Das Volumen des extrahierten Überstandes ist aufzuzeichnen und anhand des in 2.3 berechneten Gesamtvolumens der dispersen Phase das Pelletvolumen zu bestimmen.
HINWEIS: Die Menge des extrahierten Überstands variiert je nach Partikelpackung, Durchmesser und Konzentration mit einem erwarteten Mindestvolumen von 300 μL. - 1 μL 1,62 pg /μL Saccharomyces cerevisiae genomische DNA aus 2,4 in das Pellet geben und durch Pipettieren oder kräftiges Klopfen gründlich mischen.
HINWEIS: Das Vorhandensein eines überschüssigen wässrigen Inhalts kann die Verkapselungseffizienz verringern. Wenn das Probenvolumen 1% des Pelletvolumens überschreitet, konzentrieren Sie die Probe. Wenn die Probe nicht konzentriert werden kann, skalieren Sie die PCR-Mastermischung und das resultierende Pelletvolumen entsprechend dem Probenvolumen. PTE ermöglicht die Emulgierung von kleinen (10 μL) bis großen (2 ml) Volumina von Templierpartikeln. Die PCR-Mastermischung (2.3) und das Öl (2.6) können entsprechend dem Zielvolumen (2.3) bzw. dem gemessenen (2.4) Volumen des Partikelpellets skaliert werden. - 200 μL 2% Fluortensid in HFE-Öl als unlösliche kontinuierliche Phase für die Emulgierung in das Röhrchen geben. Stellen Sie sicher, dass das Pellet durch Pipettieren oder Klopfen/Flicken des Rohrs gelöst wird. Dann Wirbel bei 3000 U / min für 30 Sekunden.
HINWEIS: Die Einstellung, die 3000 U / min entspricht, kann je nach Marke und Modell variieren. - Lassen Sie die Emulsionen 1 Min. ruhen. Entfernen Sie 100 μL der unteren Ölphase und ersetzen Sie dieses Volumen durch frisches 2% Fluortensid in HFE-Öl. Drehen Sie das Röhrchen mehrmals vorsichtig um, um es zu mischen. Wiederholen Sie dies 3-5x oder bis kleine Satellitentröpfchen entfernt wurden.
3. Digitale Tröpfchen-PCR und Analyse.
- Nach 2-5 Min Absetzzeit die untere Ölphase entfernen. Ersetzen Sie dieses Volumen durch 5% Fluortensid in Fluorcarbonöl (z. B. FC-40).
- Verwenden Sie eine Pipettenspitze mit breiter Bohrung, um die 100 μL der Probe vorsichtig in 200 μL PCR-Röhrchen zu pipettieren. Legen Sie die PCR-Röhrchen in einen Thermocycler und lassen Sie sie gemäß Tabelle 2 laufen.
| Schritt | Temperatur | Dauer | Notizen |
| 1 | 95 °C | 2 Minuten | |
| 2 | 95 °C | 30 Sek. | |
| 3 | 50 °C | 90 Sek. | |
| 4 | 72 °C | 60 Sek. | |
| 5 | x34-Schritte 2 bis 4 wiederholen | ||
| 6 | 72 °C | 2 Minuten | |
| 7 | 4 °C | halten |
Tabelle 2. Thermocycling-Bedingungen für die digitale Tröpfchen-PCR unter Verwendung von PTE-Emulsionen.
- Pipettieren Sie die Probe auf einen Zählobjektträger mit einer Pipettenspitze mit breiter Bohrung für die Fluoreszenzbildgebung. Stellen Sie die Probe mit einem Fluoreszenzmikroskop mit 490 nm Anregung und 525 nm Emissionsdetektionswellenlängen vor.
- Quantifizieren Sie die positiven fluoreszierenden Tröpfchen (Np) und Gesamttropfen (NT), um das Vorhandensein zu überprüfen und die Anzahl der Vorlagenmoleküle (λ) unter Verwendung des Anteils der positiven Tröpfchen (Np / NT) und der Poisson-Statistik zu berechnen:
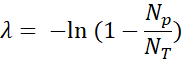
- Berechnen Sie das 95%-Konfidenzintervall (zc = 1,96) wie folgt:
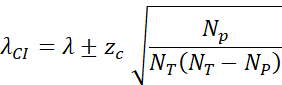
- Berechnen Sie die Probenkonzentration (Moleküle/μL) unter Verwendung des Volumens (ν in μL) der in Schritt 2.5 hinzugefügten Probe unter Verwendung der nachstehenden Gleichung. Bestimmen Sie den Mittelwert und die Standardabweichung der Probenkonzentration mithilfe technischer Replikate.
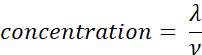
Ergebnisse

Abbildung 2. Verkapselung der Probe in Tröpfchen mittels Partikel-Template-Emulgierung. (A) Templating-Partikel, die für die Emulgierung von Partikeln templieren verwendet werden. (B) Trennung des Templierpartikelpellets vom Überstand nach der Zentrifugation. (C) Tröpfchen, die durch Partikel-Template-Emulgierung mit (D) identifizierbarer wässriger Hülle entstehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bei PTE wird die Monodispersität der Emulsionen durch die der Templierpartikel bestimmt, da die Tröpfchen einen etwas größeren Durchmesser als die Partikel haben. Daher sind gleichmäßige Partikel von zentraler Bedeutung für die kontrollierte PTE-Verkapselung11. Es gibt eine Vielzahl von Methoden zur Erzeugung gleichmäßiger Templating-Partikel, einschließlich chemischer (Sol-Gel, Emulsionspolymerisation), hydrodynamischer (Membranemulgierung, Homogenisierung) und Filtrationsmethoden. Insbesondere mikrofluidische Ansätze bieten eine hervorragende Monodispersität (Abbildung 2A) und ermöglichen zusätzliche Partikeltechnik, um ihre Funktionalität in PTE12 zu verbessern. Alternativ können Templating-Partikel gekauft werden, obwohl ihre Gleichmäßigkeit zwar ausreichend ist, aber typischerweise geringer ist als bei der mikrofluidischen Generation11.
Zur Durchführung von PTE werden die Partikel mit der zu verkapselnden Probe gemischt (Abbildung 1A), und der überschüssige Überstand wird durch Zentrifugation und Pipettieren entfernt (Abbildung 1B), wie durch ein Foto eines Partikelpellets am Boden eines PCR-Rohrs veranschaulicht (Abbildung 2B). Das verkapselnde Öl, das ein stabilisierendes Tensid enthält, wird dann zugegeben (Abbildung 1C), und die Probe wird vorsichtig pipettiert, bevor sie 30 Sekunden lang wirbelt (Abbildung 1D), um die Emulsion zu erzeugen (Abbildung 2C). Die resultierenden Tröpfchen enthalten einen Partikelkern und eine wässrige Hülle, die die Ausgangsprobe umfassen, in der sich die für die Reaktion notwendigen Reagenzien, Zielmoleküle und Zellen befinden (Abbildung 2D). Genau wie bei der mikrofluidischen Tröpfchenverkapselung werden diskrete Einheiten wie kleine Kügelchen oder Zellen zufällig und in Übereinstimmung mit einer Poisson-Verteilung verkapselt, obwohl fast alle Tröpfchen aufgrund der Natur der PTE-Physik ein Templating-Teilchen enthalten.

Abbildung 3. Identifizierung und Bereinigung von partikelschablonierten Emulgierungströpfchen. (A) Beispiel für ungleichmäßige Tröpfchenerzeugung mit mehreren Partikeln pro Tröpfchen aus unzureichender Wirbelung. (B) Erwartetes Vorhandensein von Satelliten und Tröpfchen nach Partikel-Template-Emulgierung und (C) die Wasser-in-Öl-Fraktionierung. (D) Resultierende Emulsion nach dem Waschen des Öls. (E) Übermäßige Satellitenerzeugung infolge von Restüberständen während der Emulgierung mit Partikelschablonen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Selbst bei erfolgreicher PTE gibt es Doppel- oder Dreikerntröpfchen, obwohl sie im Allgemeinen vernachlässigbar zur Reaktion beitragen, sofern sie selten sind. Das Erreichen einer niedrigen Frequenz von Mehrkerntröpfchen unter Beibehaltung geeigneter Schalen erfordert die Optimierung der Prozessparameter, einschließlich Oberflächenspannung, Haftkräfte zwischen Partikeln, Probenviskosität, Behältergröße sowie Wirbelkraft und -zeit. Beispielsweise kann eine schlecht optimierte Emulgierung polydispersierte Tröpfchen mit vielen Templating-Partikeln enthalten (Abbildung 3A), was darauf hindeutet, dass das Vortexing nicht ausreichte, um die Probe vollständig zu emulgieren. In solchen Fällen können Detergenzien hinzugefügt werden, um die Haftung zwischen den Partikeln zu reduzieren und die Oberflächenspannung zu verringern, oder die Wirbelkraft oder -zeit kann erhöht werden. Ein weiteres häufiges Problem ist die Erzeugung von übermäßigen Satelliten, bei denen es sich um kleine leere Tröpfchen handelt (Abbildung 3B). Satelliten können in PTE-Emulsionen unvermeidbar sein, abhängig von der Grenzflächenspannung und den rheologischen Eigenschaften der Probe und des Trägeröls. Sie resultieren jedoch häufig daraus, dass überschüssige Proben vor der Emulgierung nicht ausreichend entfernt werden (Abbildung 2B), oder dass sie mit zu viel Kraft wirbeln und die Schalen von den Tröpfchen entfernen. Bei einer erfolgreichen PTE-Emulgierung sollten Satelliten nicht mehr als ~10% des gesamten verkapselten Probenvolumens ausmachen (Abbildung 3C)11. Auf dieser Ebene tragen sie in der Regel vernachlässigbar zur Reaktion bei und können ignoriert werden. Aus ästhetischen Gründen können sie durch Waschen mit frischem Öl aus der Emulsion entfernt werden (Abbildung 3D).

Abbildung 4. Evaluierung der digitalen Tröpfchen-PCR zur Partikel-Template-Emulgierung. (A) Die fluoreszierende Abbildung der Tröpfchen identifiziert positive fluoreszierende Tröpfchen und negative nicht-fluoreszierende Tröpfchen. (B) Identifizierung seltener Schablonen- oder niedriger Konzentrationen der Schablone mit digitaler Tröpfchen-PCR. (C) Überreiche Template-Verkapselung, was zu einer variablen Anzahl von Template-Molekülen pro Tröpfchen führt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um den Nutzen von PTE zu demonstrieren, haben wir es verwendet, um mikrofluidikfreie digitale PCR11 durchzuführen. Mit dem Verfahren haben wir eine Probe mit genomischer DNA von S. cerevisiae eingekapselt und thermogecyclt. Bei der digitalen PCR werden Tröpfchen, die amplifizierte Targets enthalten, fluoreszierend, während solche ohne dim bleiben. Somit zeigt ein fluoreszierendes Tröpfchen ein Ziel an, das eine direkte Quantifizierung der Ziele durch Zählen positiver Tröpfchen ermöglicht (Abbildung 4A). Die Anzahl der fluoreszierenden Tröpfchen skaliert somit mit den Zielmolekülen und liefert nur wenige positive Ergebnisse, wenn das Ziel selten ist (Abbildung 4B) und viele, wenn es reichlich vorhanden ist (Abbildung 4C). Wie bei der Verkapselung anderer diskreter Komponenten folgt die Zielverkapselung einer Poisson-Verteilung, so dass die positive Tröpfchenfraktion in die Zielkonzentration umgewandelt werden kann (Abbildung 4D), wodurch die Fähigkeit demonstriert wird, eine digitale PCR mit PTE11 durchzuführen.
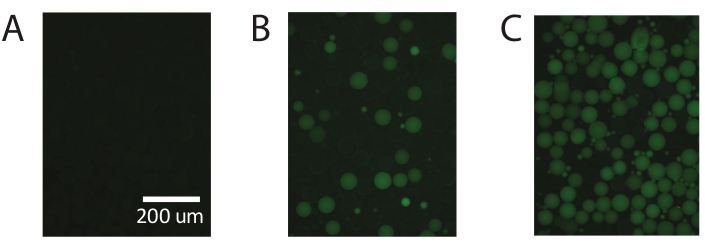
Abbildung 5. Demonstration der digitalen Tröpfchen-PCR mit handelsüblicher PAA. (A) Die fluoreszierende Abbildung der Tröpfchen identifiziert negative nicht-fluoreszierende Tröpfchen. (B) Identifizierung niedriger Konzentrationen der Schablone mit digitaler Tröpfchen-PCR. (C) Identifizierung hoher Konzentrationen der Schablone mit digitaler Tröpfchen-PCR. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diese Ergebnisse sind unter Verwendung kommerziell erhältlicher Polyacrylamidpartikel wiederholbar (Abbildung 5) und demonstrieren die Fähigkeit von PTE, eine digitale Standard-PCR mit kommerziell erhältlichen Polyacrylamidpartikeln durchzuführen und genaue Messungen über den gleichen Bereich zu erzielen.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
PTE verwendet Partikel, um Proben in monodispersierten Tröpfchen durch Wirbeln zu verkapseln. Zusätzlich zu seiner Einfachheit und Zugänglichkeit bietet PTE mehrere zusätzliche Vorteile, einschließlich der Möglichkeit, große Mengen an Tröpfchen sofort zu erzeugen. Darüber hinaus kann der Prozess in einem isolierten Röhrchen durchgeführt werden, wodurch die Notwendigkeit entfällt, Proben an mikrofluidische Geräte zu übertragen, den gesamten Arbeitsablauf zu rationalisieren und die Möglichkeiten für Probenkontamination oder -verlust zu begrenzen. Die Templating-Partikel bieten auch ein Mittel, um den Inhalt der resultierenden Tröpfchenreaktionen zu entwickeln. Zum Beispiel können Partikelgröße, Chemie und Benetzbarkeit für gezielte Biomoleküle oder Zelleinfang entwickelt werden, während funktionelle Einheiten wie Enzyme, Wirkstoffe oder Nukleinsäuren auf Partikeln angezeigt werden können, um Reaktionen zu erleichtern, z. B. für die Einzelzellsequenzierung oder funktionelle Charakterisierung. Obwohl der Ansatz flexibel ist, gibt es dennoch wichtige Einschränkungen für seine Verwendung. Beispielsweise ist es derzeit nicht möglich, Tröpfchenzusätze durchzuführen, wie sie häufig mit der Mikrofluidik durchgeführt werden, so dass alle Reaktionskomponenten vor der Verkapselung eingeführt werden müssen. Dies erfordert, dass Reagenzien kompatibel und stabil sind, bis die Tröpfchen erzeugt werden können, und im Falle problematischer Kombinationen oft durch schnelles Mischen und Emulgieren der Probe auf Eis behoben werden können. Alternativ können reaktive Komponenten verwendet werden, die extern mit Licht oder Wärme ausgelöst werden können13. PTE bietet somit eine flexible und skalierbare Methode zur Durchführung von Tröpfchenassays, die auch für Nicht-Experten zugänglich ist. Dies, gepaart mit seiner angeborenen Einfachheit und Flexibilität, macht PTE ideal für die Ausführung und Entwicklung zahlreicher Tröpfchenanwendungen.
Offenlegungen
Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit zur Entwicklung dieses Protokolls wurde von den National Institutes of Health (R01-EB019453-02), dem Büro des Direktors für nationale Intelligenz, Intelligence Advanced Research Projects Activity durch Raytheon BBN Technologies Corp (N66001-18-C-4507), dem Chan-Zuckerberg Biohub Investigator Program, der Defense Advanced Research Projects Agency über die Texas A & M University (W911NF1920013) und den Zentren für Krankheitskontrolle und Prävention durch die Johns Hopkins University Unterstützt. Physiklabor (75D30-11-9C-06818 (CDC3)). Die hierin enthaltenen Ansichten und Schlussfolgerungen sind die der Autoren und sollten nicht so interpretiert werden, dass sie notwendigerweise die offizielle Politik, weder ausgedrückt noch stillschweigend, der oben genannten Organisationen oder der US-Regierung darstellen. Die US-Regierung ist berechtigt, Nachdrucke für staatliche Zwecke zu reproduzieren und zu verteilen, ungeachtet etwaiger Urheberrechtshinweise darin.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 | |
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ | |
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) |
Referenzen
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501(2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten