Method Article
תחליב בתבנית חלקיקים מאפשר בדיקות טיפות נטולות מיקרופלואידים
In This Article
Summary
בדיקות טיפות מים בשמן שימושיות לכימיה אנליטית, התפתחות אנזימים וניתוח תאים בודדים, אך בדרך כלל דורשות מיקרופלואידיקה כדי ליצור את הטיפות. כאן, אנו מתארים תחליב בתבנית חלקיקים, גישה נטולת מיקרופלואידים לביצוע בדיקות טיפות.
Abstract
תגובות המבוצעות בטיפות מונודיספרסיות מעניקות דיוק ורגישות משופרים בהשוואה לתגובות המקבילות המבוצעות בכמות גדולה. עם זאת, הדרישה של microfluidics ליצור טיפות מבוקרות מטילה מחסום על שאינם מומחים, הגבלת השימוש בהם. כאן, אנו מתארים תחליב בתבנית חלקיקים, גישה ליצירת טיפות מונודיספרסיות ללא מיקרופלואידיקה. באמצעות כדורי הידרוג'ל templating, אנו לתמצת דגימות טיפות monodispersed על ידי מערבולת פשוטה. אנו מדגימים את הגישה באמצעותה כדי לבצע PCR דיגיטלי נטול מיקרופלואידים.
Introduction
מיקרופלואידיקה טיפה ממנפת מידור בטיפות פיקוליטר כדי להגביר את הרגישות והדיוק של בדיקות בהשוואה לתגובות בתפזורת, ויש להם יישומים רבים בהקרנה כימית, הנדסת חלבונים ורצף הדור הבא1,2,3. לדוגמה, תגובת שרשרת פולימראז טיפה דיגיטלית (ddPCR) מעניקה דיוק מוגבר בהשוואה לתגובת שרשרת פולימראז כמותית בתפזורת (qPCR), עם יישומים לשינוי גנטי בסרטן, זיהוי מחלות הגורמות למוטציות, ואבחון טרום הנדסי4,5,6. אתגר של מיקרופלואידיקה טיפה, עם זאת, הוא הדרישה של התקנים microfluidic כדי דגימות מחיצה; בעוד microfluidics להרשות לעצמם שליטה מצוינת על נכסים טיפה, הם דורשים מומחיות מיוחדת לבנות ולהפעיל7,8. כתוצאה מכך, שיטות מבוססות טיפות מוגבלות במידה רבה למעבדות מומחים או, במקרים נדירים, יישומים שבהם מכשיר מסחרי זמין 9,10. כדי להרחיב את השימוש בבדיקות טיפות, הדרישה למכשור מיקרופלואידי מיוחד היא משוכה שיש להתגבר עליה.
במאמר זה, אנו מתארים תחליב תבנית חלקיקים (PTE), שיטה נטולת מיקרופלואידים לביצוע תגובות בטיפות מונודיספרסיות. ב-PTE, חלקיקים טמפלטאים בולעים את הדגימה בטיפות בשמן נושא על ידי מערבולת פשוטה (איור 1). כאשר המערכת מתערבבת, החלק מימי נשבר לתוך טיפות של הקטנת גודל עד טיפות מכילים חלקיקים בודדים, ובשלב זה פיצול נוסף אינו אפשרי כי זה דורש שבירת החלקיקים. הדגימה הנבלעת מקיפה את החלקיקים כקליפה בטיפות, ובכך עוטפת את כל התאים, ריאגנטים או העכוזים התפקודיים (איור 1D). לכן, PTE אינו דורש ציוד או מומחיות כדי לבצע תגובות טיפה מעבר מערבולת נפוצה. בנוסף, ייצור טיפות לוקח שניות לעומת דקות או שעות עם microfluidics, ואת הסכום המיוצר הוא פרופורציונלי נפח המכל, לא זמן הפעולה של המכשיר, מה שהופך אותו מדרגי להפליא. יתרונות אלה הופכים את PTE לאידיאלי לביצוע בדיקות טיפות במגוון נסיבות שבהן מיקרופלואידיקה היא לא מעשית. כאן, אנו מדגימים PTE ומשתמשים בו כדי לנהל ddPCR.
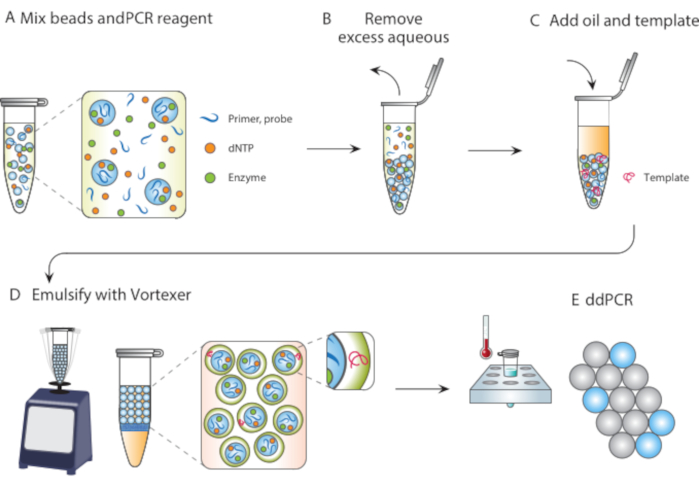
איור 1. מבט כולל על תהליך אמולסיה בתבנית חלקיקים. (A) חלקיקים טמפלטינג מעורבבים עם ריאגנטים. (ב) ריאגנטים עודפים מוסרים לאחר צנטריפוגה. (ג) התוספת של מולקולות תבנית מתרחשת לפני הוספת שמן. (D) מערבולת מייצרת טיפות המכילות מולקולת תבנית אחת. (ה) מיחזור הדמיה וההדמיה הבאים מאפשרים ניתוח טיפות דיגיטלי של תבנית היעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. הכנת חלקיקי הידרוג'ל לתליית חלקיקים בתבנית חלקיקים.
חלקיקי הידרוג'ל המשמשים תחליב תבנית חלקיקים ניתן להכין באמצעות שתי שיטות שונות.
- הכנה באמצעות חלקיקים זמינים מסחרית
- יש להוסיף 0.5 גרם חלקיקי פוליאקרילמיד מיובשים התואמים ל-PTE (למשל, ג'ל ביו-ג'ל P-60 (Bio-Rad), בקוטר 45-90 מיקרומטר) ל-30 מ"ל של מים סטריליים בצינור חרוטי של 50 מ"ל ומערבבים היטב. דגירה בטמפרטורת החדר במשך 30 דקות.
- הכנה באמצעות ייצור מיקרופלואידי של חלקיקים
הערה: חלקיקי Polyacrylamide התואמים PTE ניתן להכין באמצעות יצרני טיפה זמינים מסחרית (למשל, QX200 טיפה Generator (Bio-Rad), RayDrop (Fluigent) וכו '), או על ידי עיצוב microfluidic מותאם אישית.- ייצור מאסטר מותאם אישית
- עצב מסיכת פוטוליתוגרפיה רכה באמצעות תוכנת עיצוב (CAD) בעזרת מחשב. הדפס את מסכת הצילום ברזולוציה של 10 מיקרומטר בסרט מעגלים.
- יוצקים 1 מ"ל של פוטוארסיסט על מרכז של 3 רקיק סיליקון. השתמש מעיל ספין כדי ליצור שכבה 50 מיקרומטר של photoresist על ידי ספינינג זה ב 500 סל"ד במשך 30 שניות ואחריו 1250 סל"ד במשך 30 שניות. מניחים את הוופל על פלטה חמה להגדיר ל 95 °C (5 °F) במשך 15 דקות כדי לאדות את הממס.
- אבטחו את מסכת הצילום על רקיק הסיליקון עם מגלשת זכוכית כיסוי וחשפו את הוופל תחת 190 mW קולימי, 365 מיקרומטר UV LED למשך 2.5 דקות. מניחים את הוופל על פלטה חמה להגדיר ל 95 °C (5 דקות) עבור אפייה לאחר חשיפה.
- לפתח את רקיק סיליקון פוטורסיסט על ידי טבילתו באמבטיה של 100% פרופילן גליקול מונומתיל אתר אצטט (PGMEA) עד 15 דקות. יש לשטוף את הוופל עם 100% PGMEA טרי ואחריו 100% איזופרופנול. אוויר יבש את הוופל.
- הסר כל איזופרופנול שיורית על ידי ייבוש הוופל על פלטה חמה להגדיר ל 95 °C (70 °F) במשך 1 דקות. מניחים את הוופל לתוך 3 נקי בצלחת פטרי.
- ייצור של המכשיר המיקרופלואידי המותאם אישית
- מערבבים את בסיס הסיליקון polydimethylsiloxane (PDMS) ומרפאים ריאגנט ביחס של 10:1 במסה. Degas PDMS מעורב באמצעות חיטוי תחת ואקום הבית עד אין בועות אוויר ניתן לצפות.
- יוצקים את PDMS מנודה על המאסטר בצלחת פטרי, להבטיח את רקיק הסיליקון הוא שקוע לחלוטין. Degas את רקיק הסיליקון ו PDMS כדי להסיר את כל בועות אוויר שאולי נוצרו במהלך לשפוך.
- לרפא את PDMS על ידי הצבת רקיק סיליקון ו- PDMS בתנור להגדיר 65 °C לפחות 60 דקות. Excise בלוק של PDMS המכיל את התכונות microfluidic מצלחת פטרי באמצעות אזמל. יש להקפיד במיוחד כדי להימנע מפגיעה בתכונות הקיימות באדון הסיליקון.
- חבט את הכניסות ואת השקעים לתוך בלוק PDMS המתאים מכניסות ושקעים במכשיר microfluidic באמצעות אגרוף ביופסיה 0.75 מ"מ. הסר כל אבק וחלקיקים עם היישום החוזר והסרה של סרט אריזה אל פני השטח של בלוק PDMS.
- נקה מגלשת זכוכית 50 מ"מ x 75 מ"מ על ידי שטיפה עם 100% איזופרופנול ולאחר מכן ייבוש אוויר על פני השטח. פלזמה לטפל הן שקופית זכוכית PDMS (תכונות מול למעלה) באמצעות 1 mbar של פלזמה O2 במשך 1 דקות באמצעות bonder פלזמה.
- הצמד את ה- PDMS למגלשת הזכוכית על ידי הצבת PDMS שטופלו בפלזמה עם תכונות הפונות כלפי מטה אל מגלשת הזכוכית, צד מטופל בפלזמה הפונה כלפי מעלה. מניחים את השקופית לתוך תנור להגדיר ל 65 °C (65 °F) לפחות 30 דקות כדי להשלים את מליטה.
- לטפל בכל הערוצים microfluidic עם טיפול פני השטח פלואורין כדי להבטיח הידרופוביה פני השטח ולמנוע הרטבה. אופים את המכשיר ב 65 °C (65 °F) לפחות 10 דקות.
- ייצור של חלקיקים טמפלטינג
- הכן פתרון פוליאקרילמיד (PAA) המורכב מ-6.2% אקרילאמיד, 0.18% N,N′-מתילנדים (אקרילאמיד) ו-0.3% אמוניום אסולפט. לטעון פתרון זה לתוך מזרק 1 מ"ל עם מחט 28G.
- הכן שלב רציף בלתי מסיס המורכב מ- 5% (w/ w) פלואורוסורפקטנט ו- 1% N,N, NN-טטרמתילטילנדיאמין (TEMED) בשמן הידרופלואורואטר (HFE) לייצור וייצוב של טיפות. טען את הפתרון למזרק חדש של 1 מ"ל.
- טען הן את פתרון PAA והן את פתרון HFE המכיל מזרקים למשאבות מזרק (למשל, NE-501). חבר את שני המזרקים למכשיר המיקרופלואידי באמצעות צינורות פוליאתילן המוחדרים למזרק ולתוך המכשיר. לפני החיבור, יש להקנות את המשאבות כדי להסיר את האוויר מהצינורות.
הערה: בהתאם לדגם, משאבות מזרק עשויות להיות נשלטות באמצעות תוכנת קלט, ייצור מובנית או סקריפט מותאם אישית (זמין ב- https://github.com/AbateLab/Pump-Control-Program). - הפעל את התקן יצירת ההנפה עם כניסות שמן PAA ו- HFE במהירות של 300 μL/ שעה ו- 500 μL / שעה, בהתאמה. לאסוף 1 מ"ל של טיפות בצינור איסוף 15 מ"ל ודגרה במשך 3 שעות בטמפרטורת החדר עבור פילמור. לאחר הדגירה, להסיר את השכבה התחתונה של שמן על ידי pipetting.
- הוסף 1 מ"ל של 20% (v/v) perfluoro-1-octanol (PFO) בשמן HFE לצינור איסוף 15 מ"ל כמו demulsifier כימי. לאחר ערבוב, לסובב את צינור אוסף 15 מ"ל ב 2000 x g במשך 2 דקות. הסר את ה- PFO / HFE supernatant על ידי צנרת. חזור על 1x.
- הוסיפו 2 מ"ל של 2% סורביטן מונולאט בהקסאן לצינור האוסף והמערבולת של 15 מ"ל לערבוב. לסובב את הצינור ב 3000 x g במשך 3 דקות. הסר את supernatant על ידי pipetting כדי להסיר פתרון פעילי שטח / hexane. חזור על 2x.
- הוסף 5 מ"ל של חוצץ TEBST (20 mM Tris-HCl pH 8.0, 274 מ"מ NaCl, 5.4 מ"מ KCl, 20 mM EDTA, 0.2% טריטון X-100) ומערבב היטב. ספין למטה ב 3,000 x g במשך 3 דקות. הסר את supernatant על ידי pipetting. חזור על 3x.
- Resuspend ב 5 מ"ל TEBST. פתרון זה עשוי להיות מאוחסן ב 4 °C ללא הגבלת זמן.
- ייצור מאסטר מותאם אישית
2. תחליב תבנית חלקיקים.
לאחר הכנת חלקיקים templating, PTE משמש כדי לתמצת את המדגם ריאגנטים בטיפות.
- הכן את חלקיקי polyacrylamide עבור תחליב תבנית חלקיקים על ידי centrifuging ב 6000 x גרם במשך 1 דקות כדי לגלות את החלקיקים, ולאחר מכן להסיר את supernatant על ידי pipetting ו resuspend באמצעות מים סטריליים. חזור על 3x כדי להבטיח הסרה של כל שאריות TEBST.
- לקבוע את הריכוז ואת הקוטר של חלקיקים templating באמצעות hemocytometer (או שווה ערך). חשב קוטר חלקיקים בודד על ידי מדידת הקטרים בפיקסלים והמרה למיקרונים. ניתן לחשב את המרת הפיקסלים למיקרונים באמצעות המוציטומטר (או שווה ערך) כשקופית כיול ומדידת מרחק הרשת הידוע בפיקסלים.
- הכן את שלב הפיזור בצינור מיקרוצנטריפוגה טרי 1.5 מ"ל באמצעות תערובת מאסטר PCR, פריימרים מתאימים, ובדיקת הידרוליזה פלואורסצ'ין על פי טבלה 1. דגירה בטמפרטורת החדר במשך 5 דקות תחת עצבנות עדינה (10 סל"ד) באמצעות סיבוב צינור כדי להבטיח חלוקה הומוגנית של הרכיבים.
הערה: נפח וריכוז היעד של חלקיקים מבוססים על טעינת פואסון. ככלל, מספר החלקיקים צריך להיות סדר גודל גדול יותר ממספר הדגימות שיש לתמצת. עבור דגימות של ריכוזים לא ידועים, סדרת דילול יש צורך להבטיח טעינת פואסון.
| נפח | מגיב |
| 100 μL | חלקיקים (450 חלקיקים / μL) |
| 200 μL | תערובת אב 2X PCR |
| 18 μL | פריימר קדמי של 10 מיקרומטר |
| 18 μL | פריימר הפוך 10 מיקרומטר |
| 18 μL | 10 μM בדיקה |
| 0.8 μL | טריטון X100 |
| 45.2 μL | מים ללא נוקלאז |
טבלה 1. הכנת תערובת אמן PCR המשמשת עם PTE עבור PCR טיפה דיגיטלית.
- צנטריפוגה שלב הפיזור ב 6000 x g במשך 1 דקות ולהסיר את supernatant. הקלט את עוצמת הקול של supernatant שחולץ ושימוש בנפח פאזה הפיזור הכולל המחושב ב 2.3 לקבוע את נפח הכדור.
הערה: כמות supernatant שחולצו ישתנה בהתאם אריזת חלקיקים, קוטר, וריכוז עם נפח צפוי מינימלי של 300 μL. - הוסף 1 μL של 1.62 pg / μL Saccharomyces cerevisiae DNA גנומי לכדור מ 2.4 ולערבב ביסודיות על ידי pipetting או הקשה נמרצת.
הערה: נוכחות של תוכן מימי עודף יכול להפחית את יעילות אנקפסולציה. אם נפח המדגם עולה על 1% מנפח הכדור, לרכז את המדגם. אם לא ניתן לרכז את המדגם, שנה את קנה המידה של תערובת ה- PCR הראשית וכתוצאה מכך את עוצמת הכדור בהתאם לאמצעי האחסון לדוגמה. PTE מאפשר אמולסיה של חלקיקים קטנים (10 μL) לנפחים גדולים (2 מ"ל) של חלקיקים טמפלטינג. תערובת המאסטר PCR (2.3) ושמן (2.6) ניתן לשנות את קנה המידה על פי היעד (2.3) ונמדד (2.4) נפח של כדורי החלקיקים בהתאמה. - הוסף 200 μL 2% פלואורוסורפקטנט בשמן HFE לצינור כשלב רציף בלתי מסיס לתבלינים. ודא שהכדור מתנתק על ידי צנרת או הקשה/הבהוב של הצינור. ואז מערבולת ב 3000 סל"ד במשך 30 שניות.
הערה: ההגדרה המתאימה ל- 3000 סל"ד עשויה להשתנות בהתאם למותג ולדגם. - אפשר אמולסיות להסתפק 1 דקות. הסר 100 μL של שלב השמן התחתון ולהחליף נפח זה עם 2% פלואורוסורפקטנט טרי בשמן HFE. הפוך בעדינות את הצינור מספר פעמים לערבב. חזור על 3-5x או עד טיפות לווין קטנות הוסרו.
3. טיפה דיגיטלית PCR וניתוח.
- לאחר 2-5 דקות של התיישבות, להסיר את שלב השמן התחתון. החלף נפח זה עם 5% פלואורוסורפקטנט בשמן פלואורוקרבון (למשל, FC-40).
- באמצעות קצה פיפטה רחב, בזהירות pipette 100 μL של מדגם לתוך 200 צינורות PCR μL. מניחים את צינורות ה- PCR לתוך תרמוציקלר ולהפעיל על פי טבלה 2.
| צעד | טמפרטורה | משך | הערות |
| 1 | 95 °C (75 °F) | 2 דקות | |
| 2 | 95 °C (75 °F) | שנות ה-30 | |
| 3 | 50 °C (50 °F) | שנות ה-90 | |
| 4 | 72 °C (72 °F) | שנות ה-60 | |
| 5 | חזור על x34 שלבים 2 עד 4 | ||
| 6 | 72 °C (72 °F) | 2 דקות | |
| 7 | 4 °C (70 °F) | אחז |
טבלה 2. תנאי תרמו-אופניים עבור PCR טיפה דיגיטלית באמצעות אמולסיות PTE.
- Pipette המדגם על שקופית ספירה באמצעות קצה פיפטה משעמם רחב להדמיה פלואורסצנטית. צלם את המדגם באמצעות מיקרוסקופ פלואורסצנטי עם עירור של 490 ננומטר ואורכי גל לזיהוי פליטה של 525 ננומטר.
- לכמת את טיפות הפלואורסצנט החיוביות (Np) ואת הטיפות הכוללות (NT) כדי לאמת את הנוכחות ולחשב את מספר מולקולות התבנית (λ) באמצעות שבר הטיפות החיוביות (Np/ NT) וסטטיסטיקת פואסון:
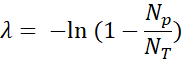
- חשב את מרווח הביטחון של 95% (zc = 1.96) לפי:
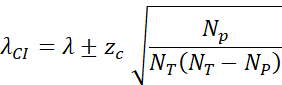
- חשב את ריכוז המדגם (מולקולות/μL) באמצעות הנפח (ν ב- μL) של המדגם שנוסף בשלב 2.5, באמצעות המשוואה שניתנה להלן. קבע את הממוצע ואת סטיית התקן של ריכוז המדגם באמצעות שכפולים טכניים.
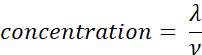
תוצאות

איור 2. אנקפסולציה של דגימה לתוך טיפות באמצעות אמולסיה תבנית חלקיקים. (A) חלקיקי טמפלטציה המשמשים לתעלוב טמפלטציה של חלקיקים. (B) הפרדת גלולה חלקיקים טמפלטציה מסופר-טבעי לאחר צנטריפוגה. (ג) טיפות הנובעות תחליב בתבנית חלקיקים עם (D) מעטפת מימית הניתנת לזיהוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ב- PTE, המונודיספרסיות של אמולסיות מוכתבת על ידי זה של החלקיקים templating, כי טיפות יש קוטר קצת יותר גדול מאשר החלקיקים. לכן, חלקיקים אחידים הם מרכזיים אנקפסולציה PTE מבוקר11. קיימות מגוון שיטות ליצירת חלקיקי טמפלטציה אחידים, כולל כימי (סול-ג'ל, פילמור אמולסיה), הידרודינמי (אמולסיה של ממברנה, הומוגניזציה) ושיטות סינון. גישות מיקרופלואידיות בפרט, מעניקות מונודיספרסיות מעולה (איור 2A) ומאפשרות להנדסת חלקיקים נוספת לשפר את הפונקציונליות שלהן ב-PTE12. לחלופין, חלקיקים templating ניתן לרכוש, אם כי האחידות שלהם, בעוד הולם, הוא בדרך כלל פחות מאשר עם דור microfluidic11.
כדי לבצע PTE, החלקיקים מעורבבים עם הדגימה שיש לעטוף (איור 1A), והסופר-נט העודף מוסר על-ידי צנטריפוגה וצינורות (איור 1B), כפי שממחיש צילום של גלולה חלקיקית בתחתית צינור PCR (איור 2B). לאחר מכן מתווסף שמן אנקפסולציה המכיל מחולל פעילי שטח מייצב (איור 1C), והדגימה מנרסת בעדינות לפני מערבולת במשך 30 שניות (איור 1D), כדי ליצור את האמולזיה (איור 2C). הטיפות המתקבלות מכילות ליבת חלקיקים ומעטפת מימית המרכיבה את המדגם הראשוני, שבתוכה שוכנים הריאגנטים, מולקולות המטרה והתאים הדרושים לתגובה (איור 2D). בדיוק כמו אנקפסולציה מיקרופלואידית טיפה, ישויות נפרדות כמו חרוזים קטנים או תאים הם עטופים באופן אקראי ובהתאם להתפלגות פואסון, אם כי כמעט כל הטיפות מכילות חלקיק templating בשל הטבע של פיזיקת PTE.

איור 3. זיהוי וניקוי של טיפות תחליב בתבנית חלקיקים. (A) דוגמה ליצירת טיפות לא אחידות עם חלקיקים מרובים לכל טיפה ממערבולת לא מספקת. (B) נוכחות צפויה של לוויינים ולטפות בעקבות תחליב תבנית חלקיקים ו-(C) פירוק מים בשמן. (ד) אמולסיה כתוצאה מכך לאחר שטיפת שמן. (ה) ייצור לווין מוגזם הנובע מסופר-נט שיורית במהלך תחליב בתבנית חלקיקים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
אפילו ב- PTE מוצלח, טיפות ליבה כפולות או משולשות קיימות, אם כי הן בדרך כלל תורמות באופן זניח לתגובה, בתנאי שהן נדירות. השגת תדירות נמוכה של טיפות מרובות קורות תוך שמירה על פגזים נאותים דורשת אופטימיזציה של פרמטרי תהליך, כולל מתח פני השטח, כוחות הידבקות בין חלקיקים, צמיגות מדגם, גודל המכולה, וכוח וזמן מערבולת. לדוגמה, תחליב שעבר אופטימיזציה גרועה עשוי להכיל טיפות רב-ממדיות עם חלקיקים טמפלטינג רבים (איור 3A), מה שמצביע על כך שהמערבולת לא הספיקה כדי לאחלחל את המדגם באופן מלא. במקרים כאלה, ניתן להוסיף חומרי ניקוי כדי להפחית הידבקות בין חלקיקים ומתח משטח נמוך יותר, או כוח מערבולת או זמן ניתן להגדיל. בעיה נפוצה נוספת היא יצירת לוויינים מוגזמים, שהם טיפות ריקות קטנות (איור 3B). לוויינים יכולים להיות בלתי נמנעים אמולסיות PTE בהתאם למתח הבין-דתי ולתכונות הרולוגיות של המדגם ושמן נושאת. עם זאת, לעתים קרובות הם נובעים מכך שהם אינם מסירים דגימה עודפת כראוי לפני תחליב (איור 2B), או מערבולת עם יותר מדי כוח, הסרת הקליפות מן הטיפות. ב אמולסיה מוצלחת של PTE, לוויינים צריכים להוות לא יותר מ- ~ 10% מנפח הדגימה הכולל (איור 3C)11. ברמה זו, הם בדרך כלל תורמים בזניחות לתגובה וניתן להתעלם מהם. למטרות אסתטיות, ניתן לנקות אותם מהתעלוי על ידי כביסה בשמן טרי (איור 3D).

איור 4. הערכה של תחליב בצורת חלקיקים PCR טיפה דיגיטלית. (A) הדמיה פלואורסצנטית של הטיפות מזהה טיפות פלואורסצנטיות חיוביות ולטפות שליליות שאינן פלואורסצנטיות. (ב) זיהוי של תבנית נדירה או ריכוזים נמוכים של תבנית עם PCR טיפה דיגיטלית. (C) יתר על המידה של אנקפסולציה של תבנית בשפע וכתוצאה מכך מספר משתנה של מולקולות תבנית לכל טיפה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי להדגים את השירות של PTE, השתמשנו בו כדי לבצע PCR11 דיגיטלי נטול מיקרופלואידים. באמצעות התהליך, תמצתנו דגימה הכוללת דנ"א גנומי S. cerevisiae , ותירגמנו אותו. ב- PCR דיגיטלי, טיפות המכילות מטרות מוגברות הופכות לפלורסנט, ואילו אלה ללא להישאר עמום. לפיכך, טיפה פלואורסצנטית מציינת יעד, המאפשר כמות ישירה של מטרות על ידי ספירת טיפות חיוביות (איור 4A). לפיכך, מספר הטיפות הפלואורסצנטיות מתרחב עם מולקולות היעד, ומניב מעט חיוביות כאשר היעד נדיר (איור 4B) ורבות כאשר הוא שופע (איור 4C). בנוסף לתמצית של רכיבים נפרדים אחרים, אנקפסולציה של היעד עוקבת אחר התפלגות פואסון, ומאפשרת להפוך את שבר הטיפה החיובי לריכוז היעד (איור 4D), ובכך מדגימה את היכולת לבצע PCR דיגיטלי עם PTE11.
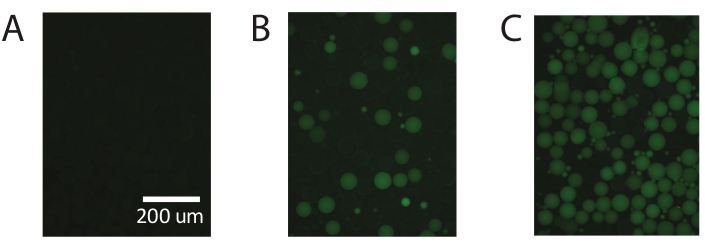
איור 5. הדגמה של PCR טיפה דיגיטלית באמצעות PAA זמין מסחרית. (א) הדמיה פלואורסצנטית של הטיפות מזהה טיפות שליליות שאינן פלואורסצנטיות. (ב) זיהוי ריכוזים נמוכים של תבנית עם PCR טיפה דיגיטלית. (ג) זיהוי ריכוזים גבוהים של תבנית עם PCR טיפה דיגיטלית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות אלה ניתנות לחזרה באמצעות חלקיקי פוליאקרילמיד זמינים מסחרית (איור 5) וממחישות את היכולת של PTE לבצע PCR דיגיטלי סטנדרטי עם חלקיקי פוליאקרילמיד זמינים מסחרית, תוך השגת מדידות מדויקות על פני אותו טווח.
קובץ משלים. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
PTE משתמש בחלקיקים כדי לתמצת דגימות בטיפות חד-ממדיות על ידי מערבולת. בנוסף לפשטותו ונגישותו, PTE מספק מספר יתרונות נוספים, כולל מתן אפשרות להפקה מיידית של כמויות גדולות של טיפות. יתר על כן, התהליך יכול להתבצע בצינור מבודד, מייתר את הצורך להעביר דגימות למכשירים microfluidic, ייעול זרימת העבודה הכוללת והגבלת הזדמנויות לזיהום מדגם או אובדן. החלקיקים הטמפרטיפים מספקים גם אמצעי שבאמצעותו להנדס את התוכן של תגובות טיפה כתוצאה מכך. לדוגמה, גודל חלקיקים, כימיה ורטובות יכולים להיות מתוכננים עבור ביומולקול ממוקד או לכידת תאים, בעוד moieties פונקציונלי כגון אנזימים, פעילים, או חומצות גרעין, ניתן להציג על חלקיקים כדי להקל על תגובות, כגון עבור רצף תאים בודדים או אפיון פונקציונלי. בעוד הגישה גמישה, ישנם בכל זאת אילוצים חשובים לשימוש בה. לדוגמה, לא ניתן כרגע לבצע תוספות טיפה כפי שמתנהלים לעתים קרובות עם microfluidics, הדורשים כי כל רכיבי התגובה להיות הציג לפני אנקפסולציה; זה דורש כי ריאגנטים להיות תואמים ויציבים עד טיפות ניתן ליצור, ובמקרה של שילובים בעייתיים, לעתים קרובות ניתן לטפל על ידי ערבוב מהיר תחליב המדגם על קרח. לחלופין, ניתן להשתמש ברכיבים תגובתיים שניתן להפעיל חיצונית עם אור או חום 13. PTE מספק אפוא שיטה גמישה ומדרגית לביצוע בדיקות טיפות הנגישות למי שאינם מומחים. זה, יחד עם הפשטות המולדת שלה וגמישות, עושה PTE אידיאלי עבור ביצוע ופיתוח של יישומי טיפה רבים.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
עבודה זו בפיתוח פרוטוקול זה נתמכה על ידי המכונים הלאומיים לבריאות (R01-EB019453-02), משרד מנהל המודיעין הלאומי, מודיעין מתקדם פרויקטים פרויקטים פעילות באמצעות ריית'און BBN טכנולוגיות קורפ (N66001-18-C-4507), צ'אן-צוקרברג Biohub תוכנית חוקר, הסוכנות לפרויקטי מחקר מתקדמים הגנה דרך אוניברסיטת טקסס A&M (W911NF1920013), ומרכזים לבקרת מחלות ומניעתן באמצעות אוניברסיטת ג'ונס הופקינס מיושם המעבדה לפיזיקה (75D30-11-9C-06818 (CDC3)). הדעות והמסקנות הכלולות במסמך זה הן של המחברים ואין לפרש אותן כמייצגות בהכרח את המדיניות הרשמית, בין אם מפורשת או משתמעת, של הארגונים הנ"ל או של ממשלת ארה"ב. ממשלת ארה"ב מוסמכת לשכפל ולהפיץ הדפסות מחדש למטרות ממשלתיות למרות כל ביאור זכויות יוצרים בו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 | |
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ | |
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) |
References
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501 (2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved