Method Article
L'emulsione con modellazione di particelle consente saggi di goccioline prive di microfluidi
In questo articolo
Riepilogo
I saggi di goccioline acqua-in-olio sono utili per la chimica analitica, l'evoluzione enzimatica e l'analisi di singole cellule, ma in genere richiedono microfluidica per formare le goccioline. Qui, descriviamo l'emulsificazione modellata con particelle, un approccio privo di microfluidi per eseguire saggi di goccioline.
Abstract
Le reazioni eseguite in goccioline monodisperse offrono una maggiore precisione e sensibilità rispetto a quelle equivalenti eseguite alla rinfusa. Tuttavia, il requisito della microfluidica di formare goccioline controllate impone una barriera ai non esperti, limitandone l'uso. Qui, descriviamo l'emulsione modellata con particelle, un approccio per generare goccioline monodisperse senza microfluidica. Utilizzando sfere di idrogel di template, incapsulamo campioni in goccioline monodisperse mediante semplice vortice. Dimostriamo l'approccio utilizzandolo per eseguire la PCR digitale senza microfluidi.
Introduzione
La microfluidica delle goccioline sfrutta la compartimentazione nelle goccioline di picoliter per aumentare la sensibilità e l'accuratezza dei saggi rispetto alle reazioni di massa e ha numerose applicazioni nello screening chimico, nell'ingegneria proteica e nel sequenziamento di prossima generazione1,2,3. Ad esempio, la reazione a catena digitale della polimerasi a goccia (ddPCR) offre una maggiore precisione rispetto alla reazione a catena quantitativa della polimerasi di massa (qPCR), con applicazioni per la variazione genetica nei tumori, il rilevamento di mutazioni che causano malattie e la diagnostica prenatale4,5,6. Una sfida della microfluidica delle goccioline, tuttavia, è il requisito dei dispositivi microfluidici per partizionare i campioni; mentre la microfluidica offre un eccellente controllo sulle proprietà delle goccioline, richiede competenze specializzate per costruire e operare7,8. Di conseguenza, i metodi basati su goccioline sono in gran parte limitati a laboratori esperti o, in rari casi, applicazioni in cui è disponibile uno strumento commerciale9,10. Per ampliare l'uso dei saggi di goccioline, il requisito di strumentazione microfluidica specializzata è un ostacolo che deve essere superato.
In questo articolo, descriviamo l'emulsificazione delle particelle modellate (PTE), un metodo privo di microfluidi per eseguire reazioni in goccioline monodisperse. Nel PTE, le particelle di template inghiottono il campione in goccioline nell'olio vettore mediante semplice vortice (Figura 1). Mentre il sistema si mescola, la porzione acquosa si frammenta in goccioline di dimensioni ridotte fino a quando le goccioline contengono singole particelle, a quel punto un'ulteriore frammentazione non è possibile perché richiede la rottura delle particelle. Il campione inghiottito circonda le particelle come un guscio nelle goccioline, incapsulando così eventuali cellule disperse, reagenti o porzioni funzionali (Figura 1D). Pertanto, pte non richiede attrezzature o competenze per eseguire reazioni di goccioline oltre un comune vortice. Inoltre, la generazione di goccioline richiede secondi rispetto a minuti o ore con la microfluidica e la quantità prodotta è proporzionale al volume del contenitore, non al tempo di funzionamento del dispositivo, rendendolo estremamente scalabile. Questi vantaggi rendono il PTE ideale per condurre saggi di goccioline in una varietà di circostanze in cui la microfluidica non è pratica. Qui, dimostriamo PTE e lo usiamo per condurre ddPCR.
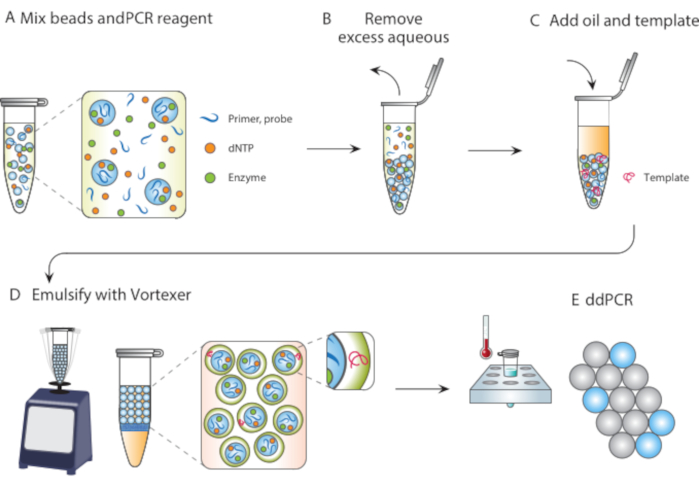
Figura 1. Panoramica del processo di emulsione con modellazione di particelle. (A) Le particelle di template sono mescolate con reagenti. (B) I reagenti in eccesso vengono rimossi dopo la centrifugazione. (C) L'aggiunta di molecole modello avviene prima dell'aggiunta di olio. (D) Il vortice produce goccioline contenenti una singola molecola modello. (E) Il successivo termociclo e l'imaging consentono l'analisi digitale delle goccioline del modello target. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
1. Preparazione di particelle di idrogel per l'emulsione di particelle modellate.
Le particelle di idrogel utilizzate per l'emulsione modellata di particelle possono essere preparate utilizzando due diversi metodi.
- Preparazione con particelle disponibili in commercio
- Aggiungere 0,5 g di particelle di poliacrilammide essiccate compatibili con PTE (ad esempio, Bio-Gel P-60 Gel (Bio-Rad), diametro 45-90 μm) a 30 mL di acqua sterile in un tubo conico da 50 mL e mescolare bene. Incubare a temperatura ambiente per 30 min.
- Preparazione mediante fabbricazione microfluidica di particelle
NOTA: le particelle di poliacrilammide compatibili con PTE possono essere preparate utilizzando produttori di gocce disponibili in commercio (ad esempio, QX200 Drop Generator (Bio-Rad), RayDrop (Fluigent) ecc.) o mediante progettazione microfluidica personalizzata.- Fabbricazione di master personalizzati
- Progettare una maschera di fotolitografia morbida utilizzando un software CAD (Computer-Aided Design). Stampare la fotomaschera con una risoluzione di 10 μm su pellicola del circuito stampato.
- Versare 1 mL di fotoresist sul centro di un wafer di silicio da 3 pollici. Utilizzare uno spin coater per creare uno strato di fotoresist da 50 μm ruotandolo a 500 rpm per 30 secondi seguito da 1250 rpm per 30 sec. Posizionare il wafer su una piastra riscaldante impostata a 95 °C per 15 minuti per far evaporare il solvente.
- Fissare la fotomaschera sul wafer di silicio con una slitta di vetro di copertura ed esporre il wafer sotto un LED UV collimato da 190 mW e 365 μm per 2,5 minuti. Posizionare il wafer su una piastra elettrica impostata a 95 °C per 5 minuti per la cottura post esposizione.
- Sviluppare il wafer di silicio fotoresistente immergendolo in un bagno di acetato di monometil etere di glicole propilenico al 100% (PGMEA) per un massimo di 15 minuti. Risciacquare il wafer con 100% PGMEA fresco seguito da isopropanolo al 100%. Asciugare all'aria il wafer.
- Rimuovere l'isopropanolo residuo asciugando il wafer su una piastra elettrica impostata a 95 °C per 1 minuto. Mettere il wafer in una capsula pulita da 3 in Petri.
- Fabbricazione del dispositivo microfluidico personalizzato
- Mescolare la base di silicio polidimetilsilossano (PDMS) e il reagente di polimerizzazione in un rapporto 10:1 in massa. Degasare il PDMS misto utilizzando un essiccatore sotto vuoto domestico fino a quando non sono osservabili bolle d'aria.
- Versare il PDMS degassato sul master nella capsula di Petri, assicurandosi che il wafer di silicio sia completamente sommerso. Degassare il wafer di silicio e pdms per rimuovere eventuali bolle d'aria che potrebbero essersi formate durante il versamento.
- Polimerizzare il PDMS posizionando il wafer di silicio e il PDMS in un forno impostato a 65 °C per almeno 60 minuti. Asportare un blocco di PDMS contenente le caratteristiche microfluidiche dalla capsula di Petri usando un bisturi. Prestare particolare attenzione per evitare di danneggiare eventuali caratteristiche presenti sul master in silicio.
- Perforare le prese e le uscite nel blocco PDMS corrispondente alle prese e alle uscite nel dispositivo microfluidico utilizzando un punzone per biopsia da 0,75 mm. Rimuovere polvere e particolato con l'applicazione ripetitiva e la rimozione del nastro adesivo sulla superficie del blocco PDMS.
- Pulire un vetrino di 50 mm x 75 mm risciacquandolo con isopropanolo al 100% e successivamente asciugando all'aria la superficie. Il plasma tratta sia il vetrino che il PDMS (caratteristiche rivolte verso l'alto) utilizzando 1 mbar di plasma O2 per 1 minuto utilizzando un bonder al plasma.
- Applicare il PDMS al vetrino posizionando il PDMS trattato al plasma con caratteristiche rivolte verso il basso sul vetrino, lato trattato al plasma rivolto verso l'alto. Mettere il vetrino in un forno impostato a 65 °C per almeno 30 minuti per completare l'incollaggio.
- Trattare tutti i canali microfluidici con un trattamento superficiale fluorurato per garantire l'idrofobicità superficiale e prevenire la bagnatura. Cuocere il dispositivo a 65 °C per almeno 10 minuti.
- Fabbricazione di particelle di template
- Preparare una soluzione di poliacrilammide (PAA) composta da 6,2% di acrilammide, 0,18% di N,N′-metilenebis (acrilammide) e 0,3% di persolfato di ammonio. Caricare questa soluzione in una siringa da 1 mL con un ago da 28 G.
- Preparare una fase continua insolubile composta da 5% (p/p) di fluorotensioattivo e 1% di N,N,NN-tetrametilendiammina (TEMED) in olio di idrofluoroetere (HFE) per la generazione e la stabilizzazione delle goccioline. Caricare la soluzione nella nuova siringa da 1 mL.
- Caricare sia la soluzione PAA che HFE contenente siringhe in pompe a siringa (ad esempio, NE-501). Collegare entrambe le siringhe al dispositivo microfluidico utilizzando tubi di polietilene inseriti sulla siringa e nel dispositivo. Prima del collegamento, innescare le pompe per rimuovere l'aria dal tubo.
NOTA: a seconda del modello, le pompe a siringa possono essere controllate con input incorporato, software di produzione o uno script personalizzato (disponibile all'https://github.com/AbateLab/Pump-Control-Program). - Eseguire il dispositivo di generazione di gocce con ingressi olio PAA e HFE rispettivamente a 300 μL/h e 500 μL/h. Raccogliere 1 mL delle goccioline in un tubo di raccolta da 15 mL e incubare per 3 ore a temperatura ambiente per la polimerizzazione. Dopo l'incubazione, rimuovere lo strato inferiore di olio mediante pipettaggio.
- Aggiungere 1 mL di perfluoro-1-ottanolo (PFO) al 20% (v/v) nell'olio di HFE al tubo di raccolta da 15 mL come demulsificatore chimico. Dopo la miscelazione, girare il tubo di raccolta da 15 ml a 2000 x g per 2 minuti. Rimuovere il surnatante PFO/HFE mediante pipettaggio. Ripeti 1x.
- Aggiungere 2 mL di monooleato di sorbitano al 2% in esano al tubo di raccolta da 15 mL e vortice per mescolare. Ruotare il tubo a 3000 x g per 3 min. Rimuovere il surnatante mediante pipettaggio per rimuovere la soluzione di tensioattivo/esano. Ripeti 2x.
- Aggiungere 5 mL di tampone TEBST (20 mM Tris-HCl pH 8,0, 274 mM NaCl, 5,4 mM KCl, 20 mM EDTA, 0,2% Triton X-100) e mescolare bene. Spin down a 3.000 x g per 3 min. Rimuovere il surnatante mediante pipettaggio. Ripeti 3x.
- Riespesso in 5 ml di TEBST. Questa soluzione può essere conservata a 4 °C a tempo indeterminato.
- Fabbricazione di master personalizzati
2. Emulsione modellata con particelle.
Dopo la preparazione di particelle di template, il PTE viene utilizzato per incapsulare il campione e i reagenti in goccioline.
- Preparare le particelle di poliacrilammide per l'emulsione modellata con particelle centrifugando a 6000 x g per 1 minuto per pellettizzare le particelle, quindi rimuovere il surnatante mediante pipettaggio e risospesso con acqua sterile. Ripetere 3 volte per garantire la rimozione di qualsiasi TEBST residuo.
- Determinare la concentrazione e il diametro delle particelle di template utilizzando un emocitometro (o equivalente). Calcola il diametro delle singole particelle misurando i diametri in pixel e convertendoli in micron. La conversione dei pixel in micron può essere calcolata utilizzando l'emocitometro (o equivalente) come diapositiva di calibrazione e misurando la distanza della griglia nota in pixel.
- Preparare la fase di dispersione in un tubo microcentrifuga fresco da 1,5 ml utilizzando una miscela master PCR, i primer appropriati e una sonda di idrolisi della fluoresceina secondo la Tabella 1. Incubare a temperatura ambiente per 5 minuti sotto agitazione delicata (10 rpm) utilizzando un rotatore a tubo per garantire una distribuzione omogenea dei componenti.
NOTA: il volume e la concentrazione target delle particelle si basano sul carico di Poisson. Come regola generale, il numero di particelle dovrebbe essere un ordine di grandezza superiore al numero di campioni da incapsulare. Per i campioni di concentrazioni sconosciute, è necessaria una serie di diluizione per garantire il carico di Poisson.
| Volume | Reagente |
| 100 μL | Particelle (450 particelle / μL) |
| 200 μL | 2x mix master PCR |
| 18 μL | Primer anteriore da 10 μM |
| 18 μL | Primer inverso da 10 μM |
| 18 μL | Sonda da 10 μM |
| 0,8 μL | Tritone X100 |
| 45,2 μL | Acqua senza nucleasi |
Tabella 1. Preparazione del master mix PCR utilizzato con PTE per PCR a goccia digitale.
- Centrifugare la fase di dispersione a 6000 x g per 1 min e rimuovere il surnatante. Registrare il volume del surnatante estratto e utilizzando il volume totale della fase di dispersione calcolato in 2.3 determinare il volume del pellet.
NOTA: La quantità di surnatante estratto varia a seconda dell'impacchettamento delle particelle, del diametro e della concentrazione con un volume minimo previsto di 300 μL. - Aggiungere 1 μL di 1,62 pg /μL saccharomyces cerevisiae dna genomico al pellet da 2,4 e mescolare accuratamente mediante pipettaggio o picchiettamento vigoroso.
NOTA: la presenza di contenuto acquoso in eccesso può ridurre l'efficienza di incapsulamento. Se il volume del campione supera l'1% del volume del pellet, concentrare il campione. Se il campione non può essere concentrato, scalare la miscela master PCR e il volume del pellet risultante in base al volume del campione. PtE consente l'emulsione di volumi da piccoli (10 μL) a grandi (2 mL) di particelle di template. La miscela master PCR (2.3) e l'olio (2.6) possono essere scalati rispettivamente in base al volume target (2.3) e misurato (2.4) del pellet di particelle. - Aggiungere 200 μL 2% di fluorotensioattivo in olio di HFE al tubo come fase continua insolubile per l'emulsione. Assicurarsi che il pellet venga rimosso mediante pipettaggio o maschiatura/sbattimento del tubo. Quindi vortice a 3000 giri / min per 30 secondi.
NOTA: l'impostazione corrispondente a 3000 rpm può variare a seconda della marca e del modello. - Lasciare che le emulsioni si depositino per 1 minuto. Rimuovere 100 μL della fase dell'olio inferiore e sostituire questo volume con fluorotensioattivo fresco al 2% in olio HFE. Capovolgere delicatamente il tubo più volte per mescolare. Ripetere 3-5 volte o fino a quando le piccole goccioline satellitari sono state rimosse.
3. PCR e analisi delle goccioline digitali.
- Dopo 2-5 minuti di sedimentazione, rimuovere la fase di olio inferiore. Sostituire questo volume con il 5% di fluorotensioattivo in olio di fluorocarbonio (ad esempio, FC-40).
- Utilizzando una punta di pipetta a foro largo, pipettare accuratamente i 100 μL di campione in tubi PCR da 200 μL. Posizionare i tubi PCR in un termociclatore e funzionare secondo la Tabella 2.
| Passo | Temperatura | Durata | Note |
| 1 | 95 °C | 2 minuti | |
| 2 | 95 °C | 30 anni | |
| 3 | 50 °C | anni '90 | |
| 4 | 72 °C | 60 anni | |
| 5 | Ripetere i passaggi da 2 a 4 x34 | ||
| 6 | 72 °C | 2 minuti | |
| 7 | 4 °C | tenere |
Tabella 2. Condizioni di termociclo per PCR a goccia digitale con emulsioni PTE.
- Pipettare il campione su un vetrino di conteggio utilizzando una punta di pipetta a foro largo per l'imaging fluorescente. Immagine del campione utilizzando un microscopio fluorescente con eccitazione a 490 nm e lunghezze d'onda di rilevamento dell'emissione a 525 nm.
- Quantificare le goccioline fluorescenti positive (Np) e le gocce totali (NT) per verificare la presenza e calcolare il numero di molecole modello (λ) utilizzando la frazione di goccioline positive (Np/NT) e le statistiche di Poisson:
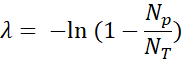
- Calcolare l'intervallo di confidenza del 95% (zc = 1,96) mediante:
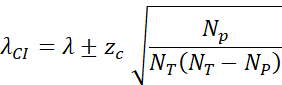
- Calcolare la concentrazione del campione (molecole/μL) utilizzando il volume (ν in μL) del campione aggiunto nel punto 2.5, utilizzando l'equazione riportata di seguito. Determinare la deviazione media e standard della concentrazione del campione utilizzando repliche tecniche.
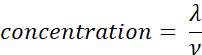
Risultati

Figura 2. Incapsulamento del campione in goccioline utilizzando l'emulsione modellata con particelle. A) particelle di modelli utilizzate per l'emulsione di modelli di particelle. (B) Separazione del pellet di particelle di template dal surnatante dopo centrifugazione. (C) Goccioline risultanti da emulsione modellata da particelle con (D) guscio acquoso identificabile. Fare clic qui per visualizzare una versione più grande di questa figura.
In PTE, la monodispersità delle emulsioni è dettata da quella delle particelle templari, perché le goccioline hanno un diametro leggermente più grande delle particelle. Pertanto, le particelle uniformi sono fondamentali per l'incapsulamento PTE controllato11. Esiste una varietà di metodi per generare particelle di template uniformi, tra cui metodi chimici (sol-gel, polimerizzazione in emulsione), idrodinamici (emulsione di membrana, omogeneizzazione) e filtrazione. Gli approcci microfluidici in particolare, offrono una superba monodispersità (Figura 2A) e consentono un'ulteriore ingegneria delle particelle per migliorare la loro funzionalità in PTE12. In alternativa, è possibile acquistare particelle di template, sebbene la loro uniformità, sebbene adeguata, sia in genere inferiore rispetto alla generazione microfluidica11.
Per eseguire pte, le particelle vengono miscelate con il campione da incapsulare (Figura 1A) e il surnatante in eccesso viene rimosso mediante centrifugazione e pipettaggio (Figura 1B), come illustrato da una fotografia di un pellet di particelle sul fondo di un tubo PCR (Figura 2B). L'olio incapsulante contenente un tensioattivo stabilizzante viene quindi aggiunto (Figura 1C) e il campione delicatamente pipettato prima di vorticare per 30 secondi (Figura 1D), per generare l'emulsione (Figura 2C). Le goccioline risultanti contengono un nucleo di particelle e un guscio acquoso che comprende il campione iniziale, all'interno del quale risiedono i reagenti, le molecole bersaglio e le cellule necessarie per la reazione (Figura 2D). Proprio come nell'incapsulamento microfluidico delle goccioline, entità discrete come piccole perle o cellule sono incapsulate in modo casuale e in conformità con una distribuzione di Poisson, sebbene quasi tutte le goccioline contengano una particella di template dovuta alla natura della fisica PTE.

Figura 3. Identificazione e pulizia di goccioline di emulsione modellate con particelle. (A) Esempio di generazione non uniforme di goccioline con particelle multiple per goccia da vortice insufficiente. (B) Presenza prevista di satelliti e goccioline dopo l'emulsione di particelle e (C) il frazionamento acqua-in-olio. (D) Emulsione risultante dopo il lavaggio dell'olio. (E) Eccessiva generazione di satelliti derivante dal surnatante residuo durante l'emulsione di particelle modellate. Fare clic qui per visualizzare una versione più grande di questa figura.
Anche nel PTE di successo, esistono goccioline a doppio o triplo nucleo, anche se generalmente contribuiscono in modo trascurabile alla reazione, a condizione che siano rare. Ottenere una bassa frequenza di goccioline multicore mantenendo gusci adeguati richiede l'ottimizzazione dei parametri di processo, tra cui la tensione superficiale, le forze di adesione interparticellare, la viscosità del campione, le dimensioni del contenitore e la potenza e il tempo di vortice. Ad esempio, un'emulsione scarsamente ottimizzata può contenere goccioline polidisperse con molte particelle di template (Figura 3A), indicando che il vortice era insufficiente per emulsionare completamente il campione. In questi casi, è possibile aggiungere detergenti per ridurre l'adesione tra particelle e ridurre la tensione superficiale, oppure aumentare la potenza o il tempo di vortice. Un altro problema comune è la generazione di satelliti eccessivi, che sono piccole goccioline vuote (Figura 3B). I satelliti possono essere inevitabili nelle emulsioni PTE a seconda della tensione interfacciale e delle proprietà reologiche del campione e dell'olio vettore. Tuttavia, spesso derivano dalla rimozione non adeguata del campione in eccesso prima dell'emulsione (Figura 2B) o dal vortice con troppa potenza, strappando i gusci dalle goccioline. In un'emulsione PTE di successo, i satelliti non dovrebbero comprendere più del ~10% del volume totale del campione incapsulato (Figura 3C)11. A questo livello, di solito contribuiscono in modo trascurabile alla reazione e possono essere ignorati. Per scopi estetici, possono essere eliminati dall'emulsione lavando con olio fresco (Figura 3D).

Figura 4. Valutazione della PCR digitale a goccioline di emulsione modellata con particelle. (A) L'imaging fluorescente delle goccioline identifica le goccioline fluorescenti positive e le goccioline negative non fluorescenti. (B) Identificazione di modelli rari o basse concentrazioni di modello con PCR a goccioline digitali. (C) Incapsulamento del modello troppo abbondante con conseguente numero variabile di molecole modello per gocciolina. Fare clic qui per visualizzare una versione più grande di questa figura.
Per dimostrare l'utilità del PTE, lo abbiamo usato per eseguire la PCR digitale senza microfluidici11. Utilizzando il processo, abbiamo incapsulato un campione composto da DNA genomico di S. cerevisiae e lo abbiamo termociclizzato. Nella PCR digitale, le goccioline contenenti bersagli amplificati diventano fluorescenti, mentre quelle senza rimangono deboli. Pertanto, una goccia fluorescente indica un bersaglio, consentendo la quantificazione diretta dei bersagli contando le goccioline positive (Figura 4A). Il numero di goccioline fluorescenti scala quindi con le molecole bersaglio, producendo pochi positivi quando il bersaglio è raro (Figura 4B) e molti quando è abbondante (Figura 4C). Come per l'incapsulamento di altri componenti discreti, l'incapsulamento target segue una distribuzione di Poisson, consentendo di trasformare la frazione di goccioline positiva nella concentrazione target (Figura 4D), dimostrando così la capacità di eseguire la PCR digitale con PTE11.
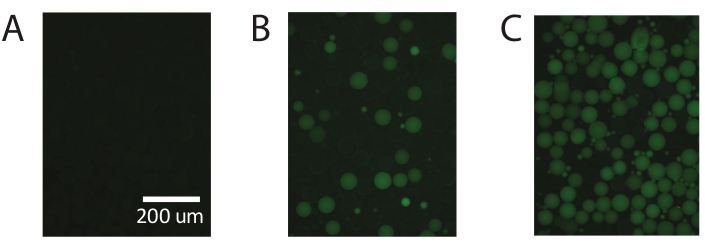
Figura 5. Dimostrazione di PCR a goccia digitale utilizzando PAA disponibile in commercio. (A) L'imaging fluorescente delle goccioline identifica le goccioline non fluorescenti negative. (B) Identificazione di basse concentrazioni di modello con PCR digitale a goccioline. (C) Identificazione di alte concentrazioni di modello con PCR digitale a goccioline. Fare clic qui per visualizzare una versione più grande di questa figura.
Questi risultati sono ripetibili utilizzando particelle di poliacrilammide disponibili in commercio (Figura 5) e dimostrano la capacità di PTE di eseguire la PCR digitale standard con particelle di poliacrilammide disponibili in commercio, ottenendo misurazioni accurate nello stesso intervallo.
File supplementare. Fare clic qui per scaricare questo file.
Discussione
PTE utilizza particelle per incapsulare campioni in goccioline monodisperse mediante vortice. Oltre alla sua semplicità e accessibilità, PTE offre diversi vantaggi aggiuntivi, tra cui la possibilità di generare istantaneamente grandi volumi di goccioline. Inoltre, il processo può essere condotto in un tubo isolato, ovviando alla necessità di trasferire campioni a dispositivi microfluidici, semplificando il flusso di lavoro complessivo e limitando le opportunità di contaminazione o perdita del campione. Le particelle di template forniscono anche un mezzo con cui progettare il contenuto delle reazioni di goccioline risultanti. Ad esempio, la dimensione delle particelle, la chimica e la bagnabilità possono essere progettate per la biomolecola mirata o la cattura cellulare, mentre le parti funzionali come enzimi, attivi o acidi nucleici possono essere visualizzate sulla particella per facilitare le reazioni, ad esempio per il sequenziamento di singole cellule o la caratterizzazione funzionale. Sebbene l'approccio sia flessibile, vi sono tuttavia importanti vincoli al suo utilizzo. Ad esempio, non è attualmente possibile eseguire aggiunte di goccioline come spesso vengono condotte con la microfluidica, richiedendo che tutti i componenti della reazione siano introdotti prima dell'incapsulamento; ciò richiede che i reagenti siano compatibili e stabili fino a quando le goccioline possono essere generate e, nel caso di combinazioni fastidiose, possono spesso essere affrontate mescolando ed emulsionando rapidamente il campione su ghiaccio. In alternativa, è possibile utilizzare componenti reattivi che possono essere attivati esternamente con luce o calore13. PTE fornisce quindi un metodo flessibile e scalabile per condurre saggi di goccioline accessibili ai non esperti. Questo, unito alla sua innata semplicità e flessibilità, rende PTE ideale per l'esecuzione e lo sviluppo di numerose applicazioni droplet.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro di sviluppo di questo protocollo è stato supportato dal National Institutes of Health (R01-EB019453-02), dall'Office of the Director of National Intelligence, dall'Intelligence Advanced Research Projects Activity attraverso Raytheon BBN Technologies Corp (N66001-18-C-4507), dal Chan-Zuckerberg Biohub Investigator Program, dalla Defense Advanced Research Projects Agency attraverso la Texas A & M University (W911NF1920013) e dai Centers for Disease Control and Prevention attraverso la Johns Hopkins University Applied Laboratorio di Fisica (75D30-11-9C-06818 (CDC3)). Le opinioni e le conclusioni contenute nel presente documento sono quelle degli autori e non devono essere interpretate come necessariamente rappresentative delle politiche ufficiali, espresse o implicite, delle organizzazioni di cui sopra o del governo degli Stati Uniti. Il governo degli Stati Uniti è autorizzato a riprodurre e distribuire ristampe per scopi governativi, nonostante qualsiasi annotazione di copyright in esse contenuta.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 | |
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ | |
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) |
Riferimenti
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501(2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon