需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
椎间盘从胚胎发育到退化的光学切片和可视化
摘要
我们提出了一种使用光学切片方法研究椎间盘肛门纤维化中空间软骨细胞组织的方法。
摘要
椎间盘(IVD)变性是腰痛的主要原因,并且对受影响的个体造成高度损害。为了解码椎间盘变性并能够开发再生方法,对IVD的细胞生物学的透彻理解至关重要。这种生物学中仍未得到解答的一个方面是细胞如何在生理状态和变性过程中在空间上排列的问题。IVD的生物学特性及其可用性使这种组织难以分析。本研究调查了肛门纤维中从早期胚胎发育到终末期变性的空间软骨细胞组织。应用光学切片方法(Apotome)以牛胚胎组织作为动物模型和从接受脊柱手术的患者那里获得的人盘组织进行高分辨率染色分析。由于早期胚胎牛盘中的软骨细胞密度非常高,细胞数量在妊娠,生长和成熟期间减少。在人盘中,细胞密度的增加伴随着组织变性的进展。正如已经在关节软骨中证明的那样,集群形成代表了晚期椎间盘变性的特征。
引言
椎间盘(IVD)是一种基于软骨的结构,乍一看,它在生物化学和细胞结构方面类似于关节软骨1。事实上,关节软骨的IVD变性和骨关节炎(OA)的特征都是由于软骨磨损,软骨下囊肿和骨赘形成以及软骨下硬化症2,3而导致的关节空间变窄。尽管有这些看似相似的东西,但两种组织的结构和功能作用还是不同的。虽然关节软骨的基质主要由拱廊形成的II型胶原蛋白网络组成,但IVD由三种不同类型的组织组成:中心富含II型胶原的髓核承担轴向负荷并将其传递到密集排列的圆形胶原I型纤维环中,称为肛门纤维。它们的功能是吸收富含蛋白聚糖和水的原子核所接收的平移轴向压力及其拉伸纵向纤维强度。在每个细胞核和肛门的顶部和底部,透明软骨终板形成与相邻椎骨4的连接(图1)。
在关节软骨中,可以找到四种不同的空间软骨细胞模式:成对,弦,双弦,小分别大簇5,6,7(图2)。这种模式的变化与OA的发病和进展有关8,9。空间软骨细胞组织也表明了软骨的直接功能特性,即其刚度,强调了这种基于图像的分级方法的功能相关性10,11。这些模式还可以用已经存在的临床可用技术12来识别。由于IVD和关节软骨之间的相似性,可以假设IVD中也存在特征性软骨细胞模式。簇的形成是一种现象,在退化的IVD13,14中也观察到。
当试图分析IVD中的空间细胞组织时,有必要克服在研究关节软骨时不存在的几个技术难题:
首先,组织本身的加工比主要由II型胶原蛋白组成的均质透明软骨更具挑战性。IVD的主要纤维成分是I型胶原蛋白,这使得产生薄的组织学切片变得更加困难。虽然在透明关节软骨中,由于组织的"玻璃状"性质,甚至厚厚的切片也很容易被分析,IVD的I型胶原蛋白网络在光学上是高度不可穿透的。因此,强烈的背景噪声是IVD组织学中的常见问题。穿透这种光学致密组织的一种快速而廉价的方法是使用光学切片装置,例如通过Apotome。在这样的Apotome中,在常规荧光显微镜的照明途径中插入网格。在网格的前面放置一个平面平行的玻璃板。这会来回倾斜,从而将图像中的网格投影到三个不同的位置。对于每个 z 位置,将创建并叠加三个具有投影网格的原始图像。通过特殊的软件,可以计算出失焦的光。基本原则是,如果网格可见,则该信息处于焦点中,如果不是,则被视为失焦。使用这种技术,可以在合理的时间内获得聚焦良好的高分辨率图像。
其次,组织很难从人类捐赠者那里获得。当进行全膝关节置换术时,可以获得关节的整个表面,以便在手术过程中进行进一步分析。虽然椎间关节的骨关节炎也是整个关节的疾病,但软骨的质量仍然存在强烈的局灶性差异,通常关节的某些区域仍然完好无损,例如由于该区域的负荷减少。这种情况在IVD中有所不同,其中手术通常仅在椎间盘被整体破坏时进行。当从手术室从人类供体获取组织时,组织也是高度碎片化的,在进行进一步分析之前,有必要将组织正确分配到IVD的三种软骨类型之一。因此,为了能够对更大的组织切片进行更详细的分析并研究IVD的胚胎发育,因此,选择动物模型生物是必要的。
在选择这样的模型生物体时,重要的是要有一个在解剖结构和尺寸,机械负荷,当前细胞群以及组织组成方面与人类椎间盘相媲美的系统。为了本文所提出的技术的目的,我们建议使用牛腰椎间盘组织:人椎间盘的一个关键特性导致其低再生潜力,即在细胞核成熟期间,赱骨细胞的损失。然而,在许多模型生物中,可以检测到其整个生命周期的赭骨细胞。大多数失去赱枝细胞的少数动物,如绵羊,山羊或嗜软骨病的狗,其IVD比人类椎间盘小得多。只有腰椎牛椎间盘的行散盘直径与人类IVDs15相当。
导致早期椎间盘退化的一个关键因素是机械负荷过大。站立的牛在腰椎中的椎间盘内压力约为0.8 MPa,脊柱水平对齐。令人惊讶的是,这些压力与直立人脊柱(0.5 MPa)报告的腰椎椎间盘内压力相当15,16。此外,牛盘中的水和蛋白聚糖的含量与年轻人类的IVD相当17。因此,尽管四足动物的运动片段的实际运动模式可能与两足动物不同,但在总负荷和椎间盘特征方面,牛比其他已建立的IVD动物模型(如绵羊和狗)更接近人类生物学。
在该协议中,我们提出了一种技术,如何从空间软骨细胞组织的角度分析IVD从早期胚胎发育到终末期变性的变化。
研究方案
为了分析胚胎发育和成熟,使用牛盘。为了评估IVD的变性,分析了人类样本。
从图宾根大学医院骨科和图宾根BG创伤中心接受腰椎间盘退行性变,椎间盘脱垂或脊柱创伤手术的患者那里获得了人IVD组织。在研究开始之前,已获得伦理委员会的全面批准(项目编号244/2013BO2)。在参与之前,所有患者都收到了书面知情同意书。这些方法是根据批准的指南进行的。
牛组织从巴伐利亚州卫生和食品安全办公室/Oberschleißheim和瓦尔特豪森(德国)的一家渲染厂获得。当地和兽医当局批准了来自死亡动物的组织。
1. 样品收获
- 人IVD组织:立即将术中获得的IVD样品放入Dulbecco的改良鹰培养基(DMEM)中,其中含有2%(v / v)青霉素 - 链霉素和1.2%(v / v)两性霉素B.储存在4°C直至进一步处理。在48小时内处理组织。或者,将组织储存在-20°C下数周。
- 牛IVD组织:确保在死后24小时内从动物身上收获组织。
将牛盘与周围的椎骨从死去的动物中整体切除。将冷冻组织在干冰上运输并储存在-20°C直至进一步处理。
注意:如果只打算进行荧光分析,并且没有计划进一步的生化定量方法,如ELISA或PCR,请按如下所述进行组织固定。这允许在需要处理之前将组织储存更长时间。为了防止组织基质变质,除非组织直接冷冻,否则在收获后48小时内进行固定。
2. 样品制备
- 在室温下解冻冷冻组织。一旦在对组织进行数字轻柔压缩后,不再感觉到冰晶,请立即处理组织。
注意:在培养皿中对DMEM中的组织进行制备。 - 根据胶原密度和取向等宏观特性,确定人IVD组织(肛门纤维,中间区,髓核或软骨终板)的起源。
- 取由牛IVD椎间盘及其两个相邻椎骨组成的运动段,并使用手术刀片(刀片编号15)从软骨下骨上将椎间盘作为一个整体解剖。
- 使用两个解剖镊子翻转椎间盘,以到达更居中的区域。进行解剖。确保最后切除髓核,因为它比肛门细得多,容易撕裂,并且不容易以明确的方式脱落。
- 识别软骨的不同区域。
- 使用手术刀片(刀片编号20或22)从整个椎间盘上切出感兴趣的区域。或者,使用冷冻切片机刀片。
注意:由于牛椎间盘作为脊柱的一部分整体出现,因此可以全面准备椎间盘。这使得正确识别不同类型的软骨变得更加容易。当以上述方式解剖椎间盘时,软骨终板仍保留在椎骨上。如果要研究这个区域,最好用凿子从下面的骨头上取下,凿子在稍微弯曲的切向方向上工作。
- 如果胚胎的冠臀长度小于20厘米,请确保对胚胎进行全面处理,以保持IVD的组织结构。在这些情况下,不要对椎骨进行任何解剖。
- 一旦椎间盘被切除,识别软骨的不同区域。
- 在室温下在乙二胺四乙酸(EDTA)(20%(w / v);pH = 7.4)中进行脱钙。根据样本量选择体积 - 整个组织必须用EDTA覆盖。
- 每天更换脱钙溶液,根据组织的大小,可以长达5天。
- 使用20号针验证脱钙是否成功,该针穿透椎骨而没有明显的阻力。
注意:脱钙溶液的日常变化对于防止螯合粘合剂EDTA饱和以保持反应有效性非常重要。它还可以防止细菌定植。
3. 样品年龄、完整性和退化的分级
- 借助临床信息以及X射线和磁共振成像18,将人体椎间盘组织分为以下五类之一(图3)。
注:I类:作为近乎健康的样本,使用肛门,没有任何急性脊柱创伤引起的IVD变性的放射学体征。
II类:为了说明急性炎症开始变性的情况,使用来自临床症状患者的中间区域的组织,持续时间少于4周。
III类:描述炎症反应已经有时间影响组织和细胞从接受核脱垂手术但症状持续时间超过4周的患者身上取下组织的情况。
IV类:对于中度椎间盘退行性变,选择从椎间融合手术获得的肛门,用于退行性椎间盘疾病,Pfirrmann评分为3或4,磁共振成像19。
V类:对于从椎间融合术中获得的终末期退行性变过程肛门,用于退行性椎间盘疾病,Pfirrmann评分为5。 - 根据动物的发育阶段/年龄将牛组织分为八类之一,如 表1所示。
- 根据凯勒建议的公式计算胚胎冠臀长度的妊娠年龄:
孕龄(月)=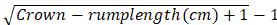
注意:妊娠前 4 周的动物的冠臀长度为 0.8-2.2 cm20。
- 根据凯勒建议的公式计算胚胎冠臀长度的妊娠年龄:
4. 组织固定
- 在4°C下将样品固定在磷酸盐缓冲盐水(PBS)中样品体积的4%(w / v)甲醛溶液的10倍中过夜。
注意:甲醛溶液从每个方向以约1毫米/小时的速度渗透组织。对于非常小或非常大的样品,可能需要调整曝光时间。 - 将组织储存在PBS中,在4°C下直至进一步处理。
5. 组织学切片
- 将样品嵌入冷冻机旋钮上的水溶性包埋培养基中。
- 将组织放在旋钮上,以便产生轴向平面或垂直切割 I 型胶原蛋白片的平面(例如,正中矢状切片平面)。
注意:组织必须被包埋介质完全覆盖。
- 将组织放在旋钮上,以便产生轴向平面或垂直切割 I 型胶原蛋白片的平面(例如,正中矢状切片平面)。
- 使用标准冷冻切片机在人类样品中以70μm的厚度切割嵌入的组织,在牛样品中以40μm的厚度切片。
注意:切片厚度的差异是由于完整的牛盘和高度退化的人体组织之间的组织完整性差异。 - 收集载玻片上的部分。
- 用疏水笔包围组织切片。
- 用磷酸盐缓冲盐水(PBS)冲洗切片3次,以除去水溶性包埋介质。
6. 荧光染色
- 在PBS中加入60μL的1%(v / v)DAPI(Exmax 358 nm,Emmax 461 nm)以及1%(v / v)的肌动蛋白跟踪染色(Exmax 540 nm,Emmax 565 nm),并在室温下孵育5分钟。
注意:这里描述的染色方案是使用DAPI核染色(蓝色)可视化细胞核,并使用肌动蛋白跟踪染色(红色)可视化细胞质。IVD由于绿色通道中的胶原纤维而具有很强的自发荧光。添加到本协议中切片的流体量适用于尺寸约为5 mm x 5 mm的切片。对于较大的部分,需要相应地增加此数量。在没有阳光直射和昏暗灯光的房间内执行所有工作,以防止染料漂白。 - 用移液管取出染色液,每次用60μLPBS洗涤三次。
- 添加合适的安装介质,并用盖玻片覆盖各部分。
注:添加盖玻片时,请确保没有气泡被卡住。最好通过开始将滑轨与滑块在一个轮辋上接触,然后让滑轨缓慢下降来完成。
7. 显微成像和处理
- 将带有染色切片的载玻片放在显微镜的样品架上。
注意:由于IVD的致密的I型胶原蛋白网络,散射光使组织难以使用常规荧光显微镜可视化。解决此问题的一种方法是使用结构化照明执行光学切片。这也允许在两个通道(蓝色和红色)中渲染整个标本的三维投影。最好使用结构化照明设置和带10倍放大倍率物镜的马赛克模式来完成,以获得样品的概览以及单个图案的3D重建。 - 启动结构化照明设备。
- 使用合适的荧光显微镜、荧光滤光片和充足的照明进行单视场成像。
注:调整所有滤光片的曝光时间,以标准化成像采集。为了在更高分辨率的图像下获得标本的准确表示,具有较高放大倍率的切片(例如,20倍物镜)。 - 使用与荧光显微镜兼容的图像优化软件优化强度和亮度,对图片进行后处理。
- 使用合适的荧光显微镜、荧光滤光片和充足的照明进行单视场成像。
- 要将剖面可视化为一个整体,请使用镶嵌成像技术
- 从工具栏面板中打开采集设置(按 6D- 采集)。
- 调整镶嵌设置(在 MosaiX 寄存器中),并定义稍后应合并到一个概视图图像的视野图像的列数和行数。
- 按 设置 并调整各个磁贴的焦点校正。
注意:对于一个大的组织切片来说,几乎不可能将整个组织表面放在一个聚焦平面上。不同焦点级别的图像图块可以通过"MosaiX Acquisition"拍摄。 - 若要开始获取图像磁贴,请按"开始"。
- 通过使用拼接功能(拼接 按钮)拼接成像的图块,软件中包含20%的重叠。
- 使用与荧光显微镜兼容的图像优化软件优化强度和亮度,对图片进行后处理。
- 要分析空间软骨细胞组织,请使用软件中包含的3D功能。
- 调整 z 轴堆栈设置。定义扫描参数:通过激活 "开始/停止 "按钮来定义 z 轴中的开始和停止位置以及切片距离。
注:软件会自动计算切片数。 - 要开始采集图像 z-stack,请按Start 。
- 使用与荧光显微镜兼容的图像优化软件优化强度和亮度,对图片进行后处理。
- 调整 z 轴堆栈设置。定义扫描参数:通过激活 "开始/停止 "按钮来定义 z 轴中的开始和停止位置以及切片距离。
- 使用与图像处理软件兼容的文件格式导出图片。
注: 将 3D 重建导出为单个图像或/和交互式 3D 模型或视频格式。
8. 细胞模式识别和密度评估
- 在适当的图像处理程序中打开整个组织切片的导出马赛克图片。
- 通过在图片中定义500μm x 500μm的感兴趣区域来定义要进行细胞密度评估的区域。
注意:所有图像质量不足的图块都将从分析中排除。 - 识别单个细胞模式。
注意:单个细胞被定义为单个细胞 - 完全封装在相邻的基质中。成对被定义为两个相邻的细胞(<25μm),其中细胞通过其基质相互连接(见 图2)。弦形成是至少三个排列成一行的软骨细胞(从细胞核的中间<25μm)。这些细胞被一个完整的基质所包围,并且可以看到每个细胞之间的基质互连。簇代表彼此直接靠近的多个细胞(<25μm),并被封装在没有基质的大空白中。 - 使用细胞计数插件对细胞模式进行定量分析。
注意:细胞质染色代表了一种识别不同空间模式的验证方法。 - 通过将计数的细胞除以所选感兴趣区域的大小来计算细胞密度。
结果
使用马赛克图像,可以清楚地识别IVD的结构及其在肛门和较软的细胞核中的致密胶原纤维网络(图4)。在胚胎发育过程中可以观察到细胞密度的连续下降(图5)。虽然在IVD发展的早期阶段,可以发现牛肛裂纤维中的细胞密度为11,435个细胞/mm²,牛髓核中的细胞密度为17,426个细胞/mm²,但这些数字在出生前迅速下降到1,011个细胞/mm²(牛肛门纤维)和...
讨论
使用荧光显微镜,加上镶嵌成像和光学切片,我们评估了软骨细胞在整个发育,成熟和变性过程中腰椎IVD肛门中的空间排列。虽然退行性组织可以从接受椎间盘变性手术的患者身上收获,但胚胎期和成熟期的分析需要使用模型生物(牛)。在早期胚胎发育期间,肛门中观察到高细胞密度。在进一步的发育过程中,可以观察到出生后生长和成熟细胞密度的显着降低。在具有晚期椎间盘变性的人体组?...
披露声明
作者没有什么可透露的。
致谢
我们感谢原始出版物的合著者的帮助和支持。我们感谢夏洛特·艾玛·班贝格(Charlotte Emma Bamberger)帮助获取了apotome图像。
材料
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
参考文献
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。