É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Secção óptica e visualização do disco intervertebral do desenvolvimento embrionário à degeneração
Neste Artigo
Resumo
Apresentamos um método para investigar a organização do condrócito espacial no ânulo fibroso do disco intervertebral utilizando um método de seção óptica.
Resumo
A degeneração do disco intervertebral (IVD) é uma das principais causas de dor lombar e implica um alto grau de comprometimento para os indivíduos afetados. Para decodificar a degeneração do disco e ser capaz de desenvolver abordagens regenerativas é essencial uma compreensão completa da biologia celular do IVD. Um aspecto dessa biologia que ainda permanece sem resposta é a questão de como as células são espacialmente dispostas em um estado fisiológico e durante a degeneração. As propriedades biológicas do IVD e sua disponibilidade dificultam a análise desse tecido. O presente estudo investiga a organização do condrócito espacial no ânulo fibroso desde o desenvolvimento embrionário precoce até a degeneração em estágio final. Um método de secção óptica (Apotome) é aplicado para realizar análises de coloração de alta resolução usando tecido embrionário bovino como modelo animal e tecido disc humano obtido de pacientes submetidos a cirurgia na coluna. A partir de uma densidade de condrocitos muito alta no disco bovino embrionário inicial, o número de células diminui durante a gestação, crescimento e maturação. Nos discos humanos, o aumento da densidade celular acompanhou a progressão da degeneração tecidual. Como já havia sido demonstrado na cartilagem articular, a formação de aglomerados representa uma característica característica da degeneração avançada do disco.
Introdução
O disco intervertebral (IVD) é uma estrutura baseada em cartilagem que bioquimicamente e com relação à arquitetura celular, à primeira vista, se assemelha em muitos aspectos à cartilagem articular1. De fato, tanto a degeneração do IVD quanto a osteoartrite (OA) da cartilagem articular são caracterizadas pelo estreitamento do espaço articular devido ao desgaste da cartilagem, formação de cisto subcondral e osteofita, e esclerose subcondral2,3. Apesar dessas semelhanças, a arquitetura e o papel funcional de ambos os tecidos diferem. Enquanto a matriz da cartilagem articular é formada principalmente por uma rede de colágeno formadora de arcade tipo II, o IVD consiste em três tipos diferentes de tecido: o núcleo pulposus rico em colágeno no centro ocupa cargas axiais e as transmite para um anel abrangente de fibras de colágeno circular densamente embaladas tipo I, que é chamado de fibroso anuloso. Sua função é absorver as pressões axiais traduzidas recebidas pelo núcleo proteoglycano e rico em água com sua resistência à fibra longitudinal. Na parte superior e inferior de cada núcleo e anulus uma placa endplata-tolina cartilaginosa hialina forma a junção com as vértebras adjacentes4 (Figura 1).
Na cartilagem articular, podem ser encontrados quatro padrões de condácito espacial distintos: pares, cordas, cordas duplas, pequenos aglomeradosgrandes 5,6,7 (Figura 2). Alterações nesse padrão estão associadas ao início e progressão de OA8,9. A organização de condrócitos espaciais também é indicativa para uma propriedade funcional direta da cartilagem, ou seja, sua rigidez, sublinhando a relevância funcional desta abordagem de classificação baseada em imagem10,11. Esses padrões podem, além disso, ser identificados com a tecnologia já existente clinicamente disponível12. Devido às semelhanças entre o IVD e a cartilagem articular, pode-se supor que padrões de condrocitos característicos também estão presentes no IVD. A formação de aglomerados é um fenômeno também observado no IVD degenerado13,14.
Ao tentar analisar a organização celular espacial no IVD, é necessário superar várias dificuldades técnicas que não estão presentes na investigação da cartilagem articular:
Em primeiro lugar, o processamento do tecido em si é muito mais desafiador do que com a cartilagem hiline homogênea que é em grande parte composta de colágeno tipo II. O principal componente de fibra do IVD é o colágeno tipo I, o que torna muito mais difícil gerar seções histológicas finas. Enquanto na cartilagem articular hialina mesmo seções grossas podem ser facilmente analisadas devido à natureza "semelhante ao vidro" do tecido, a rede de colágeno tipo I do IVD é opticamente altamente impenetrável. Por essa razão, um forte ruído de fundo é um problema comum na histologia do IVD. Uma maneira rápida e barata de penetrar neste tecido opticamente denso é o uso de um dispositivo de seção óptica, por exemplo, por meio de um Apotome. Em tal Apotome, uma grade é inserida na via de iluminação de um microscópio de fluorescência convencional. Na frente da grade é colocada uma placa de vidro paralela do avião. Isso inclina-se para frente e para trás, projetando assim a grade na imagem em três posições diferentes. Para cada posição z, três imagens brutas com a grade projetada são criadas e sobrepostas. Por meio de software especial, a luz fora de foco pode ser calculada. O princípio subjacente é que, se a grade é visível, essa informação está em foco, se não é considerada fora de foco. Com esta técnica, imagens bem focadas e de alta resolução podem ser adquiridas em um período razoável de tempo.
Em segundo lugar, o tecido é difícil de encontrar de doadores humanos. Ao fazer a substituição total do joelho, toda a superfície da articulação pode ser obtida para análise posterior durante a cirurgia. Embora a osteoartrite de uma articulação diarthrodial também seja uma doença de toda a articulação, há, no entanto, fortes diferenças focais na qualidade da cartilagem com geralmente algumas áreas da articulação ainda intactas, por exemplo, devido à redução do carregamento nessa área. Esta situação é diferente no IVD, onde a cirurgia geralmente só é realizada quando o disco é destruído globalmente. Ao obter tecido de doadores humanos da sala de operação, o tecido também é altamente fragmentado e é necessário alocar corretamente o tecido para um dos três tipos de cartilagem do IVD antes de fazer novas análises. Para permitir análises mais detalhadas de seções de tecido também maiores e olhar para o desenvolvimento embrionário do IVD a escolha de um organismo modelo animal é, portanto, necessária.
Ao escolher tal organismo modelo é importante ter um sistema que seja comparável ao disco humano em relação à sua anatomia e dimensões, seu carregamento mecânico, a população celular atual, bem como sua composição tecidual. Para efeitos da técnica apresentada aqui, sugerimos o uso de tecido discado lombar bovino: Uma propriedade crítica do disco humano resultando em seu baixo potencial regenerativo é a perda de células notootordas durante a maturação no núcleo. No entanto, em numerosos organismos modelos, células notochordal podem ser detectadas a vida toda. A maioria dos poucos animais que perdem suas células notochordal, como ovelhas, cabras ou cães de conndrodystrophig, têm um IVD muito menor do que os discos humanos. Apenas discos bovinos lombares apresentam um diâmetro de disco sagital comparável aos dos IVDs humanos15.
Um fator-chave que leva à degeneração precoce do disco é o carregamento mecânico excessivo. As pressões intradiscais de uma vaca em pé na coluna lombar são em torno de 0,8 MPa com a coluna alinhada horizontalmente. Surpreendentemente, essas pressões são comparáveis às pressões intradiscais lombares relatadas para a coluna humana ereto (0,5 MPa)15,16. Além disso, a quantidade de água e proteoglycans em discos bovinos é comparável à do IVD de jovens humanos17. Portanto, embora o padrão real de movimento dos segmentos de movimento possa diferir em animais quadrúpedes do humano bipedal, no que diz respeito ao carregamento total e características do disco, a vaca está muito mais próxima da biologia humana do que outros modelos animais estabelecidos para o IVD, como ovelhas e cães.
Neste protocolo apresentamos uma técnica de como analisar as mudanças no IVD do ponto de vista da organização condrócito espacial desde o desenvolvimento embrionário precoce até a degeneração em estágio final.
Protocolo
Para a análise do desenvolvimento embrionário e da maturação, foram utilizados discos bovinos. Para avaliar a degeneração do IVD, foram analisadas amostras humanas.
O tecido IVD humano foi obtido de pacientes submetidos a cirurgia para degeneração de disco lombar, prolapso discal ou trauma espinhal no Departamento de Cirurgia Ortopédica, Hospital Universitário de Tübingen e no Bg Trauma Centre Tübingen. A aprovação completa do comitê ético foi obtida antes do início do estudo (projeto número 244/2013BO2). O consentimento informado por escrito foi recebido de todos os pacientes antes da participação. Os métodos foram realizados de acordo com as diretrizes aprovadas.
O tecido bovino foi obtido do Escritório estadual da Baviera para Saúde e Segurança Alimentar/Oberschleißheim e de uma fábrica de renderização em Warthausen (Alemanha). A aprovação das autoridades locais e veterinárias foi recebida para tecidos de animais mortos.
1. Colheita de amostras
- Tecido IVD humano: Coloque amostras de IVD obtidas intraoperativamente imediatamente no DMEM (Modified Eagle Medium) de Dulbecco com 2% (v/v) de penicilina-estreptomicina e 1,2% de (v/v) anfotericina B. Armazenar a 4 °C até novo processamento. Processe o tecido dentro de 48 h. Alternativamente, armazene os tecidos a -20 °C por várias semanas.
- Tecido bovino IVD: Certifique-se de colher o tecido dos animais dentro de 24 horas após a morte.
Ressecção dos discos bovinos com as vértebras circundantes dos animais mortos em bloco. Transporte o tecido congelado em gelo seco e armazene a -20 °C até que seja mais processamento.
NOTA: Se apenas forem pretendidas análises de fluorescência e não forem planejados outros métodos de quantificação bioquímica, como ELISA ou PCR, realize a fixação tecidual conforme explicado abaixo. Isso permite manter o tecido mais tempo armazenado antes que ele precise ser processado. Para evitar a deterioração da matriz tecidual, realize a fixação dentro de 48 horas após a colheita, a menos que o tecido seja congelado diretamente.
2. Preparação da amostra
- Descongele o tecido congelado à temperatura ambiente. Processe o tecido assim que nenhum cristal de gelo puder ser sentido mais sobre a compressão digital suave do tecido.
NOTA: Realize a preparação do tecido em DMEM em uma placa de Petri. - Identificar a origem do tecido IVD humano (ânulo fibroso, zona intermediária, núcleo pulposus ou placa final cartilaginosa) com base em propriedades macroscópicas como densidade e orientação de colágeno.
- Pegue o segmento de movimento consistindo do disco IVD bovino com suas duas vértebras adjacentes e disseque o disco como um todo do osso subcondral usando uma lâmina cirúrgica (número da lâmina 15).
- Use duas fórceps anatômicas para virar o disco para alcançar áreas mais centradas. Faça a dissecação. Certifique-se de ressecção do núcleo pulposus por último, pois é muito mais fino que o ânulo, propenso a rasgar, e ele não sai de forma definida facilmente.
- Identifique as diferentes áreas da cartilagem.
- Corte a área de interesse de todo o disco usando uma lâmina cirúrgica (lâmina número 20 ou 22). Alternativamente, use uma lâmina criotome.
NOTA: Como os discos bovinos vêm em bloco como parte da coluna vertebral, os discos podem ser preparados in-toto. Isso facilita muito a identificação correta dos diferentes tipos de cartilagem. Ao dissecar o disco na forma descrita acima, a placa endplataática cartilaginosa permanece nas vértebras. Se esta área for investigada, é melhor tirar o osso subjacente com um cinzel trabalhando em uma direção tangencial ligeiramente dobrada.
- No caso de os embriões serem de um comprimento de coroa-garupa de menor que 20 cm, certifique-se de processar os embriões no toto para preservar a arquitetura tecidual do IVD. Não realize nenhuma dissecção das vértebras nesses casos.
- Uma vez que o disco tenha sido ressecado in-toto, identifique as diferentes áreas da cartilagem.
- Realize a decalcificação no ácido etilenodiaminetetraacético (EDTA) (20% (w/v); pH = 7,4) à temperatura ambiente. Escolha o volume dependendo do tamanho da amostra - todo o tecido deve estar bem coberto com EDTA.
- Altere a solução de decalcificação diariamente que pode ir por até 5 dias, dependendo do tamanho do tecido.
- Verifique se a decalcificação é bem sucedida com uma agulha calibre 20 que penetra as vértebras sem resistência notável.
NOTA: A mudança diária da solução de descalcificação é importante para evitar que o fichário de quela por saturação seja para manter a efeitoa de reação. Também previne a colonização bacteriana.
3. Classificação da idade amostral, integridade e degeneração
- Classificar o tecido do disco humano em uma das cinco categorias seguintes com a ajuda de informações clínicas, bem como raio-X e ressonância magnética18 (Figura 3).
NOTA: Categoria I: Servir como ânulo de amostra quase saudável sem qualquer sinal radiológico de degeneração intravenosa derivada de trauma espinhal agudo.
Categoria II: Para ilustrar uma situação de inflamação aguda com início da degeneração, use tecido da zona intermediária de pacientes com sintomas clínicos com duração inferior a 4 semanas.
Categoria III: Descrever uma situação em que a reação inflamatória já tinha tido tempo de afetar o tecido e as células tiram tecido de pacientes que foram operados para um prolapso nuclear, mas com duração do sintoma superior a 4 semanas.
Categoria IV: Para degeneração discal moderada selecione ânulo obtido de cirurgia com fusão intercorpo para doença discal degenerativa com pontuação de Pfirrmann de 3 ou 4 em ressonância magnética19.
Categoria V: Para o processo de degeneração em estágio final anulus obtido de cirurgia com fusão intercorpo para doença discal degenerativa com pontuação pfirrmann de 5. - Classificar o tecido bovino com base no estágio/idade do animal em uma das oito categorias, conforme apresentado na Tabela 1.
- Calcule a idade de gestação no comprimento da coroa-garupa dos embriões com base na fórmula sugerida por Keller:
Idade gestacional em meses =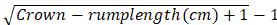
NOTA: Animais nas primeiras 4 semanas de gestação apresentam um comprimento de coroa-garupa de 0,8-2,2 cm20.
- Calcule a idade de gestação no comprimento da coroa-garupa dos embriões com base na fórmula sugerida por Keller:
4. Fixação de tecidos
- Fixar as amostras em 10x o volume da amostra de 4% (p/v) solução de formaldeído em salina tamponada de fosfato (PBS) durante a noite a 4 °C.
NOTA: A solução de formaldeído penetra tecido a uma taxa de cerca de 1 mm/hora de cada direção. Para amostras muito pequenas ou muito grandes, um ajuste do tempo de exposição poderia ser necessário. - Armazene o tecido em PBS a 4 °C até que seja mais processamento.
5. Secção histológica
- Incorpore as amostras em meio de incorporação solúvel em água no botão criotome.
- Coloque o tecido sobre o botão de tal forma que um plano axial seja gerado ou um plano que corte o colágeno tipo I lamellae perpendicular (por exemplo, um plano de secção sagital mediana).
NOTA: O tecido deve estar totalmente coberto pelo meio de incorporação.
- Coloque o tecido sobre o botão de tal forma que um plano axial seja gerado ou um plano que corte o colágeno tipo I lamellae perpendicular (por exemplo, um plano de secção sagital mediana).
- Se sectionia o tecido incorporado a uma espessura de 70 μm em amostras humanas e 40 μm em amostras bovinas usando um criotome padrão.
NOTA: A diferença na espessura da seção deve-se à diferença na integridade do tecido entre o disco bovino intacto e o tecido humano altamente degenerado. - Colete as seções em um slide de vidro.
- Cerque as seções teciduais com uma caneta hidrofóbica.
- Enxágüe as seções 3 vezes com soro fisiológico tamponado de fosfato (PBS) para remover o meio de incorporação solúvel em água.
6. Mancha de fluorescência
- Adicione 60 μL de 1% (v/v) de DAPI (Exmax 358 nm, Emmax 461 nm) bem como 1% (v/v) de coloração actin tracking (Exmax 540 nm, Emmax 565 nm) em PBS e incubar por 5 min a temperatura ambiente.
NOTA: O protocolo de coloração descrito aqui é visualizar o núcleo usando a coloração nuclear DAPI (azul) e o citoplasma usando Actin Tracking Stain (vermelho). O IVD tem uma forte autofluorescência devido às fibras de colágeno no canal verde. A quantidade de fluido adicionada às seções deste protocolo destina-se a seções de um tamanho de cerca de 5 mm x 5 mm. Para seções maiores, essa quantidade precisa ser aumentada em conformidade. Realize todos os trabalhos em salas sem exposição direta à luz solar e com luzes escurecidas para evitar branqueamento do corante. - Remova o fluido de coloração com uma pipeta e lave três vezes com 60 μL de PBS cada vez.
- Adicione um meio de montagem adequado e cubra as seções com um deslizamento de cobertura.
NOTA: Certifique-se de que não há bolhas de ar presas ao adicionar o deslizamento de cobertura. Isso é melhor feito iniciando o contato do deslizamento com o slide em uma borda e, em seguida, deixe o deslizamento descer lentamente.
7. Imagem e processamento microscópicos
- Coloque um slide com uma seção manchada no suporte de amostra do microscópio.
NOTA: Devido à densa rede de colágeno tipo I do IVD, a luz dispersa dificulta o visual do tecido usando microscopia de fluorescência convencional. Uma maneira de resolver esse problema é realizar seção óptica usando iluminação estruturada. Isso também permite tornar uma projeção tridimensional de toda a amostra em ambos os canais (azul e vermelho). Isso é melhor feito usando o ajuste de iluminação estruturada e o modo Mosaico com uma lente objetiva de ampliação de 10x para obter uma visão geral da amostra, bem como reconstruções 3D de padrões individuais. - Inicie o dispositivo de iluminação estruturado.
- Realize imagens de campo de visão única com um microscópio de fluorescência adequado, filtros de fluorescência e iluminação adequada.
NOTA: Ajuste o tempo de exposição de todos os filtros utilizados para padronizar a aquisição de imagens. Para obter uma representação precisa da amostra em uma imagem de maior resolução, as seções com maior ampliação (por exemplo, objetivo de 20x). - Pós-processo as imagens otimizando a intensidade e o brilho usando um software de otimização de imagem compatível com o microscópio de fluorescência.
- Realize imagens de campo de visão única com um microscópio de fluorescência adequado, filtros de fluorescência e iluminação adequada.
- Para visualizar a seção como um todo use a técnica de imagem de mosaico
- Abra as configurações de aquisição (pressione em 6D- Aquisição)a partir do painel da barra de ferramentas.
- Ajuste as configurações do mosaico (no Registro MosaiX) e defina o número de colunas e linhas de imagens de campo de exibição que serão posteriormente incorporadas a uma imagem de visão geral.
- Pressione a configuração e ajuste a correção do foco das telhas individuais.
NOTA: É quase impossível para uma grande seção de tecido ter toda a superfície do tecido em um único plano de foco. As telhas de imagem em diferentes níveis focais podem ser tomadas pela 'Aquisição MosaiX'. - Para iniciar a aquisição das telhas de imagem, pressione Start.
- Costure os azulejos imaged usando a função de costura (botãode costura) com 20% de sobreposição incorporada no software.
- Pós-processo as imagens otimizando a intensidade e o brilho usando um software de otimização de imagem compatível com o microscópio de fluorescência.
- Para analisar a organização do condrocito espacial, utilize a função 3D incorporada no software.
- Ajuste as configurações de pilha z. Defina os parâmetros de digitalização: defina as posições de partida e parada no eixo z e a distância da fatia ativando o botão Iniciar/Parar.
NOTA: O software calcula automaticamente o número de fatias. - Para iniciar a aquisição das pilhas z de imagem, pressione Start.
- Pós-processo as imagens otimizando a intensidade e o brilho usando um software de otimização de imagem compatível com o microscópio de fluorescência.
- Ajuste as configurações de pilha z. Defina os parâmetros de digitalização: defina as posições de partida e parada no eixo z e a distância da fatia ativando o botão Iniciar/Parar.
- Exporte as imagens com um formato de arquivo compatível com o software de processamento de imagens.
NOTA: Exporte as reconstruções 3D como imagens individuais ou/e como um modelo 3D interativo ou em formato de vídeo.
8. Identificação de padrões celulares e avaliação de densidade
- Abra as imagens de mosaico exportado de toda a seção de tecido em um programa apropriado de processamento de imagens.
- Defina as áreas submetidas à avaliação da densidade celular definindo regiões de interesse de 500 μm x 500 μm nas imagens.
NOTA: Todas as telhas que não possuem qualidade de imagem adequada são excluídas da análise. - Identifique padrões celulares individuais.
NOTA: As células únicas são definidas como células individuais - totalmente encapsuladas dentro da matriz adjacente. Os pares são definidos como duas células adjacentes próximas (<25 μm) em que as células estão interconectadas através de suas matrizes (ver Figura 2). As formações de cordas são pelo menos três condrócitos alinhados na linha (do meio dos núcleos <25 μm). Essas células são englobadas por uma matriz intacta e interconexões matriciais podem ser vistas entre cada célula. Os clusters representam múltiplas células que estão localizadas em proximidade direta entre si (<25 μm) e são encapsuladas em uma grande lacuna desprovida de matriz. - Use um plug-in de contagem de células para a análise quantitativa dos padrões celulares.
NOTA: A coloração do citoplasma representa um método de verificação para identificar os diferentes padrões espaciais. - Calcule a densidade celular dividindo as células contadas pelo tamanho da região de interesse escolhida.
Resultados
Utilizando imagens de mosaico, a arquitetura do IVD com sua densa rede de fibra de colágeno no ânulo e no núcleo mais suave pode ser claramente reconhecida(Figura 4). Uma diminuição contínua da densidade celular pode ser observada durante o desenvolvimento embrionário(Figura 5). Enquanto nos estágios iniciais do desenvolvimento do IVD uma densidade celular de 11.435 células/mm² no ânulo bovino fibroso e 17.426 células/mm² no núcleo bovino pulposo p...
Discussão
Utilizando microscopia de fluorescência aumentada por imagem de mosaico e seção óptica, avaliamos o arranjo espacial de condrocitos no ânulo do IVD lombar durante o desenvolvimento, maturação e degeneração. Enquanto o tecido degenerativo poderia ser colhido de pacientes que receberam cirurgia na coluna para degeneração do disco, a análise do período embrionário e da fase de maturação exigiu o uso de um organismo modelo (bovino). Altas densidades celulares foram notadas no ânulo durante o desenvolvimento ...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos aos nossos coautores das publicações originais pela ajuda e apoio. Agradecemos a Charlotte Emma Bamberger por ajudar a adquirir as imagens do apotome.
Materiais
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Referências
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados