このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
胚発生から変性までの椎間板の光学断面化と可視化
要約
光断面化法を用いて椎間板のアヌル線維化における空間的軟骨細胞組織を調べる方法を提示する。
要約
椎間板(IVD)変性は腰痛の主な原因であり、罹患した個人に対して高い障害を伴う。ディスクの変性を解読し、再生アプローチを開発するためには、IVDの細胞生物学を完全に理解することが不可欠です。この生物学の1つの側面は、細胞が生理学的状態と変性の間にどのように空間的に配置されているかという問題です。IVDの生物学的性質とその可用性により、この組織を分析することは困難です。本研究では、初期胚発生から末期変性まで、アヌル線維症における空間的軟骨細胞組織を調査する。脊椎手術を受けた患者から得られた動物モデルやヒト円盤組織として、牛胚組織を用いた高分解能染色解析を行うため、光学断面化法(Apotome)を適用します。初期胚性牛円盤中の非常に高い軟骨細胞密度から、細胞の数は妊娠、成長、および成熟の間に減少する。ヒトのディスクでは、細胞密度の増加が組織変性の進行を伴った。関節軟骨で既に実証されているように、クラスター形成は高度なディスク変性の特徴を表す。
概要
椎間板(IVD)は、生化学的に、そして細胞アーキテクチャに関して、一見すると、多くの点で関節軟骨1に似ている軟骨系の構造である。実際、関節軟骨のIVD変性と変形性関節症(OA)の両方が軟骨摩耗、軟骨下嚢胞および骨棘形成、及び軟骨下硬化症2、3による関節空間狭小化を特徴とする。これらの類似点にもかかわらず、両方の組織のアーキテクチャと機能的役割が異なります。関節軟骨のマトリックスは主にアーケード形成コラーゲンII型ネットワークで形成されていますが、IVDは3つの異なるタイプの組織で構成されています:中央のコラーゲンII型が豊富なパルポスス核は、軸負荷を取り込み、それらを細密に詰まった円形コラーゲンI型繊維の包含リングに送信します。その機能は、引張縦繊維強度を持つプロテオグリカンおよび水が豊富な核によって受け取られる変換された軸圧力を吸収することです。各核の上部と下部とアヌラスでは、ヒアリン軟骨エンドプレートが隣接する椎骨4との接合部を形成する(図1)。
関節軟骨では、4つの異なる空間軟骨細胞パターンが見つけられる:対、文字列、二重弦、小さな大きなクラスター5、6、7(図2)。このパターンの変更は、OA の発症と進行に関連付けられます8,9。空間的軟骨細胞組織はまた、軟骨の直接的な機能的性質、すなわちその剛性を示し、この画像ベースのグレーディングアプローチ10,11の機能的関連性を強調する。これらのパターンは、さらに既存の臨床利用可能な技術12で同定することができる。IVDと関節軟骨の類似性により、特徴的な軟骨細胞パターンもIVDに存在すると仮定することができます。クラスター形成は、退化したIVD13、14にも認められる現象である。
IVDで空間細胞組織を分析しようとする場合、関節軟骨を調査する際に存在しないいくつかの技術的な困難を克服する必要があります。
まず、組織自体の処理は、コラーゲンII型で構成される均質なヒアリン軟骨よりもはるかに困難です。IVDの主な繊維成分はコラーゲンタイプIであり、組織学的な薄い部分を生成することがはるかに困難になります。ヒアリン関節軟骨では、組織の「ガラス状」の性質により厚い切片でも容易に分析できるが、IVDのコラーゲン型I型ネットワークは光学的に高い可知性である。このため、IVDの神学では、強いバックグラウンドノイズが一般的な問題です。この光学的に密な組織を浸透するための迅速かつ安価な方法は、例えば、アポトームによって光学断面化装置の使用である。このようなアポトームでは、従来の蛍光顕微鏡の照明経路にグリッドが挿入される。グリッドの前に平面平行ガラス板が配置されます。これは前後に傾き、3つの異なる位置にイメージ内のグリッドを投影します。各 Z 位置に対して、投影グリッドを持つ 3 つの未加工イメージが作成され、重ね合わせられます。特別なソフトウェアによって、焦点外光を計算することができる。基本的な原則は、グリッドが表示されている場合、その情報がフォーカスされていない場合は、フォーカスが外されていると見なされるということです。この技術により、適切に焦点を合わせ、高解像度の画像を適度な時間で取得できます。
第二に、組織は人間のドナーから来るのが難しい。膝の全置換を行う場合、関節の全面を得て手術中にさらなる分析を行うことができる。ジ関節関節の変形性関節症は関節全体の疾患でもあるが、関節の一部の領域がそのまま残っている軟骨の質には依然として強い焦点差があるが、例えばその領域の負荷が減少したためである。この状況は、通常、ディスクがグローバルに破壊されたときにのみ手術が行われるIVDでは異なります。手術室からヒトドナーから組織を得るとき、組織も高度に断片化されており、さらなる分析を行う前に、IVDの3つの軟骨タイプのいずれかに組織を正しく割り当てる必要があります。また、より大きな組織切片のより詳細な分析を可能にし、IVDの胚発生を調べるためには、動物モデル生物の選択が必要である。
このようなモデル生物を選択する場合、その解剖学的および寸法、その機械的負荷、現在の細胞集団ならびに組織組成に関して、ヒトディスクと同等のシステムを有することが重要である。ここで提示された技術の目的のために、我々は牛腰椎椎椎組織の使用を示唆する:その低い再生電位をもたらすヒトディスクの重要な特性は、核内の成熟中の脊索細胞の喪失である。しかし、多数のモデル生物において、脊索細胞は生涯を通じて検出することができる。羊、ヤギ、軟骨栄養症犬などの脊索細胞を失う少数の動物のほとんどは、人間のディスクよりもはるかに小さいIVDを持っています。ヒトIVDの直径に匹敵する矢状円盤径を有する腰部ウシディスク15.
初期のディスク変性につながる重要な要因は、過度の機械的負荷です。腰椎の立っている牛の円盤内圧は、背骨が水平に整列した約0.8 MPaです。驚くべきことに、これらの圧力は、勃起したヒト脊椎(0.5MPa)15,16について報告された腰部の椎間板内圧に匹敵する。また、ウシディスク中の水およびプロテオグリカンの量は、若いヒト17からのIVDのそれと同等である。したがって、運動セグメントの実際の移動パターンは、二足歩行動物と二足歩行動物では異なるかもしれないが、総負荷およびディスク特性に関しては、牛は羊や犬などのIVDの他の確立された動物モデルよりもはるかに人間の生物学に近い。
このプロトコルでは、初期胚発生から末期変性まで空間軟骨細胞組織の観点からIVDの変化を解析する方法を提示する。
プロトコル
胚発生および成熟の解析のために、牛ディスクが使用された。IVDの変性を評価するために、ヒトサンプルを分析した。
ヒトIVD組織は、テュービンゲン大学病院、BG外傷センターテュービンゲン整形外科の腰椎板変性、椎間板脱、または脊髄外傷の手術を受けている患者から得られた。調査開始前に倫理委員会の完全承認を得た(プロジェクト番号244/2013BO2)。書面によるインフォームド・コンセントは、参加前にすべての患者から受け取られました。方法は、承認されたガイドラインに従って行われた。
ウシの組織は、バイエルン州保健食品安全局/オーバーシュリースハイムとワルトハウゼン(ドイツ)のレンダリング工場から入手した。地元および獣医当局の承認を受け、死んだ動物から組織を受け取った。
1. サンプル収穫
- ヒトIVD組織:術中に得られたIVDサンプルを、ペニシリン・ストレプトマイシンの2%(v/v)、さらに処理されるまで4°Cの(v/v)アンホテリシンBストアを備えた、ダルベックコの修飾イーグル培地(DMEM)に直ちに配置します。48時間以内に組織を処理する。あるいは、組織を-20°Cで数週間保存します。
- 牛IVD組織:死後24時間以内に動物から組織を収穫することを確認します。
死んだ動物のブロックから周囲の椎骨で牛のディスクを割り除きます。凍結した組織をドライアイスで輸送し、さらに処理するまで-20°Cで保管します。
注:蛍光分析のみを目的とし、ELISAやPCRなどの生化学的定量方法が計画されていない場合は、以下に説明する組織固定を行ってください。これは、それが処理される必要がある前に、保存中の組織を長く保つことができます.組織マトリックスの劣化を防ぐために、組織が直接凍結しない限り、収穫後48時間以内に固定を行う。
2. サンプル準備
- 凍結した組織を室温で解凍します。氷結晶がなまで、組織のデジタル穏やかな圧縮でこれ以上感じることができないとすぐに組織を処理します。
注意:ペトリ皿の中でDMEMのティッシュの準備を行う。 - コラーゲン密度や配向などの巨視的な特性に基づいて、ヒトIVD組織(アヌラス線維症、中間領域、パルポスス核、軟骨エンドプレート)の起源を特定します。
- 2つの隣接する椎骨を有する牛IVDディスクからなる動きセグメントを取り、外科用ブレード(ブレード番号15)を使用して軟骨下骨からディスク全体を解剖する。
- 2つの解剖鉗子を使用して、より中央の領域に到達するためにディスクを反転させます。解剖を実行します。それは、引き裂きがちな、アヌラスよりもはるかに薄く、簡単に定義された方法で外れないので、最後に核パルポスを切除することを確認してください。
- 軟骨の異なる領域を特定します。
- 外科用ブレード(ブレード番号20または22)を使用して、ディスク全体から対象領域を切り取ります。あるいは、クライオトームブレードを使用します。
注:牛のディスクは背骨の一部としてエンブロックに来るように、ディスクはtotoで準備することができます。これにより、異なるタイプの軟骨の正しい識別がはるかに容易になります。上述の方法でディスクを解剖する場合、軟骨エンドプレートは椎骨に残る。この領域を調査する場合は、わずかに曲がった接線方向に働くノミで下の骨から取り除くのが最善です。
- 胚が20cm未満のクラウンランプ長である場合には、IVDの組織アーキテクチャを維持するために胚をtotoで処理することを確認する。これらの場合には、椎骨の解剖を行わない。
- ディスクがイントトに切除されたら、軟骨の異なる領域を特定します。
- エチレンジアミンテトラ酢酸(EDTA)(20%(w/v)、pH=7.4)を室温で脱灰処理します。サンプルサイズに応じてボリュームを選択してください - 組織全体がEDTAで十分に覆われなければなりません。
- 組織の大きさに応じて最大5日間行くことができる毎日の脱灰液を変更します。
- 顕著な抵抗なしで椎骨を貫通する20ゲージの針で脱灰が成功することを確認する。
注:デケイ素化溶液の毎日の変化は、反応効果を維持するために、焼酸結合剤EDTAが飽和するのを防ぐために重要です。また、細菌のコロニー形成を防ぎます.
3. サンプルの年齢、完全性、および変性のグレーディング
- 臨床情報とX線および磁気共鳴画像18の助けを借りて、ヒトディスク組織を次の5つのカテゴリーのいずれかに分類する(図3)。
注:カテゴリーI:近い健康なサンプルとして機能するには、急性脊髄外傷に由来するIVD変性の放射線徴候なしにアヌルを使用する。
カテゴリーII:持続時間が4週間未満の臨床症状を有する患者からの中間領域からの組織を使用して、初代変性を有する急性炎症の状況を例示する。
カテゴリーIII:炎症反応が既に組織に影響を与える時間を持っていた状況を説明し、細胞は核脱出のために手術されたが、症状期間が4週間を超える患者から組織を取る。
カテゴリーIV:中程度のディスク変性のために、磁気共鳴画像法19においてPfirrmannスコア3または4を有する変性ディスク疾患に対する体間融合による手術から得られたアヌラスを選択する。
カテゴリーV:エンドステージ変性プロセスアヌラスは、Pfirrmannスコア5の変性椎間板疾患に対する体間融合を有する手術から得た。 - 牛の組織を、動物の発達段階/年齢に基づいて 、8つのカテゴリのいずれかに分類します。
- ケラーが提案した式に基づいて、胚のクラウンランプ長の妊娠年齢を計算します。
月の妊娠年齢=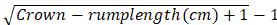
注:妊娠の最初の4週間の動物は、0.8-2.2 cm20のクラウンランプの長さを有する存在する。
- ケラーが提案した式に基づいて、胚のクラウンランプ長の妊娠年齢を計算します。
4. 組織固定
- サンプルを、リン酸緩衝生理食塩水(PBS)の4%(w/v)ホルムアルデヒド溶液の4%の体積を4°Cで一晩固定します。
注:ホルムアルデヒド溶液は、各方向から約1mm/時間の速度で組織に浸透します。非常に小さいまたは非常に大きなサンプルの場合、露光時間の調整が必要になる可能性があります。 - さらに処理されるまで4°Cで組織をPBSに保管してください。
5. 組織学的切除
- クリオトームノブに水溶性埋め込み培地にサンプルを埋め込みます。
- 軸面が生成されるか、またはコラーゲンタイプIのラメラを垂直に切断する平面(例えば、中央の矢状断面平面)になるように、ノブの上に組織を置きます。
注:組織は埋め込み培地で完全に覆われなされます。
- 軸面が生成されるか、またはコラーゲンタイプIのラメラを垂直に切断する平面(例えば、中央の矢状断面平面)になるように、ノブの上に組織を置きます。
- 組み込み組織をヒトサンプルで70μm、標準のクライオトームを使用して牛サンプルで40μmの厚さで切り離します。
注:セクションの厚さの違いは、無傷のウシディスクと非常に縮退性のヒト組織との間の組織の完全性の違いによるものです。 - ガラススライドのセクションを収集します。
- 疎水性ペンで組織切片を囲む。
- リン酸緩衝食塩水(PBS)で3回、水溶性埋め込み培地を除去してセクションをリンスする。
6. 蛍光染色
- DAPI(Exmax 358 nm、Emmax 461 nm)の1%(v/v)の60 μLと、PBSにアクチントラッキング染色(Exmax 540 nm、Emmax 565 nm)の1%(v/v)を加え、室温で5分間インキュベートします。
注: ここで説明する染色プロトコルは、アクチントラッキングステイン(赤)を使用してDAPI核染色(青)と細胞質を使用して核を可視化することです。IVDは、緑色チャネルのコラーゲン繊維による強力な自己蛍光を有する。このプロトコルのセクションに添加される流体の量は、約5 mm x 5 mmのセクションを対象としています。大きなセクションの場合、この量はこれに応じて増やす必要があります。直射日光を浴びない部屋や、薄暗いライトですべての作業を行い、染料の漂白を防ぎます。 - ピペットで染色液を取り出し、毎回60μLのPBSで3回洗浄します。
- 適切な取り付け媒体を追加し、カバースリップでセクションをカバーします。
注:カバースリップを追加する際に、気泡が閉じ込められないようにしてください。これは、1つのリムのスライドでスリップの接触を開始し、スリップがゆっくりと降りてくるので行うのが最善です。
7. 顕微鏡イメージングと加工
- 顕微鏡のサンプルホルダーに染色されたセクションを備えたスライドを置きます。
注:IVDのコラーゲンタイプIネットワークが密集しているため、散乱光は従来の蛍光顕微鏡を使用して組織を視覚化することが困難になります。この問題に対処する 1 つの方法は、構造化された照明を使用して光断面を実行することです。これにより、両方のチャンネル(青と赤)で標本全体の3次元投影をレンダリングすることもできます。これは、構造化された照明設定と10倍の拡大対物レンズを使用したモザイクモードを使用して、サンプルの概要と個々のパターンの3D再構築を得るのに最適です。 - 構造化照明装置を起動します。
- 適切な蛍光顕微鏡、蛍光フィルター、および適切な照明で単一視野イメージングを行います。
注: イメージング取得を標準化するために使用されるすべてのフィルターの露光時間を調整します。より高い解像度の画像で標本の正確な表現を得るために、より高い倍率(例えば、20倍の目的)を有するセクション。 - 蛍光顕微鏡と互換性のある画像最適化ソフトウェアを使用して、強度と明るさを最適化して画像を後処理します。
- 適切な蛍光顕微鏡、蛍光フィルター、および適切な照明で単一視野イメージングを行います。
- モザイクイメージング技術を使用してセクション全体を視覚化するには
- ツールバーパネルから取得設定を開きます (6D- 取得を押します)。
- モザイクの設定を調整 (MosaiX Registerで) し、後で 1 つのオーバービュー 画像にマージするフィールド オブ ビュー 画像の列と行の数を定義します。
- [設定]を押して、個々のタイルのフォーカス補正を調整します。
注:大きな組織セクションが単一のフォーカス面で組織表面全体を持つことはほとんど不可能です。異なる焦点レベルでの画像タイルは、「MosaiXの獲得」によって取ることができる。 - イメージ タイルの取得を開始するには 、Startキーを押します。
- ソフトウェアに20%のオーバーラップを組み込んだステッチ機能(ステッチ ボタン)を使用して、画像タイルをステッチします。
- 蛍光顕微鏡と互換性のある画像最適化ソフトウェアを使用して、強度と明るさを最適化して画像を後処理します。
- 空間的コンドロシテ組織を解析するには、ソフトウェアに組み込まれた3D機能を使用します。
- Z スタックの設定を調整します。スキャンパラメータを定義: Z軸の開始位置と終了位置、および[ 開始/停止 ]ボタンをアクティブにしてスライス距離を定義します。
注:ソフトウェアは、自動的にスライスの数を計算します。 - イメージ z スタックの取得を開始するには 、Startキーを押します。
- 蛍光顕微鏡と互換性のある画像最適化ソフトウェアを使用して、強度と明るさを最適化して画像を後処理します。
- Z スタックの設定を調整します。スキャンパラメータを定義: Z軸の開始位置と終了位置、および[ 開始/停止 ]ボタンをアクティブにしてスライス距離を定義します。
- 画像処理ソフトウェアと互換性のあるファイル形式で画像をエクスポートします。
注: 3D 再構成を個別のイメージまたはインタラクティブな 3D モデルまたはビデオ形式でエクスポートします。
8. 細胞パターンの同定と密度評価
- 適切な画像処理プログラムで組織セクション全体のエクスポートされたモザイク画像を開きます。
- 画像内で500 μm x 500 μmの対象領域を定義することにより、細胞密度評価を受ける領域を定義します。
注: 適切な画質を持たないすべてのタイルは、解析から除外されます。 - 個々の細胞パターンを特定する。
注: 単一セルは、隣接する行列内に完全にカプセル化された個々のセルとして定義されます。ペアは近接して2つの隣接セル(<25 μm)と定義され、それによってセルはマトリックスを介して相互接続されます( 図2参照)。文字列形成は、少なくとも3つの軟骨細胞が整列している(核の真ん中から<25μm)。これらの細胞は、無傷の行列によって包含され、各セル間のマトリックス相互接続が見られる。クラスタは、互いに直接近接している複数の細胞(<25 μm)を表し、マトリックスを欠いた大きなラクナにカプセル化されます。 - 細胞のパターンの定量的な分析には、セル数プラグインを使用します。
注: 細胞質染色は、異なる空間パターンを識別する検証方法を表します。 - セル密度を計算するには、カウントされたセルを、選択した対象領域のサイズで割ります。
結果
モザイク画像を用いて、アヌル内のコラーゲン繊維網と軟質核を有するIVDのアーキテクチャを明確に認識することができる(図4)。胚発生時に細胞密度の連続的な減少が観察される(図5)。IVDの初期段階では、牛の大腸線維症では11,435細胞/mm²、ウシ核パルポスでは17,426細胞/mm²の細胞密度が見つかりますが、これらの数は1,011細胞/mm²(牛の大腸線維症)...
ディスカッション
モザイクイメージングと光学断面化により増強された蛍光顕微鏡を用いて、開発、成熟、変性を通じて、腰椎IVDのアヌルにおける軟骨細胞の空間配置を評価した。椎間板変性のために脊椎手術を受けた患者から変性組織を採取することができたが、胚期および成熟期の分析にはモデル生物(ウシ)の使用が必要であった。初期の胚発生時に高い細胞密度がアヌラスで注目された。開発のさらな?...
開示事項
著者らは開示するものは何もない。
謝辞
私たちは、彼らの助けとサポートのために元の出版物からの私たちの共同執筆者に感謝します。シャーロット・エマ・バンバーガーがアポトーム画像の取得を手伝ってくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
参考文献
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved