Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Seccionamiento óptico y visualización del disco intervertebral desde el desarrollo embrionario hasta la degeneración
En este artículo
Resumen
Presentamos un método para investigar la organización espacial de los condrocitos en el anillo fibroso del disco intervertebral utilizando un método de seccionamiento óptico.
Resumen
La degeneración del disco intervertebral (IVD) es una de las principales causas de dolor lumbar y conlleva un alto grado de deterioro para los individuos afectados. Para decodificar la degeneración del disco y poder desarrollar enfoques regenerativos es esencial una comprensión profunda de la biología celular de la IVD. Un aspecto de esta biología que aún permanece sin respuesta es la cuestión de cómo las células están organizadas espacialmente en un estado fisiológico y durante la degeneración. Las propiedades biológicas del IVD y su disponibilidad hacen que este tejido sea difícil de analizar. El presente estudio investiga la organización espacial de los condrocitos en el anillo fibroso desde el desarrollo embrionario temprano hasta la degeneración en etapa terminal. Se aplica un método de seccionamiento óptico (Apotoma) para realizar análisis de tinción de alta resolución utilizando tejido embrionario bovino como modelo animal y tejido de disco humano obtenido de pacientes sometidos a cirugía de columna. A partir de una densidad de condrocitos muy alta en el disco bovino embrionario temprano, el número de células disminuye durante la gestación, el crecimiento y la maduración. En los discos humanos, un aumento en la densidad celular acompañó la progresión de la degeneración tisular. Como ya se había demostrado en el cartílago articular, la formación de grupos representa un rasgo característico de la degeneración avanzada del disco.
Introducción
El disco intervertebral (IVD) es una estructura basada en cartílago que bioquímicamente y con respecto a la arquitectura celular, a primera vista, se asemeja en muchos aspectos al cartílago articular1. De hecho, tanto la degeneración ivD como la osteoartritis (OA) del cartílago articular se caracterizan por el estrechamiento del espacio articular debido al desgaste del cartílago, el quiste subcondral y la formación de osteofitos, y la esclerosis subcondral2,3. A pesar de estas aparentes similitudes, la arquitectura y el papel funcional de ambos tejidos difieren. Mientras que la matriz del cartílago articular está formada principalmente por una red de colágeno tipo II formadora de arcadas, la IVD consiste en tres tipos diferentes de tejido: el núcleo pulposo rico en colágeno tipo II en el centro toma cargas axiales y las transmite a un anillo abarcador de fibras circulares de colágeno tipo I densamente empaquetadas que se llama anulus fibrosus. Su función es absorber las presiones axiales traducidas recibidas por el núcleo rico en proteoglicanos y agua con su resistencia a la tracción de la fibra longitudinal. En la parte superior e inferior de cada núcleo y anillo, una placa terminal cartilaginosa hialina forma la unión con las vértebras adyacentes4 (Figura 1).
En el cartílago articular, se pueden encontrar cuatro patrones de condrocitos espaciales distintos: pares, cuerdas, cuerdas dobles, pequeños grupos grandes respectivamente5,6,7 (Figura 2). Los cambios en este patrón se asocian con el inicio y la progresión de la OA8,9. La organización espacial de los condrocitos también es indicativa de una propiedad funcional directa del cartílago, a saber, su rigidez, lo que subraya la relevancia funcional de este enfoque de clasificación basado en imágenes10,11. Estos patrones también se pueden identificar con la tecnología ya existente disponible clínicamente12. Debido a las similitudes entre el IVD y el cartílago articular, se puede plantear la hipótesis de que los patrones característicos de condrocitos también están presentes en el IVD. La formación de cúmulos es un fenómeno también observado en la IVD degenerada13,14.
Al tratar de analizar la organización celular espacial en la IVD, es necesario superar varias dificultades técnicas que no están presentes al investigar el cartílago articular:
En primer lugar, el procesamiento del tejido en sí es mucho más difícil que con el cartílago hialino homogéneo que se compone en gran parte de colágeno tipo II. El principal componente de fibra del IVD es el colágeno tipo I, lo que hace que sea mucho más difícil generar secciones histológicas delgadas. Mientras que en el cartílago articular hialino incluso las secciones gruesas se pueden analizar fácilmente debido a la naturaleza "similar al vidrio" del tejido, la red de colágeno tipo I de la IVD es ópticamente altamente impenetrable. Por esta razón, un fuerte ruido de fondo es un problema común en la histología de la IVD. Una forma rápida y barata de penetrar en este tejido ópticamente denso es el uso de un dispositivo de seccionamiento óptico, por ejemplo, por medio de un apotoma. En un apotoma de este tipo, se inserta una rejilla en la vía de iluminación de un microscopio de fluorescencia convencional. Frente a la rejilla se coloca una placa de vidrio plano-paralela. Esto se inclina hacia adelante y hacia atrás, proyectando así la cuadrícula en la imagen en tres posiciones diferentes. Para cada posición z, se crean y superponen tres imágenes sin procesar con la cuadrícula proyectada. Por medio de un software especial, se puede calcular la luz desenfocada. El principio subyacente es que, si la cuadrícula es visible, esa información está enfocada, si no se considera que está fuera de foco. Con esta técnica, se pueden adquirir imágenes bien enfocadas y de alta resolución en un tiempo razonable.
En segundo lugar, el tejido es difícil de obtener de donantes humanos. Al realizar un reemplazo total de rodilla, se puede obtener toda la superficie de la articulación para un análisis adicional durante la cirugía. Aunque la osteoartritis de una articulación diartrodial también es una enfermedad de toda la articulación, sin embargo, existen fuertes diferencias focales en la calidad del cartílago, con generalmente algunas áreas de la articulación aún intactas, por ejemplo, debido a la reducción de la carga en esa área. Esta situación es diferente en la IVD, donde la cirugía generalmente solo se realiza cuando el disco se destruye globalmente. Al obtener tejido de donantes humanos de la sala de operaciones, el tejido también está altamente fragmentado y es necesario asignar correctamente el tejido a uno de los tres tipos de cartílago de la IVD antes de realizar más análisis. Por lo tanto, para permitir análisis más detallados de secciones de tejido también más grandes y para analizar el desarrollo embrionario del IVD, es necesaria la elección de un organismo modelo animal.
Al elegir un organismo modelo de este tipo, es importante tener un sistema que sea comparable con el disco humano con respecto a su anatomía y dimensiones, su carga mecánica, la población celular actual y su composición tisular. Para el propósito de la técnica presentada aquí sugerimos el uso de tejido de disco lumbar bovino: Una propiedad crítica del disco humano que resulta en su bajo potencial regenerativo es la pérdida de células notacordales durante la maduración en el núcleo. Sin embargo, en numerosos organismos modelo se pueden detectar células notocordales durante toda su vida. La mayoría de los pocos animales que pierden sus células notacordales, como ovejas, cabras o perros condrodistrofijos, tienen un IVD que es mucho más pequeño que los discos humanos. Sólo los discos bovinos lumbares presentan un diámetro de disco sagital comparable a los de los IVD humanos15.
Un factor clave que conduce a la degeneración temprana del disco es la carga mecánica excesiva. Las presiones intradiscales de una vaca de pie en la columna lumbar son de alrededor de 0,8 MPa con la columna vertebral alineada horizontalmente. Sorprendentemente estas presiones son comparables a las presiones intradiscales lumbares reportadas para la columna vertebral humana erecta (0.5 MPa)15,16. También la cantidad de agua y proteoglicanos en los discos bovinos es comparable a la del IVD de humanos jóvenes17. Por lo tanto, aunque el patrón de movimiento real de los segmentos de movimiento puede diferir en los animales cuadrúpedos del humano bípedo, con respecto a la carga total y las características del disco, la vaca está mucho más cerca de la biología humana que otros modelos animales establecidos para la IVD, como ovejas y perros.
En este protocolo presentamos una técnica de cómo analizar los cambios en la IVD desde el punto de vista de la organización espacial de los condrocitos desde el desarrollo embrionario temprano hasta la degeneración terminal.
Protocolo
Para el análisis del desarrollo embrionario y la maduración se utilizaron discos bovinos. Para evaluar la degeneración de la IVD, se analizaron muestras humanas.
El tejido IVD humano se obtuvo de pacientes sometidos a cirugía por degeneración del disco lumbar, prolapso de disco o trauma espinal en el Departamento de Cirugía Ortopédica del Hospital Universitario de Tübingen y el Centro de Trauma BG Tübingen. La aprobación completa del comité ético se obtuvo antes del inicio del estudio (proyecto número 244/2013BO2). Se recibió el consentimiento informado por escrito de todos los pacientes antes de la participación. Los métodos se llevaron a cabo de acuerdo con las directrices aprobadas.
El tejido bovino se obtuvo de la Oficina Estatal de Salud y Seguridad Alimentaria de Baviera/Oberschleißheim y de una planta de renderizado en Warthausen (Alemania). Se recibió la aprobación de las autoridades locales y veterinarias para el tejido de animales muertos.
1. Cosecha de muestra
- Tejido IVD humano: Coloque las muestras de IVD obtenidas intraoperatoriamente inmediatamente en el Medio Águila Modificada (DMEM) de Dulbecco con 2% (v/v) de penicilina-estreptomicina y 1.2% de (v/v) anfotericina B. Almacene a 4 °C hasta su posterior procesamiento. Procese el tejido dentro de las 48 h. Alternativamente, guarde los tejidos a -20 °C durante varias semanas.
- Tejido IVD bovino: Asegúrese de cosechar el tejido de los animales dentro de las 24 h posteriores a la muerte.
Reseque los discos bovinos con las vértebras circundantes de los animales muertos en bloque. Transportar el tejido congelado sobre hielo seco y almacenarlo a -20 °C hasta su posterior procesamiento.
NOTA: Si solo se pretenden análisis de fluorescencia y no se planean otros métodos de cuantificación bioquímica como ELISA o PCR, realice la fijación tisular como se explica a continuación. Esto permite mantener el tejido más tiempo almacenado antes de que necesite ser procesado. Para evitar el deterioro de la matriz tisular, realice la fijación dentro de las 48 h posteriores a la cosecha, a menos que el tejido se congele directamente.
2. Preparación de la muestra
- Descongele el tejido congelado a temperatura ambiente. Procese el tejido tan pronto como ya no se puedan sentir cristales de hielo después de la compresión suave digital del tejido.
NOTA: Realizar la preparación del tejido en DMEM en una placa de Petri. - Identificar el origen del tejido IVD humano (anillo fibroso, zona intermedia, núcleo pulposo o placa terminal cartilaginosa) en función de las propiedades macroscópicas como la densidad y orientación del colágeno.
- Tome el segmento de movimiento que consiste en el disco IVD bovino con sus dos vértebras adyacentes y diseccione el disco como un todo del hueso subcondral utilizando una cuchilla quirúrgica (cuchilla número 15).
- Use dos fórceps anatómicos para voltear el disco y llegar a las áreas más centradas. Realizar la disección. Asegúrese de resecar el núcleo pulposo por última vez, ya que es mucho más delgado que el anillo, propenso a desgarrarse, y no se desprende de manera definida fácilmente.
- Identificar las diferentes áreas del cartílago.
- Recorte el área de interés de todo el disco con una cuchilla quirúrgica (cuchilla número 20 o 22). Alternativamente, use una cuchilla criotomática.
NOTA: Como los discos bovinos vienen en bloque como parte de la columna vertebral, los discos se pueden preparar in-toto. Esto hace que la identificación correcta de los diferentes tipos de cartílago sea mucho más fácil. Al diseccionar el disco de la manera descrita anteriormente, la placa terminal cartilaginosa permanece en las vértebras. Si se investiga esta área, es mejor quitarla del hueso subyacente con un cincel que trabaje en una dirección tangencial ligeramente doblada.
- En caso de que los embriones sean de una longitud de corona-grupa de menos de 20 cm, asegúrese de procesar los embriones en toto para preservar la arquitectura tisular de la IVD. No realizar ninguna disección de las vértebras en estos casos.
- Una vez que el disco ha sido resecado in-toto, identifique las diferentes áreas del cartílago.
- Realizar la descalcificación en ácido etilendiaminotetraacético (EDTA) (20% (p/v); pH = 7,4) a temperatura ambiente. Elija el volumen dependiendo del tamaño de la muestra: todo el tejido debe estar bien cubierto con EDTA.
- Cambie la solución de descalcificación diariamente, que puede durar hasta 5 días, dependiendo del tamaño del tejido.
- Verifique que la descalcificación sea exitosa con una aguja calibre 20 que penetre en las vértebras sin resistencia notable.
NOTA: El cambio diario de la solución de descalcificación es importante para evitar que el aglutinante de quelato EDTA se sature para mantener la efectividad de la reacción. También previene la colonización bacteriana.
3. Clasificación de la edad, integridad y degeneración de la muestra
- Clasificar el tejido del disco humano en una de las cinco categorías siguientes con la ayuda de información clínica, así como imágenes de rayos X y resonancia magnética18 (Figura 3).
NOTA: Categoría I: Para servir como muestra casi sana, use un anillo sin ningún signo radiológico de degeneración IVD derivada de un trauma espinal agudo.
Categoría II: Para ilustrar una situación de inflamación aguda con degeneración inicial utilizar tejido de la zona intermedia de pacientes con síntomas clínicos con una duración inferior a 4 semanas.
Categoría III: Describir una situación en la que la reacción inflamatoria ya había tenido tiempo de afectar al tejido y las células toman tejido de pacientes que fueron operados para un prolapso nuclear pero con una duración de los síntomas superior a 4 semanas.
Categoría IV: Para la degeneración discal moderada seleccionar el anillo obtenido de la cirugía con fusión intercorporal para la enfermedad degenerativa del disco con una puntuación de Pfirrmann de 3 o 4 en resonancia magnética19.
Categoría V: Para el proceso de degeneración en etapa terminal del anillo obtenido de la cirugía con fusión intercorporal para la enfermedad degenerativa del disco con una puntuación de Pfirrmann de 5. - Clasificar el tejido bovino en función de la etapa de desarrollo/edad del animal en una de las ocho categorías, como se muestra en la Tabla 1.
- Calcule la edad de gestación en la longitud de la grupa de la corona de los embriones basándose en la fórmula sugerida por Keller:
Edad gestacional en meses =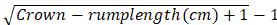
NOTA: Los animales en las primeras 4 semanas de gestación presentan una longitud corona-grupa de 0.8-2.2 cm20.
- Calcule la edad de gestación en la longitud de la grupa de la corona de los embriones basándose en la fórmula sugerida por Keller:
4. Fijación tisular
- Fijar las muestras en 10 veces el volumen de la muestra de solución de formaldehído al 4% (p/v) en solución salina tamponada con fosfato (PBS) durante la noche a 4 °C.
NOTA: La solución de formaldehído penetra en el tejido a una velocidad de aproximadamente 1 mm/hora desde cada dirección. Para muestras muy pequeñas o muy grandes podría ser necesario un ajuste del tiempo de exposición. - Guarde el tejido en PBS a 4 °C hasta su posterior procesamiento.
5. Seccionamiento histológico
- Incruste las muestras en un medio de incrustación soluble en agua en la perilla del criotoma.
- Coloque el tejido en la perilla de tal manera que se genere un plano axial o un plano que corte las láminas de colágeno tipo I perpendiculares (por ejemplo, un plano de seccionamiento sagital mediano).
NOTA: El tejido debe estar completamente cubierto por el medio de incrustación.
- Coloque el tejido en la perilla de tal manera que se genere un plano axial o un plano que corte las láminas de colágeno tipo I perpendiculares (por ejemplo, un plano de seccionamiento sagital mediano).
- Seccionar el tejido incrustado a un espesor de 70 μm en muestras humanas y 40 μm en muestras bovinas utilizando un criotoma estándar.
NOTA: La diferencia en el grosor de la sección se debe a la diferencia en la integridad del tejido entre el disco bovino intacto y el tejido humano altamente degenerado. - Recoge las secciones en un portaobjetos de vidrio.
- Rodear las secciones de tejido con una pluma hidrofóbica.
- Enjuague las secciones 3 veces con solución salina tamponada con fosfato (PBS) para eliminar el medio de incrustación soluble en agua.
6. Tinción por fluorescencia
- Agregue 60 μL del 1% (v/ v) de DAPI (Exmax 358 nm, Emmax 461 nm), así como el 1% (v / v) de tinción de seguimiento de actina (Exmax 540 nm, Emmax 565 nm) en PBS e incube durante 5 min a temperatura ambiente.
NOTA: El protocolo de tinción descrito aquí es visualizar el núcleo usando tinción nuclear DAPI (azul) y el citoplasma usando Actin Tracking Stain (rojo). El IVD tiene una fuerte autofluorescencia debido a las fibras de colágeno en el canal verde. La cantidad de líquido añadido a las secciones de este protocolo está destinada a secciones de un tamaño de aproximadamente 5 mm x 5 mm. Para secciones más grandes, esta cantidad debe aumentarse en consecuencia. Realiza todos los trabajos en habitaciones sin exposición directa a la luz solar y con luces atenuadas para evitar blanquear el tinte. - Retire el líquido de tinción con una pipeta y lave tres veces con 60 μL de PBS cada vez.
- Agregue un medio de montaje adecuado y cubra las secciones con un deslizamiento de cubierta.
NOTA: Asegúrese de que no haya burbujas de aire atrapadas al agregar el resbalón de la cubierta. Esto se hace mejor iniciando el contacto del deslizamiento con la corredera en un borde y luego dejando que el deslizamiento baje lentamente.
7. Imágenes y procesamiento microscópicos
- Coloque una diapositiva con una sección teñida en el soporte de muestra del microscopio.
NOTA: Debido a la densa red de colágeno tipo I del IVD, la luz dispersa hace que el tejido sea difícil de visualizar utilizando la microscopía de fluorescencia convencional. Una forma de abordar este problema es realizar secciones ópticas utilizando iluminación estructurada. Esto también permite realizar una proyección tridimensional de todo el espécimen en ambos canales (azul y rojo). Esto se hace mejor utilizando la configuración de iluminación estructurada y el modo mosaico con una lente de objetivo de aumento de 10x para obtener una visión general de la muestra, así como reconstrucciones 3D de patrones individuales. - Inicie el dispositivo de iluminación estructurada.
- Realice imágenes de un solo campo de visión con un microscopio de fluorescencia adecuado, filtros de fluorescencia e iluminación adecuada.
NOTA: Ajuste el tiempo de exposición de todos los filtros utilizados para estandarizar la adquisición de imágenes. Para obtener una representación precisa de la muestra a una imagen de mayor resolución, las secciones con un aumento más alto (por ejemplo, objetivo 20x). - Postprocesar las imágenes optimizando la intensidad y el brillo utilizando un software de optimización de imágenes compatible con el microscopio de fluorescencia.
- Realice imágenes de un solo campo de visión con un microscopio de fluorescencia adecuado, filtros de fluorescencia e iluminación adecuada.
- Para visualizar la sección como un todo, utilice la técnica de imagen de mosaico
- Abra la configuración de adquisición (presione en 6D- Adquisición)desde el panel de la barra de herramientas.
- Ajuste la configuración del mosaico (en MosaiX Register)y defina el número de columnas y filas de imágenes de campo de visión que luego se fusionarán en una imagen general.
- Pulse Configuración y ajuste la corrección de enfoque de los mosaicos individuales.
NOTA: Es casi imposible que una sección de tejido grande tenga toda la superficie del tejido en un solo plano de enfoque. Los mosaicos de imágenes en diferentes niveles focales se pueden tomar mediante 'MosaiX Acquisition'. - Para iniciar la adquisición de los mosaicos de imagen, presione Inicio.
- Cose los mosaicos fotografiados utilizando la función de costura (botónde costura) con un 20% de superposición incorporada en el software.
- Postprocesar las imágenes optimizando la intensidad y el brillo utilizando un software de optimización de imágenes compatible con el microscopio de fluorescencia.
- Para analizar la organización espacial de los condrocitos, utilice la función 3D incorporada en el software.
- Ajuste la configuración de la pila z. Defina los parámetros de escaneo: defina las posiciones de inicio y parada en el eje z y la distancia de corte activando el botón Start/Stop.
NOTA: El software calcula automáticamente el número de sectores. - Para iniciar la adquisición de las pilas z de imagen, pulse Inicio.
- Postprocesar las imágenes optimizando la intensidad y el brillo utilizando un software de optimización de imágenes compatible con el microscopio de fluorescencia.
- Ajuste la configuración de la pila z. Defina los parámetros de escaneo: defina las posiciones de inicio y parada en el eje z y la distancia de corte activando el botón Start/Stop.
- Exporte las imágenes con un formato de archivo compatible con el software de procesamiento de imágenes.
NOTA: Exporte las reconstrucciones 3D como imágenes individuales y/o como un modelo 3D interactivo o en formato de vídeo.
8. Identificación de patrones celulares y evaluación de la densidad
- Abra las imágenes de mosaico exportadas de toda la sección de tejido en un programa de procesamiento de imágenes apropiado.
- Definir las áreas sometidas a evaluación de densidad celular definiendo regiones de interés de 500 μm x 500 μm en las imágenes.
NOTA: Todos los mosaicos que no tienen una calidad de imagen adecuada se excluyen del análisis. - Identificar patrones celulares individuales.
NOTA: Las celdas individuales se definen como celdas individuales, completamente encapsuladas dentro de la matriz adyacente. Los pares se definen como dos celdas adyacentes en estrecha proximidad (<25 μm) por lo que las células están interconectadas a través de sus matrices (ver Figura 2). Las formaciones de cuerdas son al menos tres condrocitos alineados en línea (desde el centro de los núcleos <25 μm). Estas células están rodeadas por una matriz intacta y se pueden ver interconexiones matriciales entre cada célula. Los clústeres representan múltiples células que se encuentran en proximidad directa entre sí (<25 μm) y están encapsuladas en una gran laguna desprovista de matriz. - Utilice un complemento de recuento de células para el análisis cuantitativo de los patrones celulares.
NOTA: La tinción del citoplasma representa un método de verificación para identificar los diferentes patrones espaciales. - Calcule la densidad celular dividiendo las celdas contadas por el tamaño de la región de interés elegida.
Resultados
Usando imágenes de mosaico, la arquitectura del IVD con su densa red de fibra de colágeno en el anillo y el núcleo más blando se puede reconocer claramente (Figura 4). Se puede observar una disminución continua de la densidad celular durante el desarrollo embrionario (Figura 5). Mientras que en las primeras etapas del desarrollo de la IVD se puede encontrar una densidad celular de 11.435 células/mm² en el anulus fibroso bovino y 17.426 células/mm² en el...
Discusión
Utilizando microscopía de fluorescencia aumentada por imágenes de mosaico y seccionamiento óptico, evaluamos la disposición espacial de los condrocitos en el anillo de la IVD lumbar durante todo el desarrollo, la maduración y la degeneración. Si bien se podía extraer tejido degenerativo de pacientes que recibían cirugía de columna vertebral para la degeneración del disco, el análisis del período embrionario y la fase de maduración requería el uso de un organismo modelo (bovino). Se observaron altas densidad...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a nuestros coautores de las publicaciones originales por su ayuda y apoyo. Agradecemos a Charlotte Emma Bamberger por ayudar a adquirir las imágenes del apotoma.
Materiales
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Referencias
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados