Method Article
使用 1-Cyano-4-二甲基亚胺四氟化物 (CDAP) 激活和结合可溶性聚糖
Erratum Notice
摘要
蛋白质和含胺配体可与氰化试剂、1-氰化物-4-二甲基甲基苯丙胺四氟溴酸酯(CDAP)激活的多糖共价相关,形成共价蛋白(利甘)-多糖结合体。本文描述了在 0 °C 和变 pH 值下执行受控 CDAP 激活以及执行激活多糖后续结合的改进协议。
摘要
结合疫苗是疫苗学的显著进步。对于多糖结合疫苗的制备,多糖可以方便地功能化,并使用1-氰化物-4-二甲基丙胺四氟溴酸酯(CDAP)与疫苗载体蛋白连接,这是一种易于处理的氰化物试剂。CDAP 通过在 pH 7-9 中与碳水化合物羟基组发生反应来激活多糖。CDAP 的稳定性和反应性高度依赖 pH 值。由于CDAP的水解作用,反应的pH值在激活过程中也会降低,这使得良好的pH值控制成为可重复激活的关键。原始 CDAP 激活协议是在室温下以未缓冲的 pH 9 解决方案执行的。
由于在这种情况下(<3分钟)下快速反应,以及伴随快速CDAP水解的快速pH值下降,在短时间内快速调整和维持目标反应pH值是很困难。此处描述的改进协议在 0 °C 下执行,可减慢 CDAP 水解速度,并将激活时间从 3 分钟延长至 ±15 分钟。二甲基亚胺(DMAP)也被用作缓冲,在添加CDAP试剂之前,预先调整多糖溶液到目标激活pH值。反应时间越长,加上 CDAP 水解速度较慢,以及使用 DMAP 缓冲器,使得在整个激活过程的整个持续时间内保持激活 pH 值更加容易。改进的协议使激活过程不那么狂热,更易重复,更易于扩展。
引言
结合疫苗,如那些由多糖共同与载体蛋白共同组成的疫苗,是疫苗学1,2的显著进展之一。多糖作为T细胞独立的抗原,在婴儿中免疫力差,不会诱导记忆、类切换或抗体的亲和力成熟。这些缺点在多糖结合疫苗4中得到克服。由于大多数多糖没有方便的化学处理来结合,因此必须首先对它们进行反应或"激活"。然后,激活的多糖直接与蛋白质(或改性蛋白质)连接,或在结合4之前功能化,以进行额外的分化。大多数获得许可的多糖结合疫苗使用还原性凝结或氰化来激活多糖羟基。氰化物溴化物(CNBr)是一种试剂,以前曾用于激活色谱树脂,最初用于多糖衍生。然而,CNBr 需要高 pH 值(通常为 + pH 10.5 或更高)来部分脱质多糖羟基,以便它们足够嗜核,能够攻击氰化物组。高pH值可能不利于碱性实验室多糖,CNBr和最初形成的活性氰化物在如此高的pH值下都不够稳定。
CDAP (1-氰化物-4-二甲基丙胺四氟化物;图1)由李斯等人介绍,用作氰化剂,用于激活多糖5,6。CDAP 是结晶的,易于处理,被发现以低于 CNBr 的 pH 值激活多糖,并且侧反应更少。与 CNBr 不同,CDAP 激活的多糖可以直接与蛋白质结合,简化合成过程。CDAP 激活的多糖可以使用二胺(例如六烷二胺)或二氢酰胺(例如,二氢化二胺、ADH)功能化,以制造氨基或氢化物衍生的多糖。同位素高浓度用于抑制多糖的交联。然后,氨基多糖可以使用用于蛋白质结合的无数技术进行结合。海德拉齐德衍生的多糖通常与使用碳水化合物试剂(例如,1-乙基-3-(3-二甲基丙基)碳水化合物酰胺(EDAC)7的蛋白质耦合。Lees 等人8描述了 CDAP 多糖激活的进一步优化,并已纳入此处描述的协议中。
CDAP 结合概述
CDAP 协议可概念化为两个阶段:(1) 多糖的激活和 (2) 活化多糖与蛋白质或配体的结合(图 2)。第一步的目标是高效激活多糖,而第二步的目标是有效地与激活的多糖结合。激活的多糖将两个步骤连在一起。这种概念化有助于专注于每个步骤的关键要素。 图2 扩展了这一概念化,显示了所需的激活和耦合反应,以及水解反应和侧反应。
在激活阶段,三个主要问题是CDAP稳定性、CDAP与多糖羟基的反应以及活性多糖的稳定性(图3)。CDAP 水解随 pH 值增加,活化多糖的水解和侧反应也随之增加。但是,通过增加 pH 值,可促进多糖的 CDAP 反应。使用 CDAP 高效激活多糖需要在 1) 多糖和 CDAP 的反应和 2) 试剂和激活的多糖的水解和侧反应之间取得平衡。
在 Lees 等人描述的原始 CDAP 激活协议中,多糖的 CDAP 激活是在室温下在未缓冲的 pH 9 溶液中进行的。在这种情况下,激活速度很快,激活将在 3 分钟内完成。反应的同时,CDAP也迅速水解,导致未缓冲反应溶液的快速pH值下降。在如此短的时间内快速提高并保持目标值的反应 pH 值是很具有挑战性的。在描述的协议中,激活是通过将 CDAP 从 100 毫克/mL 库存溶液添加到未缓冲的多糖溶液中来执行的。30年代后,pH值被提升为"等量的0.2M三聚氰胺"。然后在激活反应中加入2.5分钟后结合的蛋白质。值得注意的是,激活步骤的 pH 值没有得到很好的控制,并且很可能最初超过了目标 pH 值。需要快速 pH 调整的快速反应使激活过程难以控制,难以扩大规模。
与原始协议相比,此处描述的修改协议有两个主要改进。首先,在添加 CDAP 之前,多糖溶液的 pH 值经过预先调整,以达到目标激活 pH 值,使用 DMAP 作为缓冲。DMAP 的 pKa 为 9.5,因此在 pH 9 周围具有良好的缓冲功率,与许多其他缓冲器不同,DMAP 没有发现可以促进 CDAP 水解8。此外,DMAP 已经是一个中间过程,因此不会在反应混合物中添加新的组件。在添加 CDAP 之前对 pH 进行预先调整,消除反应开始时的大 pH 摆动,并允许在反应期间更有效地维护目标 pH 值。第二个改进是在 0 °C 下执行激活反应,CDAP 水解率明显低于室温下。试剂半衰期较长,温度为 0 °C,激活时间从 3 分钟增加到 15 分钟,以补偿低温下的激活速度较慢。反应时间越长,维护反应pH值就越容易。使用 0 °C 还可以减缓 pH 敏感多糖的降解,从而有可能制备此类多糖的结合体。协议的改进使激活过程不那么狂热,更容易控制,更易于重复,更易于扩展。
本文介绍了在 0 °C 和指定目标 pH 值下对多糖进行受控 CDAP 激活以及随后使用 ADH 对激活的多糖进行衍生的改进协议。还描述了一种三硝基苯硫酸(TNBS)检测,基于齐等人的方法,用于确定改性多糖上的水合物水平。还描述了基于氧化醇和硫酸10的六氧化硫的改性检测,可用于确定更广泛的多糖。有关CDAP激活和结合的更多信息,读者被李斯等人提及早期出版物5、6、8。
研究方案
注:在执行多糖激活和功能化程序之前,提前准备多糖溶液、ADH 溶液、DMAP 溶液和 CDAP 库存溶液。将解决方案和设备放置在一个有序、方便和合乎逻辑的位置。描述的反应是10毫克多糖,可以向上或向下放大。建议在扩大规模之前对协议进行小规模评估。
1. 准备 5 毫克/mL 多糖溶液,2 mL。
- 用于冻血多糖
- 打开前让多糖容器达到室温。使用分析平衡,在螺丝帽管内称量出 10 毫克多糖。使用静态消除器,以便更轻松地取样和更准确地称重粉末。
- 在管中加入 2 mL 0.15 M 氯化钠 (NaCl) 以溶解多糖。盖和旋涡管。
注:氯化钠不影响CDAP反应,但可能影响多糖二次结构。一些多糖在不同的盐浓度下更易溶于溶性。 - 根据多糖分子量,通过端端旋转将管子混合 12-24 小时,使多糖充分水合。如有必要,轻轻加热管子,促进溶化。
- 用于缓冲溶液中的溶解性多糖
注意:对于高效的 CDAP 激活,多糖溶液不应包含任何缓冲,尤其是磷酸盐离子。遵循以下程序,用水或盐水溶液替换缓冲器,并将多糖浓度调整为 5 毫克/毫升。- 获得适当的分子重量截止 (MWCO) 的 4 mL 或 15 mL 离心旋转滤波器件。
注:MWCO的理想小于多糖分子量的5-10倍。 - 在滤芯插入中加入含有 ±20 毫克多糖的缓冲多糖溶液体积。用水或盐水溶液填充满标记。将过滤器盖紧。按端结束混合几次。
- 以制造商建议的离心力离心器件离心。确保离心时间足够长,每次旋转后至少可减少 5 倍体积。丢弃流过。重新组装过滤器件。
- 用淡水或盐水溶液将过滤器插入到完整标记。将过滤器盖紧。通过端端旋转 +10 或通过柔和的漩涡混合过滤器中的内容;重复旋转。
注:聚糖可以积聚在离心装置滤芯插入的底部,形成凝胶。建议在下次旋转之前将过滤器插入内的视网膜与新鲜重新填充重新混合。 - 重复补充和旋转周期至少 3 次。
- 按照下面的练习从过滤器插入中恢复多糖阻滞剂。
- 将淡水或盐水添加到过滤器插入,使体积为 ±1 mL。通过上下管道或温和的漩涡混合。
- 将所有混合延缓剂转移到 5 mL 管中。在过滤器插入中加入 1 mL 的淡水或盐水。通过上下管道或温和的涡流冲洗过滤器。转移和结合所有的冲洗与回收的多糖。
- 确定多糖浓度(参见第 7.3 节中的多糖检测)。将多糖与额外的水或盐水稀释至5毫克/毫升。
- 获得适当的分子重量截止 (MWCO) 的 4 mL 或 15 mL 离心旋转滤波器件。
- 准备多糖溶液时,将含有多糖溶液的管子冷却在冰桶中。
2. 准备 0.5 M 二氢化酸 (ADH) 溶液,10 mL。
- 在分析平衡中称重 0.87 g ADH,在 0.1 M HEPES(4-(2-羟基乙基)-1-管道酸乙烷硫化酸)的 8 mL 中溶解,pH 8。
- 调整到目标pH值与1M氢氧化钠(NaOH),由pH表监测。带上额外的缓冲器至 10 mL,并重新确认 pH 值。
3. 准备 2.5 M DMAP 解决方案,10 mL。
注:DMAP 是有毒的,会穿透皮肤。执行手术时戴上亚硝酸盐手套。
- 小心地将 3 克 DMAP 重成 50 mL 圆锥形管。将 5 毫升水添加到 DMAP 中,通过涡流混合 5 分钟,获得多云溶液 (+ 7 mL)。
- 混合时,在 DMAP 溶液中加入 50 微升增量 10 N 盐酸 (HCl)。在每个添加之间混合。当解决方案变得清晰时,停止添加。
- 在 25 μL 增量中添加 10 N NaOH,将 DMAP 解决方案带到 +pH 8。
- 将 DMAP 溶液带至 10 mL 带水,以提供 2.5 M 解决方案。
- 微调 2.5 M DMAP 解决方案的 pH 值。
注:DMAP 解决方案 pH 值随浓度和离子强度而变化。此练习是将 2.5 M DMAP 库存微调到特定 pH 值,以便当该库存与 10 卷多糖混合时,产生的溶液接近目标 pH 以激活。- 准备一系列 1.5 mL 管,其中含有 1 mL 的水或 NaCl 溶液,以准备多糖溶液为准。冰上把管子冷却。
- 将 100 μL 的 DMAP 添加到冰镇管中。漩涡,用pH表测量pH值。然后,丢弃测量的管子。
- 如果测量的 pH 值未接近目标值,则根据需要调整 DMAP 库存的 pH 值,调整为 1 M NaOH 或 HCl。重复步骤 3.5.2 和 3.5.3,直到测量的 pH 值接近目标 pH 值。
4. 准备 100 毫克/mL CDAP 库存解决方案
注意:CDAP 粉末应保持紧密封闭,储存在 -20 °C 下,并允许在打开前达到室温。执行手术时戴上亚硝酸盐手套。
- 在分析平衡上使用 1.5 mL 的扣盖微中心管。使用一个小铲子,将10-140毫克的CDAP放入管中。注意 CDAP 的实际重量。
- 确定准备 100 毫克/mL CDAP 所需的丙酮三醇体积。在烟气罩中打开丙酮三叶。
- 使用适当的体积管道,绘制和释放丙酮三叶草,使其在管道尖端的蒸汽平衡。等待溶剂在几秒钟后从管道尖端滴出,并准备将其直接转移到 CDAP 管。绘制丙酮三叶素的计算体积,并直接将其转移到 CDAP 管中。关闭盖。
注:丙酮三叶液也可以使用汉密尔顿注射器或其相当于合适的尺寸转移到CDAP管。 - 漩涡完全溶化 CDAP。将 CDAP 管放入冰桶中。
注意:CDAP 在寒冷的丙酮三叶液中是稳定的。可溶性股票可能保持在 -20 °C > 1 周。但是,最好准备新的 CDAP 解决方案。
5. 聚糖活化和水合物功能化
- 在开始激活之前,请确保所有以下项目都准备好,并在冰上冷却溶液:2 mL 的 5 毫克/mL 多糖溶液放在平底宽嘴容器中,内含搅拌棒,放置在磁搅拌器顶部:100毫克/mL CDAP库存溶液;2.5 M DMAP 库存解决方案;带有半微型 pH 探头(如直径为 6 mm 的探头)的 pH 仪表,根据制造商的说明校准为 0 °C;100 微升管道,随时可以使用;清除并准备使用的时器;定位的自动提款机分配器头或 10 μL 管道准备使用;0.5 M ADH 解决方案。
- 使用 DMAP 将多糖的 pH 值预调整为目标 pH 值。
- 将 pH 探头放入多糖溶液中,并在整个激活过程中将其留在溶液中。
- 将 200 μL 的 DMAP 库存溶液转移到多糖溶液中,在搅拌下滴入添加。将解决方案的 pH 值调整到目标激活 pH 值。添加 0.1 M HCl 以降低 pH 值和 0.1 M NaOH 以增加 pH 值。避免超过目标pH值超过0.1 pH单位,并在激活期间保持反应在冰水浴中冷却。
- CDAP 激活
- 管道 100 μL CDAP 上下平衡管道尖端的蒸汽。将 100 μL CDAP 转移到搅拌的多糖溶液中。
注:此激活使用 1 毫克 CDAP 为 1 毫克多糖作为起始比率。优化激活时,可以增加或减少该比率。 - 启动定时器并在整个激活过程中监控 pH 值变化。在自动分拆器(或管道)的帮助下,通过及时添加 10 μL 增量 0.1 M NaOH 来保持目标 pH 值的反应。
注:它可能有助于减少pH响应时间,轻轻搅拌与pH探头。pH 值在开始时下降更快,可能需要更频繁地添加 0.1 M NaOH。随着反应的进行,pH 值的降低变慢,添加频率降低。在接近最佳激活时间时,pH 值应基本保持不变,即 pH 9 激活时间为 10-15 分钟。
- 管道 100 μL CDAP 上下平衡管道尖端的蒸汽。将 100 μL CDAP 转移到搅拌的多糖溶液中。
- ADH 功能化
- 达到最佳激活时间后,在搅拌下将 0.5 M ADH 的 2 mL 全部添加到激活的多糖中。检查 pH 值是否在目标范围内(ADH 的 pH 8-9)。
注:快速混合的一个添加物最大限度地降低了二甲酰胺两端与激活的多糖发生反应的概率,防止多糖交叉链接。 - 继续搅拌反应混合物至少1小时。将反应混合物转移到 4 °C,但 0-20 °C 是可以接受的。
注意:ADH 功能化反应并不强烈地依赖于温度。由于二甲酰胺的大量过量作为淬火试剂,因此没有必要进一步淬火活化多糖。然而,当直接结合蛋白质时,反应应被淬火,通常与1M甘氨酸,pH 8-9。
- 达到最佳激活时间后,在搅拌下将 0.5 M ADH 的 2 mL 全部添加到激活的多糖中。检查 pH 值是否在目标范围内(ADH 的 pH 8-9)。
6. 通过透析净化ADH功能化多糖
注:ADH功能化反应产生的粗制滥发产品含有高浓度的ADH(0.5 M),可以通过广泛透析最有效地去除。带柱子或自旋脱盐装置的凝胶过滤效率不高,尤其是当需要去除残留的 ADH 污染物时。
- 确定透析膜的 MWCO。使用 3 kDa 截止时间用于较小的多糖。
注:透析膜的MWCO理想比多糖MW小5-10倍。 - 选择所需的透析格式(盒式磁带或管子)和正确的设备容量。确保设备容量是样品体积的 2 倍。请咨询制造商使用设备的说明。
- 使用前将透析膜水合在水中。根据制造商的说明,将粗衍生多糖溶液转移到透析设备上。
注意:戴上亚硝酸盐手套,避免与 DMAP 接触。 - 在装满 2-4 L 的 1 M NaCl 和搅拌棒的容器中进行透析。将容器放在冷室或冰箱内的搅拌盘上。透析期间轻轻地连续搅拌透析。
- 透析至少 4 小时后,换上新鲜的 1 M NaCl,并至少进行 12 小时的透析。对 0.15 M 盐水的 2 个变化进行透析,每个变化至少 12 小时。如果需要,对2次水的变化进行透析。
- 使用快速 TNBS 测试测试隔夜透析,验证是否删除了所有 ADH。
- 获得3个玻色硅酸盐管,分别将其标记为负控制(ctrl)、阳性 ctrl 和样品。
- 在负 ctrl 管中,添加 975 μL 的 0.1 M 玻色子,pH 9。
- 在正 ctrl 管中,添加 100 μL 的 0.05 mM ADH (0.1 m hydrazide) 和 875 μL 的 0.1 M 玻酸盐,pH 9。
- 在样品管中,加入 500 μL 的隔夜透析剂和 475 μL 的 0.1 M 玻酸盐,pH 9。
- 在所有三个管中加入 25 μL 的 1% TNBS。混合好。在黑暗中放置1小时。
- 在 1 小时内比较 3 管的颜色强度。确保样本管颜色强度在正 ctrl 和负 ctrl 之间,这表明 ADH 污染物降至 0.01 mM 或以下。再放一次。
注意:尽可能降低ADH污染物水平,使ADH水合物占纯化水合物-多糖总水合物的不到1%,这是谨慎的。 - 从透析中恢复衍生的多糖。确定多糖和水合物的浓度。计算水合物/多糖比率(见第 7 节)。如果透析多糖必须浓缩到 5-10 毫克/毫升,请咨询第 1.2 节。
7. 水合物衍生多糖分析
注:此处描述的分析的目的是根据水合物/多糖比率确定多糖浓度、水合物浓度和水合物衍生化水平。
- 样品制备
注:要检测的多糖需要不含低分子量碳水化合物、胺或氢化物杂质。嗜血样品应干燥且无盐,以确保准确的重量测量。通常,1-2 毫克/mL 溶液的 +1 mL 足以进行检测。- 使用非静态铲子或静态除虫剂,在分析平衡上称重至少 10 毫克的冻血多糖样品。将水中或盐水中的多糖溶解到浓度(例如,2 毫克/毫升),使检测信号位于标准曲线的线性范围内。
- 混合端过端,并留出足够的时间让样品完全溶解。根据多糖分子量进行隔夜水化。
- 聚糖检测:再糖醇/硫酸方法
注:多糖的适当检测将取决于聚合物的碳水化合物成分。最初的再醇/硫酸检测用于六氧化硫糖10.通过将加热步骤的温度从 90 °C 提高到 140 °C,对检测进行了修改。 在这个更高的温度下,检测会失去一些特异性,但可用于检测许多糖分。但是,仍有必要确定检测是否适合特定的多糖。建议每个点使用三重设施,但由于加热块的容量,可能需要一些住宿。- 准备 75% 硫酸
注:浓缩硫酸具有极强的腐蚀性,可引起严重烧伤。在化学烟气罩中执行此程序。总是把浓缩酸倒入水中, 而不是相反!- 在 200 毫升玻璃瓶中加入 50 毫升的水。将瓶子放在冷水浴池中。慢慢加入150mL硫酸。盖上瓶子,让它发泄。
- 允许溶液与室温平衡。在 3 个月内使用解决方案。
- 准备碳水化合物标准
- 以 1 毫克/mL 的速度准备未修改的多糖溶液,作为标准使用。或者,使用多糖重复单位中单个糖的混合物,作为标准,总糖浓度为 1 毫克/毫升。
注:虽然糖的混合物通常会给出与相同糖成分的碳水化合物聚合物相同的结果,但这应该通过实验来证实。
- 以 1 毫克/mL 的速度准备未修改的多糖溶液,作为标准使用。或者,使用多糖重复单位中单个糖的混合物,作为标准,总糖浓度为 1 毫克/毫升。
- 确保 13 x 100 玻色硅酸盐试管带管支架的加热块正常工作。在发生酸泄漏时,使用加热块下面和周围的保护垫。将加热块预热至 140 °C,最小 1 小时,通过所有使用的方块实现稳定、均匀的温度。
- 标签 13 x 100 玻色硅酸盐试管,每个标准和每个样品的三重。将 1 毫克/兆升碳水化合物标准的 0、2.5、5、7.5、10 μg(或 μL)添加到相应标记的标准管中。向每个管子添加水,使体积达到 100 μL。
注:产生的颜色取决于特定的糖。由于某些糖需要更多的质量来生成完整的吸积范围,用于标准曲线的实际量可能会有所不同。 - 通过在三个样品管中添加含有 ±5 μg 的衍生多糖体积,并让总体积达到 100 微克水,从而设置样本检测。或者,如果样品中的多糖浓度未知,则进行一系列 4 倍稀释。在三重酸盐中测试每次稀释的 100 μL。
- 使用前立即在去离子 (dI) 水中以 6 毫克/毫升的速度准备新鲜的再醇。漩涡,直到溶解再溶质醇。在每个管中加入 100 微升 6 毫克/mL 再醇。
- 小心地将估计的 75% 硫酸倒入小烧杯中。
注意:穿实验室外套、亚硝酸盐手套和安全眼镜。小心滴水、溢出和溅落。保持湿纸巾方便擦拭任何滴水。当硫酸的活动在长时间暴露于空气时发生变化时,在整个检测中使用硫酸的均匀混合物。 - 使用重复管道,在每个管子中均匀地添加 300 μL 的 75% 硫酸。将管子大力旋入混合,在漩涡时将管子指向外。按顺序将管子以稳定的速度放置在加热器块中。一旦所有的管子都进来了,立即将定时器设置为3分钟。
- 3分钟后,以相同的顺序以稳定的速度取出管子,并直接放在冰水浴的架子上。离开管子,直到它们结冰。取出管子,使其平衡到室温+5分钟,以防止在阅读过程中凝结在库维特。
- 设置 UV/VIS 光谱仪,使用 10 mm 路径长的 cuvette 将吸气量读取到 430 nm。空白与零标准管。在 430 nm 下阅读所有管子的吸收度。
注:一次性塑料小饰物使用方便。 - 通过绘制碳水化合物标准与 A430的 μg 来构建标准曲线。使用葡萄糖作为参考标准,请参阅 图 4 的典型标准曲线。
- 使用 A430 值位于标准曲线线性范围内的样本检测管,从标准曲线方程计算样本检测管中未知多糖的 μg 量。确定未知多糖的浓度,从未知添加的体积,占稀释。根据需要将浓度转换为 mg/mL 或 μM 重复装置。
- 准备 75% 硫酸
- 使用三硝基苯硫酸 (TNBS) 进行海德拉齐德检测
- 准备 0.9% NaCl 含有 0.02% 钠阿齐德 (样本缓冲) 溶解 9 克 NaCl 和 200 毫克钠阿齐德在 dI H2O 到最终体积 1 L.
- 准备 0.1 M 钠玻酸盐,pH 9(检测缓冲器),通过混合 100 mL 的 0.5 M 钠玻酸盐,pH 9,与 400 mL 的 dI H2O. 确认解决方案 pH 值为 9 ± 0.1:如有必要,进行调整。
- 准备 1% TNBS 稀释 200 μL 的 5% 2,4,6-三硝基苯硫酸溶液到 1 mL 与 dI H2O. 标记管作为 1% TNBS 和存储在 4 °C 在黑暗中一个星期。
- 准备 50 mM ADH 库存(相当于 100 mM 水合物)。
- 使用分析平衡,称量出 871 毫克二乙酰胺 (ADH) 粉末。通过在顶部装载机平衡的帮助下将样品缓冲器添加到 100 mL,将粉末溶解在试剂瓶中。
- 将瓶子标记为 100 mM 水合物/50 mM ADH。紧紧盖住瓶子,在 4 °C 下存放 1 年。
- 准备水合物标准(0.1、0.2、0.3、0.4、0.5 和 0.6 m 水合物)。
- 使用顶部装载机平衡,用样品缓冲稀释 100 mM 水合物库存,从而准备 6 个水合物标准。准备每个标准的 100 mL,以最大限度地减少浓度错误。紧紧关闭瓶子,在 4 °C 下存放 1 年。
- 设置检测反应
注:TNBS 检测以 1 mL 的反应音量运行。每个检测管由 100 μL 的样品(或标准)、875 μL 的检测缓冲器和 25 μL 的 1% TNBS 解决方案组成。所有检测反应(用于样品和标准)均以三重酸盐设置。- 每个标准(包括零标准)标记 3 个硅酸盐玻璃管(12 x 75 毫米)。按增加浓度的顺序对管架中的标准管进行排序和排列。使用校准的 100 μL 或 200 μL 微管,将 100 μL 的标准准确添加到每个相应的管子中。对于零标准,请使用 100 μL 的示例缓冲器。
- 标记 3 个硅酸盐玻璃管(12 x 75 mm),用于检测每个稀释样品。相应地对管架中的样品管进行排序和排列。使用校准的 100 μL 或 200 μL 微管将样品的 100 μL 准确添加到每个相应的样品管中。
- 使用校准的 1000 μL 微管,在所有检测管中准确添加 875 μL 的检测缓冲器:标准和样品。
- 要启动检测反应,请使用校准的 100 μL 微管准确添加 25 μL 的 1% TNBS 到每个检测管。从零标准管开始,按增加浓度的顺序移动到标准管,然后按照预先确定的顺序移动到样品管。启动新标准或新样品时更改提示,并将在所有管子中添加 TNBS 所花费的时间保持在 5 分钟以内。
- Vortex 所有测定管在高速或速度设置下为 2 s,允许检测管内的液体向上旋转,从管打开处达到 1/2 英寸的高度。
- 记录测定开始时间,并将定时器设置为 2 小时。在室温下将检测管架放在黑暗中 2 小时。时间结束后,再对所有管子进行涡流,然后开始数据收集。
- 数据采集
- 让紫外线/VIS光谱仪预热,使基线稳定下来。将检测波长设置为 500 nm,用于水合物检测。在整个检测中,使用 1 mL 石英 1 厘米路径长的夸夸其测定进行所有吸水测量。
- 通过将零标准检测传输到 cuvette 来开始数据收集;将仪器空白(将吸纳度设置为零)。
- 在每个管子上执行单个读数,并在数据表中记录吸收值。在阅读新样品之前,从幼虫中取出任何残留液体。从零标准开始,转向增加浓度的标准,然后转向样品。一旦开始,高效执行所有步骤,无需停止并在 10 分钟内读取所有管子。
- 分析样本数据
- 通过绘制 mM 水合物标准与 A500创建标准曲线。以y = x= b 的形式查找标准曲线方程,其中 y表示 mM 水合物,x表示 A500。有关典型的标准曲线,请参阅图 4。
- 使用标准曲线方程计算样品中的 mM 水合物,根据稀释因子进行调整。仅选择 A500 值在标准曲线线性范围内的样本检测管进行计算。
- 使用方程计算水合物/多糖的摩尔比(1)。
海德拉齐德/多糖 = h / c ×兆瓦(1)
h 是 mM 水合物,c是多糖的毫克/mL 浓度,MW是 kDa 中的多糖分子量。 - 使用方程(2)计算每100千达多糖的海合物标签密度。
标签密度每 100 kDa 多糖 = h / c × 100 (2)
h是 mM 水合物,c是多糖的毫克/mL 浓度。
注:为了方便起见,多糖的分子量可视为10万道尔顿。这允许人们在比较各种多糖的衍生化水平时考虑"标签密度"。 - 将水合物标记密度计算为体重百分比 ADH。
- 使用方程(3)确定 ADH 的有效毫克/mL 浓度。
毫克/mL ADH = (mM 水合物 / 1000) × 174(3)
其中 174 是 Adh 的 Mw 。 - 使用方程计算重量百分比 ADH(4)。
重量 % ADH = (mg/mL ADH) / (mg/mL 多糖) × 100(4)
- 使用方程(3)确定 ADH 的有效毫克/mL 浓度。
结果
为了说明使用CDAP化学激活和衍生多糖,德克斯特兰被激活在0.25和0.5毫克CDAP/mg德克斯特拉。对于每个反应,在冰上冷却水中的 10 毫克/mL dextran 溶液,并添加 2.5 M DMAP 库存的 1/10 体积(如第 3 节所述)。最终解决方案通过在 10 μL 阿利库特中添加 0.1 M NaOH 而达到 pH 9。CDAP补充说,解决方案被冷却和搅拌,pH值维持在pH 9,在15分钟内添加10微升0.1 M NaOH的alquot。在pH 9时只增加了0.25 mL的0.5 M ADH(低于通常的量),并且允许在4°C下过夜的反应。
然后,标记的 dextran 按顺序对 1 M NaCl、0.15 M NaCl 和第 6 节中描述的水进行透析。然后,使用再氧醇/硫酸检测(第7.2节)对ADH-dextran进行测定。以葡萄糖为糖标准的典型标准曲线见 图4A。水合物含量是使用第7.3节中描述的TNBS测定确定的。图 4B中给出了以ADH为标准的典型水合物标准曲线。
图4A、B显示在两个激活层激活德克斯特兰的代表性计算。数据被呈现为每100 kDa的德克斯特拉聚合物的海合物和作为ADH到德克斯特拉的重量百分比,分别在图4C第7.9.3.4节和7.9.3.5节中描述。随着CDAP比率的加倍,衍生化程度大约翻了一番。
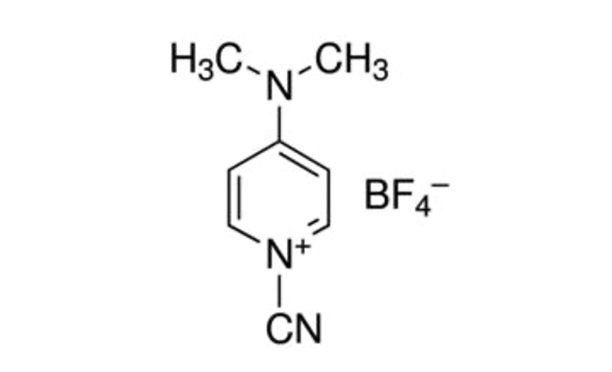
图1:CDAP的化学结构。CDAP = 1-氰化物-4-二甲基丙胺四氟化物。 请单击此处查看此图的较大版本。
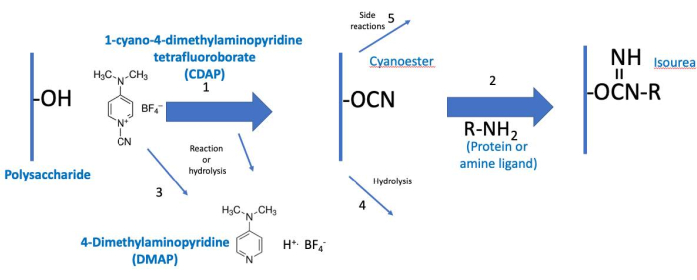
图2:CDAP激活和结合的过程。 这个过程在概念上分为两个阶段,激活的多糖是两者共同的。在基本条件下,CDAP 激活多糖羟基,释放 DMAP(反应 1)。CDAP 水解还释放 DMAP(反应 3)。虽然显示青亚诺酯,这可能不是实际的中间体。因此,中间体被称为(CDAP)"激活"多糖。在第一个激活阶段,激活的多糖可以水解(反应4)或发生侧反应(反应5)。在第二个结合阶段(反应2),激活的多糖与胺发生反应,形成稳定的等素键,除了反应4和5。缩写: CDAP = 1-氰化物-4-二甲基丙胺四氟化物;DMAP = 4-二甲基亚胺:R -NH2 = 胺。 请单击此处查看此图的较大版本。
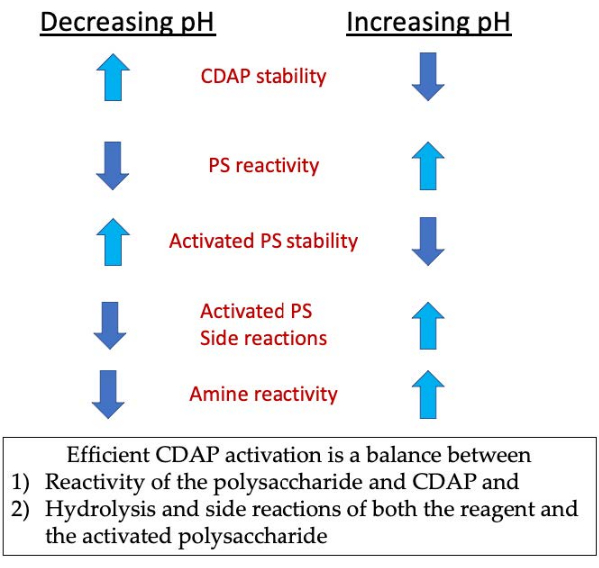
图3: CDAP激活和结合。 这个过程需要平衡CDAP反应与多糖,CDAP和活性多糖的稳定性,以及活性多糖与胺的反应。 请单击此处查看此图的较大版本。
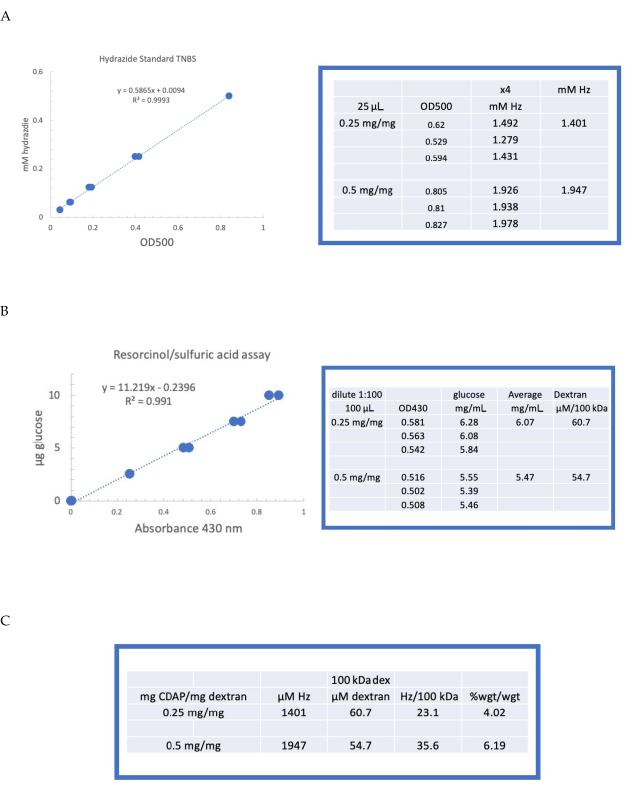
图4: 德克斯特拉因CDAP激活的代表结果。(A ) 氧化醇/硫酸和(B) TNBS 检测的典型标准曲线。显示用 0.25 和 0.5 毫克 CDAP/mg dextran 激活的德克斯特兰检测结果。葡萄糖被用作再溶胶检测的标准。德克斯特兰,在毫克/mL,被除以100千达给摩尔浓度。水合物浓度是使用ADH作为标准确定的,结果表示为2M Hz.(C)水合物计算:德克斯特兰比率。推导化水平计算为每100千达的德克斯特拉水合物,以促进不同平均分子量的聚合物之间的比较。g ADH/g dextran 的百分比是使用 174 克/摩尔的 MW 计算的。请单击此处查看此图的较大版本。
讨论
CDAP 是一种方便的试剂,可衍生和结合多糖。本文描述了使用CDAP用水合物(PS-ADH)衍生多糖的一般方法,并结合了最近发表的改进8。首先,该技术强调保持目标pH值以控制激活过程的重要性。我们发现,虽然许多常见的缓冲器干扰CDAP激活反应,DMAP可以成功地用作缓冲管理pH8。此外,DMAP 已经是 CDAP 激活的副产品。最后,在添加 CDAP 之前,用 DMAP 缓冲多糖溶液有助于精确定位和维护反应 pH 值。正如我们描述的那样,调整集中的 DMAP 库存解决方案的 pH 值是有用的,这样当稀释时,它就会达到目标 pH 值。其次,在寒冷中执行过程减慢了反应时间,使激活过程不那么狂热和宽容。较低的温度降低了 CDAP 水解率,pH 9 的最佳激活时间从 +3 分钟增加到 ±15 分钟。此外,与在室温下执行时相比,实现相同激活水平所需的 CDAP 更少。
ADH衍生的多糖可以与使用碳水化合物(例如EDAC)7的蛋白质结合。例如,几种获得许可 的流感嗜血杆菌 b (Hib) 疫苗使用与 ADH 衍生的多脂乙酰磷酸盐 (PRP) 使用 EDAC 与破伤风毒素结合。CNBr 最初被雇用,但 CDAP 是一种更容易用于此目的的试剂。根据我们的经验,ADH 衍生化的良好目标范围是每 100 kDa 多糖 10-30 水合物或按重量分乘 +1-3% ADH。
同样的过程可以用来用原胺代替ADH来提取多糖与原胺。建议使用六烷二胺将多糖与胺8一起提取。聚糖(PS-NH2)可以使用为蛋白质结合11开发的试剂进行结合。通常,PS-NH2 是用雄胺(例如,磺胺 4-[N-雄性甲基甲基] 环氧烷-1-碳基酸盐 (SMCC) 或 N-γ-马莱米多-氧西尼酰胺酯 (GMBS) 来衍生的,蛋白质是硫化的(例如, 与苏奇尼米尔 3 - (2 - 皮里迪尔迪西奥) 丙酸酯 (SPDP)。硫磺胺化学是非常有效的。
蛋白质也可以通过莱辛酸上的亚胺直接与CDAP激活的多糖耦合。虽然使用的激活协议通常与此处描述的方案相似,但有必要优化活化水平、多糖和蛋白质浓度,以及蛋白质:多糖比 5、6、8。
Dextran 是最容易用 CDAP 激活的多糖之一,因为它的羟基组密度相对较高,但一些多糖,如维抗原,可能具有挑战性。因此,没有单一的"最佳"协议,CDAP直接结合蛋白质。我们建议首先制定一个协议,以达到适当的激活水平,由水合物衍生化程度决定,然后着手将蛋白质结合直接引向CDAP激活的多糖。
披露声明
安德鲁·李斯是菲娜生物解决方案的创始人和所有者。他拥有多项与CDAP化学相关的专利,并受益于化学和CDAP结合知识的许可。
致谢
这里描述的工作是由菲娜生物解决方案有限责任公司资助的。
材料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
参考文献
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
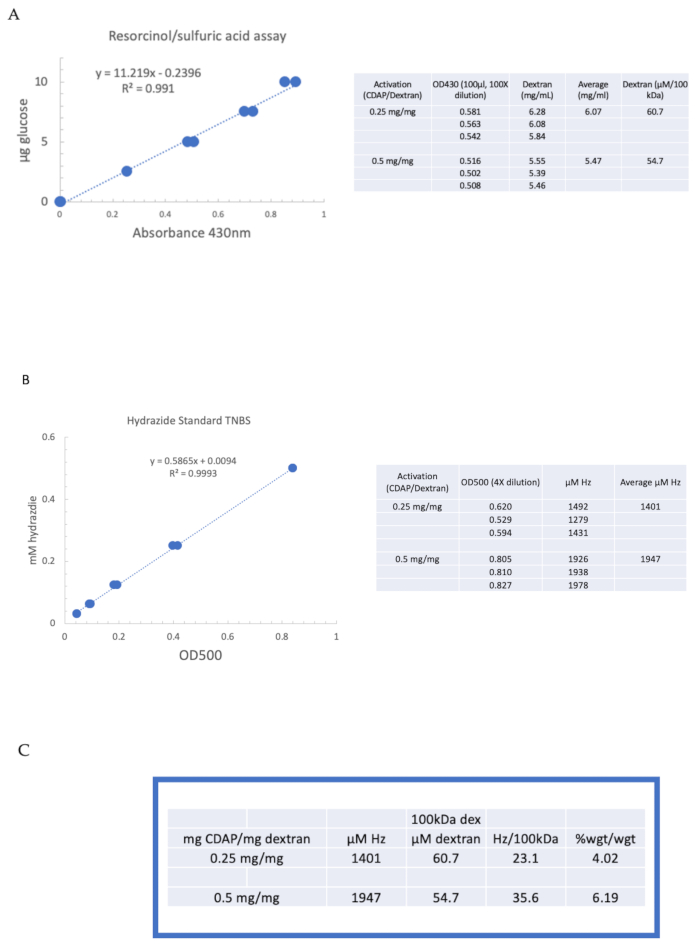
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。