Method Article
Activation et conjugaison de polysaccharides solubles à l’aide de tétrafluoroborate de 1-cyano-4-diméthylaminopyridine (CDAP)
Dans cet article
Erratum Notice
Résumé
Les protéines et les ligands contenant des amines peuvent être liés de manière covalente aux polysaccharides activés par le réactif de cyanylation, le tétrafluoroborate de 1-cyano-4-diméthylaminopyridine (CDAP), pour former des conjugués protéine covalente (ligand)-polysaccharide. Cet article décrit un protocole amélioré pour effectuer une activation contrôlée du CDAP à 0 °C et faire varier le pH et effectuer une conjugaison ultérieure des polysaccharides activés.
Résumé
Les vaccins conjugués sont des avancées remarquables en vaccinologie. Pour la préparation de vaccins conjugués polysaccharidiques, les polysaccharides peuvent être facilement fonctionnalisés et liés aux protéines porteuses du vaccin à l’aide du tétrafluoroborate de 1-cyano-4-diméthylaminopyridine (CDAP), un réactif cyanylant facile à manipuler. CdAP active les polysaccharides en réagissant avec les groupes hydroxyles glucidiques à pH 7-9. La stabilité et la réactivité du CDAP dépendent fortement du pH. Le pH de la réaction diminue également lors de l’activation en raison de l’hydrolyse du CDAP, ce qui fait du bon contrôle du pH la clé d’une activation reproductible. Le protocole d’activation CDAP original a été réalisé à température ambiante dans des solutions de pH 9 sans tampon.
En raison de la réaction rapide dans ces conditions (<3 min) et de la chute rapide du pH qui l’accompagne en raison de l’hydrolyse rapide du CDAP, il était difficile d’ajuster et de maintenir rapidement le pH de la réaction cible dans un court laps de temps. Le protocole amélioré décrit ici est effectué à 0 °C, ce qui ralentit l’hydrolyse CDAP et prolonge le temps d’activation de 3 min à ~15 min. La diméthylaminopyridine (DMAP) a également été utilisée comme tampon pour pré-ajuster la solution de polysaccharide au pH d’activation cible avant d’ajouter le réactif CDAP. Le temps de réaction plus long, associé à l’hydrolyse CDAP plus lente et à l’utilisation d’un tampon DMAP, facilite le maintien du pH d’activation pendant toute la durée du processus d’activation. Le protocole amélioré rend le processus d’activation moins frénétique, plus reproductible et plus facile à mettre à l’échelle.
Introduction
Les vaccins conjugués, tels que ceux constitués de polysaccharides liés de manière covalente à une protéine porteuse, font partie des avancées remarquables en vaccinologie1,2. Les polysaccharides, en tant qu’antigènes indépendants des lymphocytes T, sont peu immunogènes chez les nourrissons et n’induisent pas la mémoire, le changement de classe ou la maturation d’affinité des anticorps3. Ces lacunes sont surmontées dans les vaccins conjugués polysaccharidiques4. Comme la plupart des polysaccharides n’ont pas de poignée chimique pratique pour la conjugaison, ils doivent d’abord être rendus réactifs ou « activés ». Le polysaccharide activé est alors soit directement lié à la protéine (ou protéine modifiée), soit fonctionnalisé pour une dérivatisation supplémentaire avant conjugaison4. La plupart des vaccins conjugués polysaccharidiques homologués utilisent l’amination réductrice ou la cyanylation pour activer les hydroxyles polysaccharidiques. Le bromure de cyanogène (CNBr), un réactif qui avait déjà été utilisé pour activer les résines de chromatographie, a été initialement utilisé pour la dérivatisation des polysaccharides. Cependant, CNBr nécessite un pH élevé, généralement ~ pH 10,5 ou plus, pour déprotoner partiellement les hydroxyles polysaccharidiques afin qu’ils soient suffisamment nucléophiles pour attaquer le groupe cyano. Le pH élevé peut être préjudiciable aux polysaccharides base-labile, et ni le CNBr ni le cyano-ester actif initialement formé ne sont suffisamment stables à un pH aussi élevé.
CDAP (tétrafluoroborate de 1-cyano-4-diméthylaminopyridine; Figure 1) a été introduit par Lees et al. pour être utilisé comme agent cyanylant pour l’activation des polysaccharides5,6. Le CDAP, qui est cristallin et facile à manipuler, s’est avéré activer les polysaccharides à un pH inférieur à celui du CNBr et avec moins de réactions secondaires. Contrairement au CNBr, les polysaccharides activés par cdap peuvent être directement conjugués aux protéines, ce qui simplifie le processus de synthèse. Les polysaccharides activés par cdAP peuvent être fonctionnalisés avec une diamine (p. ex. diamine hexane) ou un dihydrazide (p. ex., dihydrazide adipique, ADH) pour fabriquer des polysaccharides dérivés d’amino- ou d’hydrazide. Une forte concentration du réactif homobifonctionnel est utilisée pour supprimer la réticulation des polysaccharides. Les polysaccharides aminés peuvent ensuite être conjugués en utilisant l’une des myriades de techniques utilisées pour la conjugaison des protéines. Les polysaccharides dérivés de l’hydrazide sont souvent couplés à des protéines à l’aide d’un réactif de carbodiimide (par exemple, le 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDAC))7. Une optimisation supplémentaire de l’activation des polysaccharides CDAP a été décrite par Lees et al.8 et est incorporée dans le protocole décrit ici.
Vue d’ensemble de la conjugaison CDAP
Le protocole CDAP peut être conceptualisé en deux phases : (1) l’activation du polysaccharide et (2) la conjugaison du polysaccharide activé avec une protéine ou un ligand(Figure 2). Le but de la première étape est d’activer efficacement le polysaccharide, tandis que le but de la seconde est de conjuguer efficacement au polysaccharide activé. Le polysaccharide activé relie les deux étapes ensemble. Cette conceptualisation permet de se concentrer sur les éléments critiques de chaque étape. La figure 2 développe cette conceptualisation, montrant les réactions d’activation et de couplage souhaitées, ainsi que les réactions d’hydrolyse et les réactions secondaires.
Au cours de la phase d’activation, les trois préoccupations majeures sont la stabilité du CDAP, la réaction du CDAP avec les hydroxyles de polysaccharide et la stabilité du polysaccharide activé(Figure 3). L’hydrolyse CDAP augmente avec le pH, tout comme l’hydrolyse du polysaccharide activé et les réactions secondaires. Cependant, la réaction CDAP avec le polysaccharide est facilitée par l’augmentation du pH. L’activation efficace des polysaccharides avec CDAP nécessite un équilibre entre 1) la réactivité du polysaccharide et du CDAP et 2) l’hydrolyse et les réactions secondaires du réactif et du polysaccharide activé.
Dans le protocole d’activation CDAP original décrit par Lees et al.5,l’activation CDAP des polysaccharides a été réalisée à température ambiante dans une solution de pH 9 sans tampon. Le taux d’activation s’est avéré rapide dans cette condition, et l’activation serait terminée dans les 3 minutes. La réaction s’est également accompagnée d’une hydrolyse rapide du CDAP, provoquant une chute rapide du pH de la solution réactionnaire sans tampon. Il était difficile d’augmenter rapidement et de maintenir le pH de réaction à la valeur cible dans un laps de temps aussi court. Dans le protocole décrit, l’activation a été effectuée en ajoutant du CDAP à partir d’une solution stock de 100 mg/mL à la solution de polysaccharide sans tampon. Le pH a été relevé 30 s plus tard avec « un volume égal de 0,2 M de triéthylamine ». La protéine à conjuguer a ensuite été ajoutée après 2,5 minutes à la réaction d’activation. Notamment, le pH de l’étape d’activation n’était pas bien contrôlé et dépassait très probablement initialement le pH cible. La réaction rapide nécessitant un ajustement rapide du pH a rendu le processus d’activation difficile à contrôler et difficile à mettre à l’échelle.
Contrairement au protocole original, le protocole modifié décrit ici présente deux améliorations majeures. Tout d’abord, le pH de la solution de polysaccharide est pré-ajusté pour cibler le pH d’activation, en utilisant le DMAP comme tampon, avant l’ajout de CDAP. DMAP a un pKa de 9,5 et a donc un bon pouvoir tampon autour de pH 9, et contrairement à beaucoup d’autres tampons, DMAP n’a pas été trouvé pour favoriser l’hydrolyse CDAP8. De plus, le DMAP est déjà un intermédiaire de procédé et n’ajoute donc pas de nouveau composant au mélange réactionnel. Le préréglage du pH avant l’ajout de CDAP élimine la grande variation de pH au début de la réaction et permet un maintien plus efficace du pH cible pendant la réaction. La deuxième amélioration consiste à effectuer la réaction d’activation à 0 °C, où le taux d’hydrolyse CDAP est nettement plus lent que celui à température ambiante. Avec la demi-vie plus longue du réactif à 0 °C, le temps d’activation est augmenté de 3 min à 15 min pour compenser le taux d’activation plus lent à la température inférieure. Le temps de réaction plus long, à son tour, facilite le maintien du pH de la réaction. L’utilisation de 0 °C ralentit également la dégradation des polysaccharides sensibles au pH, ce qui permet de préparer des conjugués de ce type de polysaccharide. Les améliorations apportées au protocole rendent le processus d’activation moins frénétique, plus facile à contrôler, plus reproductible et plus facile à mettre à l’échelle.
Cet article décrit le protocole amélioré pour effectuer l’activation CDAP contrôlée du polysaccharide à 0 °C et à un pH cible spécifié et effectuer une dérivatisation ultérieure des polysaccharides activés avec de l’ADH. On décrit également un dosage de l’acide trinitrobenzène sulfonique (TNBS), basé sur la méthode de Qi et al.9, pour la détermination du taux d’hydrazide sur le polysaccharide modifié. Un dosage modifié pour les hexoses à base de résorcinol et d’acide sulfurique10 est également décrit, qui peut être utilisé pour déterminer une gamme plus large de polysaccharides. Pour plus d’informations sur l’activation et la conjugaison cdap, le lecteur est renvoyé aux publicationsantérieures5,6,8 de Lees et al.
Protocole
REMARQUE: Préparez la solution de polysaccharide, la solution d’ADH, la solution de DMAP et la solution de stock de CDAP à l’avance avant d’exécuter les procédures d’activation et de fonctionnalisation des polysaccharides. Placez les solutions et l’équipement dans un emplacement organisé, pratique et logique. La réaction décrite est pour 10 mg de polysaccharide et peut être mise à l’échelle vers le haut ou vers le bas. Il est recommandé d’évaluer le protocole à petite échelle avant de le mettre à l’échelle.
1. Préparer une solution de polysaccharides à 5 mg/mL, 2 mL.
- Pour les polysaccharides lyophilisés
- Laissez le récipient polysaccharidique atteindre la température ambiante avant de l’ouvrir. Peser 10 mg de polysaccharide à l’intérieur d’un tube à bouchon à vis à l’aide d’une balance analytique. Utilisez un éliminateur statique pour faciliter l’échantillonnage et une pesée plus précise de la poudre.
- Ajouter 2 mL de chlorure de sodium (NaCl) de 0,15 M dans le tube pour dissoudre le polysaccharide. Coiuchez et vortexez le tube.
REMARQUE: Le chlorure de sodium n’affecte pas la réaction CDAP, mais il peut affecter la structure secondaire du polysaccharide. Certains polysaccharides sont plus solubles à différentes concentrations de sel. - Mélanger le tube par rotation d’extrémité à extrémité pendant 12-24 h, en fonction du poids moléculaire du polysaccharide, pour permettre au polysaccharide de s’hydrater complètement. Si nécessaire, réchauffez doucement le tube pour favoriser la solubilisation.
- Pour polysaccharide solubilisé en solution tamponnée
REMARQUE: Pour une activation efficace du CDAP, la solution de polysaccharide ne doit contenir aucun tampon, en particulier de l’ion phosphate. Suivez la procédure ci-dessous pour remplacer le tampon par de l’eau ou une solution saline et pour ajuster la concentration de polysaccharide à 5 mg/mL.- Obtenir un filtre centrifuge de 4 mL ou 15 mL du seuil de masse moléculaire approprié (MWCO).
REMARQUE: Le MWCO est idéalement 5 à 10 fois plus petit que le poids moléculaire du polysaccharide. - Ajouter un volume de la solution de polysaccharide tamponnée contenant ~20 mg de polysaccharide à l’insert filtrant. Remplir à fond avec de l’eau ou une solution saline. Bien serrer le filtre. Mélangez par bout plusieurs fois.
- Centrifuger le dispositif filtrant à la force centrifuge suggérée par le fabricant. Assurez-vous que le temps de centrifugation est suffisamment long pour obtenir une réduction de volume d’au moins 5 fois après chaque rotation. Jetez le flux. Réassemblez le dispositif de filtre.
- Remplissez l’insert du filtre à pleine marque avec de l’eau douce ou une solution saline. Bien serrer le filtre. Mélanger le contenu du filtre par rotation d’extrémité à extrémité ~ 10 fois ou par un léger vortex; répétez le spin.
REMARQUE: Le polysaccharide peut s’accumuler au bas de l’insert filtrant du dispositif centrifuge, formant un gel. Il est recommandé de re-mélanger le rétenant à l’intérieur de l’insert filtrant avec la recharge fraîche avant la prochaine rotation. - Répétez le cycle de recharge et de rotation pendant au moins 3 fois.
- Suivez l’exercice ci-dessous pour récupérer le rétentant polysaccharidique de l’insert filtrant.
- Ajouter de l’eau fraîche ou une solution saline à l’insert du filtre de sorte que le volume soit d’environ 1 mL. Mélanger en pipetant de haut en bas ou en vortexant doucement.
- Transférer tout le rétenant mélangé dans un tube de 5 mL. Ajouter 1 mL d’eau douce ou de solution saline à l’insert du filtre. Rincez le filtre en pipetant de haut en bas ou en vortexant doucement. Transférer et combiner tous les rinçages avec le polysaccharide récupéré.
- Déterminer la concentration en polysaccharides (voir le dosage des polysaccharides à la rubrique 7.3). Diluer le polysaccharide avec de l’eau ou une solution saline supplémentaire à 5 mg/mL.
- Obtenir un filtre centrifuge de 4 mL ou 15 mL du seuil de masse moléculaire approprié (MWCO).
- Lorsque la solution de polysaccharide est préparée, refroidir le tube contenant la solution de polysaccharide dans un seau à glace.
2. Préparer 0,5 M de solution de dihydrazide d’acide adipique (ADH), 10 mL.
- Peser 0,87 g d’ADH dans une balance analytique et solubiliser dans 8 mL de 0,1 M HEPES (acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique), pH 8.
- Ajuster au pH cible avec 1 M d’hydroxyde de sodium (NaOH), surveillé par un pH-mètre. Porter à 10 mL avec un tampon supplémentaire et reconsrasser le pH.
3. Préparer une solution DMAP de 2,5 M, 10 mL.
REMARQUE: DMAP est toxique et pénètre dans la peau. Portez des gants en nitrile lors de l’exécution de la procédure.
- Peser soigneusement 3 g de DMAP dans un tube conique de 50 mL. Ajouter 5 ml d’eau au DMAP et mélanger en vortexant pendant 5 min pour obtenir une solution trouble (~ 7 ml).
- Pendant le mélange, ajouter des incréments de 50 μL d’acide chlorhydrique 10 N (HCl) à la solution DMAP. Mélanger entre chaque ajout. Arrêtez d’ajouter lorsque la solution devient claire.
- Ajouter 10 N NaOH par incréments de 25 μL pour amener la solution DMAP à ~pH 8.
- Porter la solution DMAP à 10 mL avec de l’eau pour donner une solution de 2,5 M.
- Affiner le pH de la solution DMAP de 2,5 M.
REMARQUE: Le pH de la solution de DMAP change avec la concentration et la force ionique. Cet exercice consiste à affiner le stock de DMAP de 2,5 M à un pH spécifique de sorte que lorsqu’il est mélangé à 10 volumes de polysaccharide, la solution résultante soit proche du pH cible pour l’activation.- Préparer une série de tubes de 1,5 mL contenant 1 mL d’eau ou la solution de NaCl, selon ce qui a été utilisé pour préparer la solution de polysaccharide. Refroidir les tubes sur la glace.
- Ajouter 100 μL de DMAP dans un tube réfrigéré. Vortex et mesurez le pH avec un pH-mètre. Ensuite, jetez le tube mesuré.
- Si le pH mesuré n’est pas proche de la valeur cible, ajuster le pH du stock DMAP avec 1 M NaOH ou HCl selon le cas. Répétez les étapes 3.5.2 et 3.5.3 jusqu’à ce que le pH mesuré soit proche du pH cible.
4. Préparer une solution sur mesure de CDAP de 100 mg/mL
REMARQUE: La poudre de CDAP doit être maintenue hermétiquement fermée et stockée à -20 ° C et laissée à température ambiante avant ouverture. Portez des gants en nitrile lors de l’exécution de la procédure.
- Tare un tube de microcentrifugation à capuchon encliquetable de 1,5 mL sur une balance analytique. À l’aide d’une petite spatule, peser 10 à 140 mg de CDAP dans le tube. Notez le poids réel du CDAP.
- Déterminer le volume d’acétonitrile nécessaire pour préparer 100 mg/mL de CDAP. Ouvrez l’acétonitrile dans une hotte aspirante.
- À l’aide d’une pipette de volume appropriée, aspirez et relâchez l’acétonitrile pour équilibrer sa vapeur dans la pointe de la pipette. Attendez que le solvant s’écoule de l’embout de la pipette après quelques secondes et préparez-vous à le transférer directement dans le tube CDAP. Dessinez le volume calculé d’acétonitrile et transférez-le directement dans le tube CDAP. Fermez le capuchon.
REMARQUE: L’acétonitrile peut également être transféré dans le tube CDAP à l’aide d’une seringue Hamilton ou de son équivalent de taille appropriée. - Vortex pour solubiliser complètement le CDAP. Placez le tube CDAP dans un seau à glace.
REMARQUE: CDAP est stable dans l’acétonitrile dans le froid. Les stocks solubles peuvent être maintenus à -20 °C pendant >1 semaine. Cependant, il est préférable de préparer de nouvelles solutions CDAP.
5. Activation des polysaccharides et fonctionnalisation de l’hydrazide
- S’assurer que tous les articles suivants sont prêts et que les solutions sont réfrigérées sur de la glace avant de commencer l’activation : 2 mL d’une solution de polysaccharide de 5 mg/mL dans un récipient à fond plat et à bouche large contenant une barre d’agitation, placé sur un agitateur magnétique; Solution 100 mg/mL CDAP; 2,5 M solution d’origine DMAP; un pH-mètre avec une sonde de pH semi-micro, telle que la sonde de 6 mm de diamètre, calibrée pour 0 °C selon les instructions du fabricant; une pipette de 100 μL prête à l’emploi; une minuterie dégagée et prête à l’emploi; une tête de distributeur autotitratrice positionnée ou une pipette de 10 μL prête à l’emploi; Solution d’ADH 0,5 M.
- Pré-ajustez le pH du polysaccharide au pH cible à l’aide de DMAP.
- Placez la sonde de pH dans la solution de polysaccharide et laissez-la dans la solution pendant toute la procédure d’activation.
- Transférer 200 μL de la solution d’origine DMAP dans la solution polysaccharidique par addition goutte à goutte sous agitation. Ajustez le pH de la solution au pH d’activation cible. Ajouter 0,1 M HCl pour abaisser le pH et 0,1 M NaOH pour augmenter le pH. Évitez de dépasser le pH cible de plus de 0,1 unité de pH et gardez la réaction au frais dans un bain-eau pendant toute la durée de l’activation.
- Activation du CDAP
- Pipet 100 μL CDAP de haut en bas pour équilibrer la vapeur dans la pointe de la pipette. Transférer 100 μL de CDAP dans la solution de polysaccharide sous agitation.
REMARQUE: Cette activation utilise 1 mg de CDAP pour 1 mg de polysaccharide comme rapport de départ. Le ratio peut être augmenté ou diminué lors de l’optimisation de l’activation. - Démarrez la minuterie et surveillez le changement de pH pendant toute l’activation. Maintenez la réaction au pH cible en ajoutant rapidement des incréments de 10 μL de NaOH de 0,1 M à la réaction, à l’aide d’un distributeur autotitrateur (ou pipet).
REMARQUE: Il peut être utile de réduire le temps de réponse du pH pour remuer doucement avec une sonde de pH. Le pH baisse plus rapidement au début, et il peut être nécessaire d’ajouter le NaOH 0,1 M plus fréquemment. Au fur et à mesure que la réaction se poursuit, la diminution du pH devient plus lente et l’ajout devient moins fréquent. Le pH doit rester essentiellement inchangé à l’approche du temps d’activation optimal, qui est de 10-15 min pour l’activation du pH 9.
- Pipet 100 μL CDAP de haut en bas pour équilibrer la vapeur dans la pointe de la pipette. Transférer 100 μL de CDAP dans la solution de polysaccharide sous agitation.
- Fonctionnalisation ADH
- Lorsque le temps d’activation optimal est atteint, ajouter 2 mL de 0,5 M ADH en une seule fois au polysaccharide activé sous agitation. Vérifiez que le pH est dans la plage cible (pH 8-9 pour l’ADH).
REMARQUE: Un ajout avec mélange rapide minimise la probabilité que les deux extrémités du dihydrazide réagissent avec le polysaccharide activé, empêchant ainsi la réticulation des polysaccharides. - Continuer à remuer le mélange réactionnel pendant au moins 1 h. Transférer le mélange réactionnel à 4 °C, mais 0-20 °C est acceptable.
REMARQUE: La réaction de fonctionnalisation de l’ADH ne dépend pas fortement de la température. Comme le grand excès de dihydrazide agit comme réactif de trempe, il n’est pas nécessaire d’éteindre davantage le polysaccharide activé. Cependant, lors de la conjugaison directe des protéines, la réaction doit être éteinte, généralement avec 1 M de glycine, pH 8-9.
- Lorsque le temps d’activation optimal est atteint, ajouter 2 mL de 0,5 M ADH en une seule fois au polysaccharide activé sous agitation. Vérifiez que le pH est dans la plage cible (pH 8-9 pour l’ADH).
6. Purification du polysaccharide fonctionnalisé par ADH par dialyse
REMARQUE: Le produit brut de la réaction de fonctionnalisation de l’ADH contient une forte concentration d’ADH (0,5 M), qui peut être éliminée plus efficacement par dialyse étendue. La filtration sur gel, que ce soit avec une colonne ou un dispositif de dessalement par essorage, n’est pas aussi efficace, surtout lorsqu’elle est nécessaire pour éliminer le contaminant ADH résiduel.
- Déterminer le MWCO de la membrane de dialyse. Utilisez une coupure de 3 kDa pour les polysaccharides plus petits.
REMARQUE: Le MWCO de la membrane de dialyse est idéalement 5 à 10 fois plus petit que le MW de polysaccharide. - Choisissez le format de dialyse souhaité (cassettes ou tubes) et la capacité correcte de l’appareil. Assurez-vous que la capacité de l’appareil est 2 fois supérieure au volume de l’échantillon. Consultez les instructions d’utilisation de l’appareil par le fabricant.
- Hydrater la membrane de dialyse dans de l’eau avant utilisation. Transférer la solution de polysaccharides dérivatisés brute dans l’appareil de dialyse conformément aux instructions du fabricant.
REMARQUE: Portez des gants en nitrile pour éviter tout contact avec le DMAP. - Dialyze dans un récipient rempli de 2-4 L de 1 M NaCl et d’une barre de remuage. Placez le récipient sur une plaque à remuer dans une chambre froide ou à l’intérieur d’un réfrigérateur. Remuer le dialysat doucement et continuellement pendant la dialyse.
- Après la dialyse pendant au moins 4 h, passer à 1 M NaCl frais et dialyze pendant au moins 12 h. Dialyze contre 2 changements de solution saline de 0,15 M, chacun pendant au moins 12 h. Si vous le souhaitez, dialyze contre 2 changements d’eau.
- Vérifiez si tout l’ADH est éliminé en testant le dialysat de nuit à l’aide d’un test TNBS rapide.
- Obtenez 3 tubes borosilicates, étiquetez-les comme contrôle négatif (ctrl), ctrl positif et échantillon, respectivement.
- Au tube ctrl négatif, ajouter 975 μL de borate 0,1 M, pH 9.
- Au tube ctrl positif, ajouter 100 μL de 0,05 mM d’ADH (hydrazide de 0,1 mM) et 875 μL de borate de 0,1 M, pH 9.
- Dans le tube d’échantillonnage, ajouter 500 μL du dialysat de nuit et 475 μL de borate de 0,1 M, pH 9.
- Ajouter 25 μL de TNBS à 1 % aux trois tubes. Bien mélanger. Placer dans le noir pendant 1 h.
- Comparez l’intensité de couleur des 3 tubes en 1 h. Assurez-vous que l’intensité de la couleur du tube d’échantillonnage se situe entre celle du ctrl positif et du ctrl négatif, ce qui indique que le contaminant ADH est inférieur ou inférieur à 0,01 mM. Dialyze une fois de plus.
REMARQUE: Il est prudent de réduire autant que possible le niveau de contaminant ADH afin que l’hydrazide ADH représente moins de 1% de l’hydrazide total dans l’hydrazide-polysaccharide purifié. - Récupérer le polysaccharide dérivé de la dialyse. Déterminer la concentration des polysaccharides et de l’hydrazide. Calculer le rapport hydrazide/polysaccharide (voir rubrique 7). Si le polysaccharide dialysé doit être concentré à 5-10 mg/mL, consulter la rubrique 1.2.
7. Analyse des polysaccharides dérivés de l’hydrazide
REMARQUE: Le but de l’analyse décrite ici est de déterminer la concentration de polysaccharide, la concentration d’hydrazide et le niveau de dérivatisation de l’hydrazide en termes de rapport hydrazide/polysaccharide.
- Préparation des échantillons
REMARQUE: Les polysaccharides à dosage doivent être exempts de glucides, d’amines ou d’hydrazides de faible poids moléculaire. Les échantillons lyophilisés doivent être secs et sans sel pour assurer une mesure précise du poids. Habituellement, ~1 mL d’une solution de 1-2 mg/mL est suffisant pour les essais.- Peser au moins 10 mg de l’échantillon de polysaccharide lyophilisé sur une balance analytique, à l’aide d’une spatule non statique ou d’un éliminateur statique. Dissoudre le polysaccharide dans l’eau ou une solution saline à une concentration (p. ex., 2 mg/mL) de sorte que les signaux d’essai se situent dans la plage linéaire de la courbe standard.
- Mélanger bout à bout et laisser suffisamment de temps pour que l’échantillon se dissolve complètement. Effectuer une hydratation nocturne en fonction du poids moléculaire du polysaccharide.
- Dosage des polysaccharides : méthode résorcinol/acide sulfurique
REMARQUE: Le dosage approprié pour les polysaccharides dépendra de la composition en glucides des polymères. Le dosage original du résorcinol/acide sulfurique était destiné aux sucres hexoses10. Le dosage a été modifié ici en élevant la température de l’étape de chauffage de 90 °C à 140 °C. À cette température plus élevée, le test perd une certaine spécificité mais peut être utilisé pour dosage de nombreux sucres. Cependant, il est encore nécessaire de déterminer l’adéquation du test pour un polysaccharide particulier. Des triplés sont recommandés pour chaque point, mais certains aménagements peuvent être nécessaires en raison de la capacité du bloc chauffant.- Préparer 75% d’acide sulfurique
REMARQUE: L’acide sulfurique concentré est extrêmement corrosif et peut causer de graves brûlures. Effectuez cette procédure dans une hotte à fumée chimique. Versez toujours de l’acide concentré dans l’eau, et non l’inverse!- Ajouter 50 mL d’eau dans une bouteille en verre de 200 mL. Placez la bouteille dans un bain d’eau froide. Ajouter lentement 150 mL d’acide sulfurique. Bouchon de la bouteille pour qu’elle soit ventilée.
- Laisser la solution s’équilibrer à la température ambiante. Utilisez la solution dans les 3 mois.
- Préparer des normes de glucides
- Préparer la solution polysaccharidique non modifiée à 1 mg/mL à utiliser comme étalon. Alternativement, utilisez un mélange de sucres individuels dans le rapport trouvé dans l’unité de répétition du polysaccharide, à 1 mg / mL de la concentration totale de sucre, comme norme.
REMARQUE: Bien que le mélange de sucre donne généralement le même résultat que le polymère glucidique de composition de sucre identique, cela devrait être confirmé expérimentalement.
- Préparer la solution polysaccharidique non modifiée à 1 mg/mL à utiliser comme étalon. Alternativement, utilisez un mélange de sucres individuels dans le rapport trouvé dans l’unité de répétition du polysaccharide, à 1 mg / mL de la concentration totale de sucre, comme norme.
- Assurez-vous que le bloc chauffant avec des porte-tubes pour 13 x 100 tubes à essai en borosilicate fonctionne. Utilisez un coussin de protection sous et autour du bloc chauffant en cas de déversement d’acide. Préchauffez le bloc chauffant à 140 °C pendant au moins 1 h pour obtenir une température stable et uniforme à travers tous les blocs utilisés.
- Étiqueter 13 x 100 tubes à essai borosilicates, triple pour chaque étalon et chaque échantillon. Ajouter 0, 2,5, 5, 7,5, 10 μg (ou μL) de l’étalon de glucides de 1 mg/mL aux tubes étalons étiquetés en conséquence. Ajouter de l’eau à chaque tube pour porter le volume à 100 μL.
REMARQUE: La couleur générée dépend de sucres spécifiques. Comme certains sucres nécessitent plus de masse pour générer toute la plage d’absorbance, les quantités réelles utilisées pour la courbe standard peuvent varier. - Mettre en place des tests d’échantillon en ajoutant un volume contenant ~ 5 μg du polysaccharide dérivé à trois tubes d’échantillon et porter le volume total à 100 μL avec de l’eau. Alternativement, si la concentration de polysaccharide dans l’échantillon est inconnue, effectuez une série de dilutions 4 fois. Tester 100 μL de chaque dilution en triple.
- Préparer le résorcinol frais à 6 mg/mL dans de l’eau désionisée (dI) immédiatement avant utilisation. Vortex jusqu’à ce que le résorcinol soit en solution. Ajouter 100 μL de 6 mg/mL de résorcinol à chaque tube.
- Versez soigneusement la quantité estimée d’acide sulfurique à 75% dans un petit bécher.
REMARQUE: Portez une blouse de laboratoire, des gants en nitrile et des lunettes de sécurité. Méfiez-vous des gouttes, des déversements et des éclaboussures. Gardez des serviettes en papier humides à portée de main pour essuyer les gouttes. Comme l’activité de l’acide sulfurique change lors d’une exposition prolongée à l’air, utilisez un mélange uniforme d’acide sulfurique pour l’ensemble du test. - À l’aide d’un pipetteur répétitif, ajoutez uniformément 300 μL d’acide sulfurique à 75% à chaque tube. Vortex les tubes vigoureusement pour bien mélanger, en pointant le tube tout en vortexant. Placez les tubes dans un bloc chauffant à un rythme régulier dans l’ordre séquentiel. Une fois que tous les tubes sont en place, réglez immédiatement la minuterie pendant 3 minutes.
- À 3 min, retirez les tubes à un rythme soutenu dans le même ordre et placez-les directement dans une grille dans un bain-marie. Laissez les tubes jusqu’à ce qu’ils soient glacés. Retirez les tubes et laissez-les s’équilibrer à la température ambiante pendant environ 5 minutes pour éviter la condensation sur la cuvette pendant la lecture.
- Réglez un spectrophotomètre UV/VIS pour lire l’absorbance à 430 nm à l’aide d’une cuvette de longueur de trajet de 10 mm. Vierge avec un tube standard zéro. Lire l’absorbance de tous les tubes à 430 nm.
REMARQUE: Les cuvettes en plastique jetables sont pratiques à utiliser. - Construisez une courbe standard en traçant μg de glucides standard par rapport à A430. Voir la figure 4 pour une courbe standard typique utilisant le glucose comme étalon de référence.
- Utilisez les tubes d’essai d’échantillon avec des valeurs A430 se situant dans la plage linéaire de la courbe standard, calculez la quantité de μg du polysaccharide inconnu dans les tubes d’essai de l’échantillon à partir de l’équation de courbe standard. Déterminer la concentration du polysaccharide inconnu à partir du volume de l’inconnu ajouté, en tenant compte des dilutions. Convertir la concentration en unités de répétition mg/mL ou μM selon les besoins.
- Préparer 75% d’acide sulfurique
- Dosage de l’hydrazide à l’aide d’acide trinitrobenzène sulfonique (TNBS)
- Préparer 0,9 % de NaCl contenant 0,02 % d’azide de sodium (tampon d’échantillon) en dissolvant 9 g de NaCl et 200 mg d’azide de sodium dans dI H2O pour un volume final de 1 L.
- Préparer 0,1 M de borate de sodium, pH 9 (tampon d’essai), en mélangeant 100 mL de borate de sodium de 0,5 M, pH 9, avec 400 mL de dI H2O. Confirmer que le pH de la solution est de 9 ± 0,1; ajuster si nécessaire.
- Préparer 1% de TNBS en diluant 200 μL de 5% de solution d’acide sulfonique 2,4,6-trinitrobenzène à 1 mL avec dI H2O. Marquer le tube comme 1% TNBS et conserver à 4 °C dans l’obscurité pendant une semaine.
- Préparer un stock d’ADH de 50 mM (équivalent à 100 mM d’hydrazide).
- Peser 871 mg de poudre de dihyrazide adipique (ADH) à l’aide d’une balance analytique. Dissoudre la poudre dans un flacon de réactif en ajoutant un tampon d’échantillon à 100 mL à l’aide d’un équilibre de chargeur supérieur.
- Étiqueter la bouteille comme étant de 100 mM d’hydrazide/50 mM d’ADH. Bien bousiller le flacon et conserver à 4 °C pendant 1 an.
- Préparer des étalons d’hydrazide (0,1, 0,2, 0,3, 0,4, 0,5 et 0,6 mM d’hydrazide).
- Préparer les 6 étalons d’hydrazide en diluant le stock d’hydrazide de 100 mM avec un tampon d’échantillon à l’aide d’un équilibre de chargeur supérieur. Préparer 100 mL de chaque étalon pour minimiser l’erreur de concentration. Fermez hermétiquement les bouteilles et conservez à 4 °C pendant 1 an.
- Mise en place de réactions de dosage
REMARQUE: Le test TNBS est exécuté à un volume de réaction de 1 mL. Chaque tube d’essai se compose de 100 μL d’un échantillon (ou d’un étalon), de 875 μL de tampon d’essai et de 25 μL de solution de TNBS à 1 %. Toutes les réactions d’essai (pour les échantillons et les étalons) sont mises en place en trois exemplaires.- Étiquetez 3 tubes en verre borosilicate (12 x 75 mm) pour chaque étalon, y compris l’étalon zéro. Trier et disposer les tubes standard dans un rack à tubes par ordre de concentration croissante. Utilisez une micropipette calibrée de 100 μL ou 200 μL pour ajouter avec précision 100 μL des étalons à chaque tube correspondant. Pour l’étalon zéro, utilisez 100 μL de tampon d’échantillon.
- Étiqueter 3 tubes en verre borosilicate (12 x 75 mm) pour chaque échantillon dilué à échantillon à échantillonr. Triez et disposez les tubes d’échantillonnage dans le rack à tubes en conséquence. Utilisez une micropipette calibrée de 100 μL ou 200 μL pour ajouter avec précision 100 μL de l’échantillon à chaque tube d’échantillon correspondant.
- Utilisez une micropipette calibrée de 1000 μL pour ajouter avec précision 875 μL de tampon d’essai à tous les tubes d’essai : les étalons et les échantillons.
- Pour commencer la réaction d’essai, utilisez une micropipette calibrée de 100 μL pour ajouter avec précision 25 μL de TNBS à 1 % à chaque tube d’essai. Commencez à partir des tubes standard zéro, passez aux tubes standard par ordre de concentration croissante, puis aux tubes d’échantillonnage selon l’ordre prédéterminé. Changez les conseils lors du démarrage d’une nouvelle norme ou d’un nouvel échantillon et gardez le temps passé à ajouter du TNBS à tous les tubes dans les 5 minutes.
- Vortex tous les tubes d’essai pendant 2 s à grande vitesse ou à un réglage de vitesse permettant au liquide à l’intérieur du tube d’essai de tourbillonner vers le haut pour atteindre une hauteur de 1/2 pouce de l’ouverture du tube.
- Enregistrez l’heure de début du test et réglez la minuterie sur 2 h. Placez le porte-tubes d’essai dans l’obscurité à température ambiante pendant 2 h. Lorsque le temps est terminé, vortex tous les tubes une fois de plus et procéder à la collecte de données.
- Collecte de données
- Laissez le spectrophotomètre UV/VIS se réchauffer et la ligne de base se stabiliser. Réglez la longueur d’onde de détection à 500 nm pour le dosage de l’hydrazide. Utilisez une cuvette de quartz de 1 mL d’une longueur de trajet de 1 cm pour toutes les mesures d’absorbance pour l’ensemble du test.
- Commencez la collecte de données en transférant un test standard zéro à la cuvette; vider l’instrument (mettre l’absorbance à zéro).
- Effectuez une seule lecture sur chaque tube et enregistrez les valeurs d’absorbance dans un tableau de données. Retirez tout liquide résiduel de la cuvette avant de lire un nouvel échantillon. Commencez à partir des étalons zéro, passez aux normes de concentration croissante, puis aux échantillons. Une fois démarré, effectuez toutes les étapes efficacement sans vous arrêter et lisez tous les tubes dans les 10 minutes.
- Analyse d’échantillons de données
- Créez une courbe standard en traçant l’étalon d’hydrazide mM par rapport à A500. Trouvez l’équation de courbe standard sous la forme de y = ax + b, où y représente mM hydrazide et x représente A500. Voir la figure 4 pour une courbe standard typique.
- Calculer l’hydrazide mM dans les échantillons à l’aide de l’équation de courbe standard, en ajustant les facteurs de dilution. Choisissez uniquement les tubes d’essai d’échantillon avec des valeurs A500 se situant dans la plage linéaire de la courbe standard pour le calcul.
- Calculer le rapport molaire de l’hydrazide/polysaccharide à l’aide de l’équation (1).
Hydrazide/polysaccharide = h/c × MW ( 1)
Où h est l’hydrazide mM, c est la concentration en mg/mL du polysaccharide et MW est le poids moléculaire du polysaccharide en kDa. - Calculer la densité de marque de l’hydrazide par 100 kDa de polysaccharide à l’aide de l’équation (2).
Densité d’étiquetage par polysaccharide de 100 kDa = h / c × 100 (2)
Où h est l’hydrazide mM et c est la concentration en mg/mL du polysaccharide.
REMARQUE: Pour plus de commodité, les polysaccharides peuvent être considérés comme avait un poids moléculaire de 100 000 daltons. Cela permet de considérer une « densité de étiquetage » en comparant le niveau de dérivatisation de divers polysaccharides. - Calculez la densité d’étiquetage de l’hydrazide en pourcentage en poids d’ADH.
- Déterminer la concentration efficace en mg/mL d’ADH à l’aide de l’équation (3).
mg/mL ADH = (mM hydrazide / 1000) × 174 (3)
où 174 est le MW d’ADH. - Calculer le pourcentage en poids d’ADH à l’aide de l’équation (4).
% en poids ADH = (mg/mL ADH) / (mg/mL polysaccharide) × 100 (4)
- Déterminer la concentration efficace en mg/mL d’ADH à l’aide de l’équation (3).
Résultats
Pour illustrer l’activation et la dérivatisation d’un polysaccharide à l’aide de la chimie CDAP, le dextran a été activé à 0,25 et 0,5 mg de CDAP/mg dextran. Pour chaque réaction, une solution de dextran de 10 mg/mL dans de l’eau a été réfrigérée sur de la glace etle 1/10e volume d’un stock de DMAP de 2,5 M (préparé comme décrit à la rubrique 3) a été ajouté. La solution finale a été portée à pH 9 par addition de NaOH de 0,1 M dans des aliquotes de 10 μL. La solution a été réfrigérée et agitée, le CDAP ajouté et le pH maintenu à pH 9 en ajoutant 10 μL aliquotes de 0,1 M NaOH pendant 15 min. Seulement 0,25 mL de 0,5 M ADH à pH 9 a été ajouté (inférieur à la quantité habituelle) et la réaction a pu se poursuivre pendant la nuit à 4 °C.
Le dextran étiqueté a ensuite été dialysé séquentiellement contre 1 M NaCl, 0,15 M NaCl et de l’eau comme décrit à la rubrique 6. L’ADH-dextran a ensuite été analysé pour le dextran à l’aide du dosage résorcinol/acide sulfurique (rubrique 7.2). Une courbe standard typique utilisant le glucose comme étalon de sucre est illustrée à la figure 4A. La teneur en hydrazide a été déterminée à l’aide du dosage TNBS décrit à la rubrique 7.3. Une courbe standard typique d’hydrazide utilisant l’ADH comme étalon est donnée à la figure 4B.
Des calculs représentatifs de l’activation du dextran aux deux niveaux d’activation sont présentés à la figure 4A,B. Les données sont présentées à la fois sous forme d’hydrazides par 100 kDa de polymère de dextran et en pourcentage en poids d’ADH par rapport au dextran, comme décrit aux rubriques 7.9.3.4 et 7.9.3.5, respectivement, de la figure 4C. Le degré de dérivatisation a presque doublé à mesure que le ratio CDAP a été doublé.
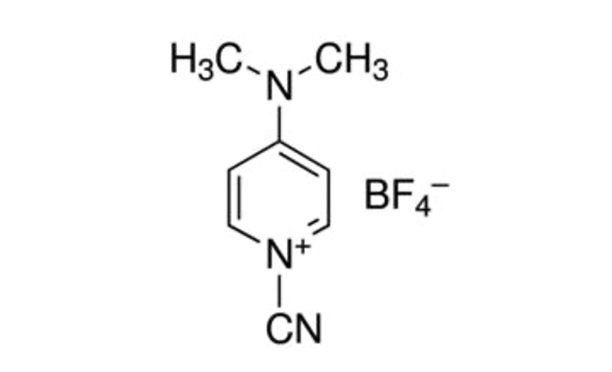
Figure 1: Structure chimique du CDAP. CDAP = tétrafluoroborate de 1-cyano-4-diméthylaminopyridine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
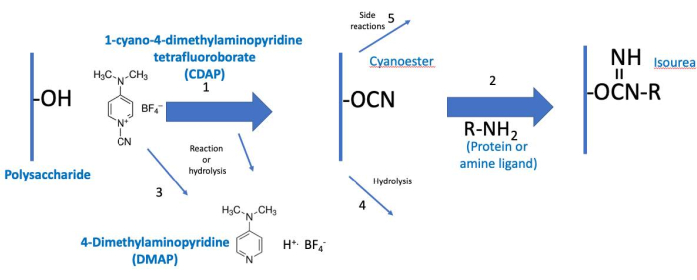
Figure 2: Processus d’activation et de conjugaison du CDAP. Le processus est conceptuellement divisé en deux phases, avec le polysaccharide activé commun aux deux. Dans des conditions de base, le CDAP active les hydroxyles polysaccharidiques, libérant du DMAP (réaction 1). L’hydrolyse CDAP libère également du DMAP (réaction 3). Bien qu’un cyano-ester soit montré, ce n’est peut-être pas l’intermédiaire réel. L’intermédiaire est donc appelé polysaccharide « activé » (CDAP). Au cours de la première phase d’activation, le polysaccharide activé peut s’hydrolyser (réaction 4) ou subir des réactions secondaires (réaction 5). Dans la deuxième phase de conjugaison (réaction 2), le polysaccharide activé réagit avec une amine pour former une liaison isourée stable en plus des réactions 4 et 5. Abréviations : CDAP = tétrafluoroborate de 1-cyano-4-diméthylaminopyridine; DMAP = 4-diméthylaminopyridine; R-NH2 = amine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
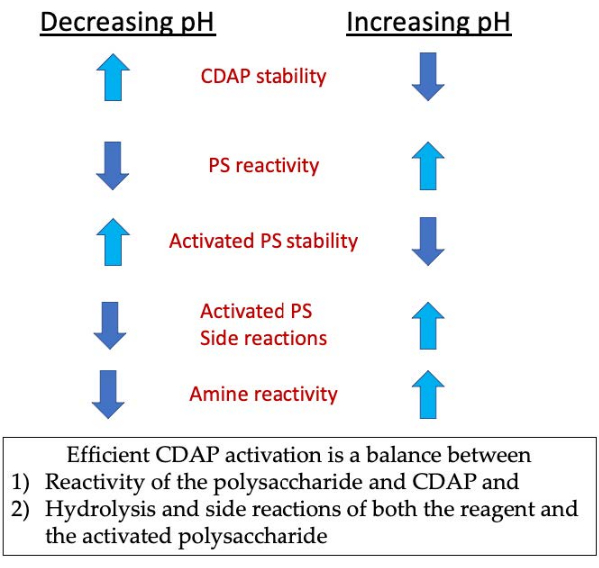
Figure 3: Activation et conjugaison du CDAP. Le processus nécessite d’équilibrer la réactivité du CDAP avec le polysaccharide, la stabilité du CDAP et du polysaccharide activé, ainsi que la réactivité du polysaccharide activé avec celle de l’amine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
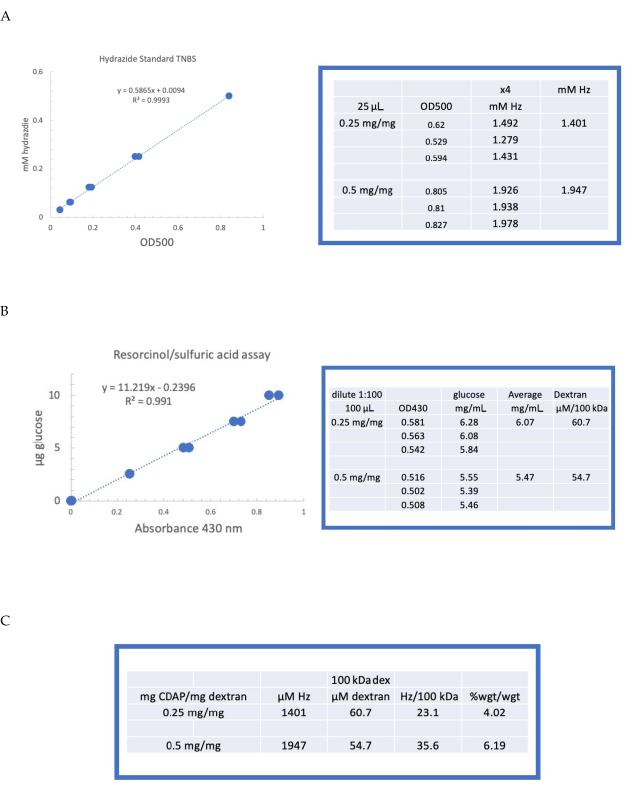
Figure 4: Résultats représentatifs de l’activation CDAP du dextran. Courbes standard typiques pour les essais (A) résorcinol/acide sulfurique et (B) TNBS. Les résultats du test pour le dextran activé avec 0,25 et 0,5 mg cdAP/mg de dextran sont présentés. Le glucose a été utilisé comme norme pour le dosage du résorcinol. Le dextran, en mg/mL, est divisé par 100 kDa pour donner une concentration molaire. La concentration d’hydrazide est déterminée en utilisant l’ADH comme étalon et les résultats exprimés en μM Hz. (C) Calcul des rapports hydrazide:dextran. Le niveau de dérivatisation a été calculé en hydrazides par 100 kDa de dextran pour faciliter la comparaison entre polymères de différents poids moléculaires moyens. Le rapport en % en poids de g ADH/g dextran a été calculé en utilisant un MW de 174 g/mole pour l’ADH. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le CDAP est un réactif pratique pour dévatiser et conjuguer les polysaccharides. Cet article décrit la méthode générale d’utilisation du CDAP pour dévatiser les polysaccharides avec des hydrazides (PS-ADH) et intègre des améliorations récemment publiées8. Tout d’abord, la technique souligne l’importance de maintenir le pH cible pour contrôler le processus d’activation. Nous avons constaté que bien que de nombreux tampons courants interfèrent avec la réaction d’activation du CDAP, le DMAP pouvait être utilisé avec succès comme tampon pour gérer le pH8. De plus, le DMAP est déjà un sous-produit de réaction de l’activation du CDAP. Enfin, la mise en mémoire tampon de la solution de polysaccharide avec du DMAP avant l’ajout du CDAP facilite le ciblage précis et le maintien du pH de la réaction. Comme nous le décrivons, il est utile d’ajuster le pH de la solution centrale concentrée de DMAP de telle sorte que, lorsqu’elle est diluée, elle atteigne le pH ciblé. Deuxièmement, l’exécution du processus dans le froid a ralenti le temps de réaction, rendant le processus d’activation moins frénétique et plus indulgent. Une température plus basse a diminué le taux d’hydrolyse CDAP et le temps d’activation optimal à pH 9 passe de ~3 min à ~15 min. De plus, moins de CDAP est nécessaire pour atteindre le même niveau d’activation que lorsqu’il est effectué à température ambiante.
Les polysaccharides dérivés de l’ADH peuvent être conjugués à des protéines à l’aide de carbodiimides (par exemple, EDAC)7. Par exemple, plusieurs vaccins homologués contre Haemophilus influenzae b (Hib) utilisent le polyribosylribitolphosphate (PRP) dérivé de l’ADH pour se conjuguer à l’anatoxine tétanique à l’aide de l’EDAC. CNBr a été initialement utilisé, mais CDAP est un réactif beaucoup plus facile à utiliser à cette fin. D’après notre expérience, une bonne plage cible pour la dérivatisation de l’ADH est de 10 à 30 hydrazides par polysaccharide de 100 kDa ou d’environ 1 à 3% d’ADH en poids.
Le même procédé peut être utilisé pour dévatiser les polysaccharides avec des amines primaires en substituant l’ADH à une diamine. Il est recommandé d’utiliser l’hexane diamine pour dévatiser les polysaccharides avec des amines8. Le polysaccharide aminé (PS-NH2) peut être conjugué à l’aide de réactifs développés pour la conjugaison des protéines11. Typiquement, le PS-NH2 est dérivé avec un maléimide (par exemple, l’ester de succinimidyl 4-[N-maleimidomethyl]cyclohexane-1-carboxylate (SMCC) ou N-γ-maleimidobutyryl-oxysuccinimide (GMBS)), et la protéine est thiolée (par exemple, avec le propionate de succinimidyl 3-(2-pyridyldithio)(SPDP)). La chimie thiol-maléimide est très efficace.
Les protéines peuvent également être directement couplées aux polysaccharides activés par le CDAP via l’ɛ-amine sur les lysines. Bien que le protocole d’activation utilisé soit généralement similaire à celui décrit ici, il est nécessaire d’optimiser le niveau d’activation, la concentration en polysaccharides et en protéines, ainsi que le rapport protéine/polysaccharide5,6,8.
Le dextran est l’un des polysaccharides les plus faciles à activer avec le CDAP en raison de sa densité relativement élevée de groupes hydroxyles, mais certains polysaccharides, tels que l’antigène Vi, peuvent être difficiles. Par conséquent, il n’existe pas de « meilleur » protocole unique pour la conjugaison CDAP directement aux protéines. Nous suggérons d’abord de développer un protocole pour atteindre des niveaux appropriés d’activation, tels que déterminés par l’étendue de la dérivatisation de l’hydrazide, puis de procéder à la conjugaison directe des protéines en polysaccharide activé par CDAP.
Déclarations de divulgation
Andrew Lees est fondateur et propriétaire de Fina Biosolutions. Il détient plusieurs brevets relatifs à la chimie CDAP et bénéficie de licences sur le savoir-faire en chimie et en conjugaison CDAP.
Remerciements
Le travail décrit ici a été financé par Fina Biosolutions LLC.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
Références
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
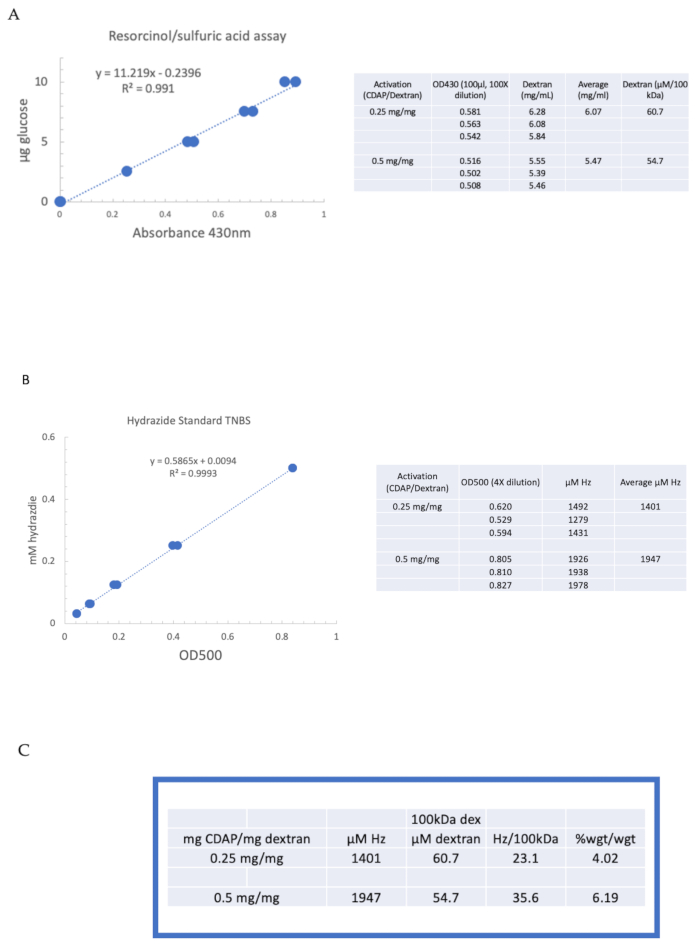
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon