Method Article
Активация и конъюгация растворимых полисахаридов с использованием 1-циано-4-диметиламинопиридина тетрафторбората (CDAP)
В этой статье
Erratum Notice
Резюме
Белки и аминосодержащие лиганды могут быть ковалентно связаны с полисахаридами, активированными реагентом цианирования, 1-циано-4-диметиламинопиридина тетрафторборатом (CDAP), с образованием ковалентного белка (лиганда)-полисахаридных конъюгатов. В данной статье описан усовершенствованный протокол для проведения контролируемой активации CDAP при 0 °C и изменении рН и выполнения последующей конъюгации активированных полисахаридов.
Аннотация
Конъюгированные вакцины являются замечательными достижениями в вакцинологии. Для приготовления полисахаридных конъюгированных вакцин полисахариды могут быть удобно функционализированы и связаны с белками-носителями вакцин с использованием 1-циано-4-диметиламинопиридина тетрафторбората (CDAP), простого в обращении цианилирующего реагента. CDAP активирует полисахариды, реагируя с гидроксильными группами углеводов при рН 7-9. Стабильность и реакционная способность CDAP сильно зависят от pH. pH реакции также снижается во время активации из-за гидролиза CDAP, что делает хороший контроль pH ключом к воспроизводимой активации. Оригинальный протокол активации CDAP выполняли при комнатной температуре в небуферизованных растворах рН 9.
Из-за быстрой реакции в этом состоянии (<3 мин) и сопровождающего ее быстрого падения рН от быстрого гидролиза CDAP было сложно быстро отрегулировать и поддерживать целевой рН реакции в короткие сроки. Улучшенный протокол, описанный здесь, выполняется при 0 °C, что замедляет гидролиз CDAP и увеличивает время активации с 3 мин до ~15 мин. Диметиламинопиридин (DMAP) также использовали в качестве буфера для предварительной корректировки раствора полисахарида к целевому активации рН перед добавлением реагента CDAP. Более длительное время реакции в сочетании с более медленным гидролизом CDAP и использованием буфера DMAP облегчает поддержание рН активации в течение всего процесса активации. Улучшенный протокол делает процесс активации менее неистовым, более воспроизводимым и более поддающимся масштабированию.
Введение
Конъюгированные вакцины, такие как те, которые состоят из полисахаридов, ковалентно связанных с белком-носителем, являются одними из замечательных достижений в вакцинологии1,2. Полисахариды, как Т-клеточные независимые антигены, плохо иммуногенны у младенцев и не вызывают памяти, переключения классов или аффинного созревания антител3. Эти недостатки преодолены в полисахаридных конъюгированных вакцинах4. Поскольку большинство полисахаридов не имеют удобной химической ручки для конъюгации, их сначала необходимо сделать реакционноспособными или «активированными». Активированный полисахарид затем связывают либо непосредственно с белком (или модифицированным белком), либо функционализируют для дополнительной дериватизации перед конъюгацией4. Большинство лицензированных полисахаридных конъюгированных вакцин используют либо восстановительное аминирование, либо цианилирование для активации гидроксилов полисахарида. Цианогенбромид (CNBr), реагент, который ранее использовался для активации хроматографических смол, первоначально использовался для дериватизации полисахаридов. Однако CNBr требует высокого рН, обычно ~ рН 10,5 или выше, чтобы частично депротонировать гидроксилы полисахарида, чтобы они были достаточно нуклеофильными для атаки цианогруппы. Высокий рН может быть вредным для базово-лабильных полисахаридов, и ни CNBr, ни первоначально сформированный активный циано-эфир не являются достаточно стабильными при таком высоком рН.
CDAP (1-циано-4-диметиламинопиридина тетрафторборат; Рисунок 1) был введен Lees et al. для использования в качестве цианилирующего агента для активации полисахаридов5,6. Было обнаружено, что CDAP, который является кристаллическим и простым в обращении, активирует полисахариды при более низком рН, чем CNBr, и с меньшим количеством побочных реакций. В отличие от CNBr, CDAP-активированные полисахариды могут быть непосредственно конъюгированы с белками, упрощая процесс синтеза. CDAP-активированные полисахариды могут быть функционализированы диамином (например, гексановым диамином) или дигидразидом (например, адипиковым дигидразидом, АДГ) для получения амино- или гидразид-дериватизированных полисахаридов. Высокая концентрация гомобифункционального реагента используется для подавления сшивания полисахаридов. Затем аминополисахариды могут быть конъюгированы с использованием любого из множества методов, используемых для конъюгации белка. Гидразид-дериватизированные полисахариды часто связаны с белками с использованием карбодиимидного реагента (например, 1-этил-3-(3-диметиламинопропил)карбодиимида (EDAC))7. Дальнейшая оптимизация активации полисахарида CDAP была описана Lees et al.8 и включена в протокол, описанный здесь.
Обзор сопряжения CDAP
Протокол CDAP может быть концептуализирован как две фазы: (1) активация полисахарида и (2) конъюгация активированного полисахарида с белком или лигандом(фиг.2). Целью первого шага является эффективная активация полисахарида, в то время как цель второго - эффективное сопряжение с активированным полисахаридом. Активированный полисахарид связывает два этапа вместе. Эта концептуализация помогает сосредоточиться на критических элементах каждого шага. Рисунок 2 расширяет эту концептуализацию, показывая желаемые реакции активации и связи, а также реакции гидролиза и побочные реакции.
Во время фазы активации тремя основными проблемами являются стабильность CDAP, реакция CDAP с гидроксилами полисахарида и стабильность активированного полисахарида(рисунок 3). Гидролиз CDAP увеличивается с рН, как и гидролиз активированного полисахарида и побочные реакции. Однако реакция CDAP с полисахаридом облегчается повышением рН. Эффективная активация полисахаридов с помощью CDAP требует баланса между 1) реакционной способностью полисахарида и CDAP и 2) гидролизом и побочными реакциями как реагента, так и активированного полисахарида.
В оригинальном протоколе активации CDAP, описанном Lees et al.5,CDAP-активацию полисахаридов проводили при комнатной температуре в небуферируемом растворе рН 9. При этом условии было обнаружено, что скорость активации является быстрой, и активация будет завершена в течение 3 минут. Реакция также сопровождалась быстрым гидролизом CDAP, вызывая быстрое падение рН небуферистого реакционного раствора. Было сложно быстро повысить и поддерживать реакционный рН на целевом значении в такие короткие сроки. В описанном протоколе активацию осуществляли путем добавления CDAP из 100 мг/мл запасного раствора к небуферизованным раствором полисахарида. рН был повышен через 30 с при «равном объеме 0,2 М триэтиламина». Затем через 2,5 мин к реакции активации добавляли белок, который нужно было конъюгировать. Примечательно, что рН этапа активации не контролировался хорошо и, скорее всего, первоначально превышал целевой рН. Быстрая реакция, требующая быстрой регулировки pH, затруднял контроль процесса активации и затруднял масштабирование.
В отличие от оригинального протокола, модифицированный протокол, описанный здесь, имеет два основных улучшения. Во-первых, pH раствора полисахарида предварительно настраивается на целевой активационный pH, используя DMAP в качестве буфера, перед добавлением CDAP. DMAP имеет pKa 9,5 и, таким образом, имеет хорошую буферную мощность около pH 9, и в отличие от многих других буферов, DMAP не был обнаружен для содействия гидролизу CDAP8. Кроме того, DMAP уже является промежуточным продуктом процесса и, следовательно, не добавляет новый компонент в реакционную смесь. Предварительная регулировка pH перед добавлением CDAP устраняет большие колебания pH в начале реакции и позволяет более эффективно сохранять целевой pH во время реакции. Второе улучшение заключается в выполнении реакции активации при 0 °C, где скорость гидролиза CDAP заметно медленнее, чем при комнатной температуре. При более длительном периоде полувыполнеки реагента при 0 °C время активации увеличивается с 3 мин до 15 мин, чтобы компенсировать более медленную скорость активации при более низкой температуре. Более длительное время реакции, в свою очередь, облегчает поддержание рН реакции. Применение 0 °C также замедляет деградацию pH-чувствительных полисахаридов, что позволяет готовить конъюгаты этого типа полисахарида. Улучшения в протоколе делают процесс активации менее неистовым, более простым в управлении, более воспроизводимым и более поддающимся масштабированию.
В данной статье описан усовершенствованный протокол для проведения контролируемой CDAP-активации полисахарида при 0 °C и при заданном целевом рН и выполнения последующей дериватизации активированных полисахаридов АДГ. Также описан анализ тринитробензолсульфоновой кислоты (TNBS), основанный на методе Qi et al.9,для определения уровня гидразида на модифицированном полисахариде. Также описан модифицированный анализ гексосов на основе резорцина и серной кислоты10, который может быть использован для определения более широкого спектра полисахаридов. Для получения дополнительной информации об активации и сопряжении CDAP читатель обращается к более ранним публикациям5,6,8 Lees et al.
протокол
ПРИМЕЧАНИЕ: Заранее подготовьте полисахаридный раствор, раствор АДГ, раствор DMAP и раствор запаса CDAP перед выполнением процедур активации и функционализации полисахарида. Разместите решения и оборудование в организованном, удобном и логичном месте. Описанная реакция рассчитана на 10 мг полисахарида и может быть увеличена или уменьшена. Рекомендуется оценить протокол в небольшом масштабе перед масштабированием.
1. Приготовить 5 мг/мл раствора полисахарида, 2 мл.
- Для лиофилизированного полисахарида
- Дайте полисахаридной емкости выйти на комнатную температуру перед открытием. Взвесьте 10 мг полисахарида внутри трубки с винтовой крышкой с помощью аналитических весов. Используйте статический элиминатор для упрощения отбора проб и более точного взвешивания порошка.
- Добавьте 2 мл 0,15 М хлорида натрия (NaCl) в пробирку для растворения полисахарида. Колпачок и вихрь трубки.
ПРИМЕЧАНИЕ: Хлорид натрия не влияет на реакцию CDAP, но может влиять на вторичную структуру полисахарида. Некоторые полисахариды более растворимы при различных концентрациях солей. - Перемешайте трубку путем сквозного вращения в течение 12-24 ч, в зависимости от молекулярной массы полисахарида, чтобы полисахарид полностью гидратироваться. При необходимости аккуратно прогрейте трубку, чтобы способствовать солюбилизации.
- Для солюбилизированного полисахарида в буферном растворе
ПРИМЕЧАНИЕ: Для эффективной активации CDAP раствор полисахарида не должен содержать буфера, особенно фосфат-иона. Следуйте приведенной ниже процедуре, чтобы заменить буфер водой или солевым раствором и отрегулировать концентрацию полисахарида до 5 мг/мл.- Получают 4 мл или 15 мл центробежно-спинового фильтрующего устройства соответствующей молекулярно-весовой отсечки (MWCO).
ПРИМЕЧАНИЕ: MWCO в идеале в 5-10 раз меньше молекулярной массы полисахарида. - Добавьте в фильтрующий вкладыш объем буферного раствора полисахарида, содержащего ~20 мг полисахарида. Заполнить до полной отметки водой или солевым раствором. Плотно закрепить фильтр крышкой. Перемешайте по окончанию несколько раз.
- Центрифугировать фильтрующее устройство при центробежной силе, предложенной заводом-изготовителем. Убедитесь, что время центрифугирования достаточно долгое, чтобы достичь по крайней мере 5-кратного уменьшения объема после каждого вращения. Отбросьте сквозной поток. Соберите фильтрующее устройство.
- Заправьте фильтрующий вкладыш до полной отметки пресной водой или солевым раствором. Плотно закрепить фильтр крышкой. Перемешайте содержимое в фильтре путем сквозного вращения ~10 раз или путем мягкого вихря; повторите вращение.
ПРИМЕЧАНИЕ: Полисахарид может накапливаться в нижней части фильтрующей вставки центробежного устройства, образуя гель. Рекомендуется повторно смешать ретентант внутри фильтрующей вставки со свежим заправом перед следующим отжимом. - Повторите цикл заправки и отжима не менее 3 раз.
- Выполните упражнение ниже, чтобы восстановить полисахаридный ретентентар из фильтрующей вставки.
- Добавьте свежую воду или физиологический раствор в фильтрующий раствор, чтобы объем был ~1 мл. Перемешайте путем пипетки вверх и вниз или путем мягкого вихря.
- Перенесите весь смешанный ретентант в пробирку 5 мл. Добавьте 1 мл пресной воды или физиологического раствора в фильтрующий вкладыш. Промывайте фильтр путем пипетки вверх и вниз или путем мягкого вихря. Перенесите и соедините все полоскания с восстановленным полисахаридом.
- Определение концентрации полисахарида (см. анализ полисахаридов в разделе 7.3). Разбавляют полисахарид дополнительной водой или физиологическим раствором до 5 мг/мл.
- Получают 4 мл или 15 мл центробежно-спинового фильтрующего устройства соответствующей молекулярно-весовой отсечки (MWCO).
- Когда раствор полисахарида приготовлен, охладите трубку, содержащую раствор полисахарида, в ведре со льдом.
2. Готовят 0,5 М раствора дигидразида адипиновой кислоты (АДГ), 10 мл.
- Весят 0,87 г АДГ в аналитических весах и солюбилизируют в 8 мл 0,1 М HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), рН 8.
- Отрегулируйте целевой рН с помощью 1 М гидроксида натрия (NaOH), контролируемого рН-метром. Доведите до 10 мл с дополнительным буфером и повторно подтвердите рН.
3. Подготовьте раствор 2,5 М DMAP, 10 мл.
ПРИМЕЧАНИЕ: DMAP токсичен и проникает в кожу. Надевайте нитриловые перчатки при выполнении процедуры.
- Тщательно взвесьте 3 г DMAP в коническую трубку 50 мл. Добавьте 5 мл воды в DMAP и перемешайте путем вихря в течение 5 мин до получения мутного раствора (~ 7 мл).
- Во время смешивания добавьте 50 мкл с шагом 10 N соляной кислоты (HCl) в раствор DMAP. Смешайте между каждым добавлением. Прекратите добавление, когда решение станет ясным.
- Добавьте 10 Н NaOH с шагом 25 мкл, чтобы довести раствор DMAP до ~pH 8.
- Доведите раствор DMAP до 10 мл с водой, чтобы получить раствор 2,5 мл.
- Тонкая настройка рН раствора DMAP 2,5 М.
ПРИМЕЧАНИЕ: рН раствора DMAP изменяется с концентрацией и ионной силой. Это упражнение заключается в тонкой настройке запаса DMAP 2,5 М до определенного рН таким образом, чтобы при смешивании с 10 объемами полисахарида полученный раствор был близок к целевому рН для активации.- Готовят серию из 1,5 мл пробирок, содержащих 1 мл воды или раствора NaCl, в зависимости от того, что использовалось для приготовления раствора полисахарида. Охладите трубки на льду.
- Добавьте 100 мкл DMAP в охлажденный тюбик. Вихрь и измерьте pH с помощью pH-метра. Затем отбросьте измеренную трубку.
- Если измеренный рН не близок к целевому значению, скорректируйте рН запаса DMAP с 1 М NaOH или HCl в зависимости от обстоятельств. Повторяйте шаги 3.5.2 и 3.5.3 до тех пор, пока измеренный рН не приблизится к целевому рН.
4. Приготовьте 100 мг/мл раствора CDAP
ПРИМЕЧАНИЕ: Порошок CDAP следует держать плотно закрытым и хранить при -20 °C и дать ему перейти к комнатной температуре перед открытием. Надевайте нитриловые перчатки при выполнении процедуры.
- Натрите микроцентрифужную трубку емкостью 1,5 мл на аналитические весы. Используя небольшой шпатель, взвесьте 10-140 мг CDAP в пробирку. Обратите внимание на фактический вес CDAP.
- Определить объем ацетонитрила необходимо для приготовления 100 мг/мл CDAP. Открыть ацетонитрил в вытяжке.
- Используя соответствующий объем пипетки, вытяните и освободите ацетонитрил, чтобы уравновесить его пар в наконечнике пипетки. Подождите, пока растворитель выпадет из наконечника пипетки через несколько секунд, и будьте готовы перенести его непосредственно в трубку CDAP. Нарисуйте расчетный объем ацетонитрила и непосредственно перенесите его в трубку CDAP. Закройте крышку.
ПРИМЕЧАНИЕ: Ацетонитрил также может быть перенесен в трубку CDAP с помощью шприца Гамильтона или его эквивалента подходящего размера. - Вихрь для полной солюбилизации CDAP. Поместите трубку CDAP в ведро со льдом.
ПРИМЕЧАНИЕ: CDAP стабилен в ацетонитриле на холоде. Растворимые запасы могут храниться при -20 °C в течение >1 недели. Однако предпочтительнее готовить свежие растворы CDAP.
5. Активация полисахарида и функционализация гидразидов
- Перед началом активации убедитесь, что все следующие продукты готовы и растворы охлаждаются на льду: 2 мл раствора полисахарида 5 мг/мл в контейнере с плоским дном с широким горлом, со стержнем, помещенном поверх магнитной мешалки; 100 мг/мл ХДАП раствора для запаса; 2.5 M DMAP складовое решение; рН-метр с полумикрозондом рН, таким как датчик диаметром 6 мм, откалиброванный на 0 °C в соответствии с инструкциями завода-изготовителя; готовый к использованию пипетка 100 мкл; таймер очищен и готов к использованию; расположенная головка дозатора автотитратора или готовая к использованию пипетка 10 мкл; 0,5 М АДГ раствора.
- Предварительно отрегулируйте pH полисахарида до целевого pH с помощью DMAP.
- Поместите pH-зонд в раствор полисахарида и оставьте его в растворе в течение всей процедуры активации.
- Переложить 200 мкл раствора DMAP в раствор полисахарида путем по каплевидного добавления при перемешивание. Отрегулируйте pH раствора в соответствии с целевым pH активации. Добавьте 0,1 M HCl для снижения pH и 0,1 M NaOH для повышения pH. Избегайте превышения целевого рН более чем на 0,1 единицы рН и держите реакцию охлажденной на ледяной водяной бане в течение всего периода активации.
- Активация CDAP
- Пипетка 100 мкл CDAP вверх и вниз для уравновешиния пара в наконечнике пипетки. Переложить 100 мкл CDAP в раствор полисахарида при перемешивание.
ПРИМЕЧАНИЕ: Эта активация использует 1 мг CDAP на 1 мг полисахарида в качестве начального соотношения. Коэффициент может быть увеличен или уменьшен при оптимизации активации. - Запустите таймер и следите за изменением pH в течение всей активации. Поддерживайте реакцию на целевом рН путем быстрого добавления к реакции приращений 10 мкл 0,1 М NaOH с помощью автотитраторного дозатора (или пипетки).
ПРИМЕЧАНИЕ: Это может помочь уменьшить время отклика pH для мягкого перемешивания с помощью pH-зонда. pH падает быстрее в начале, и может потребоваться чаще добавлять 0,1 M NaOH. По мере протекая реакции снижение рН становится медленнее, а добавление становится менее частым. pH должен оставаться практически неизменным при приближении к оптимальному времени активации, которое составляет 10-15 мин для активации pH 9.
- Пипетка 100 мкл CDAP вверх и вниз для уравновешиния пара в наконечнике пипетки. Переложить 100 мкл CDAP в раствор полисахарида при перемешивание.
- Функционализация АДГ
- Когда будет достигнуто оптимальное время активации, добавьте 2 мл 0,5 М АДГ сразу к активированной полисахариду при перемешивание. Убедитесь, что pH находится в целевом диапазоне (pH 8-9 для АДГ).
ПРИМЕЧАНИЕ: Одно добавление с быстрым перемешиванием сводит к минимуму вероятность того, что оба конца дигидразида вступают в реакцию с активированным полисахаридом, предотвращая сшивание полисахарида. - Продолжайте перемешивать реакционную смесь в течение не менее 1 ч. Перенесите реакционную смесь до 4 °C, но допустимо 0-20 °C.
ПРИМЕЧАНИЕ: Реакция функционализации АДГ не сильно зависит от температуры. Поскольку большой избыток дигидразида действует как закаляющий реагент, нет необходимости в дальнейшем закалывать активированный полисахарид. Однако при непосредственном конъюгировании белков реакцию следует закалять, как правило, с 1 М глицина, рН 8-9.
- Когда будет достигнуто оптимальное время активации, добавьте 2 мл 0,5 М АДГ сразу к активированной полисахариду при перемешивание. Убедитесь, что pH находится в целевом диапазоне (pH 8-9 для АДГ).
6. Очистка АДГ-функционализированного полисахарида методом диализа
ПРИМЕЧАНИЕ: Сырой продукт реакции функционализации АДГ содержит высокую концентрацию АДГ (0,5 М), которая может быть удалена наиболее эффективно путем обширного диализа. Гелевая фильтрация, либо с помощью колонны, либо со спиновым обессоливляющим устройством, не так эффективна, особенно когда требуется удалить остаточное загрязняющее свойство АДГ.
- Определение MWCO диализной мембраны. Используйте отсечку 3 кДа для небольших полисахаридов.
ПРИМЕЧАНИЕ: MWCO диализной мембраны в идеале в 5-10 раз меньше, чем MW полисахарида. - Выберите желаемый формат диализа (кассеты или трубки) и правильную емкость устройства. Убедитесь, что емкость устройства в 2 раза больше объема образца. Ознакомьтесь с инструкциями производителей по использованию устройства.
- Увлажняйте мембрану диализа в воде перед использованием. Перенесите сырой производный раствор полисахарида на диализное устройство в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Носите нитриловые перчатки, чтобы избежать контакта с DMAP. - Диализ в контейнере, наполненном 2-4 л 1 М NaCl и перемешивании. Поместите контейнер на тарелку в холодном помещении или в холодильнике. Перемешайте диализат осторожно и непрерывно во время диализа.
- После диализа в течение не менее 4 ч, переведите на свежий 1 М NaCl и диализуйте в течение не менее 12 ч. Диализ против 2 изменений по 0,15 М физиологического раствора, каждый в течение не менее 12 ч. При желании диализуют против 2 смен воды.
- Проверьте, удалены ли все АДГ, протестировав ночной диалисат с помощью быстрого теста TNBS.
- Получите 3 боросиликатные трубки, пометьте их как отрицательный контроль (ctrl), положительный ctrl и образец соответственно.
- К отрицательной трубке ctrl добавьте 975 мкл 0,1 М бората, рН 9.
- К положительной трубке ctrl добавляют 100 мкл 0,05 мМ АДГ (0,1 мМ гидразида) и 875 мкл 0,1 М бората, рН 9.
- В пробирку для образцов добавляют 500 мкл ночного диализата и 475 мкл 0,1 М бората, рН 9.
- Добавьте 25 мкл 1% TNBS во все три пробирки. Хорошо перемешать. Поставить в темное время суток на 1 ч.
- Сравните интенсивность цвета 3 тубок за 1 ч. Убедитесь, что интенсивность цвета пробирки находится между интенсивностью положительного ctrl и отрицательного ctrl, что указывает на то, что загрязняющее вещество АДГ снижается до 0,01 мМ или ниже. Диализе еще раз.
ПРИМЕЧАНИЕ: Разумно максимально снизить уровень адг-загрязнителя, чтобы на гидразид АДГ приходится менее 1% от общего количества гидразида в очищенном гидразид-полисахариде. - Восстанавливают дериватизированный полисахарид после диализа. Определяют концентрацию полисахаридов и гидразидов. Рассчитайте соотношение гидразид/полисахарид (см. раздел 7). Если диализованный полисахарид должен быть концентрирован до 5-10 мг/мл, обратитесь к разделу 1.2.
7. Анализ гидразид-дериватизированных полисахаридов
ПРИМЕЧАНИЕ: Целью анализа, описанного здесь, является определение концентрации полисахарида, концентрации гидразида и уровня дериватизации гидразида в терминах соотношения гидразида/полисахарида.
- Пробоподготовка
ПРИМЕЧАНИЕ: Полисахариды для анализа должны быть свободны от низкомолекулярных примесей углеводов, аминов или гидразидов. Лиофилизированные образцы должны быть сухими и бессолевыми, чтобы обеспечить точное измерение веса. Обычно ~ 1 мл раствора 1-2 мг / мл достаточно для анализов.- Взвесьте не менее 10 мг лиофилизированного образца полисахарида на аналитических весах, используя нестатический шпатель или статический элиминатор. Растворите полисахарид в воде или физиологическом растворе до концентрации (например, 2 мг/мл) таким образом, чтобы сигналы анализа попадали в линейный диапазон стандартной кривой.
- Перемешайте конец-конец и дайте достаточно времени, чтобы образец полностью растворяется. Выполняют ночную гидратацию в зависимости от молекулярной массы полисахарида.
- Анализ на полисахариды: метод резорцина/серной кислоты
ПРИМЕЧАНИЕ: Соответствующий анализ полисахаридов будет зависеть от углеводного состава полимеров. Оригинальный анализ резорцина/серной кислоты предназначался для гексозных сахаров10. Анализ был модифицирован здесь путем повышения температуры ступени нагрева с 90 °C до 140 °C. При этой более высокой температуре анализ теряет некоторую специфичность, но может быть использован для анализа многих сахаров. Однако все же необходимо определить пригодность анализа для конкретного полисахарида. Для каждой точки рекомендуются трипликаты, но некоторые места могут потребоваться из-за вместимости нагревательного блока.- Приготовить 75% серной кислоты
ПРИМЕЧАНИЕ: Концентрированная серная кислота чрезвычайно коррозионна и может вызвать сильные ожоги. Выполните эту процедуру в химическом вытяжном капюшоне. Всегда наливайте в воду концентрированную кислоту, а не наоборот!- Добавьте 50 мл воды в стеклянную бутылку объемом 200 мл. Поместите бутылку в ванну с холодной водой. Медленно добавляйте 150 мл серной кислоты. Закускиваете бутылку так, чтобы она была проветриваемой.
- Дайте раствору уравновеситься до комнатной температуры. Используйте раствор в течение 3 месяцев.
- Подготовьте углеводные стандарты
- Готовят немодифицированный раствор полисахарида в 1 мг/мл для использования в качестве стандарта. Альтернативно, используют смесь отдельных сахаров в соотношении, обнаруженном в повторной единице полисахарида, при 1 мг/мл общей концентрации сахара, в качестве стандарта.
ПРИМЕЧАНИЕ: Хотя сахарная смесь обычно дает тот же результат, что и углеводный полимер с идентичным сахарным составом, это должно быть подтверждено экспериментально.
- Готовят немодифицированный раствор полисахарида в 1 мг/мл для использования в качестве стандарта. Альтернативно, используют смесь отдельных сахаров в соотношении, обнаруженном в повторной единице полисахарида, при 1 мг/мл общей концентрации сахара, в качестве стандарта.
- Убедитесь, что нагревательный блок с держателями трубок для 13 x 100 боросиликатных пробирок функционирует. Используйте защитную прокладку под и вокруг нагревательного блока в случае разливов кислоты. Предварительно нагревайте нагревательный блок до 140 °C в течение как минимум 1 ч для достижения стабильной, равномерной температуры через все используемые блоки.
- Этикетка 13 x 100 боросиликатных пробирок, трипликация для каждого стандарта и каждого образца. Добавьте 0, 2,5, 5, 7,5, 10 мкг (или мкл) из 1 мг/мл углеводного стандарта в соответствующие маркированные стандартные пробирки. Добавьте воду в каждый тюбик, чтобы довести объем до 100 мкл.
ПРИМЕЧАНИЕ: Создаваемый цвет зависит от конкретных сахаров. Поскольку некоторые сахара требуют больше массы для создания полного диапазона поглощения, фактические количества, используемые для стандартной кривой, могут варьироваться. - Настройте пробоотборники, добавив объем, содержащий ~5 мкг дериватизированного полисахарида, в три пробирки для образцов и доведите общий объем до 100 мкл с водой. Альтернативно, если концентрация полисахарида в образце неизвестна, выполняют серию 4-кратных разведений. Испытание на 100 мкл каждого разведения в трех количествах.
- Приготовьте свежий резорцин в 6 мг/мл в деионизированной (dI) воде непосредственно перед использованием. Вихрь до тех пор, пока резорцин не будет в растворе. Добавьте 100 мкл 6 мг/мл резорцина в каждый пробирку.
- Осторожно налейте расчетное количество 75% серной кислоты в небольшой замок.
ПРИМЕЧАНИЕ: Носите лабораторный халат, нитриловые перчатки и защитные очки. Будьте осторожны с каплями, разливами и брызгами. Держите влажные бумажные полотенца под рукой, чтобы вытереть любые капли. Поскольку активность серной кислоты изменяется при длительном воздействии воздуха, используйте однородную смесь серной кислоты для всего анализа. - Используя повторный пипетатор, равномерно добавляйте 300 мкл 75% серной кислоты в каждую трубку. Вихрь трубок энергично перемешивается, чтобы хорошо перемешать, направляя трубку в сторону во время вихря. Поместите трубки в блок нагревателя в устойчивом темпе в последовательном порядке. Как только все трубки вовремя войдя, установите таймер на 3 минуты.
- Через 3 мин снимите трубки в устойчивом темпе в том же порядке, и поместите их непосредственно в стойку на ледяной водяной бане. Оставьте трубки до тех пор, пока они не будут ледяными. Снимите трубки и дайте им выравниваться до комнатной температуры в течение ~ 5 мин, чтобы предотвратить конденсацию на кювете во время считывания.
- Установите спектрофотометр UV/VIS для считывания поглощения при 430 нм с помощью кюветы с 10 мм. Заготовка с нулевой стандартной трубкой. Считывание поглощения всех трубок при 430 нм.
ПРИМЕЧАНИЕ: Одноразовые пластиковые кюветы удобны в использовании. - Постройте стандартную кривую, построив мкг углеводного стандарта против A430. См. рисунок 4 для типичной стандартной кривой, использующего глюкозу в качестве эталонного стандарта.
- Используя пробные пробирки со значениями А430, попадающими в линейный диапазон стандартной кривой, рассчитайте количество мкг неизвестного полисахарида в пробных пробирках образца из уравнения стандартной кривой. Определяют концентрацию неизвестного полисахарида из объема неизвестного добавленного, с учетом разбавлений. При необходимости переоформляйте концентрацию в мг/мл или мкМ повторяющихся единиц.
- Приготовить 75% серной кислоты
- Гидразидный анализ с использованием тринитробензолсульфоновой кислоты (TNBS)
- Готовят 0,9% NaCl, содержащий 0,02% азида натрия (буфер образца), растворяя 9 г NaCl и 200 мг азида натрия в dIH2O до конечного объема 1 л.
- Готовят 0,1 М бората натрия, рН 9 (буфер анализа), смешивая 100 мл 0,5 М бората натрия, рН 9, с 400 мл dIH2O. Подтвердите, что рН раствора составляет 9 ± 0,1; при необходимости отрегулируйте.
- Готовят 1% ТНБС путем разбавления 200 мкл 5% 2,4,6-раствора тринитробензола сульфокислота до 1 мл с dIH2O. Пробирку маркируют как 1% ТНБС и хранят при 4 °С в темноте в течение недели.
- Готовят запас АДГ 50 мМ (что эквивалентно 100 мМ гидразида).
- Взвесьте 871 мг порошка адипик-дигиразида (АДГ) с помощью аналитических весов. Растворите порошок в бутылке с реагентами, добавив буфер пробы до 100 мл с помощью баланса верхнего загрузчика.
- Маркируете бутылку как гидразид 100 мМ/50 мМ АДГ. Плотно закуйте флакон и храните при 4 °C в течение 1 года.
- Подготовьте гидразидные стандарты (гидразид 0,1, 0,2, 0,3, 0,4, 0,5 и 0,6 мМ гидразида).
- Подготовьте 6 стандартов гидразида, разбавляя запас гидразида 100 мМ буфером sample с помощью верхнего баланса погрузчика. Подготовьте 100 мл каждого стандарта, чтобы свести к минимуму погрешность концентрации. Плотно закройте бутылки и храните при 4 °C в течение 1 года.
- Настройка реакций анализа
ПРИМЕЧАНИЕ: Анализ TNBS проводится при реакционном объеме 1 мл. Каждая пробирка состоит из 100 мкл образца (или стандарта), 875 мкл буфера анализа и 25 мкл 1% раствора TNBS. Все реакции анализа (как для образцов, так и для стандартов) устанавливаются в трех вариантах.- Этикетка 3 боросиликатные стеклянные трубки (12 x 75 мм) для каждого стандарта, включая нулевой стандарт. Отсортируйте и расположите стандартные трубки в трубной стойке в порядке увеличения концентрации. Используйте калиброванную микропипетку 100 мкл или 200 мкл, чтобы точно добавить 100 мкл эталонов в каждую соответствующую трубку. Для нулевого стандарта используйте 100 мкл буфера Sample.
- Этикетка 3 боросиликатные стеклянные трубки (12 x 75 мм) для каждого разбавленного образца, который необходимо провести анализ. Отсортируйте и расположите пробирки в стойке для трубок соответствующим образом. Используйте калиброванную микропипетку 100 мкл или 200 мкл для точного добавления 100 мкл образца в каждую соответствующую пробирку.
- Используйте калиброванную микропипетку 1000 мкл, чтобы точно добавить 875 мкл буфера анализа во все пробирки: стандарты и образцы.
- Чтобы начать реакцию анализа, используйте калиброванную микропипетку 100 мкл, чтобы точно добавить 25 мкл 1% TNBS в каждую пробирку. Начните с нуля стандартных пробирок, перейдите к стандартным пробиркам в порядке повышения концентрации, затем к пробоотборникам согласно заранее определенному порядку. Меняйте наконечники при запуске нового стандарта или нового образца и держите время, затраченное на добавление TNBS во все пробирки, в течение 5 минут.
- Вихрь всех пробирных трубок в течение 2 с на высокой скорости или на скорости установки, позволяя жидкости внутри пробирной трубки закручиваться вверх, чтобы достичь высоты 1/2 дюйма от отверстия трубки.
- Запишите время начала анализа и установите таймер на 2 ч. Поместите стойку для пробирки в темное время суток при комнатной температуре на 2 ч. Когда время закончится, еще раз вихрьйте все трубки и приступайте к сбору данных.
- Сбор данных
- Позвольте спектрофотометру UV/VIS прогреться, а базовая линия стабилизируется. Установите длину волны обнаружения на уровне 500 нм для гидразидного анализа. Используйте кварцевую кювету объемом 1 мл длиной 1 см для всех измерений поглощения для всего анализа.
- Начните сбор данных с переноса нулевого стандартного анализа на кювету; заглушить инструмент (установите поглощение равным нулю).
- Выполните однократное считывание на каждой трубке и запишите значения поглощения в таблицу данных. Удалите остатки жидкости из кюветы перед чтением нового образца. Начните с нулевых норм, переходите к нормам повышения концентрации, а затем к образцам. После запуска выполните все шаги эффективно, не останавливаясь, и прочитайте все трубки в течение 10 минут.
- Анализ демонстрационных данных
- Создайте стандартную кривую, построив стандарт гидразида мМ против стандарта А500. Найдите стандартное уравнение кривой в виде y = ax + b, где y представляет гидразид mM, а x представляет A500. Типичная стандартная кривая см. на рисунке 4.
- Рассчитайте мМ гидразида в образцах, используя стандартное уравнение кривой с поправкой на коэффициенты разрежения. Выбирайте только пробоотборные пробирки со значениями A500, попадающими в линейный диапазон стандартной кривой для расчета.
- Рассчитайте молярное соотношение гидразида/полисахарида с помощью уравнения (1).
Гидразид/полисахарид = ч/с × МВт (1)
Где h - гидразид мМ, c - концентрация мг/мл полисахарида, а MW - молекулярная масса полисахарида в кДа. - Рассчитать плотность маркировки гидразида на 100 кДа полисахарида по уравнению (2).
Плотность маркировки на полисахарид 100 кДа = ч/с × 100 (2)
Где h - гидразид mM, а c - концентрация мг/мл полисахарида.
ПРИМЕЧАНИЕ: Для удобства полисахариды можно считать имея молекулярную массу 100 000 дальтон. Это позволяет учитывать «плотность маркировки» при сравнении уровня дериватизации различных полисахаридов. - Рассчитайте плотность маркировки гидразида в весовом проценте АДГ.
- Определить эффективную концентрацию МГ/мл АДГ можно с помощью уравнения(3).
мг/мл АДГ = (мМ гидразида / 1000) × 174 (3)
где 174 — МВт АДГ. - Рассчитайте вес % АДГ с помощью уравнения (4).
вес % АДГ = (мг/мл АДГ) / (мг/мл полисахарида) × 100 (4)
- Определить эффективную концентрацию МГ/мл АДГ можно с помощью уравнения(3).
Результаты
Чтобы проиллюстрировать активацию и дериватизацию полисахарида с использованием химии CDAP, декстран активировали при 0,25 и 0,5 мг CDAP/мг декстрана. Для каждой реакции на льду охлаждали раствор декстрана 10 мг/мл в воде и добавляли1/10-й объем запаса DMAP 2,5 М (приготовленного, как описано в разделе 3). Конечный раствор доводили до рН 9 путем добавления 0,1 М NaOH в 10 мкл аликвот. Раствор охлаждали и перемешивали, добавляли CDAP, а рН поддерживали на уровне рН 9 путем добавления 10 мкл аликвот 0,1 М NaOH в течение 15 мин. Добавляли только 0,25 мл 0,5 М АДГ при рН 9 (меньше обычного количества) и реакцию позволяли продолжать в течение ночи при 4°С.
Затем меченый декстран последовательно диализировали против 1 M NaCl, 0,15 M NaCl и воды, как описано в разделе 6. Затем АДГ-декстран был проана на декстран с использованием анализа резорцина/серной кислоты (раздел 7.2). Типичная стандартная кривая, использующая глюкозу в качестве стандарта сахара, показана на рисунке 4А. Содержание гидразида определяли с помощью анализа TNBS, описанного в разделе 7.3. Типичная гидразидная стандартная кривая, использующая АДГ в качестве стандарта, приведена на рисунке 4B.
Репрезентативные расчеты из активации декстрана на двух уровнях активации показаны на рисунке 4A,B. Данные представлены как в виде гидразидов на 100 кДа декстран-полимера, так и в виде весового процента АДГ к декстрану, как описано в разделах 7.9.3.4 и 7.9.3.5, соответственно, на рисунке 4C. Степень дериватизации приблизительно удвоилась по мере удвоения коэффициента CDAP.
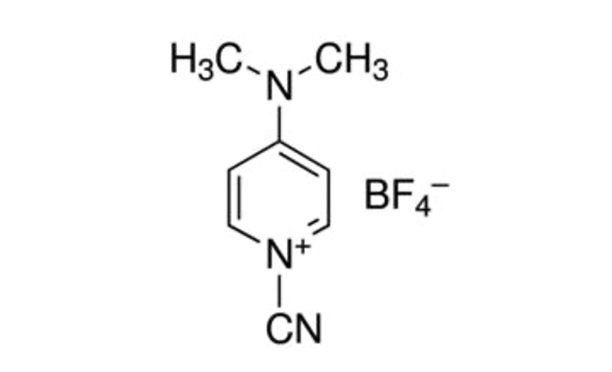
Рисунок 1:Химическая структура CDAP. CDAP = 1-циано-4-диметиламинопиридина тетрафторборат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
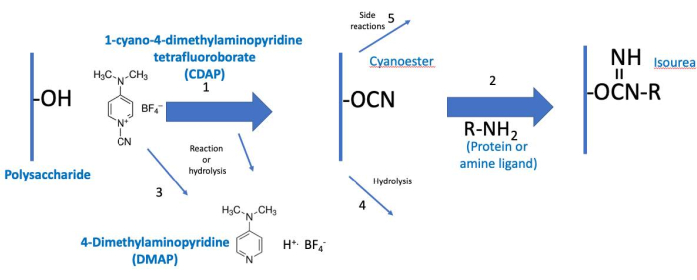
Рисунок 2:Процесс активации и сопряжения CDAP. Процесс концептуально разделен на две фазы, причем активированный полисахарид является общим для обоих. В основных условиях CDAP активирует гидроксилы полисахарида, высвобождая DMAP (реакция 1). Гидролиз CDAP также высвобождает DMAP (реакция 3). Хотя показан циано-эфир, это может не быть фактическим промежуточным продуктом. Промежуточный продукт, таким образом, называется (CDAP) «активированным» полисахаридом. Во время первой фазы активации активированный полисахарид может гидролизоваться (реакция 4) или подвергаться побочным реакциям (реакция 5). Во второй фазе конъюгации (реакция 2) активированный полисахарид реагирует с амином с образованием стабильной связи измощевинения в дополнение к реакциям 4 и 5. Сокращения: CDAP = 1-циано-4-диметиламинопиридина тетрафторборат; DMAP = 4-диметиламинопиридин; R-NH2 = амин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
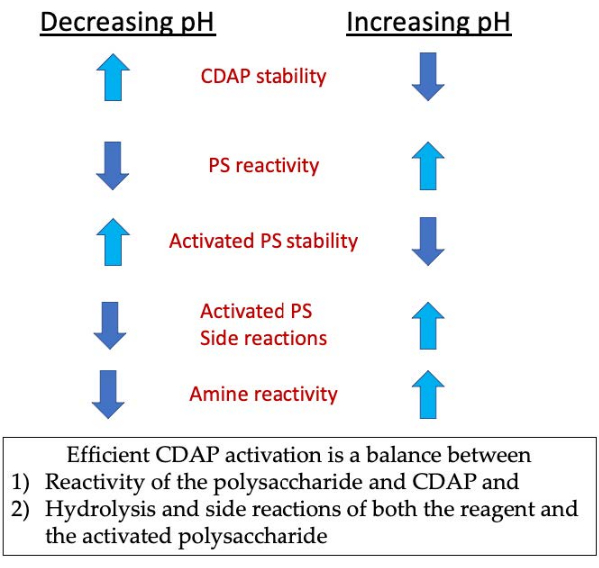
Рисунок 3:Активация и сопряжение CDAP. Процесс требует балансировки реакционной способности CDAP с полисахаридом, стабильности CDAP и активированного полисахарида, а также реакционной способности активированного полисахарида с реакцией амина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
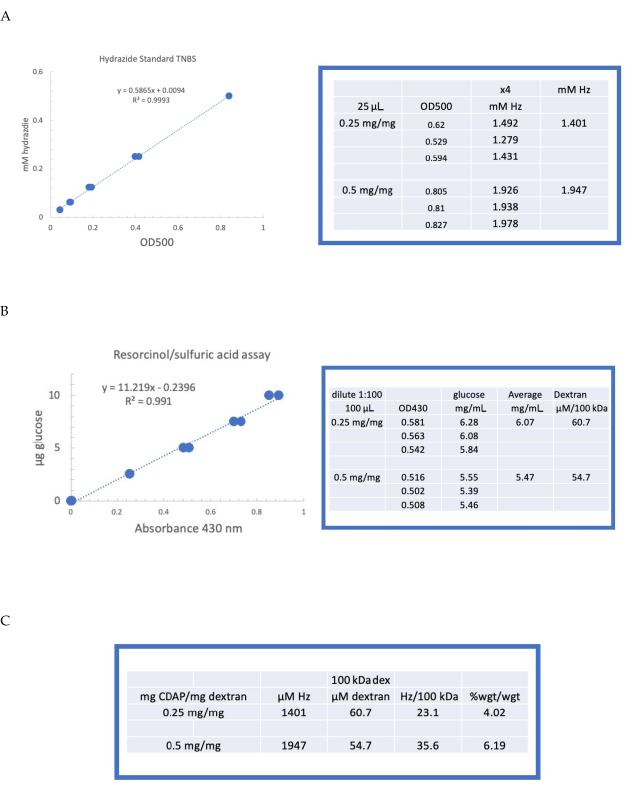
Рисунок 4:Репрезентативные результаты для CDAP активации декстрана. Типичные стандартные кривые для анализов(A)резорцина/серной кислоты и(B)TNBS. Показаны результаты анализа декстрана, активированного 0,25 и 0,5 мг CDAP/мг декстрана. Глюкоза использовалась в качестве стандарта для анализа резорцина. Декстран в мг/мл делится на 100 кДа для получения молярной концентрации. Концентрацию гидразида определяют с использованием АДГ в качестве стандарта, а результаты выражают в виде мкМ Гц.(C)Расчет соотношения гидразида: декстрана. Уровень дериватизации рассчитывали как гидразиды на 100 кДа декстрана для облегчения сравнения полимеров с различной средней молекулярной массой. Весовое соотношение г АДГ/г декстрана было рассчитано с использованием МВт 174 г/моль для АДГ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
CDAP является удобным реагентом для дериватизации и конъюгированных полисахаридов. В этой статье описывается общий метод использования CDAP для дериватизации полисахаридов с гидразидами (PS-ADH) и включены недавно опубликованные улучшения8. Во-первых, методика подчеркивает важность поддержания целевого рН для контроля процесса активации. Мы обнаружили, что, хотя многие распространенные буферы мешают реакции активации CDAP, DMAP может быть успешно использован в качестве буфера для управления pH8. Кроме того, DMAP уже является побочным продуктом реакции активации CDAP. Наконец, буферизация раствора полисахарида с помощью DMAP перед добавлением CDAP облегчает точное нацеливание и поддержание рН реакции. Как мы описываем, полезно регулировать рН концентрированного раствора DMAP таким образом, чтобы при разбавления он достиг целевого рН. Во-вторых, выполнение процесса на холоде замедляло время реакции, делая процесс активации менее неистовым и более снисходительным. Более низкая температура снижает скорость гидролиза CDAP, а оптимальное время активации при рН 9 увеличивается с ~3 мин до ~15 мин. Кроме того, для достижения того же уровня активации требуется меньше CDAP, чем при комнатной температуре.
ADH-дериватизированные полисахариды могут быть конъюгированы с белками с использованием карбодиимидов (например, EDAC)7. Например, несколько лицензированных вакцин Haemophilus influenzae b (Hib) используют полирибозилрибитолфосфат (PRP), производный с АДГ, для конъюгироваться со столбнячному токсину с использованием EDAC. Первоначально использовался CNBr, но CDAP является гораздо более простым реагентом для этой цели. По нашему опыту, хороший целевой диапазон для дериватизации АДГ составляет 10-30 гидразидов на полисахарид 100 кДа или ~1-3% АДГ по весу.
Этот же процесс может быть использован для дериватизации полисахаридов первичными аминами путем замены диамина АДГ. Рекомендуется использовать гександиамин для дериватизации полисахаридов с аминами8. Аминированный полисахарид (PS-NH2)может быть конъюгирован с использованием реагентов, разработанных для конъюгации белка11. Как правило,PS-NH2 дериватизируют с помощью малеимида (например, сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата (SMCC) или N-γ-малеимидобутирил-оксисукцинимидного эфира (GMBS)), а белок тиолируют (например, сукцинимидил 3-(2-пиридилдитио)пропионатом (SPDP)). Химия тиол-малеимида очень эффективна.
Белки также могут быть напрямую связаны с CDAP-активированными полисахаридами через ɛ-амин на лизинах. Хотя используемый протокол активации в целом аналогичен описанной здесь, необходимо оптимизировать уровень активации, концентрацию полисахарида и белка, а также соотношение белка к полисахариду5,6,8.
Декстран является одним из самых простых полисахаридов для активации с помощью CDAP из-за его относительно высокой плотности гидроксильных групп, но некоторые полисахариды, такие как антиген Vi, могут быть сложными. Следовательно, не существует единого «лучшего» протокола для конъюгации CDAP непосредственно с белками. Мы предлагаем сначала разработать протокол для достижения подходящих уровней активации, определяемых степенью дериватизации гидразида, а затем перейти к прямой конъюгации белка с CDAP-активированным полисахаридом.
Раскрытие информации
Эндрю Лис является основателем и владельцем Fina Biosolutions. Он имеет несколько патентов, связанных с химией CDAP, и получает выгоду от лицензирования ноу-хау в области химии и конъюгации CDAP.
Благодарности
Работа, описанная здесь, финансировалась компанией Fina Biosolutions LLC.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
Ссылки
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
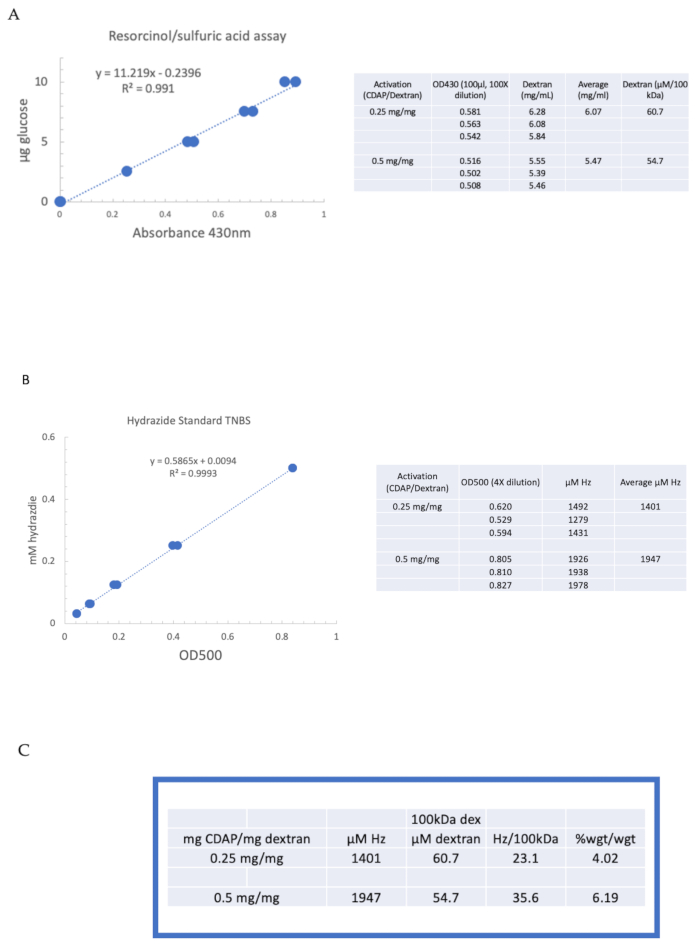
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены