Method Article
Attivazione e coniugazione di polisaccaridi solubili utilizzando 1-ciano-4-dimetilamminopiridina tetrafluoroborato (CDAP)
In questo articolo
Riepilogo
Le proteine e i ligandi contenenti ammine possono essere legati covalentemente ai polisaccaridi attivati dal reagente di cianilazione, 1-ciano-4-dimetilamminopiridina tetrafluoroborato (CDAP), per formare coniugati di proteine covalenti (ligando)-polisaccaridi. Questo articolo descrive un protocollo migliorato per eseguire l'attivazione controllata del CDAP a 0 °C e il pH variabile ed eseguire la successiva coniugazione dei polisaccaridi attivati.
Abstract
I vaccini coniugati sono notevoli progressi nella vaccinologia. Per la preparazione di vaccini coniugati con polisaccaridi, i polisaccaridi possono essere comodamente funzionalizzati e collegati alle proteine portanti del vaccino utilizzando 1-ciano-4-dimetilamminopiridina tetrafluoroborato (CDAP), un reagente cianolante facile da maneggiare. CDAP attiva i polisaccaridi reagendo con i gruppi ossidrilici dei carboidrati a pH 7-9. La stabilità e la reattività del CDAP dipendono fortemente dal pH. Il pH della reazione diminuisce anche durante l'attivazione a causa dell'idrolisi del CDAP, che rende un buon controllo del pH la chiave per l'attivazione riproducibile. Il protocollo di attivazione CDAP originale è stato eseguito a temperatura ambiente in soluzioni di pH 9 non tamponate.
A causa della reazione rapida in questa condizione (<3 min) e del rapido calo del pH che accompagna la rapida idrolisi CDAP, è stato difficile regolare rapidamente e mantenere il pH della reazione target nel breve lasso di tempo. Il protocollo migliorato qui descritto viene eseguito a 0 °C, che rallenta l'idrolisi CDAP ed estende il tempo di attivazione da 3 min a ~15 min. La dimetilamminopiridina (DMAP) è stata anche utilizzata come tampone per pre-regolare la soluzione di polisaccaride al pH di attivazione target prima di aggiungere il reagente CDAP. Il tempo di reazione più lungo, unito all'idrolisi CDAP più lenta e all'uso del tampone DMAP, rende più facile mantenere il pH di attivazione per l'intera durata del processo di attivazione. Il protocollo migliorato rende il processo di attivazione meno frenetico, più riproducibile e più suscettibile di scalare.
Introduzione
I vaccini coniugati, come quelli costituiti da polisaccaridi legati covalentemente ad una proteina vettore, sono tra i notevoli progressi della vaccinologia1,2. I polisaccaridi, come antigeni indipendenti dalle cellule T, sono scarsamente immunogenici nei neonati e non inducono memoria, cambio di classe o maturazione di affinità degli anticorpi3. Queste carenze sono superate nei vaccini coniugati con polisaccaridi4. Poiché la maggior parte dei polisaccaridi non ha una comoda maniglia chimica per la coniugazione, devono prima essere resi reattivi o "attivati". Il polisaccaride attivato viene quindi collegato direttamente con la proteina (o proteina modificata) o viene funzionalizzato per un'ulteriore derivatizzazione prima della coniugazione4. La maggior parte dei vaccini coniugati con polisaccaridi autorizzati utilizzano l'aminazione riduttiva o la cianilizzazione per attivare gli idrossili polisaccaridi. Il bromuro di cianogeno (CNBr), un reagente che era stato precedentemente utilizzato per attivare le resine per cromatografia, è stato inizialmente utilizzato per la derivatizzazione dei polisaccaridi. Tuttavia, CNBr richiede un pH elevato, in genere ~ pH 10,5 o superiore, a idrossili polisaccaridi parzialmente deprotonati in modo che siano sufficientemente nucleofili da attaccare il gruppo ciano. L'alto pH può essere dannoso per i polisaccaridi base-labili e né il CNBr né il ciano-estere attivo inizialmente formato sono sufficientemente stabili a un pH così elevato.
CDAP (1-ciano-4-dimetilamminopiridina tetrafluoroborato; Figura 1) è stato introdotto da Lees et al. per l'uso come agente cianilante per l'attivazione dei polisaccaridi5,6. CDAP, che è cristallino e facile da maneggiare, è stato trovato per attivare polisaccaridi ad un pH inferiore rispetto a CNBr e con meno reazioni collaterali. A differenza del CNBr, i polisaccaridi attivati da CDAP possono essere coniugati direttamente alle proteine, semplificando il processo di sintesi. I polisaccaridi attivati da CDAP possono essere funzionalizzati con una diammina (ad esempio, esano diammina) o un diidrazide (ad esempio, diidrazide adipico, ADH) per produrre polisaccaridi derivati da amino o idrazide. Un'alta concentrazione del reagente omobifunzionale viene utilizzata per sopprimere la reticolazione dei polisaccaridi. Gli amminopolisaccaridi possono quindi essere coniugati utilizzando una qualsiasi delle miriadi di tecniche utilizzate per la coniugazione delle proteine. I polisaccaridi derivati dall'idrazide sono spesso accoppiati a proteine utilizzando un reagente di carbodiimide (ad esempio, 1-etil-3-(3-dimetilamminopropil)carbodiimide (EDAC))7. Un'ulteriore ottimizzazione dell'attivazione del polisaccaride CDAP è stata descritta da Lees et al.8 ed è incorporata nel protocollo qui descritto.
Panoramica della coniugazione CDAP
Il protocollo CDAP può essere concettualizzato in due fasi: (1) l'attivazione del polisaccaride e (2) la coniugazione del polisaccaride attivato con una proteina o un ligando (Figura 2). L'obiettivo del primo passo è quello di attivare in modo efficiente il polisaccaride, mentre l'obiettivo del secondo è quello di coniugare in modo efficiente al polisaccaride attivato. Il polisaccaride attivato lega insieme i due passaggi. Questa concettualizzazione aiuta a concentrarsi sugli elementi critici di ogni passaggio. La Figura 2 espande questa concettualizzazione, mostrando le reazioni di attivazione e accoppiamento desiderate, insieme alle reazioni di idrolisi e alle reazioni collaterali.
Durante la fase di attivazione, le tre principali preoccupazioni sono la stabilità del CDAP, la reazione del CDAP con gli idrossili polisaccaridi e la stabilità del polisaccaride attivato (Figura 3). L'idrolisi CDAP aumenta con il pH, così come l'idrolisi del polisaccaride attivato e le reazioni collaterali. Tuttavia, la reazione CDAP con il polisaccaride è facilitata aumentando il pH. L'attivazione efficiente dei polisaccaridi con CDAP richiede un equilibrio tra 1) la reattività del polisaccaride e del CDAP e 2) l'idrolisi e le reazioni collaterali sia del reagente che del polisaccaride attivato.
Nel protocollo di attivazione CDAP originale descritto da Lees et al.5, l'attivazione CDAP dei polisaccaridi è stata effettuata a temperatura ambiente in soluzione di pH 9 non tamponata. Il tasso di attivazione è risultato essere rapido in questa condizione e l'attivazione sarebbe stata completata entro 3 minuti. La reazione è stata anche accompagnata da una rapida idrolisi del CDAP, causando un rapido calo del pH della soluzione di reazione non tamponata. È stato difficile aumentare rapidamente e mantenere il pH di reazione al valore target in un lasso di tempo così breve. Nel protocollo descritto, l'attivazione è stata eseguita aggiungendo CDAP da una soluzione stock da 100 mg/mL alla soluzione di polisaccaride non tamponata. Il pH è stato aumentato di 30 s in seguito con "un volume uguale di 0,2 M di trietilammina". La proteina da coniugare è stata quindi aggiunta dopo 2,5 minuti alla reazione di attivazione. In particolare, il pH della fase di attivazione non era ben controllato e molto probabilmente inizialmente superava il pH target. La reazione rapida che richiedeva una rapida regolazione del pH rendeva il processo di attivazione difficile da controllare e difficile da scalare.
In contrasto con il protocollo originale, il protocollo modificato qui descritto ha due importanti miglioramenti. In primo luogo, il pH della soluzione di polisaccaride viene pre-regolato per indirizzare il pH di attivazione, utilizzando DMAP come tampone, prima dell'aggiunta di CDAP. DMAP ha un pKa di 9,5 e quindi ha un buon potere tampone intorno a pH 9 e, a differenza di molti altri buffer, DMAP non è stato trovato per promuovere l'idrolisi CDAP8. Inoltre, DMAP è già un intermedio di processo e quindi non aggiunge un nuovo componente alla miscela di reazione. La pre-regolazione del pH prima di aggiungere CDAP elimina la grande oscillazione del pH all'inizio della reazione e consente un mantenimento più efficiente del pH target durante la reazione. Il secondo miglioramento consiste nell'eseguire la reazione di attivazione a 0 °C, dove la velocità di idrolisi CDAP è notevolmente più lenta di quella a temperatura ambiente. Con l'emivita del reagente più lunga a 0 °C, il tempo di attivazione viene aumentato da 3 minuti a 15 minuti per compensare il tasso di attivazione più lento alla temperatura più bassa. Il tempo di reazione più lungo, a sua volta, rende più facile mantenere il pH di reazione. L'uso di 0 °C rallenta anche la degradazione dei polisaccaridi pH-sensibili, rendendo possibile la preparazione di coniugati di questo tipo di polisaccaride. I miglioramenti nel protocollo rendono il processo di attivazione meno frenetico, più facile da controllare, più riproducibile e più suscettibile di scalare.
Questo articolo descrive il protocollo migliorato per l'esecuzione controllata dell'attivazione CDAP del polisaccaride a 0 °C e ad un pH target specificato e l'esecuzione della successiva derivatizzazione dei polisaccaridi attivati con ADH. Viene inoltre descritto un saggio di acido trinitrobenzene solfonico (TNBS), basato sul metodo di Qi et al.9,per la determinazione del livello di idrazide sul polisaccaride modificato. Viene inoltre descritto un saggio modificato per le esosi a base di resorcinolo e acido solforico10, che può essere utilizzato per determinare una gamma più ampia di polisaccaridi. Per ulteriori informazioni sull'attivazione e la coniugazione cdAP, il lettore è rimandato alle precedenti pubblicazioni5,6,8 di Lees et al.
Protocollo
NOTA: Preparare in anticipo la soluzione di polisaccaride, la soluzione ADH, la soluzione DMAP e la soluzione stock CDAP prima di eseguire le procedure di attivazione e funzionalizzazione dei polisaccaridi. Posiziona le soluzioni e le attrezzature in una posizione organizzata, comoda e logica. La reazione descritta è per 10 mg di polisaccaride e può essere scalata verso l'alto o verso il basso. Si consiglia di valutare il protocollo su piccola scala prima di scalare verso l'alto.
1. Preparare 5 mg/mL di soluzione di polisaccaride, 2 mL.
- Per polisaccaride liofilizzato
- Lasciare che il contenitore di polisaccaridi arrivi a temperatura ambiente prima dell'apertura. Pesare 10 mg di polisaccaride all'interno di un tubo a vite utilizzando una bilancia analitica. Utilizzare un eliminatore statico per un campionamento più semplice e una pesatura più accurata della polvere.
- Aggiungere 2 mL di cloruro di sodio 0,15 M (NaCl) al tubo per sciogliere il polisaccaride. Cappuccio e vortice del tubo.
NOTA: Il cloruro di sodio non influisce sulla reazione CDAP, ma può influenzare la struttura secondaria del polisaccaride. Alcuni polisaccaridi sono più solubili a diverse concentrazioni di sale. - Mescolare il tubo mediante rotazione end-over-end per 12-24 ore, a seconda del peso molecolare del polisaccaride, per consentire al polisaccaride di idratarsi completamente. Se necessario, riscaldare delicatamente il tubo per favorire la solubilizzazione.
- Per polisaccaride solubilizzato in soluzione tamponata
NOTA: per un'attivazione efficiente del CDAP, la soluzione di polisaccaride non deve contenere alcun tampone, in particolare lo ione fosfato. Seguire la procedura riportata di seguito per sostituire il tampone con acqua o una soluzione salina e per regolare la concentrazione di polisaccaride a 5 mg/ml.- Ottenere un filtro centrifugo da 4 mL o 15 mL con il cutoff a peso molecolare appropriato (MWCO).
NOTA: Il MWCO è idealmente 5-10 volte più piccolo del peso molecolare del polisaccaride. - Aggiungere un volume della soluzione di polisaccaride tamponata contenente ~ 20 mg di polisaccaride all'inserto del filtro. Riempire fino al segno completo con acqua o una soluzione salina. Chiudere saldamente il filtro. Mescolare per end-over-end un paio di volte.
- Centrifugare il dispositivo filtrante alla forza centrifuga suggerita dal produttore. Assicurarsi che il tempo di centrifugazione sia abbastanza lungo da ottenere una riduzione del volume di almeno 5 volte dopo ogni giro. Scartare il flusso attraverso. Riassemblare il dispositivo filtrante.
- Riempire l'inserto del filtro fino al segno completo con acqua dolce o soluzione salina. Chiudere saldamente il filtro. Mescolare il contenuto nel filtro mediante rotazione end-over-end ~ 10 volte o mediante vortice delicato; ripetere lo spin.
NOTA: il polisaccaride può accumularsi nella parte inferiore dell'inserto del filtro del dispositivo centrifugo, formando un gel. Si consiglia di rimescolare il retentant all'interno dell'inserto del filtro con la ricarica fresca prima della successiva rotazione. - Ripetere il ciclo di ricarica e rotazione per un minimo di 3 volte.
- Seguire l'esercizio riportato di seguito per recuperare il polisaccaride ritenente dall'inserto del filtro.
- Aggiungere acqua fresca o soluzione salina all'inserto del filtro in modo che il volume sia ~ 1 ml. Mescolare pipettando su e giù o con un leggero vortice.
- Trasferire tutto il retentant misto in un tubo da 5 ml. Aggiungere 1 mL di acqua dolce o soluzione salina all'inserto del filtro. Risciacquare il filtro tubando su e giù o con un leggero vortice. Trasferire e combinare tutti i risciacqui con il polisaccaride recuperato.
- Determinare la concentrazione di polisaccaridi (vedere il saggio dei polisaccaridi nel paragrafo 7.3). Diluire il polisaccaride con acqua o soluzione salina aggiuntiva a 5 mg/ml.
- Ottenere un filtro centrifugo da 4 mL o 15 mL con il cutoff a peso molecolare appropriato (MWCO).
- Quando la soluzione di polisaccaride è preparata, raffreddare il tubo contenente la soluzione di polisaccaride in un secchiello del ghiaccio.
2. Preparare la soluzione di acido adipico 0,5 M di diidrazide (ADH), 10 mL.
- Pesare 0,87 g di ADH in una bilancia analitica e solubilizzare in 8 mL di 0,1 M HEPES (acido 4-(2-idrossietil)-1-piperazineetansolfonico), pH 8.
- Regolare il pH target con idrossido di sodio (NaOH) da 1 M, monitorato da un pHmetro. Portare a 10 ml con tampone aggiuntivo e ricon confermare il pH.
3. Preparare la soluzione DMAP da 2,5 M, 10 ml.
NOTA: DMAP è tossico e penetra nella pelle. Indossare guanti di nitrile durante l'esecuzione della procedura.
- Pesare attentamente 3 g di DMAP in un tubo conico da 50 ml. Aggiungere 5 ml di acqua al DMAP e mescolare vorticosamente per 5 minuti per ottenere una soluzione torbida (~ 7 mL).
- Durante la miscelazione, aggiungere incrementi di 50 μL di acido cloridrico 10 N (HCl) alla soluzione DMAP. Mescolare tra ogni aggiunta. Smetti di aggiungere quando la soluzione diventa chiara.
- Aggiungere 10 N NaOH con incrementi di 25 μL per portare la soluzione DMAP a ~pH 8.
- Portare la soluzione DMAP a 10 ml con acqua per dare una soluzione da 2,5 M.
- Ottimizzare il pH della soluzione DMAP da 2,5 M.
NOTA: il pH della soluzione DMAP cambia con la concentrazione e la forza ionica. Questo esercizio consiste nel mettere a punto lo stock DMAP da 2,5 M su un pH specifico in modo che quando viene miscelato con 10 volumi di polisaccaride, la soluzione risultante sia vicina al pH target per l'attivazione.- Preparare una serie di tubi da 1,5 mL contenenti 1 mL di acqua o la soluzione di NaCl, a seconda di quale sia stata utilizzata per preparare la soluzione di polisaccaride. Raffreddare i tubi sul ghiaccio.
- Aggiungere 100 μL di DMAP a un tubo refrigerato. Vortice e misurare il pH con un pHmetro. Quindi, scartare il tubo misurato.
- Se il pH misurato non è vicino al valore target, regolare il pH dello stock DMAP con 1 M NaOH o HCl a seconda dei casi. Ripetere i passaggi 3.5.2 e 3.5.3 fino a quando il pH misurato è vicino al pH target.
4. Preparare la soluzione stock di CDAP da 100 mg/mL
NOTA: la polvere di CDAP deve essere tenuta ben chiusa e conservata a -20 °C e lasciata arrivare a temperatura ambiente prima dell'apertura. Indossare guanti di nitrile durante l'esecuzione della procedura.
- Tarare un tubo microcentrifuga a scatto da 1,5 mL su una bilancia analitica. Usando una piccola spatola, pesare 10-140 mg di CDAP nel tubo. Si noti il peso effettivo di CDAP.
- Determinare il volume di acetonitrile necessario per preparare 100 mg/mL CDAP. Aprire l'acetonitrile in una cappa aspirante.
- Utilizzando un pipetto di volume appropriato, disegnare e rilasciare l'acetonitrile per equilibrare il suo vapore nella punta del pipetto. Attendere che il solvente goccioli fuori dalla punta del pipetto dopo alcuni secondi e prepararsi a trasferirlo direttamente sul tubo CDAP. Prelevare il volume calcolato di acetonitrile e trasferirlo direttamente sul tubo CDAP. Chiudi il cappuccio.
NOTA: L'acetonitrile può anche essere trasferito al tubo CDAP utilizzando una siringa Hamilton o un suo equivalente di dimensioni adeguate. - Vortice per solubilizzare completamente il CDAP. Posizionare il tubo CDAP in un secchiello per il ghiaccio.
NOTA: CDAP è stabile in acetonitrile al freddo. Le scorte solubili possono essere mantenute a -20 °C per >1 settimana. Tuttavia, è preferibile preparare nuove soluzioni CDAP.
5. Attivazione dei polisaccaridi e funzionalizzazione dell'idrazide
- Assicurarsi che tutti i seguenti elementi siano pronti e le soluzioni refrigerate su ghiaccio prima di iniziare l'attivazione: 2 ml di una soluzione di polisaccaride da 5 mg/mL in un contenitore a bocca larga a fondo piatto contenente una barra di agitazione, posta sopra un agitatore magnetico; 100 mg/mL di soluzione stock di CDAP; Soluzione stock DMAP da 2,5 M; un pHmetro con una sonda di pH semi-micro, come la sonda di diametro 6 mm, calibrata per 0 °C secondo le istruzioni del produttore; un pipetto da 100 μL pronto all'uso; un timer cancellato e pronto all'uso; una testa erogatrice autotitolatore posizionata o un pipetto da 10 μL pronto all'uso; Soluzione ADH da 0,5 M.
- Pre-regolare il pH del polisaccaride al pH target utilizzando DMAP.
- Posizionare la sonda di pH nella soluzione di polisaccaride e lasciarla nella soluzione durante l'intera procedura di attivazione.
- Trasferire 200 μL della soluzione stock di DMAP alla soluzione di polisaccaride mediante aggiunta a goccia sotto agitazione. Regolare il pH della soluzione al pH di attivazione target. Aggiungere 0,1 M HCl per abbassare il pH e 0,1 M NaOH per aumentare il pH. Evitare di superare il pH target di oltre 0,1 unità di pH e mantenere la reazione refrigerata in un bagno di acqua ghiacciata per tutta la durata dell'attivazione.
- Attivazione CDAP
- Pipetta 100 μL CDAP su e giù per equilibrare il vapore nella punta del pipetto. Trasferire 100 μL di CDAP alla soluzione di polisaccaride con agitazione.
NOTA: questa attivazione utilizza 1 mg di CDAP per 1 mg di polisaccaride come rapporto di partenza. Il rapporto può essere aumentato o diminuito quando si ottimizza l'attivazione. - Avviare il timer e monitorare la variazione di pH durante l'intera attivazione. Mantenere la reazione al pH target aggiungendo tempestivamente incrementi di 10 μL di 0,1 M NaOH alla reazione, con l'aiuto di un distributore autotitolatore (o pipet).
NOTA: Può aiutare a ridurre delicatamente il tempo di risposta del pH da mescolare con una sonda di pH. Il pH scende più rapidamente all'inizio e potrebbe essere necessario aggiungere il NaOH 0,1 M più frequentemente. Man mano che la reazione procede, la diminuzione del pH diventa più lenta e l'aggiunta diventa meno frequente. Il pH dovrebbe rimanere sostanzialmente invariato quando ci si avvicina al tempo di attivazione ottimale, che è di 10-15 minuti per l'attivazione del pH 9.
- Pipetta 100 μL CDAP su e giù per equilibrare il vapore nella punta del pipetto. Trasferire 100 μL di CDAP alla soluzione di polisaccaride con agitazione.
- Funzionalizzazione ADH
- Quando viene raggiunto il tempo di attivazione ottimale, aggiungere 2 ml di 0,5 M ADH tutto in una volta al polisaccaride attivato sotto agitazione. Verificare che il pH sia nell'intervallo target (pH 8-9 per ADH).
NOTA: Un'aggiunta con miscelazione rapida riduce al minimo la probabilità che entrambe le estremità del diidrazide reagiscano con il polisaccaride attivato, impedendo la reticolazione dei polisaccaridi. - Continuare a mescolare la miscela di reazione per almeno 1 ora. Trasferire la miscela di reazione a 4 °C, ma 0-20 °C è accettabile.
NOTA: la reazione di funzionalizzazione ADH non dipende fortemente dalla temperatura. Poiché il grande eccesso di diidrazide agisce come reagente di spegnimento, non è necessario estinguere ulteriormente il polisaccaride attivato. Tuttavia, quando si coniugano direttamente le proteine, la reazione deve essere placata, in genere con 1 M glicina, pH 8-9.
- Quando viene raggiunto il tempo di attivazione ottimale, aggiungere 2 ml di 0,5 M ADH tutto in una volta al polisaccaride attivato sotto agitazione. Verificare che il pH sia nell'intervallo target (pH 8-9 per ADH).
6. Purificazione del polisaccaride funzionalizzato ad ADH mediante dialisi
NOTA: Il prodotto grezzo della reazione di funzionalizzazione adH contiene un'alta concentrazione di ADH (0,5 M), che può essere rimosso in modo più efficiente mediante dialisi estesa. La filtrazione del gel, sia con una colonna che con un dispositivo di dissaldaggio spin, non è altrettanto efficiente, specialmente quando è necessario rimuovere il contaminante ADH residuo.
- Determinare il MWCO della membrana di dialisi. Utilizzare un cutoff di 3 kDa per polisaccaridi più piccoli.
NOTA: Il MWCO della membrana di dialisi è idealmente 5-10 volte più piccolo del MW di polisaccaride. - Scegliere il formato di dialisi desiderato (cassette o tubi) e la capacità corretta del dispositivo. Assicurarsi che la capacità del dispositivo sia 2 volte superiore al volume del campione. Consultare le istruzioni dei produttori per l'utilizzo del dispositivo.
- Idratare la membrana di dialisi in acqua prima dell'uso. Trasferire la soluzione di polisaccaride derivato grezzo al dispositivo di dialisi secondo le istruzioni del produttore.
NOTA: Indossare guanti in nitrile per evitare il contatto con DMAP. - Dialyze in un contenitore riempito con 2-4 L di 1 M NaCl e una barra di agitazione. Posizionare il contenitore su una piastra di agitazione in una cella frigorifera o all'interno di un frigorifero. Mescolare il dialisio delicatamente e continuamente durante la dialisi.
- Dopo aver dialiticizzato per almeno 4 ore, passare a 1 M NaCl fresco e dialisi per almeno 12 ore. Dialyze contro 2 cambi di 0,15 M salino, ciascuno per almeno 12 ore. Se lo si desidera, dialyze contro 2 cambi d'acqua.
- Verificare se tutto l'ADH viene rimosso testando il dialisi durante la notte utilizzando un rapido test TNBS.
- Ottenere 3 tubi di borosilicato, etichettarli rispettivamente come controllo negativo (ctrl), ctrl positivo e campione.
- Al tubo ctrl negativo, aggiungere 975 μL di borato 0,1 M, pH 9.
- Al tubo ctrl positivo, aggiungere 100 μL di 0,05 mM ADH (0,1 mM idrazide) e 875 μL di 0,1 M borato, pH 9.
- Alla provetta del campione, aggiungere 500 μL di dialisi durante la notte e 475 μL di borato 0,1 M, pH 9.
- Aggiungere 25 μL di TNBS all'1% a tutti e tre i tubi. Mescolare bene. Mettere al buio per 1 ora.
- Confronta l'intensità del colore dei 3 tubi in 1 ora. Assicurarsi che l'intensità del colore della provetta del campione sia compresa tra quella del ctrl positivo e del ctrl negativo, il che indica che il contaminante ADH è inferiore a 0,01 mM. Dialyze ancora una volta.
NOTA: È prudente ridurre il più possibile il livello del contaminante ADH in modo che l'idrazide ADH rappresenti meno dell'1% dell'idrazide totale nell'idrazide-polisaccaride purificato. - Recuperare il polisaccaride derivatizzato dalla dialisi. Determinare la concentrazione dei polisaccaridi e dell'idrazide. Calcolare il rapporto idrazide/polisaccaride (vedere paragrafo 7). Se il polisaccaride dializzato deve essere concentrato a 5-10 mg/ml, consultare paragrafo 1.2.
7. Analisi dei polisaccaridi derivati dall'idrazide
NOTA: Lo scopo dell'analisi qui descritta è determinare la concentrazione di polisaccaride, la concentrazione di idrazide e il livello di derivatizzazione dell'idrazide in termini di rapporto idrazide/polisaccaride.
- Preparazione del campione
NOTA: I polisaccaridi da dosare devono essere privi di impurità di carboidrati, ammine o idrazidi a basso peso molecolare. I campioni liofilizzati devono essere asciutti e privi di sale per garantire una misurazione accurata del peso. Di solito, ~ 1 mL di una soluzione da 1-2 mg / mL è adeguato per i test.- Pesare almeno 10 mg del campione di polisaccaride liofilizzato su una bilancia analitica, utilizzando una spatola non statica o un eliminatore statico. Sciogliere il polisaccaride in acqua o soluzione salina ad una concentrazione (ad esempio, 2 mg/mL) in modo che i segnali di dosaggio rientrino nell'intervallo lineare della curva standard.
- Mescolare end-over-end e lasciare abbastanza tempo affinché il campione si dissolva completamente. Eseguire l'idratazione durante la notte in base al peso molecolare del polisaccaride.
- Saggio dei polisaccaridi: metodo resorcinolo/acido solforico
NOTA: Il test appropriato per i polisaccaridi dipenderà dalla composizione dei carboidrati dei polimeri. Il saggio originale del resorcinolo/acido solforico era destinato agli zuccheri esosici10. Il test è stato modificato qui aumentando la temperatura della fase di riscaldamento da 90 °C a 140 °C. A questa temperatura più elevata, il saggio perde una certa specificità, ma può essere utilizzato per saggiare molti zuccheri. Tuttavia, è ancora necessario determinare l'idoneità del saggio per un particolare polisaccaride. I triplicati sono raccomandati per ogni punto, ma alcuni alloggi potrebbero essere necessari a causa della capacità del blocco riscaldante.- Preparare il 75% di acido solforico
NOTA: l'acido solforico concentrato è estremamente corrosivo e può causare gravi ustioni. Eseguire questa procedura in una cappa aspirante chimica. Versare sempre acido concentrato in acqua, non viceversa!- Aggiungere 50 ml di acqua a una bottiglia di vetro da 200 ml. Metti la bottiglia a bagnomaria fredda. Aggiungere lentamente 150 ml di acido solforico. Tappare la bottiglia in modo che sia ventilata.
- Lasciare che la soluzione si equilibra a temperatura ambiente. Utilizzare la soluzione entro 3 mesi.
- Preparare gli standard dei carboidrati
- Preparare la soluzione di polisaccaride non modificato a 1 mg/mL da utilizzare come standard. In alternativa, utilizzare una miscela di singoli zuccheri nel rapporto trovato nell'unità di ripetizione del polisaccaride, a 1 mg / mL della concentrazione totale di zucchero, come standard.
NOTA: Sebbene la miscela di zucchero di solito dia lo stesso risultato del polimero di carboidrati di identica composizione zuccherino, questo dovrebbe essere confermato sperimentalmente.
- Preparare la soluzione di polisaccaride non modificato a 1 mg/mL da utilizzare come standard. In alternativa, utilizzare una miscela di singoli zuccheri nel rapporto trovato nell'unità di ripetizione del polisaccaride, a 1 mg / mL della concentrazione totale di zucchero, come standard.
- Assicurarsi che il blocco riscaldante con supporti per tubi per provette in borosilicato 13 x 100 funzioni. Utilizzare un cuscinetto protettivo sotto e intorno al blocco riscaldante in caso di fuoriuscite di acido. Preriscaldare il blocco riscaldante a 140 °C per un minimo di 1 ora per ottenere una temperatura stabile e uniforme attraverso tutti i blocchi utilizzati.
- Etichetta 13 x 100 provette di borosilicato, triplicato per ogni standard e ogni campione. Aggiungere 0, 2,5, 5, 7,5, 10 μg (o μL) dello standard di carboidrati da 1 mg/mL ai tubi standard etichettati corrispondentemente. Aggiungere acqua a ciascun tubo per portare il volume a 100 μL.
NOTA: il colore generato dipende da zuccheri specifici. Poiché alcuni zuccheri richiedono più massa per generare l'intero intervallo di assorbanza, le quantità effettive utilizzate per la curva standard possono variare. - Impostare i saggi del campione aggiungendo un volume contenente ~ 5 μg del polisaccaride derivato a tre provette del campione e portare il volume totale a 100 μL con acqua. In alternativa, se la concentrazione di polisaccaridi nel campione è sconosciuta, eseguire una serie di diluizioni 4 volte. Test 100 μL di ogni diluizione in triplice copia.
- Preparare il resorcinolo fresco a 6 mg/mL in acqua deionizzata (dI) immediatamente prima dell'uso. Vortice fino a quando il resorcinolo è in soluzione. Aggiungere 100 μL di 6 mg/mL di resorcinolo a ciascun tubo.
- Versare con attenzione la quantità stimata di acido solforico al 75% in un piccolo becher.
NOTA: indossare un cappotto da laboratorio, guanti in nitrile e occhiali di sicurezza. Fai attenzione a gocciolamenti, fuoriuscite e schizzi. Tieni a portata di mano gli asciugamani di carta bagnati per pulire eventuali gocce. Poiché l'attività dell'acido solforico cambia con l'esposizione prolungata all'aria, utilizzare una miscela uniforme di acido solforico per l'intero test. - Utilizzando un pipettor ripetuto, aggiungere uniformemente 300 μL di acido solforico al 75% a ciascun tubo. Vortice i tubi vigorosamente per mescolare bene, puntando il tubo lontano mentre vortice. Posizionare i tubi in un blocco riscaldatore a un ritmo costante in ordine sequenziale. Una volta che tutti i tubi sono dentro, impostare immediatamente il timer per 3 minuti.
- A 3 minuti, rimuovere i tubi a un ritmo costante nello stesso ordine e posizionarli direttamente in un rack in un bagno di acqua ghiacciata. Lasciare i tubi fino a quando non sono ghiacciati. Rimuovere i tubi e lasciarli equilibrare a temperatura ambiente per ~ 5 minuti per evitare la condensa sulla cuvetta durante la lettura.
- Impostare uno spettrofotometro UV/VIS per leggere l'assorbanza a 430 nm utilizzando una cuvetta di lunghezza percorsa di 10 mm. Vuoto con un tubo standard zero. Leggi l'assorbanza di tutti i tubi a 430 nm.
NOTA: le cuvette di plastica usa e getta sono comode da usare. - Costruisci una curva standard tracciando μg di carboidrati standard rispetto a A430. Vedere la Figura 4 per una tipica curva standard che utilizza il glucosio come standard di riferimento.
- Utilizzare le provette di dosaggio del campione con valori A430 che rientrano nell'intervallo lineare della curva standard, calcolare la quantità di μg del polisaccaride sconosciuto nelle provette del campione dall'equazione della curva standard. Determinare la concentrazione del polisaccaride sconosciuto dal volume dell'ignoto aggiunto, tenendo conto delle diluizioni. Convertire la concentrazione in mg/mL o μM unità di ripetizione secondo necessità.
- Preparare il 75% di acido solforico
- Dosaggio dell'idrazide con acido trinitrobenzene solfonico (TNBS)
- Preparare lo 0,9% di NaCl contenente lo 0,02% di azide di sodio (tampone campione) sciogliendo 9 g di NaCl e 200 mg di azide di sodio in dI H2O per un volume finale di 1 L.
- Preparare 0,1 M di borato di sodio, pH 9 (tampone di saggio), mescolando 100 mL di borato di sodio 0,5 M, pH 9, con 400 mL di dI H2O. Confermare che il pH della soluzione è 9 ± 0,1; regolare se necessario.
- Preparare l'1% di TNBS diluendo 200 μL di soluzione di acido solfonico al 5% di 2,4,6-trinitrobenzene a 1 mL con dI H2O. Contrassegnare il tubo come TNBS all'1% e conservare a 4 °C al buio per una settimana.
- Preparare 50 mM di stock DI ADH (equivalente a 100 mM di idrazide).
- Pesare 871 mg di polvere di diirazide adipico (ADH) utilizzando una bilancia analitica. Sciogliere la polvere in un flacone di reagente aggiungendo il tampone del campione a 100 ml con l'aiuto di una bilancia del caricatore superiore.
- Etichettare la bottiglia come 100 mM hydrazide/50 mM ADH. Chiudere saldamente il flacone e conservare a 4 °C per 1 anno.
- Preparare gli standard di idrazide (0,1, 0,2, 0,3, 0,4, 0,5 e 0,6 mM di idrazide).
- Preparare i 6 standard di idrazide diluendo il calcio di idrazide da 100 mM con il buffer del campione con l'aiuto di una bilancia del caricatore superiore. Preparare 100 ml di ogni standard per ridurre al minimo l'errore di concentrazione. Chiudere ermeticamente le bottiglie e conservare a 4 °C per 1 anno.
- Impostazione delle reazioni di analisi
NOTA: il test TNBS viene eseguito ad un volume di reazione di 1 mL. Ogni provetta di dosaggio è composta da 100 μL di un campione (o di uno standard), 875 μL di tampone di saggio e 25 μL di soluzione TNBS all'1%. Tutte le reazioni di analisi (sia per i campioni che per gli standard) sono impostate in triplice copia.- Etichetta 3 tubi di vetro borosilicato (12 x 75 mm) per ogni standard, incluso lo standard zero. Ordinare e disporre i tubi standard in tube rack in ordine di concentrazione crescente. Utilizzare una micropipetta calibrata da 100 μL o 200 μL per aggiungere con precisione 100 μL degli standard a ciascun tubo corrispondente. Per lo standard zero, utilizzare 100 μL di buffer campione.
- Etichettare 3 tubi di vetro borosilicato (12 x 75 mm) per ogni campione diluito da testare. Ordinare e disporre le provette campione nel rack del tubo di conseguenza. Utilizzare una micropipetta calibrata da 100 μL o 200 μL per aggiungere con precisione 100 μL del campione a ciascuna provetta campione corrispondente.
- Utilizzare una micropipetta calibrata da 1000 μL per aggiungere con precisione 875 μL di tampone di analisi a tutti i tubi di analisi: gli standard e i campioni.
- Per avviare la reazione di analisi, utilizzare una micropipetta calibrata da 100 μL per aggiungere con precisione 25 μL di TNBS all'1% a ciascun tubo di analisi. Iniziare dalle provette standard zero, passare alle provette standard in ordine di concentrazione crescente, quindi alle provette campione secondo l'ordine predeterminato. Cambia i suggerimenti quando inizi un nuovo standard o un nuovo campione e mantieni il tempo speso per aggiungere TNBS a tutti i tubi entro 5 minuti.
- Vortice tutti i tubi di analisi per 2 s ad alta velocità o ad un'impostazione di velocità che consente al liquido all'interno del tubo di analisi di ruotare verso l'alto per raggiungere un'altezza di 1/2 pollice dall'apertura del tubo.
- Registrare l'ora di inizio del test e impostare il timer su 2 ore. Posizionare il rack del tubo di analisi al buio a temperatura ambiente per 2 ore. Quando il tempo è finito, vortice tutti i tubi ancora una volta e procedere alla raccolta dei dati.
- Raccolta dei dati
- Lasciare che lo spettrofotometro UV/VIS si riscaldi e che la linea di base si stabilizzi. Impostare la lunghezza d'onda di rilevamento a 500 nm per il test dell'idrazide. Utilizzare una cuvetta di quarzo da 1 mL di 1 cm di lunghezza di percorso per tutte le misurazioni di assorbanza per l'intero test.
- Avviare la raccolta dei dati trasferendo un test standard zero alla cuvetta; spegnere lo strumento (impostare l'assorbanza su zero).
- Eseguire una singola lettura su ciascun tubo e registrare i valori di assorbanza in una tabella dati. Rimuovere il liquido residuo dalla cuvetta prima di leggere un nuovo campione. Inizia dagli standard zero, passa agli standard di concentrazione crescente e poi ai campioni. Una volta avviato, eseguire tutti i passaggi in modo efficiente senza fermarsi e leggere tutti i tubi entro 10 minuti.
- Analisi dei dati di esempio
- Create una curva standard tracciando mM hydrazide standard rispetto a A500. Trova l'equazione della curva standard nella forma di y = ax + b, dove y rappresenta mM idrazide e x rappresenta A500. Vedere la Figura 4 per una curva standard tipica.
- Calcola l'idrazide mM nei campioni usando l'equazione della curva standard, regolando i fattori di diluizione. Scegliere solo le provette campione con valori A500 che rientrano nell'intervallo lineare della curva standard per il calcolo.
- Calcolare il rapporto molare di idrazide/polisaccaride usando l'equazione (1).
Idrazide/polisaccaride = h/ c × MW (1)
Dove h è l'idrazide mM, c è la concentrazione mg/mL del polisaccaride e MW è il peso molecolare del polisaccaride in kDa. - Calcolare la densità di etichettatura dell'idrazide per 100 kDa di polisaccaride usando l'equazione (2).
Densità di etichettatura per 100 kDa polisaccaride = h / c × 100 (2)
Dove h è l'idrazide mM e c è la concentrazione mg/mL del polisaccaride.
NOTA: Per comodità, i polisaccaridi possono essere considerati avere un peso molecolare di 100.000 dalton. Ciò consente di considerare una "densità di etichettatura" nel confrontare il livello di derivatizzazione di vari polisaccaridi. - Calcola la densità di etichettatura dell'idrazide come percentuale di peso ADH.
- Determinare la concentrazione effettiva di mg/mL di ADH utilizzando l'equazione (3).
mg/mL ADH = (mM idrazide / 1000) × 174 (3)
dove 174 è il MW di ADH. - Calcolare il peso % ADH utilizzando l'equazione (4).
peso % ADH = (mg/mL ADH) / (mg/mL polisaccaride) × 100 (4)
- Determinare la concentrazione effettiva di mg/mL di ADH utilizzando l'equazione (3).
Risultati
Per illustrare l'attivazione e la derivatizzazione di un polisaccaride utilizzando la chimica CDAP, il destrano è stato attivato a 0,25 e 0,5 mg cdAP/mg destrorsano. Per ogni reazione, una soluzione di destrano da 10 mg/mL in acqua è stata raffreddata su ghiaccio ed è stato aggiunto1/10 di volume di uno stock DMAP da 2,5 M (preparato come descritto al paragrafo 3). La soluzione finale è stata portata a pH 9 mediante l'aggiunta di 0,1 M NaOH in aliquote da 10 μL. La soluzione è stata refrigerata e mescolata, ha aggiunto CDAP, e il pH è stato mantenuto a pH 9 aggiungendo aliquote di 10 μL di 0,1 M NaOH per 15 minuti. Sono stati aggiunti solo 0,25 mL di 0,5 M ADH a pH 9 (meno della quantità abituale) e la reazione ha permesso di procedere durante la notte a 4 °C.
Il destrano etichettato è stato quindi dializzato sequenzialmente contro 1 M NaCl, 0,15 M NaCl e acqua come descritto nel paragrafo 6. L'ADH-destrano è stato quindi valutato per il destrorso utilizzando il saggio del resorcinolo/acido solforico (paragrafo 7.2). Una tipica curva standard che utilizza il glucosio come standard dello zucchero è mostrata nella Figura 4A. Il contenuto di idrazide è stato determinato utilizzando il test TNBS descritto al paragrafo 7.3. Una tipica curva standard dell'idrazide che utilizza ADH come standard è riportata nella Figura 4B.
I calcoli rappresentativi dall'attivazione del destrano ai due livelli di attivazione sono mostrati in Figura 4A,B. I dati sono presentati sia come idrazidi per 100 kDa di polimero destrano che come percentuale in peso di ADH a destrano, come descritto rispettivamente nei sezioni 7.9.3.4 e 7.9.3.5 nella Figura 4C. Il grado di derivatizzazione è approssimativamente raddoppiato quando il rapporto CDAP è stato raddoppiato.
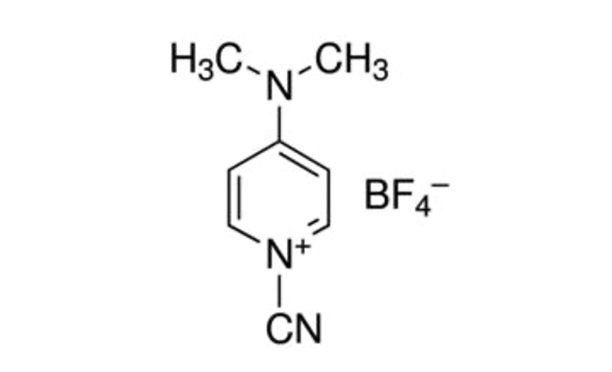
Figura 1: Struttura chimica del CDAP. CDAP = 1-ciano-4-dimetilamminopiridina tetrafluoroborato. Fare clic qui per visualizzare una versione più grande di questa figura.
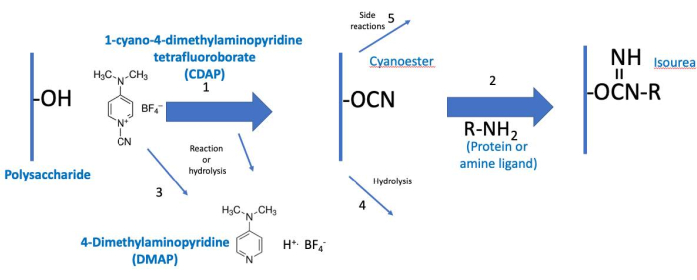
Figura 2: Processo di attivazione e coniugazione CDAP. Il processo è concettualmente diviso in due fasi, con il polisaccaride attivato comune ad entrambe. In condizioni di base, CDAP attiva idrossili polisaccaridi, rilasciando DMAP (reazione 1). L'idrolisi CDAP rilascia anche DMAP (reazione 3). Sebbene venga mostrato un ciano-estere, questo potrebbe non essere l'intermedio effettivo. L'intermedio è, quindi, indicato come polisaccaride "attivato" (CDAP). Durante la prima fase di attivazione, il polisaccaride attivato può idrolizzare (reazione 4) o subire reazioni collaterali (reazione 5). Nella seconda fase di coniugazione (reazione 2), il polisaccaride attivato reagisce con un'ammina per formare un legame isoureico stabile oltre alle reazioni 4 e 5. Abbreviazioni: CDAP = 1-ciano-4-dimetilamminopiridina tetrafluoroborato; DMAP = 4-dimetilamminopiridina; R-NH2 = ammina. Fare clic qui per visualizzare una versione più grande di questa figura.
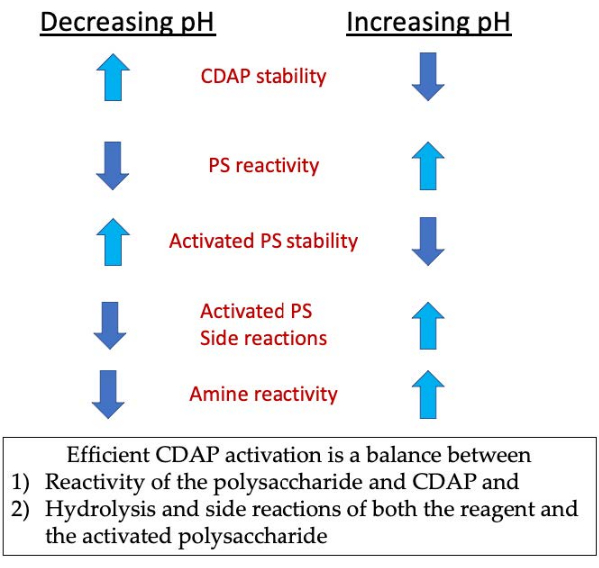
Figura 3: Attivazione e coniugazione CDAP. Il processo richiede il bilanciamento della reattività del CDAP con il polisaccaride, la stabilità del CDAP e del polisaccaride attivato, nonché la reattività del polisaccaride attivato con quella dell'ammina. Fare clic qui per visualizzare una versione più grande di questa figura.
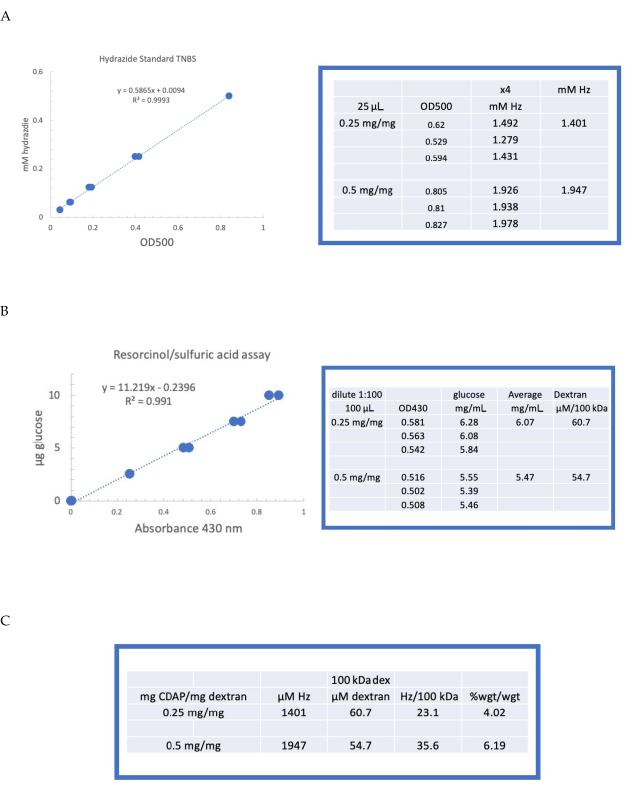
Figura 4: Risultati rappresentativi per l'attivazione CDAP del destrano. Curve standard tipiche per i saggi (A) resorcinolo/ acido solforico e (B) TNBS. Vengono mostrati i risultati del test per il destro attivato con 0,25 e 0,5 mg di CDAP/mg di destrano. Il glucosio è stato utilizzato come standard per il test del resorcinolo. Il destro, in mg/ml, è diviso per 100 kDa per dare una concentrazione molare. La concentrazione di idrazide è determinata utilizzando ADH come standard e i risultati espressi come μM Hz. (C) Calcolo dell'idrazide: rapporti destrano. Il livello di derivatizzazione è stato calcolato come idrazidi per 100 kDa di destrano per facilitare il confronto tra polimeri di diversi pesi molecolari medi. Il rapporto % peso di g ADH/g destrano è stato calcolato utilizzando un MW di 174 g/mole per ADH. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
CDAP è un reagente conveniente per derivare e coniugare polisaccaridi. Questo articolo descrive il metodo generale per utilizzare CDAP per derivare polisaccaridi con idrazidi (PS-ADH) e incorpora i miglioramenti pubblicati di recente8. In primo luogo, la tecnica sottolinea l'importanza di mantenere il pH target per controllare il processo di attivazione. Abbiamo scoperto che mentre molti buffer comuni interferiscono con la reazione di attivazione CDAP, DMAP potrebbe essere utilizzato con successo come buffer per gestire il pH8. Inoltre, DMAP è già un sottoprodotto di reazione dell'attivazione CDAP. Infine, il buffering della soluzione di polisaccaride con DMAP prima di aggiungere il CDAP facilita il targeting preciso e il mantenimento del pH di reazione. Come descriviamo, è utile regolare il pH della soluzione stock DMAP concentrata in modo tale che, una volta diluita, raggiunga il pH target. In secondo luogo, eseguire il processo al freddo ha rallentato il tempo di reazione, rendendo il processo di attivazione meno frenetico e più indulgente. La temperatura più bassa ha ridotto il tasso di idrolisi CDAP e il tempo di attivazione ottimale a pH 9 aumenta da ~ 3 min a ~ 15 min. Inoltre, è necessario meno CDAP per raggiungere lo stesso livello di attivazione rispetto a quando viene eseguito a temperatura ambiente.
I polisaccaridi derivati dall'ADH possono essere coniugati alle proteine usando carbodiimmidi (ad esempio, EDAC)7. Ad esempio, diversi vaccini autorizzati Haemophilus influenzae b (Hib) utilizzano il poliribosilribitolofosfato (PRP) derivato con ADH per coniugare al tossoide tetanico utilizzando EDAC. CNBr è stato inizialmente impiegato, ma CDAP è un reagente molto più facile da usare per questo scopo. Nella nostra esperienza, un buon intervallo target per la derivatizzazione dell'ADH è di 10-30 idrazidi per polisaccaride da 100 kDa o ~ 1-3% di ADH in peso.
Lo stesso processo può essere utilizzato per derivare polisaccaridi con ammine primarie sostituendo l'ADH con una diammina. Si consiglia di utilizzare esano diammina per derivare polisaccaridi con ammine8. Il polisaccaride aminato (PS-NH2) può essere coniugato utilizzando reagenti sviluppati per la coniugazione proteica11. Tipicamente, il PS-NH2 è derivato con una maleimmide (ad esempio, succinimidyl 4-[N-maleimidomethyl]cyclohexane-1-carboxylate (SMCC) o N-γ-maleimidobutyryl-oxysuccinimide ester (GMBS)), e la proteina è tiolata (ad esempio, con succinimidyl 3-(2-pyridyldithio)propionate (SPDP)). La chimica tiolo-maleimmide è molto efficiente.
Le proteine possono anche essere accoppiate direttamente ai polisaccaridi attivati da CDAP tramite l'ɛ-ammina sulle lisine. Mentre il protocollo di attivazione utilizzato è generalmente simile a quello qui descritto, è necessario ottimizzare il livello di attivazione, la concentrazione di polisaccaridi e proteine, nonché il rapporto proteina:polisaccaride5,6,8.
Il destro è uno dei polisaccaridi più facili da attivare con CDAP a causa della sua densità relativamente elevata di gruppi ossidrilici, ma alcuni polisaccaridi, come l'antigene Vi, possono essere impegnativi. Di conseguenza, non esiste un unico protocollo "migliore" per la coniugazione CDAP direttamente alle proteine. Suggeriamo prima di sviluppare un protocollo per raggiungere adeguati livelli di attivazione, come determinato dall'entità della derivatizzazione dell'idrazide, e quindi di procedere alla coniugazione proteica diretta al polisaccaride attivato da CDAP.
Divulgazioni
Andrew Lees è fondatore e proprietario di Fina Biosolutions. Detiene diversi brevetti relativi alla chimica CDAP e beneficia della licenza del know-how di chimica e coniugazione CDAP.
Riconoscimenti
Il lavoro qui descritto è stato finanziato da Fina Biosolutions LLC.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
Riferimenti
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon