需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
基于毛细管电泳的氢/氘交换,用于自上而下的质谱法对蛋白质进行构象表征
摘要
这里介绍的是基于毛细管电泳的氢/氘交换(HDX)方法与自上而下的质谱法相结合的方案。该方法通过同时进行差分HDX和电泳分离来表征不同蛋白质物种(包括不同状态的蛋白质和不同蛋白质形式)之间高阶结构的差异。
摘要
解决溶液中共存的多种蛋白质状态的构象非均质性仍然是蛋白质治疗药物表征和确定对生物学功能至关重要的构象过渡途径(从分子识别到酶催化)的主要障碍之一。氢/氘交换(HDX)反应与自上而下的质谱(MS)分析相结合,提供了一种以构象特异性方式表征蛋白质高阶结构和动力学的方法。该技术的构象分辨能力高度依赖于在完整蛋白质水平上分离蛋白质状态的效率,并最大限度地减少HDX反应期间残留的非氘代质子含量。
在这里,我们描述了HDX MS方法的基于毛细管电泳(CE)的变体,旨在提高构象分辨率。在这种方法中,蛋白质在毛细管电泳分离过程中通过氘代背景电解质溶液(BGE)迁移时进行HDX反应。在溶液中共存的不同蛋白质状态或蛋白质形式可以基于其不同的电荷大小比有效地分离。蛋白质和质子溶剂分子之间电泳迁移率的差异最大限度地减少了残留的非氘代溶剂,从而在HDX过程中产生了几乎完全的氘化环境。流通的微粒CE-MS界面允许与喷雾器出口处的淬灭和变性改性剂溶液快速混合后,对洗脱的蛋白质物种进行有效的电喷雾电离。在线自上而下的MS分析测量洗脱完好的完整蛋白质物种的全球氘化水平,随后测量其气相片段的氘化。本文在差分HDX系统中演示了这种方法,包括牛奶中共存的天然蛋白质变体。
引言
区分不同构象、结合或修饰状态的蛋白质物种并表征其结构差异对于监测这些参与生物事件的物种之间的转变途径非常重要,从分子识别到酶催化,并了解这些事件背后的机制。传统的生物物理技术由于分辨率不足和溶液中动态信息丢失等局限性而无法提供完整的解决方案。氢/氘交换与质谱(HDX MS)相结合是一种技术,通过蛋白质不稳定的氢原子之间的交换和故意引入的2 H 2O溶液中的2H之间的交换,用氘(2H)标记蛋白质的结构和构象特征。参与氢键或从蛋白质内部的溶剂中螯合的质子不易交换1.因此,由于可交换位点的交换速率高度依赖于其参与高阶结构,因此可以通过MS以高空间分辨率揭示蛋白质结构,该MS基于1H和2H之间的不同原子质量探测2H摄取的范围和速率。近几十年来,HDX MS已成为研究蛋白质构象和动力学的一种非常成功的技术2。
在HDX MS的经典自下而上方法中,不同构象,结合或修饰状态的蛋白质物种的集合在完整蛋白质水平上不分离的情况下进行蛋白水解,因此通过分析具有卷曲氘含量的所得蛋白水解片段来表征单个物种是不可行的。相反,在自上而下的方法中,不同的蛋白质状态或蛋白形式在MS扫描中掺入了不同的氘含量,从而产生完整蛋白质团块的多个分布。这允许通过使用适当的质量过滤器(例如四极杆)的质量选择对应于每个质量分布的离子的质量选择来分离单个物种,并在随后的串联MS分析3,4,5,6中表征其构象差异。然而,在该策略中分离蛋白质状态或蛋白形式的有效性受到其相应质量分布差异程度的限制。
毛细管电泳(CE)提供了一种基于其在溶液相中的不同电荷和流体动力学尺寸以高效率分离蛋白质种类的方法7。将CE与HDX相结合,可以在溶液相中额外分离蛋白质状态或蛋白形式。此外,CE毛细管体积小,允许利用完全氘代溶液作为背景电解质溶液(BGE),即电泳缓冲液,使毛细管成为蛋白质样品的HDX反应器。由于在电泳过程中蛋白质和质子试剂之间的电泳迁移率存在差异,在CE期间进行HDX会导致蛋白质分析物的几乎完全氘化环境,残留的非氘代含量最小,从而提高使用HDX数据进行结构分析的灵敏度。因此,我们开发了一种基于CE的差分HDX方法,结合自上而下的MS,以状态或蛋白形式特异性方式表征蛋白质高阶结构8。
本文通过详细说明材料制备,实验程序和数据分析的步骤来描述这种方法的方案。可能影响方法性能或数据质量的因素在简短的注释中列出。这里介绍的代表性结果包括不同蛋白质混合物的差异HDX数据和牛β-乳球蛋白(β-lg)的天然变体,牛奶中存在的主要乳清蛋白9。我们证明了β-lg的两个丰富变体(即A和B10,11)在基于CE的HDX期间的分离效率,再现性和2H标记性能,以及它们构象的变体特异性表征。
研究方案
注意:尽可能使用高效液相色谱(HPLC)级或MS级试剂,以最大限度地减少可能干扰MS分析的污染物。测量过程中不要徒手触摸CE-MS接口,以免因电泳电压或电喷雾电压而造成电击。
1. 材料准备
- 熔融石英毛细管改性用于CE
- 通过将HPC粉末(分子量[MW]:100 kDa)溶解在水中并在室温下在磁力搅拌器上连续搅拌约12小时或直到固体颗粒12完全消失,制备5%(w / w)羟丙基纤维素(HPC)溶液。用超声波检查器去除任何可见的气泡。
- 将约85厘米长的熔融石英玻璃毛细管(内径[ID]:50μm,外径[外径]:360μm)安装到CE仪器中。通过使用CE的自动进样器在40 psi的输注压力下连续注入有机溶剂(例如丙酮13)来冲洗毛细管10-15分钟。
- 使用自动进样器在40 psi的输注压力下用HPC溶液填充清洁的毛细管(通常需要约40分钟)。以40 psi的功率将空气注入充满HPC的毛细管中,以确保毛细管中的自由气流,这由浸入水中时从毛细管中喷出的气泡指示。
- 按照 图1所示的温度程序,在可编程温度烘箱(理想情况下是程序升温气相色谱仪的温度控制柱式烘箱)中用流经毛细管的氮气(25 psi)烘烤HPC涂层毛细管。
- 将烤箱冷却至室温,然后再取出毛细管。使用这种HPC修饰的毛细管进行CE分离。
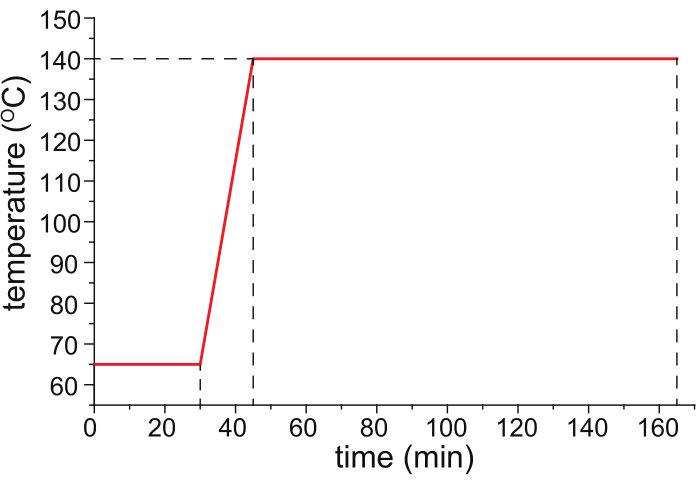
图 1:毛细管烘烤的推荐温度程序。请单击此处查看此图的大图。
- 背景电解质(BGE)溶液和改性剂溶液8
- 通过在2小时2O中溶解适量的乙酸铵,以所需浓度(例如,10 mM)制备1-10 mL BGE.将200μL等分试样BGE放入单独的BGE小瓶中,并用parafilm密封小瓶,以尽量减少BGE与空气中水蒸气之间的HDX反应。
- 用75%(v / v)甲醇和25%(v / v)水制备10 mL改性剂溶液,使用甲酸将pH调节至2.5。
注意:如果侧链中的氘原子和未受保护的主链酰胺应保留以供MS检测,则使用2 H 2O和氘代甲醇制备改性剂溶液。
- 蛋白质样品的脱盐
- 在非氘酸水中以所需浓度制备乙酸铵溶液。
注意:建议使用低于100 mM的浓度,以避免电泳过程中的高电流和由此产生的焦耳加热效应。 - 必要时使用甲酸(pH值<6.8)或氢氧化铵(pH值>6.8)将乙酸铵溶液的pH值调节到所需的水平。
- 用乙酸铵溶液(在非氘酸水中以所需浓度制备;用氢氧化铵调节至7.5)代替蛋白质溶液的原始缓冲液,使用具有适当MW截止的离心过滤器在4°C下至少五个顺序浓度和稀释步骤。
注意:要脱盐的蛋白质样品可以来自先前的生产程序(例如,纯化或配方)或通过溶解蛋白质的冻干粉末来制备。在此步骤中,要从样品溶液中除去的"盐"通常是指所有非挥发性的小离子或分子。虽然这些物质可以在电泳过程中有效地从蛋白质中分离出来,但建议使用此步骤以避免损害电泳分辨率,从而最大限度地减少质谱仪的污染。当蛋白质分析物应通过特定盐或添加剂稳定时,将它们包含在BGE中。 - 使用微量紫外可见分光光度计测定蛋白质浓度。
- 在非氘酸水中以所需浓度制备乙酸铵溶液。
2. 基于 CE 的 HDX MS 分析操作
注意:这种方法中使用的质谱仪应配备具有超高分辨率的质量分析仪,例如傅里叶变换离子回旋加速器共振(FTICR)或orbitrap,质量过滤器,例如允许质量选择前体离子进行碎片化的四极杆,以及电子转移解离(ETD)或电子捕获解离(ECD)功能,以使用可靠的串联MS数据(理想情况下同位素分辨的碎片信号)进行自上而下的分析。
- 优化 CE 和 MS 设置
- 使用标准电喷雾电离 (ESI) 源进行中试 MS 测量,方法是喷涂来自金属涂层硼硅酸盐玻璃毛细管的预加载样品("静态"nanoESI 方案)或来自金属发射器的连续注入样品,以优化用于测量完整蛋白质 (MS1) 及其气相片段 (MS2) 的 MS 设置。通过大规模选择其离子在单一电荷状态下的集合来片段感兴趣的蛋白质种类,然后是前体离子的ETD或ECD。
注意:基本设置包括影响脱溶的参数,前体离子的质量选择(以避免来自其他物种的干扰)和破碎效率。应增加质量选择窗口的中心和宽度,以匹配HDX后分析物离子的质量分布。由于CE中蛋白质物种的洗脱窗口通常为0.5分钟至2分钟,因此请根据在可比较的时间窗口中累积的MS2扫描来评估片段化效率。这些参数的最佳值是蛋白质特异性的;读者可参考先前发布的关于示例性设置的报告8,14。 - 使用配备光学检测器(即光电二极管阵列(PDA)检测器或紫外检测器)的CE仪器进行中试CE测量,以优化CE设置,以分离蛋白质种类和迁移时间,这相当于HDX反应时间。
注:此步骤是可选的,具体取决于 CE 光学检测器的可用性。在没有光学探测器的情况下,按照第2.3节中描述的说明,可以在完成第2.2节后使用CE-MS优化CE设置。基本设置包括影响分离效率的参数、电泳图中显示的峰形状和洗脱时间。
- 使用标准电喷雾电离 (ESI) 源进行中试 MS 测量,方法是喷涂来自金属涂层硼硅酸盐玻璃毛细管的预加载样品("静态"nanoESI 方案)或来自金属发射器的连续注入样品,以优化用于测量完整蛋白质 (MS1) 及其气相片段 (MS2) 的 MS 设置。通过大规模选择其离子在单一电荷状态下的集合来片段感兴趣的蛋白质种类,然后是前体离子的ETD或ECD。
- CE-HDX 设置的预处理
- 在室温下用超声处理50%甲醇,49%水和1%甲酸(v / v)的混合物清洁流通的微量VI-MS界面至少30分钟。
- 将HPC修饰的毛细管安装在CE仪器上后,使用自动进样器用BGE冲洗毛细管10分钟,并使毛细管充满BGE。
- 获得适当长度的未改性熔融石英毛细管(ID:50μm,OD:360μm)作为用于改性剂溶液的输注管。使用活接和适当的套筒将改性剂管连接到具有钝尖端的气密玻璃注射器,并使用输液泵用改性剂溶液冲洗管子至少10分钟。
- 将HPC涂层的CE毛细管和改性剂管的出口(已装载相应的溶液)插入清洁的CE-MS接口,如图 2所示。
- 手动或与输液泵一起推进用于改性剂输注的注射器,以确保改性剂溶液到达界面的尖端。将组装好的CE-MS接口安装在质谱仪的nanoESI源外壳上。
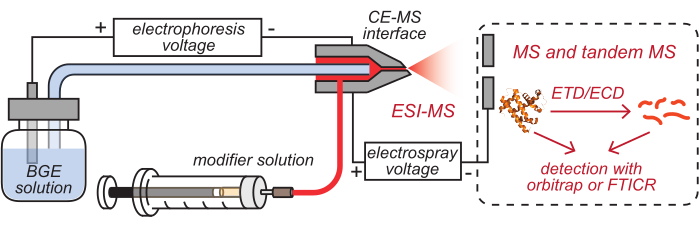
图 2:基于 CE 的 HDX MS 设置示意图。 此数字已从8 修改。缩写:BGE =背景电解质溶液;CE = 毛细管电泳;MS = 质谱;HDX = 氢/氘交换;ESI = 电喷雾电离;FTICR = 傅里叶变换离子回旋加速器共振;ETD = 电子转移解离;ECD = 电子俘获解离。 请点击此处查看此图的大图。
- 同时进行 CE 分离、HDX 反应和质谱分析
注意:建议在开封后1天内使用氘代BGE。- 将3-5 kV的喷雾电压施加到CE-MS接口上。
- 开始以0.1至10μL/min的流速将改性剂溶液注入输液泵,并确保在CE-MS接口的尖端进行稳定的电喷雾。
- 将含有BGE的样品瓶置于自动进样器中,并在步骤2.3.4中使用它来获取空白电泳图和空白质谱。
- 使用自动进样器以2 psi和适当的持续时间进样样品溶液,以允许进样所需量的样品。使用由等式(1)定义的注射量和注射参数15之间的关系来估计注射量。
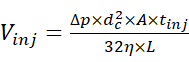 (1)
(1)
其中 Vinj 是注射量,Δp 是注射的压力, dc 是毛细管的内径, A 是毛细管的横截面, tinj 是注射的持续时间,η 是毛细管中液体的粘度, L 是毛细管的长度。 - 通过施加30 kV的电泳电压和0至2 psi的输注压力范围开始CE分离,并获取电泳图。同时,在色谱模式下开始采集MS数据,其中离子电流图是作为时间的函数获取的,并且相应的MS扫描不会自动组合成单个光谱。
注意:蛋白质在此步骤的电泳迁移过程中,在接触BGE中的2 H2O分子的点发生自发HDX反应。除了MS检测之外,还可以使用CE的光学检测。由于柱上检测需要在熔融石英毛细管的出口端去除一定长度的聚酰亚胺涂层,因此在组装CE-MS界面时应格外小心,以避免毛细管损坏。 - 保存空白电泳图和质谱作为参考。
注意:空白数据将用于故障排除,而不是基线减法。 - 将含有所需浓度蛋白质样品溶液的样品瓶放入自动进样器中。按照步骤2.3.4-2.3.5获取蛋白质样品的电泳图和质谱。收集足够数量的MS扫描以获得电泳分离的和 2个H标记蛋白质物种的MS1光谱。
- 在同一次游程中获取MS1光谱后或在随后的单独游程中,对感兴趣的物种进行串联MS测量。
- 必要时,通过改变输注压力或CE毛细管的长度来调整迁移时间/ HDX反应时间。如果HDX反应时间必须短于迁移时间,请使用前面描述的方法8,该方法在CE过程中在毛细管中同时使用氘代和非氘代BGE。
- 每次测量后,用BGE在20 psi的压力下冲洗CE毛细管至少10分钟。
- 实验完成后,清洁CE-MS接口和所有管道以进行存储。
- 在直接输注模式下使用MS获取HDX"终点"样品的数据集(可以使用前面描述的方法6,16制备)。
注意:仅当基于 CE 的 HDX 使用氘代改性剂解决方案时,才需要执行此步骤。
3. 数据分析
- CE数据分析
- 使用以下图之一作为电泳图来确定电泳特性,包括峰数,迁移时间和分离效率:(a)紫外吸光度与迁移时间,由CE仪器的光学检测器获取(如果可用);(b) MS获得的总离子电流(TIC)图;(c) MS获得的提取离子电流(EIC/XIC)图。
注:EIC/XIC在上述电泳图格式中通常提供最佳信噪比(S/N)。值得注意的是,即使在没有任何仪器偏差的情况下,虽然紫外吸光度与蛋白质的质量浓度成正比,但MS信号与摩尔浓度成正比。因此,观察CE和MS衍生的电泳图之间的峰模式差异是合理的。 - 使用电泳图中显示的峰的曲线下面积 (AUC) 进行半定量。对于涉及蛋白质复合物的样品,使用前面描述的方法17 从TIC / EIC电泳图中推导出质量浓度数据。
- 使用以下图之一作为电泳图来确定电泳特性,包括峰数,迁移时间和分离效率:(a)紫外吸光度与迁移时间,由CE仪器的光学检测器获取(如果可用);(b) MS获得的总离子电流(TIC)图;(c) MS获得的提取离子电流(EIC/XIC)图。
- 质谱数据分析
- 通过分别在相应的洗脱窗口内采集的MS1和MS2扫描,获得MS1和MS2光谱。
- 通过以下两种方法之一确定完整蛋白质(M (完整蛋白质))和片段的质量。
- 计算产生同位素分辨信号簇的离子的平均质量。
- 使用由相应同位素包络 6 的拟合产生的高斯样曲线的中心。
- 使用Biopharma Finder,ProSight18或MASH Suite19 等软件来生成碎片离子的质量列表并识别它们。
- HDX 数据分析
- 使用等式(2)确定完整蛋白质物种的总体氘化水平。
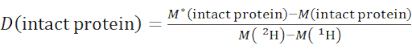 (二)
(二)
其中 M (2H) 或 M (1H) 是 2H 或 1H 的原子量。星号表示 2个H标记样品的数据。 - 确定特定节段的骨架酰胺的累积保护或累积氘。
- 对于使用氘代修饰剂溶液获取的数据,请使用方程(3)和(4)来确定累积保护级别。
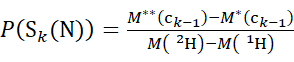 (3)
(3)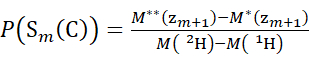 (4)
(4)
其中 P(Sk(N))是跨越残基1到 k的N端链段的总保护, P(Sm(C))是包含 m 残基的C端段的总保护, M (2H)或 M (1H)是 2H或 1H的原子量, M (ci)或 M (zi)是ci 或zi 离子的分子量。
注意:双星号表示 HDX"终结点"示例的数据。 - 对于使用非氘代修饰剂溶液获取的数据,使用方程(5)和(6)来确定累积氘化水平。
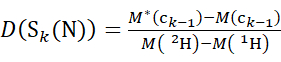 (5)
(5)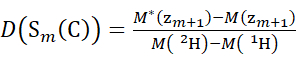 (6)
(6)
其中 D(Sk(N))是跨越残基1至 k的N端段的累积氘摄取; D(Sm(C))是包含 m 个残基的C端段的累积氘摄取。
- 对于使用氘代修饰剂溶液获取的数据,请使用方程(3)和(4)来确定累积保护级别。
- 确定局部主链酰胺组的氘水平
- 对于使用氘代修饰剂溶液获取的数据,请使用等式 (7)、(8)、(9)、(10) 和 (11) 来确定局部保护级别。
用于从 c 离子推导出的数据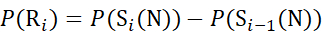 (7)
(7)
用于从 z 离子推导出的数据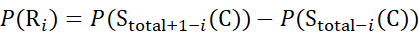 (8)
(8)
其中 P(Ri)是残基 i处主链酰胺的保护,下标"total"表示蛋白质的总残基数。
对于后续片段离子缺失的残基位点,使用方程(9)和(10)分配P(Ri)。
用于从 c 离子推导出的数据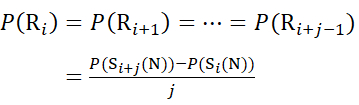 (9)
(9)
用于从 z 离子推导出的数据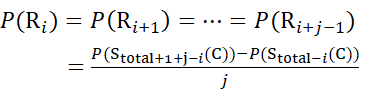 (10)
(10)
然后,使用等式(11)确定局部骨架酰胺基团处的氘化水平D(Ri)。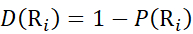 (11)
(11) - 对于使用非氘代修饰剂溶液获取的数据,请使用方程 (12)、(13)、(14) 和 (15) 来确定局部保护级别。
用于从 c 离子推导出的数据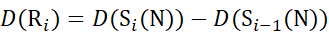 (12)
(12)
用于从 z 离子推导出的数据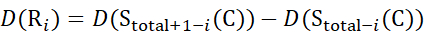 (13)
(13)
其中 D(Ri)是残基 i处主链酰胺的保护,下标"总计"表示蛋白质的总残基数。
对于后续片段离子缺失的残基位点,使用方程(14)和(15)分配D(Ri)。
用于从 c 离子推导出的数据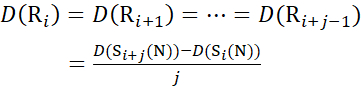 (14)
(14)
用于从 z 离子推导出的数据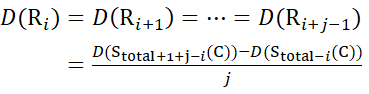 (15)
(15)
- 对于使用氘代修饰剂溶液获取的数据,请使用等式 (7)、(8)、(9)、(10) 和 (11) 来确定局部保护级别。
- 使用等式(2)确定完整蛋白质物种的总体氘化水平。
结果
改变BGE的输注压力可以调整分离效率和迁移时间,这相当于要分离的蛋白质的HDX反应时间(图3)。较低的输注压力导致以实验持续时间为代价更好地分离CE峰(图3A)。较长的迁移/ HDX反应时间导致蛋白质分析物的更高水平的氘化(图3B-D)。在 HDX 分钟时间尺度上,氘变差异应主要反映结构受保护站点(?...
讨论
涂覆CE毛细管内壁的目标包括在CE过程中最小化电渗流和蛋白质吸收13。虽然电渗流有利于传统的小分子CE分析,因为它能够将中性或带相反电荷的物质驱动到检测器,但它会损害溶液中具有相似尺寸和净电荷的蛋白质物种的分离效率。用HPC涂覆毛细管可最大限度地减少由毛细管内壁上的硅烷醇基团引起的电渗流。此外,掩盖这些硅醇基团减少了它们与蛋白质的相互作用,避免了?...
披露声明
D. D. Y. Chen是生物分子健康知识研究所的创始人之一,该研究所正在将流通的微病毒CE-MS接口商业化。其他作者没有什么可披露的。
致谢
这项工作得到了国家自然科学基金(NSFC 21974069)的资助。作者还得到了中国深圳湾实验室细胞分析研究所的支持。江苏省生物医用功能材料协同创新中心;南京师范大学江苏省生物医用材料重点实验室。
材料
| Name | Company | Catalog Number | Comments |
| ammonium acetate | Fisher Chemical | A/3446/50 | ≥99% |
| CESI 8000 plus capillary electrophoresis system | Sciex, USA | ||
| centrifuge | Eppendorf | 5406000097 | |
| centrifugal filter | Merck | UFC201024 | 10 kDa cutoff |
| deuterium oxide | Energy Chemical | E090001 | 99.9 % D |
| formic acid | Acros Organics | 270480250 | |
| fused silica glass capillary | Polymicro Technologies | 1068150017 | ID 50μm, OD 360μm |
| gas chromatography | Agilent | GC6890N | |
| hydrochloric acid | Sigma Aldrich | 258148 | |
| hydroxypropyl cellulose | Aladdin | H113415 | MW 100000 |
| magnetic stirrers | DLAB | 8030101212 | |
| methanol | Fisher Chemical | A456-4 | MS grade |
| microvolume UV-Vis spectrophotometer | DeNovix | 84677JK7731 | |
| myoglobin | Sigma Aldrich | M1882 | |
| Orbitrap Fusion Lumos mass spectrometer | Thermo Fisher Scientific, USA | ||
| PA 800 Plus Pharmaceutical Analysis CE System | Beckman Coulter, USA | ||
| Q Exactive UHMR mass Spectrometer | Thermo Fisher Scientific, Germany | ||
| sodium hydroxide | Sigma Aldrich | S5881 | |
| ubiquitin | Sigma Aldrich | U6253 | |
| ultrasonicator | SCIENTZ | SB-5200 | |
| β-lactoglobulin | Sigma Aldrich | L0130 | |
参考文献
- Kaltashov, I. A., Bobst, C. E., Pawlowski, J., Wang, G. Mass spectrometry-based methods in characterization of the higher order structure of protein therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 184, 113169 (2020).
- Engen, J. R., Botzanowski, T., Peterle, D., Georgescauld, F., Wales, T. E. Developments in hydrogen/deuterium exchange mass spectrometry. Analytical Chemistry. 93 (1), 567-582 (2021).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Conformer-specific hydrogen exchange analysis of Abeta(1-42) oligomers by top-down electron capture dissociation mass spectrometry. Analytical Chemistry. 83 (13), 5386-5393 (2011).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Structure and dynamics of small soluble Abeta(1-40) oligomers studied by top-down hydrogen exchange mass spectrometry. Biochemistry. 51 (17), 3694-3703 (2012).
- Pan, J., Borchers, C. H. Top-down structural analysis of posttranslationally modified proteins by Fourier transform ion cyclotron resonance-MS with hydrogen/deuterium exchange and electron capture dissociation. Proteomics. 13 (6), 974-981 (2013).
- Wang, G., Abzalimov, R. R., Bobst, C. E., Kaltashov, I. A. Conformer-specific characterization of nonnative protein states using hydrogen exchange and top-down mass spectrometry. Proceedings of the National Academy of Sciences of the United. States of America. 110 (50), 20087-20092 (2013).
- Mironov, G. G., Clouthier, C. M., Akbar, A., Keillor, J. W., Berezovski, M. V. Simultaneous analysis of enzyme structure and activity by kinetic capillary electrophoresis-MS. Nature Chemical Biology. 12 (11), 918-922 (2016).
- Shen, Y., Zhao, X., Wang, G., Chen, D. D. Y. Differential hydrogen/deuterium exchange during proteoform separation enables characterization of conformational differences between coexisting protein states. Analytical Chemistry. 91 (6), 3805-3809 (2019).
- Kontopidis, G., Holt, C., Sawyer, L. Invited review: β-lactoglobulin: binding properties, structure, and function. Journal of Dairy Science. 87 (4), 785-796 (2004).
- Qin, B. Y., et al. Structural basis of the Tanford transition of bovine β-lactoglobulin. Biochemistry. 37 (40), 14014-14023 (1998).
- Qin, B. Y., Bewley, M. C., Creamer, L. K., Baker, E. N., Jameson, G. B. Functional implications of structural differences between variants A and B of bovine beta-lactoglobulin. Protein Science. 8 (1), 75-83 (1999).
- Wang, L., et al. High resolution capillary isoelectric focusing mass spectrometry analysis of peptides, proteins, and monoclonal antibodies with a flow-through microvial interface. Analytical Chemistry. 90 (15), 9495-9503 (2018).
- Busch, M. H. A., Kraak, J. C., Poppe, H. Cellulose acetate-coated fused-silica capillaries for the separation of proteins by capillary zone electrophoresis. Journal of Chromatography A. 1695 (2), 287-296 (1995).
- Zhao, X., Shen, Y., Tong, W., Wang, G., Chen, D. D. Y. Deducing disulfide patterns of cysteine-rich proteins using signature fragments produced by top-down mass spectrometry. Analyst. 143 (4), 817-823 (2018).
- Sutera, S. P., Skalak, R. The history of Poiseuille's law. Annual Review of Fluid Mechanics. 25 (1), 1-20 (1993).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Wang, G., Johnson, A. J., Kaltashov, I. A. Evaluation of electrospray ionization mass spectrometry as a tool for characterization of small soluble protein aggregates. Analytical Chemistry. 84 (3), 1718-1724 (2012).
- Fellers, R. T., et al. ProSight Lite: graphical software to analyze top-down mass spectrometry data. Proteomics. 15 (7), 1235-1238 (2015).
- Cai, W., et al. MASH Suite Pro: A comprehensive software tool for top-down proteomics. Molecular & Cellular Proteomics. 15 (2), 703-714 (2016).
- Paterson, G. R., Hill, J. P., Otter, D. E. Separation of β-lactoglobulin A, B and C variants of bovine whey using capillary zone electrophoresis. Journal of Chromatography A. 700 (1), 105-110 (1995).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Nicolardi, S., et al. On-line electrochemical reduction of disulfide bonds: improved FTICR-CID and -ETD coverage of oxytocin and hepcidin. Journal of the American Society for Mass Spectrometry. 24 (12), 1980-1987 (2013).
- Adhikari, S., Xia, Y., McLuckey, S. A. Top-down analysis of disulfide-linked proteins using photoinduced radical reactions and ET-DDC. International Journal of Mass Spectrometry. 444, 116173 (2019).
- Rush, M. J. P., Riley, N. M., Westphall, M. S., Coon, J. J. Top-down characterization of proteins with intact disulfide bonds using activated-ion electron transfer dissociation. Analytical Chemistry. 90 (15), 8946-8953 (2018).
- Zhong, X., Maxwell, E. J., Chen, D. D. Y. Mass transport in a micro flow-through vial of a junction-at-the-tip capillary electrophoresis-mass spectrometry interface. Analytical Chemistry. 83 (12), 4916-4923 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。