Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Methods Article
Kapillarelektrophorese-basierter Wasserstoff/Deuterium-Austausch zur Konformationscharakterisierung von Proteinen mit Top-down-Massenspektrometrie
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll für einen Kapillarelektrophorese-basierten Wasserstoff/Deuterium-Austausch (HDX)-Ansatz in Verbindung mit Top-Down-Massenspektrometrie vorgestellt. Dieser Ansatz charakterisiert den Unterschied in Strukturen höherer Ordnung zwischen verschiedenen Proteinspezies, einschließlich Proteinen in verschiedenen Zuständen und verschiedenen Proteoformen, indem er gleichzeitig differentielle HDX- und elektrophoretische Trennung durchführt.
Zusammenfassung
Die Auflösung der Konformationsheterogenität mehrerer Proteinzustände, die in Lösung koexistieren, bleibt eines der Haupthindernisse bei der Charakterisierung von Proteintherapeutika und der Bestimmung der für biologische Funktionen kritischen Konformationsübergangswege, die von der molekularen Erkennung bis zur enzymatischen Katalyse reichen. Die Reaktion auf Wasserstoff/Deuterium-Austausch (HDX) in Verbindung mit der top-down-Massenspektrometrie (MS) bietet ein Mittel, um Proteinstrukturen und -dynamiken höherer Ordnung konformitätsspezifisch zu charakterisieren. Das Konformationsauflösungsvermögen dieser Technik hängt stark von den Wirkungsgraden der Trennung von Proteinzuständen auf intakter Proteinebene und der Minimierung des verbleibenden nicht deuterierten Protikgehalts während der HDX-Reaktionen ab.
Hier beschreiben wir eine auf Kapillarelektrophorese (CE) basierende Variante des HDX MS-Ansatzes, die darauf abzielt, die Konformationsauflösung zu verbessern. Bei diesem Ansatz durchlaufen Proteine HDX-Reaktionen, während sie während der kapillaren elektrophoretischen Trennung durch eine deuterierte Hintergrundelektrolytlösung (BGE) wandern. Verschiedene Proteinzustände oder Proteoformen, die in Lösung koexistieren, können aufgrund ihrer unterschiedlichen Ladungs-zu-Größe-Verhältnisse effizient getrennt werden. Der Unterschied in der elektrophoretischen Mobilität zwischen Proteinen und protischen Lösungsmittelmolekülen minimiert das verbleibende nicht deuterierte Lösungsmittel, was zu einer nahezu vollständigen Deuterationsumgebung während des HDX-Prozesses führt. Die durchströmende mikroviale CE-MS-Grenzfläche ermöglicht eine effiziente Elektrosprayionisation der eluierten Proteinspezies nach einer schnellen Vermischung mit der Abschreck- und Denaturierungsmodifikatorlösung am Ausgang des Sprühgeräts. Die Online-Top-Down-MS-Analyse misst das globale Deuterationsniveau der eluierten intakten Proteinspezies und anschließend die Deuteration ihrer Gasphasenfragmente. Dieses Papier demonstriert diesen Ansatz in differentiellem HDX für Systeme, einschließlich der natürlichen Proteinvarianten, die in Milch koexistieren.
Einleitung
Die Unterscheidung von Proteinspezies in verschiedenen Konformations-, Bindungs- oder Modifikationszuständen und die Charakterisierung ihrer strukturellen Unterschiede sind wichtig, um die Wege der Übergänge zwischen diesen Spezies zu überwachen, die an biologischen Ereignissen beteiligt sind, von der molekularen Erkennung bis zur enzymatischen Katalyse, und um die Mechanismen zu verstehen, die diesen Ereignissen zugrunde liegen. Herkömmliche biophysikalische Techniken bieten aufgrund der Einschränkungen wie unzureichende Auflösung und Verlust dynamischer Informationen in der Lösung keine vollständige Lösung. Der Wasserstoff/Deuterium-Austausch in Verbindung mit der Massenspektrometrie (HDX MS) ist eine Technik, die die Struktur- und Konformationsmerkmale von Proteinen mit Deuterium (2 H) über den Austausch zwischen labilen Wasserstoffatomen von Proteinen und 2 H aus der absichtlich eingeführten 2H2O-Lösung markiert. Protonen, die an der Wasserstoffbrückenbindung beteiligt sind oder die aus dem Lösungsmittel im Proteininneren sequestriert werden, tauschen nicht leicht1 aus. Da die Wechselkursrate an einem austauschbaren Ort stark von seiner Beteiligung an Strukturen höherer Ordnung abhängt, können die Proteinstrukturen mit hoher räumlicher Auflösung von MS aufgedeckt werden, die das Ausmaß und die Rate der 2-H-Aufnahme basierend auf den unterschiedlichen Atommassen zwischen 1H und 2H untersucht. HDX MS hat sich in den letzten Jahrzehnten zu einer herausragend erfolgreichen Technik zur Untersuchung von Proteinkonformationen und -dynamikenentwickelt 2.
Beim klassischen Bottom-up-Ansatz von HDX MS wird das Ensemble von Proteinspezies in verschiedenen Konformations-, Bindungs- oder Modifikationszuständen ohne Trennung auf intakter Proteinebene proteolysiert, so dass es nicht möglich ist, einzelne Spezies durch Analyse der resultierenden proteolytischen Fragmente mit konvolutem Deuteriumgehalt zu charakterisieren. Im Gegensatz dazu führen beim Top-Down-Ansatz verschiedene Proteinzustände oder Proteoformen, die unterschiedliche Deuteriumgehalte eingebaut haben, zu einer Mehrfachverteilung intakter Proteinmassen in einem MS-Scan. Dies ermöglicht die Trennung einzelner Spezies durch Massenselektion von Ionen entsprechend jeder Massenverteilung unter Verwendung eines geeigneten Massenfilters (z. B. eines Quadrupols) und die Charakterisierung ihrer Konformationsunterschiede in der anschließenden Tandem-MS-Analyse 3,4,5,6. Die Effizienz der Trennung von Proteinzuständen oder Proteoformen in dieser Strategie ist jedoch durch das Ausmaß der Differenz in ihren entsprechenden Massenverteilungen begrenzt.
Die Kapillarelektrophorese (CE) bietet die Möglichkeit, Proteinspezies basierend auf ihren unterschiedlichen Ladungen und hydrodynamischen Größen in der Lösungsphase mit hohem Wirkungsgradzu trennen 7. Die Kombination von CE mit HDX bietet eine zusätzliche Trennung von Proteinzuständen oder Proteoformen in der Lösungsphase. Darüber hinaus ermöglicht das geringe Volumen der CE-Kapillare die Verwendung einer vollständig deuterierten Lösung als Hintergrundelektrolytlösung (BGE), d. H. Der laufende Puffer, wodurch die Kapillare als HDX-Reaktor für Proteinproben dient. Aufgrund des Unterschieds in der elektrophoretischen Mobilität zwischen Proteinen und protischen Reagenzien im Elektrophoreseprozess führt die Durchführung von HDX während der CE zu einer nahezu vollständigen Deuterationsumgebung für die Proteinanalyten mit minimalen verbleibenden nicht deuterierten Inhalten, wodurch die Empfindlichkeit der Strukturanalyse unter Verwendung von HDX-Daten erhöht wird. Daher entwickelten wir einen CE-basierten differentiellen HDX-Ansatz in Verbindung mit Top-Down-MS, um Proteinstrukturen höherer Ordnung auf zustands- oder proteoformspezifische Weise zu charakterisieren8.
Dieses Papier beschreibt Protokolle für diesen Ansatz, indem die Schritte der Materialvorbereitung, des experimentellen Verfahrens und der Datenanalyse detailliert beschrieben werden. Faktoren, die sich auf die Methodenleistung oder die Datenqualität auswirken können, sind in kurzen Anmerkungen aufgeführt. Zu den repräsentativen Ergebnissen, die hier vorgestellt werden, gehören differentielle HDX-Daten von Mischungen verschiedener Proteine und natürlichen Varianten von Rinder-β-Lactoglobulin (β-lg), dem wichtigsten Molkenprotein in Milch9. Wir demonstrieren die Trenneffizienz, Reproduzierbarkeit und 2-H-Markierungsleistung der beiden reichlich vorhandenen Varianten von β-lg, d.h. A und B10,11 während der CE-basiertenHDX und variantenspezifischen Charakterisierung ihrer Konformationen.
Protokoll
HINWEIS: Verwenden Sie nach Möglichkeit Hochleistungsreagenzien in Flüssigkeitschromatographie (HPLC) oder MS-Qualität, um die Verunreinigungen zu minimieren, die die MS-Analyse beeinträchtigen können. Berühren Sie die CE-MS-Schnittstelle während der Messung nicht mit bloßen Händen, um die Möglichkeit eines elektrischen Schlags zu vermeiden, der entweder durch die elektrophoretische Spannung oder die Elektrosprayspannung verursacht wird.
1. Materialaufbereitung
- Modifikation der Kapillare für Quarzglas für CE
- Eine 5%ige (w/w) Hydroxypropylcellulose (HPC)-Lösung wird hergestellt, indem HPC-Pulver (Molekulargewicht [MW]: 100 kDa) in Wasser unter kontinuierlichem Rühren bei Raumtemperatur auf einem Magnetrührer für ~12 h oder bis zum vollständigen Verschwinden fester Partikel12 gelöst wird. Entfernen Sie alle sichtbaren Luftblasen mit einem Ultraschallgerät.
- Montieren Sie eine Kapillare aus Quarzglas (Innendurchmesser [ID]: 50 μm, Außendurchmesser [OD]: 360 μm) von ca. 85 cm Länge in ein CE-Instrument. Spülen Sie die Kapillare, indem Sie kontinuierlich ein organisches Lösungsmittel wie Aceton13 infundieren, indem Sie den Autosampler von CE bei einem Infusionsdruck von 40 psi für 10-15 min verwenden.
- Füllen Sie die gereinigte Kapillare mit HPC-Lösung mit dem Autosampler bei einem Infusionsdruck von 40 psi (was oft ~ 40 Minuten dauert). Gießen Sie Luft mit 40 psi in die HPC-gefüllte Kapillare, um einen freien Luftstrom in der Kapillare zu gewährleisten, der durch die Luftblasen angezeigt wird, die beim Eintauchen in Wasser aus der Kapillare ausgestoßen werden.
- Backen Sie die HPC-beschichtete Kapillare in einem temperaturprogrammierbaren Ofen (idealerweise dem temperaturgesteuerten Säulenofen eines temperaturprogrammierten Gaschromatographen) mit Stickstoffgas (25 psi), das durch die Kapillare fließt, und folgen Sie dem in Abbildung 1 gezeigten Temperaturprogramm.
- Kühlen Sie den Ofen auf Raumtemperatur ab, bevor Sie die Kapillare herausnehmen. Verwenden Sie diese HPC-modifizierte Kapillare für die CE-Trennung.
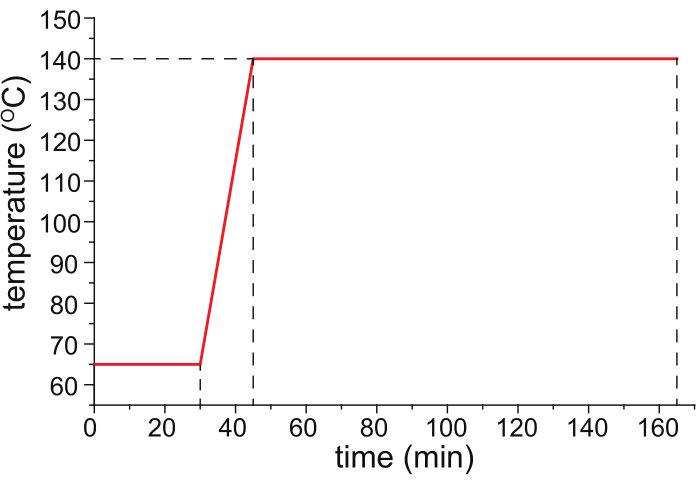
Abbildung 1: Ein empfohlenes Temperaturprogramm für das Kapillarbacken. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Hintergrundelektrolytlösung (BGE) und Modifikatorlösung8
- Bereiten Sie 1-10 mL BGE in der gewünschten Konzentration (z. B. 10 mM) vor, indem Sie die entsprechende Menge Ammoniumacetat in 2H2O auflösen. 200 μL-Aliquots BGE in separate BGE-Durchstechflaschen geben und die Durchstechflaschen mit Parafilm versiegeln, um die HDX-Reaktion zwischen BGE und Wasserdampf in der Luft zu minimieren.
- Bereiten Sie 10 ml einer Modifikatorlösung mit 75% (v/v) Methanol und 25% (v/v) Wasser vor, wobei der pH-Wert mit Ameisensäure auf 2,5 eingestellt ist.
HINWEIS: Verwenden Sie 2H2O und deuteriertes Methanol, um die Modifikatorlösung herzustellen, wenn die Deuteriumatome in den Seitenketten und ungeschützten Rückgratamiden für den Nachweis durch MS aufbewahrt werden sollten.
- Entsalzung von Eiweißproben
- Bereiten Sie eine Ammoniumacetatlösung in nicht deuteriertem Wasser in der gewünschten Konzentration vor.
HINWEIS: Eine Konzentration von weniger als 100 mM wird empfohlen, um einen hohen elektrischen Strom während der Elektrophorese und den daraus resultierenden Joule-Erwärmungseffekt zu vermeiden. - Bei Bedarf ist der pH-Wert der Ammoniumacetatlösung mit Ameisensäure (für pH < 6,8) oder Ammoniumhydroxid (für pH > 6,8) auf das gewünschte Niveau einzustellen.
- Ersetzen Sie die ursprünglichen Puffer der Proteinlösung durch eine Ammoniumacetatlösung (hergestellt in nicht deuteriertem Wasser in der gewünschten Konzentration; pH-Wert eingestellt auf 7,5 mit Ammoniumhydroxid) durch mindestens fünf aufeinanderfolgende Konzentrationen und Verdünnungsschritte bei 4 °C unter Verwendung eines Zentrifugalfilters mit einem geeigneten MW-Grenzwert.
HINWEIS: Die zu entsalzenden Proteinproben können entweder aus früheren Produktionsverfahren (z. B. Reinigung oder Formulierung) stammen oder durch Lösen des lyophilisierten Proteinpulvers hergestellt werden. Die "Salze", die in diesem Schritt aus den Probenlösungen entfernt werden sollen, beziehen sich im Allgemeinen auf alle kleinen Ionen oder Moleküle, die nicht flüchtig sind. Obwohl diese Spezies während des Elektrophoreseprozesses effizient von Proteinen getrennt werden können, wird dieser Schritt empfohlen, um eine Beeinträchtigung der elektrophoretischen Auflösung zu vermeiden und somit die Kontamination des Massenspektrometers zu minimieren. Wenn Proteinanalyten durch bestimmte Salze oder Zusatzstoffe stabilisiert werden sollen, nehmen Sie sie in die BGE auf. - Bestimmen Sie die Proteinkonzentration mit einem Mikrovolumen-UV-Vis-Spektralphotometer.
- Bereiten Sie eine Ammoniumacetatlösung in nicht deuteriertem Wasser in der gewünschten Konzentration vor.
2. Betrieb der CE-basierten HDX-MS-Analyse
HINWEIS: Das bei diesem Ansatz verwendete Massenspektrometer sollte mit einem Massenanalysator mit ultrahoher Auflösung ausgestattet sein, wie z. B. einer Fourier-Transformations-Ionenzyklotronresonanz (FTICR) oder Orbitrap, einem Massenfilter, wie einem Quadrupol, der die Massenauswahl von Vorläuferionen für die Fragmentierung ermöglicht, und Elektronentransferdissoziationsfunktionen (ETD) oder Elektroneneinfangdissoziation (ECD), um eine Top-Down-Analyse mit zuverlässigen Tandem-MS-Daten (idealerweise isotopenaufgelöste Signale von Fragmentionen) durchzuführen.
- Optimierung von CE- und MS-Einstellungen
- Führen Sie eine Pilot-MS-Messung mit einer Standard-Elektrospray-Ionisationsquelle (ESI) durch, indem Sie entweder die vorgespannte Probe aus einer metallbeschichteten Borosilikatglaskapillare (das "statische" nanoESI-Schema) oder die kontinuierlich infundierte Probe aus einem Metallemitter sprühen, um die MS-Einstellungen für die Messung intakter Proteine (MS1) und ihrer Gasphasenfragmente (MS2) zu optimieren. Fragmentieren Sie die interessierenden Proteinspezies durch Massenselektion des Ensembles ihrer Ionen in einem Einzelladungszustand, gefolgt von ETD oder ECD der Vorläuferionen.
HINWEIS: Zu den wesentlichen Einstellungen gehören die Parameter, die die Desolvation beeinflussen, die Massenauswahl von Vorläuferionen (um Interferenzen durch andere Spezies zu vermeiden) und die Fragmentierungseffizienz. Sowohl der Mittelpunkt als auch die Breite des Massenauswahlfensters sollten vergrößert werden, um der resultierenden Massenverteilung der Analytionen nach HDX zu entsprechen. Da das Elutionsfenster einer Proteinspezies in CE typischerweise zwischen 0,5 min und 2 min liegt, bewerten Sie die Fragmentierungseffizienz basierend auf MS2-Scans, die über ein vergleichbares Zeitfenster akkumuliert wurden. Die optimalen Werte dieser Parameter sind proteinspezifisch; Für beispielhafte Einstellungenwerden die Leser auf zuvor veröffentlichte Berichte verwiesen 8,14. - Führen Sie eine Pilot-CE-Messung mit einem CE-Instrument durch, das mit einem optischen Detektor ausgestattet ist, d. h. einem PDA-Detektor (Photodiode Array) oder einem UV-Detektor, um die CE-Einstellungen für die Trennung der Proteinspezies und die Migrationszeiten zu optimieren, was den HDX-Reaktionszeiten entspricht.
HINWEIS: Dieser Schritt ist je nach Verfügbarkeit des optischen Detektors von CE optional. In Ermangelung eines optischen Detektors können die CE-Einstellungen nach Abschluss von Abschnitt 2.2 gemäß den in Abschnitt 2.3 beschriebenen Anweisungen mit CE-MS optimiert werden. Zu den wesentlichen Einstellungen gehören Parameter, die sich auf die Abscheideeffizienz auswirken, Spitzenformen, die in Elektropherogrammen angezeigt werden, und Elutionszeiten.
- Führen Sie eine Pilot-MS-Messung mit einer Standard-Elektrospray-Ionisationsquelle (ESI) durch, indem Sie entweder die vorgespannte Probe aus einer metallbeschichteten Borosilikatglaskapillare (das "statische" nanoESI-Schema) oder die kontinuierlich infundierte Probe aus einem Metallemitter sprühen, um die MS-Einstellungen für die Messung intakter Proteine (MS1) und ihrer Gasphasenfragmente (MS2) zu optimieren. Fragmentieren Sie die interessierenden Proteinspezies durch Massenselektion des Ensembles ihrer Ionen in einem Einzelladungszustand, gefolgt von ETD oder ECD der Vorläuferionen.
- Vorkonditionierung des CE-HDX-Setups
- Reinigen Sie die mikroflächliche CE-MS-Grenzfläche mit einer Mischung aus 50% Methanol, 49% Wasser und 1% Ameisensäure (v/v) mit Ultraschall für mindestens 30 min bei Raumtemperatur.
- Nach der Montage der HPC-modifizierten Kapillare auf einem CE-Instrument spülen Sie die Kapillare mit BGE mit dem Autosampler für 10 Minuten aus und lassen Sie die Kapillare mit BGE gefüllt.
- Erhalten Sie eine angemessene Länge des unmodifizierten Kapillarschlauchs für Quarzglas (ID: 50 μm, OD: 360 μm) als Infusionsschlauch für die Modifikatorlösung. Schließen Sie den Modifikatorschlauch mit einer stumpfen Spitze mit einer Vereinigung und einer geeigneten Hülse an eine gasdichte Glasspritze an und spülen Sie den Schlauch mit der Modifikatorlösung mit einer Infusionspumpe für mindestens 10 Minuten ab.
- Setzen Sie die Auslässe der HPC-beschichteten CE-Kapillar- und Modifikatorschläuche, die mit entsprechenden Lösungen bestückt wurden, in die gereinigte CE-MS-Schnittstelle ein, wie in Abbildung 2 dargestellt.
- Bewegen Sie die Spritze für die Modifikatorinfusion entweder manuell oder mit der Infusionspumpe vor, um sicherzustellen, dass die Modifikatorlösung die Spitze der Grenzfläche erreicht. Montieren Sie die montierte CE-MS-Schnittstelle auf einem nanoESI-Quellgehäuse eines Massenspektrometers.
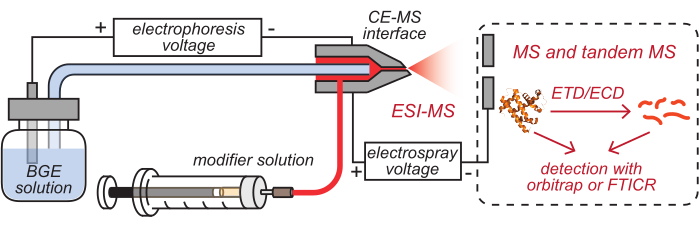
Abbildung 2: Schematische Darstellung des CE-basierten HDX MS-Setups. Diese Zahl wurde von8 geändert. Abkürzungen: BGE = Hintergrundelektrolytlösung; CE = Kapillarelektrophorese; MS = Massenspektrometrie; HDX = Wasserstoff/Deuterium-Austausch; ESI = Elektrospray-Ionisation; FTICR = Fourier-Transformations-Ionen-Zyklotron-Resonanz; ETD = Elektronentransfer-Dissoziation; ECD = Elektroneneinfang-Dissoziation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Gleichzeitige CE-Trennung, HDX-Reaktion und MS-Analyse
HINWEIS: Es wird empfohlen, deuteriertes BGE innerhalb von 1 Tag nach dem Entsiegeln zu verwenden.- Legen Sie eine Sprühspannung von 3-5 kV an die CE-MS-Schnittstelle an.
- Beginnen Sie mit der Infusionspumpe mit der Infusionspumpe mit einer Durchflussrate von 0,1 bis 10 μL/min und sorgen Sie für ein stabiles Elektrospray an der Spitze der CE-MS-Grenzfläche.
- Geben Sie die Durchstechflasche mit der BGE in den Autosampler und verwenden Sie sie in Schritt 2.3.4, um leere Elektropherogramme und leere Massenspektren zu erfassen.
- Injizieren Sie die Probenlösung mit dem Autosampler bei 2 psi und für eine angemessene Dauer, um die Injektion einer gewünschten Menge der Probe zu ermöglichen. Schätzen Sie das Injektionsvolumen anhand der Beziehung zwischen Einspritzvolumen und Einspritzparametern15, die durch Gleichung (1) definiert ist.
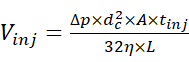 (1)
(1)
Dabei ist Vinj das Injektionsvolumen, Δp der Injektionsdruck, d c der Innendurchmesser der Kapillare, A der Querschnitt der Kapillare, tinj die Dauer der Injektion, η die Viskosität der Flüssigkeit in der Kapillare und L die Länge der Kapillare. - Beginnen Sie die CE-Trennung, indem Sie eine elektrophoretische Spannung von 30 kV und einen Infusionsdruck von 0 bis 2 psi anlegen und das Elektropherogramm erfassen. Beginnen Sie in der Zwischenzeit mit der Erfassung der MS-Daten im chromatographischen Modus, in dem der Ionenstromgraph als Funktion der Zeit erfasst wird und die entsprechenden MS-Scans nicht automatisch zu einem einzigen Spektrum kombiniert werden.
HINWEIS: Proteine durchlaufen während ihrer elektrophoretischen Migration in diesem Schritt eine spontane HDX-Reaktion an der Kontaktstelle von 2H2-O-Molekülen in BGE. Neben der MS-Detektion kann auch die optische Detektion für CE eingesetzt werden. Da die On-Column-Detektion das Entfernen einer bestimmten Länge der Polyimidbeschichtung am Auslassende der Quarzglaskapillare erfordert, sollte zusätzliche Sorgfalt darauf verwendet werden, Kapillarschäden während der Montage der CE-MS-Schnittstelle zu vermeiden. - Speichern Sie das leere Elektropherogramm und die Massenspektren als Referenzen.
HINWEIS: Leere Daten sind für die Fehlerbehebung und nicht für die Baseline-Subtraktion zu verwenden. - Legen Sie die Probenfläschchen mit den gewünschten Konzentrationen der Proteinprobenlösungen in den Autosampler. Erfassen Sie die Elektropherogramme und Massenspektren für die Proteinproben gemäß den Schritten 2.3.4-2.3.5. Sammeln Sie eine ausreichende Anzahl von MS-Scans, um MS1-Spektren der elektrophoretisch getrennten und 2H-markierten Proteinspezies zu erhalten.
- Führen Sie Tandem-MS-Messungen für die interessierenden Spezies durch, entweder nachdem Sie die MS1-Spektren innerhalb desselben Durchlaufs oder in einem nachfolgenden, separaten Durchlauf erfasst haben.
- Passen Sie bei Bedarf die Migrationszeiten/HDX-Reaktionszeiten an, indem Sie den Infusionsdruck oder die Länge der CE-Kapillare ändern. Wenn die HDX-Reaktionszeit kürzer als die Migrationszeit sein muss, verwenden Sie den zuvorbeschriebenen Ansatz 8, bei dem während des CE-Prozesses sowohl deuterierte als auch nicht deuterierte BGE in der Kapillare verwendet werden.
- Spülen Sie die CE-Kapillare mit BGE bei einem Druck von 20 psi für mindestens 10 min nach jeder Messung.
- Reinigen Sie nach Abschluss der Experimente die CE-MS-Schnittstelle und alle Schläuche für die Lagerung.
- Erfassen Sie einen Datensatz der HDX-"Endpunkt"-Probe (die mit den zuvor beschriebenen Ansätzenvorbereitet werden kann 6,16) mit MS im direkten Infusionsmodus.
HINWEIS: Dieser Schritt ist nur erforderlich, wenn eine deuterierte Modifikatorlösung für CE-basiertes HDX verwendet wird.
3. Datenanalyse
- Analyse von CE-Daten
- Verwenden Sie eines der folgenden Diagramme als Elektropherogramm, um die elektrophoretischen Eigenschaften zu bestimmen, einschließlich der Anzahl der Peaks, Migrationszeiten und der Abscheideeffizienz: (a) UV-Absorption im Vergleich zur Migrationszeit, die vom optischen Detektor des CE-Instruments erfasst wird (falls verfügbar); b) das von den Mitgliedstaaten erfasste Gesamtionenstromdiagramm (TIC); c) das von den Mitgliedstaaten erfasste Diagramm des extrahierten Ionenstroms (EIC/XIC).
HINWEIS: EIC/XIC bietet das optimale Signal-Rausch-Verhältnis (S/N) im Allgemeinen unter den oben genannten Formaten von Elektropherogrammen. Es ist bemerkenswert, dass selbst in Abwesenheit von instrumentellen Verzerrungen, während die UV-Absorption proportional zur Massenkonzentration des Proteins ist, das MS-Signal proportional zur molaren Konzentration ist. Daher ist es sinnvoll, Unterschiede in den Spitzenmustern zwischen CE- und MS-abgeleiteten Elektropherogrammen zu beobachten. - Verwenden Sie den Bereich unter der Kurve (AUC) der in den Elektropherogrammen gezeigten Spitzen für die Halbquantifizierung. Für Proben mit Proteinkomplexen verwenden Sie den zuvor beschriebenen Ansatz17, um die Massenkonzentrationsdaten aus den TIC/EIC-Elektropherogrammen abzuleiten.
- Verwenden Sie eines der folgenden Diagramme als Elektropherogramm, um die elektrophoretischen Eigenschaften zu bestimmen, einschließlich der Anzahl der Peaks, Migrationszeiten und der Abscheideeffizienz: (a) UV-Absorption im Vergleich zur Migrationszeit, die vom optischen Detektor des CE-Instruments erfasst wird (falls verfügbar); b) das von den Mitgliedstaaten erfasste Gesamtionenstromdiagramm (TIC); c) das von den Mitgliedstaaten erfasste Diagramm des extrahierten Ionenstroms (EIC/XIC).
- Analyse von MS-Daten
- Erhalten Sie die MS1- und MS2-Spektren, indem Sie die MS1- und MS2-Scans kombinieren, die in den entsprechenden Elutionsfenstern erfasst wurden.
- Bestimmen Sie die Massen des intakten Proteins (M (intaktes Protein)) und der Fragmente mit einer der beiden folgenden Methoden.
- Berechnen Sie die durchschnittlichen Massen der Ionen, die zu den isotopenaufgelösten Signalclustern führen.
- Verwenden Sie den Mittelpunkt der Gaußschen Kurven, die sich aus der Anpassung der entsprechenden Isotopenhüllenergeben 6.
- Verwenden Sie Software wie Biopharma Finder,ProSight 18 oder MASH Suite19, um die Massenliste der Fragmentionen zu generieren und zu identifizieren.
- Analyse von HDX-Daten
- Bestimmen Sie den Gesamtdeuterationsgrad einer intakten Proteinspezies unter Verwendung von Gleichung (2).
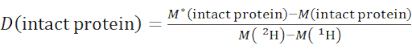 (2)
(2)
wobei M (2 H) oder M (1 H) Atomgewichte von 2H oder 1H sind. Das Sternchen kennzeichnet die Daten der 2H-markierten Probe. - Bestimmen Sie den kumulativen Schutz oder die kumulative Deuteration von Rückgrat-Amiden eines bestimmten Segments.
- Verwenden Sie für Daten, die mit einer deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (3) und (4), um das kumulative Schutzniveau zu bestimmen.
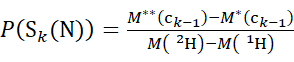 (3)
(3)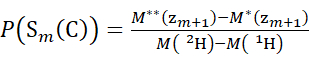 (4)
(4)
Dabei ist P(S k(N)) der Gesamtschutz des N-terminalen Segments, das die Reste 1 bis k umfasst, P(Sm(C)) der Gesamtschutz des C-terminalen Segments, das m-Reste umfasst, M (2 H) oder M (1 H) sind Atomgewichte von 2H oder 1H und M (c i) oder M (zi) sind die Molekulargewichte von c i oder z i Ionen.
HINWEIS: Das doppelte Sternchen kennzeichnet Daten des HDX-"Endpunkts"-Beispiels. - Verwenden Sie für Daten, die mit einer nicht deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (5) und (6), um den kumulativen Deuterationsgrad zu bestimmen.
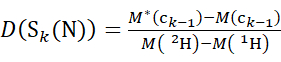 (5)
(5)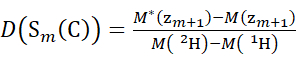 (6)
(6)
wobei D(S k(N)) die kumulative Deuteriumaufnahme des N-terminalen Segments ist, das die Reste 1 bis k umfasst; D(S m(C)) ist die kumulative Deuteriumaufnahme des C-terminalen Segments, das m-Reste umfasst.
- Verwenden Sie für Daten, die mit einer deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (3) und (4), um das kumulative Schutzniveau zu bestimmen.
- Bestimmung des Deuterationsgrades an einer lokalen Backbone-Amidgruppe
- Verwenden Sie für Daten, die mit einer deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (7), (8), (9), (10) und (11), um die lokale Schutzebene zu bestimmen.
für Daten, die aus C-Ionen abgeleitet werden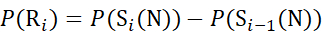 (7)
(7)
Für Daten, die aus Z-Ionen abgeleitet werden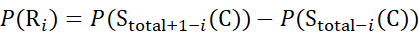 (8)
(8)
Dabei ist P(R i) der Schutz eines Rückgratamids bei Resti, und das tiefgestellte "total" bezeichnet die Gesamtrestzahl des Proteins.
Für Rückstandsstellen, an denen nachfolgende Fragmentionen fehlten, ist P(Ri) mit den Gleichungen (9) und (10) zuzuordnen.
für Daten, die aus C-Ionen abgeleitet werden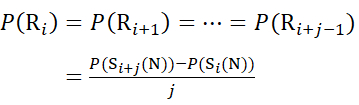 (9)
(9)
Für Daten, die aus Z-Ionen abgeleitet werden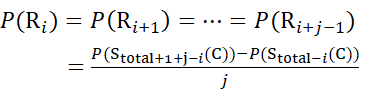 (10)
(10)
Bestimmen Sie dann den Deuterationsgrad D(Ri) an einer lokalen Backbone-Amidgruppe unter Verwendung der Gleichung (11).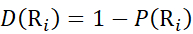 (11)
(11) - Verwenden Sie für Daten, die mit einer nicht deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (12), (13), (14) und (15), um die lokale Schutzebene zu bestimmen.
für Daten, die aus C-Ionen abgeleitet werden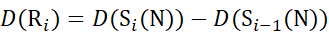 (12)
(12)
Für Daten, die aus Z-Ionen abgeleitet werden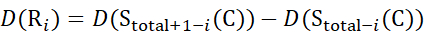 (13)
(13)
Dabei ist D(R i) der Schutz eines Rückgratamids bei Resti, und das tiefgestellte "total" bezeichnet die Gesamtrestzahl des Proteins.
Für Rückstandsstellen, an denen nachfolgende Fragmentionen fehlten, ist D (Ri) unter Verwendung der Gleichungen (14) und (15) zuzuweisen.
für Daten, die aus C-Ionen abgeleitet werden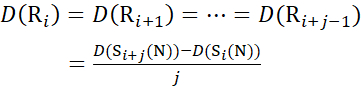 (14)
(14)
Für Daten, die aus Z-Ionen abgeleitet werden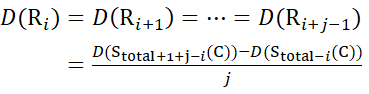 (15)
(15)
- Verwenden Sie für Daten, die mit einer deuterierten Modifikatorlösung erfasst wurden, die Gleichungen (7), (8), (9), (10) und (11), um die lokale Schutzebene zu bestimmen.
- Bestimmen Sie den Gesamtdeuterationsgrad einer intakten Proteinspezies unter Verwendung von Gleichung (2).
Ergebnisse
Die Änderung des Infusionsdrucks von BGE ermöglicht die Einstellung sowohl der Abscheideeffizienz als auch der Migrationszeit, die der HDX-Reaktionszeit der zu trennenden Proteine entspricht (Abbildung 3). Ein niedrigerer Infusionsdruck führt zu einer besseren Trennung der CE-Spitzen auf Kosten der Dauer des Experiments (Abbildung 3A). Eine längere Migrations-/HDX-Reaktionszeit führt zu einer höheren Deuteration der Proteinanalyten (Ab...
Diskussion
Zu den Zielen der Beschichtung der Innenwand der CE-Kapillare gehören die Minimierung des elektroosmotischen Flusses und die Proteinabsorption während des CE-Prozesses13. Obwohl der elektroosmotische Fluss für die konventionelle CE-Analyse kleiner Moleküle von Vorteil ist, da er neutrale oder entgegengesetzt geladene Spezies zum Detektor treiben kann, beeinträchtigt er die Trenneffizienz von Proteinspezies mit ähnlichen Größen und Nettoladungen in Lösung. Die Beschichtung der Kapillare mi...
Offenlegungen
D. D. Y. Chen ist einer der Gründer des Knowledge for Health Institute for Biomolecules, das die mikrofläuliche CE-MS-Schnittstelle kommerzialisiert. Andere Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der National Natural Science Foundation of China (NSFC 21974069) unterstützt. Die Autoren erhielten auch Unterstützung vom Institute for Cell Analysis, Shenzhen Bay Laboratory, China; Jiangsu Collaborative Innovation Center für biomedizinische Funktionsmaterialien; und Jiangsu Key Laboratory of Biomedical Materials an der Nanjing Normal University, China.
Materialien
| Name | Company | Catalog Number | Comments |
| ammonium acetate | Fisher Chemical | A/3446/50 | ≥99% |
| CESI 8000 plus capillary electrophoresis system | Sciex, USA | ||
| centrifuge | Eppendorf | 5406000097 | |
| centrifugal filter | Merck | UFC201024 | 10 kDa cutoff |
| deuterium oxide | Energy Chemical | E090001 | 99.9 % D |
| formic acid | Acros Organics | 270480250 | |
| fused silica glass capillary | Polymicro Technologies | 1068150017 | ID 50μm, OD 360μm |
| gas chromatography | Agilent | GC6890N | |
| hydrochloric acid | Sigma Aldrich | 258148 | |
| hydroxypropyl cellulose | Aladdin | H113415 | MW 100000 |
| magnetic stirrers | DLAB | 8030101212 | |
| methanol | Fisher Chemical | A456-4 | MS grade |
| microvolume UV-Vis spectrophotometer | DeNovix | 84677JK7731 | |
| myoglobin | Sigma Aldrich | M1882 | |
| Orbitrap Fusion Lumos mass spectrometer | Thermo Fisher Scientific, USA | ||
| PA 800 Plus Pharmaceutical Analysis CE System | Beckman Coulter, USA | ||
| Q Exactive UHMR mass Spectrometer | Thermo Fisher Scientific, Germany | ||
| sodium hydroxide | Sigma Aldrich | S5881 | |
| ubiquitin | Sigma Aldrich | U6253 | |
| ultrasonicator | SCIENTZ | SB-5200 | |
| β-lactoglobulin | Sigma Aldrich | L0130 | |
Referenzen
- Kaltashov, I. A., Bobst, C. E., Pawlowski, J., Wang, G. Mass spectrometry-based methods in characterization of the higher order structure of protein therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 184, 113169 (2020).
- Engen, J. R., Botzanowski, T., Peterle, D., Georgescauld, F., Wales, T. E. Developments in hydrogen/deuterium exchange mass spectrometry. Analytical Chemistry. 93 (1), 567-582 (2021).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Conformer-specific hydrogen exchange analysis of Abeta(1-42) oligomers by top-down electron capture dissociation mass spectrometry. Analytical Chemistry. 83 (13), 5386-5393 (2011).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Structure and dynamics of small soluble Abeta(1-40) oligomers studied by top-down hydrogen exchange mass spectrometry. Biochemistry. 51 (17), 3694-3703 (2012).
- Pan, J., Borchers, C. H. Top-down structural analysis of posttranslationally modified proteins by Fourier transform ion cyclotron resonance-MS with hydrogen/deuterium exchange and electron capture dissociation. Proteomics. 13 (6), 974-981 (2013).
- Wang, G., Abzalimov, R. R., Bobst, C. E., Kaltashov, I. A. Conformer-specific characterization of nonnative protein states using hydrogen exchange and top-down mass spectrometry. Proceedings of the National Academy of Sciences of the United. States of America. 110 (50), 20087-20092 (2013).
- Mironov, G. G., Clouthier, C. M., Akbar, A., Keillor, J. W., Berezovski, M. V. Simultaneous analysis of enzyme structure and activity by kinetic capillary electrophoresis-MS. Nature Chemical Biology. 12 (11), 918-922 (2016).
- Shen, Y., Zhao, X., Wang, G., Chen, D. D. Y. Differential hydrogen/deuterium exchange during proteoform separation enables characterization of conformational differences between coexisting protein states. Analytical Chemistry. 91 (6), 3805-3809 (2019).
- Kontopidis, G., Holt, C., Sawyer, L. Invited review: β-lactoglobulin: binding properties, structure, and function. Journal of Dairy Science. 87 (4), 785-796 (2004).
- Qin, B. Y., et al. Structural basis of the Tanford transition of bovine β-lactoglobulin. Biochemistry. 37 (40), 14014-14023 (1998).
- Qin, B. Y., Bewley, M. C., Creamer, L. K., Baker, E. N., Jameson, G. B. Functional implications of structural differences between variants A and B of bovine beta-lactoglobulin. Protein Science. 8 (1), 75-83 (1999).
- Wang, L., et al. High resolution capillary isoelectric focusing mass spectrometry analysis of peptides, proteins, and monoclonal antibodies with a flow-through microvial interface. Analytical Chemistry. 90 (15), 9495-9503 (2018).
- Busch, M. H. A., Kraak, J. C., Poppe, H. Cellulose acetate-coated fused-silica capillaries for the separation of proteins by capillary zone electrophoresis. Journal of Chromatography A. 1695 (2), 287-296 (1995).
- Zhao, X., Shen, Y., Tong, W., Wang, G., Chen, D. D. Y. Deducing disulfide patterns of cysteine-rich proteins using signature fragments produced by top-down mass spectrometry. Analyst. 143 (4), 817-823 (2018).
- Sutera, S. P., Skalak, R. The history of Poiseuille's law. Annual Review of Fluid Mechanics. 25 (1), 1-20 (1993).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Wang, G., Johnson, A. J., Kaltashov, I. A. Evaluation of electrospray ionization mass spectrometry as a tool for characterization of small soluble protein aggregates. Analytical Chemistry. 84 (3), 1718-1724 (2012).
- Fellers, R. T., et al. ProSight Lite: graphical software to analyze top-down mass spectrometry data. Proteomics. 15 (7), 1235-1238 (2015).
- Cai, W., et al. MASH Suite Pro: A comprehensive software tool for top-down proteomics. Molecular & Cellular Proteomics. 15 (2), 703-714 (2016).
- Paterson, G. R., Hill, J. P., Otter, D. E. Separation of β-lactoglobulin A, B and C variants of bovine whey using capillary zone electrophoresis. Journal of Chromatography A. 700 (1), 105-110 (1995).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Nicolardi, S., et al. On-line electrochemical reduction of disulfide bonds: improved FTICR-CID and -ETD coverage of oxytocin and hepcidin. Journal of the American Society for Mass Spectrometry. 24 (12), 1980-1987 (2013).
- Adhikari, S., Xia, Y., McLuckey, S. A. Top-down analysis of disulfide-linked proteins using photoinduced radical reactions and ET-DDC. International Journal of Mass Spectrometry. 444, 116173 (2019).
- Rush, M. J. P., Riley, N. M., Westphall, M. S., Coon, J. J. Top-down characterization of proteins with intact disulfide bonds using activated-ion electron transfer dissociation. Analytical Chemistry. 90 (15), 8946-8953 (2018).
- Zhong, X., Maxwell, E. J., Chen, D. D. Y. Mass transport in a micro flow-through vial of a junction-at-the-tip capillary electrophoresis-mass spectrometry interface. Analytical Chemistry. 83 (12), 4916-4923 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten