需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
碳纳米管负载掺杂Co和N原子金属纳米粒子的合成及其在制氢中的催化应用
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种协议,用于合成碳纳米管上负载的Co纳米颗粒,并具有Co-和N-掺杂剂用于制氢。
摘要
本文提出了一种用原子分散的钴和氮掺杂剂轻松合成负载在碳纳米管上的纳米结构催化剂的方法。该策略基于在800 °C的Ar气氛下对乙酰丙酮钴(II)和富氮有机前驱体进行简单的一锅热解处理,从而形成具有蚯蚓状形貌的Co-和N-共掺杂碳纳米管。结果表明,所获得的催化剂具有高密度的缺陷位点,拉曼光谱证实了这一点。在这里,钴(II)纳米颗粒稳定在原子分散的钴和氮掺杂碳纳米管上。结果表明,该催化剂在氨硼烷催化水解中有效,其周转频率为5.87 mol H 2·mol Co-1·min-1,比产氢速率为2447 mL H2·gCo-1·min-1。首次提出了Co纳米粒子与掺杂碳纳米管在温和条件下氨硼烷反应催化水解中的协同作用。由此产生的氢气生产具有高能量密度和最短的加注时间,可能适合未来发展,作为移动和固定应用的能源,如运输和物流中的公路卡车和叉车。
引言
开发低成本和高效的可再生能源生产催化剂仍然是缓解能源危机的最关键和最具挑战性的问题之一。然而,由于性能可靠、生产成本高、长期稳定性延长催化剂使用寿命的大规模生产方法等几个问题,它离实际应用还很远。运输和物流等工业部门需要车辆和设备的能源生产,这些车辆和设备具有较长的运行时间、高功率的能源供应和最短的加油时间,以实现高效运营1,2,3。因此,已广泛利用有效的策略来解决上述技术挑战。例如,通过调节金属活性位点和催化剂载体的电子结构,设计金属纳米催化剂的特定结构,微调金属成分,对锚定载体进行官能团修饰,以及改变形貌以增加固有活性位点的数量。在过去的几十年中,纳米粒子(NPs)在各种非均相催化领域占据主导地位,通过改变NPs的大小可以有效地调节催化活性。直到最近几年,高度分散的单原子催化剂(SACs)由于其独特的电子结构和配位环境而在许多催化反应中具有优异的性能。特别是,SACs在电化学反应(HER,ORR,OER)和电化学能源系统(例如超级电容器,可充电电池)等能量转换方面已经表现出优异的性能4,5,6。虽然NPs和SACs在催化应用中都有各自的优势和局限性,但确实存在需要NPs和SACs以提高催化反应性的反应。例如, 负载在Ni和N共掺杂碳纳米管上结构上的Ru NPs可以促进乙酸7的高催化湿空气氧化.Pd1+NPs/TiO2催化剂在室温下对高选择性酮和醛类加氢也证明了这种协同效应8。为了加速协同NPs和SACs催化领域的发展,并进一步探索其催化应用,一种简便的催化剂合成方式是非常可取的,并且由于SACs9的高聚集趋势,引入高负载原子分散活性位点仍然是一个挑战。
已经有几种方法用于合成SACs,用于硝基芳烃的加氢10,氧还原反应和析氢反应11,12,锂氧电池13。最常见的策略是自下而上的方法,其中金属前体被吸收、减少并固定在相应支撑的缺陷上。单核金属配合物也可以首先连接到载体的官能团上,然后去除有机配体,从而为催化过程创建活性金属位点。原子层沉积(ALD)可能是自下而上制造最常用的程序,通过在基板上沉积一层薄膜并反复暴露反应物。虽然可以精确控制催化剂尺寸,并大大提高反应性14,但基底的纯度要求较高,金属负载量相对较低,导致实际应用生产成本较高。采用直接浸渍、共沉淀、沉积沉淀等多种方法,通过表面电荷效应将金属纳米颗粒固定在支撑表面上,如金属氧化物和氮化物。然而,增加金属负载通常会导致金属原子或纳米颗粒的显着团聚和团簇形成。因此,通常需要非常稀释的金属溶液,从而导致催化剂15的SAC负载量低。胺配体如菲咯啉已被用于与金属前体进行热解,以制备具有高活性Co-Nx活性位点的原子分散金属催化剂,用于甲酸的选择性脱氢。然而,由于胺前体中可用N原子的数量有限,金属负载量相对较低(2-3重量%)16。
在过去的几十年中,由于前者的零排放优势,氢一直被视为替代化石燃料或碳氢化合物(如煤、天然气和汽油)的潜在替代品。到目前为止,大约94%的商业氢气仍然来自化石燃料的重整过程,其中该过程释放了大量的温室气体。17.因此,从电解水等可再生资源中制氢是解决化石资源枯竭和碳排放严重的问题的一种方式。然而,低制氢效率阻碍了其更广泛的应用。因此,为了克服这种水分解的动能障碍,在过去十年中发现了许多高效的电催化剂。18.另一个问题是由于氢气在环境条件下的气态和爆炸性而导致的存储问题。压缩等物理储存方法将需要将氢气压缩到700-800巴,而液化低温储存将需要-253°C的低温19.尽管商业化的氢燃料电池动力汽车已经成功证明,但如果该技术要用于更广泛的应用,例如微型设备和微型燃料电池,则存储问题尚未解决。因此,利用化学H材料的储存方法一直是氢能研究的热点之一。化学H储存材料的一些例子是氨硼烷(AB)20, 甲酸 (FA)21、氨气22,丙氨酸钠23和氢化镁24.其中,AB具有低分子量(30.7 g·mol-1)、高重量密度和体积密度 (196 gH2·公斤-1 和 146 gH2·L-1分别)。此外,它是一种空气和水分稳定的化合物,无毒,极易溶于水。各种负载材料上的金属纳米颗粒已被广泛用于从AB中释放三种当量的氢,例如铂(Pt-),钯(Pd-),钌(Ru-),钴(Co-)和镍(Ni-)基催化剂。负载在碳材料上的共基非均相催化剂因其成本低、丰度高、易于回收等特点而备受关注。已经报道了几种合成策略,例如支链聚乙烯亚胺修饰氧化石墨烯上支持的Co NPs。25.具有大表面积的3D结构确保了Co NPs的稳定性保持在2-3 nm尺寸范围内,并防止了NPs的聚集。另一种策略是使用N掺杂碳材料来支持小尺寸的Co NPs。使用Co(salen)26 和联合货币部27 (金属有机骨架)为前驱体, 分别在N掺杂多孔碳材料上制备了负载的9.0 nm和3.5 nm的Co NPs.对AB水解的稳定性高,反应活性在10次反应运行后可保持初始活性的95%以上。近年来,具有中空微/纳米结构的催化剂被用于AB水解。这些材料通常通过水热法制备,已广泛用于锂离子电池、超级电容器、化学传感器和多相催化研究。因此,铜钴对AB水解的协同作用已被空心CuMoO证明4-CoMoO428,其TOF高达104.7分钟-1.其他高度依赖结构的例子包括核壳CuO-NiO/Co3O429,公司x铜1−x公司2O4@Coy铜1−y公司2O4 蛋黄壳型30,和尼0.4铜0.6公司2O4 纳米阵列31 还发现对AB水解有活性。另一种称为异质结构催化剂的新兴材料,如MXenes和层状双氢氧化物(LDH),正越来越多地用于电催化和光催化反应32,33,34,35.这些材料如NiFe层状双氢氧化物36,37 以及具有N掺杂碳-钴硼化物异质界面的CoB-N材料38 对析氧和还原反应特别活跃。原则上,它们可以进一步用于氨硼烷等储氢材料的析氢反应39.最大化催化剂和底物之间的相互作用也是AB水解的另一种策略。Chiang等人利用氧化石墨烯的表面氧化物基团与AB40,因此凰0.8铂0.2/GO和rGO对AB水解表现出优异的反应性。使用α-MoC作为Co和Ni双金属催化剂的载体有助于水分子的活化,并实现了AB水解的高TOF,比商用Pt/C催化剂高四倍41.
利用双氰胺和相关C3N4材料的高N含量,本文提出了一种在高度分散的Co-和N-掺杂碳纳米管上轻松合成负载的钴NPs的方案。在C3N4材料热解过程中,形成的原子分散Co逐渐原位形成Co NPs,确保1)Co NPs和Co掺杂剂高度分散;2)Co NPs可以牢固地锚定在掺杂的碳载体上,3)Co NPs的大小可以通过热解的温度和时间仔细控制。由于Co NPs的强锚定和Co掺杂剂降低水分子吸附能的能力,所制备的Co/Co-N-CNT在AB水解制氢方面具有优异的稳定性。催化剂合成方案的细节和氢气产量的测量将是本报告的重点。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:建议读者仔细检查本文中描述的化学品的特性和毒性,以便从相关材料安全数据表(MSDS)中正确处理化学品。使用的一些化学品对健康有害,应特别注意。纳米材料对人类健康的影响尚不清楚,并可能构成安全和健康风险。应避免吸入和通过皮肤接触这些材料。还应采取安全预防措施,例如在催化剂合成过程中将废气释放到通风橱中,并在适当排放氢气的情况下进行催化剂性能评估。建议始终穿戴个人防护装备。氢气是一种潜在的爆炸性气体,在空气中的可燃性范围非常广泛,为4%-74%。应注意让氢气适当地排放到大气中。
1. 美莱姆-C 3N4 材料的合成
- 称取 280 g 双氰胺(密度 = 1.4 g·cm-3)到 800 mL 烧杯中。
- 将装有上述固体的烧杯放入马弗炉中,以5°C·min-1的升温缓慢升温至350°C。
- 保持温度在350°C2小时,通过自然冷却冷却炉子。
- 将获得的白色固体研磨成细粉,作为 C3N4 材料以 melem 形式 (DCD-350)。
注意:产量为175克。
2. 在不同温度下退火 melem-C 3N4 和 Co(acac)2 混合物
- 将 10.0 克 melem-C 3 N 4 与 0.218 g Co(acac)2 [Co : melem-C3N4 = 1:200(重量比)] 混合。研磨并混合两种固体,直到观察到均匀的颜色。
- 加入6mL柠檬酸溶液(水:乙醇=1:1,柠檬酸=10g·L-1)将混合物均匀并进一步研磨材料。
- 将材料在60°C的烤箱中干燥6小时。
- 将材料放入方形坩埚中,然后将其放入管式炉中。
- 将材料以2.6 °C·min-1的加热速率从室温加热至800 °C,并在100 mL·min-1的Ar流下保持2 h。
- 通过自然冷却慢慢冷却炉子。
- 称出催化剂样品。在这里,产量为0.65克。
3. 测量氨硼烷水解中的氢气释放
- 设置充水倒置圆筒系统(补充图1)。
- 设置 0.1 M H2SO4 洗涤溶液。
- 将舒伦克烧瓶与洗涤溶液和充满水的倒置圆柱体连接。
- 将水浴温度设置为40°C。
- 将0.04g催化剂放入舒伦克烧瓶中。
- 制备氨硼烷水溶液,0.948 mL水中加入0.04 g氨硼烷(浓度= 0.04 g·mL-1)。
- 向反应器中注入1 mL的NH3BH3 溶液(40 mg·mL-1),引发水解反应。
- 随着反应的进行,监测水位的下降。在指定时间仔细记录生产量,例如,每 5 秒间隔一次。
- 绘制 H2 产量与时间的关系图(以分钟为单位)。
4. 动力学研究
- 活化能的测定
- 将水浴温度设置为40°C。
- 将 0.04 g 催化剂和 10 mL 水放入舒伦克烧瓶中,浸入水浴中。在超声波浴中以40kHz超声处理溶液6分钟。
- 向反应器中注入1 mL的NH3BH3 溶液(40 mg·mL-1),引发水解反应。
- 记录完成氢气释放的时间。
- 重复步骤4.1.1-4.1.4,将水浴温度设置为35°C。
- 分别在30°C和25°C下重复上述实验。
- 使用以下等式在图形上绘制特定速率常数与时间的关系。ln k 和 1/t 的图应该产生一条直线。
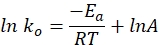
其中ko表示比速率常数(mol H 2·g Co-1·min-1),R为理想气体常数(8.314 kJ·mol-1),T表示反应温度(K),A为前指数因子(molH 2 gCo-1·min-1)。
- 确定周转频率和比制氢率
- 根据以下公式计算周转频率:
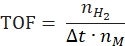
其中nH2 是产生的氢摩尔数,Δt是完全释放氢气所需的时间,nM 是催化剂中金属的摩尔量。 - 根据以下公式42,43 计算比制氢率:
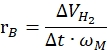
其中ΔVH2 是产生的氢气体积,t是引发和稳定阶段所需的时间(例如,40mg氨硼烷产生70 mL氢气的时间,80mg氨硼烷产生140 mL氢气的时间),ωM 是催化剂中金属的质量。
- 根据以下公式计算周转频率:
- 测定[氨硼烷]与反应速率之间的关系
- 将水浴温度设置为40°C。
- 将40mg催化剂和10mL水放入舒伦克烧瓶中,浸入水浴中。在超声波浴中以40kHz超声处理溶液6分钟。
- 向反应器中注入1 mL的NH3BH3 溶液(40 mg·mL-1),引发水解反应。
- 记录完成氢气释放的时间。
- 重复步骤4.3.3,向反应器中注入2mL的NH3BH3 溶液(即每2mL80mg)以引发水解反应。
- 分别用0.5 mL和0.25 mL的NH3BH 3溶液(40 mg / mL)重复步骤4.3.1-4.3.4,以记录完成氢释放的时间。
- 根据以下公式44计算反应速率:
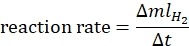
其中 ΔmlH2 是产生的氢气体积,Δt 是释放 70 mL 氢气所需的时间。 - 绘制 ln 速率与 ln[氨硼烷] 的关系并确定图形的斜率。
- 确定[催化剂]与生产率之间的关系
- 将水浴温度设置为40°C。
- 将40mg催化剂和10mL水放入舒伦克烧瓶中,浸入水浴中。在超声波浴中以40kHz超声处理溶液6分钟。
- 向反应器中注入1 mL的NH3BH3 溶液(40 mg·mL-1),引发水解反应。
- 记录完成氢气释放的时间。
- 重复步骤4.4.1-4.4.4,改变催化剂的量(20毫克、40毫克、60毫克、80毫克),向反应器中注入1 mL的NH3BH3 溶液(即40 mg·mL-1)以引发水解反应。
- 记录使用上述各种催化剂量的氢气释放完成时间。
- 根据以下公式44计算反应速率:
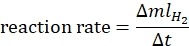
其中 ΔmlH2 是产生的氢气体积,Δt 是释放 70 mL 氢气所需的时间。 - 绘制 ln 速率与 ln[催化剂] 的关系并确定图形的斜率。
5. 循环性能测试
- 将水浴温度设置为40°C。
- 将 0.04 g 催化剂和 10 mL 水放入舒伦克烧瓶中,浸入水浴中。在超声波浴中以40kHz超声处理溶液6分钟。
- 向反应器中注入1 mL的NH3BH3 溶液(40 mg·mL-1),引发水解反应。
- 记录完成氢气释放的时间。
- 过滤掉催化剂,用水(5mL)洗涤三次,然后在烘箱(60°C)中干燥催化剂3小时。
- 将催化剂放入 10 mL 水中,并在超声波浴中以 40 kHz 超声处理溶液。
- 重复步骤 5.1.3-5.1.5 十次。
- 分别绘制制氢量、TOF 和比生成速率与周期的关系图。
6. 金属NPs浸出实验得到纯金属SAs CNT
- 将油浴温度设置为80°C。
- 将 0.15 g 催化剂和 50 mL 的 0.5 M H2SO4 放入舒伦克烧瓶中并浸入油浴中。
- 搅拌反应2小时。
- 使用布赫纳漏斗过滤固体,并用去离子水洗涤固体(每次 3 次,每次 10 mL)。在 250 mL 容量瓶中将渗滤液进一步稀释至 250 mL。
- 收集金属纳米颗粒浸出的固体(仅包含共掺杂的CNT)并在60°C的烘箱中干燥。
7. 使用电感耦合等离子体发射光谱法(ICP-OES)测定金属含量
- 总钴金属含量的测定
- 将来自第 2 节的约 0.02 g 制备的催化剂放入 50 mL 的 2 M 酸溶液(HCl:HNO 3 =3:1 摩尔比)45,46 中,放入聚四氟乙烯衬里的不锈钢高压釜中。
- 将聚四氟乙烯内衬容器放入不锈钢炸弹中并盖上盖子。
- 将炸弹放入烤箱,将温度设置为180°C,并将炸弹加热12小时。
- 取出炸弹并清空内容物。过滤固体并在装有 200 mL 去离子水的 250 mL 容量瓶中稀释溶质。
注意:稀释的目的是调整ICP样品的浓度,该浓度将适合金属标准浓度范围,即0-40 ppm。 - 运行溶液的ICP-OES测试并计算Co的总量(以重量%为单位)。
- 碳纳米管上钴原子含量的测定
- 将步骤 6.5 中制备的约 0.02 g 催化剂放入 50 mL 的 2 M 酸溶液(HCl:HNO 3 =3:1 摩尔比)45,46 中,置于聚四氟乙烯衬里的不锈钢高压釜中。
- 将聚四氟乙烯衬里的容器放入不锈钢炸弹中并盖上盖子。
- 将炸弹放入烤箱,将温度设置为180°C,并将炸弹加热12小时。
- 取出炸弹并清空内容物。过滤固体并在装有 200 mL 去离子水的 250 mL 容量瓶中稀释溶质。
注意:稀释的目的是调整ICP样品的浓度,该浓度将适合金属标准浓度范围,即0-40 ppm。 - 运行溶液的ICP-OES测试并计算Co原子含量的量(重量%)。
- 钴纳米颗粒(NPs)含量的测定
- 7.1.5和7.2.5的金属含量之差是Co NPs的重量%。
Access restricted. Please log in or start a trial to view this content.
结果
已经获得了X射线衍射图(XRD)来确定钴NPs的结晶度和尺寸。如图 1所示,对应于金属钴立方相的(111)、(200)和(220)平面(分别为44.2°、51.5°和75.8°的2θ)的衍射峰与JCPDS(粉末衍射标准联合委员会)功率衍射文件(卡片#15-0806)47一致。对应于石墨碳(N-CNTs)的2θ处约26°的宽峰可以索引到JCPDS卡#75-1621。强烈而尖锐的衍射峰表明晶体结构明确。
Access restricted. Please log in or start a trial to view this content.
讨论
热解法已成为在NPs尺寸受控的情况下,在各种杂原子掺杂固体载体上合成一维纳米材料的强大策略之一。例如,Guo等人报道了纳米空间受限热解策略56。简而言之,将预处理后的MWCNTs、钴和磷前驱体在N2 气氛下于800 °C热解,得到N-CNT负载的CoP NPs。微孔的存在可以作为Co和P前体在热解过程中渗透并与孔周围的C和N原子配位的途径。该策略可以有效控制NPs的大小并抑制其聚集...
Access restricted. Please log in or start a trial to view this content.
披露声明
我们没有什么可透露的。
致谢
这项工作由香港大学教育资助委员会 - 院校发展计划(IDS)协作研究补助金(资助编号UGC/IDS(C)14/B(E)01/19)、教师发展计划(FDS),资助编号UGC/FDS25/E08/20全额资助,部分资助由院校发展计划资助,资助编号UGC/IDS(R)25/20。
.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
参考文献
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243(2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087(2021).
- Sun, B. -W., Li, H. -J., Yu, H. -Y., Qian, D. -J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48(2020).
- Yang, X. -F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319(2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576(2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070(2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4(2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), Basel. 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460(2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422(2021).
- Wang, H., Lee, J. -M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426(2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。