É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese de Nanopartículas metálicas suportadas em Nanotubo de Carbono com Doped Co e N Átomos e suas Aplicações Catalíticas na Produção de Hidrogênio
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para sintetizar nanopartículas Co suportadas em nanotubos de carbono com co-e N-dopants para produções de hidrogênio.
Resumo
Um método para síntese fácil de catalisadores nanoestruturados suportados em nanotubos de carbono com cobalto atomicamente disperso e dopant nitrogênio é apresentado aqui. A nova estratégia é baseada em um tratamento fácil de pirólise de um pote de cobalto (II) acetilado e precursores orgânicos ricos em nitrogênio sob atmosfera ar a 800 °C, resultando na formação de nanotubo de carbono co-dopado co-dopado co-co-dopado com morfologia semelhante a minhoca. O catalisador obtido foi encontrado com uma alta densidade de locais de defeito, como confirmado pela espectroscopia de Raman. Aqui, as nanopartículas de cobalto (II) foram estabilizadas nos nanotubos de carbono de cobalto e nitrogênio dispersados atomicamente. O catalisador foi confirmado como eficaz na hidrólise catalítica da amônia borana, na qual a frequência de volume de negócios foi de 5,87 mol H2·mol Co-1·min-1, e a taxa específica de geração de hidrogênio foi determinada como sendo 2447 mL H2·g Co-1·min-1. Uma função sinérgica entre a nanopartícula Co e os nanotubos de carbono dopados foi proposta pela primeira vez na hidrólise catalítica da reação de borano de amônia sob uma condição leve. A produção de hidrogênio resultante com sua alta densidade energética e tempo mínimo de reabastecimento pode ser adequada para o desenvolvimento futuro como fontes de energia para aplicações móveis e estacionárias, como caminhões rodoviários e empilhadeiras em transporte e logística.
Introdução
O desenvolvimento de catalisadores de baixo custo e altamente eficientes para a produção de energia renovável continua sendo um dos problemas mais críticos e desafiadores para aliviar a crise energética. No entanto, está longe de ser aplicações práticas devido a várias preocupações, como métodos de produção em larga escala com desempenho confiável, alto custo de produção e estabilidade de longa data para prolongar a vida útil dos catalisadores. Setores industriais, como transporte e logística, exigem produção de energia para veículos e equipamentos com longas horas de operação, alto fornecimento de energia e tempo mínimo de reabastecimento para alcançar operações eficientes 1,2,3. Portanto, estratégias eficazes têm sido amplamente exploradas para enfrentar os desafios técnicos acima. Por exemplo, regulando a estrutura eletrônica dos locais ativos metálicos e suportes catalisadores, projetando a arquitetura específica dos nano-catalisadores metálicos, composições metálicas de ajuste fino, modificação funcional do grupo de suporte ancorado e variando a morfologia para aumentar o número de locais ativos intrínsecos. Nas últimas décadas, as nanopartículas (NPs) dominaram os campos de várias catálise heterogêneas, e as atividades catalíticas podem ser efetivamente ajustadas variando o tamanho dos NPs. Somente até os últimos anos, catalisadores de átomos únicos (SACs) altamente dispersos surgiram para ter excelentes propriedades em direção a muitas reações catalíticas devido à sua estrutura eletrônica única e ambiente de coordenação. Particularmente, os SACs já demonstraram desempenhos superiores na conversão de energia, como reações eletroquímicas (HER, ORR, OER) e sistemas de energia eletroquímica (por exemplo, supercapacitores, baterias recarregáveis)4,5,6. Embora ambos os NPs e SACs tenham suas respectivas vantagens e limitações em aplicações catalíticas, existem reações que requerem nps e SACs para aumentar a reatividade catalítica. Por exemplo, ru NPs suportados na superestrutura de nanotubo de carbono ni-e n-co-dopado poderia facilitar a oxidação de ar catalítico elevado de ácido acético7. Este efeito sinérgico também foi demonstrado porcatalisadores Pd 1+NPs/TiO2 para hidrogenação de cetona altamente seletiva e aldeídos a temperaturas ambientes8. A fim de acelerar o campo de NPs sinérgicos e SACs catalisis e explorar mais sobre suas aplicações catalíticas, uma maneira fácil de síntese catalisador é altamente desejável, e a introdução de altas cargas do local ativo atomicamente disperso continua sendo um desafio devido à alta tendência da agregação de SACs9.
Vários métodos foram utilizados para sintetizar SACs para aplicações na hidrogenação de nitroarenos10, reação de redução de oxigênio e reação de evolução do hidrogênio11,12, baterias de lítio-oxigênio13. A estratégia mais comum é a abordagem de baixo para cima, na qual os precursores metálicos foram absorvidos, reduzidos e imobilizados sobre os defeitos do suporte correspondente. Os complexos metálicos mononucleares também poderiam ser primeiro anexados ao grupo funcional de suportes, seguidos pela posterior remoção dos ligantes orgânicos, criando assim locais metálicos ativos para o processo catalítico. A deposição de camada atômica (ALD) é provavelmente o procedimento mais usado para fabricação de baixo para cima, depositando uma fina camada de filme no substrato com exposição repetida de reagentes. Embora o tamanho do catalisador pudesse ser precisamente controlado e a reatividade pudesse ser muito melhorada14, a pureza do substrato era bastante exigente, e o carregamento metálico era relativamente baixo, resultando em altos custos de produção para aplicações práticas. Vários métodos, como impregnação direta, co-precipitação e deposição-precipitação, têm sido empregados para imobilizar nanopartículas metálicas nas superfícies de suporte, como óxido de metal e nitreto, através de efeitos de carregamento superficial. No entanto, o aumento da carga metálica geralmente leva a aglomeração significativa e formação de aglomerados dos átomos metálicos ou nanopartículas. Portanto, geralmente, é necessária uma solução metálica muito diluída, levando assim a baixos carregamentos de SACs dos catalisadores15. Ligantes de amina como a fenanthrolina têm sido empregados para se submeter à pirólise com precursores metálicos para preparar catalisadores metálicos atomicamente dispersos com locais ativos co-nx altamente ativos para a desidrogenação seletiva do ácido fórmico. No entanto, o carregamento metálico foi relativamente baixo (2-3 wt%) devido ao número limitado de átomos N disponíveis nos precursores de amina16.
Nas últimas décadas, o hidrogênio tem sido considerado como uma alternativa potencial para substituir combustíveis fósseis ou hidrocarbonetos, como carvão, gás natural e gasolina, devido à vantagem da emissão zero do primeiro. Até agora, cerca de 94% do hidrogênio comercial ainda é produzido a partir do processo de reforma dos combustíveis fósseis, no qual o processo libera uma grande quantidade de gases de efeito estufa17. Portanto, a produção de hidrogênio a partir de recursos renováveis, como a eletrólise da água, é uma forma de resolver o problema dos recursos fósseis esgotados e das emissões severas de carbono. No entanto, a baixa eficiência de produção de hidrogênio tem dificultado suas aplicações mais amplas. Assim, para superar esta barreira de energia cinética para a divisão da água, inúmeros eletrocatalitos eficientes foram descobertos na última década18. Outro problema é o problema de armazenamento devido à natureza gasosa e explosiva do gás hidrogênio em condições ambientais. Métodos de armazenamento físico, como a compressão, exigirão que o hidrogênio seja comprimido até 700-800 bar, e o armazenamento criogênico por liquefação exigirá baixa temperatura a -253 °C19. Embora veículos comercializados movidos a célula de combustível de hidrogênio tenham sido demonstrados com sucesso, o problema de armazenamento ainda não foi resolvido se a tecnologia for usada em aplicações mais amplas, como dispositivos em miniatura e mini-células de combustível. Assim, os métodos de armazenamento do uso de materiais químicos H têm sido um dos focos quentes na pesquisa de energia de hidrogênio. Alguns exemplos de materiais químicos de armazenamento H são a amônia borana (AB)20, ácido fórmico (FA)21, gás amônia22, alanato de sódio23, e hidreto de magnésio24. Entre estes, AB tem baixo peso molecular (30,7 g·mol-1), altas densidades gravimétricas e volumétricas (196 gH2·kg-1 e 146 gH2· L-1, respectivamente). Além disso, é um composto estável de ar e umidade, não tóxico e altamente solúvel em água. Nanopartículas metálicas em vários materiais suportados têm sido amplamente utilizadas para liberar os três equivalentes de hidrogênio da AB, como platina- (Pt-), paládio- (Pd-), rutênio- (Ru-), cobalto- (Co-) e catalisadores baseados em níquel(Ni-) Catalisadores heterogêneos co-baseados suportados em materiais de carbono estão especialmente atraindo muita atenção devido ao seu baixo custo, alta abundância e facilidade de recuperação. Várias estratégias sintéticas foram relatadas, como os Co NPs suportados em óxido de grafeno decorado de polietilenimina ramificada25. A estrutura 3D com uma grande área de superfície garante a estabilização de Co NPs mantendo na faixa de tamanho de 2-3 nm e impediu a agregação de NPs. Outra estratégia é usar materiais de carbono dopados em N para suportar Co NPs com tamanhos pequenos. Usando Co(salen)26 e Co-MOF27 (estrutura orgânica metálica) como precursores, Co NPs de 9,0 nm e 3,5 nm suportados em materiais de carbono porosos n-doped foram preparados, respectivamente. A estabilidade em relação à hidrólise AB é alta e a reatividade pode manter mais de 95% da atividade inicial após 10 corridas de reação. Recentemente, catalisadores com micro/nanoestruturas ocas foram explorados para a hidrólise AB. Estes materiais são convencionalmente preparados por métodos hidrotérmicos e têm sido amplamente utilizados para baterias de íons de lítio, supercapacitores, sensores químicos e pesquisa de catálise heterogênea. Assim, a sinergia cobre-cobalto em direção à hidrólise AB foi demonstrada pelo CuMoO oco4-CoMoo428, o que dá um TOF alto de 104,7 min-1. Outros exemplos altamente dependentes estruturais incluem o CuO-NiO/Co de conchas centrais3O429, o CoxRio1−xCo2O4@CoyRio1−yCo2O4 tipo yolk-shell30, e o Ni0.4Rio0.6Co2O4 nanoarrays31 também foram encontrados ativos para a hidrólise AB. Outro tipo de materiais emergentes conhecidos como catalisadores heteroestruturados, como MXenes e hidróxidos duplos em camadas (LDHs), estão cada vez mais sendo explorados para reação eletrocatalílica e fotocatalítica32,33,34,35. Esses materiais, como o hidróxido duplo em camadas nife36,37 e os materiais CoB-N com heterointerfaces de boride de carbono-cobalto n-dopados38 são especialmente ativos para evolução de oxigênio e reação de redução. Em princípio, eles poderiam ser ainda mais explorados para reações de evolução de hidrogênio a partir de materiais de armazenamento de hidrogênio, como a amônia borane39. Maximizar a interação entre os catalisadores e substratos também é outra estratégia para a hidrólise AB. Chiang et al. utilizaram o grupo de óxido superficial de óxido de grafeno para formar uma espécie complexa iniciada com AB40, assim Ni0.8Pt0.2/GO e rGO demonstraram excelente reatividade para a hidrólise AB. O uso de α-MoC como suporte para catalisadores bimetálicos Co e Ni ajudou na ativação de moléculas de água e alcançou alto TOF em direção à hidrólise AB, que é quatro vezes maior que o catalisador comercial Pt/C41.
Aproveitando-se do alto teor N dos materiais de dicyandiamide e C3N4 relacionados, um protocolo para alcançar uma síntese fácil de NPs de cobalto suportados em nanotubos de carbono co-e-n-dopados altamente dispersos é apresentado aqui. A formação gradual in-situ de Co NPs a partir da Co dispersa atômica formada durante a pirólise de materiais C3N4 garantem que 1) Co NPs e Co dopants sejam altamente dispersos; 2) Os Co NPs podem ser fortemente ancorados nos suportes de carbono dopados e 3) O tamanho de Co NPs pode ser cuidadosamente controlado pela temperatura e tempo da pirólise. O Co/Co-N-CNT, como resultado dos Co NPs fortemente ancorados e da capacidade dos co dopants de baixar a energia de adsorção das moléculas de água, foi encontrado com estabilidade superior em relação à hidrólise da AB para produção de hidrogênio. Os detalhes do protocolo sintético dos catalisadores e a medição da produção de hidrogênio serão o ponto focal deste relatório.
Protocolo
ATENÇÃO: Os leitores são aconselhados a verificar cuidadosamente as propriedades e toxicidades dos produtos químicos descritos neste artigo para o manuseio químico adequado das folhas de dados de segurança do material relevante (MSDS). Alguns dos produtos químicos utilizados são prejudiciais à saúde, e cuidados especiais devem ser tomados. O impacto dos nanomateriais na saúde humana é desconhecido e pode representar riscos à segurança e à saúde. A inalação e o contato através da pele com esses materiais devem ser evitados. Também devem ser exercidas precauções de segurança, como a liberação do gás residuado durante a síntese catalisadora para o capô da fumaça e avaliação de desempenho do catalisador com ventilação adequada do gás hidrogênio. O equipamento de proteção individual é aconselhado a ser usado o tempo todo. Hidrogênio é um gás potencialmente explosivo com uma gama muito ampla de inflamabilidade de 4%a 74% no ar. Deve-se tomar cuidado para permitir que o gás hidrogênio desabafe adequadamente para a atmosfera.
1. Síntese de materiais melem-C 3N4
- Pesar 280 g de dicyandiamida (densidade = 1,4 g·cm-3) em um béquer de 800 mL.
- Coloque o béquer com o sólido acima em um forno de abafa e aumente lentamente a temperatura da temperatura ambiente para 350 °C com uma rampa de 5 °C·min-1.
- Mantenha a temperatura a 350 °C por 2h, esfrie o forno por resfriamento natural.
- Triture os sólidos brancos obtidos em pó fino como os materiais C3N4 na forma melem (DCD-350).
NOTA: O rendimento é de 175 g.
2. Acoalando as misturas melem-C 3N4 e Co(acac)2 a temperaturas diferentes
- Misture 10,0 g de melem-C3N4 com 0,218 g de Co(acac)2 [Co : melem-C3N4 = 1:200 (razão de peso)]. Triture e misture os dois sólidos até que a cor homogênea seja observada.
- Adicionar 6 mL de solução de ácido cítrico (água: etanol = 1:1, ácido cítrico = 10 g· L-1) à mistura homogênea e moer ainda mais os materiais.
- Seque os materiais em um forno a 60 °C por 6h.
- Coloque os materiais em um cadinho em forma de quadrado e, em seguida, coloque-o em um forno tubular.
- Aqueça os materiais a uma taxa de aquecimento de 2,6 °C·min-1 da temperatura ambiente a 800 °C e mantenha por 2 h sob um fluxo ar de 100 mL·min-1.
- Esfrie lentamente o forno por resfriamento natural.
- Desmarce as amostras catalisadoras. Aqui, o rendimento foi de 0,65 g.
3. Medindo a liberação de hidrogênio da hidrólise de borano de amônia
- Configurar o sistema de cilindro invertido cheio de água (Figura Suplementar 1).
- Configure a solução de lavagem 0,1 M H2SO4 .
- Conecte o frasco schlenk com a solução de lavagem e o cilindro invertido cheio de água.
- Coloque a temperatura do banho de água para 40 °C.
- Coloque 0,04 g do catalisador no frasco de Schlenk.
- Prepare uma solução de borano de amônia na água, com 0,04 g de borano de amônia em 0,948 mL de água (concentração = 0,04 g·mL-1).
- Injete 1 mL da solução NH3BH3 (40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Monitore a queda no nível da água à medida que a reação prossegue. Grave cuidadosamente o volume de produção em horários designados, por exemplo, a cada intervalos de 5 s.
- Plote o gráfico de volume de produção de H2 versus tempo em minutos.
4. Estudos cinéticos
- Determinação da energia de ativação
- Coloque a temperatura do banho de água em 40 °C.
- Coloque 0,04 g do catalisador e 10 mL de água no frasco de Schlenk e mergulhe no banho de água. Sonicate a solução a 40 kHz em um banho ultrassônico por 6 min.
- Injete 1 mL da solução NH3BH3 (40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Regissue o tempo para a conclusão da liberação do hidrogênio.
- Repetição de passos 4.1.1-4.1.4 definindo a temperatura do banho de água em 35 °C.
- Repita o experimento acima a 30 °C e 25 °C, respectivamente.
- Plote a constante de taxa específica versus tempo em um gráfico usando a equação a seguir. Um lote de Ln k e 1/T deve render uma linha reta.
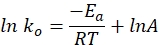
onde ko denota a constante de taxa específica (mol H2·g Co-1·min-1), R é a constante de gás ideal (8.314 kJ·mol-1), T representa a temperatura de reação (K), e A é o fator pré-exponencial (mol H2 g Co-1·min-1).
- Determinação da frequência de rotatividade e taxa específica de geração de hidrogênio
- Calcule a frequência de volume de negócios de acordo com a seguinte equação:
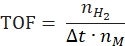
onde nH2 é a verrugas de hidrogênio produzido, Δt é o tempo necessário para a liberação completa de hidrogênio e nM é a quantidade molar de metal no catalisador. - Calcule a taxa específica de geração de hidrogênio de acordo com a seguinte equação42,43:
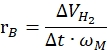
Onde ΔVH2 é o volume de hidrogênio produzido, t é o tempo necessário para os estágios de início e estabilização (por exemplo, o tempo onde 70 mL de hidrogênio gerado por 40 mg de borano de amônia, o tempo onde 140 mL de hidrogênio gerado para 80 mg de borano de amônia) e ωM é a massa de metal no catalisador.
- Calcule a frequência de volume de negócios de acordo com a seguinte equação:
- Determinação da relação entre [borano de amônia] e taxa de reação
- Coloque a temperatura do banho de água em 40 °C.
- Coloque 40 mg do catalisador e 10 mL de água no frasco de Schlenk e mergulhe no banho de água. Sonicate a solução a 40 kHz em um banho ultrassônico por 6 min.
- Injete 1 mL da solução NH3BH3 (40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Regissue o tempo para a conclusão da liberação do hidrogênio.
- Repita o passo 4.3.3 injetando 2 mL da solução NH3BH3 (ou seja, 80 mg por 2 mL) ao reator para iniciar a reação de hidrólise.
- Repetir as etapas 4.3.1-4.3.4 com 0,5 mL e 0,25 mL da solução NH3BH3 (40 mg/mL), respectivamente, para registrar o tempo de conclusão da liberação de hidrogênio.
- Calcule a taxa de reação de acordo com a seguinte equação44:
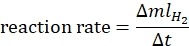
onde ΔmlH2 é o volume de hidrogênio produzido, Δt é o tempo necessário para 70 mL de liberação de hidrogênio. - Plote a taxa de Ln vs. In[ammonia borane] e determine a inclinação do gráfico.
- Determinação da relação entre [catalisadores] e taxa de produção
- Coloque a temperatura do banho de água em 40 °C.
- Coloque 40 mg do catalisador e 10 mL de água no frasco de Schlenk e mergulhe no banho de água. Sonicate a solução a 40 kHz em um banho ultrassônico por 6 min.
- Injete 1 mL da solução NH3BH3 (40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Regissue o tempo para a conclusão da liberação do hidrogênio.
- Repita as etapas 4.4.1-4.4.4 variando a quantidade de catalisador (20 mgs, 40 mgs, 60 mgs, 80 mgs) e injete 1 mL da solução NH3BH3 (ou seja, 40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Registo o tempo para conclusão da liberação de hidrogênio para usar as quantidades acima de vários catalisadores.
- Calcule a taxa de reação de acordo com a seguinte equação44:
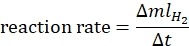
onde ΔmlH2 é o volume de hidrogênio produzido, Δt é o tempo necessário para 70 mL de liberação de hidrogênio. - Plote a taxa de Ln vs. Ln[catalisador] e determine a inclinação do gráfico.
5. Teste de desempenho do ciclismo
- Coloque a temperatura do banho de água em 40 °C.
- Coloque 0,04 g do catalisador e 10 mL de água no frasco de Schlenk e mergulhe no banho de água. Sonicate a solução a 40 kHz em um banho ultrassônico por 6 min.
- Injete 1 mL da solução NH3BH3 (40 mg·mL-1) no reator para iniciar a reação de hidrólise.
- Regissue o tempo para a conclusão da liberação do hidrogênio.
- Filtre o catalisador, lavado com água (5 mL) três vezes e, em seguida, seque o catalisador no forno (60 °C) por 3h.
- Coloque o catalisador em 10 mL de água e sonicar a solução a 40 kHz em um banho ultrassônico.
- Repetia as etapas 5.1.3-5.1.5 por dez vezes.
- Plote o volume de produção de hidrogênio, TOF e taxa de geração específica versus ciclos, respectivamente.
6. Experimento de leaching para NPs metálicos para obter SAs de metal puro CNT
- Coloque a temperatura do banho de óleo em 80 °C.
- Coloque 0,15 g do catalisador e 50 mL de 0,5 M H2SO4 no frasco de Schlenk e mergulhe no banho de óleo.
- Mexa a reação por 2h.
- Filtre o sólido usando um funil Buchner e lave o sólido com água deionizada (3x em 10 mL cada). Diluir o lixiviação ainda mais para 250 mL em um frasco volumoso de 250 mL.
- Colete os sólidos de metal nanopartículas-lixiviação (que contêm apenas CNT co-dopado) e seque a 60 °C em um forno.
7. Determinação de conteúdo metálico usando espectroscopia óptica de emissão óptica de plasma indutivamente acoplado (ICP-OES)
- Determinação do conteúdo total de metal de cobalto
- Coloque aproximadamente 0,02 g de catalisador preparado da seção 2 em 50 mL de solução de ácido de 2 M (HCl: HNO3 = 3:1 mole ratio)45,46 em uma autoclave de aço inoxidável forrada com politetrafluoroetileno.
- Coloque o recipiente forrado de politefluoroetileno na bomba de aço inoxidável e proteja a tampa.
- Coloque a bomba em um forno, coloque a temperatura para 180 °C e aqueça a bomba por 12 h.
- Remova a bomba e esvazie o conteúdo. Filtre o sólido e dilua o soluto em um frasco volumoso de 250 mL com 200 mL de água deionizada.
NOTA: O objetivo da diluição é ajustar a concentração das amostras de ICP, que se encaixarão na faixa de concentração padrão metálica, ou seja, de 0-40 ppm. - Execute o teste ICP-OES da solução e calcule a quantidade total de Co em wt%.
- Determinação do conteúdo dos átomos de cobalto na CNT
- Coloque aproximadamente 0,02 g de catalisador preparado da etapa 6.5 para 50 mL de solução de ácido de 2 M (HCl: HNO3 = 3:1 mole ratio)45,46 em uma autoclave de aço inoxidável revestida de politetrafluoroetileno.
- Coloque o recipiente forrado de politefluoroetileno na bomba de aço inoxidável e proteja a tampa.
- Coloque a bomba em um forno, coloque a temperatura para 180 °C e aqueça a bomba por 12 h.
- Remova a bomba e esvazie o conteúdo. Filtre o sólido e dilua o soluto em um frasco volumoso de 250 mL com 200 mL de água deionizada.
NOTA: O objetivo da diluição é ajustar a concentração das amostras de ICP, que se encaixarão na faixa de concentração padrão metálica, ou seja, de 0-40 ppm. - Execute o teste ICP-OES da solução e calcule a quantidade de conteúdo de átomo co em wt%.
- Determinação do conteúdo das nanopartículas de cobalto (NPs)
- A diferença entre o teor metálico de 7.1.5 e 7.2.5 é o wt% dos Co NPs.
Resultados
Os padrões de difração de raios-X (XRD) foram obtidos para determinar a cristalina e o tamanho dos NPs de cobalto. Como mostrado na Figura 1, os picos de difração correspondentes aos (111), (200) e (220) (220) (a 2φ de 44,2°, 51,5°, e 75,8° respectivamente) da fase cúbica do cobalto metálico estavam presentes em concordância com o arquivo jcpds (Comitê Conjunto para Padrões de Difração em Pó) (cartão nº 15-0806)47. O pico amplo em 2φ de cerca de 26...
Discussão
O método de pirólise tornou-se uma das estratégias poderosas na síntese de nanomateriais unidimensionais em vários suportes sólidos dotados de heteroatoma com tamanhos controlados de NPs. Por exemplo, a estratégia de pirólise nanoespacial confinada foi relatada por Guo et al.56. Resumidamente, os precursores de MWCNTs, cobalto e fósforo pré-tratados foram pirolisados a 800 °C sob atmosfera N2 , e os CoP NPs suportados no N-CNT podem ser obtidos. A presença dos micro-poros po...
Divulgações
Não temos nada para revelar.
Agradecimentos
Este trabalho foi totalmente financiado pelo Comitê de Subsídios da Universidade de Hong Kong - Fundo de Pesquisa Colaborativa do Programa de Desenvolvimento Institucional (IDS), número de subvenção UGC/IDS(C)14/B(E)01/19, o Programa de Desenvolvimento do Corpo docente (FDS), número de subvenção UGC/FDS25/E08/20 e parcialmente financiado pelo Regime de Desenvolvimento Institucional (IDS), número de subvenção UGC/IDS(R)25/20.
.
Materiais
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
Referências
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243 (2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087 (2021).
- Sun, B. -. W., Li, H. -. J., Yu, H. -. Y., Qian, D. -. J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -. F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48 (2020).
- Yang, X. -. F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319 (2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576 (2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070 (2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4 (2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460 (2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422 (2021).
- Wang, H., Lee, J. -. M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426 (2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -. Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -. C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados