A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינתזה של ננו-חלקיקי מתכת הנתמכים על ננו-צינוריות פחמן עם אטומי Co ו-N מסוממים ויישומיה הקטליטיים בייצור מימן
* These authors contributed equally
In This Article
Summary
כאן אנו מציגים פרוטוקול לסינתזה של ננו-חלקיקי Co הנתמכים בננו-צינוריות פחמן עם דופנטים Co ו-N לייצור מימן.
Abstract
כאן מוצגת שיטה לסינתזה של זרזים ננומטריים הנתמכים על גבי ננו-צינוריות פחמן עם קובלט וחנקן המפוזרים באופן אטומי. האסטרטגיה החדשנית מבוססת על טיפול פירוליזה בסיר אחד של קובלט (II) אצטילאצטונאט ומבשרים אורגניים עשירים בחנקן תחת אטמוספירת Ar בטמפרטורה של 800 מעלות צלזיוס, וכתוצאה מכך נוצרות ננו-צינוריות פחמן מסוממות Co ו-N עם מורפולוגיה דמוית תולעת אדמה. הזרז המתקבל נמצא כבעל צפיפות גבוהה של אתרי פגם, כפי שאושר על ידי ספקטרוסקופיית ראמאן. כאן, ננו-חלקיקי קובלט (II) התייצבו על ננו-צינוריות פחמן מסוממות קובלט וחנקן המפוזרות אטומית. הזרז אושר כיעיל בהידרוליזה הקטליטית של אמוניה בוראן, שבה תדירות התחלופה הייתה 5.87 מול H 2·מול Co-1·min-1, וקצב ייצור המימן הספציפי נקבע להיות 2447 מ"ל H2·g Co-1·min-1. פונקציה סינרגטית בין ננו-חלקיקי Co לבין ננו-צינוריות פחמן מסוממות הוצעה לראשונה בהידרוליזה הקטליטית של תגובת אמוניה בוראן במצב מתון. ייצור המימן המתקבל עם צפיפות האנרגיה הגבוהה שלו וזמן התדלוק המינימלי יכול להתאים לפיתוח עתידי כמקורות אנרגיה ליישומים ניידים ונייחים כגון משאיות כביש ומלגזות בהובלה ובלוגיסטיקה.
Introduction
פיתוח זרזים זולים ויעילים ביותר לייצור אנרגיה מתחדשת נותר אחת הבעיות הקריטיות והמאתגרות ביותר להקלה על משבר האנרגיה. עם זאת, הוא רחוק מלהיות יישומים מעשיים בשל מספר חששות, כגון שיטות ייצור בקנה מידה גדול עם ביצועים אמינים, עלות ייצור גבוהה ויציבות ארוכת שנים כדי להאריך את חיי השירות של זרזים. מגזרי תעשייה, כמו תחבורה ולוגיסטיקה, דורשים ייצור אנרגיה עבור כלי רכב וציוד עם שעות פעולה ארוכות, אספקת אנרגיה בהספק גבוה וזמן תדלוק מינימלי בהשגת פעולות יעילות 1,2,3. לכן, אסטרטגיות יעילות נוצלו באופן נרחב כדי להתמודד עם האתגרים הטכניים לעיל. לדוגמה, על ידי ויסות המבנה האלקטרוני של האתרים הפעילים במתכת ותמיכות הזרז, תכנון הארכיטקטורה הספציפית של הננו-זרזים המתכתיים, כוונון עדין של הרכבי המתכת, שינוי קבוצתי פונקציונלי של תמיכה מעוגנת, ושינוי המורפולוגיה כדי להגדיל את מספר האתרים הפעילים הפנימיים. בעשורים האחרונים, ננו-חלקיקים (NPs) שלטו בתחומים של קטליזה הטרוגנית שונים, וניתן לכוונן ביעילות את הפעילויות הקטליטיות על ידי שינוי גודל ה-NPs. רק שבשנים האחרונות, זרזים חד-אטומיים מפוזרים מאוד (SACs) התגלו כבעלי תכונות מצוינות כלפי תגובות קטליטיות רבות בשל המבנה האלקטרוני הייחודי שלהם וסביבת התיאום שלהם. במיוחד, SACs כבר הוכיחו ביצועים מעולים בהמרת אנרגיה כגון תגובות אלקטרוכימיות (HER, ORR, OER) ומערכות אנרגיה אלקטרוכימיות (למשל, סופר-קבלים, סוללות נטענות)4,5,6. בעוד שגם ל-NPs וגם ל-SACs יש יתרונות ומגבלות בהתאמה ביישומים קטליטיים, קיימות תגובות הדורשות גם NPs וגם SACs כדי להגביר את התגובה הקטליטית. לדוגמה, Ru NPs הנתמכים במבנה-על של ננו-צינוריות-פחמן מסוממות Ni ו-N יכולים להקל על חמצון האוויר הרטוב הקטליטי הגבוה של חומצה אצטית7. השפעה סינרגטית זו הודגמה גם על ידי זרזים Pd1+NPs/TiO2 עבור הידרוגנציה סלקטיבית מאוד של קטון ואלדהידים בטמפרטורות חדר8. על מנת להאיץ את התחום של קטליזה סינרגטית של NPs ו- SACs ולחקור יותר על היישומים הקטליטיים שלהם, דרך קלה של סינתזת זרזים רצויה מאוד, והכנסת עומסים גבוהים של האתר הפעיל המפוזר אטומית נותרה אתגר בשל הנטייה הגבוהה של צבירה של SACs9.
מספר שיטות שימשו לסינתזה של SACs ליישומים בהידרוגנציה של ניטרוארנים10, תגובת הפחתת חמצן ותגובת אבולוציה של מימן 11,12, סוללות ליתיום-חמצן13. האסטרטגיה הנפוצה ביותר היא הגישה מלמטה למעלה, שבה מבשרי המתכת נספגו, הופחתו והושתקו על הפגמים של התמיכה המתאימה. קומפלקסים של מתכות חד-גרעיניות יכולים גם להיות מחוברים תחילה לקבוצה הפונקציונלית של תומכים, ולאחר מכן להסיר את הליגנדות האורגניות, ובכך ליצור אתרי מתכת פעילים לתהליך הקטליטי. תצהיר שכבה אטומית (ALD) הוא ככל הנראה ההליך הנפוץ ביותר לייצור מלמטה למעלה על ידי הפקדת שכבה דקה של סרט על המצע עם חשיפה חוזרת ונשנית של מגיבים. למרות שניתן היה לשלוט במדויק בגודל הזרז וניתן היה לשפר מאוד את התגובה14, טוהר המצע היה תובעני למדי, ועומס המתכת היה נמוך יחסית, ובכך הביא לעלויות ייצור גבוהות עבור יישומים מעשיים. שיטות שונות כגון הספגה ישירה, משקעים משותפים ומשקעים משקעים, שימשו לשיתוק ננו-חלקיקי מתכת על משטחי התמיכה, כגון תחמוצת מתכת וניטריד, באמצעות אפקטים של טעינה על פני השטח. עם זאת, הגדלת העמסת המתכת מובילה בדרך כלל להצטברות משמעותית ולהיווצרות צבירים של אטומי המתכת או הננו-חלקיקים. לכן, בדרך כלל, נדרש פתרון מתכת מדולל מאוד, ובכך מוביל להעמסת SACs נמוכה של הזרזים15. ליגנדות אמין כגון פננתרולין שימשו כדי לעבור פירוליזה עם מבשרי מתכת כדי להכין זרזים מתכתיים מפוזרים אטומית עם אתרים פעילים Co-Nx פעיל מאוד עבור dehydrogenation סלקטיבית של חומצה פורמית. עם זאת, עומס המתכת היה נמוך יחסית (2-3 wt%) בשל המספר המוגבל של אטומי N זמינים במבשרי האמין16.
בעשורים האחרונים, מימן נחשב כחלופה פוטנציאלית להחלפת דלקי מאובנים או פחמימנים, כגון פחם, גז טבעי ובנזין, בשל היתרון של אפס פליטה של הראשון. עד כה, כ-94% מהמימן המסחרי עדיין מופק מתהליך הרפורמה של דלקי המאובנים, שבו התהליך משחרר הרבה מאוד גזי חממה.17. לכן, הפקת מימן ממשאבים מתחדשים כגון אלקטרוליזה של מים היא דרך לפתור את הבעיה של משאבי מאובנים מדולדלים ופליטות פחמן חמורות. עם זאת, יעילות ייצור המימן הנמוכה הפריעה ליישומים הרחבים יותר שלהם. לפיכך, כדי להתגבר על מחסום האנרגיה הקינטית הזו לפיצול מים, התגלו בעשור האחרון אלקטרוקטליסטים יעילים רבים18. בעיה נוספת היא בעיית האחסון בשל האופי הגזי והנפיץ של גז מימן בתנאי סביבה. שיטות אחסון פיזיקליות כגון דחיסה ידרשו לדחוס את המימן עד 700-800 בר, ואחסון קריוגני על ידי הנזלה ידרוש טמפרטורה נמוכה ב -253 מעלות צלזיוס19. למרות שכלי רכב ממוסחרים המונעים בתאי דלק מימן הודגמו בהצלחה, בעיית האחסון טרם נפתרה אם הטכנולוגיה תשמש ביישומים רחבים יותר, כגון התקנים זעירים ותאי דלק זעירים. לפיכך, שיטות אחסון של שימוש בחומרים כימיים H היו אחד המוקדים החמים בחקר אנרגיית מימן. כמה דוגמאות לחומרי אחסון כימיים H הם אמוניה בוראן (AB)20חומצה פורמית (FA),21גז אמוניה,22נתרן אלנאט,23ומגנזיום הידריד,24. בין אלה, AB יש משקל מולקולרי נמוך (30.7 גרם·mol-1), צפיפות גרבימטרית ונפחית גבוהה (196 gH2·ק"ג-1 ו-146 ג'יגה-ה2· L-1בהתאמה)., חוץ מזה, מדובר בתרכובת יציבה לאוויר וללחות, לא רעילה ומסיסה מאוד במים. ננו-חלקיקי מתכת על חומרים נתמכים שונים היו בשימוש נרחב כדי לשחרר את שלוש המקבילות של מימן מ-AB, כגון פלטינה- (Pt-), פלדיום- (Pd-), רותניום- (Ru-), קובלט- (Co-) וזרזים מבוססי ניקל-(Ni). זרזים הטרוגניים מבוססי שיתוף הנתמכים בחומרי פחמן מושכים תשומת לב רבה במיוחד בשל עלותם הנמוכה, השפע הגבוה וקלות ההתאוששות שלהם. דווח על מספר אסטרטגיות סינתטיות, כגון Co NPs הנתמכים על תחמוצת גרפן מסועפת המעוטרת בפוליאתילנימין25. המבנה התלת-ממדי עם שטח פנים גדול מבטיח את ייצובם של Co NPs תוך שמירה על טווח הגודל של 2-3 ננומטר ומניעת צבירה של NPs. אסטרטגיה נוספת היא להשתמש בחומרי פחמן מסוממים N כדי לתמוך ב- Co NPs עם גדלים קטנים. שימוש ב- Co(salen)26 וקו-מ"ף27 (מסגרת אורגנית מתכתית) כמו מבשרים, Co NPs של 9.0 ננומטר ו 3.5 ננומטר נתמך על N מסוממים פחמן נקבובי הוכנו בהתאמה. היציבות לקראת הידרוליזה של AB גבוהה והתגובתיות יכולה לשמור על יותר מ-95% מהפעילות הראשונית לאחר 10 ריצות תגובה. לאחרונה, זרזים עם מיקרו/ננו-מבנים חלולים נוצלו להידרוליזה של AB. חומרים אלה מוכנים באופן קונבנציונלי בשיטות הידרותרמיות והיו בשימוש נרחב עבור סוללות ליתיום-יון, סופר-קבלים, חיישנים כימיים ומחקר קטליזה הטרוגנית. לפיכך, סינרגיית הנחושת-קובלט לקראת הידרוליזה של AB הודגמה על ידי CuMoO החלול4-CoMoO428המעניק TOF גבוה של 104.7 דקות-,1. דוגמאות אחרות התלויות מאוד במבנה כוללות את מעטפת הליבה CuO-NiO/Co3O429ה-Co,xCu1−xשיתוף2O4@CoyCu1−yשיתוף2O4 סוג קליפת חלמון30וה-Ni,0.4Cu0.6שיתוף2O4 ננומערכים31 נמצאו גם פעילים לקראת הידרוליזה של AB. סוג אחר של חומרים מתפתחים הידועים כזרזים הטרו-מובנים, כגון MXenes והידרוקסידים כפולים שכבתיים (LDHs), מנוצלים יותר ויותר לתגובה אלקטרוקטליטית ופוטוקטליטית32,33,34,35. חומרים אלה כגון הידרוקסיד כפול שכבתי NiFe36,37 וחומרי ה-CoB-N בעלי הטרו-ממשקים של פחמן קובלט מסוממים N38 פעילים במיוחד לאבולוציה של חמצן ולתגובת הפחתתו. באופן עקרוני, הם יכולים להיות מנוצלים עוד יותר לתגובות אבולוציה של מימן מחומרי אחסון מימן כגון אמוניה בוראן39. מקסום האינטראקציה בין הזרזים והמצעים הוא גם אסטרטגיה נוספת להידרוליזה של AB. צ'יאנג ואחרים השתמשו בקבוצת תחמוצת פני השטח של תחמוצת גרפן כדי ליצור מין מורכב יזום עם AB40ולכן ני,0.8נק'0.2/GO ו-rGO הפגינו תגובתיות מצוינת לקראת הידרוליזה של AB. השימוש ב-α-MoC כתמיכה בזרזים דו-מתכתיים של Co ו-Ni סייע להפעלה של מולקולות מים והשיג TOF גבוה לקראת הידרוליזה של AB, שהוא גבוה פי ארבעה מזרז Pt/C המסחרי41.
תוך ניצול תכולת N גבוהה של הדיקיאנדיאמיד וחומרים קשורים C3N4 , פרוטוקול להשגת סינתזה קלה של NPs קובלט הנתמכים על ננו-צינוריות פחמן מסוממות Co ו- N מפוזרות מאוד מוצג כאן. היווצרות ה-in-situ ההדרגתית של Co NPs מה-Co המפוזר באופן אטומי במהלך הפירוליזה של חומרי C3N4 מבטיחה כי 1) Co NPs ו-Co dopants מפוזרים מאוד; 2) Co NPs יכול להיות מעוגן חזק על תומך פחמן מסומם 3) גודל Co NPs יכול להיות נשלט בקפידה על ידי הטמפרטורה והזמן של פירוליזה. ה-Co/Co-N-CNT כפי שהוכן, כתוצאה מה-Co NPs המעוגנים בחוזקה והיכולת של ה-Co dopants להוריד את אנרגיית הספיחה של מולקולות מים, נמצא כבעל יציבות מעולה כלפי הידרוליזה של AB לייצור מימן. פרטי הפרוטוקול הסינתטי של הזרזים ומדידת ייצור המימן יהיו המוקד של דו"ח זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
התראה: מומלץ לקוראים לבדוק היטב את התכונות והרעילות של הכימיקלים המתוארים במאמר זה לקבלת טיפול כימי נאות מגיליונות נתוני בטיחות החומרים (MSDS) הרלוונטיים. חלק מהכימיקלים שבהם נעשה שימוש מזיקים לבריאות, ויש לנקוט בטיפולים מיוחדים. ההשפעה של ננו-חומרים על בריאות האדם אינה ידועה ועלולה להוות סיכון בטיחותי ובריאותי. יש להימנע משאיפה ומגע דרך העור עם חומרים אלה. כמו כן, יינקטו אמצעי זהירות, כגון שחרור גז הפסולת במהלך סינתזת הזרז למכסה האדים והערכת ביצועי הזרז עם אוורור נכון של גז המימן. מומלץ ללבוש ציוד מגן אישי בכל עת. מימן הוא גז שעלול להיות נפיץ עם טווח דליקות רחב מאוד בין 4%-74% באוויר. יש להקפיד לאפשר לגז המימן להתאוורר כראוי לאטמוספרה.
1. סינתזה של חומרי מלם-C 3N4
- שוקלים 280 גרם של דיקיאנדיאמיד (צפיפות = 1.4 גרם·cm-3) לתוך של 800 מ"ל.
- מניחים את הכוס עם המוצק הנ"ל לתוך תנור עמום ולאט לאט להעלות את הטמפרטורה מטמפרטורת החדר ל 350 מעלות צלזיוס עם רמפה של 5 °C ·min-1.
- שומרים על טמפרטורה של 350 מעלות צלזיוס למשך שעתיים, מקררים את הכבשן על ידי קירור טבעי.
- טוחנים את המוצקים הלבנים המתקבלים לאבקה דקה כחומרי C3N4 בצורת מלם (DCD-350).
הערה: התשואה היא 175 גרם.
2. חישול תערובות מלם-C 3N4 ו-Co(acac)2 בטמפרטורה שונה
- מערבבים 10.0 גרם של מלם-C 3 N 4 עם 0.218 גרם של Co(acac)2 [Co : melem-C3N4 = 1:200 (יחס משקל)]. טוחנים ומערבבים את שני המוצקים עד לצפייה בצבע ההומוגני.
- הוסף 6 מ"ל של תמיסת חומצת לימון (מים: אתנול = 1:1, חומצת לימון = 10 גרם· L-1) לתערובת הומוגנית וטחינה נוספת של החומרים.
- מייבשים את החומרים בתנור ב 60 מעלות צלזיוס במשך 6 שעות.
- מניחים את החומרים לתוך כור היתוך בצורת ריבוע ולאחר מכן לשים אותו לתוך תנור צינורי.
- מחממים את החומרים בקצב חימום של 2.6°C·min-1 מטמפרטורת החדר ל-800°C ושומרים למשך שעתיים תחת זרימת Ar של 100 מ"ל·min-1.
- קררו את הכבשן באיטיות על ידי קירור טבעי.
- שקלול דגימות הזרז. כאן, התשואה היתה 0.65 גרם.
3. מדידת שחרור מימן מאמוניה בוראן הידרוליזה
- הגדר את מערכת הצילינדרים ההפוכים המלאים במים (איור משלים 1).
- הגדירו את תמיסת הכביסה 0.1 M H2SO4 .
- חבר את בקבוק Schlenk עם תמיסת הכביסה והגליל ההפוך המלא במים.
- הגדר את טמפרטורת אמבט המים ל 40 °C (75 °F).
- מניחים 0.04 גרם של זרז לתוך בקבוק Schlenk.
- הכן תמיסה של אמוניה בוראן במים, עם 0.04 גרם של אמוניה בוראן ב 0.948 מ"ל של מים (ריכוז = 0.04 גרם·mL-1).
- להזריק 1 מ"ל של תמיסתNH 3 BH3 (40 מ"ג·mL-1) לכור כדי ליזום את תגובת ההידרוליזה.
- עקוב אחר הירידה במפלס המים ככל שהתגובה מתקדמת. רשום בקפידה את נפח הייצור בזמנים המיועדים לכך, למשל, כל מרווח של 5 שניות.
- התווה את גרף נפח הייצור של H2 לעומת הזמן בדקות.
4. מחקרים קינטיים
- קביעת אנרגיית השפעול
- הגדר את טמפרטורת אמבט המים ב 40 °C (75 °F).
- הכניסו 0.04 גרם של הזרז ו-10 מ"ל מים לתוך בקבוק שלנק וטבלו לתוך אמבט המים. סוניק את הפתרון ב 40 kHz באמבט קולי במשך 6 דקות.
- להזריק 1 מ"ל של תמיסתNH 3 BH3 (40 מ"ג·mL-1) לכור כדי ליזום את תגובת ההידרוליזה.
- רשום את הזמן להשלמת שחרור המימן.
- חזור על שלבים 4.1.1-4.1.4 הגדרת טמפרטורת אמבט המים ב 35 מעלות צלזיוס.
- חזור על הניסוי לעיל ב 30 °C ו 25 °C, בהתאמה.
- התווה את קבוע הקצב הספציפי לעומת הזמן בגרף באמצעות המשוואה הבאה. חלקה של ln k ו- 1/T אמורה להניב קו ישר.
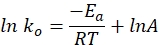
כאשר ko מציין את קבוע הקצב הספציפי (mol H 2·g Co-1·min-1), R הוא קבוע הגז האידיאלי (8.314 kJ·mol-1), T מייצג את טמפרטורת התגובה (K), ו- A הוא הגורם הקדם-מעריכי (mol H2 gCo-1·min-1).
- קביעת תדירות המחזור וקצב ייצור המימן הספציפי
- חישוב תדירות המחזור לפי המשוואה הבאה:
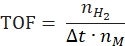
כאשר nH2 הוא השומות של מימן המיוצר, Δt הוא הזמן הדרוש לשחרור מימן מלא ו-nM הוא כמות המתכת הטוחנת בזרז. - חישוב קצב ייצור המימן הספציפי על פי המשוואה הבאה42,43:
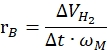
כאשר ΔVH2 הוא נפח המימן המיוצר, t הוא הזמן הדרוש לשלבי הייזום והייצוב (למשל, הזמן שבו 70 מ"ל מימן נוצר עבור 40 מ"ג אמוניה בוראן, הזמן שבו 140 מ"ל מימן שנוצר עבור 80 מ"ג אמוניה בוראן) ו- ωM הוא מסת המתכת בזרז.
- חישוב תדירות המחזור לפי המשוואה הבאה:
- קביעת הקשר בין [אמוניה בוראן] לבין קצב התגובה
- הגדר את טמפרטורת אמבט המים ב 40 °C (75 °F).
- הכניסו 40 מ"ג של הזרז ו-10 מ"ל מים לתוך בקבוק שלנק וטבלו לתוך אמבט המים. סוניק את הפתרון ב 40 kHz באמבט קולי במשך 6 דקות.
- להזריק 1 מ"ל של תמיסתNH 3 BH3 (40 מ"ג·mL-1) לכור כדי ליזום את תגובת ההידרוליזה.
- רשום את הזמן להשלמת שחרור המימן.
- חזור על שלב 4.3.3 הזרקת 2 מ"ל של תמיסת NH3 BH3 (כלומר, 80 מ"ג לכל 2 מ"ל) לכור כדי ליזום את תגובת ההידרוליזה.
- חזור על שלבים 4.3.1-4.3.4 עם 0.5 מ"ל ו-0.25 מ"ל של תמיסתNH 3 BH3 (40 מ"ג/מ"ל) בהתאמה כדי לתעד את הזמן להשלמת שחרור המימן.
- חישוב קצב התגובה לפי המשוואה הבאה44:
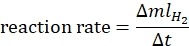
כאשר ΔmlH2 הוא נפח המימן המיוצר, Δt הוא הזמן הדרוש לשחרור מימן של 70 מ"ל. - שרטטו את שיעור ה-ln לעומת ln[אמוניה בוראן] וקבעו את שיפוע הגרף.
- קביעת הקשר בין [זרזים] לקצב הייצור
- הגדר את טמפרטורת אמבט המים ב 40 °C (75 °F).
- הכניסו 40 מ"ג של הזרז ו-10 מ"ל מים לתוך בקבוק שלנק וטבלו לתוך אמבט המים. סוניק את הפתרון ב 40 kHz באמבט קולי במשך 6 דקות.
- להזריק 1 מ"ל של תמיסתNH 3 BH3 (40 מ"ג·mL-1) לכור כדי ליזום את תגובת ההידרוליזה.
- רשום את הזמן להשלמת שחרור המימן.
- חזור על שלבים 4.4.1-4.4.4 תוך שינוי כמות הזרז (20 מ"ג, 40 מ"ג, 60 מ"ג, 80 מ"ג) והזרקת 1 מ"ל של תמיסתNH 3 BH3 (כלומר, 40 מ"ג·מ"ל-1) לכור כדי ליזום את תגובת ההידרוליזה.
- רשום את הזמן להשלמת שחרור המימן לשימוש בכמויות הזרזים השונות לעיל.
- חישוב קצב התגובה לפי המשוואה הבאה44:
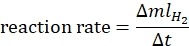
כאשר ΔmlH2 הוא נפח המימן המיוצר, Δt הוא הזמן הדרוש לשחרור מימן של 70 מ"ל. - התווה את קצב ln לעומת ln[זרז] וקבע את שיפוע הגרף.
5. מבחן ביצועי רכיבה על אופניים
- הגדר את טמפרטורת אמבט המים ב 40 °C (75 °F).
- הכניסו 0.04 גרם של הזרז ו-10 מ"ל מים לתוך בקבוק שלנק וטבלו לתוך אמבט המים. סוניק את הפתרון ב 40 kHz באמבט קולי במשך 6 דקות.
- להזריק 1 מ"ל של תמיסתNH 3 BH3 (40 מ"ג·mL-1) לכור כדי ליזום את תגובת ההידרוליזה.
- רשום את הזמן להשלמת שחרור המימן.
- מסננים את הזרז, שוטפים במים (5 מ"ל) שלוש פעמים, ואז מייבשים את הזרז בתנור (60 מעלות צלזיוס) במשך 3 שעות.
- מניחים את הזרז ב 10 מ"ל של מים ו sonicate את הפתרון ב 40 kHz באמבטיה קולית.
- חזור על שלבים 5.1.3-5.1.5 במשך עשר פעמים.
- התווה את נפח ייצור המימן, TOF וקצב ייצור ספציפי לעומת מחזורים, בהתאמה.
6. ניסוי שטיפה עבור NPs מתכת כדי להשיג מתכת טהורה SAs CNT
- הגדר את טמפרטורת אמבט השמן ב 80 °C (80 °F).
- מניחים 0.15 גרם של הזרז ו 50 מ"ל של 0.5 M H2SO4 לתוך בקבוק Schlenk לטבול לתוך אמבט שמן.
- מערבבים את התגובה במשך שעתיים.
- מסננים את המוצק באמצעות משפך בוכנר ושוטפים את המוצק במים שעברו דה-יוניזציה (פי 3 ב-10 מ"ל כל אחד). יש לדלל את השטיפה עוד יותר ל-250 מ"ל בבקבוק נפחי של 250 מ"ל.
- אספו את המוצקים המתכתיים בעלי ננו-חלקיקים (המכילים רק CNT מסומם) ויבשו בטמפרטורה של 60 מעלות צלזיוס בתנור.
7. קביעת תכולת מתכת באמצעות ספקטרוסקופיית פליטה אופטית של פלזמה מצומדת אינדוקטיבית (ICP-OES)
- קביעת תכולת מתכת קובלט כוללת
- יש להניח כ-0.02 גרם של זרז מוכן מסעיף 2 ל-50 מ"ל של תמיסת חומצה 2 M (HCl: HNO 3 = יחס שומה של3:1)45,46 באוטוקלב מפלדת אל-חלד מרופד בפוליטטרפלואורואתילן.
- הכניסו את המיכל המרופד בפוליטטרפלואורואתילן לתוך פצצת הנירוסטה ואבטחו את הפקק.
- מכניסים את הפצצה לתנור, מכוונים את הטמפרטורה ל-180 מעלות צלזיוס ומחממים את הפצצה למשך 12 שעות.
- הסר את הפצצה ורוקן את התכולה. מסננים את המוצק ומדללים את המומס בבקבוק נפחי של 250 מ"ל עם 200 מ"ל של מים שעברו דה-יוניזציה.
הערה: מטרת הדילול היא להתאים את ריכוז דגימות ה- ICP, אשר יתאימו לטווח הריכוזים הסטנדרטי המתכתי, כלומר 0-40 עמודים לדקה. - הפעל את בדיקת ICP-OES של הפתרון וחשב את הסכום הכולל של Co ב- wt%.
- קביעת תכולת אטומי הקובלט ב- CNT
- יש להניח כ-0.02 גרם של זרז מוכן משלב 6.5 ל-50 מ"ל של תמיסת חומצה 2 M (HCl: HNO 3 = יחס שומה של3:1)45,46 באוטוקלב מפלדת אל-חלד מרופד בפוליטטרפלואורואתילן.
- הכניסו את המיכל המרופד בפוליטטרפלואורואתילן לתוך פצצת הנירוסטה ואבטחו את הפקק.
- מכניסים את הפצצה לתנור, מכוונים את הטמפרטורה ל-180 מעלות צלזיוס ומחממים את הפצצה למשך 12 שעות.
- הסר את הפצצה ורוקן את התכולה. מסננים את המוצק ומדללים את המומס בבקבוק נפחי של 250 מ"ל עם 200 מ"ל של מים שעברו דה-יוניזציה.
הערה: מטרת הדילול היא להתאים את ריכוז דגימות ה- ICP, אשר יתאימו לטווח הריכוזים הסטנדרטי המתכתי, כלומר 0-40 עמודים לדקה. - הפעל את בדיקת ICP-OES של התמיסה וחשב את כמות תוכן אטום Co ב- wt%.
- קביעת תכולת הננו-חלקיקי קובלט (NPs)
- ההבדל בין תכולת המתכת של 7.1.5 ו 7.2.5 הוא wt% של Co NPs.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תבניות עקיפה של קרני רנטגן (XRD) התקבלו כדי לקבוע את הגבישיות והגודל של NPs קובלט. כפי שניתן לראות באיור 1, פסגות עקיפה המתאימות למישורים (111), (200) ו-(220) (ב-2θ של 44.2°, 51.5° ו-75.8° בהתאמה) של הפאזה המעוקבת של קובלט מתכתי נכחו בהסכמה עם קובץ עקיפת הכוח JCPDS (הוועדה המשותפת לתקני עקיפת אבקה) ...
Access restricted. Please log in or start a trial to view this content.
Discussion
שיטת הפירוליזה הפכה לאחת האסטרטגיות החזקות בסינתזה של ננו-חומר חד-ממדי על תמיכות מוצקות מסוממות הטרואטומיות שונות עם גדלים מבוקרים של NPs. לדוגמה, אסטרטגיית הפירוליזה המוגבלת בננו-חלל דווחה על ידי Guo et al.56. בקצרה, מבשרי MWCNTs, קובלט וזרחן שטופלו מראש היו פירוליזה בטמפרטורה של 800 מע...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין לנו מה לחשוף.
Acknowledgements
עבודה זו מומנה במלואה על ידי ועדת המענקים של אוניברסיטת הונג קונג - תוכנית פיתוח מוסדית (IDS) מענק מחקר שיתופי, מענק מספר UGC/IDS(C)14/B(E)01/19, תוכנית פיתוח הפקולטה (FDS), מענק מספר UGC/FDS25/E08/20 ומומן בחלקו על ידי תוכנית הפיתוח המוסדית (IDS), מענק מספר UGC/IDS(R)25/20.
.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
References
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243(2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087(2021).
- Sun, B. -W., Li, H. -J., Yu, H. -Y., Qian, D. -J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48(2020).
- Yang, X. -F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319(2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576(2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070(2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4(2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), Basel. 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460(2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422(2021).
- Wang, H., Lee, J. -M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426(2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved