Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтез металлических наночастиц, поддерживаемых на углеродных нанотрубках с легированными атомами Co и N, и его каталитические применения в производстве водорода
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол синтеза наночастиц Co, поддерживаемых на углеродных нанотрубках с Co- и N-легирующими веществами для производства водорода.
Аннотация
В настоящем описан способ легкого синтеза наноструктурированных катализаторов, поддерживаемых на углеродных нанотрубках с атомарно диспергированным кобальтом и азотным легирующим веществом. Новая стратегия основана на легкой пиролизной обработке кобальта (II) ацетилацетоната и богатых азотом органических предшественников в атмосфере Ar при 800 °C, что приводит к образованию ко- и N-легированных углеродных нанотрубок с морфологией, подобной дождевым червям. Было обнаружено, что полученный катализатор имеет высокую плотность участков дефектов, что подтверждается рамановской спектроскопией. Здесь наночастицы кобальта (II) были стабилизированы на атомарно диспергированных углеродных нанотрубках, легированных кобальтом и азотом. Было подтверждено, что катализатор эффективен при каталитическом гидролизе аммиачного борана, при котором частота оборота составляла 5,87 моль Н2·моль Co-1·мин-1, а удельная скорость генерации водорода была определена как 2447 мл Н2·г Co-1·мин-1. Синергетическая функция между наночастицей Co и легированными углеродными нанотрубками была впервые предложена в реакции каталитического гидролиза аммиака борана в мягких условиях. Полученное в результате производство водорода с его высокой плотностью энергии и минимальным временем заправки может быть пригодно для будущего развития в качестве источников энергии для мобильных и стационарных применений, таких как автомобильные грузовики и вилочные погрузчики в транспорте и логистике.
Введение
Разработка недорогих и высокоэффективных катализаторов для производства возобновляемой энергии остается одной из наиболее важных и сложных проблем для смягчения энергетического кризиса. Тем не менее, он далек от практического применения из-за нескольких проблем, таких как крупномасштабные методы производства с надежной производительностью, высокая стоимость производства и долгосрочная стабильность для продления срока службы катализаторов. Отрасли промышленности, такие как транспорт и логистика, требуют производства энергии для транспортных средств и оборудования с длительными часами работы, мощным энергоснабжением и минимальным временем заправки для достижения эффективных операций 1,2,3. Поэтому эффективные стратегии широко используются для решения вышеуказанных технических проблем. Например, путем регулирования электронной структуры металлических активных сайтов и каталитических опор, проектирования специфической архитектуры металлических нанокатализаторов, тонкой настройки металлических композиций, модификации функциональной группы анкерной опоры и изменения морфологии для увеличения числа собственных активных сайтов. В последние несколько десятилетий наночастицы (НП) доминировали в областях различного гетерогенного катализа, и каталитическая активность может быть эффективно настроена путем изменения размера НП. Только в последние годы появились высокодисперсные одноатомные катализаторы (SAC), обладающие отличными свойствами по отношению ко многим каталитическим реакциям благодаря их уникальной электронной структуре и координационной среде. В частности, SAC уже продемонстрировали превосходные характеристики в преобразовании энергии, такие как электрохимические реакции (HER, ORR, OER) и электрохимические энергетические системы (например, суперконденсаторы, аккумуляторные батареи)4,5,6. Хотя как НП, так и SAC имеют свои соответствующие преимущества и ограничения в каталитических приложениях, существуют реакции, которые требуют как NP, так и SAC для повышения каталитической реакционной способности. Например, Ru NP, поддерживаемые надстройкой углеродных нанотрубок, легированной Ni- и N-co,, могут способствовать высокому каталитическому окислению уксусной кислоты 7 во влажномвоздухе. Этот синергетический эффект был также продемонстрирован катализаторами Pd1+NPs/TiO2 для высокоселективного гидрирования кетонов и альдегидов при комнатных температурах8. В целях ускорения области синергетического катализа НП и САС и более подробного изучения их каталитических применений весьма желателен упрощенный способ синтеза катализаторов, а введение высоких нагрузок атомарно дисперсного активного сайта остается проблемой из-за высокой тенденции агрегации САС9.
Несколько методов были использованы для синтеза SAC для применения в гидрировании нитроаренов10, реакции восстановления кислорода и реакции эволюции водорода 11,12, литий-кислородных батареях13. Наиболее распространенной стратегией является подход «снизу вверх», при котором предшественники металлов поглощаются, уменьшаются и обездвиживаются на дефектах соответствующей опоры. Моноядерные металлические комплексы также могут быть сначала присоединены к функциональной группе опор с последующим удалением органических лигандов, создавая таким образом активные металлические участки для каталитического процесса. Осаждение атомного слоя (ALD), вероятно, является наиболее часто используемой процедурой для изготовления снизу вверх путем нанесения тонкого слоя пленки на подложку с повторным воздействием реагентов. Хотя размер катализатора можно точно контролировать, а реакционную способность можно значительноулучшить14, чистота подложки была довольно требовательной, а загрузка металла была относительно низкой, что приводило к высоким производственным затратам для практического применения. Различные методы, такие как прямое пропитывание, совместное осаждение и осаждение-осаждение, были использованы для иммобилизации наночастиц металлов на опорных поверхностях, таких как оксид металла и нитрид, с помощью эффектов поверхностной зарядки. Однако увеличение нагрузки на металл обычно приводит к значительной агломерации и кластерному образованию атомов металла или наночастиц. Поэтому, как правило, требуется очень разбавленный металлический раствор, что приводит к низким нагрузкам SAC катализаторов15. Аминные лиганды, такие как фенантролин, использовались для прохождения пиролиза с предшественниками металлов для получения атомарно диспергированных металлических катализаторов с высокоактивными активными сайтами Co-Nx для селективного дегидрирования муравьиной кислоты. Однако загрузка металла была относительно низкой (2-3 мас.%) из-за ограниченного числа доступных атомов N в предшественниках аминов16.
В последние несколько десятилетий водород рассматривался как потенциальная альтернатива для замены ископаемого топлива или углеводородов, таких как уголь, природный газ и бензин, из-за преимущества нулевого выброса первого. До сих пор около 94% коммерческого водорода по-прежнему производится в процессе риформинга ископаемого топлива, в котором процесс выделяет большое количество парниковых газов.17. Поэтому производство водорода из возобновляемых ресурсов, таких как электролиз воды, является способом решения проблемы истощения ископаемых ресурсов и серьезных выбросов углерода. Однако низкая эффективность производства водорода препятствует их более широкому применению. Таким образом, чтобы преодолеть этот кинетический энергетический барьер для расщепления воды, за последнее десятилетие были открыты многочисленные эффективные электрокатализаторы.18. Другой проблемой является проблема хранения из-за газообразной и взрывоопасной природы газообразного водорода в условиях окружающей среды. Физические методы хранения, такие как сжатие, потребуют сжатия водорода до 700-800 бар, а криогенное хранение путем сжижения потребует низкой температуры при -253 °C.19. Хотя коммерческие транспортные средства на водородных топливных элементах были успешно продемонстрированы, проблема хранения еще не решена, если технология будет использоваться в более широких приложениях, таких как миниатюрные устройства и мини-топливные элементы. Таким образом, методы хранения с использованием химических материалов H были одним из горячих фокусов в исследованиях водородной энергии. Некоторыми примерами химических материалов для хранения H являются аммиачный боран (AB)20, муравьиная кислота (FA)21, газообразный аммиак22, аланат натрия23, и гидрид магния24. Среди них AB имеет низкую молекулярную массу (30,7 г·моль).-1), высокая гравиметрическая и объемная плотности (196 гГн)2·кг-1 и 146 гГн2· L-1, соответственно). Кроме того, это воздухо- и влагостойкое соединение, нетоксичное и хорошо растворимое в воде. Наночастицы металлов на различных поддерживаемых материалах широко используются для высвобождения трех эквивалентов водорода из AB, таких как катализаторы на основе платины (Pt-), палладия (Pd-), рутения (Ru-), кобальта (Co-) и никеля (Ni).. Гетерогенные катализаторы на совместной основе, поддерживаемые на углеродных материалах, особенно привлекают большое внимание из-за их низкой стоимости, высокого изобилия и простоты извлечения. Сообщалось о нескольких синтетических стратегиях, таких как Co NPs, поддерживаемые на разветвленном полиэтиленимине оксиде графена, украшенном25. 3D-структура с большой площадью поверхности обеспечивает стабилизацию Ко НП, поддерживая в диапазоне размеров 2-3 нм, и предотвращает агрегацию НП. Другая стратегия заключается в использовании углеродных материалов, легированных N, для поддержки Co NNP с небольшими размерами. Использование Co(salen)26 и Ко-МФ27 (металлический органический каркас) в качестве прекурсоров были получены Co NPs 9,0 нм и 3,5 нм, поддерживаемые на N-легированных пористых углеродных материалах. Стабильность к гидролизу AB высока, и реакционная способность может поддерживать более 95% первоначальной активности после 10 реакционных запусков. В последнее время катализаторы с полыми микро/наноструктурами используются для гидролиза АВ. Эти материалы традиционно готовятся гидротермальными методами и широко используются для литий-ионных батарей, суперконденсаторов, химических датчиков и исследований гетерогенного катализа. Таким образом, синергия меди и кобальта в направлении гидролиза AB была продемонстрирована полым CuMoO4-CoMoO428, что дает высокий TOF 104,7 мин-1. Другие высокоструктурно-зависимые примеры включают ядро-оболочку CuO-NiO/Co3O429, КоxCu1−xСо2O4@CoyCu1−yСо2O4 желток-скорлупа30, и Ni0.4Cu0.6Со2O4 наночипы31 было также обнаружено, что они активны в отношении гидролиза АВ. Другой тип новых материалов, известных как гетероструктурированные катализаторы, такие как MXenes и слоистые двойные гидроксиды (LDH), все чаще используются для электрокаталитических и фотокаталитических реакций.32,33,34,35. Эти материалы, такие как NiFe-слоистый двойной гидроксид36,37 и материалы CoB-N с N-легированными гетероинтерфейсами углеродно-кобальт борида38 особенно активны для эволюции кислорода и реакции восстановления. В принципе, они могут быть дополнительно использованы для реакций эволюции водорода из материалов хранения водорода, таких как боран аммиака.39. Максимизация взаимодействия между катализаторами и субстратами также является еще одной стратегией гидролиза AB. Chiang et al. использовали поверхностную оксидную группу оксида графена для формирования инициированного сложного вида с AB40, таким образом, Ni0.8Точка0.2/GO и rGO продемонстрировали отличную реакционную способность к гидролизу AB. Использование α-MoC в качестве поддержки биметаллических катализаторов Co и Ni способствовало активации молекул воды и достижению высокого TOF в направлении гидролиза AB, что в четыре раза выше, чем коммерческий катализатор Pt/ C.41.
Используя преимущества высокого содержания N в дициандиамиде и связанных с ним материалахC3N4, в настоящем документе представлен протокол для достижения легкого синтеза кобальтовых NP, поддерживаемых на высокодисперсных co- и N-легированных углеродных нанотрубках. Постепенное образование Co NPs in-situ из образовавшегося атомарно дисперсного Co во время пиролиза материалов C3N4 обеспечивает высокую дисперсность 1) Co NPs и Легирующие Co вещества; 2) Co NPs могут быть сильно закреплены на легированных углеродных опорах и 3) Размер Co NPs может тщательно контролироваться температурой и временем пиролиза. Было обнаружено, что подготовленный по способу Co/Co-N-CNT, в результате сильно закрепленных Co-NP и способности легирующих веществ Co снижать энергию адсорбции молекул воды, обладает превосходной стабильностью к гидролизу AB для производства водорода. Детали синтетического протокола катализаторов и измерения производства водорода будут в центре внимания настоящего доклада.
Access restricted. Please log in or start a trial to view this content.
протокол
ВНИМАНИЕ: Читателям рекомендуется тщательно проверять свойства и токсичность химических веществ, описанных в этой статье, для надлежащего обращения с химическими веществами на основе соответствующих паспортов безопасности материалов (MSDS). Некоторые из используемых химических веществ наносят ущерб здоровью, и необходимо проявлять особую осторожность. Воздействие наноматериалов на здоровье человека неизвестно и может представлять угрозу безопасности и здоровью. Следует избегать вдыхания и контакта через кожу с этими материалами. Также должны соблюдаться меры предосторожности, такие как высвобождение отработанного газа во время синтеза катализатора в вытяжной шкаф и оценка производительности катализатора при надлежащем выпуске газообразного водорода. Средства индивидуальной защиты рекомендуется носить постоянно. Водород является потенциально взрывоопасным газом с очень широким диапазоном воспламеняемости от 4% до 74% в воздухе. Необходимо позаботиться о том, чтобы газообразный водород надлежащим образом выходил в атмосферу.
1. Синтез материалов мелем-С 3N4
- Взвесьте 280 г дициандиамида (плотность = 1,4 г·см-3) в стакан емкостью 800 мл.
- Поместите стакан с вышеуказанным твердым веществом в муфельную печь и медленно поднимите температуру с комнатной температуры до 350 °C с рампой 5 °C ·мин-1.
- Держите температуру на уровне 350 °C в течение 2 ч, охладите печь естественным охлаждением.
- Полученные белые твердые вещества измельчить в мелкий порошок в виде материалов C3N4 в форме мелема (DCD-350).
ПРИМЕЧАНИЕ: Выход 175 г.
2. Отжиг смеси мелем-С 3N4 и Co(acac)2 при разной температуре
- Смешать 10,0 г мелем-С3N4 с 0,218 г Co(acac)2 [Co: мелем-C3N4 = 1:200 (весовое соотношение)]. Измельчите и перемешайте два твердых вещества до тех пор, пока не будет наблюдаться однородный цвет.
- Добавьте 6 мл раствора лимонной кислоты (вода: этанол = 1:1, лимонная кислота = 10 г· L-1) до однородной смеси и дальнейшего измельчения материалов.
- Высушите материалы в духовке при 60 °C в течение 6 ч.
- Поместите материалы в тигель квадратной формы, а затем поместите его в трубчатую печь.
- Нагревают материалы со скоростью нагрева 2,6 °C·мин-1 от комнатной температуры до 800 °C и выдерживают в течение 2 ч при потоке Ar 100 мл·мин-1.
- Медленно охлаждайте печь естественным охлаждением.
- Взвесьте образцы катализатора. Здесь выход составил 0,65 г.
3. Измерение высвобождения водорода при гидролизе борана аммиака
- Настройте заполненную водой перевернутую цилиндрическую систему (дополнительный рисунок 1).
- Установите моющий раствор 0,1 M H2SO4 .
- Соедините колбу Schlenk с моющим раствором и заполненным водой перевернутым цилиндром.
- Установите температуру водяной бани на 40 °C.
- Поместите 0,04 г катализатора в колбу Шленка.
- Готовят раствор аммиака борана в воде, с 0,04 г аммиака борана в 0,948 мл воды (концентрация = 0,04 г·мл-1).
- Вводят 1 мл раствора NH3BH3 (40 мг·мл-1) в реактор, чтобы начать реакцию гидролиза.
- Следите за падением уровня воды по ходу реакции. Тщательно регистрируйте объем производства в назначенное время, например, каждые 5 с интервалами.
- График объема производстваН2 против времени в минутах.
4. Кинетические исследования
- Определение энергии активации
- Установите температуру водяной бани на уровне 40 °C.
- Поместите 0,04 г катализатора и 10 мл воды в колбу Schlenk и погрузите в водяную баню. Обжаривайте раствор ультразвуком при 40 кГц в ультразвуковой ванне в течение 6 мин.
- Вводят 1 мл раствора NH3BH3 (40 мг·мл-1) в реактор, чтобы начать реакцию гидролиза.
- Запишите время завершения высвобождения водорода.
- Повторите шаги 4.1.1-4.1.4, установив температуру водяной бани на уровне 35°С.
- Повторите приведенный выше эксперимент при 30 °C и 25 °C соответственно.
- Постройте конкретную константу скорости по отношению ко времени на графике, используя следующее уравнение. Участок ln k и 1/T должен давать прямую линию.
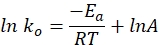
где ko обозначает удельную константу скорости (моль H2·g Co-1·min-1), R — постоянную идеального газа (8,314 кДж·моль-1), T представляет температуру реакции (K), а A — предэкспоненциальный множитель (моль H2 г Co-1·мин-1).
- Определение частоты оборота и удельной скорости генерации водорода
- Рассчитайте частоту оборота по следующему уравнению:
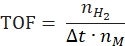
где nH2 - моли полученного водорода, Δt - время, необходимое для полного высвобождения водорода, а nM - молярное количество металла в катализаторе. - Рассчитайте удельную скорость генерации водорода по следующему уравнению42,43:
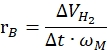
Где ΔVH2 представляет собой объем произведенного водорода, t - время, необходимое для стадий инициации и стабилизации (например, время, когда 70 мл водорода образуется для 40 мг аммиачного борана, время, когда 140 мл водорода образуется для 80 мг аммиака борана), а ωM - масса металла в катализаторе.
- Рассчитайте частоту оборота по следующему уравнению:
- Определение взаимосвязи между [бораном аммиака] и скоростью реакции
- Установите температуру водяной бани на уровне 40 °C.
- Поместите 40 мг катализатора и 10 мл воды в колбу Шленка и погрузите в водяную баню. Обжаривайте раствор ультразвуком при 40 кГц в ультразвуковой ванне в течение 6 мин.
- Вводят 1 мл раствора NH3BH3 (40 мг·мл-1) в реактор, чтобы начать реакцию гидролиза.
- Запишите время завершения высвобождения водорода.
- Повторите этап 4.3.3 впрыскивания 2 мл раствора NH3BH3 (т.е. 80 мг на 2 мл) в реактор для начала реакции гидролиза.
- Повторите шаги 4.3.1-4.3.4 с 0,5 мл и 0,25 мл раствора NH3BH3 (40 мг/мл), соответственно, для регистрации времени завершения высвобождения водорода.
- Рассчитайте скорость реакции по следующему уравнению44:
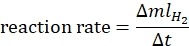
где ΔmlH2 - объем произведенного водорода, Δt - время, необходимое для высвобождения 70 мл водорода. - Постройте диаграмму скорости ln по отношению к ln[аммиачному борану] и определите наклон графика.
- Определение взаимосвязи между [катализаторами] и скоростью производства
- Установите температуру водяной бани на уровне 40 °C.
- Поместите 40 мг катализатора и 10 мл воды в колбу Шленка и погрузите в водяную баню. Обжаривайте раствор ультразвуком при 40 кГц в ультразвуковой ванне в течение 6 мин.
- Вводят 1 мл раствора NH3BH3 (40 мг·мл-1) в реактор, чтобы начать реакцию гидролиза.
- Запишите время завершения высвобождения водорода.
- Повторите этапы 4.4.1-4.4.4, изменяя количество катализатора (20 мг, 40 мг, 60 мг, 80 мг) и вводят в реактор 1 мл раствора NH3BH3 (т.е. 40 мг·мл-1) для начала реакции гидролиза.
- Запишите время завершения высвобождения водорода для использования вышеуказанных различных количеств катализатора.
- Рассчитайте скорость реакции по следующему уравнению44:
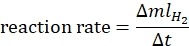
где ΔmlH2 - объем произведенного водорода, Δt - время, необходимое для высвобождения 70 мл водорода. - Постройте ставку ln по сравнению с ln[catalyst] и определите наклон графика.
5. Тест производительности езды на велосипеде
- Установите температуру водяной бани на уровне 40 °C.
- Поместите 0,04 г катализатора и 10 мл воды в колбу Schlenk и погрузите в водяную баню. Обжаривайте раствор ультразвуком при 40 кГц в ультразвуковой ванне в течение 6 мин.
- Вводят 1 мл раствора NH3BH3 (40 мг·мл-1) в реактор, чтобы начать реакцию гидролиза.
- Запишите время завершения высвобождения водорода.
- Отфильтровать катализатор, промыть водой (5 мл) три раза, а затем высушить катализатор в духовке (60 °C) в течение 3 ч.
- Поместите катализатор в 10 мл воды и обработайте раствор ультразвуком на частоте 40 кГц в ультразвуковой ванне.
- Повторите шаги 5.1.3-5.1.5 десять раз.
- Постройте график объема производства водорода, TOF и удельной скорости генерации по сравнению с циклами, соответственно.
6. Эксперимент по выщелачиванию металлических НП для получения чистых металлических СА УНТ
- Установите температуру масляной ванны на уровне 80 °C.
- Поместите 0,15 г катализатора и 50 мл 0,5 M H2SO4 в колбу Шленка и погрузите в масляную ванну.
- Перемешивайте реакцию в течение 2 ч.
- Отфильтруйте твердое вещество с помощью воронки Бюхнера и промойте твердое вещество деионизированной водой (3 раза в 10 мл каждая). Разбавьте фильтрат дополнительно до 250 мл в объемной колбе объемом 250 мл.
- Соберите металлические наночастицы- выщелоченные твердые вещества (которые содержат только co-легированный CNT) и высушите при 60 °C в печи.
7. Определение содержания металлов с помощью оптической эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-OES)
- Определение общего содержания металлов кобальта
- Поместите приблизительно 0,02 г подготовленного в виде катализатора из секции 2 в 50 мл раствора кислоты 2 М (HCl: HNO3 = соотношение 3:1 моль)45,46 в автоклав из нержавеющей стали с политетрафторэтиленовой футеровкой.
- Поместите контейнер с политетрафторэтиленом в бомбу из нержавеющей стали и закрепите крышку.
- Поместите бомбу в духовку, установите температуру 180 °C и нагрейте бомбу в течение 12 часов.
- Снимите бомбу и очистите содержимое. Отфильтруйте твердое вещество и разбавьте растворенное вещество в объемной колбе объемом 250 мл с 200 мл деионизированной воды.
ПРИМЕЧАНИЕ: Цель разбавления заключается в регулировке концентрации образцов МСП, которая будет соответствовать стандартному диапазону концентраций металлов, т.е. 0-40 ppm. - Запустите тест ICP-OES раствора и рассчитайте общее количество Co в мас.%.
- Определение содержания атомов кобальта в УНТ
- Поместите приблизительно 0,02 г подготовленного в виде катализатора со стадии 6,5 в 50 мл раствора кислоты 2 М (HCl: HNO3 = соотношение 3:1 моль)45,46 в автоклав из нержавеющей стали с политетрафторэтиленом.
- Поместите контейнер с политетрафторэтиленом в бомбу из нержавеющей стали и закрепите крышку.
- Поместите бомбу в духовку, установите температуру 180 °C и нагрейте бомбу в течение 12 часов.
- Снимите бомбу и очистите содержимое. Отфильтруйте твердое вещество и разбавьте растворенное вещество в объемной колбе объемом 250 мл с 200 мл деионизированной воды.
ПРИМЕЧАНИЕ: Цель разбавления заключается в регулировке концентрации образцов МСП, которая будет соответствовать стандартному диапазону концентраций металлов, т.е. 0-40 ppm. - Запустите тест ICP-OES раствора и рассчитайте количество содержания соатома в мас.%.
- Определение содержания наночастиц кобальта (НП)
- Разница между содержанием металлов 7,1,5 и 7,2,5 составляет мас.% Co NPs.
Access restricted. Please log in or start a trial to view this content.
Результаты
Получены рентгеновские дифракционные картины (XRD) для определения кристалличности и размера кобальтовых НП. Как показано на фиг.1, пики дифракции, соответствующие (111), (200) и (220) плоскостям (при 2θ 44,2°, 51,5° и 75,8° соответственно) кубической фазы металлического кобальта, прису...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Метод пиролиза стал одной из мощных стратегий в синтезе одномерного наноматериала на различных легированных гетероатом твердых опорах с контролируемыми размерами НП. Например, стратегия пиролиза, ограниченная нанопространством, была описана Guo et al.56. Вкратце, предварител...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа была полностью профинансирована Комитетом по грантам Гонконгского университета - Схемой институционального развития (IDS), совместным исследовательским грантом, номером гранта UGC/ IDS(C)14/B(E)01/19, Схемой развития преподавателей (FDS), номером гранта UGC / FDS25 / E08 / 20 и частично финансировалась Схемой институционального развития (IDS), номер гранта UGC / IDS (R) 25/20.
.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
Ссылки
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243(2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087(2021).
- Sun, B. -W., Li, H. -J., Yu, H. -Y., Qian, D. -J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48(2020).
- Yang, X. -F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319(2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576(2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070(2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4(2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), Basel. 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460(2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422(2021).
- Wang, H., Lee, J. -M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426(2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены