Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis de nanopartículas metálicas soportadas en nanotubos de carbono con átomos dopados de Co y N y sus aplicaciones catalíticas en la producción de hidrógeno
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para sintetizar nanopartículas de Co soportadas en nanotubos de carbono con Dopantes de Co y N para producciones de hidrógeno.
Resumen
Aquí se presenta un método para la síntesis fácil de catalizadores nanoestructurados soportados en nanotubos de carbono con dopante de cobalto y nitrógeno dispersos atómicamente. La nueva estrategia se basa en un tratamiento de pirólisis fácil de un solo recipiente de acetilacetonato de cobalto (II) y precursores orgánicos ricos en nitrógeno bajo atmósfera de Ar a 800 ° C, lo que resulta en la formación de nanotubos de carbono codopados con Co y N con morfología similar a la lombriz de tierra. Se encontró que el catalizador obtenido tenía una alta densidad de sitios defectuosos, según lo confirmado por la espectroscopia Raman. Aquí, las nanopartículas de cobalto (II) se estabilizaron en los nanotubos de carbono dopados con cobalto y nitrógeno atómicamente dispersos. Se confirmó que el catalizador era eficaz en la hidrólisis catalítica del borano de amoníaco, en la que la frecuencia de rotación era de 5,87 mol H 2·mol Co-1·min-1, y se determinó que la tasa de generación de hidrógeno específica era de 2447 mL H2·gCo-1·min-1. Se propuso por primera vez una función sinérgica entre la nanopartícula de Co y los nanotubos de carbono dopados en la hidrólisis catalítica de la reacción de borano de amoníaco en una condición leve. La producción de hidrógeno resultante con su alta densidad de energía y su tiempo de reabastecimiento mínimo podría ser adecuada para el desarrollo futuro como fuentes de energía para aplicaciones móviles y estacionarias, como camiones de carretera y carretillas elevadoras en el transporte y la logística.
Introducción
El desarrollo de catalizadores de bajo costo y altamente eficientes para la producción de energía renovable sigue siendo uno de los problemas más críticos y desafiantes para aliviar la crisis energética. Sin embargo, está lejos de ser aplicaciones prácticas debido a varias preocupaciones, como los métodos de producción a gran escala con un rendimiento confiable, alto costo de producción y estabilidad duradera para extender la vida útil de los catalizadores. Los sectores industriales, como el transporte y la logística, requieren la producción de energía para vehículos y equipos con largas horas de operación, suministro de energía de alta potencia y un tiempo mínimo de reabastecimiento de combustible para lograr operaciones eficientes 1,2,3. Por lo tanto, se han explotado ampliamente estrategias eficaces para abordar los desafíos técnicos mencionados. Por ejemplo, regulando la estructura electrónica de los sitios activos metálicos y los soportes catalíticos, diseñando la arquitectura específica de los nanocatalizadores metálicos, ajustando las composiciones metálicas, modificando el grupo funcional del soporte anclado y variando la morfología para aumentar el número de sitios activos intrínsecos. En las últimas décadas, las nanopartículas (NP) han dominado los campos de varias catálisis heterogéneas, y las actividades catalíticas pueden ajustarse de manera efectiva variando el tamaño de las NP. Solo hasta en los últimos años, los catalizadores de un solo átomo altamente dispersos (SAC) surgieron para tener excelentes propiedades hacia muchas reacciones catalíticas debido a su estructura electrónica única y entorno de coordinación. En particular, los SAC ya han demostrado un rendimiento superior en la conversión de energía, como las reacciones electroquímicas (HER, ORR, OER) y los sistemas de energía electroquímica (por ejemplo, supercondensadores, baterías recargables)4,5,6. Si bien tanto las NP como las SAC tienen sus respectivas ventajas y limitaciones en aplicaciones catalíticas, existen reacciones que requieren tanto NP como SAC para aumentar la reactividad catalítica. Por ejemplo, los NP Ru apoyados en la superestructura de nanotubos de carbono dopados con Ni y N podrían facilitar la alta oxidación catalítica del aire húmedo del ácido acético7. Este efecto sinérgico también fue demostrado por catalizadores de Pd1+NPs/TiO2 para la hidrogenación altamente selectiva de cetonas y aldehídos a temperatura ambiente8. Con el fin de acelerar el campo de la catálisis sinérgica de NPs y SACs y explorar más sobre sus aplicaciones catalíticas, una forma fácil de síntesis de catalizadores es altamente deseable, y la introducción de altas cargas del sitio activo disperso atómicamente sigue siendo un desafío debido a la alta tendencia de la agregación de SACs9.
Se han utilizado varios métodos para sintetizar SAC para aplicaciones en la hidrogenación de nitroarenos10, reacción de reducción de oxígeno y reacción de evolución de hidrógeno 11,12, baterías de litio-oxígeno13. La estrategia más común es el enfoque de abajo hacia arriba, en el que los precursores metálicos fueron absorbidos, reducidos e inmovilizados en los defectos del soporte correspondiente. Los complejos metálicos mononucleares también podrían unirse primero al grupo funcional de soportes, seguidos de la posterior eliminación de los ligandos orgánicos, creando así sitios metálicos activos para el proceso catalítico. La deposición de capa atómica (ALD) es probablemente el procedimiento más utilizado para la fabricación ascendente mediante el depósito de una capa delgada de película sobre el sustrato con la exposición repetida de reactivos. Aunque el tamaño del catalizador podía controlarse con precisión y la reactividad podía mejorarse considerablemente14, la pureza del sustrato era bastante exigente y la carga de metal era relativamente baja, lo que resultaba en altos costos de producción para aplicaciones prácticas. Se han empleado varios métodos, como la impregnación directa, la coprecipitación y la precipitación por deposición, para inmovilizar nanopartículas metálicas en las superficies de soporte, como el óxido metálico y el nitruro, a través de efectos de carga superficial. Sin embargo, el aumento de la carga de metal generalmente conduce a una aglomeración significativa y la formación de grupos de átomos metálicos o nanopartículas. Por lo tanto, por lo general, se requiere una solución metálica muy diluida, lo que conduce a bajas cargas SAC de los catalizadores15. Los ligandos de amina como la fenantrolina se han empleado para someterse a pirólisis con precursores metálicos para preparar catalizadores metálicos dispersos atómicamente con sitios activos altamente activos de Co-Nx para la deshidrogenación selectiva del ácido fórmico. Sin embargo, la carga de metal fue relativamente baja (2-3 en peso) debido al número limitado de átomos de N disponibles en los precursores de aminas16.
En las últimas décadas, el hidrógeno ha sido considerado como una alternativa potencial para reemplazar los combustibles fósiles o hidrocarburos, como el carbón, el gas natural y la gasolina, debido a la ventaja de cero emisiones de los primeros. Hasta ahora, alrededor del 94% del hidrógeno comercial todavía se produce a partir del proceso de reformado de los combustibles fósiles, en el que el proceso libera una gran cantidad de gases de efecto invernadero.17. Por lo tanto, la producción de hidrógeno a partir de recursos renovables como la electrólisis del agua es una forma de resolver el problema del agotamiento de los recursos fósiles y las graves emisiones de carbono. Sin embargo, la baja eficiencia de producción de hidrógeno ha obstaculizado sus aplicaciones más amplias. Por lo tanto, para superar esta barrera de energía cinética para la división del agua, se han descubierto numerosos electrocatalizadores eficientes en la última década.18. Otro problema es el problema de almacenamiento debido a la naturaleza gaseosa y explosiva del gas hidrógeno en condiciones ambientales. Los métodos de almacenamiento físico, como la compresión, requerirán que el hidrógeno se comprima hasta 700-800 bar, y el almacenamiento criogénico por licuefacción requerirá baja temperatura a -253 ° C19. Aunque se han demostrado con éxito los vehículos comercializados con pilas de combustible de hidrógeno, el problema de almacenamiento aún no se ha resuelto si la tecnología se va a utilizar en aplicaciones más amplias, como dispositivos en miniatura y minipilas de combustible. Por lo tanto, los métodos de almacenamiento de uso de materiales químicos H han sido uno de los focos calientes en la investigación de la energía del hidrógeno. Algunos ejemplos de materiales químicos de almacenamiento de H son el borano de amoníaco (AB)20, ácido fórmico (FA)21, gas amoníaco22, alanato de sodio23, e hidruro de magnesio24. Entre estos, AB tiene un bajo peso molecular (30.7 g·mol-1), altas densidades gravimétricas y volumétricas (196 gH2·kg-1 y 146 gH2· L-1, respectivamente). Además, es un compuesto estable al aire y la humedad, no tóxico y altamente soluble en agua. Las nanopartículas metálicas en diversos materiales soportados se han utilizado ampliamente para liberar los tres equivalentes de hidrógeno de AB, como los catalizadores basados en platino (Pt-), paladio (Pd-), rutenio (Ru-), cobalto (Co-) y níquel (Ni-). Los catalizadores heterogéneos basados en materiales de carbono están atrayendo especialmente mucha atención debido a su bajo costo, alta abundancia y facilidad de recuperación. Se han reportado varias estrategias sintéticas, como los Co NP apoyados en óxido de grafeno ramificado decorado con polietilenimina25. La estructura 3D con una gran superficie asegura la estabilización de los Co NP manteniéndose en el rango de tamaño de 2-3 nm y evita la agregación de NPs. Otra estrategia es utilizar materiales de carbono dopados con N para apoyar las NP de Co con tamaños pequeños. Uso de Co(salen)26 y Co-MOF27 (estructura orgánica metálica) como precursores, se han preparado Co NP de 9,0 nm y 3,5 nm soportados en materiales de carbono poroso dopados con N, respectivamente. La estabilidad hacia la hidrólisis AB es alta y la reactividad puede mantener más del 95% de la actividad inicial después de 10 ejecuciones de reacción. Recientemente, los catalizadores con micro/nanoestructuras huecas han sido explotados para la hidrólisis AB. Estos materiales se preparan convencionalmente por métodos hidrotérmicos y se han utilizado ampliamente para baterías de iones de litio, supercondensadores, sensores químicos e investigación de catálisis heterogénea. Por lo tanto, la sinergia cobre-cobalto hacia la hidrólisis AB ha sido demostrada por el CuMoO hueco.4-CoMoO428, lo que da un TOF alto de 104,7 min-1. Otros ejemplos altamente dependientes de la estructura incluyen el núcleo CuO-NiO/Co3O429, el CoxCu1−xCo2O4@CoyCu1−yCo2O4 Tipo de yema y cáscara30, y el Ni0.4Cu0.6Co2O4 nanoarrays31 también se encontró que eran activos para la hidrólisis AB. Otro tipo de materiales emergentes conocidos como catalizadores heteroestructurados, como MXenes e hidróxidos dobles en capas (LDH), se están explotando cada vez más para la reacción electrocatalítica y fotocatalítica.32,33,34,35. Estos materiales como el hidróxido doble en capas de NiFe36,37 y los materiales CoB-N con heterointerfaces de boruro carbono-cobalto dopadas con N.38 son especialmente activos para la evolución del oxígeno y la reacción de reducción. En principio, podrían explotarse aún más para las reacciones de evolución del hidrógeno a partir de materiales de almacenamiento de hidrógeno como el borano de amoníaco.39. Maximizar la interacción entre los catalizadores y los sustratos es también otra estrategia para la hidrólisis AB. Chiang et al. han utilizado el grupo de óxido de superficie del óxido de grafeno para formar una especie compleja iniciada con AB40, por lo tanto Ni0.8Pt0.2/GO y rGO demostraron una excelente reactividad hacia la hidrólisis AB. El uso de α-MoC como soporte para catalizadores bimetálicos de Co y Ni ayudó a la activación de moléculas de agua y logró un alto TOF hacia la hidrólisis AB, que es cuatro veces mayor que el catalizador comercial de Pt / C.41.
Aprovechando el alto contenido de N de la diciandiamida y los materiales relacionados conC3N4 , se presenta aquí un protocolo para lograr una síntesis fácil de NP de cobalto soportados en nanotubos de carbono dopados con Co y N altamente dispersos. La formación gradual in situ de Co NPs a partir del Co formado atómicamente disperso durante la pirólisis de materialesC3N4 asegura que 1) Co NPs y Co dopantes estén altamente dispersos; 2) Los Co NP pueden estar fuertemente anclados en los soportes de carbono dopados y 3) el tamaño de los Co NP puede controlarse cuidadosamente por la temperatura y el tiempo de la pirólisis. Se encontró que el Co / Co-N-CNT preparado como resultado de los Co NP fuertemente anclados y la capacidad de los Dopantes de Co para reducir la energía de adsorción de las moléculas de agua, tenía una estabilidad superior hacia la hidrólisis de AB para la producción de hidrógeno. Los detalles del protocolo sintético de los catalizadores y la medición de la producción de hidrógeno serán el punto focal de este informe.
Access restricted. Please log in or start a trial to view this content.
Protocolo
PRECAUCIÓN: Se recomienda a los lectores que verifiquen cuidadosamente las propiedades y toxicidades de los productos químicos descritos en este documento para el manejo químico adecuado de las hojas de datos de seguridad de materiales (MSDS) relevantes. Algunos de los productos químicos utilizados son perjudiciales para la salud, y se deben tener cuidados especiales. Se desconoce el impacto de los nanomateriales en la salud humana y podría plantear riesgos para la seguridad y la salud. Se debe evitar la inhalación y el contacto a través de la piel con estos materiales. También se tomarán precauciones de seguridad, como la liberación del gas residual durante la síntesis del catalizador a la campana extractora y la evaluación del funcionamiento del catalizador con una ventilación adecuada del gas hidrógeno. Se recomienda el uso de equipo de protección personal en todo momento. El hidrógeno es un gas potencialmente explosivo con un rango de inflamabilidad muy amplio de 4% -74% en el aire. Se procurará que el gas hidrógeno se ventile adecuadamente a la atmósfera.
1. Síntesis de materiales melem-C3 N4
- Pesar 280 g de diciandiamida (densidad = 1,4 g·cm-3) en un vaso de precipitados de 800 ml.
- Coloque el vaso de precipitados con el sólido anterior en un horno de mufla y eleve lentamente la temperatura de temperatura ambiente a 350 °C con una rampa de 5 °C·min-1.
- Mantener la temperatura a 350 °C durante 2 h, enfriar el horno mediante enfriamiento natural.
- Moler los sólidos blancos obtenidos en polvo fino como los materiales C3N4 en forma de melem (DCD-350).
NOTA: El rendimiento es de 175 g.
2. Recocido de las mezclas de melem-C3 N4 y Co(acac)2 a diferente temperatura
- Mezclar 10,0 g de melem-C 3 N 4 con 0,218 g de Co(acac)2 [Co : melem-C3N4 = 1:200 (relación peso)]. Moler y mezclar los dos sólidos hasta que se observe el color homogéneo.
- Añadir 6 ml de solución de ácido cítrico (agua: etanol = 1:1, ácido cítrico = 10 g· L-1) a la mezcla homogénea y moler aún más los materiales.
- Secar los materiales en un horno a 60 °C durante 6 h.
- Coloque los materiales en un crisol de forma cuadrada y luego póngalo en un horno tubular.
- Calentar los materiales a una velocidad de calentamiento de 2,6 °C·min-1 desde la temperatura ambiente hasta 800 °C y mantener durante 2 h bajo un caudal de Ar de 100 mL·min-1.
- Enfríe lentamente el horno mediante enfriamiento natural.
- Pesar las muestras del catalizador. Aquí, el rendimiento fue de 0,65 g.
3. Medición de la liberación de hidrógeno de la hidrólisis de borano de amoníaco
- Configure el sistema de cilindros invertidos llenos de agua (Figura complementaria 1).
- Configure la solución de lavado 0.1 M H2SO4 .
- Conecte el matraz Schlenk con la solución de lavado y el cilindro invertido lleno de agua.
- Ajuste la temperatura del baño de agua a 40 °C.
- Introducir 0,04 g del catalizador en el matraz Schlenk.
- Preparar una solución de borano de amoníaco en agua, con 0,04 g de borano de amoníaco en 0,948 mL de agua (concentración = 0,04 g·mL-1).
- Inyectar 1 ml de la solución NH 3 BH3(40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Controle la caída en el nivel del agua a medida que avanza la reacción. Registre cuidadosamente el volumen de producción en momentos designados, por ejemplo, cada 5 s intervalos.
- Trazar el gráfico de volumen de producción deH2 vs. tiempo en minutos.
4. Estudios cinéticos
- Determinación de la energía de activación
- Ajuste la temperatura del baño de agua a 40 °C.
- Introducir 0,04 g del catalizador y 10 ml de agua en el matraz Schlenk y sumergir en el baño maría. Sonicar la solución a 40 kHz en un baño ultrasónico durante 6 min.
- Inyectar 1 ml de la solución NH 3 BH3(40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Registre el tiempo para completar la liberación de hidrógeno.
- Repita los pasos 4.1.1-4.1.4 ajustando la temperatura del baño maría a 35 °C.
- Repita el experimento anterior a 30 °C y 25 °C, respectivamente.
- Traza la constante de tasa específica frente al tiempo en un gráfico usando la siguiente ecuación. Una gráfica de ln k y 1/T debería producir una línea recta.
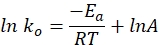
donde ko denota la constante de velocidad específica (mol H 2·g Co-1·min-1), R es la constante de gas ideal (8.314 kJ·mol-1), T representa la temperatura de reacción (K), y A es el factor preexponencial (mol H2 gCo-1·min-1).
- Determinación de la frecuencia de rotación y la tasa específica de generación de hidrógeno
- Calcule la frecuencia de rotación de acuerdo con la siguiente ecuación:
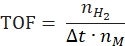
donde nH2 son los moles de hidrógeno producidos, Δt es el tiempo requerido para la liberación completa de hidrógeno y nM es la cantidad molar de metal en el catalizador. - Calcule la tasa de generación de hidrógeno específica de acuerdo con la siguiente ecuación42,43:
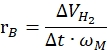
Donde ΔVH2 es el volumen de hidrógeno producido, t es el tiempo requerido para las etapas de iniciación y estabilización (por ejemplo, el tiempo en que se generaron 70 ml de hidrógeno para 40 mg de amoníaco borano, el tiempo en que se generaron 140 ml de hidrógeno para 80 mg de amoníaco borano) y ωM es la masa de metal en el catalizador.
- Calcule la frecuencia de rotación de acuerdo con la siguiente ecuación:
- Determinación de la relación entre [borano amoniaco] y velocidad de reacción
- Ajuste la temperatura del baño de agua a 40 °C.
- Introducir 40 mg del catalizador y 10 ml de agua en el matraz Schlenk y sumergir en el baño maría. Sonicar la solución a 40 kHz en un baño ultrasónico durante 6 min.
- Inyectar 1 ml de la solución NH 3 BH3(40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Registre el tiempo para completar la liberación de hidrógeno.
- Repita el paso 4.3.3 inyectando 2 ml de la solución NH 3 BH3(es decir, 80 mg por 2 ml) al reactor para iniciar la reacción de hidrólisis.
- Repita los pasos 4.3.1-4.3.4 con 0,5 ml y 0,25 ml de la solución NH 3 BH3(40 mg/ml) respectivamente para registrar el tiempo de finalización de la liberación de hidrógeno.
- Calcule la velocidad de reacción de acuerdo con la siguiente ecuación44:
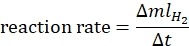
donde ΔmlH2 es el volumen de hidrógeno producido, Δt es el tiempo requerido para 70 ml de liberación de hidrógeno. - Trazar la tasa de ln frente a ln [borano de amoníaco] y determinar la pendiente del gráfico.
- Determinación de la relación entre [catalizadores] y tasa de producción
- Ajuste la temperatura del baño de agua a 40 °C.
- Introducir 40 mg del catalizador y 10 ml de agua en el matraz Schlenk y sumergir en el baño maría. Sonicar la solución a 40 kHz en un baño ultrasónico durante 6 min.
- Inyectar 1 ml de la solución NH 3 BH3(40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Registre el tiempo para completar la liberación de hidrógeno.
- Repita los pasos 4.4.1-4.4.4 variando la cantidad de catalizador (20 mg, 40 mg, 60 mg, 80 mg) e inyecte 1 ml de la solución NH 3 BH3(es decir, 40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Registre el tiempo para completar la liberación de hidrógeno para usar las diversas cantidades de catalizador anteriores.
- Calcule la velocidad de reacción de acuerdo con la siguiente ecuación44:
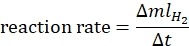
donde ΔmlH2 es el volumen de hidrógeno producido, Δt es el tiempo requerido para 70 ml de liberación de hidrógeno. - Trazar la tasa ln vs. ln[catalizador] y determinar la pendiente del gráfico.
5. Prueba de rendimiento de ciclismo
- Ajuste la temperatura del baño de agua a 40 °C.
- Introducir 0,04 g del catalizador y 10 ml de agua en el matraz Schlenk y sumergir en el baño maría. Sonicar la solución a 40 kHz en un baño ultrasónico durante 6 min.
- Inyectar 1 ml de la solución NH 3 BH3(40 mg·mL-1) en el reactor para iniciar la reacción de hidrólisis.
- Registre el tiempo para completar la liberación de hidrógeno.
- Filtrar el catalizador, lavar con agua (5 ml) tres veces y, a continuación, secar el catalizador en el horno (60 °C) durante 3 h.
- Coloque el catalizador en 10 ml de agua y sonicar la solución a 40 kHz en un baño ultrasónico.
- Repita los pasos 5.1.3-5.1.5 diez veces.
- Trazar el volumen de producción de hidrógeno, TOF y tasa de generación específica frente a ciclos, respectivamente.
6. Experimento de lixiviación de NPs metálicos para obtener SAs de metal puro CNT
- Ajuste la temperatura del baño de aceite a 80 °C.
- Introducir 0,15 g del catalizador y 50 ml de 0,5 MH2SO4 en el matraz Schlenk y sumergir en el baño de aceite.
- Revuelva la reacción durante 2 h.
- Filtre el sólido usando un embudo Buchner y lave el sólido con agua desionizada (3x en 10 ml cada uno). Diluir el lixiviado hasta 250 ml en un matraz aforado de 250 ml.
- Recoger los sólidos lixiviados de nanopartículas metálicas (que contienen sólo CNT codopado) y secar a 60 °C en un horno.
7. Determinación del contenido de metales mediante espectroscopía de emisión óptica de plasma acoplado inductivamente (ICP-OES)
- Determinación del contenido total de metal cobalto
- Introducir aproximadamente 0,02 g de catalizador preparado de la sección 2 en 50 ml de solución ácida 2 M (HCl: HNO 3 = relación molar3:1)45,46 en un autoclave de acero inoxidable revestido de politetrafluoroetileno.
- Coloque el recipiente forrado de politetrafluoroetileno en la bomba de acero inoxidable y asegure la tapa.
- Coloque la bomba en un horno, ajuste la temperatura a 180 ° C y caliente la bomba durante 12 h.
- Retire la bomba y vacíe el contenido. Filtrar el sólido y diluir el soluto en un matraz aforado de 250 ml con 200 ml de agua desionizada.
NOTA: El propósito de la dilución es ajustar la concentración de las muestras ICP, que encajarán en el rango de concentración estándar de metal, es decir, 0-40 ppm. - Ejecute la prueba ICP-OES de la solución y calcule la cantidad total de Co en peso%.
- Determinación del contenido de átomos de cobalto en el CNT
- Colocar aproximadamente 0,02 g de catalizador preparado desde la etapa 6.5 en 50 ml de solución ácida 2 M (HCl: HNO 3 = relación molar3:1)45,46 en un autoclave de acero inoxidable revestido de politetrafluoroetileno.
- Coloque el recipiente forrado de politetrafluoroetileno en la bomba de acero inoxidable y asegure la tapa.
- Coloque la bomba en un horno, ajuste la temperatura a 180 ° C y caliente la bomba durante 12 h.
- Retire la bomba y vacíe el contenido. Filtrar el sólido y diluir el soluto en un matraz aforado de 250 ml con 200 ml de agua desionizada.
NOTA: El propósito de la dilución es ajustar la concentración de las muestras ICP, que encajarán en el rango de concentración estándar de metal, es decir, 0-40 ppm. - Ejecute la prueba ICP-OES de la solución y calcule la cantidad de contenido de átomos de Co en peso%.
- Determinación del contenido de nanopartículas de cobalto (NPs)
- La diferencia entre el contenido de metal de 7.1.5 y 7.2.5 es el % en peso de Co NPs.
Access restricted. Please log in or start a trial to view this content.
Resultados
Se han obtenido patrones de difracción de rayos X (XRD) para determinar la cristalinidad y el tamaño de las NP de cobalto. Como se muestra en la Figura 1, los picos de difracción correspondientes a los planos (111), (200) y (220) (a 2θ de 44.2°, 51.5° y 75.8° respectivamente) de la fase cúbica del cobalto metálico estuvieron presentes de acuerdo con el archivo de difracción de potencia JCPDS (Joint Committee for Powder Diffraction Standards) (tarjeta # 15-0806)47<...
Access restricted. Please log in or start a trial to view this content.
Discusión
El método de pirólisis se ha convertido en una de las poderosas estrategias en la síntesis de nanomaterial unidimensional sobre varios soportes sólidos dopados con heteroátomos con tamaños controlados de NPs. Por ejemplo, la estrategia de pirólisis confinada al nanoespacio fue reportada por Guo et al.56. Brevemente, los MWCNT, el cobalto y los precursores de fósforo pretratados se pirolizaron a 800 °C bajo atmósfera deN2, y se pueden obtener los NP de CoP soportados en N-CNT. ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue financiado en su totalidad por el Comité de Becas de la Universidad de Hong Kong - Beca de Investigación Colaborativa del Plan de Desarrollo Institucional (IDS), número de subvención UGC / IDS (C) 14 / B (E) 01/19, el Plan de Desarrollo Docente (FDS), número de subvención UGC / FDS25 / E08 / 20 y parcialmente financiado por el Plan de Desarrollo Institucional (IDS), número de subvención UGC / IDS (R) 25/20.
.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
Referencias
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243(2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087(2021).
- Sun, B. -W., Li, H. -J., Yu, H. -Y., Qian, D. -J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48(2020).
- Yang, X. -F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319(2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576(2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070(2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4(2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), Basel. 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460(2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422(2021).
- Wang, H., Lee, J. -M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426(2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados