このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Co原子およびN原子をドープしたカーボンナノチューブに担持された金属ナノ粒子の合成と水素製造における触媒応用
* これらの著者は同等に貢献しました
要約
ここでは、水素製造用のCo-およびN-ドーパントを用いてカーボンナノチューブに担持されたCoナノ粒子を合成するためのプロトコルを提示する。
要約
原子的に分散したコバルトおよび窒素ドーパントを有するカーボンナノチューブ上に担持されたナノ構造触媒の容易な合成のための方法が本明細書に提示される。この新しい戦略は、コバルト(II)アセチルアセトナートと窒素に富む有機前駆体をAr雰囲気下、800°Cで簡単にワンポット熱分解処理し、ミミズのような形態を持つCoおよびN-共ドープカーボンナノチューブを形成することに基づいています。得られた触媒は、ラマン分光法によって確認されるように、高密度の欠陥部位を有することがわかった。ここで、コバルト(II)ナノ粒子は、原子的に分散したコバルトおよび窒素ドープカーボンナノチューブ上で安定化された。アンモニアボランの触媒加水分解に有効であることが確認され、ターンオーバー頻度は5.87 mol H2・molCo-1・min-1であり、比水素発生速度は2447 mLH2・gCo-1・min-1と決定された。Coナノ粒子とドープされたカーボンナノチューブとの間の相乗機能は、穏やかな条件下でのアンモニアボラン反応の触媒加水分解において初めて提案されました。結果として得られる水素製造は、その高いエネルギー密度と最小限の給油時間で、輸送および物流におけるロードトラックやフォークリフトなどの移動および固定アプリケーションのエネルギー源として将来の開発に適している可能性があります。
概要
再生可能エネルギー生産のための低コストで高効率の触媒を開発することは、エネルギー危機を緩和するための最も重要で困難な問題の1つです。しかし、信頼性の高い性能を備えた大規模製造方法、高い製造コスト、触媒の耐用年数を延ばすための長年の安定性など、いくつかの懸念があるため、実用化にはほど遠いです。輸送や物流などの産業部門では、効率的な運用を実現するために、長時間の運転、高出力のエネルギー供給、最小限の給油時間を備えた車両や機器のエネルギー生産が必要です1,2,3。したがって、上記の技術的課題に対処するために、効果的な戦略が広く利用されてきました。例えば、金属活性点および触媒担体の電子構造を調節し、金属ナノ触媒の特定の構造を設計し、金属組成を微調整し、アンカー担体の官能基修飾、および形態を変化させて固有の活性点の数を増加させる。過去数十年の間に、ナノ粒子(NP)は様々な不均一触媒の分野を支配しており、触媒活性はNPのサイズを変えることによって効果的に調整することができる。近年になってようやく、高分散単一原子触媒(SAC)は、その独特の電子構造と配位環境により、多くの触媒反応に対して優れた特性を持つようになりました。特に、SACは、電気化学反応(HER、ORR、OER)や電気化学エネルギーシステム(スーパーキャパシタ、充電式電池など)などのエネルギー変換においてすでに優れた性能を発揮しています4,5,6。NPとSACの両方に触媒用途にはそれぞれ利点と制限がありますが、触媒反応性を高めるためにNPとSACの両方を必要とする反応が存在します。例えば、NiおよびN-coドープカーボンナノチューブ上部構造に担持されたRu NPは、酢酸7の高触媒湿気酸化を促進する可能性がある。この相乗効果は、室温での選択性の高いケトンおよびアルデヒド水素化のためのPd1+NPs/TiO2触媒によっても実証されました8。相乗的なNPおよびSAC触媒の分野を加速し、それらの触媒用途をさらに探求するためには、触媒合成の容易な方法が非常に望ましく、原子的に分散した活性部位の高負荷の導入は、SACの凝集の傾向が高いため、依然として課題である9。
ニトロアレーン10の水素化、酸素還元反応および水素発生反応11,12、リチウム酸素電池13における用途のためのSACを合成するためにいくつかの方法が利用されてきた。最も一般的な戦略はボトムアップアプローチであり、金属前駆体を吸収、還元、および対応する支持体の欠陥に固定化します。単核金属錯体は、最初に担体の官能基に結合し、続いて有機配位子を除去して、触媒プロセスのための活性金属点を生成することもできる。原子層堆積(ALD)は、反応物を繰り返し露光しながら基板上に薄膜を堆積させることによるボトムアップ製造におそらく最も頻繁に使用される手順である。触媒サイズを正確に制御でき、反応性を大幅に向上させることができましたが14、基板の純度はかなり要求が厳しく、金属の負荷が比較的低かったため、実用化には高い製造コストがかかりました。表面帯電効果により、金属酸化物や窒化物などの金属ナノ粒子を支持体表面に固定化するために、直接含浸、共沈、堆積沈殿などのさまざまな方法が採用されています。しかしながら、金属負荷を増加させることは、通常、金属原子またはナノ粒子の著しい凝集およびクラスター形成をもたらす。したがって、通常、非常に希釈された金属溶液が必要であり、したがって触媒15の低いSACs負荷をもたらす。フェナントロリンなどのアミン配位子は、ギ酸の選択的脱水素のために高活性Co-Nx活性点を有する原子分散金属触媒を調製するために、金属前駆体との熱分解を受けるために使用されている。しかしながら、金属担持量は、アミン前駆体16中の利用可能なN原子の数が限られているため、比較的低かった(2〜3重量%)。
過去数十年の間、水素は、前者のゼロエミッションの利点により、石炭、天然ガス、ガソリンなどの化石燃料または炭化水素に代わる潜在的な代替手段と見なされてきました。これまで、市販の水素の約94%は、大量の温室効果ガスを放出する化石燃料の改質プロセスから製造されています。17.したがって、水の電気分解などの再生可能資源からの水素製造は、化石資源の枯渇と深刻な炭素排出の問題を解決する方法です。しかし、水素製造効率が低いため、より広い用途が妨げられています。したがって、水分解のためのこの運動エネルギー障壁を克服するために、過去10年間で多数の効率的な電極触媒が発見されました。18.別の問題は、周囲条件での水素ガスのガス状および爆発性の性質による貯蔵問題です。圧縮などの物理的貯蔵方法では、水素を700〜800バールまで圧縮する必要があり、液化による極低温貯蔵には-253°Cの低温が必要です。19.水素燃料電池自動車の実用化は成功しているが、小型デバイスや軽燃料電池など、より広い用途に活用するためには、貯蔵問題は未だ解決されていない。このように、化学H材料を使用する貯蔵方法は、水素エネルギー研究におけるホットな焦点の1つでした。化学H貯蔵材料のいくつかの例は、アンモニアボラン(AB)です。20、ギ酸(FA)21、アンモニアガス22、アラニンナトリウム23、および水素化マグネシウム24.これらのうち、ABは低分子量(30.7g・mol-1)、高い重量密度および体積密度(196 gH2·キロ-1 および146 gH2·L-1、それぞれ)。その上、それは空気と湿気に安定な化合物であり、無毒で、水に非常に溶けやすいです。様々な担持材料上の金属ナノ粒子は、白金-(Pt-)、パラジウム-(Pd-)、ルテニウム-(Ru-)、コバルト-(Co-)、およびニッケル-(Ni-)ベースの触媒など、ABから3当量の水素を放出するために広く使用されている。炭素材料に担持されたCoベースの不均一系触媒は、低コスト、高存在量、回収の容易さから特に注目されています。分岐ポリエチレンイミンで装飾された酸化グラフェンに担持されたCo NPなど、いくつかの合成戦略が報告されています。25.表面積の大きい3D構造は、2〜3 nmのサイズ範囲で維持されるCo NPの安定化を保証し、NPの凝集を防止します。別の戦略は、Nドープ炭素材料を使用して、小さなサイズのCo NPをサポートすることです。コ(サレン)の使用26 および共同27 前駆体として、Nドープ多孔性炭素材料に担持された9.0nmおよび3.5nmのCoNPsがそれぞれ調製されている。AB加水分解に対する安定性は高く、反応性は10回の反応実行後に初期活性の95%以上を維持することができます。近年、中空マイクロ・ナノ構造を有する触媒がAB加水分解に利用されている。これらの材料は、従来、水熱法によって調製され、リチウムイオン電池、スーパーキャパシタ、化学センサー、および不均一触媒研究に広く使用されてきました。したがって、AB加水分解に対する銅-コバルトの相乗効果は、中空CuMoOによって実証されています。4-コモオ428、これは104.7分の高いTOFを与えます-1.その他の構造依存性の高い例としては、コアシェルCuO-NiO/Coなどがあります。3O429、Coxキュ1−x共2O4@Coyキュ1−y共2O4 卵黄殻タイプ30、およびNi0.4キュ0.6共2O4 ナノアレイ31 また、AB加水分解に対して活性があることも見出された。MXenesや層状複水酸化物(LDH)などのヘテロ構造触媒として知られる別のタイプの新興材料は、電極触媒および光触媒反応のためにますます利用されています32,33,34,35.NiFe層状複水酸化物などのこれらの材料36,37 Nドープ炭素-コバルトホウ化物ヘテロ界面を有するCoB-N材料38 酸素発生および還元反応に特に活性がある。原理的には、アンモニアボランなどの水素貯蔵材料からの水素発生反応にさらに利用できる可能性があります39.触媒と基質の間の相互作用を最大化することも、AB加水分解の別の戦略です。Chiangらは、酸化グラフェンの表面酸化物基を利用して、ABと開始された複合種を形成しています。40、したがってNi0.8ティッカー0.2/GOおよびrGOはAB加水分解に対して優れた反応性を示した。CoおよびNiバイメタル触媒の担体としてα-MoCを使用することで、水分子の活性化を助け、市販のPt/C触媒の4倍のAB加水分解に対する高いTOFを達成しました。41.
ジシアンジアミドおよび関連するC3N4材料の高いN含有量を利用して、高度に分散したCo−およびNドープカーボンナノチューブ上に担持されたコバルトNPの容易な合成を達成するためのプロトコルが本明細書に提示される。C3N4材料の熱分解中に形成された原子分散CoからのCo NPの漸進的なin-situ形成は、1)Co NPおよびCoドーパントが高度に分散することを確実にする。2)Co NPはドープされたカーボン担体に強く固定することができ、3)Co NPのサイズは熱分解の温度と時間によって注意深く制御できます。調製されたCo/Co-N-CNTは、Co NPが強く固定され、Coドーパントが水分子の吸着エネルギーを低下させる能力の結果として、水素製造のためのABの加水分解に対して優れた安定性を有することが見出された。触媒の合成プロトコルの詳細と水素製造の測定が、このレポートの焦点になります。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注意: 読者は、関連する製品安全データシート(MSDS)から、このペーパーに記載されている化学物質の特性と毒性を注意深くチェックして、化学物質の適切な取り扱いを確認することをお勧めします。使用される化学物質のいくつかは健康に有害であり、特別な注意を払う必要があります。ナノマテリアルが人間の健康に与える影響は不明であり、安全衛生上のリスクをもたらす可能性があります。吸入およびこれらの物質との皮膚を介した接触は避けるべきである。また、触媒合成中の排ガスをヒュームフードに放出し、水素ガスを適切に通気して触媒性能を評価するなど、安全対策も講じる必要があります。個人用保護具は常に着用することをお勧めします。水素は爆発の可能性のあるガスであり、空気中の4%〜74%の非常に広い可燃性範囲があります。水素ガスが適切に大気に放出されるように注意する必要があります。
1. メレムC3N4材料の合成
- 280 gのジシアンジアミド(密度= 1.4 g·cm-3)を800 mLのビーカーに計量します。
- 上記の固体を入れたビーカーをマッフル炉に入れ、5°C・min-1のランプで室温から350°Cまでゆっくりと温度を上げます。
- 温度を350°Cで2時間保ち、自然冷却で炉を冷却します。
- 得られた白色固体をメレム形態のC3N4 材料として微粉末に粉砕する(DCD-350)。
注:収量は175 gです。
2. メレムC 3N4 とCo(acac)2 混合物を異なる温度でアニーリングする
- 10.0 gのメレム-C 3 N 4と0.218 gのCo(acac)2を混合します[Co:メレム-C3N4 = 1:200(重量比)]。均質な色が観察されるまで、2つの固体を粉砕して混合します。
- クエン酸溶液6mLを加える(水:エタノール=1:1、クエン酸=10g・s)L-1)均質な混合物とし、さらに材料を粉砕する。
- 材料を60°Cのオーブンで6時間乾燥させます。
- 材料を正方形のるつぼに入れ、管状炉に入れます。
- 材料を室温から800°Cまで2.6°C・min-1の昇温速度で加熱し、100mL・min-1のArフロー下で2時間保持します。
- 自然冷却により炉をゆっくりと冷却します。
- 触媒サンプルの重量を量ります。ここで、収量は0.65gであった。
3. アンモニアボラン加水分解による水素放出の測定
- 水で満たされた逆シリンダーシステムをセットアップします(補足図1)。
- 0.1 M H2SO4 洗浄液をセットアップします。
- シュレンクフラスコを洗浄液と水で満たされた倒立シリンダーに接続します。
- ウォーターバス温度を40°Cに設定します。
- 0.04 gの触媒をシュレンクフラスコに入れます。
- 0.948 mLの水に0.04 gのアンモニアボランを入れたアンモニアボランの溶液を調製します(濃度= 0.04 g・mL-1)。
- 1 mLのNH 3 BH3溶液(40mg·mL-1)を反応器に注入して、加水分解反応を開始します。
- 反応の進行に伴う水位の低下を監視します。5秒間隔など、指定された時間に生産量を注意深く記録します。
- H2生産量対時間のグラフを分単位でプロットする。
4.速度論的研究
- 活性化エネルギーの決定
- ウォーターバス温度を40°Cに設定します。
- 0.04 gの触媒と10 mLの水をシュレンクフラスコに入れ、水浴に浸します。超音波浴中で40kHzで6分間溶液を超音波処理する。
- 1 mLのNH 3 BH3溶液(40mg·mL-1)を反応器に注入して、加水分解反応を開始します。
- 水素放出の完了時間を記録します。
- 手順4.1.1〜4.1.4を繰り返し、ウォーターバスの温度を35°Cに設定します。
- 上記の実験をそれぞれ30°Cおよび25°Cで繰り返す。
- 次の式を使用して、特定の速度定数対時間をグラフにプロットします。ln kと1 / Tのプロットは直線になるはずです。
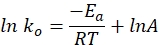
ここで、koは比速度定数(mol H 2·g Co-1·min-1)、Rは理想気体定数(8.314 kJ·mol-1)、Tは反応温度(K)、Aは事前指数係数(mol H 2 gCo-1·min-1)を表す。
- 回転頻度と比水素発生率の決定
- 次の式に従って回転頻度を計算します。
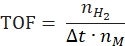
ここで、nH 2 は生成される水素のモル数、Δtは完全な水素放出に必要な時間、nM は触媒中の金属のモル量です。 - 下記式42,43に従って比水素発生率を算出する:
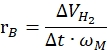
ここで、ΔVH2 は生成する水素の量、tは開始段階および安定化段階に要する時間(例えば、40mgのアンモニアボランに対して70mLの水素が生成される時間、80mgのアンモニアボランに対して140mLの水素が生成される時間)、ωMは触媒 中の金属の質量である。
- 次の式に従って回転頻度を計算します。
- [アンモニアボラン]と反応速度の関係の決定
- ウォーターバス温度を40°Cに設定します。
- 40 mgの触媒と10 mLの水をシュレンクフラスコに入れ、水浴に浸します。超音波浴中で40kHzで6分間溶液を超音波処理する。
- 1 mLのNH 3 BH3溶液(40mg·mL-1)を反応器に注入して、加水分解反応を開始します。
- 水素放出の完了時間を記録します。
- 2mLのNH3BH3溶液(すなわち、2mL当たり80mg)を反応器に注入するステップ4.3.3を繰り返して、加水分解反応を開始する。
- NH 3 BH3溶液(40 mg / mL)をそれぞれ0.5 mLと0.25 mLで手順4.3.1〜4.3.4を繰り返し、水素放出が完了するまでの時間を記録します。
- 下記式44に従って反応速度を算出する:
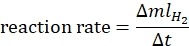
ここで、ΔmlH2 は生成される水素の量であり、Δtは70mLの水素放出に必要な時間です。 - ln率対ln[アンモニアボラン]をプロットし、グラフの傾きを決定します。
- [触媒]と生成速度の関係の決定
- ウォーターバス温度を40°Cに設定します。
- 40 mgの触媒と10 mLの水をシュレンクフラスコに入れ、水浴に浸します。超音波浴中で40kHzで6分間溶液を超音波処理する。
- 1 mLのNH 3 BH3溶液(40mg·mL-1)を反応器に注入して、加水分解反応を開始します。
- 水素放出の完了時間を記録します。
- 触媒の量(20 mg、40 mg、60 mg、80 mg)を変えて手順4.4.1〜4.4.4を繰り返し、1 mLのNH 3 BH3溶液(つまり、40 mg·mL-1)を反応器に注入して加水分解反応を開始します。
- 上記の各種触媒量を用いるための水素放出の完了までの時間を記録する。
- 下記式44に従って反応速度を算出する:
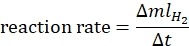
ここで、ΔmlH2 は生成される水素の量であり、Δtは70mLの水素放出に必要な時間です。 - lnレート対ln[触媒]をプロットし、グラフの傾きを決定します。
5.サイクリング性能試験
- ウォーターバス温度を40°Cに設定します。
- 0.04 gの触媒と10 mLの水をシュレンクフラスコに入れ、水浴に浸します。超音波浴中で40kHzで6分間溶液を超音波処理する。
- 1 mLのNH 3 BH3溶液(40mg·mL-1)を反応器に注入して、加水分解反応を開始します。
- 水素放出の完了時間を記録します。
- 触媒を濾別し、水(5mL)で3回洗浄した後、触媒をオーブン(60°C)で3時間乾燥させた。
- 触媒を10mLの水に入れ、超音波浴中で40kHzで溶液を超音波処理する。
- 手順 5.1.3-5.1.5 を 10 回繰り返します。
- 水素生産量、TOF、比発生率対サイクルをそれぞれプロットします。
6. 純金属SAを得るための金属NPの浸出実験 CNT
- オイルバス温度を80°Cに設定します。
- 0.15gの触媒および50mLの0.5M H 2SO4をシュレンクフラスコに入れ、オイルバスに浸す。
- 反応物を2時間攪拌する。
- ブフナー漏斗を使用して固体をろ過し、脱イオン水(各10 mLで3x)で固体を洗浄します。浸出液を250 mLメスフラスコでさらに250 mLに希釈します。
- 金属ナノ粒子浸出固形物(CoドープCNTのみを含む)を収集し、オーブン中で60°Cで乾燥させる。
7. 誘導結合プラズマ発光分光法(ICP-OES)を用いた金属含有量測定
- 総コバルト金属含有量の測定
- セクション2の調製した触媒約0.02 gを50 mLの2 M酸溶液(HCl:HNO3 = 3:1モル比)45,46にポリテトラフルオロエチレンで裏打ちしたステンレス鋼オートクレーブに入れます。
- ポリテトラフルオロエチレンで裏打ちされた容器をステンレス鋼爆弾に入れ、キャップを固定します。
- 爆弾をオーブンに入れ、温度を180°Cに設定し、爆弾を12時間加熱します。
- 爆弾を取り除き、中身を空にします。固体をろ過し、溶質を250 mLメスフラスコで200 mLの脱イオン水で希釈します。
注:希釈の目的は、金属標準濃度範囲、つまり0〜40ppmに適合するICPサンプルの濃度を調整することです。 - 溶液のICP-OESテストを実行し、Coの総量を重量%で計算します。
- CNT上のコバルト原子含有量の測定
- ステップ6.5で調製した触媒約0.02 gを、ポリテトラフルオロエチレンで裏打ちされたステンレス鋼オートクレーブ内の50 mLの2 M酸溶液(HCl:HNO3 = 3:1モル比)45,46に入れます。
- ポリテトラフルオロエチレンで裏打ちされた容器をステンレス鋼爆弾に入れ、キャップを固定します。
- 爆弾をオーブンに入れ、温度を180°Cに設定し、爆弾を12時間加熱します。
- 爆弾を取り除き、中身を空にします。固体をろ過し、溶質を250 mLメスフラスコで200 mLの脱イオン水で希釈します。
注:希釈の目的は、金属標準濃度範囲、つまり0〜40ppmに適合するICPサンプルの濃度を調整することです。 - 溶液のICP-OESテストを実行し、Co原子含有量の量を重量%で計算します。
- コバルトナノ粒子(NP)含有量の測定
- 7.1.5と7.2.5の金属含有量の違いは、Co NPの重量%です。
Access restricted. Please log in or start a trial to view this content.
結果
コバルトNPの結晶性とサイズを決定するために、X線回折パターン(XRD)が得られています。 図1に示すように、金属コバルトの立方相の(111)、(200)、(220)面(それぞれ2θ44.2°、51.5°、75.8°)に対応する回折ピークは、JCPDS(粉末回折標準合同委員会)パワー回折ファイル(カード#15-0806)47と一致して存在していました。グラファイト炭素(N-CNT)に対応する約26°の2θの?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
熱分解法は、NPのサイズを制御したさまざまなヘテロ原子ドープ固体支持体上での1次元ナノ材料の合成における強力な戦略の1つになっています。例えば、ナノスペース閉じ込め熱分解戦略はGuoらによって報告された56。簡単に説明すると、前処理したMWCNT、コバルト、およびリン前駆体をN2雰囲気下800°Cで熱分解し、N-CNTに担持されたCoP NPを得ることができる。マイ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
開示するものは何もありません。
謝辞
この研究は、香港大学助成委員会-機関開発スキーム(IDS)共同研究助成金、助成金番号UGC/IDS(C)14/B(E)01/19、ファカルティディベロップメントスキーム(FDS)、助成金番号UGC/FDS25/E08/20によって完全に資金提供され、機関開発スキーム(IDS)、助成金番号UGC/IDS(R)25/20によって部分的に資金提供されました。
.
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
参考文献
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243(2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087(2021).
- Sun, B. -W., Li, H. -J., Yu, H. -Y., Qian, D. -J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48(2020).
- Yang, X. -F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319(2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576(2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070(2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4(2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), Basel. 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460(2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422(2021).
- Wang, H., Lee, J. -M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426(2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved