Method Article
DNA双链断裂时转录活性的活细胞成像
摘要
该协议提出了一种新的报告基因系统和实验设置,以检测具有单分子灵敏度的DNA双链断裂处的转录。
摘要
DNA双链断裂(DSB)是最严重的DNA损伤类型。尽管对基因组完整性造成了灾难性的后果,但到目前为止,DSB如何影响转录仍然难以捉摸。造成这种情况的一个原因是缺乏合适的工具来同时监测转录和诱导具有足够时间和空间分辨率的基因DSB。这项工作描述了一组新的报告基因,它们在DNA模板中诱导DSB后立即直接可视化活细胞中的转录。噬菌体RNA茎环用于监测单分子灵敏度的转录。为了将DSB靶向特定的基因区域,报告基因被设计为包含归巢核酸内酯 酶I-SceI的单个识别序列,否则人类基因组中不存在。每个报告基因的单个拷贝被整合到人类细胞系的基因组中。该实验系统允许检测由规范基因转录或DNA断裂诱导转录启动产生的单个RNA分子。这些记者为解释转录和DNA损伤之间的相互相互作用以及揭示迄今为止未被重视的DNA断裂诱导转录的各个方面提供了前所未有的机会。
引言
DNA双链断裂(DSBs)是有毒的DNA病变,会破坏细胞功能,并导致多种疾病和衰老的蔓延1。由DSBs的不准确修复引起的突变影响基因表达,并为细胞的功能下降奠定基础。DSBs在病变位点 从头 驱动断裂诱导转录的新兴观点2,3,4,5,6,7 表明DSB也可能通过断裂诱导的RNA影响细胞功能。最近的几项研究表明,DSB足以启动程序性转录(例如,在刺激诱导基因处)和非计划性转录(例如,在非规范启动子处)转录4,5,7。然而,尽管有几项研究探索了DNA损伤与转录之间的联系,但该领域在提供DNA断裂位点转录事件的精确(即单分子)表征方面仍然落后。其中一个重要原因是缺乏适当的实验工具。细胞照射(γ射线、X 射线、重离子)和药物治疗(例如拓扑异构酶抑制剂或插层剂)缺乏空间精确度,并诱发 DSB 以外的 DNA 病变,包括单链断裂和 DNA 加合物8。内切酶(如 I-PpoI 和 AsiSI)可生成位点特异性 DSB,但尚未与允许在单个位点以高时间精度同时活细胞可视化转录的系统结合使用8。为了绕过这一限制,我们的实验室率先开发了一套尖端的报告器,这些报告基因在控制诱导独特的DSB4时,以单分子分辨率直接可视化转录。在这里,我们描述了这些报告者,为DSB转录的活细胞成像提供了详细的方案,并显示了在单个DSB下显示转录起始的数据。
该协议中使用的报告基因系统基于表征良好的小鼠IgM报告基因,并且包含IgM的膜结合形式(μm)的外显子M1和M2,μ重链9,10,11。杂交内含子将两个外显子与强腺病毒主要晚期转录本(AdML)PY tract12分开。报告基因的表达由人巨细胞病毒启动子(CMV)控制,其中插入了Tet操作员(TetO)序列的两个串联拷贝。每个报告基因入到含有 Flp 重组靶标( FRT )位点的质粒载体中,并插入到 HEK293 宿主细胞系基因组中的特定 FRT 靶位点。该细胞系还组成性地表达Tet抑制蛋白, 通过 存在或不存在四环素/多西环素来调节报告基因的表达。为了能够可视化报告基因转录,在转录起始位点和报告基因的外显子/内含子结构的不同位置插入了MS2茎环序列的24个串联重复序列和24个串联重复序列。MS2/PP7 RNA 茎环在转录时形成,并由标记有绿色和红色荧光蛋白的异位表达的 MS2/PP7 涂层蛋白特异性结合,这是以前广泛使用的成像转录策略13,14,15。此外,为归巢内切酶 I-SceI 插入了18 bp识别序列的单个拷贝,该序列的直接两侧是报告基因中的RNA茎环序列阵列。采用标准克隆技术生成所有质粒,含有PROP报告基因I-SceI-24xMS2茎环的片段由商业基因合成服务合成。
通过在外显子I中插入推定的转录起始位点下游的 I-SceI 切割位点45个碱基对(bp),构建启动子-近端DSB报告基因(PROP),然后以149 bp构建,直到24x MS2茎环盒的开始,该盒 从头 设计有两个交替的不相同的茎环序列16 和额外的五个非重复的20 bp间隔序列,以减少冗余。MS2茎环阵列之后是72 bp,直到1844 bp内含子的开始,然后是1085 bp的外显子II,直到裂解和多腺苷酸化位点。外显子II编码青色荧光蛋白(CFP),该蛋白融合到来自人过氧化物酶体酰辅酶A氧化酶的C端过氧化物酶靶向序列(PTS),以允许独立筛选报告基因表达(图1A)。
外显子II DSB报告基因(EX2)由167 bp的外显子I组成,后跟编码CFP-PTS的内含子和外显子II。在下游169 bp的距离处,插入一个包含24x MS2茎环的盒,然后是一个84 bp的连接子序列,中心有一个 I-SceI 位点,然后是24x PP7茎环和221 bp,直到切割和多腺苷酸化位点17 (图1B)。
最后,具有反义转录标记(EX2AS)的外显子II DSB报告基因基于人泛素B(UBB)基因转录UBB-201,包含两个外显子和一个内含子。外显子I的总长度为1534 bp,反向插入24x MS2茎环序列。因此,正确的MS2茎环RNA序列将在反义方向上转录,相对于来自CMV启动子的报告基因的意义转录。内含子的长度为490 bp,其次是具有 I-SceI 位点的外显子II,并为两个框架内泛素亚基插入编码区域。UBB基因的下游是一个序列,在报告基因在感觉方向上转录时形成24x PP7茎环(图1C)。
归巢内切酶 I-SceI 的诱导构建体的瞬时转染允许在每个报告基因内插入的识别位点控制DSB的产生18。 I-SceI 内切酶与糖皮质激素受体的配体结合域和远红色荧光蛋白iRFP713融合在框架中。在没有曲安奈德(TA)的情况下,这种结构是细胞质的,但是当将TA加入细胞的生长培养基时,该结构会迅速迁移到细胞核中(图1D)。 I-SceI 系统对DSB的感应是稳健的,如前所述18,19,20。通过可视化荧光标记的RNA茎环系统MS2和PP7,可以并行监测报告基因转录。
研究方案
1. 用于活细胞显微镜的细胞制备和转染
- 在活细胞显微镜 实验前一天,准备一个25 cm2细胞培养瓶,报告细胞系(EX2,EX2-AS或PROM)与5mL DMEM一起达到80-90%的汇合度。
- 用移液管从25 cm 2 细胞培养瓶中吸出培养基,并用2.5mL 1x PBS洗涤细胞。
- 加入1mL胰蛋白酶-EDTA(0.05%),并在37°C下孵育2-3分钟以进行细胞脱离。
- 细胞脱离后,加入4mL不含酚红的DMEM含HEPES缓冲液,补充10%(v / v)木炭剥离的胎牛血清,并轻轻重悬细胞。
- 将细胞溶液的板1mL放入具有10 mm玻璃底孔(直径1.5号)的35mm圆形培养皿中并均质化。将35mm圆形培养皿储存在100mm标准细胞培养皿中,并将其在37°C下在具有5%CO 2的加湿气氛中孵育。
- 接种后〜6小时,转染玻璃底培养皿中的细胞。对于每种转染混合物,按以下方式制备两种溶液:
- 在1.5mL微量离心管中,制备含有150μL还原血清最小必需培养基(MEM),质粒DNA(如 表1所述)和2.5μg/ μL转染辅助试剂DNA的溶液A(见 材料表)。
- 同时,制备溶液B,含有150μL还原血清MEM和1.5μg/ μL脂质转染试剂的DNA(见 材料表)。
- 将两种溶液在室温(RT)下孵育5分钟。然后,将溶液A轻轻加入溶液B中,并在室温下孵育20分钟。
- 要转染细胞,将300μL溶液A + B滴加到每个培养皿中并轻轻分布。将玻璃底培养皿储存在100毫米标准细胞培养皿中,并将其在37°C的加湿气氛中孵育,其中CO2含量为5%。
- 准备一个1.5mL微量离心管,其中200μLDMEM与HEPES,没有酚红,补充10%(v / v)木炭剥离的胎牛血清,并加入TA至7.5×10-7 M的浓度。
2. 实验设置
- 在公共控制单元处将大型有机玻璃显微镜孵育室和顶台孵育室的温度设置为37°C。将舞台培养箱内的环境条件设置为5%CO2 和100%湿度。
注:在开始实验之前,必须至少设置显微镜笼和载物台培养箱的温度,以允许加热整个系统,以尽量减少温度波动。同时启动所有其他显微镜控制和操作单元。 - 通过向生长培养基中加入多西环素(0.5μg/ mL)来诱导报告基因的转录,并在开始显微镜观察之前用200μL微量移液器上下移液约1小时轻轻混合。
注意:将转染细胞的玻璃底培养皿保持在100毫米标准细胞培养皿内,以便于处理,并在聚苯乙烯泡沫塑料容器中从细胞培养物运输到显微镜室,以保持温度尽可能稳定。 - 在开始观察之前至少30分钟将细胞运送到显微镜中,并在到达后,将100mm培养皿与细胞立即放在预热的大型显微镜孵育室内。
- 将微量离心管与步骤1.7中预稀释的TA放在一起。在大型显微镜环境室内加热至37°C。
- 更换玻璃底盘的盖子,类似于之前准备的盖子,在盖子上钻一个直径为3毫米的孔(图2A)。
注意:TA稍后将通过盖子上的小孔添加到细胞中,而无需操纵安装在显微镜载物台上的培养皿。 - 在显微镜控制面板中选择100x(复消色差物镜,1.4数值孔径)油浸物镜。在物镜上涂抹一滴浸入油。
- 将玻璃底培养皿与细胞放在显微镜台式孵育室内,并将其锁定到位。合上载物台培养箱的盖子和显微镜外壳的所有门。
- 启动显微镜操作和控制软件,打开 焦点控制 窗口(图2B),单击 示波器 窗格,然后在发射 选择 窗格中,单击 100%眼 框以设置眼光束路径,以便用眼睛直接观察样品。
- 在 "滤镜集 "菜单中,切换到 "眼睛 "滤镜集并单击" 明场",然后按 "打开明场 "按钮。
- 将显微镜物镜朝向玻璃底盘移动,直到油接触到玻璃。然后通过目镜观察并手动聚焦在细胞的平面上。关闭" 打开明场 "按钮。
- 在开始实验观察之前,将细胞放置30分钟,以适应环境条件,并通过温度梯度防止成像过程中的焦点漂移。
- 将200 μL微量移液管和200 μL滤嘴尖端放在室温下备用。
3. 图像采集
- 在显微镜 控制 软件的对焦控制窗口中,将激光强度设置为5%,并输入曝光时间值50 ms(图2B)。
- 打开 "捕获 "窗口以调整设置以执行三维(3D)延时的自动图像采集(图2C)。
- 选择 3D捕获 采集类型并设置12到16个相隔0.4μm的光学切片,勾选 "电流范围" 和 "捕获后返回当前位置"复选框。
- 在" 延时捕捉 "窗格中,输入值 120 表示 时间点数 ,输入 30 秒作为 间隔。
- 根据转染的荧光蛋白标记选择共聚焦滤光片集 ,GFP 为 λ = 488 nm,TagRFPt 为 λ = 561 nm, iRFP713 为 λ = 640 nm ,并将每个通道的曝光时间设置为 50 ms。
- 使用激光功率的 电流 设置,使用在 对焦窗口中 选择的5%值(图2C)。
- 在" 对焦控制 "窗口中,转到" 相机 "窗格,选择" 缩放图像显示 "控件,然后选择" 手动 "按钮以设置要显示的固定图像强度范围。输入 "低:500"和"高:5000" 的值(请参见 图 2B)。
注:此设置限制了实时取景中显示的相机捕获的动态范围,以选择相同荧光强度范围内的细胞(图2D)。 - 选择用于诱导DSB时转录位点的3D延时成像的细胞。筛选单元格并根据讨论中描述的条件选择三个视场。
- 将先前位于视野中心的每个选定细胞聚焦,转录位点位于Z-stack的中间平面。
注意:将细胞和转录位点居中置于XYZ中,以适应细胞的某些运动。 - 通过单击"设置点",在"焦点控制"窗口的"XY"窗格中标记每个 XYZ 位置。
注意:在接下来的5分钟内重新访问所选位置2-3次,以确认报告基因的连续转录和XYZ维度中细胞位置的相对位置稳定性。 - 从步骤1.7中加入200μL预稀释的TA。如图 2F所示的单元格。
注意:在添加 TA 时,请格外小心,不要触摸玻璃底碟或盖子,以防止从标记的 XY 位置发生任何偏移。DSB诱导后,确认细胞在视野内居中,转录位点在中心Z平面。重新对焦和位置更新不应超过1-2分钟。 - 通过单击"捕获"窗口中的"开始"来启动 3D 时间序列成像。
- 将成像数据保存在显微镜控制软件中,数据格式在显微镜控制计算机硬盘上。
4. 数据分析
- 在显微镜控制软件中打开成像数据,并导出为16位TIFF格式的文件。
- 使用StaQtool21 软件打开导出的文件。选择 单点3D 模式,然后按 Go加载图像文件。
注:所选时间序列将在 "最大投影延时摄影器"中打开,显示第一个时间点的 z-stack 的最大强度投影(图 3A)。 - 使用左侧的垂直 MAX 滑块调整图像强度显示。
- 使用水平"时间点"滑块选择要分析 的时间点 。
- 将光标悬停在标记的转录站点的位置以进行手动标记,或使用 自动检测 功能,如果检测到多个对象,则按相应的转录站点。
- 使用 自动跟踪 功能可以确定转录站点随时间变化的 XYZ 位置。
注意:如果未正确跟踪给定位置,请根据 StaQtool 软件手册手动选择转录站点。 - 按 "自动 "按钮为每个时间点执行高斯拟合,并测量总荧光强度 (TFI)。
注意:如果转录活性停止,跟踪工具将保持在检测到衍射受限物体(标记的转录位点)的最后一个位置。如果细胞在转录位点标签消失后沿XY方向移动,则需要手动重新定位 搜索方块 。 - 完成每个时间点的 TFI 值拟合后,按 结束延时 按钮关闭当前时序图像文件并继续下一个文件。
注意:TFI 值将自动导出并保存在 Excel 文件中。
5. 显微镜校准测量和分析
- 将细胞接种到35mm玻璃底培养皿中,并用荧光标记的MS2和PP7涂层蛋白转染,如第1节所述。
注意:对于校准测量,请使用简介中描述的相同报告基因细胞系。 - 在开始显微镜图像采集之前,向细胞的生长培养基中加入0.5μg/ mL多西环素1小时。
- 将玻璃底皿安装在显微镜载物台孵育室内,并像以前一样准备图像采集(见第2节)。
注:校准实验时,玻璃底盘的原始盖子不会更换。 - 使用与第 3.1 点中所述的相同激光强度和曝光设置。
- 设置 2D 时间序列的 "捕捉 "设置(在" 捕捉类型 "窗格中取消选择 3D 选项),并在" 延时捕捉" 面板中以 500 毫秒的间隔设置 120 个时间点(图 2C)。
注:此图像采集设置将导致单个光学平面内的时间序列以非常短的间隔。 - 从多个位置获取数十个校准时间序列,以生成数据集以计算数百个单份成绩单TFI测量值。
- 对于校准时间序列的分析,请根据点 4.1 将文件转换为 16 位 TIFF 格式的文件。
- 使用StaQtool21 软件打开导出的文件(图3)。按 选择日志文件 按钮,选择按点4.2中所述获取的相应2D时间序列的日志文件。
- 选中 多点 2D 复选框,然后按 GO 按钮将时间序列加载到分析软件中。
- 在 延时摄影查看器窗口 (图3A)中,在PSF FWHM中,输入字段插入为显微镜系统和物镜计算的值,如所述21。
- 要开始分析过程,请按 "自动检测 "按钮以检测显示的当前时间点的所有衍射受限物体。然后,单击 AutoFit 以执行高斯拟合以确定每个对象的 TFI 值(图 3A)。
- 或者,将光标指向衍射受限的对象,然后单击以选择它(白色正方形内出现绿色圆圈),然后按 "高斯拟合" 按钮进行手动选择和高斯拟合过程。
注意:建议使用最后一种模式来排除未计数的对象,例如同一细胞核中存在多个新生转录本的明亮转录位点。 - 按 结束延时 按钮完成上一步。
注意:结果将自动以 Microsoft Excel 文件格式保存在与图像文件相同的文件夹中。 - 通过按下相应的按钮启动多个点 的TFI和W分布 模块(图3B)。
- 通过"添加文件"按钮加载Excel文件,然后按"转到"按钮开始TFI分析。
注:输出是从多个测量的单一转录本TFI确定的平均TFI值。 - 通过插入先前在点 5.10 中使用的 PSF FWHM 来开始 W 分析。,然后使用 Bin 的默认值 按 Go 按钮 。
注:W参数是单转录本TFI测量的质量控制,以符合所用显微镜系统的正确PSF FWHM值。
6. 数据和校准合并
- 输入从第 4.8 点中保存的 Excel 工作表中获取的时间序列 TFI 值。放入新的 Excel 工作表中,并将每个时间点值除以在点 5.15 中获得的单个成绩单的平均 TFI。
注意:为了标准化此过程,使用了自定义准备的 Excel 模板表单。
结果
含有图1A-C中描述的报告基因的细胞系允许研究活细胞中单个DSB的转录动力学。每个图形报告基因表示下方的图1A-C中的数字表示以千碱基对(kbp)为单位的长度。CMV指示巨细胞病毒启动子,TetO是Tet-operator序列,pA突出了基因末端的3'裂解和聚腺苷化位点。CFP-PTS是融合到过氧化物酶体靶向信号的编码青色荧光蛋白,2UBB是编码的人泛素B串联单元。通过遵循上述方案和分析程序,可以获得显示荧光标记的报告基因转录本随时间变化的数量的图表,在长达数小时的时间内具有几秒钟的时间分辨率(图4A-D)。图4A中的图表显示了由MS2-GFP分子在新生转录本上积累标记的PROM报告基因转录位点的TFI值的时间过程。这个特定的图表代表了没有添加TA的对照实验;因此,不会感应到DSB。在整个60分钟的观察期内,转录继续以爆裂状峰值和2-8个转录本一次进行。EX2 和 EX2-AS 报告基因也获得了类似的结果(此处未显示数据)4。在报告基因中诱导单个DSBs(使用I-SceI-GR-iRFP)允许研究DSB对正在进行的报告基因转录的影响以及监测从DSB位点出现的转录事件,即断裂诱导转录(图4B-D)。
DNA断裂诱导转录的动力学取决于基因中DSB的位置
具有启动子-近端 I-SceI识别位点的报告基因 I-SceI-GR-iRFP诱导单个DSB 导致TA添加后约11 min后报告基因的转录沉默,并且在60分钟观察期内转录未恢复转录(图4B)。当观察EX2报告基因转录时,在TA添加后约30分钟同时完全丢失MS2-GFP和PP7-RFP信号,检测到规范启动子驱动的转录完全抑制。然而,在10分钟内,转录重新启动,正如重新出现的PP7-RFP荧光峰所揭示的那样。PP7-RFP信号(而不是MS2-GFP荧光)的完全恢复显示断裂诱导的转录启动(图4C)。断裂诱导的转录在很长一段时间内不稳定;它看起来像爆发状和低峰值强度,表明只有少数断裂诱导的转录本是从DSB位点启动的。
EX2AS报告基因在I-SceI位点下游的外显子II中包含24x PP7茎环阵列以检测感觉转录,显示规范启动子驱动的转录在TA添加后约25分钟内在EX2AS报告基因内终止。然后,它被反义断裂诱导的转录所取代,正如MS2-GFP蛋白与反义MS2茎环序列生成的RNA结合的积累所揭示的那样(图4D)。由于DSB的诱导,在感觉转录中断之前,反义转录活性不存在,并且在此示例中显示,在大约15分钟内从断裂位点启动了几个转录本。这里获得的代表性数据显示,正如最近报道的那样,DSBs对转录有不同的影响,这取决于它们在基因中的位置4。数据还揭示了 I-SceI-GR-iRFP诱导DSB时间的细胞间变异性,其范围为TA添加后12至30分钟。此外,检测单个转录本允许发现细胞间和断裂位点差异,以达到断裂诱导的转录活性的强度。断裂诱导的转录仅在基因内的DSB中检测到。在启动子-近端 DSB 处不存在该功能,在剩余的观察期内,在 DSB 上,规范转录停止。
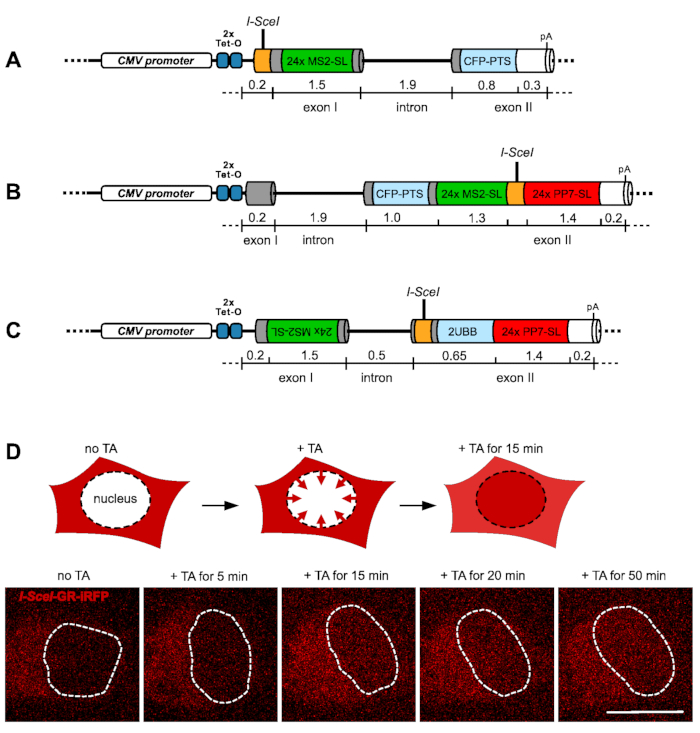
图1:报告基因和诱导DNA双链断裂的系统。 (A)至(C)中的示意图显示了用于研究诱导DNA双链断裂时转录的三个报告基因的结构。第一个外显子(PROM)中具有启动子-近端 I-SceI 位点的报告基因在下游由24x MS2茎环(MS2-SL)序列阵列描述,如(A)。所示。第二个外显子(EX2)中 具有I-SceI 位点的报告基因在上游两侧具有24x MS2茎环序列,下游由24x PP7茎环(PP7-SL)阵列显示,如(B)所示。具有位于外显子II中的 I-SceI 位点的报告基因,具有I-SceI位点上游的24x MS2茎环序列的反平行插入以检测反义转录(EX2-AS)如(C)所示。 I-SceI-GR-iRFP融合蛋白构建体的功能在(D)中通过图形显示和下面的活细胞的相应图像来描述。在报告基因细胞系中构建体(红色)的瞬时表达时,该蛋白完全是细胞质,这可以防止 I-SceI 内切酶过早切割靶位点。加入TA后,融合蛋白开始迁移到细胞核(由虚线表示)并开始在5-15分钟之间积累。比例尺 = 10 μm 请单击此处查看此图的放大版本。
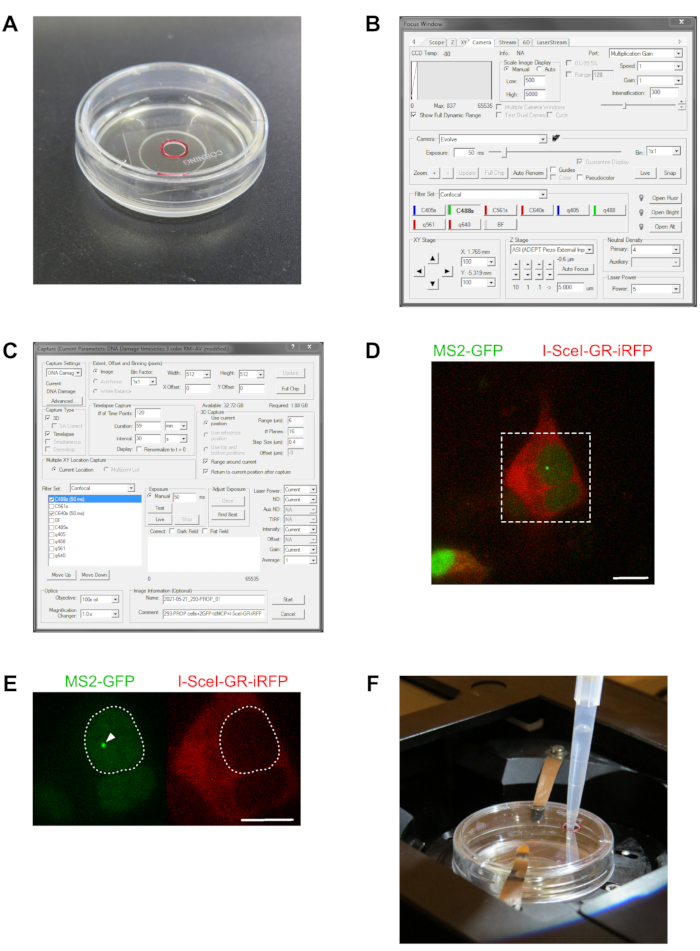
图2:选择细胞进行转录位点的3D延时成像。 (A)中的照片显示了用于活细胞成像的35毫米玻璃底培养皿,带有定制的修改盖子,其中钻出直径为3毫米的孔以直接加入在生长培养基中稀释的TA。孔位置用红色圆圈标记。(B)中的面板显示了显微镜控制软件的"焦点"窗口的屏幕截图,用于设置实时取景曝光时间,滤光片设置,激光强度和比例图像显示到屏幕,以便进行后续的延时成像,在(C)中显示相应的"捕获"窗口的屏幕截图,以调整活细胞3D延时采集的所有设置。第 3 节介绍了"滤镜"、"捕捉类型"、"延时捕捉"和"3D 捕捉"窗格的特定设置。在此处显示的视图中,调整设置以获取用MS2-GFP和I-SceI-GR-iRFP构建体转染的PROM报告基因系的3D延时,以便在报告基因的启动子 - 近端区域诱导DNA双链断裂时进行成像转录。(D)中的图像被合并为GFP和iRFP通道,并显示通过显微镜系统看到的视野,以及293-PROM报告基因细胞系的几个细胞。将细胞与融合到核定位序列的串联二聚体MS2涂层蛋白构建体,两个绿色荧光蛋白(GFP-MS2CP)和 I-SceI-GR-iRFP构建体共转染。几个细胞显示GFP-MS2CP构建体的表达,从而突出了细胞核, I-SceI-GR-iRFP构建体突出了细胞质。虚线方块表示 (E) 中所示的放大区域。对于3D延时成像,根据讨论中给出的要求选择细胞,例如(D)中放大区域中具有较大细胞核的细胞。该细胞用两种荧光构建体转染,并通过在从头转录的报告基因前mRNA上积累GFP-MS2CP来显示明亮标记的转录位点(箭头)(左图)。细胞的生长培养基不含TA;因此, I-SceI-GR-iRFP构建体完全是细胞质(右图)。在(F)中,玻璃底皿安装在显微镜载物台孵育室中,用于3D延时成像实验,并配有包含TA加载孔的定制盖子。将200μL微量移液管尖端小心地插入孔中,将稀释的TA施加到细胞的生长培养基上。比例尺 = 10 μm 请单击此处查看此图的放大版本。
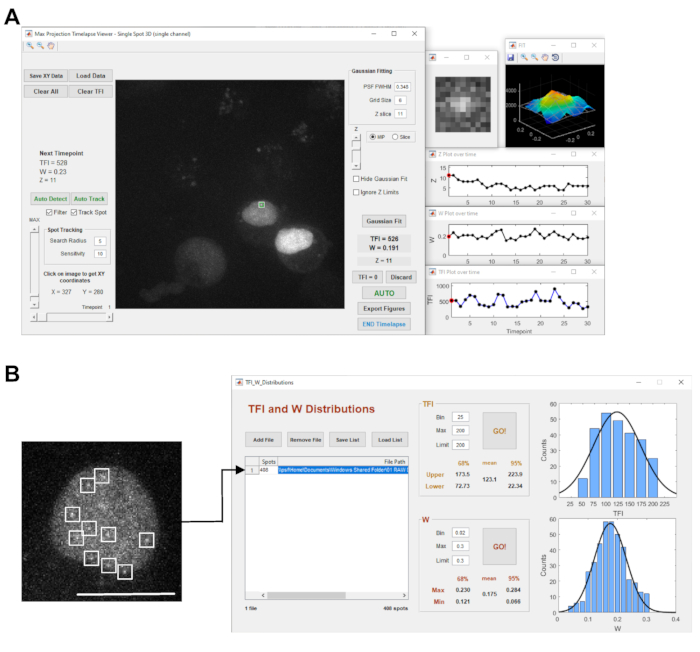
图 3:图像采集和分析软件。 (A) 中的面板显示了 STaQTool:Spot 跟踪和量化工具的屏幕截图。该图像显示了PROM报告基因细胞系的示例时间序列,其标记的转录位点在中心的最大强度投影显示中标有绿色圆圈/白色正方形。右侧的窗口显示所选转录位点的放大视图、具有当前时间点的 2D 高斯拟合网格的相应 3D 着色强度表面图,以及 z 栈内转录位点 Z 位置的图、高斯拟合宽度 (W) 和随时间变化的 TFI 测量值。(B)中的显微图像显示了转染有MS2-GFP的PROM报告基因细胞系细胞核的缩放单个光学平面。该图像表示具有 120 个时间点的 2D 校准时间序列的一次性点。细胞核显示几个荧光标记的转录本在核质中显示为衍射受限的物体(用白色方块标记)。右侧面板显示了 STaQTool 中 TFI 和 W 分布工具的屏幕截图,用于分析 2D 延时采集中的多个点。在该示例分析中,该工具检测到408个衍射限制点,代表用MS2-GFP标记的报告基因转录本,这些转录本在核质中扩散。右侧的图形显示对象的 TFI 和高斯拟合宽度分布直方图以及高斯拟合曲线。从高斯拟合曲线的中心峰值位置派生的 TFI 和 W 平均值以及计算出的置信区间将显示在相应的窗格中。比例尺 = 10 μm 请单击此处查看此图的放大版本。
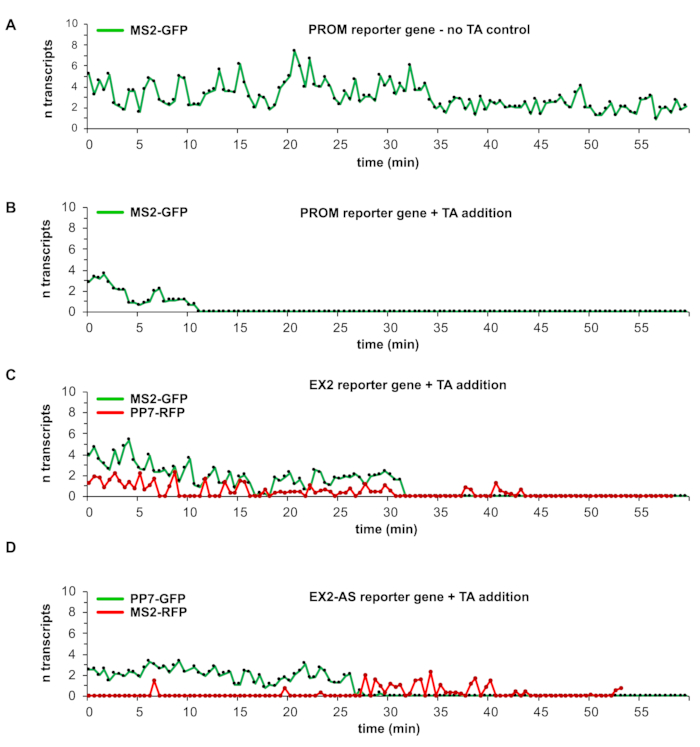
图4:DNA双链断裂部位转录检测的代表性结果。 (A)至(D)中的图形表示一个转录位点随时间变化的校准TFI曲线。TFI值使用在校准实验中针对相应报告基因构建体和相应实验中使用的荧光标记RNA茎环结合蛋白MS2或PP7测量的单个转录本的平均TFI转换为转录本。在(A)中,显示了使用PROM报告基因而不添加TA的对照实验的图表。标有MS2-GFP的转录本表明在整个观察期内具有连续的转录活性。(B)中的图表示TA添加和诱导DSB时的PROM报告基因,这导致剩余观察时间的转录抑制。(C)中的EX2报告基因图显示了在添加TA时对规范启动子驱动的转录的转录抑制。在同一时间推移的后期,只有PP7-RFP标记的转录活性出现。在(D)中的图表中,从规范启动子到传感方向的EX2-AS报告基因转录在TA添加到(C)中的EX2报告基因时同样受到抑制。然而,来自反向插入的MS2茎环序列的MS2-RFP标记转录本的出现表明在TA添加之前的意义转录活动期间不存在反义转录。 请点击此处查看此图的放大版本。
| 报告细胞系 | EX2 和 EX2-AS | 舞会 |
| 转染质粒 | 1.5 微克 pI-SceI-GR-iRFP | 1.5 微克 pI-SceI-GR-iRFP |
| 0.65 μg pUBC-mCherry-nls-tdPP7-mCherry | 0.5 μg pUBC-GFP-nls-tdMS2-GFP | |
| 0.35 微克 pUBC-GFP-nls-tdMS2-GFP |
表1:报告基因细胞系的转染。 该表描述了用于瞬时转染不同报告基因细胞系的不同质粒的转染方案和量。
讨论
复制、转录、DNA 损伤和 DNA 修复等基本生物过程之间的冲突已被确定为基因组不稳定的关键来源22。这些研究还导致在DNA损伤位点发现了转录,并将断裂诱导的转录本在调节DNA损伤修复过程中的功能作用归因于23。这里描述的新工具和方案允许进一步研究DSB的RNA Pol II转录动力学。该协议中的一个关键点是产生包含整合到基因组中的报告基因的单个拷贝的细胞系。这一关键特征消除了由多个报告基因的转录产生的噪声,这些基因与单个基因组位点内的多个拷贝集成在一起,并允许收集转录动力学和单个RNA转录本的动力学参数。观察单报告基因整合转录的关键技术要求是显微镜系统的可用性,该系统允许检测活细胞中用MS2或PP7系统标记的单个RNA转录本4,12。在这里,活细胞显微镜是在安装在倒置显微镜上的共聚焦旋转盘系统上进行的,该系统配备了100 mW固态激光器,并连接到声光可调谐滤波器,如其他地方所述24。此外,要使用报告基因在单个DSB下研究转录,必须仔细监测单个细胞以实现最高的时间分辨率,这需要对细胞进行数小时的成像,这使得这是一种低通量测定。尽管如此,我们仍然观察到几个细胞与压电驱动的显微镜载物台控制的定位并行。为了确保在数小时内观察活细胞的最佳环境条件,显微镜主体(包括样品台)放置在有机玻璃环境室中。此外,封闭式平台培养箱安装在显微镜载物台上,并连接到CO2 和湿度供应控制器。
该协议中的第一个关键步骤是选择具有细胞的感兴趣区域以进行成像。标记用于成像的每个XY位置必须包含一个或多个细胞,根据表1第1节以及图2D,E中描述的报告基因和转染方案显示与荧光RNA干环结合蛋白的转染。此外,细胞必须表现出明亮的标记转录位点,必须与I-SceI-GR-iRFP713构建体共同转染,并且蛋白质必须最初定位于细胞质中(图2D和E)。
细胞应显示未结合的荧光标记MS2和/或PP7涂层蛋白的荧光强度水平,足以检测背景荧光水平上的单个标记转录本。同时,荧光标记的MS2和/或PP7涂层蛋白的稳定荧光强度水平是必要的,以便允许成像至少60分钟,而不会由于发生一些漂白而损失太多荧光。第3.7节中描述的具有固定范围的"缩放图像显示"用于允许根据其荧光强度水平对细胞进行标准化选择。
第二个关键的实验方案步骤是通过玻璃底皿盖上的小孔将TA添加到预定XY位置的细胞中。对玻璃底培养皿的任何操作都会导致细胞的标记XY位置偏移,必须避免。因此,小心处理微量移液器,同时加入稀释在细胞生长培养基中的TA对于预选细胞的成功观察至关重要, 如图2F所示。适应不同的系统以将药物添加到安装在显微镜载物台上的细胞中,例如灌注系统,将需要一个单独的阶段孵育室,具有管入口和出口开口以及泵或注射系统来管理药物。其他方法,例如具有盖玻片状底面的通道载玻片导致给药药物缓慢扩散到通道中,并导致药物添加和效果之间的额外延迟。最后,不小心移液到通道载玻片开口中也可能改变样品位置。因此,本系统在玻璃底培养皿的盖子上具有定制的钻孔,易于适应,成本低,并且适用于施用不同的生长培养基,药物和组分。小直径的孔和舞台孵育室中的加湿气氛也防止了细胞培养基的干燥。
该协议的第三个关键步骤是数据分析,这需要手动检查由于DSB诱导而停止转录的时间点。终止转录的时间点通过从报告基因转录的先前明亮标记位点释放最后一个转录本来指示。同样,必须小心检查断裂诱导转录起始的事件,以检测具有相对较低的单个荧光标记的mRNA的信噪比的单个转录事件。
诱导DSB的修复动力学为使用这些报告器生成的数据的分析增加了额外的复杂性,将它们限制在DSB诱导后的最初几分钟内。报告基因的转基因性质以及MS2和PP7茎环阵列的重复富集性质可能组装出独特的染色质景观,干扰建立假定稳定的断裂诱导转录程序。尽管如此,与电离或紫外线照射相比, I-SceI 介导的报告基因中DSB的诱导是一个更强大的系统,可以研究单个DSB的转录。
不同的内切酶系统,如 I-CreI, I-PpoI 或 AsiSI ,在人类基因组中具有或不具有额外的识别位点,可以与目前的报告基因系统相结合,以可能产生更高的DSB效率。然而,他们需要首先将核酸内切酶识别位点引入报告基因中。其次,它们在单个细胞中DSB的诱导时间和效率方面可能具有相似的变异性。另一方面,插入核酸内切酶识别位点的串联拷贝可能会提高DSB诱导的效率。此外,在不同细胞系中测试所呈现的报告基因系统将允许比较不同细胞背景之间DSB位点的转录动态以及不同DNA损伤修复途径的可用性,例如在癌细胞,原代细胞和分化非循环细胞中。然而,与Flp / FRT系统相容的报告基因的构建目前限制了与可用Flp / FRT宿主细胞系的整合。
除了基于显微镜的应用外,当前的报告基因还可以与生化测定(例如染色质免疫沉淀)相结合,以研究DNA修复或转录因子对单个DSB的募集或评估核小体占用,组蛋白修饰和DSB位点周围的染色质状态。此外,与不同的报告系统相结合将允许研究DNA损伤与基因组组织或DNA复制等过程之间的功能联系。
披露声明
作者没有利益冲突可披露。
致谢
我们感谢RH Singer,J.A. Chao,T. Misteli,M. Carmo-Fonseca赠送的质粒和试剂。我们还感谢iMM生物成像设施的工作人员A. Temudo,A. Nascimento和J. Rino对手稿的批判性阅读。这项工作由PTDC/MED-OUT/32271/2017、PTDC/BIA-MOL/30438/2017和PTDC/MED-OUT/4301/2020资助,来自葡萄牙CIência e Tecnologia基金会(FCT)和LISBOA-01-0145-FEDER-007391,该项目由FEDER通过葡萄牙2020-葡萄牙里斯本地区行动计划和FCT共同资助。欧盟地平线2020研究与创新计划(RiboMed 857119)也获得了资金。M.A.是FCT博士奖学金 2020.05899.BD 获得者。
材料
| Name | Company | Catalog Number | Comments |
| 100 mW solid-state Lasers | Coherent Inc., Santa Clara, CA, USA | ||
| 3i Marianas SDC Confocal Spinning Disk system | Intelligent Imaging Innovations Inc. | ||
| Air-cooled EMCCD Camera Evolve 512 | Photometrics, Tucson, AZ USA | ||
| Axio Observer Z1 inverted microscope | Carl Zeiss MicroImaging, Germany | ||
| Blasticidin | InvivoGen | ant-bl-1 | |
| charcoal-stripped fetal bovine serum | Sigma-Aldrich | F6765-500 ML | |
| CO2 module S | PeCon GmbH, Erbach, Germany | ||
| CSU-X1 confocal spinning disk unit | Yokogawa Electric, Tokyo, Japan | ||
| DMEM | Gibco | 41966029 | |
| DMEM with Hepes no PhenolRed | Gibco | 21063-029 | |
| Doxicyclin | Sigma-Aldrich | D9891 | for induction of reporter gene expression; stock solution of 0.5 mg/ml was used at 1:1000 dillution in cell growth medium |
| FBS | Gibco | 10270106 | |
| Flp-In T-REx 293 cell line | Thermo Fischer Scientific Invitrogen | R75007 | |
| I-SceI-24x MS2 stem loop sequence | GeneArt, Thermo Fischer Scientific | custom synthesized DNA fragment containing a single I-SceI recognition sequence and 24 tandem MS2 stem loop sequences | |
| Heating Device Humidity 2000 | PeCon GmbH, Erbach, Germany | ||
| Hygromycin B | Roche | 10843555001 | |
| Immersion oil Immersol 518 F | Carl Zeiss MicroImaging Inc.) | 444960-0000-000 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| Lipofectamin 3000 helper reagent P3000 | Thermo Fisher Scientific | L3000001 | transfection helper reagent |
| Lipofectamine 3000 reagent | Thermo Fisher Scientific | L3000001 | lipid-based transfection reagent |
| MatTek 35 mm dish, Glass bottom No. 1.5 | MatTek Corporation, Ashland, MA, USA | P35G-1.5-10-C | |
| microscope incubation chamber | PeCon GmbH, Erbach, Germany | ||
| pcDNA5/FRT/TO | Thermo Fischer Scientific Invitrogen | V652020 | |
| pOG44 plasmid | Thermo Fischer Scientific Invitrogen | V600520 | |
| SlideBook 6.0 Software | Intelligent Imaging Innovations Inc. | ||
| stage incubation chamber PeCon P-Set 2000 | PeCon GmbH, Erbach, Germany | ||
| StaQtool Software | iMM-JLA Lisbon, Portugal | available at: https://imm.medicina.ulisboa.pt/facility/bioimaging/lib/exe/fetch.php?media=STaQTool_setup.zip | |
| triamcinolone acetonide (TA) | Sigma-Aldrich | T6501 | synthetic glucocorticoid; induces the glucocorticoid receptor to migrate from the cytoplasm to the nucleus |
| Trypsin/EDTA Solution (TE) | Thermo Fisher Scientific | R001100 |
参考文献
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461 (7267), 1071-1078 (2009).
- Capozzo, I., Iannelli, F., Francia, S., d'Adda di Fagagna, F. Express or repress? The transcriptional dilemma of damaged chromatin. FEBS Journal. 284 (14), 2133-2147 (2017).
- Michelini, F., et al. Damage-induced lncRNAs control the DNA damage response through interaction with DDRNAs at individual double-strand breaks. Nature Cell Biology. 19 (12), 1400-1411 (2017).
- Vítor, A. C., et al. Single-molecule imaging of transcription at damaged chromatin. Science Advances. 5 (1), (2019).
- Michalik, K. M., Böttcher, R., Förstemann, K. A. Small RNA response at DNA ends in Drosophila. Nucleic Acids Research. 40 (19), 9596-9603 (2012).
- Wei, W., et al. A role for small RNAs in DNA double-strand break repair. Cell. 149 (1), 101-112 (2012).
- Francia, S., et al. Site-specific DICER and DROSHA RNA products control the DNA-damage response. Nature. 488 (7410), 231-235 (2012).
- Vítor, A. C., Huertas, P., Legube, G., de Almeida, S. F. Studying DNA double-strand break repair: An ever-growing toolbox. Frontiers in Molecular Biosciences. 7, 24 (2020).
- Alt, F. W., et al. Synthesis of secreted and membrane-bound immunoglobulin mu heavy chains is directed by mRNAs that differ at their 3' ends. Cell. 20 (2), 293-301 (1980).
- Watakabe, A., Tanaka, K., Shimura, Y. The role of exon sequences in splice site selection. Genes & Development. 7 (3), 407-418 (1993).
- Guth, S., Martínez, C., Gaur, R. K., Valcárcel, J. Evidence for substrate-specific requirement of the splicing factor U2AF(35) and for its function after polypyrimidine tract recognition by U2AF(65). Molecular and Cellular Biology. 19 (12), 8263-8271 (1999).
- Martin, R. M., Rino, J., Carvalho, C., Kirchhausen, T., Carmo-Fonseca, M. Live-cell visualization of pre-mRNA splicing with single-molecule sensitivity. Cell Reports. 4 (6), 1144-1155 (2013).
- Peabody, D. S. The RNA binding site of bacteriophage MS2 coat protein. The EMBO Journal. 12 (2), 595-600 (1993).
- Lim, F., Peabody, D. S. RNA recognition site of PP7 coat protein. Nucleic Acids Research. 30 (19), 4138-4144 (2002).
- Chao, J. A., Patskovsky, Y., Almo, S. C., Singer, R. H. Structural basis for the coevolution of a viral RNA-protein complex. Nature Structural & Molecular Biology. 15 (1), 103-105 (2008).
- Bertrand, E., Chartrand, P., Schaefer, M., Shenoy, S. M., Singer, R. H., Long, R. M. Localization of ASH1 mRNA particles in living yeast. Molecular Cell. 2 (4), 437-445 (1998).
- Larson, D. R., Zenklusen, D., Wu, B., Chao, J. A., Singer, R. H. Real-time observation of transcription initiation and elongation on an endogenous yeast gene. Science. 332 (6028), 475-478 (2011).
- Soutoglou, E., et al. Positional stability of single double-strand breaks in mammalian cells. Nature Cell Biology. 9 (6), 675-682 (2007).
- Rouet, P., Smih, F., Jasin, M. Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease. Molecular and Cellular Biology. 14 (12), 8096 (1994).
- Roukos, V., Voss, T. C., Schmidt, C. K., Lee, S., Wangsa, D., Misteli, T. Spatial Dynamics of Chromosome Translocations in Living Cells. Science. 341 (6146), 660 (2013).
- Rino, J., de Jesus, A. C., Carmo-Fonseca, M. STaQTool: Spot tracking and quantification tool for monitoring splicing of single pre-mRNA molecules in living cells. Methods. 98, 143-149 (2016).
- Hamperl, S., Bocek, M. J., Saldivar, J. C., Swigut, T., Cimprich, K. A. Transcription-replication conflict orientation modulates R-Loop levels and activates distinct DNA damage responses. Cell. 170 (4), 774-786 (2017).
- D'Alessandro, G., d'Adda di Fagagna, F. Transcription and DNA Damage: Holding Hands or Crossing Swords. Journal of Molecular Biology. 429 (21), 3215-3229 (2017).
- Boulant, S., Kural, C., Zeeh, J. C., Ubelmann, F., Kirchhausen, T. Actin dynamics counteract membrane tension during clathrin-mediated endocytosis. Nature Cell Biology. 13 (9), 1124-1131 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。