Method Article
DNA二重鎖破断時の転写活性の生細胞イメージング
要約
このプロトコルは、新しいレポーター遺伝子システムと、一分子感受性を有するDNA二本鎖破断時の転写を検出するための実験的セットアップを提示する。
要約
DNA二本鎖切断(DSB)は、DNA損傷の最も深刻なタイプです。ゲノム完全性に壊滅的な影響を及ぼすにもかかわらず、DSBが転写にどのような影響を与えるかは、これまでのところ不可解なままです。その理由は、転写を同時に監視するための適切なツールの欠如と、十分な時間的および空間的解像度を持つ新しいDSBの誘導であった。この研究は、DNAテンプレートでDSBが誘導された直後に生細胞の転写を直接可視化する新しいレポーターのセットを記述する。バクテリオファージRNAステムループは、単一分子感受性で転写を監視するために使用される。DSBを特定の遺伝子領域にタージングするために、レポーター遺伝子はホーミングエンドヌクレアーゼ I-SceIの単一の認識配列を含む、それ以外の場合はヒトゲノムから存在しない組み合わせて設計される。各レポーター遺伝子の単一のコピーがヒト細胞株のゲノムに統合された。この実験システムは、正規遺伝子転写またはDNA破壊誘発転写開始によって生成された単一RNA分子の検出を可能にする。これらの記者は、転写とDNA損傷の間の相互相互作用を解釈し、DNA破壊誘発転写の評価されていない側面を開示する前例のない機会を提供する。
概要
DNA二本鎖切断(DSB)は、細胞機能を破壊し、いくつかの疾患および老化の反乱に寄与する有毒なDNA病変である。DSBの不正確な修復に起因する突然変異は、遺伝子発現に影響を与え、細胞の機能的衰退の基礎を設定する。 DSBsが病変部位でノボ破断誘発転写を駆動するという明らかになった見解は、DSBが破断誘発RNAを介して細胞機能にも影響を与える可能性があることを示唆している。いくつかの最近の研究は、DSBがプログラム(例えば、刺激誘発性遺伝子で)および予定外(例えば、非正規プロモーターで)転写を開始するのに十分であることを示している4,5,7。しかし、DNA損傷と転写の間のリンクを探求するいくつかの研究にもかかわらず、この分野は依然としてDNA破壊部位における転写事象の正確な(すなわち単一分子)特徴付けを提供する能力に遅れをとった。その重要な理由の1つは、適切な実験ツールの欠如でした。細胞照射(γ線、X線、重イオン)および薬物治療(例えば、トポイソメラーゼ阻害剤またはインターカロ剤)は、空間的な精度を欠き、一本鎖切断およびDNA付加物8を含むDSB以外のDNA病変を誘導する。I-PpoIやAsiSIなどのエンドヌクレアーゼは、遺伝子座特異的なDSBを生成しますが、高精度の単一の遺伝子座で同時に生細胞の転写を可視化できるシステムと組み合わせられていない8。この制限を回避するために、私たちの研究室は、ユニークなDSB4の制御誘導時に単一分子分解能で転写を直接視覚化する最先端のレポーターのセットを開発しました。ここでは、これらのレポーターについて説明し、DSBでの転写の生細胞イメージングのための詳細なプロトコルを提供し、単一のDSBで転写開始を明らかにするデータを示す。
このプロトコルで使用されるレポーター遺伝子系は、よく特徴づけられたマウスIgMレポーター遺伝子に基づいており、重鎖9,10,11のIgM μ膜結合形態のエキソンM1およびM2を含有する。ハイブリッドイントロンは、強いアデノウイルス主要後期転写物(AdML)PY tract12を有する2つのエキソンを分離する。レポーター遺伝子の発現は、ヒトサイトメガロウイルスプロモーター(CMV)によって制御され、テト操作体(TetO)配列の2つのタンデムコピーが挿入されている。レポーター遺伝子は、それぞれFlp組換え標的(FRT)部位を含むプラスミドベクターに挿入され、HEK293宿主細胞株のゲノム中の特定のFRT標的部位に挿入される。この細胞株はまた、テトラサイクリン/ドキシサイクリンの有無を介してレポーター遺伝子の発現を調節するテットリプレッサータンパク質を構成的に発現する。レポーター遺伝子転写の可視化を可能にするために、PP7ステムループ配列のMS2ステムループ配列の24タンデム反復と24タンデム反復を、レポーター遺伝子の転写開始部位およびエキソン/イントロン構造に関して異なる位置に挿入した。MS2/PP7 RNAステムループは転写時に形成され、緑色および赤色の蛍光タンパク質でタグ付けされた異所性MS2/PP7コートタンパク質によって特異的に結合され、以前は転写13,14,15を画像化するために広く使用されている戦略です。さらに、18 bp認識配列の単一のコピーを、レポーター遺伝子内のRNAステムループ配列によって直接横たわっているホーミングエンドヌクレアーゼI-SceIに挿入した。標準クローニング技術は、全てのプラスミドを生成するために使用され、PROPレポーター遺伝子のI-SceI-24xMS2ステムループを含む断片を、市販遺伝子合成サービスによって合成した。
プロモーター近位DSBレポーター遺伝子(PROP)は、エキソンIの推定転写開始部位のI-SceI切断部位45塩基対(bp)を挿入し、続いて24倍MS2ステムループカセットの開始まで149 bpを挿入して構築した。 冗長性を低減するために、さらに5つの非反復的な20 bpスペーサーシーケンスを追加します。MS2ステムループアレイは、1844 bpイントロンの始まりまで72 bp、切断およびポリアデニル化部位まで1085 bpエキソンIIが続きます。エキソンIIは、レポーター遺伝子発現の独立したスクリーニングを可能にするヒトペルオキシソマルアシルCoAオキシダーゼからC末端ペルオキシソーム標的配列(PTS)に融合したシアン蛍光タンパク質(CFP)をコードする(図1A)。
エキソンII DSBレポーター遺伝子(EX2)は、167 bpのエキソンと続くイントロンとエキソンIIがCFP-PTSをコードする。さらに169bpの距離で下流に、24倍MS2ステムループを含むカセットを挿入し、続いて I-SceI 部位を中心に84bpリンカー配列を挿入し、続いて24倍PP7ステムループと221bpが切断およびポリアデニル化部位17 まで続いた(図1B)。
最後に、アンチセンス転写標識(EX2AS)を有するエキソンII DSBレポーター遺伝子は、ヒトユビキチンB(UBB)遺伝子転写UBB-201に基づいており、2つのエキソンと1つのイントロンが含まれています。エキソンIは、24倍MS2のステムループシーケンスの逆挿入を伴う1534 bpの全長を有する。したがって、正しいMS2ステムループRNA配列は、CMVプロモーターからのレポーター遺伝子のセンス転写に関してアンチセンス方向に転写される。イントロンは490 bpの長さを有し、続いて I-SceI 部位を有するエキソンIIが続き、2つのインフレームユビキチンサブユニットに対して符号化領域が挿入された。UBB遺伝子の下流は、レポーター遺伝子をある意味方向に転写した際に24倍PP7ステムループを形成する配列である(図1C)。
ホーミングエンドヌクレアーゼI-SceIの誘導性構築物の一時的なトランスフェクションは、各レポーターgene18内の挿入された認識部位でのDSBの制御された作成を可能にする。I-SceIエンドヌクレアーゼは、グルココルチコイド受容体のリガンド結合ドメインと遠赤色蛍光タンパク質iRFP713とフレーム内で融合している。この構築物は、トリアムシノロンアセトニン(TA)の存在の細胞質であるが、細胞の増殖培地にTAを添加すると核に急速に移行する(図1D)。I-SceIシステムによるDSBの誘導は、18,19,20の前に示されているように堅牢です。レポーター遺伝子転写は、蛍光タグ付きRNAステムループシステムMS2とPP7を可視化することにより、並列に監視することができる。
プロトコル
1. 細胞の生細胞顕微鏡のための細胞の調製とトランスフェクション
- ライブ細胞顕微鏡実験の前日に80-90%の合流性を達成するために、レポーター細胞株(EX2、EX2-AS、またはPROM)の25cm2細胞培養フラスコをDMEMの5 mLで調製します。
- 培地を25cm2の細胞培養フラスコからピペットで吸引し、2.5mLの1xPBSで細胞を洗浄する。
- トリプシンEDTA(0.05%)を1 mL添加し、37°Cでインキュベートして2~3分間培養して細胞剥離を行います。
- 細胞剥離後、ヘペスバッファーを含むフェノールレッドなしでDMEMの4 mLを加え、10%(v/v)炭摘み取り牛血清を補い、細胞を穏やかに再中断する。
- 10mmガラス底ウェル(直径1.5)を備えた35mm丸皿のセル溶液のプレート1mLを均質化。35mmの丸い皿を100mm標準の細胞培養皿の中に入れ、5%CO2の加湿雰囲気の中で37°Cでインキュベートします。
- ~6時間播種後、ガラス底皿の細胞をトランスフェクトする。各トランスフェクション混合物について、次の方法で2つの溶液を調製します。
- 1.5 mLマイクロ遠心チューブで、150 μLの還元血清最小必須培地(MEM)、プラスミドDNA( 表1に記載)、および2.5 μg/μLのトランスフェクションヘルパー試薬のDNAを含む溶液Aを調製します( 材料表参照)。
- 並行して、脂質ベースのトランスフェクション試薬の150μLの還元血清MEMおよび1.5μg/μL DNAを含む溶液Bを調製する( 材料表を参照)。
- 両方の溶液を室温(RT)で5分間インキュベートします。次に、溶液Aを溶液Bに軽く加え、RTで20分間インキュベートする。
- 細胞をトランスフェクトするには、各皿に300 μLの溶液A+Bドロップワイズを加え、穏やかに分配します。ガラス底皿を100mm標準の細胞培養皿の中に保管し、5%CO2の加湿雰囲気の中で37°Cでインキュベートします。
- ヘペスとDMEMの200 μLで1.5 mLマイクロ遠心チューブを準備し、フェノールレッドに10%(v/v)の炭を剥がしたウシ胎児血清を補わず、TAを7.5 x 10-7 Mの濃度に加えます。
2. 実験的なセットアップ
- 大きなプレキシガラス顕微鏡インキュベーションチャンバーとトップステージインキュベーションチャンバーの温度を、共通制御ユニットで37°Cに設定します。ステージインキュベーションチャンバ内の環境条件を5%CO2 、湿度100%に設定します。
注:顕微鏡ケージとステージインキュベーター温度は、温度変動を最小限に抑えるために完全なシステムの加熱を可能にするために、実験を開始する前に少なくとも1時間を設定する必要があります。他のすべての顕微鏡制御と操作ユニットを同時に開始します。 - 成長培地にドキシサイクリン(0.5 μg/mL)を加えてレポーター遺伝子の転写を誘導し、顕微鏡観察を開始する前に200 μLマイクロピペット~1時間で上下にピペットを加えて穏やかに混合します。
注:トランスフェクトされた細胞を持つガラス底皿は、100mmの標準的な細胞培養皿の中に入れて、細胞培養物から顕微鏡室への取り扱いと輸送を容易に行い、温度をできるだけ安定に保ちます。 - 観察を開始する少なくとも30分前に顕微鏡に細胞を輸送し、到着時に、予熱された大型顕微鏡インキュベーションチャンバーの中に細胞をすぐに入れて100mm皿を置きます。
- マイクロ遠心チューブをステップ1.7からあらかじめ希釈したTAと一緒に置きます。37 °Cまで温める大きい顕微鏡の環境部屋の中。
- 前に準備したガラス底皿の蓋を、蓋に穴を開けた直径3mmの穴に交換します(図2A)。
注:TAは、顕微鏡ステージに取り付けられた皿を操作することなく、蓋の小さな穴を通して細胞に後で追加されます。 - 顕微鏡コントロールパネルで100x(アポクロマティック目的、1.4個の開口)油浸し目的を選択します。目的に浸漬油の滴を適用します。
- 顕微鏡ステージインキュベーションチャンバー内の細胞でガラス底皿をセットし、所定の位置にロックします。ステージインキュベーターの蓋と顕微鏡ハウジングのすべてのドアを閉じます。
- 顕微鏡の操作および制御ソフトウェアを起動し、[ フォーカス制御 ]ウィンドウ(図2B)を開き、[ スコープ ]ペインをクリックし、[ 放出選択] ペインで[ 100%アイ ]ボックスをクリックして、直接サンプル観察用の眼球ビームパスを設定します。
- フィルタセットメニューで、アイフィルターセットに切り替えて「ブライトフィールド」をクリックし、開くブライトフィールドボタンを押します。
- 顕微鏡の目的をガラス底皿に向かって、オイルがガラスに触れるまで動かします。次に、眼を見て、手動で細胞の平面に焦点を当てます。 [ブライトフィールドを開く ] ボタンをオフにします。
- 実験観測を開始する前に30分間細胞を放置し、環境条件に適応し、温度勾配によるイメージング中の焦点ドリフトを防ぎます。
- 200 μL マイクロピペットと 200 μL フィルターチップを室温で使用できます。
3. 画像取得
- 顕微鏡制御ソフトウェアの フォーカス制御 ウィンドウで、レーザー強度を5%に設定し、露光時間に50msの値を入力します(図2B)。
- [キャプチャ]ウィンドウを開き、3D(3D)タイムラプスの自動画像取得を実行するように設定を調整します(図2C)。
- 3Dキャプチャ取得タイプを選択し、0.4 μmで区切られた12〜16の光学スライスを設定し、電流の周りの範囲のチェックボックスをオンにし、キャプチャ後に現在の位置に戻ります。
- [タイムラプス キャプチャ] ウィンドウで、時間ポイントの数に 120、間隔に 30 秒の値を入力します。
- GFPの場合はλ = 488nm、タグRFPtの場合はλ = 561 nm、iRFP713の場合はλ = 640 nmのトランスフェクト蛍光タンパク質ラベルに従って設定された共焦点フィルタを選択し、各チャネルの露光時間を50 msに設定します。
- フォーカスウィンドウで選択した値5%を使用するには、レーザーパワーの電流を使用します(図2C)。
- フォーカスコントロールウィンドウで、カメラペインに移動し、画像の拡大縮小表示コントロールを選択し、[手動]ボタンを選択して、表示する画像の輝度の固定範囲を設定します。[低] 500 と [高: 5000] の値を入力します (図 2B を参照)。
注: この設定では、同じ蛍光強度範囲内のセルを選択するために、ライブビューに表示されるカメラ キャプチャのダイナミック レンジを制限します(図 2D)。 - DSBの誘導時の転写部位の3Dタイムラプスイメージング用の細胞を選択します。セルを選択し、ディスカッションで説明した条件に従って 3 つの視野を選択します。
- Zスタックの中央平面にある転写部位で、以前に視野の中央に位置する選択した各セルにフォーカスを設定します。
注: セルと転写部位を XYZ の中央に配置すると、セルの移動に対応します。 - [ フォーカス コントロール ] ウィンドウの [XY] ペインで[ポイントの設定]をクリックして、XYZ の各位置を マークします。
注:選択した位置を次の5分で2〜3回再訪し、レポーター遺伝子の連続転写とXYZ次元における細胞の位置の相対的な位置安定性を確認します。 - ステップ1.7から200μLの希釈済みTAを加えます。 図 2F に示すようにセルに対して。
注:マークされたXY位置からのシフトを防ぐために、TAを追加しながら、ガラス底皿や蓋に触れないように細心の注意を払ってください。DSB誘導後、細胞が視野内で中央に配置され、転写部位が中央Z平面内にあることを確認します。再焦点と位置の更新は1-2分以上かかるはずです。 - キャプチャウィンドウで[開始]をクリックして、3D時系列イメージングを開始します。
- 顕微鏡制御コンピュータのハードドライブ上の顕微鏡制御ソフトウェアデータ形式でイメージングデータを保存します。
4. データ分析
- 顕微鏡制御ソフトウェアでイメージングデータを開き、16ビットのTIFFフォーマットファイルとしてエクスポートします。
- エクスポートしたファイルをStaQtool21 ソフトウェアで開きます。 シングル スポット 3D モードを選択し、 Go キーを押して画像ファイルをロードします。
注: 選択した時系列が [最大投影時間表示]ビューアで開き、最初のタイムポイントの Z スタックの最大強度投影が表示されます(図 3A)。 - 左側の垂直 MAX スライダを使用して、イメージの強度表示を調整します。
- 水平の [タイムポイント] スライダーで、分析する タイムポイントを 選択します。
- 手動でマーキングするためのラベル付き転写サイトの位置にカーソルを置くか、複数のオブジェクトが検出された場合は 、自動検出 機能を使用し、それぞれの転写部位を押します。
- 自動トラック機能を使用して、時間の経過に応じた転写サイトの XYZ 位置を決定します。
注:所定の位置が正しく追跡されなかった場合は、StaQtoolソフトウェアマニュアルに従って手動で転写サイトを選択してください。 - オートボタンを押して各タイムポイントのガウスフィッティングを実行し、蛍光強度の合計(TFI)を測定します。
注: 転写活動が停止した場合、トラッキングツールは、回折限定オブジェクト(標識転写サイト)が検出された最後の位置に残ります。転写部位ラベルが消えた後に細胞がXY方向に移動する場合、 検索の正方形 の手動再配置が必要である。 - 各タイムポイントの TFI 値フィッティングが終了したら、[ 終了タイムラプス ] ボタンを押して現在の時系列イメージ ファイルを閉じ、次のファイルに進みます。
注: TFI 値は自動的にエクスポートされ、Excel ファイルに保存されます。
5. 顕微鏡の校正測定と分析
- 細胞を35mmのガラス底皿に播種し、セクション1で説明されているように蛍光タグ付きMS2およびPP7コートタンパク質でトランスフェクトします。
注: キャリブレーション測定では、「はじめに」で説明したのと同じレポーター遺伝子細胞株を使用します。 - 顕微鏡画像取得を開始する前に、細胞の成長培地に0.5 μg/mLのドキシサイクリンを加えます。
- 顕微鏡ステージインキュベーションチャンバー内にガラス底皿を取り付け、画像取得を以前のように準備します(セクション2参照)。
メモ:ガラス底皿の元の蓋は、キャリブレーション実験のために置き換えされません。 - ポイント 3.1 で説明したレーザー強度と露出設定と同じレーザー強度と露出設定を使用します。
- [キャプチャ タイプ] ウィンドウで 2D 時系列の キャプチャ 設定を設定し( キャプチャ タイプ ペインで[3D]オプションを選択解除)、[ Timelapse キャプチャ ]パネルで 500 ミリ秒間隔で 120 個のタイムポイントを設定します(図 2C)。
注: この画像取得の設定は、非常に短い間隔で単一の光学平面内で時系列になります。 - 複数の位置から数十のキャリブレーション時系列を取得して、数百個の単一のトランスクリプトTFI測定をカウントするデータセットを生成します。
- キャリブレーション時系列の分析では、ファイルをポイント 4.1 に応じて 16 ビット TIFF 形式のファイルに変換します。
- エクスポートしたファイルを StaQtool21 ソフトウェアで開きます (図 3)。[ログ ファイルの選択]ボタンを押して、ポイント4.2の説明に従って取得した各2D時系列のログファイルを選択します。
- [ 複数のスポット 2D ]チェックボックスをオンにし、[ GO ]ボタンを押して、時系列を解析ソフトウェアにロードします。
- タイムラプスビューアウィンドウ(図3A)では、PSF FWHMにおいて、入力フィールドは、顕微鏡システムと目標に対して算出された値を、説明21のように挿入する。
- 解析プロセスを開始するには、[ 自動検出 ]ボタンを押して、現在表示されている現在のタイム ポイントの回折制限オブジェクトをすべて検出します。次に、 AutoFit をクリックしてガウス継ぎを実行し、各オブジェクトの TFI 値を決定します(図 3A)。
- または、回折制限のあるオブジェクトの上にカーソルを置き、それをクリックして選択し(白い四角形内の緑色の円が表示されます)、手動選択とガウスフィッティング手順のために ガウスフィット ボタンを押します。
注: 最後のモードは、同じ核内に複数の新しい転写物が存在する明るい転写部位など、カウントされないオブジェクトを除外することをお勧めします。 - [終了時間切り時間]ボタンを押して、前の手順を完了します。
注 : 結果は、自動的に画像ファイルと同じフォルダに Microsoft Excel ファイル形式で保存されます。 - 複数のスポットに対して TFI および W ディストリビューション モジュールを起動します(図 3B)。
- [ファイルの追加] ボタンを使用して Excel ファイルを読み込み、移動ボタンを押して TFI 分析を開始します。
注: 出力は、複数の測定された単一のトランスクリプトのTfIから決定される平均TFI値です。 - ポイント 5.10 で以前に使用した PSF FWHM を挿入して、W 分析を開始します。をクリックし、Bin のデフォルト値を使用して [Go ]ボタンを押します。
注: W パラメータは、使用する顕微鏡システムの正しい PSF FWHM 値に準拠するための単一のトランスクリプト TFI 測定の品質管理です。
6. データとキャリブレーションのマージ
- ポイント 4.8 で保存された Excel シートから取得した時系列 TFI 値を入力します。新しい Excel シートにし、ポイント 5.15 で取得した単一のトランスクリプトの平均 TFI で各時間ポイント値を割ります。
注: このプロセスを標準化するために、カスタム準備された Excel テンプレート フォームが使用されました。
結果
図1A-Cに記載されたレポーター遺伝子を収容する細胞株は、生細胞における単一のDSBにおける転写ダイナミクスの研究を可能にする。各グラフィカルレポーター遺伝子表現の下の図1A-Cの数値は、キロベースペア(kbp)の長さを示しています。CMVはサイトメガロウイルスプロモーターを示し、TetOはTet-operator配列であり、pAは遺伝子末端における3'切断およびポリアデニル化部位を強調する。CFP-PTSはペルオキシソムターゲティングシグナルに融合したコードされたシアン蛍光タンパク質であり、2UBBはコード化されたヒトユビキチンBタンデムユニットである。上記のプロトコルおよび分析手順に従うことによって、蛍光標識されたレポーター遺伝子転写物の数を、時間経過に伴う秒数の時間分解能を有するグラフを得ることができる(図4A-D)。図4Aのグラフは、新生転写物上のMS2-GFP分子の蓄積によって標識されたPROMレポーター遺伝子転写部位のTFI値の時間経過を示す。この特定のグラフは、TA を追加しない制御実験を表します。したがって、DSBは誘導されません。転写は、60分の観察期間全体にわたって一度にバースト状のピークと2〜8の転写物で続きます。同様の結果は、EX2およびEX2-ASレポーター遺伝子について得られた(データは以下に示さない)。4.レポーター遺伝子に単一のDSBを誘導(I-SceI-GR-iRFPを使用)することで、進行中のレポーター遺伝子転写およびDSB部位から出現する転写事象のモニタリング、すなわち破断誘発転写(図4B-D)に対するDSBの影響を研究することができます(図4B-D)。
DNA破壊誘発転写のダイナミクスは、遺伝子内のDSBの位置に依存する
プロモーター近位I-SceI認識部位を有するレポーター遺伝子におけるI-SceI-GR-iRFPによる単一のDSBの誘導は、TA添加後約11分後にレポーター遺伝子の転写サイレンシングを行い、60分の観察期間内に転写が回復しない(図4B)。EX2レポーター遺伝子転写を観察した場合、TA添加後30分前後のMS2-GFPとPP7-RFP信号の両方の同時完全損失により、正規プロモーター駆動転写の完全な抑制が検出された。しかし、10分以内に、転写が再開し、PP7-RFP蛍光の再出現ピークによって明らかになった。PP7-RFPシグナルの完全な回復(MS2-GFP蛍光ではなく)は、ブレーク誘発転写開始を示す(図4C)。破断誘発転写は長期間にわたって安定していない。それはバースト状および低いピーク強度に見え、DSB部位から数回の破断誘発転写物のみが開始されたことを示す。
I-SceI部位のエキソンII下流に24倍のPP7ステムループアレイを含むEX2ASレポーター遺伝子は、センス転写を検出するために、TA添加後約25分以内にEX2ASレポーター遺伝子内で正規プロモーター駆動転写終了を示す。その後、アンチセンスMS2ステムループ配列から生成されたRNAに対するMS2-GFPタンパク結合の蓄積によって明らかにされるように、アンチセンス破断誘発転写に置き換えられる(図4D)。アンチセンス転写活性は、DSBの誘導によるセンス転写の中断前に存在しなかったし、この例では、15分前後で複数の転写が中断部位から開始されたことを示している。ここで得られた代表的なデータは、最近報告されたように、DSBが遺伝子内の位置に応じて転写に異なる影響を及ぼすことを示している4。また、TA添加後12~30分の I-SceI-GR-iRFPによるDSB誘導のタイミングにおける細胞の変動性も明らかにしている。さらに、個々の転写物の検出は、細胞から細胞への発見を可能にし、破断誘発転写活性の強度に向けて部位の違いを破る。破断誘発転写は、遺伝子内のDBでのみ検出される。プロモーター近位のDSBでは存在せず、残りの観察期間はDSBで正規転写が停止する。
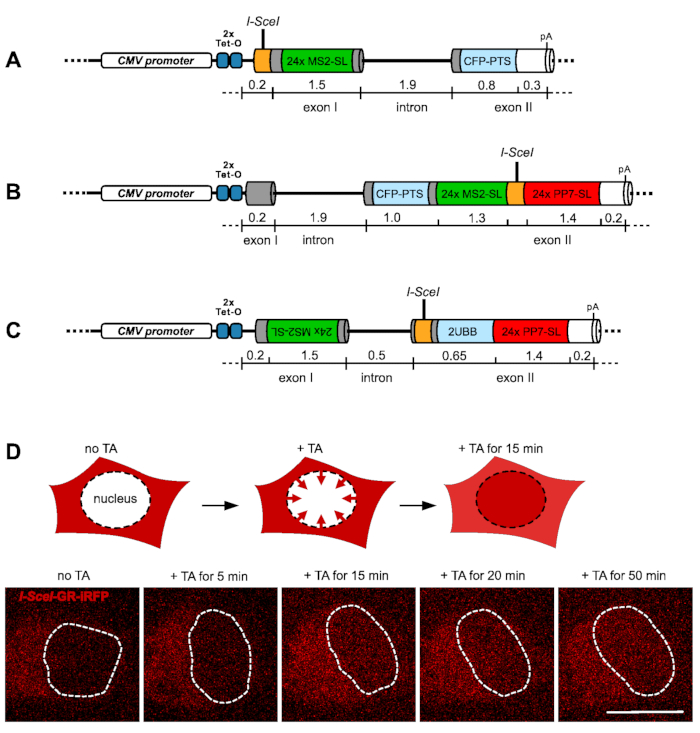
図1:DNA二本鎖切断を誘導するレポーター遺伝子とシステム (A)〜(C)の概略表現は、DNA二本鎖破断の誘導時に転写を研究するために使用される3つのレポーター遺伝子の構造を示す。第1エキソン(PROM)におけるプロモーター近位 I-SceI 部位を有するレポーター遺伝子は、24倍MS2ステムループ(MS2-SL)配列によって下流に横たわる配列(A)に描かれている。24x MS2ステムループ配列で上流に横たわる第2エキソン(EX2)の I-SceI 部位を有するレポーター遺伝子を、24倍PP7ステムループ(PP7-SL)アレイによって下流に横たわる(B)。I-SceI部位に位置するレポーター遺伝子を、 I-SceI 部位の上流に24倍MS2ステムループ配列を上流に挿入してアンチセンス転写(EX2-AS)を検出した(C)に示されている。 I-SceI-GR-iRFP融合タンパク質構築物の機能は、以下の生細胞のグラフィカルディスプレイおよび対応する画像によって(D)に描かれています。レポーター遺伝子細胞株中の構築物(赤色)の一過性発現時に、タンパク質は細胞質のみであり、 I-SceI エンドヌクレアーゼによる標的部位の早期切断を防止する。TAを添加すると、融合タンパク質は細胞核(破線で示される)に移行し始め、5〜15分の間に蓄積を開始します。Scalebar = 10 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
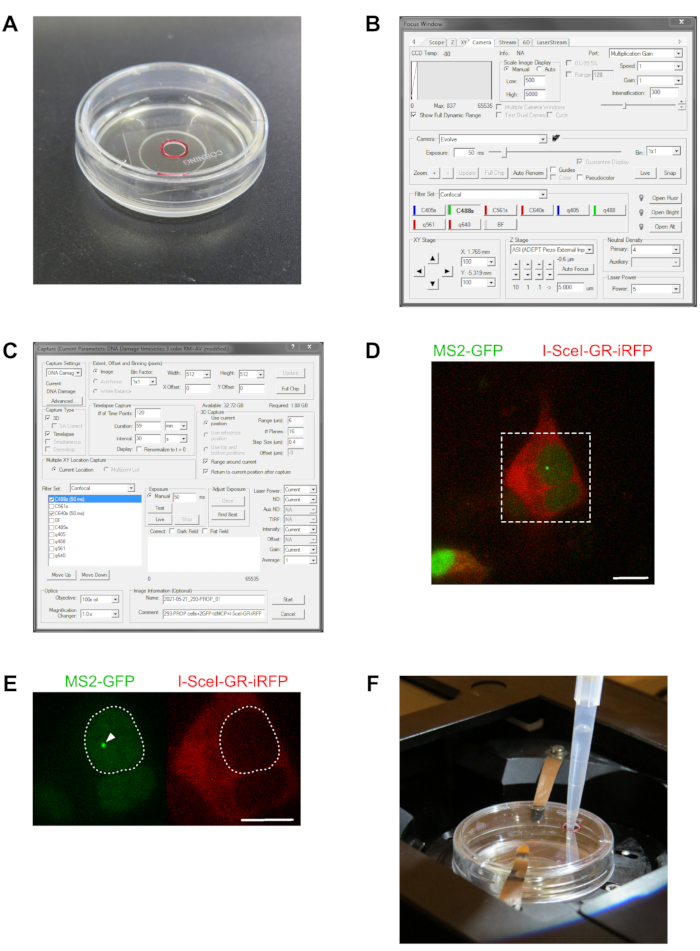
図2:転写部位の3Dタイムラプスイメージング用細胞を選択する。 (A)の写真は、生細胞イメージングに使用される35mmガラス底皿を示し、カスタム修正蓋を有し、直径3mmの穴を開けてTAを直接成長培地に希釈したTAを加えた。穴の位置は赤い円でマークされます。(B)のパネルは、顕微鏡制御ソフトウェアの「Focus」ウィンドウのスクリーンショットを示し、ライブビュー露出時間、フィルタ設定、レーザー強度、およびスケール画像表示を設定し、その後のタイムラプスイメージング(C)のセルをスクリーニングし、対応する「キャプチャ」ウィンドウのスクリーンショットをライブセルの3Dタイムラプス取得のすべての設定を調整します。セクション 3 では、フィルター、キャプチャ タイプ、タイムラプス キャプチャ、および 3D キャプチャ の各ペインの設定について説明します。ここに示すビューでは、設定は、レポーター遺伝子のプロモーター近位領域におけるDNA二重鎖破断の誘導時に転写をイメージングするためのMS2-GFPおよびI-SceI-GR-iRFP構築物にトランスフェクトされたPROMレポーター遺伝子線の3Dタイムラプスを取得するように調整される。(D)の画像は、GFPおよびiRFPチャネルのためにマージされ、293-PROMレポーター遺伝子細胞株のいくつかの細胞を有する顕微鏡システムを通して見た視野を示す。細胞を、核局在配列に融合したタンデムダイマーMS2コートタンパク質構築物、2つの緑色蛍光タンパク質(GFP-MS2CP)、および I-SceI-GR-iRFP構築物と共にトランスフェクトした。いくつかの細胞は、GFP-MS2CP構築物の発現を示し、それによって細胞質を強調する核および I-SceI-GR-iRFP構築物を強調する。破線の四角形は、(E)に示す拡大領域を示します。3Dタイムラプスイメージングでは、拡大領域(D)の大きな核を持つ細胞など、議論で与えられた要件に従って細胞が選択されます。この細胞は、両方の蛍光構造にトランスフェクトされ、デノボ転写レポーター遺伝子プレmRNA(左画像)にGFP-MS2CPを蓄積することによって、明らかに標識された転写部位(矢印頭)を示す。細胞の増殖培地はTAを含んでいません;したがって、 I-SceI-GR-iRFP構築物は、細胞質(右画像)のみである。(F)では、ガラス底皿を顕微鏡ステージインキュベーションチャンバーに取り付け、3Dタイムラプスイメージング実験を行い、TAローディングホールを含むカスタム蓋を装備した。200 μL マイクロピペットチップを慎重に穴に挿入し、希釈した TA を細胞の成長培地に適用します。Scalebar = 10 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
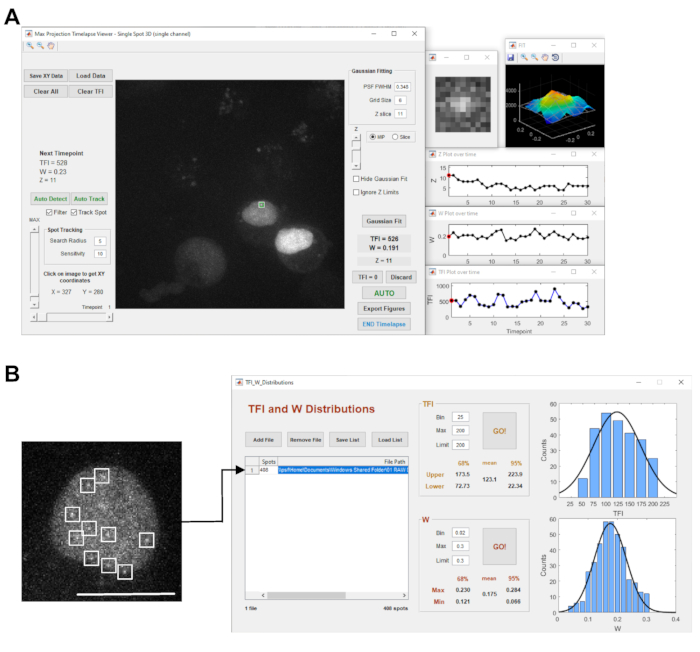
図3:画像取得および解析ソフトウェア (A) のパネルには、STaQTool: スポット追跡と定量化ツールのスクリーンショットが表示されます。画像は、中央の最大強度投影表示に緑色の円/白い正方形でマークされた標識転写部位を有するPROMレポーター遺伝子細胞株の時系列の例を示す。右側のウィンドウには、選択した転写サイトスポットの拡大図、現在のタイムポイントの2Dガウスフィットグリッドを備えた対応する3Dシェーディング強度サーフェスプロット、Zスタック内の転写サイトスポットZ位置のプロット、ガウスフィット幅(W)、および時間の経過に伴うTFI測定が表示されます。(B)の顕微鏡画像は、MS2-GFPにトランスフェクトされたPROMレポーター遺伝子細胞株の核のズームされた単一光学面を示す。この画像は、120 のタイムポイントを持つ 2D キャリブレーション時系列のワンタイムポイントを表します。核は、核内の回折限定の物体として現れるいくつかの蛍光標識された転写物(白い正方形で示される)を示す。右側のパネルには、2D タイムラプス集録で複数のスポットを分析する STaQTool の TFI および W ディストリビューション ツールのスクリーンショットが表示されます。この分析例では、このツールは、核細胞内に拡散するMS2-GFPで標識されたレポーター遺伝子転写産物を表す408回折限定スポットを検出した。右側のグラフには、オブジェクトの TFI およびガウスフィット幅分布ヒストグラムとガウスフィット曲線が表示されます。ガウスフィット曲線の中心ピークの位置から得られた TFI および W の平均値と計算された信頼区間が、それぞれのペインに表示されます。Scalebar = 10 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
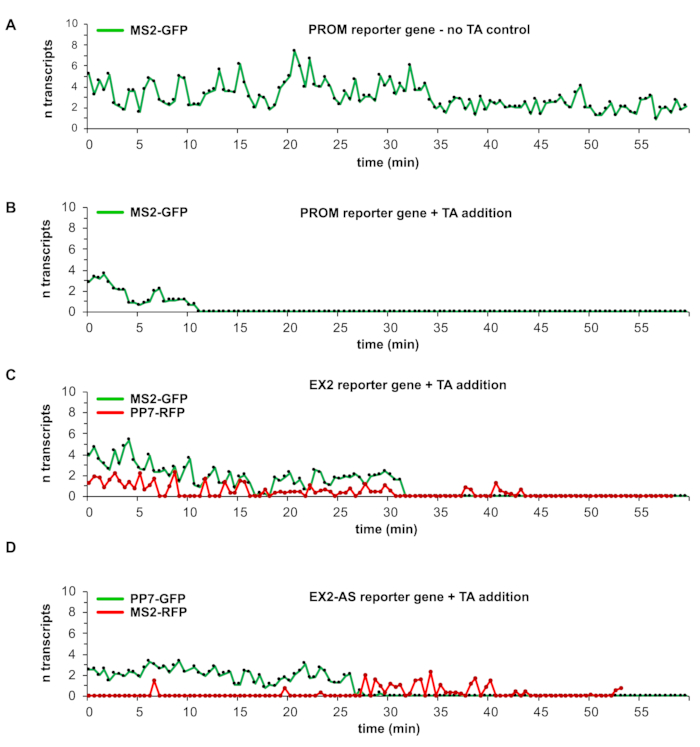
図4:DNA二本鎖破断部位における転写検出の代表的な結果。 (A)~(D)のグラフは、時間の経過に関する1つの転写部位の較正されたTFI曲線を表す。TFI値は、それぞれの実験で使用されるそれぞれのレポーター遺伝子構築物および蛍光タグ付きRNAステムループ結合タンパク質MS2またはPP7の較正実験で測定された単一の転写物の平均TFIを使用して転写物に変換される。(A)では、TA添加を伴わないPROMレポーター遺伝子を用いた対照実験からのグラフが示されている。MS2-GFPで標識された転写物は、観察期間全体にわたって連続的な転写活性を示す。(B)のグラフは、DSBのTA添加および誘導時のPROMレポーター遺伝子を表し、残りの観察時間の転写の抑制につながる。EX2レポーター遺伝子グラフ(C)は、TA添加時の正規プロモーター駆動転写の転写抑制を示す。後で同じタイムラプスで、PP7-RFP標識転写活性のみが出現する。(D)におけるグラフでは、EX2-ASレポーター遺伝子は、意味のある方向に正規プロモーターから転写が同様に、(C)のEX2レポーター遺伝子にTA付加した際に抑制される。しかし、逆挿入されたMS2ステムループ配列に由来するMS2-RFP標識転写物の出現は、TA付加前のセンス転写活性の間に存在しないアンチセンス転写を示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| レポーターセルライン | EX2 および EX2-AS | プロム |
| プラスミドからトランスフェクトへ | 1.5 μg pI-SceI-GR-iRFP | 1.5 μg pI-SceI-GR-iRFP |
| 0.65 μg pUBC-mCherry-nls-tdPP7-mCherry | 0.5 μg pUBC-GFP-nls-tdMS2-GFP | |
| 0.35 μg pUBC-GFP-nls-tdMS2-GFP |
表1:レポーター遺伝子細胞株のトランスフェクション。 表は、異なるレポーター遺伝子細胞株を一過性にトランスフェクトするために使用される異なるプラスミドのトランスフェクションスキームおよび量を説明する。
ディスカッション
複製、転写、DNA損傷、DNA修復などの重要な生物学的プロセス間の競合は、ゲノム不安定性の重要な原因として同定されている22.これらの研究はまた、DNA損傷部位における転写の発見につながり、DNA損傷修復プロセスを調節する際の破断誘発転写産物に機能的役割を有する23を有する。ここで説明する新しいツールとプロトコルにより、DSB における RNA Pol II 転写ダイナミクスのさらなる調査が可能になります。このプロトコルの重要なポイントは、ゲノムに統合されたレポーター遺伝子の単一のコピーを含む細胞株の生成である。この重要な特徴は単一のゲノムの軌跡の多数の写しと統合される複数のレポーター遺伝子の転写によって作成される騒音を除去し、転写力学および個々のRNA転写物の運動学的パラメータの収集を可能にする。単一レポーター遺伝子の組み込み転写を観察するための重要な技術的要件は、生細胞4,12のMS2またはPP7系で標識された単一のRNA転写物の検出を可能にする顕微鏡システムの利用可能性です。ここでは、反転顕微鏡に搭載された共焦点回転ディスクシステム上で生細胞顕微鏡を行い、他の場所で説明されているように音響光学調整可能なフィルタに結合された100mWの固体レーザーを搭載した。さらに、レポーターを用いて単一のDSBで転写を研究するには、個々の細胞を注意深く監視して、数時間の画像化を必要とする最高の時間分解能を達成する必要があり、これを低スループットアッセイにする必要があります。それでも、ピエゾ駆動型顕微鏡ステージで制御される位置と並行して複数の細胞を観察します。数時間にわたる生きた細胞観察のための最適な環境条件を確保するために、サンプルステージを含む顕微鏡体は、プレキシガラス環境室の中に置かれる。さらに、閉じたステージインキュベーション室を顕微鏡ステージに取り付け、CO2と湿度供給コントローラに接続します。
プロトコルの最初の重要なステップは、イメージング用のセルを持つ対象領域の選択です。画像化のためにマークされた各XY位置は、図2D、Eに記載されているレポーター遺伝子およびトランスフェクションスキームに従った蛍光RNAステムループ結合タンパク質とのトランスフェクションを示す1つ以上の細胞を含まなければならない。さらに、細胞は明るい標識転写部位を示さなければならないI-SceI-GR-iRFP713コンストラクトと共にトランスフェクトされ、タンパク質は最初に細胞質に局在する必要があります(図2DおよびE)。
細胞は、バックグラウンド蛍光レベルで単一標識された転写物を検出するのに十分低い、蛍光タグ付きMS2および/またはPP7コートタンパク質の蛍光強度レベルを示すべきである。同時に、蛍光タグ付きMS2および/またはPP7コートタンパク質の堅牢な蛍光強度レベルは、発生するいくつかの漂白のためにあまりにも多くの蛍光を失うことなく、少なくとも60分以上のイメージングを可能にするために必要です。セクション3.7に記載されているように固定範囲の「スケール画像表示」は、それらの蛍光強度レベルに応じて細胞の標準化された選択を可能にするために使用される。
第2の重要なプロトコルステップは、ガラス底皿の蓋の小さな穴を通して、事前に決定されたXY位置の細胞にTAを追加することです。ガラス底皿の操作は、細胞のマークされたXY位置からのシフトを引き起こし、避けなければなりません。したがって、細胞増殖培地に希釈されたTAを添加しながらマイクロピペットを慎重に取り扱うことは、事前選択された細胞の観察を成功させるために不可欠であり、 図2Fに示すように。灌流システムなどの顕微鏡ステージに搭載された細胞に薬物を追加するための異なるシステムの適応には、チューブの入り口と出口の開口部を備えた別のステージインキュベーションチャンバーと、薬物を投与するためのポンプまたは注射システムが必要です。カバースリップのような底面を持つチャネルスライドのような他の方法は、チャネルへの投与薬物の拡散が遅くなり、薬物の添加と効果の間にさらなる遅延を引き起こす。最後に、チャネルスライド開口部への慎重なピペット化は、サンプル位置もシフトする可能性がある。したがって、ガラス底皿の蓋にカスタムドリル穴を持つ本システムは、容易に適応し、低コストで、異なる成長培地、医薬品、およびコンポーネントを投与するのに適しています。また、ステージインキュベーションチャンバー内の孔の小径と加湿雰囲気も、細胞培地から乾燥を防止します。
このプロトコルの第3の重要なステップは、DSBの誘導のために転写が停止したときの時間ポイントの手動検査を必要とするデータ分析です。転写終了の時点は、レポーター遺伝子転写の以前に明るい標識部位から最後の転写物を放出することによって示される。同様に、ブレイク誘発転写開始のイベントは、単一の蛍光標識mRNAの比較的低いシグナル対雑音比を持つ個々の転写事象を検出するために注意して検査されなければならない。
誘導されたDSBの修復のダイナミクスは、これらのレポーターを使用して生成されたデータの分析に複雑さの余分な層を追加し、DSBの誘導直後の最初の分にそれらを制限します。レポーター遺伝子のトランスジェニックな性質とMS2およびPP7ステムループアレイの繰り返し豊富な性質は、ユニークなクロマチンの風景を組み立て、推定安定した破断誘発転写プログラムの確立を妨げ得る。それにもかかわらず、電離照射またはUV照射と比較して、レポーター遺伝子におけるDSBの I-SceI 媒介誘導は、個々のDSBにおける転写を調査するためのはるかに堅牢なシステムである。
ヒトゲノム内に認識部位を追加または持たないI-CreI、I-PpoI、AsiSIなどの異なるエンドヌクレアーゼシステムを、現レポーター遺伝子システムと組み合わせることで、DSBの生成効率を高めることができます。しかし、彼らはまずレポーター遺伝子にエンドヌクレアーゼ認識部位を導入する必要があります。第二に、それらは、個々の細胞におけるDSBのタイミングおよび効率誘導に同様の変動性を有し得る。一方、エンドヌクレアーゼ認識部位のタンデムコピーを挿入すると、DSB誘導の効率が向上する可能性がある。さらに、異なる細胞株で提示されたレポーター遺伝子系をテストすることで、異なる細胞背景間のDSB部位での転写ダイナミクスの比較と、癌細胞、原発細胞、分化された非循環細胞などの異なるDNA損傷修復経路の可用性を可能にする。しかし、Flp/FRTシステムと互換性のあるレポーター遺伝子の構築は、現在、利用可能なFlp/FRT宿主細胞株への統合を制限している。
顕微鏡ベースのアプリケーションに加えて、現在のレポーター遺伝子は、クロマチン免疫沈降などの生化学的アッセイと組み合わせて、DNA修復因子または転写因子を単一のDSBに採用することを研究するか、またはヌクレオソーム占有率、ヒストン修飾、およびDSB部位の周りのクロマチン状態を評価する。さらに、異なるレポーターシステムとの組み合わせにより、DNA損傷とゲノム組織やDNA複製などのプロセス間の機能的なリンクの研究が可能になります。
開示事項
著者らは開示する利益相反を持っていません。
謝辞
RHシンガー、J.A.チャオ、T.ミステリ、M.カルモ・フォンセカのプラスミドと試薬の贈り物に感謝します。また、iMMバイオイメージング施設のスタッフであるA.テムド、A.ナシメント、J.リノの方にも、原稿を批判的に読んでもらっています。この作品は、PTDC/MED-OUT/32271/2017によって資金提供されました。 PTDC/BIA-MOL/30438/2017 およびPTDC/MED-OUT/4301/2020 から フンダソン・パラ・ア・シエンシア・エ・ア・テクノロジア (FCT) (FCT) ポルトガル および LISBOA-01-0145-FEDER-007391, フェデラーが資金を調達した ポルトガル2020-プログラムオペラシオナル地域デリスボア、およびFCT。EU Horizon 2020 リサーチ・イノベーション・プログラム (RiboMed 857119) からも資金が寄せられた。M.A.はFCT博士フェローシップ 2020.05899.BD の受領者です。
資料
| Name | Company | Catalog Number | Comments |
| 100 mW solid-state Lasers | Coherent Inc., Santa Clara, CA, USA | ||
| 3i Marianas SDC Confocal Spinning Disk system | Intelligent Imaging Innovations Inc. | ||
| Air-cooled EMCCD Camera Evolve 512 | Photometrics, Tucson, AZ USA | ||
| Axio Observer Z1 inverted microscope | Carl Zeiss MicroImaging, Germany | ||
| Blasticidin | InvivoGen | ant-bl-1 | |
| charcoal-stripped fetal bovine serum | Sigma-Aldrich | F6765-500 ML | |
| CO2 module S | PeCon GmbH, Erbach, Germany | ||
| CSU-X1 confocal spinning disk unit | Yokogawa Electric, Tokyo, Japan | ||
| DMEM | Gibco | 41966029 | |
| DMEM with Hepes no PhenolRed | Gibco | 21063-029 | |
| Doxicyclin | Sigma-Aldrich | D9891 | for induction of reporter gene expression; stock solution of 0.5 mg/ml was used at 1:1000 dillution in cell growth medium |
| FBS | Gibco | 10270106 | |
| Flp-In T-REx 293 cell line | Thermo Fischer Scientific Invitrogen | R75007 | |
| I-SceI-24x MS2 stem loop sequence | GeneArt, Thermo Fischer Scientific | custom synthesized DNA fragment containing a single I-SceI recognition sequence and 24 tandem MS2 stem loop sequences | |
| Heating Device Humidity 2000 | PeCon GmbH, Erbach, Germany | ||
| Hygromycin B | Roche | 10843555001 | |
| Immersion oil Immersol 518 F | Carl Zeiss MicroImaging Inc.) | 444960-0000-000 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| Lipofectamin 3000 helper reagent P3000 | Thermo Fisher Scientific | L3000001 | transfection helper reagent |
| Lipofectamine 3000 reagent | Thermo Fisher Scientific | L3000001 | lipid-based transfection reagent |
| MatTek 35 mm dish, Glass bottom No. 1.5 | MatTek Corporation, Ashland, MA, USA | P35G-1.5-10-C | |
| microscope incubation chamber | PeCon GmbH, Erbach, Germany | ||
| pcDNA5/FRT/TO | Thermo Fischer Scientific Invitrogen | V652020 | |
| pOG44 plasmid | Thermo Fischer Scientific Invitrogen | V600520 | |
| SlideBook 6.0 Software | Intelligent Imaging Innovations Inc. | ||
| stage incubation chamber PeCon P-Set 2000 | PeCon GmbH, Erbach, Germany | ||
| StaQtool Software | iMM-JLA Lisbon, Portugal | available at: https://imm.medicina.ulisboa.pt/facility/bioimaging/lib/exe/fetch.php?media=STaQTool_setup.zip | |
| triamcinolone acetonide (TA) | Sigma-Aldrich | T6501 | synthetic glucocorticoid; induces the glucocorticoid receptor to migrate from the cytoplasm to the nucleus |
| Trypsin/EDTA Solution (TE) | Thermo Fisher Scientific | R001100 |
参考文献
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461 (7267), 1071-1078 (2009).
- Capozzo, I., Iannelli, F., Francia, S., d'Adda di Fagagna, F. Express or repress? The transcriptional dilemma of damaged chromatin. FEBS Journal. 284 (14), 2133-2147 (2017).
- Michelini, F., et al. Damage-induced lncRNAs control the DNA damage response through interaction with DDRNAs at individual double-strand breaks. Nature Cell Biology. 19 (12), 1400-1411 (2017).
- Vítor, A. C., et al. Single-molecule imaging of transcription at damaged chromatin. Science Advances. 5 (1), (2019).
- Michalik, K. M., Böttcher, R., Förstemann, K. A. Small RNA response at DNA ends in Drosophila. Nucleic Acids Research. 40 (19), 9596-9603 (2012).
- Wei, W., et al. A role for small RNAs in DNA double-strand break repair. Cell. 149 (1), 101-112 (2012).
- Francia, S., et al. Site-specific DICER and DROSHA RNA products control the DNA-damage response. Nature. 488 (7410), 231-235 (2012).
- Vítor, A. C., Huertas, P., Legube, G., de Almeida, S. F. Studying DNA double-strand break repair: An ever-growing toolbox. Frontiers in Molecular Biosciences. 7, 24 (2020).
- Alt, F. W., et al. Synthesis of secreted and membrane-bound immunoglobulin mu heavy chains is directed by mRNAs that differ at their 3' ends. Cell. 20 (2), 293-301 (1980).
- Watakabe, A., Tanaka, K., Shimura, Y. The role of exon sequences in splice site selection. Genes & Development. 7 (3), 407-418 (1993).
- Guth, S., Martínez, C., Gaur, R. K., Valcárcel, J. Evidence for substrate-specific requirement of the splicing factor U2AF(35) and for its function after polypyrimidine tract recognition by U2AF(65). Molecular and Cellular Biology. 19 (12), 8263-8271 (1999).
- Martin, R. M., Rino, J., Carvalho, C., Kirchhausen, T., Carmo-Fonseca, M. Live-cell visualization of pre-mRNA splicing with single-molecule sensitivity. Cell Reports. 4 (6), 1144-1155 (2013).
- Peabody, D. S. The RNA binding site of bacteriophage MS2 coat protein. The EMBO Journal. 12 (2), 595-600 (1993).
- Lim, F., Peabody, D. S. RNA recognition site of PP7 coat protein. Nucleic Acids Research. 30 (19), 4138-4144 (2002).
- Chao, J. A., Patskovsky, Y., Almo, S. C., Singer, R. H. Structural basis for the coevolution of a viral RNA-protein complex. Nature Structural & Molecular Biology. 15 (1), 103-105 (2008).
- Bertrand, E., Chartrand, P., Schaefer, M., Shenoy, S. M., Singer, R. H., Long, R. M. Localization of ASH1 mRNA particles in living yeast. Molecular Cell. 2 (4), 437-445 (1998).
- Larson, D. R., Zenklusen, D., Wu, B., Chao, J. A., Singer, R. H. Real-time observation of transcription initiation and elongation on an endogenous yeast gene. Science. 332 (6028), 475-478 (2011).
- Soutoglou, E., et al. Positional stability of single double-strand breaks in mammalian cells. Nature Cell Biology. 9 (6), 675-682 (2007).
- Rouet, P., Smih, F., Jasin, M. Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease. Molecular and Cellular Biology. 14 (12), 8096 (1994).
- Roukos, V., Voss, T. C., Schmidt, C. K., Lee, S., Wangsa, D., Misteli, T. Spatial Dynamics of Chromosome Translocations in Living Cells. Science. 341 (6146), 660 (2013).
- Rino, J., de Jesus, A. C., Carmo-Fonseca, M. STaQTool: Spot tracking and quantification tool for monitoring splicing of single pre-mRNA molecules in living cells. Methods. 98, 143-149 (2016).
- Hamperl, S., Bocek, M. J., Saldivar, J. C., Swigut, T., Cimprich, K. A. Transcription-replication conflict orientation modulates R-Loop levels and activates distinct DNA damage responses. Cell. 170 (4), 774-786 (2017).
- D'Alessandro, G., d'Adda di Fagagna, F. Transcription and DNA Damage: Holding Hands or Crossing Swords. Journal of Molecular Biology. 429 (21), 3215-3229 (2017).
- Boulant, S., Kural, C., Zeeh, J. C., Ubelmann, F., Kirchhausen, T. Actin dynamics counteract membrane tension during clathrin-mediated endocytosis. Nature Cell Biology. 13 (9), 1124-1131 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved