Method Article
通过椎前途径直接吻合的小鼠模型用于跨神经转移手术
* 这些作者具有相同的贡献
摘要
我们模拟临床手术,建立小鼠双侧臂丛神经通过脊髓前途径直接吻合的方案,有助于研究中枢和周围神经系统损伤后交叉神经转移后康复的神经机制。
摘要
跨神经转移手术是修复臂丛神经撕脱性损伤患者受伤上肢的有效方法。最近,该手术创造性地应用于脑损伤的临床治疗,实现了瘫痪手臂的实质性康复。手术后的这种功能恢复表明,外周感觉运动干预诱导了深刻的神经可塑性,以补偿脑损伤后的功能丧失;然而,潜在的神经机制知之甚少。因此,需要紧急临床动物模型。在这里,我们模拟了临床手术,以建立通过小鼠脊髓前途径直接吻合双侧臂丛神经的方案。神经解剖学、电生理学和行为学实验有助于确定这些小鼠转移的神经成功地重新支配了受损的前肢,并有助于加速脑损伤后的运动恢复。因此,小鼠模型揭示了中枢和周围神经系统损伤后交叉神经转移后康复的神经机制。
引言
臂丛神经 (BP) 由五条具有不同脊柱节段 (C5-T1) 的神经组成,负责手臂、手和手指的感觉和运动。这五条血压神经从脊髓中退出后,它们合并形成三条神经干:上神经干(由 C5 和 C6 合并形成)、内侧神经干(来自 C7)和下神经干(C8 和 T1 的分支)。严重的损伤,特别是由于交通事故造成的伤害,往往会导致血压神经根撕脱,这种功能障碍对患者有毁灭性的影响1。作为一种强大的临床方法,已经进行了交叉神经转移手术,通过将受伤的神经末梢重新连接到血压的健康侧来修复血压的撕脱损伤 2,3。该手术可改善患者受伤手的功能,并直接重组患者双半球的感觉运动皮层4。动物研究表明,在交叉神经转移后诱导了皮质回路的剧烈重组5.由于周围感觉运动修饰可以重新激活成熟大脑的休眠可塑性,因此交叉神经转移手术在修复脑损伤方面也显示出巨大的潜力6。
最近,我们证实了创造性地使用交叉神经转移作为中枢神经系统问题的新周围神经改变策略的可能性。通过将 C7 神经从非瘫痪侧转移到瘫痪侧,应用一种交叉神经转移手术,即对侧颈椎第七神经转移术 (CC7),使瘫痪手臂显着恢复7。这种外科手术的一个独特之处在于,瘫痪的上肢的感觉和运动信号通过"左右交叉"移位神经传达到对侧半球。值得注意的是,CC7 手术引起的功能恢复不仅限于 C7 神经本身支配的功能8。此外,CC7手术不仅可用于治疗儿童脑瘫,还可用于中老年脑卒中患者的康复。因此,有充分的理由相信,交叉神经转移可以通过调节周围感觉运动系统来刺激神经可塑性,从而加速脑损伤中的运动恢复。
尽管跨神经移植手术在臂丛神经损伤 (BPI) 和脑损伤的临床治疗中取得了实质性的康复,但对这种手术背后的神经机制仍然知之甚少。缺乏具有临床特征的合适动物模型限制了对内部机制的研究。传统上,在临床上,病变对侧的 C7 神经根通过神经移植物(例如尺神经、腓肠神经或隐神经)转移到受伤侧,并与受累的臂丛神经(例如正中神经、C7 根或下躯干)连接2,3,9。该手术的一个相对较新的修改涉及将未受影响的 C7 根通过脊髓前途径直接转移到受影响的 C7 神经,没有任何间隙,这表明了最佳解决方案7。目前,小鼠在细胞类型特异性和遗传菌株多样性方面表现出优势,更适合研究神经生理机制。因此,模拟临床手术以建立小鼠通过脊髓前途径直接吻合双侧 C7 神经根的方案,并有助于研究交叉神经转移后康复的神经机制。
研究方案
所有动物实验均经复旦大学实验动物机构关爱委员会和中国科学院根据美国国立卫生研究院指南批准。使用8周龄的成年雄性C57BL / 6N小鼠。
1. 术前设置
- 确保有适当的高压灭菌手术器械、设备、镇痛药物和麻醉药物库存。
- 确保手术台上有足够的工作空间。
- 使用尿布覆盖的定制手术泡沫板准备手术台作为小鼠的床。用覆盖有无菌纱布的医用胶带将加热垫固定在泡沫板上。
- 通过使用血管镊弯曲针灸针,将其对折,然后将折叠的针灸针的尖端弯曲成钩子来创建牵开器。在针灸针的末端固定一条橡胶条,然后用图钉将橡胶条的末端固定在泡沫板上。
- 校准体视显微镜;选择具有足够焦距的体视显微镜。用消毒的铝箔盖住变焦/对焦按钮,以便外科医生在手术过程中调整它们。将灭菌的铝箔放在变焦/对焦按钮上,允许外科医生戴着无菌手套使用它。
2.小鼠麻醉和准备
- 称量小鼠并麻醉相对应的体重(异氟烷3%)。确保鼠标在捏住爪子的趾间空间时没有反应,以确认麻醉深度。在整个手术过程中应保持足够的麻醉深度(1% 异氟烷)。
- 双侧将眼药膏涂抹在眼睛上,以防止手术过程中角膜刺激或干燥。
- 用自动理发器剃掉颈部和胸部的皮毛,准备手术部位。去除并清洁松散的头发。
- 将鼠标仰卧在覆盖有无菌纱布的加热垫上。在整个操作过程中将鼠标的温度保持在37°C。用医用胶带固定鼠标,使前肢水平外展,防止后肢和尾巴移动。将具有适当开口的消毒一次性手术布放在小鼠身上。
3. 手术程序
- 注射曲马多作为先发制人的镇痛药(20mg/kg,腹腔注射)。在锁骨上缘标记横切口。使用碘伏消毒液和乙醇交替擦洗三个周期对手术部位进行消毒。手术前用脚趾捏确认麻醉深度。
- 在显微镜下工作,使用无菌手术刀沿标记做一个 4 毫米的横向切口。必要时在手术过程中扩大切口。
- 钝性地解剖皮下筋膜,识别下颌下腺的下缘。向上拉下颌下腺,露出锁骨上窝和胸骨。
注意:该区域可能有小口径血管。电烙术可用于止血。 - 通过沿中线从头到尾切开胸骨进行部分正中胸骨切开术切口 (~4 mm)。在胸骨切开术期间保护胸膜、心脏和血管。
- 识别胸骨舌骨肌。用两个由针灸针制成的小型定制牵开器轻轻拉动胸骨,并识别气管和食道上方的胸骨舌骨肌。缩回这块肌肉,露出颈动脉、颈内静脉、膈神经、迷走神经、气管和食管。
注意: 轻轻缩回胸骨以避免开放性气胸。与人类不同,小鼠的食道不在气管后面,而是在左侧的气管附近。 - 识别左臂丛神经。在左颈内静脉的外侧边缘,向外拉筋膜和脂肪组织,露出臂丛神经。寻找由 C5 和 C6 神经组成的上躯干,它有三个分支。识别由 C7 神经组成的中躯干和由 C8 和 T1 神经组成的下躯干,沿着上躯干一直到小鼠的尾巴。
注意:臂丛神经表面有纵向血管。使用电烙术防止出血。分离左臂丛神经时,保护乳糜管以避免乳糜瘘。 - 收获左 C7 神经。解剖锁骨下方远端至分部至脊髓水平的中干(C7 神经)的前支和后支,并通过局部输注到 0.1 mL 2% 利多卡因到神经干中阻断 C7 神经。用 vannas 弹簧剪刀在其与外侧脊髓和后脊髓的合并点切除 C7 神经。修剪 C7 神经,使每个分区的长度相似。
注意:C7神经的前支和后支以及上下躯干的前支和后支在汇合前延伸很长的距离,因此C7神经在切除前应充分释放。事实上,C7神经并不总是分为两个部分;有时,它分为三个部分,在极少数情况下甚至分为四个部分。 - 移除左侧 C6 腹板。小心保护膈神经,并在C6节段水平上严重施展前斜角肌,以暴露C7神经根。用微镊子切割支配脊柱旁肌肉的C7神经的小分支。轻轻拉出 C7 神经并小心切除 C6 腹板。
注意:左颈动脉内侧和食道外侧之间有一个骨性突起。这个骨突起是第 6颈椎的腹板。C6腹板外侧缘的纵肌为前斜角肌,膈神经在前斜角肌表面运行。 - 收获正确的 C7 神经。右侧前斜角肌加重,与左侧相似,横断右侧 C7 神经根靠近椎间孔。从其分裂水平解剖右侧 C7 神经。
注意: 小心切开右侧 C7 神经,以防止神经下方血管受损。 - 转移左 C7 神经。
- 在椎体两侧部分移除肌肉发达的长丘。直截了当地分离和扩大气管 - 食管和椎体之间的空间。
- 通过脊柱前途径从椎体右侧向左侧发送半折 5-0 尼龙缝合线。
- 用输液管连接左侧 C7 神经,并通过脊髓前途径将神经引导至右侧。
- 轻轻缩回气管和食管,并使用 12-0 尼龙缝合线将左 C7 神经的前支和后支与右 C7 神经根无张力。用 4-5 针缝合神经周围的神经外膜,以牢固地粘合神经。
注意: 选择适当厚度的塑料输液管至关重要。管子太细会损伤神经,管子太厚会损伤气管和食道。此外,气管-食管与椎体之间的空间为"V"形空间,切开部分肌肉长丘可缩短转移通路。
4. 伤口闭合
- 用无菌生理盐水冲洗伤口,并用无菌纱布擦干。
- 缝合胸骨并使用 5-0 单丝缝合线闭合皮肤。
5. 术后护理
- 等待鼠标从麻醉中醒来。将老鼠转移到干净的笼子里,没有垫料,但用温暖的毯子加热。观察鼠标,直到它可以走动。使用曲马多(20mg/kg,ip)作为术后镇痛。
- 将小鼠放入恢复笼中并对其进行监测直至恢复。手术后恢复小鼠的水分和饮食。每天在术后监测小鼠是否有损伤或感染的迹象,包括营养不良、驼背姿势和褶皱的皮毛。手术后两周,应拆除缝合线。
注意:连续三天每天将红霉素软膏涂抹在伤口表面。 - 如果观察到任何并发症,例如伤口水肿,应立即解决。
6. 行为分析
注意:所有行为测试和分析都是由对实验组不知情的观察者完成的。
- 气缸测试
注意:圆柱体测试评估手术后 4 周和 8 周在圆柱体内自发垂直探索期间前肢的使用21.- 将小鼠放在一个透明的圆柱体(直径9厘米,高15厘米)中。
- 为便于观察和记录,请将镜子固定在圆柱体下方 45° 角。
- 记录在镜子的帮助下观察到的每只小鼠的自发饲养10分钟。
- 手动确定 (i) 右爪、(ii) 左爪或 (iii) 双爪与玻璃壁接触的时间长度。在每个会话中总共计算 20 个动作。从分析中排除在测试期间不活跃的小鼠。
- 将测试性能评分为:
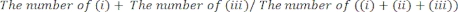
- 网格行走试验
注意:网格行走测试评估手术后 4 周和 8 周自发探索期间前爪在网格梯级上的准确位置。22.- 将小鼠放在带有25毫米方孔的金属丝网格(20厘米×24厘米)上,并让它们自由探索10分钟,同时用摄像机记录它们的表现。
- 在出现以下任一情况时,应判定脚滑:
- 寻找爪子完全错过梯级的情况(在这种情况下,肢体落在梯级之间并且动物失去平衡)。
- 寻找爪子正确放置在横档上但在承受体重时滑落的情况。
- 将测试结果表示为右前肢足滑/全足滑。虽然圆柱体测试和网格行走测试都不需要训练,但通过在手术前对每只动物进行一次测试来获得基线分数。
结果
由于成人代偿性神经可塑性的局限性,单侧脑损伤通常会导致对侧肢体的永久性功能障碍10,11。此前,我们报道了 CC7 手术可用于治疗脑损伤后成年患者偏瘫的上肢7.为了评估通过脊髓前途径直接吻合双侧 C7 神经的方案的有效性,我们在单侧创伤性脑损伤 (TBI) 后的小鼠中进行了交叉神经转移手术。 图 1 描述了 TBI 程序并验证了损坏范围和效果。首先,使用电皮质挫伤撞击器(eCCI)损伤成年小鼠左半球的大脑皮层(前后= + 1.0 mm至-2.0 mm,内侧= 0.5 mm至3.5 mm)导致单侧脑损伤。2周后,解剖结构证实,这种TBI协议几乎破坏了感觉运动皮层,这是启动运动的重要位置。这些患有单侧TBI的小鼠表现出明显的右前肢运动缺陷。
图 2 描述了 CC7 过程。CC7 手术的路径图显示,与其他路径相比,代表脊髓前路径的路径 A 是最短的路径。路径 A 的长度甚至低于左侧(非瘫痪侧)收获的 C7 神经的长度。这一发现为选择完成神经移植手术的脊髓前途径提供了解剖学基础。CC7 手术在 TBI 后两周通过脊柱前途径直接吻合进行。非瘫痪侧的颈椎7(C7)神经直接转移到瘫痪侧,而不是进行其原始的大脑连接。 图 3 显示了电子显微镜的结果,显示转移的 C7 神经已成功再生。从CC7术后4周开始,转移的C7神经髓鞘厚度逐渐增加,在CC7术后8周几乎与对照组相当。 图 4 使用肌电图记录识别转移的 C7 神经的肌肉再支配。术后 4 周,电刺激 C7 神经吻合术近端稳定诱导受影响前肢多块肌肉的动作电位,与电子显微镜结果一致。 图 5 显示,通过霍乱毒素亚基 B (CTB) 逆行标记,转移的 C7 神经在健康侧含有来自腹角的运动纤维和来自脊髓 C7 节段背根神经节的感觉纤维。
图6 显示,小鼠模型在单侧TBI后也表现出显著的运动恢复,与临床研究结果一致。为验证CC7手术对TBI后损伤运动功能恢复的影响,建立了TBI+Sham组和对照+Sham组。TBI + Sham组和TBI + CC7组的小鼠同时接受相同的TBI损伤手术,而对照+Sham组的小鼠仅接受假手术。TBI+CC7组小鼠接受神经移植手术,TBI+假手术组和对照+假手术组小鼠接受双侧颈椎7(C7)神经切除术。在圆柱体测试中,在 CC7 手术后 4 周和 8 周,TBI + CC7 组对受损前肢的使用率明显高于 TBI 组 (p < 0.01)。在网格行走测试中,TBI + CC7 组在 CC7 手术后 4 周表现出比 TBI 组更低的错误率。此外,在CC7手术后8周,TBI+CC7组的错误率显著低于TBI组(p < 0.05)。这些行为结果表明,CC7手术可以改善TBI小鼠患肢的运动功能。总之,这些结果表明,通过 CC7 手术通过脊柱前途径重建的转移的 C7 神经成功再生并重新支配受损的前肢,有助于单侧 TBI 成年小鼠的运动恢复。
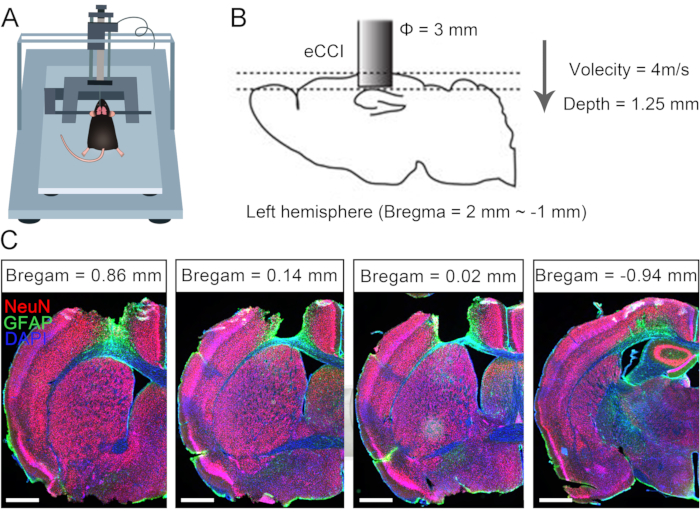
图1:单侧创伤性脑损伤的特征。 (A) 显示鼠标在 eCCI 中位置的示意图。(B) eCCI的参数和损坏范围。(C) 显示病变皮质的代表性冠状切片(TBI 后 2 周,比例尺 = 500 μm)。缩写:eCCI = 电皮质挫伤撞击器。 请点击这里查看此图的较大版本.
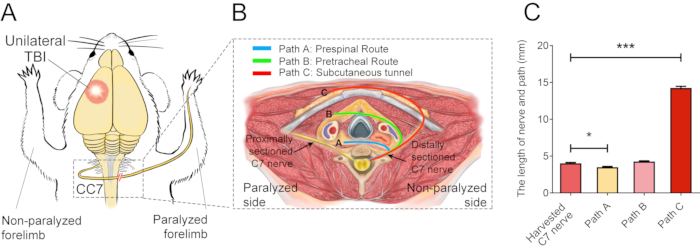
图 2:手术基本图。 (A)显示了在TBI小鼠中进行对侧C7神经转移的实验设计示意图。红色圆圈表示创伤的位置。虚线矩形内的红色双斜杠表示缝合的神经。(B)横截面显示了小鼠对侧C7神经转移的三种替代途径。路径 A,蓝线描绘了转移神经的脊髓前路线;路径 B,绿线,描绘了转移神经的气管前路径;路径 C,红线,描绘了转移神经的皮下隧道。(C) 该图显示了 (B) 中路线的长度和收获的 C7 神经。路径A的长度(3.3±0.10 mm)显著低于收获的C7神经的长度(4.05±0.11 mm;* p < 0.05,单因素方差分析,每组n = 20)。路径C的长度(14.15±0.20 mm)显著大于收获的C7神经(***p < 0.001,单因素方差分析,每组n = 20)。路径B的长度为4.2±0.08 mm(n=20)。 请点击这里查看此图的较大版本.
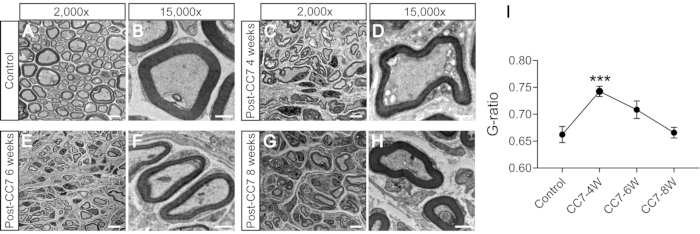
图3:神经横截面的电子显微镜分析。 (A,B) 对照小鼠的神经图像。比例尺 = 5 μm (A) 和 1 μm (B)。(C,D)手术后一个月再生神经的图像。比例尺 = 5 μm (C) 和 1 μm (D)。(英、女)手术后五个月再生神经的图像。比例尺 = 5 μm (E) 和 1 μm (F)。(G、H)手术后两个月再生神经的图像。比例尺 = 5 μm (G) 和 1 μm (H)。A、C、E和G的放大倍率为2,000倍;B、D、F 和 H 的放大倍率为 15,000 倍。(I)对照组样本的G比值(髓鞘内径与外径之比)低于4周样本,等于术后6-8周样本(***:p < 0.001;不同组轴突与t检验的比较;每组n = 3只小鼠)。缩写:CC7=对侧颈椎第七神经转移;CC7-XW = 术后 X 周。请点击这里查看此图的较大版本.
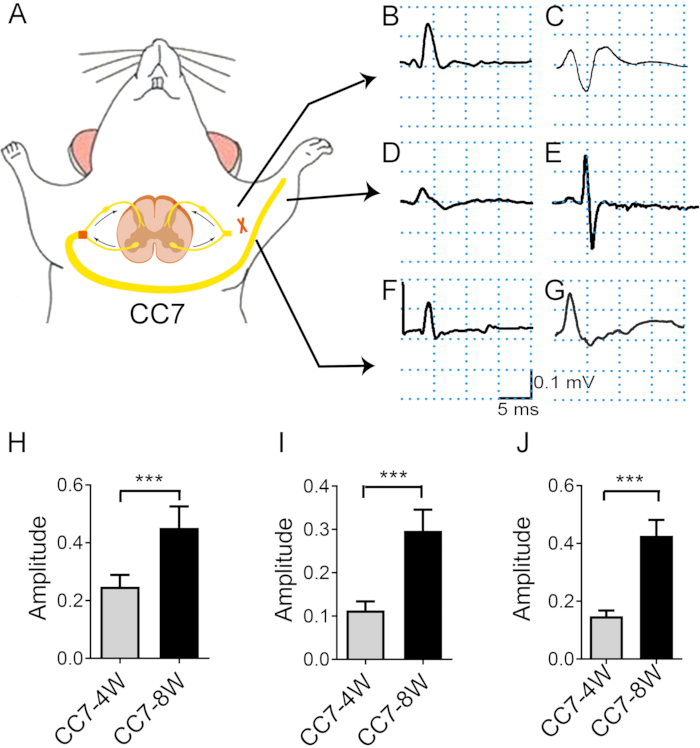
图 4:对侧 C7 神经转移后的肌电图分析表明神经再生的速率。 (A)显示电子转移刺激和体内肌电图记录的示意图。整个测试过程中的刺激强度相同(2 mA)。刺激部位是吻合口近端的 C7 神经。(乙、丙)显示手术后两周 (B) 和四周 (C) 在胸大肌处记录的动作电位的照片。(D、E)术后 4 周 (D) 和 8 周 (E) 记录手指伸肌肌电图。(F) 三周时,肱三头肌出现 CMAP。(G)在4周和8周时,肱三头肌的CMAP增加。(H) 胸大肌的平均振幅在 4 周时达到 ~0.25 mV ± 0.16 mV,而 8 周时为 0.45 mV ± 0.03 mV,两个时间点之间存在显着差异(*** p < 0.001,t 检验,每组 n = 6)。 (I) 肱三头肌的平均振幅在 4 周时达到 ~0.15 mV ± 0.01 mV,而 8 周时为 0.46 mV ± 0.02 mV,两个时间点之间存在显着差异(***:p < 0.001,t 检验,每组 n = 6)。 (J) 趾伸肌的平均振幅在 4 周时达到 ~0.11 mV ± 0.01 mV,而 8 周时为 0.29 mV ± 0.02 mV,两个时间点之间存在显着差异(***:p < 0.001,t 检验,每组 n = 6)。 缩写:EMG = 肌电图;CMAP = 复合肌肉动作电位。请点击这里查看此图的较大版本.
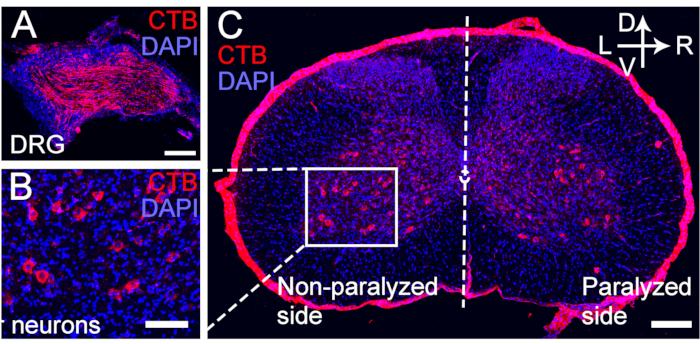
图 5:转移的 C7 神经的运动和感觉神经元的 CTB 逆行标记。 (A-C) CC7 手术后 4 周在 C7 神经吻合的远端注射 CTB。(一)感觉神经元被标记为 DRG。(乙、丙)转移的 C7 神经的运动神经元被标记为脊髓前角。放大倍率,20 倍。比例尺 = 200 μm (A, B);100μm(C)。缩写:CTB = 霍乱毒素亚基 B;DRG = 背根神经节;DAPI = 4′,6-二脒基-2-苯基吲哚。请点击这里查看此图的较大版本.
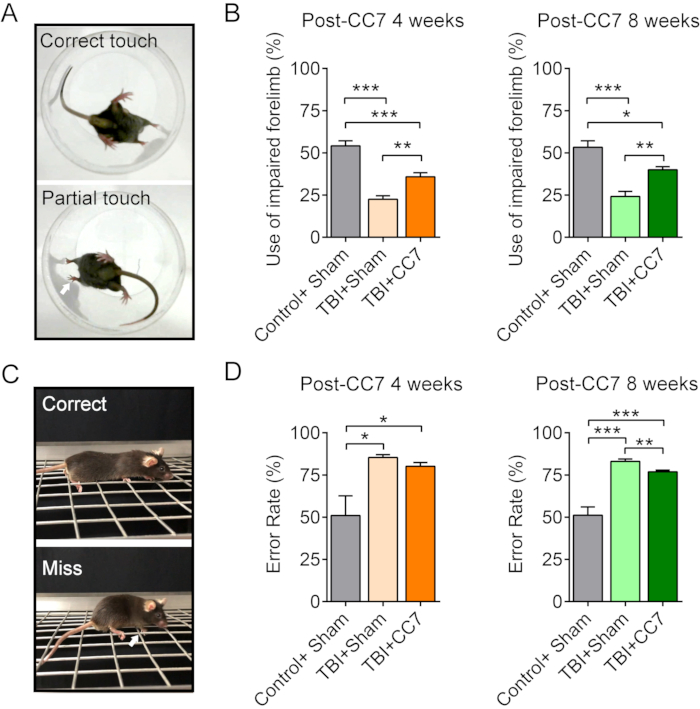
图 6:CC7 手术后的行为变化。 (A)图像显示了小鼠的圆柱体测试。(B)显示手术后4周和8周CC7转移对TBI小鼠(n = 6只小鼠)的影响的汇总图。p = 0.001;未配对 T 检验。对照组+假肢受损组的平均使用率为54.17%±3.01%,TBI组±2.14%;在 CC7 手术后 4 周,TBI + CC7 组为 35.83% ± 2.39%,表明存在显着差异(单因素方差分析;p < 0.05,每组 n = 6)。CC7转移后8周,对照组+假组、TBI+假组、TBI+CC7组的使用率分别为53.33%、±3.80%、24.17%±3.01%和40.00%±1.83%,差异有统计学意义(*p <0.05,单因素方差分析,每组n=6)。(C) 图像显示网格行走测试。(D)图示TBI+Sham组前肢受损平均错误率为85.41%±1.59%(n=6),TBI+CC7组为80.17%±2.19%(n=6),均大于对照+假肢组(50.99%±11.69%)。术后8周,TBI+CC7组错误率为76.87±1.07%(n=6),显著低于TBI+Sham组(83.06%±1.41%;p<0.05,单因素方差分析,每组n=6)。缩写:CC7=对侧颈椎第七神经转移;TBI = 创伤性脑损伤。 请点击这里查看此图的较大版本.
讨论
在临床上,交叉神经转移手术已被用于治疗臂丛神经撕脱损伤和脑损伤后的患者,例如中风和 TBI 7,9,12。值得注意的是,脑损伤是一种严重的神经系统疾病,可导致多种并发症,包括癫痫、脑疝和感染13。并非所有单侧脑损伤患者都适合 CC7 手术。一般来说,CC7手术已在慢性期(受伤后6个月)对中心性偏瘫患者进行,以尽可能避免脑水肿的影响。脑损伤后认知障碍和四肢瘫痪的患者被排除在 CC7 手术的治疗之外。
大多数研究报道了使用皮下入路和腓肠或尺神经移植吻合术转移对侧 C7 神经根14,15。然而,通过这种方法进行神经再生需要六个月的时间,这会阻碍运动恢复过程,甚至可能影响大脑的可塑性14。在之前的研究中,对侧C7转移在大鼠中进行,双侧C7神经通过4股插位自体移植腓肠神经使用。然而,目前还没有关于小鼠通过脊柱前途径转移 C7 神经的报道。我们对小鼠进行了改良的脊髓前途径的 CC7 手术,并验证了 C7 神经转移后的功能恢复速度。在这项研究中,通过脊髓前途径进行的对侧 C7 神经转移改善了手术后一个月瘫痪的肢体功能,反映了神经移植动物模型的恢复时间更短。因此,该模型可以精确模拟临床情况,为进一步的实验奠定基础。
如何解剖神经根并降低风险是 C7 转移的基本问题。与人类不同,小鼠的臂丛神经位于锁骨下方的胸部 5,16。因此,必须改变通路策略,以便观察 C7 神经和脊柱的根部 17。胸骨切开术是一种安全有效的手术方法,通常应用于心胸外科的小鼠实验18,19。C6腹板也是神经转移的障碍。因此,进行胸骨切开术以解剖 C7 神经根并切断 C6 腹板以缩短转移距离。
虽然脊髓前途径可以显著提高神经转移手术直接吻合的成功率,但并非所有小鼠都能直接吻合。这主要是由于这些小鼠的解剖学差异。中干(C7神经)在非常靠近椎间孔的位置与上干或下干合并。因此,可用于收获的 C7 神经的长度不足。目前,唯一的方法是神经移植或更换小鼠。该模型通常用于8周龄的小鼠(20-25g),因为小鼠已经成熟并且C7神经的大小足以处理。虽然这种手术方案也适用于年轻小鼠,但手术难度在年轻小鼠中会显着增加。
TBI+CC7组小鼠前肢运动功能在1个月和2个月时显著增加,提示转移的C7神经有助于受损前肢的恢复。髓鞘再生对功能性神经恢复至关重要。先前的一项研究表明,受伤神经的髓鞘在一个月后再生,与这些结果一致20。在这里,转移的神经逐渐成熟,这与行为测试一致。肌电图用于进一步测试神经转移后的功能恢复率。结果表明,转移的神经在手术后 4 周支配了受影响的肌肉。值得注意的是,这项研究是第一个确定交叉神经移植手术后直接吻合术神经再支配的时间点的研究。
综上所述,我们模拟了临床手术,建立了小鼠双侧臂丛神经通过脊髓前途径直接吻合的方案,并证实了移位神经的功能。小鼠模型有助于阐明中枢和周围神经系统损伤后交叉神经转移后康复的神经机制。
披露声明
作者没有利益冲突需要声明。
致谢
这项工作得到了中国国家自然科学基金(82071406、81902296和81873766)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
参考文献
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t., Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784 (2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676 (2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231 (2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562 (2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。