Method Article
Um Modelo de Anastomose Direta em Camundongos por Via Pré-Espinhal para Cirurgia de Transferência de Nervo Cruzado
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Simulamos a cirurgia clínica para estabelecer um protocolo de anastomose direta dos nervos do plexo braquial bilateral por via pré-espinhal em camundongos, contribuindo para o estudo dos mecanismos neurais subjacentes à reabilitação ao cruzar a transferência nervosa após lesões do sistema nervoso central e periférico.
Resumo
A cirurgia de transferência de cruzamento de nervos tem sido uma abordagem poderosa para reparar membros superiores lesados em pacientes com lesões por avulsão do plexo braquial. Recentemente, esta cirurgia foi criativamente aplicada no tratamento clínico da lesão cerebral e conseguiu substancial reabilitação do braço paralisado. Essa recuperação funcional após a cirurgia sugere que a intervenção sensório-motora periférica induz neuroplasticidade profunda para compensar a perda de função após lesão cerebral; no entanto, o mecanismo neural subjacente é pouco compreendido. Portanto, um modelo clínico animal emergente é necessário. Aqui, simulamos a cirurgia clínica para estabelecer um protocolo de anastomose direta dos nervos do plexo braquial bilateral pela via pré-espinhal em camundongos. Experimentos neuroanatômicos, eletrofisiológicos e comportamentais ajudaram a identificar que os nervos transferidos desses camundongos reinervaram com sucesso o membro anterior comprometido e contribuíram para acelerar a recuperação motora após lesão cerebral. Portanto, o modelo em camundongos revelou os mecanismos neurais subjacentes à reabilitação ao cruzar a transferência de nervos após lesões do sistema nervoso central e periférico.
Introdução
O plexo braquial (PB) é composto por cinco nervos com diferentes segmentos espinhais (C5-T1) responsáveis pela sensação e movimento no braço, mão e dedos. Após a saída desses cinco nervos do PB da medula espinhal, eles se fundem para formar três troncos nervosos: o superior (formado pela fusão de C5 e C6), medial (de C7) e inferior (ramos de C8 e T1). Lesões graves, principalmente decorrentes de acidentes de trânsito, muitas vezes levam à avulsão das raízes nervosas do PB, e tal disfunção tem efeito devastador nos pacientes1. Como uma poderosa abordagem clínica, a cirurgia de transferência cruzada de nervos tem sido realizada para reparar lesões avulsionais no PB, reconectando as extremidades nervosas lesadas ao lado saudável do PB 2,3. Essa cirurgia resulta em melhora funcional das mãos lesadas e reorganização direta do córtex sensório-motor em ambos os hemisférios nos pacientes4. Estudos em animais revelaram que uma drástica reorganização nos circuitos corticais foi induzida após a transferência nervosa cruzada5. Como a modificação sensório-motora periférica pode reativar a plasticidade dormente do cérebro maduro, a cirurgia de transferência de nervo cruzado também apresenta grande potencial na reparação de lesões cerebrais6.
Recentemente, confirmamos a possibilidade do uso criativo da transferência de nervos cruzados como uma nova estratégia de mudança de nervo periférico para problemas com o sistema nervoso central. Um tipo de cirurgia de transferência do nervo cruzado, a transferência do sétimo nervo cervical contralateral (CC7), foi aplicada para obter recuperação funcional significativa do braço paralisado por meio da transferência do nervo C7 do lado não paralisado para o lado paralisado no paciente após lesão cerebral7. Uma característica única desta operação cirúrgica é que os sinais sensoriais e motores da extremidade superior paralisada se comunicavam com o hemisfério contralesional através do nervo deslocado "cruzamento esquerda-direita". Notadamente, a recuperação funcional causada pela cirurgia de CC7 não se limita à função inervada pelo próprio nervo C78. Além disso, a cirurgia CC7 pode ser usada não apenas para tratar crianças com paralisia cerebral, mas também para alcançar a reabilitação em pacientes de AVC de meia-idade e idosos. Portanto, há razões suficientes para acreditar que a transferência nervosa cruzada pode estimular a neuroplasticidade para acelerar a recuperação motora de danos cerebrais por meio da modulação do sistema sensório-motor periférico.
Embora a cirurgia de transferência de cruzamento de nervo tenha alcançado reabilitação substancial no tratamento clínico das lesões do plexo braquial (BPI) e cerebrais, os mecanismos neurais subjacentes a essa cirurgia permanecem pouco compreendidos. A falta de um modelo animal adequado com características clínicas tem restringido o estudo de mecanismos internos. Tradicionalmente, na clínica, a raiz nervosa de C7 contralateral à lesão é transferida para o lado lesado através de um enxerto de nervo (por exemplo, nervo ulnar, nervo sural ou nervo safeno) e conectada com o plexo braquial afetado (por exemplo, nervo mediano, raiz de C7 ou tronco inferior)2,3,9. Uma modificação relativamente nova dessa cirurgia envolve a transferência direta da raiz C7 não afetada para o nervo C7 afetado pela via pré-espinhal, sem qualquer gap, sugerindo uma solução ótima7. Atualmente, camundongos exibem uma vantagem na especificidade do tipo celular e diversidade de linhagens genéticas e são mais adequados para estudar mecanismos neurofisiológicos. Assim, a cirurgia clínica foi simulada para estabelecer um protocolo de anastomose direta de raízes nervosas C7 bilaterais por via pré-espinhal em camundongos e contribuir para o estudo dos mecanismos neurais subjacentes à reabilitação ao cruzar a transferência nervosa.
Protocolo
Todos os experimentos com animais foram aprovados pelo Comitê de Cuidados Institucionais de Animais Experimentais da Universidade de Fudan e pela Academia Chinesa de Ciências, em conformidade com as diretrizes do Instituto Nacional de Saúde. Foram utilizados camundongos C57BL/6N, machos adultos com oito semanas de idade.
1. Configuração pré-operatória
- Garantir um estoque adequado de instrumentais cirúrgicos esterilizados autoclavados, equipamentos, medicamentos analgésicos e medicamentos anestésicos.
- Garantir espaço de trabalho adequado em uma mesa cirúrgica.
- Prepare a mesa cirúrgica usando uma placa de espuma cirúrgica personalizada coberta por fraldas como uma cama para o mouse. Fixe uma almofada de aquecimento na placa de espuma com fita adesiva coberta com gaze estéril.
- Crie afastadores dobrando uma agulha de acupuntura usando pinças vasculares, dobrando-a ao meio e, em seguida, dobrando a ponta da agulha de acupuntura dobrada em um gancho. Fixe uma tira de borracha na extremidade da agulha de acupuntura e use uma tacha para fixar a extremidade da tira de borracha na placa de espuma.
- Calibrar o estereomicroscópio; Escolha um estereomicroscópio com uma distância de foco adequada. Cubra os botões de zoom/foco com papel alumínio esterilizado para permitir que o cirurgião os ajuste durante a operação. A folha de alumínio esterilizada foi colocada nos botões de zoom/foco, permitindo ao cirurgião utilizá-la com luvas estéreis.
2. Anestesia e preparo de camundongos
- Pesar o camundongo e anestesiar correspondente ao peso corporal (isoflurano 3%). Certifique-se de que o mouse não responda quando os espaços interdigitais de sua pata são pinçados para confirmar a profundidade da anestesia. A profundidade adequada da anestesia deve ser mantida durante todo o procedimento (isoflurano a 1%).
- Aplique pomada oftálmica bilateralmente aos olhos para evitar irritação ou ressecamento da córnea durante a cirurgia.
- Prepare o local cirúrgico raspando o pelo no pescoço e tórax com um cortador automático. Retire e limpe os cabelos soltos.
- Coloque o rato em decúbito dorsal sobre a almofada de aquecimento coberta com gaze estéril. Mantenha a temperatura do rato a 37 °C durante toda a operação. Fixe o rato com fita adesiva para fazer com que os membros anteriores abdudam horizontalmente e impeça que os membros posteriores e a cauda se movam. Um pano cirúrgico descartável esterilizado com abertura apropriada foi colocado nos camundongos.
3. Procedimento operatório
- Injetar tramadol como analgesia preventiva (20 mg/kg, i.p.). Marque a incisão transversal na borda superior da clavícula. Utilizar três ciclos alternados de esfoliantes alternados de solução de desinfecção iodóforo e etanol para desinfetar o sítio cirúrgico. Confirme a profundidade da anestesia com uma pinça do dedo do pé antes da cirurgia.
- Trabalhando ao microscópio, faça uma incisão transversal de 4 mm ao longo da marca usando um bisturi estéril. Aumente a incisão durante o procedimento, conforme necessário.
- Dissecar a fáscia subcutânea e identificar a borda inferior da glândula submandibular. Puxar a glândula submandibular para cima para expor a fossa supraclavicular e o esterno.
NOTA: Pode haver vasos sanguíneos de pequeno calibre nesta área. O eletrocautério pode ser usado para parar o sangramento. - Faça uma incisão parcial da esternotomia mediana (~4 mm) incisando o esterno da cabeça à cauda ao longo da linha média. Proteger a pleura, o coração e os vasos sanguíneos durante a esternotomia.
- Identificar o músculo esterno-hioideo. Puxe o esterno suavemente com dois pequenos afastadores personalizados feitos de agulhas de acupuntura e identifique o músculo esterno-hioideo, sobre a traqueia e o esôfago. Retrair esse músculo para expor a artéria carótida, veia jugular interna, nervo frênico, nervo vago, traqueia e esôfago.
NOTA: Retraia suavemente o esterno para evitar pneumotórax aberto. Ao contrário dos seres humanos, o esôfago do camundongo não está atrás da traqueia, mas adjacente à traqueia do lado esquerdo. - Identificar o plexo braquial esquerdo. Na borda lateral da veia jugular interna esquerda, tracionar a fáscia e o tecido adiposo para fora para expor o plexo braquial. Procure o tronco superior, composto pelos nervos C5 e C6, que possui três ramos. Identificar o tronco médio composto pelo nervo C7 e o tronco inferior composto pelos nervos C8 e T1, ao longo do tronco superior até a cauda do camundongo.
NOTA: Existem vasos sanguíneos longitudinais na superfície do plexo braquial. Use eletrocautério para evitar sangramento. Ao separar o plexo braquial esquerdo, proteger o canal quiloso para evitar uma fístula quilosa. - Colher o nervo C7 esquerdo. Dissecar a divisão anterior e posterior do tronco médio (nervo C7) distalmente ao nível da divisão ao cordão sob a clavícula e bloquear o nervo C7 com 0,1 mL de lidocaína a 2% por infusão local no tronco nervoso. Ressecção do nervo C7 por tesoura de mola de vannas em seus pontos de fusão com o fascículo lateral e posterior do fascículo. Corte o nervo C7 para que o comprimento de cada divisão seja semelhante.
NOTA: As divisões anterior e posterior do nervo C7 e as divisões anterior e posterior dos troncos superior e inferior percorrem uma longa distância antes da confluência, de modo que o nervo C7 deve ser liberado suficientemente antes da ressecção. De fato, o nervo C7 nem sempre é dividido em duas divisões; Às vezes, é dividido em três divisões ou mesmo em quatro em casos raros. - Remova a lâmina ventricular esquerda de C6. Proteger cuidadosamente o nervo frênico e grave o músculo escaleno anterior ao nível do segmento C6 para expor a raiz nervosa de C7. Cortar pequenos ramos do nervo C7 inervando o músculo paraespinhal com micropinças. Puxe o nervo C7 suavemente e extire a lâmina C6 ventralis cuidadosamente.
NOTA: Há uma proeminência óssea entre a face medial da artéria carótida esquerda e a face lateral do esôfago. Esta proeminência óssea é a lâmina ventral da6ª vértebra cervical. O músculo longitudinal da borda lateral da lâmina ventral de C6 é o músculo escaleno anterior, e o nervo frênico corre na superfície do músculo escaleno anterior. - Colher o nervo C7 direito. Severo o músculo escaleno anterior do lado direito, semelhante ao esquerdo, e transecto a raiz nervosa direita de C7 próximo ao forame intervertebral. Dissecar o nervo C7 direito a partir de seu nível de divisão.
NOTA: Corte cuidadosamente o nervo C7 direito para evitar danos aos vasos sanguíneos sob o nervo. - Transferir o nervo C7 esquerdo.
- Remover o músculo longo colidir ao lado dos corpos vertebrais parcialmente em ambos os lados. Separar e expandir o espaço entre a traqueia-esôfago e o corpo vertebral.
- Enviar uma sutura de náilon 5-0 de meia dobra do lado direito do corpo vertebral para o lado esquerdo através da via pré-espinhal.
- Enrosque o nervo C7 esquerdo com um tubo de infusão e guie o nervo para o lado direito pela via pré-espinhal.
- Retrair a traqueia e o esôfago suavemente e encaixar as divisões anterior e posterior do nervo C7 esquerdo à raiz do nervo C7 direito sem tensão usando pontos de náilon 12-0. Sutura o epineuro ao redor dos nervos com 4-5 pontos para coaptar os nervos fortemente.
NOTA: É crucial escolher um tubo de infusão de plástico de espessura adequada. Muito fino de um tubo pode danificar o nervo, e muito grosso de um tubo pode danificar a traqueia e esôfago. Além disso, o espaço entre a traqueia-esôfago e o corpo vertebral é em forma de "V", e cortar parte do colo longo muscular pode encurtar a via de transferência.
4. Fechamento da ferida
- Irrigar a ferida com soro fisiológico estéril e secar com gaze estéril.
- Sutura do esterno e fechamento da pele com fio monofilamentar 5-0.
5. Cuidados pós-operatórios
- Espere o rato acordar da anestesia. Transfira o rato para uma gaiola limpa, sem material de cama, mas aquecida com uma manta de aquecimento. Observe o rato até que ele esteja deambulando. Utilizar tramadol (20mg/kg, i.p.) como analgesia pós-operatória.
- Coloque os ratos em uma gaiola de recuperação e monitore-os até a recuperação. Restaurar a água e dieta dos ratos após a operação. Monitore os camundongos no pós-operatório em busca de sinais de comprometimento ou infecção todos os dias, incluindo desnutrição, postura curvada e pelos babados. Duas semanas após a cirurgia, deve ocorrer a remoção da sutura.
NOTA: Aplique pomada de eritromicina na superfície da ferida todos os dias por três dias consecutivos. - Se alguma complicação, como edema da ferida for observada, isso deve ser resolvido imediatamente.
6. Análise comportamental
OBS: Todos os testes e análises comportamentais foram realizados por um observador cego para os grupos experimentais.
- Teste do cilindro
OBS: O teste do cilindro avalia o uso dos membros torácicos durante a exploração vertical espontânea dentro de um cilindro com 4 e 8 semanas depós-operatório21.- Coloque os ratos em um cilindro transparente (diâmetro 9 cm, altura 15 cm) em uma estrutura elevada.
- Para facilitar a observação e o registro, fixe um espelho em um ângulo de 45° abaixo do cilindro.
- Registrar a criação espontânea de cada camundongo observada com a ajuda do espelho por 10 min.
- Determine manualmente o período de tempo durante o qual a (i) pata direita, (ii) a pata esquerda ou (iii) ambas as patas entraram em contato com as paredes de vidro. Conte um total de 20 movimentos durante cada sessão. Exclua da análise os ratinhos que não estejam ativos durante o teste.
- Classifique o desempenho do teste como:
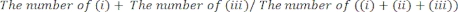
- Teste de caminhada em grade
NOTA: O teste grid-walk avalia o posicionamento preciso das patas dianteiras nos degraus de uma grade durante a exploração espontânea 4 e 8 semanas após a cirurgia. 22º.- Coloque os ratos em uma grade de arame (20 cm x 24 cm) com furos quadrados de 25 mm e deixe-os explorar livremente por 10 minutos enquanto gravam seu desempenho com uma câmera de vídeo.
- Marcar um deslize de pé no caso de qualquer um dos seguintes:
- Procure casos em que a pata erra completamente um degrau (caso em que o membro cai entre os degraus e o animal perde o equilíbrio).
- Procure casos em que a pata é colocada corretamente em um degrau, mas escorrega ao carregar o peso corporal.
- Expresse o resultado do teste como deslizamento do pé do membro anterior direito / deslizamento total do pé. Embora nem o teste do cilindro nem o teste da caminhada em grade exijam treinamento, obtenha os escores basais testando cada animal uma vez antes da cirurgia.
Resultados
A lesão cerebral unilateral frequentemente causa disfunção permanente do membro contralateral devido às limitações da plasticidade neural compensativa em adultos10,11. Anteriormente, relatamos que a cirurgia de CC7 poderia ser usada para tratar membros superiores hemiplégicos em pacientes adultos após lesão cerebral7. Para avaliar a eficácia do protocolo de anastomose direta bilateral dos nervos C7 por via pré-espinhal, realizamos a cirurgia de transferência de nervo cruzado em camundongos após traumatismo cranioencefálico (TCE) unilateral. A Figura 1 descreve os procedimentos de TCE e verifica a amplitude e o efeito do dano. Primeiro, um impactor de contusão cortical elétrica (eCCI) foi usado para danificar o córtex cerebral do hemisfério esquerdo (anteroposterior = +1,0 mm a -2,0 mm, mediolateral = 0,5 mm a 3,5 mm) em camundongos adultos para resultar em lesão cerebral unilateral. Após 2 semanas, estruturas anatômicas confirmaram que esse protocolo de TCE quase destruiu o córtex sensório-motor, um local importante para iniciar os movimentos. Esses camundongos com TCE unilateral exibiram defeitos motores significativos do membro torácico direito.
A Figura 2 descreve os procedimentos do CC7. O diagrama de trajeto da cirurgia CC7 revelou que o trajeto A, representando a via pré-espinhal, foi a abordagem mais curta em relação aos demais. O comprimento do trajeto A é ainda menor que o comprimento do nervo C7 retirado do lado esquerdo (lado não paralisado). Esse achado forneceu a base anatômica para a escolha da via pré-espinhal para a cirurgia completa de transferência nervosa. A cirurgia CC7 foi realizada em anastomose direta por via pré-espinhal duas semanas após o TCE. O nervo cervical 7 (C7) do lado não paralisado foi transferido diretamente para o lado paralisado em vez de fazer suas conexões cerebrais originais. A Figura 3 mostra os resultados da microscopia eletrônica que revelou que o nervo C7 transferido havia se regenerado com sucesso. A espessura da bainha de mielina do nervo C7 transferido aumentou gradualmente, começando em 4 semanas pós-cirurgia CC7, e foi quase comparável à do grupo controle em 8 semanas pós-cirurgia CC7. A Figura 4 identifica a reinervação muscular do nervo C7 transferido por meio de registros eletromiográficos. A estimulação elétrica da extremidade proximal da anastomose do nervo C7 induziu de forma estável potenciais de ação em múltiplos músculos do membro torácico afetado com 4 semanas de pós-operatório, de acordo com os resultados da microscopia eletrônica. A Figura 5 mostra que o nervo C7 transferido contém fibras motoras do corno ventral e fibras sensitivas dos gânglios da raiz dorsal do segmento C7 da medula espinhal no lado saudável através da marcação retrógrada da subunidade B da toxina da cólera (CTB).
A Figura 6 mostra que o modelo de camundongo também apresentou recuperação motora significativa após TCE unilateral, consistente com os resultados dos estudos clínicos. Para verificar o efeito da cirurgia CC7 na recuperação da função motora lesada após TCE, um grupo TCE + Sham e um grupo Controle + Sham foram estabelecidos. Os camundongos do grupo TCE + Sham e do grupo TCE + CC7 receberam os mesmos procedimentos para lesão por TCE simultaneamente, enquanto os camundongos do grupo Controle + Sham receberam apenas cirurgia simulada. Enquanto os camundongos do grupo TCE + CC7 receberam cirurgia de transferência nervosa, os camundongos do grupo TCE + simulação e do grupo Controle + Sham foram submetidos à ressecção bilateral do nervo cervical 7 (C7). Nos testes em cilindros, o grupo TCE + CC7 apresentou taxa de utilização do membro torácico comprometido significativamente maior do que o grupo TCE 4 e 8 semanas pós-CC7 (p < 0,01). Nos testes grid-walking, o grupo TCE + CC7 apresentou menor taxa de erro do que o grupo TCE 4 semanas pós-CC7. Além disso, a taxa de erro do grupo TCE + CC7 foi significativamente menor do que a do grupo TCE 8 semanas pós-CC7 (p < 0,05). Esses resultados comportamentais mostraram que a cirurgia CC7 pode melhorar a função motora do membro afetado em camundongos com TCE. Em conjunto, esses resultados sugerem que o nervo C7 transferido reconstruído pela cirurgia CC7 pela via pré-espinhal foi regenerado com sucesso e reinervado o membro torácico comprometido, contribuindo para a restauração motora em camundongos adultos com TCE unilateral.
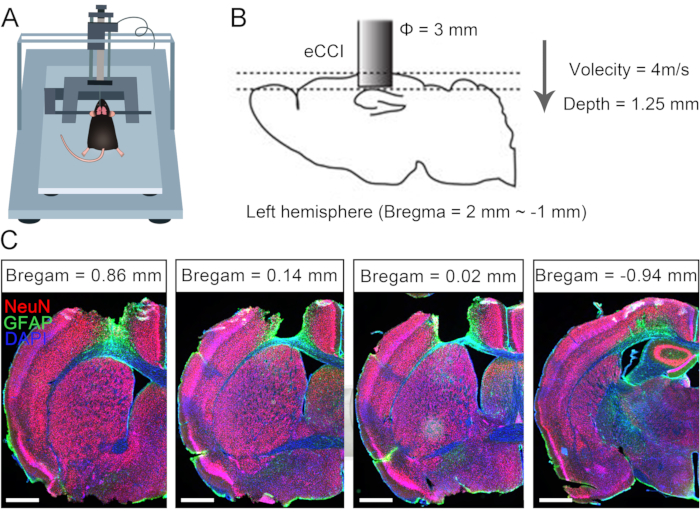
Figura 1: Caracterização do traumatismo cranioencefálico unilateral. (A) Esquema mostrando a posição do mouse em eCCI. (B) Os parâmetros e a faixa de danos da eCCI. (C) Corte coronal representativo mostrando o córtex lesado (2 semanas após o TCE, barra de escala = 500 μm). Abreviação: eCCI = impactor de contusão cortical elétrica. Clique aqui para ver uma versão maior desta figura.
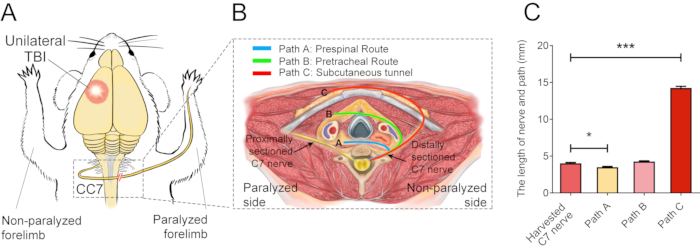
Figura 2: Diagrama elementar cirúrgico. (A) Diagrama esquemático mostrando o desenho experimental para a realização da transferência do nervo C7 contralateral em camundongos TCE. O círculo vermelho mostra a posição do trauma. A barra dupla vermelha dentro do retângulo tracejado mostra o nervo suturado. (B) Um corte transversal mostra três rotas alternativas de transferência do nervo C7 contralateral nos camundongos. Caminho A, a linha azul representa a via pré-espinhal do nervo transferido; O trajeto B, a linha verde, representa o trajeto pré-traqueal do nervo transferido; O trajeto C, a linha vermelha, representa o túnel subcutâneo do nervo transferido. (C) O gráfico mostra o comprimento das vias e o nervo C7 colhido em (B). O comprimento do trajeto A (3,3 ± 0,10 mm) foi significativamente menor que o comprimento do nervo C7 captado (4,05 ± 0,11 mm; * p < 0,05, ANOVA one-way, n = 20 em cada grupo). O comprimento do trajeto C (14,15 ± 0,20 mm) foi significativamente maior que o do nervo C7 captado (*** p < 0,001, ANOVA one-way, n = 20 em cada grupo). O comprimento do trajeto B foi de 4,2 ± 0,08 mm (n=20). Clique aqui para ver uma versão maior desta figura.
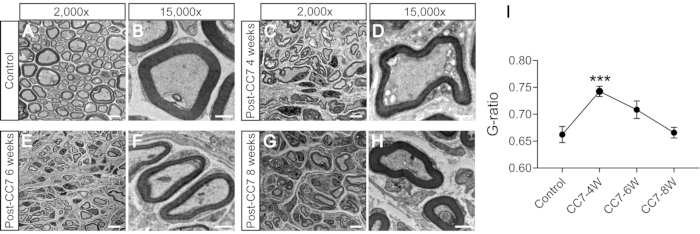
Figura 3: Análise por microscopia eletrônica de um corte transversal do nervo. (A,B) Imagens do nervo em camundongos controle. Barra de escala = 5 μm (A) e 1 μm (B). (C,D) Imagens do nervo regenerado um mês após a cirurgia. Barra de escala = 5 μm (C) e 1 μm (D). (E, F) Imagens do nervo regenerado em um ponto cinco meses após a cirurgia. Barra de escala = 5 μm (E) e 1 μm (F). (G, H) Imagem do nervo regenerado dois meses após a cirurgia. Barra de escala = 5 μm (G) e 1 μm (H). Ampliação de A, C, E e G, 2.000x; magnificação de B, D, F e H, 15.000x. (I) A razão G (razão entre o diâmetro interno e externo da bainha de mielina) é menor nas amostras do grupo controle do que nas amostras de 4 semanas e igual às amostras de 6-8 semanas pós-cirurgia (***: p < 0,001; comparação em diferentes axônios do grupo com o teste t; n = 3 camundongos em cada grupo). Abreviações: CC7= transferência do sétimo nervo cervical contralateral; CC7-XW = X semanas pós-operatório. Clique aqui para ver uma versão maior desta figura.
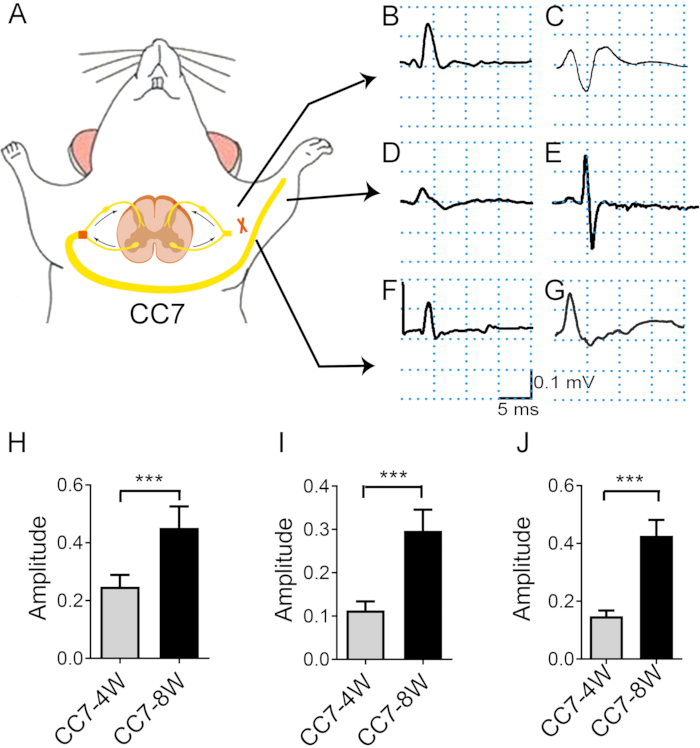
Figura 4: A análise eletromiográfica após a transferência do nervo C7 contralateral indica a taxa de regeneração nervosa. (A) Diagrama esquemático mostrando a estimulação por transferência eletrônica e o registro eletromiográfico in vivo . A intensidade de estimulação foi a mesma durante todo o teste (2 mA). O local de estimulação é o nervo C7 proximal à anastomose. (B, C) Fotografias mostrando potencial de ação registradas no peitoral maior com duas semanas (B) e quatro semanas (C) após a cirurgia. (D, E) A EMG foi registrada no extensor dos dedos 4 semanas (D) e 8 semanas (E) pós-operatório. (F) Com três semanas, os PAMC emergiram no tríceps braquial. (G) Com quatro e oito semanas, os CMAPs do tríceps braquial aumentaram. (H) A amplitude média do peitoral maior atingiu ~0,25 mV ± 0,16 mV em 4 semanas versus 0,45 mV ± 0,03 mV em 8 semanas, mostrando diferença significativa entre os dois momentos (*** p < 0,001, teste t, n = 6 em cada grupo). (I) A amplitude média do tríceps braquial atingiu ~0,15 mV ± 0,01 mV em 4 semanas versus 0,46 mV ± 0,02 mV em 8 semanas, mostrando diferença significativa entre os dois momentos (***: p < 0,001, teste t, n = 6 em cada grupo). (J) A amplitude média do extensor dos dedos atingiu ~0,11 mV ± 0,01 mV em 4 semanas versus 0,29 mV ± 0,02 mV em 8 semanas, mostrando diferença significativa entre os dois momentos (***: p < 0,001, teste t, n = 6 em cada grupo). Abreviações: EMG = eletromiografia; CMAP = potencial de ação muscular composto. Clique aqui para ver uma versão maior desta figura.
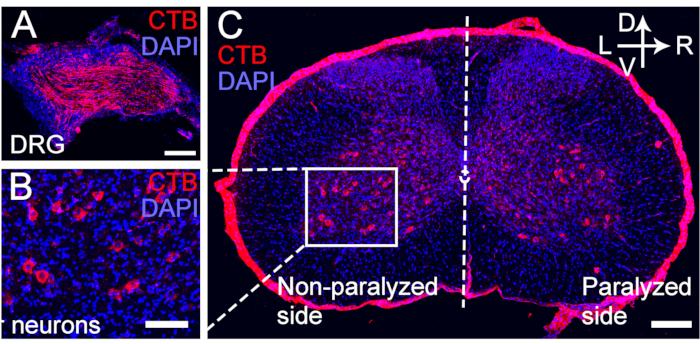
Figura 5: CTB marcação retrógrada dos neurônios motores e sensitivos do nervo C7 transferido. (A-C) CTB foi injetado na extremidade distal da anastomose do nervo C7 4 semanas após a cirurgia CC7. (A) Os neurônios sensoriais foram marcados para o DRG. (B, C) Os neurônios motores do nervo C7 transferido foram marcados para o corno anterior espinhal. Ampliação, 20x. Barra de escala = 200 μm (A, B); 100 μm (C). Abreviações: CTB = toxina da cólera subunidade B; DRG = gânglio da raiz dorsal; DAPI = 4′,6-diamidino-2-fenilindol. Clique aqui para ver uma versão maior desta figura.
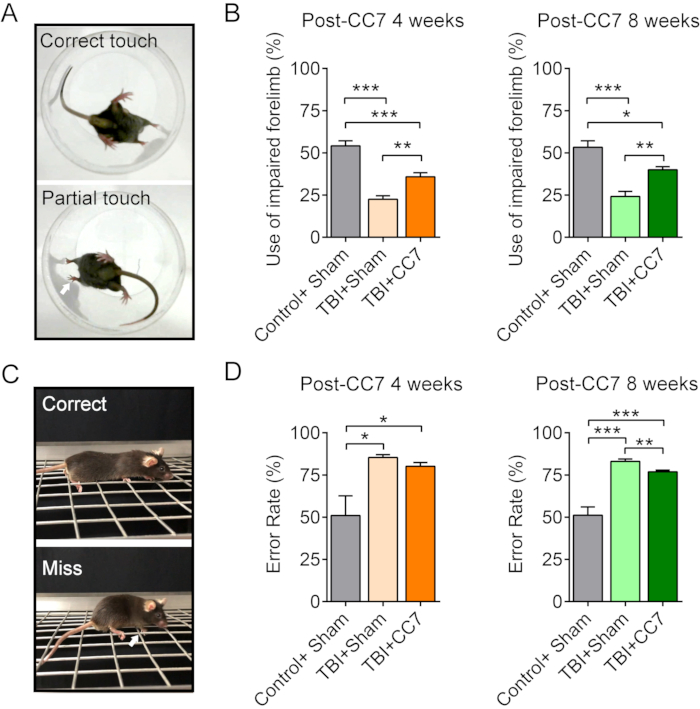
Figura 6: Mudanças comportamentais após cirurgia de CC7. (A) As imagens mostram o teste do cilindro dos camundongos. (B) Gráfico resumo mostrando o efeito da transferência de CC7 em 4 semanas e 8 semanas após a cirurgia nos camundongos com TCE (n = 6 camundongos). p = 0,001; teste t não pareado. O uso médio do membro torácico comprometido foi de 54,17% ± 3,01% no grupo Controle + Sham versus 22,5% ± 2,14% no grupo TCE + Sham; 35,83% ± 2,39% no grupo TCE + CC7 4 semanas pós-CC7, indicando diferença significativa (ANOVA one way; p < 0,05, n = 6 em cada grupo). Em 8 semanas após a transferência de CC7, o uso foi de 53,33% ± 3,80%, 24,17% ± 3,01% e 40,00% ± 1,83% nos grupos Controle + Sham, TCE + Sham e TCE + CC7, respectivamente, uma diferença significativa (*p < 0,05, ANOVA one way, n = 6 em cada grupo). (C) As imagens exibem o teste de caminhada em grade. (D) O gráfico mostra que as médias de erro do membro torácico acometido no grupo TCE + Sham foram de 85,41% ± 1,59% (n = 6) equivalendo ao grupo TCE + CC7 de 80,17% ± 2,19% (n = 6), sendo ambos superiores ao grupo Controle + Sham (50,99% ± 11,69%). Com 8 semanas de pós-operatório, a taxa de erro no grupo TCE + CC7 foi de 76,87 ± 1,07% (n = 6), significativamente menor do que a do grupo TCE + Sham (83,06% ± 1,41%; p < 0,05, ANOVA one-way, n = 6 em cada grupo). Abreviações: CC7= transferência do sétimo nervo cervical contralateral; TCE = traumatismo cranioencefálico. Clique aqui para ver uma versão maior desta figura.
Discussão
Na clínica, a cirurgia de transferência cruzada de nervos tem sido utilizada para tratar pacientes com lesão da avulsão do plexo braquial e após lesão cerebral, como acidente vascular cerebral e TCE 7,9,12. Notadamente, a lesão cerebral é uma condição neurológica grave que pode levar a várias complicações, incluindo epilepsia, hérnia cerebral e infecção13. Nem todos os pacientes com lesão cerebral unilateral são adequados para a cirurgia CC7. Em geral, a cirurgia de CC7 tem sido realizada em pacientes com hemiplegia central na fase crônica (6 meses após a lesão) para evitar ao máximo a influência do edema cerebral. Pacientes com comprometimento cognitivo e tetraplegia após lesões cerebrais são excluídos do tratamento para cirurgia CC7.
A maioria dos estudos relata o uso de abordagem subcutânea e anastomose com enxerto de nervo sural ou ulnar para transferência da raiz nervosa de C7contralateral14,15. Entretanto, a regeneração nervosa por esses métodos requer seis meses, o que pode dificultar o processo de recuperação motora e até mesmo potencialmente influenciar a plasticidade cerebral14. Em estudos anteriores, a transferência de C7 contralateral foi realizada em ratos, e o nervo C7 bilateral foi usado através de 4 fitas do nervo sural autoenxertado interposicional. No entanto, não houve relatos de transferência do nervo C7 pela via pré-espinhal em camundongos. Realizamos a cirurgia CC7 da via pré-espinhal modificada em camundongos e verificamos a velocidade de recuperação funcional após a transferência do nervo C7. Neste estudo, a transferência do nervo C7 contralateral por via pré-espinhal melhorou a função do membro paralisado um mês após a cirurgia, refletindo um menor tempo de recuperação do modelo animal enxertado de nervo. Portanto, esse modelo poderia simular com precisão situações clínicas e lançar as bases para novos experimentos.
Como dissecar a raiz nervosa e reduzir o risco são questões essenciais para a transferência de C7. Ao contrário do ser humano, o plexo braquial do camundongo está localizado no tórax, abaixo da clavícula5,16. Portanto, a estratégia de acesso teve que ser alterada para permitir a observação da raiz do nervo C7 e da colunavertebral 17. A esternotomia é uma abordagem operatória segura e eficaz, sendo comumente aplicada em experimentos em camundongos em cirurgia cardiotorácica18,19. A lâmina ventrali C6 também é um obstáculo à transferência de nervos. Assim, a esternotomia cirúrgica foi realizada para dissecar a raiz nervosa de C7 e cortar a lâmina ventral de C6 para encurtar a distância de transferência.
Embora a via pré-espinhal possa aumentar significativamente a taxa de sucesso da anastomose direta na cirurgia de transferência de nervo, nem todos os camundongos podem ser anastomosados diretamente. Isso se deve principalmente às diferenças anatômicas nesses camundongos. O tronco médio (nervo C7) funde-se com o tronco superior ou inferior em uma localização muito próxima ao forame intervertebral. Assim, o comprimento dos nervos C7 disponíveis para a coleta é insuficiente. Atualmente, a única abordagem é o transplante de nervo ou substituição de camundongos. Este modelo é tipicamente empregado em camundongos com 8 semanas de idade (20-25 g), pois os camundongos são maduros e os nervos C7 são de tamanho adequado para serem manuseados. Embora este protocolo cirúrgico também seja aplicável a camundongos jovens, a dificuldade da operação aumentará significativamente em camundongos mais jovens.
A função motora do membro torácico de camundongos do grupo TCE + CC7 aumentou significativamente em um mês e dois meses, sugerindo que o nervo C7 transferido contribuiu para a recuperação do membro torácico comprometido. A remielinização é fundamental para a recuperação neural funcional. Estudo anterior mostrou que as bainhas de mielina dos nervos lesados se regeneraram após um mês, concordando com esses resultados20. Aqui, o nervo transferido amadureceu gradualmente, o que foi consistente com o teste comportamental. A eletromiografia foi usada para testar a taxa de recuperação funcional após a transferência nervosa. Os resultados demonstraram que o nervo transferido inervava o músculo afetado 4 semanas após a operação. Notavelmente, este estudo é o primeiro a determinar o ponto de tempo de reinervação com uma anastomose direta após a cirurgia de transferência de nervo cruzado.
Em resumo, simulamos a cirurgia clínica para estabelecer um protocolo de anastomose direta dos nervos do plexo braquial bilateral por via pré-espinhal em camundongos e confirmamos a função do nervo deslocado. O modelo murino contribuiu para a elucidação dos mecanismos neurais subjacentes à reabilitação ao cruzar a transferência nervosa após lesões do sistema nervoso central e periférico.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (82071406, 81902296 e 81873766).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
Referências
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t, Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784(2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676(2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231(2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562(2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados