Method Article
Un modelo murino de anastomosis directa a través de la vía preespinal para la cirugía de transferencia de nervios cruzados
* Estos autores han contribuido por igual
En este artículo
Resumen
Simulamos la cirugía clínica para establecer un protocolo de anastomosis directa de los nervios bilaterales del plexo braquial por vía preespinal en ratones, contribuyendo al estudio de los mecanismos neurales que subyacen a la rehabilitación tras la transferencia de nervios cruzados tras lesiones del sistema nervioso central y periférico.
Resumen
La cirugía de transferencia de nervios cruzados ha sido un enfoque poderoso para reparar las extremidades superiores lesionadas en pacientes con lesiones por avulsión del plexo braquial. Recientemente, esta cirugía se aplicó creativamente en el tratamiento clínico de la lesión cerebral y logró una rehabilitación sustancial del brazo paralizado. Esta recuperación funcional después de la cirugía sugiere que la intervención sensoriomotora periférica induce una neuroplasticidad profunda para compensar la pérdida de función después del daño cerebral; Sin embargo, el mecanismo neuronal subyacente es poco conocido. Por lo tanto, se requiere un modelo clínico animal emergente. Aquí, simulamos cirugía clínica para establecer un protocolo de anastomosis directa de los nervios bilaterales del plexo braquial por vía preespinal en ratones. Los experimentos neuroanatómicos, electrofisiológicos y conductuales ayudaron a identificar que los nervios transferidos de estos ratones reinervaron con éxito la extremidad anterior deteriorada y contribuyeron a acelerar la recuperación motora después de una lesión cerebral. Por lo tanto, el modelo de ratón reveló los mecanismos neurales que subyacen a la rehabilitación tras la transferencia nerviosa cruzada después de lesiones del sistema nervioso central y periférico.
Introducción
El plexo braquial (PA) está formado por cinco nervios con diferentes segmentos espinales (C5-T1) responsables de la sensibilidad y el movimiento en el brazo, la mano y los dedos. Después de la salida de estos cinco nervios BP de la médula espinal, se fusionan para formar tres troncos nerviosos: el superior (formado por la fusión de C5 y C6), el medial (de C7) y el inferior (ramas de C8 y T1). Las lesiones graves, especialmente debidas a accidentes de tráfico, a menudo conducen a la avulsión de las raíces nerviosas de la PA, y dicha disfunción tiene un efecto devastador en los pacientes1. Como un enfoque clínico poderoso, se ha realizado la cirugía de transferencia de nervios cruzados para reparar las lesiones por avulsión de la PA mediante la reconexión de los extremos nerviosos lesionados con el lado sano de la PA 2,3. Esta cirugía da como resultado mejoras funcionales de las manos lesionadas y una reorganización directa de la corteza sensoriomotora en ambos hemisferios en los pacientes4. Estudios en animales han revelado que la reorganización drástica en los circuitos corticales fue inducida después de la transferencia nerviosa cruzada5. Debido a que la modificación sensoriomotora periférica puede reactivar la plasticidad latente del cerebro maduro, la cirugía de transferencia de nervios cruzados también exhibe un gran potencial en la reparaciónde lesiones cerebrales.
Recientemente, confirmamos la posibilidad del uso creativo de la transferencia de nervios cruzados como una nueva estrategia de cambio de nervios periféricos para problemas con el sistema nervioso central. Se aplicó un tipo de cirugía de transferencia de nervios cruzados, la transferencia contralateral del séptimo nervio cervical (CC7), para lograr una recuperación funcional significativa del brazo paralizado mediante la transferencia del nervio C7 del lado no paralizado al lado paralizado en el paciente después de la lesión cerebral7. Una característica única de esta operación quirúrgica es que las señales sensoriales y motoras de la extremidad superior paralizada se comunican con el hemisferio contralesional a través del nervio desplazado "cruce izquierda-derecha". Cabe destacar que la recuperación funcional provocada por la cirugía CC7 no se limita a la función inervada por el propio nervio C78. Además, la cirugía CC7 se puede utilizar no solo para tratar a niños con parálisis cerebral, sino también para lograr la rehabilitación en pacientes con accidente cerebrovascular de mediana edad y ancianos. Por lo tanto, hay razones suficientes para creer que la transferencia nerviosa cruzada puede estimular la neuroplasticidad para acelerar la recuperación motora del daño cerebral mediante la modulación del sistema sensoriomotor periférico.
Aunque la cirugía de transferencia de nervios cruzados ha logrado una rehabilitación sustancial en el tratamiento clínico tanto de las lesiones del plexo braquial (BPI) como de las lesiones cerebrales, los mecanismos neurales subyacentes a esta cirugía siguen siendo poco conocidos. La falta de un modelo animal adecuado con características clínicas ha restringido el estudio de los mecanismos internos. Tradicionalmente, en la clínica, la raíz nerviosa C7 contralateral a la lesión se transfiere al lado lesionado a través de un injerto nervioso (p. ej., nervio cubital, nervio sural o nervio safeno) y se conecta con el plexo braquial afectado (p. ej., nervio mediano, raíz C7 o tronco inferior)2,3,9. Una modificación relativamente nueva de esta cirugía consiste en que la raíz C7 no afectada se transfiera directamente al nervio C7 afectado a través de la vía preespinal sin ningún espacio, lo que sugiere una solución óptima7. Actualmente, los ratones muestran una ventaja en la especificidad del tipo de célula y la diversidad de cepas genéticas y son más adecuados para estudiar los mecanismos neurofisiológicos. Por lo tanto, se simuló la cirugía clínica para establecer un protocolo de anastomosis directa de las raíces nerviosas C7 bilaterales a través de la vía preespinal en ratones y contribuir al estudio de los mecanismos neurales que subyacen a la rehabilitación en la transferencia de nervios cruzados.
Protocolo
Todos los experimentos con animales fueron aprobados por el Comité Institucional de Cuidado de Animales de Experimentación de la Universidad de Fudan y la Academia China de Ciencias de conformidad con las directrices del Instituto Nacional de Salud. Se utilizaron ratones machos adultos C57BL/6N de ocho semanas de edad.
1. Configuración preoperatoria
- Asegurar un stock adecuado de instrumentos quirúrgicos esterilizados esterilizados en autoclave, equipos, medicamentos analgésicos y medicamentos anestésicos.
- Asegure un espacio de trabajo adecuado en una mesa de operaciones.
- Prepare la mesa de operaciones utilizando una tabla de espuma quirúrgica personalizada cubierta de pañales como cama para el ratón. Fije una almohadilla térmica a la tabla de espuma con cinta médica cubierta con una gasa estéril.
- Cree retractores doblando una aguja de acupuntura con pinzas vasculares, doblándola por la mitad y luego doblando la punta de la aguja de acupuntura doblada en un gancho. Fije una tira de goma en el extremo de la aguja de acupuntura y use una chincheta para fijar el extremo de la tira de goma a la tabla de espuma.
- Calibrar el microscopio estereoscópico; Elija un microscopio estereoscópico con una distancia de enfoque adecuada. Cubra los botones de zoom/enfoque con papel de aluminio esterilizado para permitir que el cirujano los ajuste durante la operación. El papel de aluminio esterilizado se colocó en los botones de zoom/enfoque, lo que permitió al cirujano utilizarlo con guantes estériles.
2. Anestesia y preparación del ratón
- Pesar el ratón y anestesiar correspondiente al peso corporal (isoflurano 3%). Asegúrese de que el ratón no responda cuando se pellizquen los espacios interdigitales de su pata para confirmar la profundidad de la anestesia. Se debe mantener una profundidad adecuada de la anestesia durante todo el procedimiento (isoflurano al 1%).
- Aplique el ungüento oftálmico bilateralmente en los ojos para evitar la irritación o la sequedad de la córnea durante la cirugía.
- Prepare el sitio quirúrgico afeitando el pelaje del cuello y el pecho con una maquinilla automática. Retira y limpia el cabello suelto.
- Coloque el ratón en posición supina sobre la almohadilla calentadora cubierta con una gasa estéril. Mantenga la temperatura del ratón a 37 °C durante toda la operación. Fije el ratón con cinta médica para hacer que las extremidades delanteras abducan horizontalmente y evitar que las extremidades traseras y la cola se muevan. Se colocó un paño quirúrgico desechable esterilizado con la abertura adecuada a los ratones.
3. Procedimiento operativo
- Inyectar tramadol como analgesia preventiva (20 mg/kg, i.p.). Marque la incisión transversal en el borde superior de la clavícula. Use tres ciclos de exfoliantes alternos de solución desinfectante de yodóforo y etanol para desinfectar el sitio quirúrgico. Confirme la profundidad de la anestesia con un pellizco en el dedo del pie antes de la cirugía.
- Trabajando bajo un microscopio, haga una incisión transversal de 4 mm a lo largo de la marca con un bisturí estéril. Agrandar la incisión durante el procedimiento según sea necesario.
- Diseccionar sin rodeos a través de la fascia subcutánea e identificar el borde inferior de la glándula submandibular. Tire de la glándula submandibular hacia arriba para exponer la fosa supraclavicular y el esternón.
NOTA: Puede haber vasos sanguíneos de pequeño calibre en esta área. La electrocauterización se puede utilizar para detener el sangrado. - Realice una incisión parcial de esternotomía mediana (~4 mm) haciendo una incisión en el esternón desde la cabeza hasta la cola a lo largo de la línea media. Proteja la pleura, el corazón y los vasos sanguíneos durante la esternotomía.
- Identifica el músculo esternohioideo. Tire suavemente del esternón con dos pequeños retractores personalizados hechos de agujas de acupuntura e identifique el músculo esternohioideo, sobre la tráquea y el esófago. Retraiga este músculo para exponer la arteria carótida, la vena yugular interna, el nervio frénico, el nervio vago, la tráquea y el esófago.
NOTA: Retraiga suavemente el esternón para evitar el neumotórax abierto. A diferencia de los humanos, el esófago del ratón no está detrás de la tráquea, sino adyacente a la tráquea en el lado izquierdo. - Identifica el plexo braquial izquierdo. En el borde lateral de la vena yugular interna izquierda, tire de la fascia y el tejido adiposo hacia afuera para exponer el plexo braquial. Busca el tronco superior, compuesto por los nervios C5 y C6, que tiene tres ramas. Identifique el tronco medio compuesto por el nervio C7 y el tronco inferior compuesto por los nervios C8 y T1, a lo largo del tronco superior hasta la cola del ratón.
NOTA: Hay vasos sanguíneos longitudinales en la superficie del plexo braquial. Use electrocauterio para prevenir el sangrado. Al separar el plexo braquial izquierdo, proteja el canal quiloso para evitar una fístula quilosa. - Extraiga el nervio C7 izquierdo. Diseccionar la división anterior y la división posterior del tronco medio (nervio C7) distalmente hasta el nivel de la división a la médula debajo de la clavícula y bloquear el nervio C7 con 0,1 ml de lidocaína al 2% mediante infusión local en el tronco nervioso. Resecar el nervio C7 con unas tijeras de resorte vannas en sus puntos de fusión con el cordón lateral y el cordón posterior. Recorta el nervio C7 para que la longitud de cada división sea similar.
NOTA: Las divisiones anterior y posterior del nervio C7 y las divisiones anterior y posterior de los troncos superior e inferior recorren una larga distancia antes de la confluencia, por lo que el nervio C7 debe liberarse lo suficiente antes de la resección. De hecho, el nervio C7 no siempre se divide en dos divisiones; A veces, se divide en tres divisiones o incluso en cuatro en casos raros. - Retire la lámina ventralis C6 izquierda. Proteja cuidadosamente el nervio frénico y severa el músculo escaleno anterior a nivel del segmento C6 para exponer la raíz nerviosa C7. Corta pequeñas ramas del nervio C7 que inervan el músculo paraespinal con micropinzas. Extraiga el nervio C7 con cuidado y extirpe la lámina ventral C6 con cuidado.
NOTA: Existe una prominencia ósea entre el lado medial de la arteria carótida izquierda y el lado lateral del esófago. Esta prominencia ósea es la lámina ventral de la6ª vértebra cervical. El músculo longitudinal del borde lateral de la lámina ventral C6 es el músculo escaleno anterior, y el nervio frénico corre por la superficie del músculo escaleno anterior. - Extrae el nervio C7 derecho. Severa el músculo escaleno anterior en el lado derecho, similar al lado izquierdo, y transecta la raíz nerviosa C7 derecha cerca del agujero intervertebral. Disecciona el nervio C7 derecho desde su nivel de división.
NOTA: Corte con cuidado el nervio C7 derecho para evitar daños en los vasos sanguíneos debajo del nervio. - Transfiere el nervio C7 izquierdo.
- Retire el músculo largo colli junto a los cuerpos vertebrales parcialmente en ambos lados. Separe y amplíe sin rodeos el espacio entre la tráquea-esófago y el cuerpo vertebral.
- Envíe suturas de nailon 5-0 de medio pliegue desde el lado derecho del cuerpo vertebral hacia el lado izquierdo a través de la ruta preespinal.
- Enganche el nervio C7 izquierdo con un tubo de infusión y guíe el nervio hacia el lado derecho a través de la vía preespinal.
- Retraiga la tráquea y el esófago suavemente y coloque las divisiones anterior y posterior del nervio C7 izquierdo a la raíz nerviosa C7 derecha sin tensión utilizando suturas de nailon 12-0. Sutura el epineuro alrededor de los nervios con 4-5 puntos de sutura para coaptar los nervios con fuerza.
NOTA: Es crucial elegir un tubo de infusión de plástico de grosor adecuado. Un tubo demasiado delgado podría dañar el nervio, y un tubo demasiado grueso podría dañar la tráquea y el esófago. Además, el espacio entre la tráquea-esófago y el cuerpo vertebral es un espacio en forma de "V", y cortar parte del músculo largo colli puede acortar la vía de transferencia.
4. Cierre de heridas
- Irrigar la herida con solución salina normal estéril y secarla con gasa estéril.
- Suturar el esternón y cerrar la piel con suturas de monofilamento 5-0.
5. Cuidados postoperatorios
- Espere a que el ratón se despierte de la anestesia. Transfiera el ratón a una jaula limpia sin material de cama, pero calentado con una manta térmica. Observa al ratón hasta que sea ambulatorio. Utilizar tramadol (20 mg/kg, i.p.) como analgesia postoperatoria.
- Coloque a los ratones en una jaula de recuperación y vigílelos hasta que se recuperen. Restaure el agua y la dieta de los ratones después de la operación. Monitoree a los ratones después de la operación para detectar signos de deterioro o infección todos los días, incluida la desnutrición, la postura encorvada y el pelaje erizado. A las dos semanas después de la cirugía, se debe retirar la sutura.
NOTA: Aplique ungüento de eritromicina en la superficie de la herida todos los días durante tres días consecutivos. - Si se observa alguna complicación, como edema de la herida, debe resolverse de inmediato.
6. Análisis conductual
NOTA: Todas las pruebas y análisis de comportamiento fueron realizados por un observador ciego a los grupos experimentales.
- Prueba de cilindros
NOTA: La prueba del cilindro evalúa el uso de las extremidades anteriores durante la exploración vertical espontánea dentro de un cilindro a las 4 y 8 semanas después de la cirugía21.- Coloque los ratones en un cilindro transparente (diámetro 9 cm, altura 15 cm) en un marco elevado.
- Para facilitar la observación y el registro, fije un espejo en un ángulo de 45° debajo del cilindro.
- Registre la cría espontánea de cada ratón observado con la ayuda del espejo durante 10 minutos.
- Determine manualmente el período de tiempo durante el cual (i) la pata derecha, (ii) la pata izquierda o (iii) ambas patas hicieron contacto con las paredes de vidrio. Cuenta un total de 20 movimientos durante cada sesión. Excluya del análisis a los ratones que no estén activos durante la prueba.
- Califique el rendimiento de la prueba como:
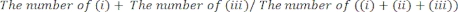
- Prueba de recorrido por cuadrícula
NOTA: La prueba de caminar en cuadrícula evalúa la colocación precisa de las patas delanteras en los peldaños de una cuadrícula durante la exploración espontánea a las 4 y 8 semanas después de la cirugía. Artículo 22.- Coloque los ratones en una rejilla de alambre (20 cm x 24 cm) con agujeros cuadrados de 25 mm y déjelos explorar libremente durante 10 minutos mientras graban su actuación con una cámara de video.
- Marque un deslizamiento del pie en el caso de cualquiera de los siguientes:
- Busque casos en los que la pata pierda por completo un peldaño (en cuyo caso la extremidad cae entre los peldaños y el animal pierde el equilibrio).
- Busque casos en los que la pata esté colocada correctamente en un peldaño, pero se resbale mientras soporta el peso del cuerpo.
- Exprese el resultado de la prueba como deslizamiento del pie de la extremidad anterior derecha / deslizamiento total del pie. Aunque ni la prueba del cilindro ni la prueba de caminar en cuadrícula requieren entrenamiento, obtenga puntajes de referencia evaluando a cada animal una vez antes de la cirugía.
Resultados
El daño cerebral unilateral a menudo causa disfunción permanente de la extremidad contralateral debido a las limitaciones de la plasticidad neural compensativa en adultos 10,11. Anteriormente, informamos que la cirugía CC7 podría utilizarse para tratar miembros superiores hemipléjicos en pacientes adultos después de una lesión cerebral7. Para evaluar la efectividad del protocolo de anastomosis directa de los nervios C7 bilaterales por vía preespinal, realizamos la cirugía de transferencia de nervios cruzados en ratones tras traumatismo craneoencefálico unilateral (TCE). En la Figura 1 se describen los procedimientos de TCE y se verifica el rango y el efecto del daño. En primer lugar, se utilizó un impactador de contusión cortical eléctrica (eCCI) para dañar la corteza cerebral del hemisferio izquierdo (anteroposterior = +1,0 mm a -2,0 mm, mediolateral = 0,5 mm a 3,5 mm) en ratones adultos para provocar una lesión cerebral unilateral. Después de 2 semanas, las estructuras anatómicas confirmaron que este protocolo de LCT casi destruyó la corteza sensoriomotora, un lugar importante para iniciar movimientos. Estos ratones con TCE unilateral exhibieron defectos motores significativos de la extremidad anterior derecha.
En la figura 2 se describen los procedimientos de CC7. El diagrama de trayectoria de la cirugía CC7 reveló que la ruta A, que representa la ruta preespinal, fue el abordaje más corto en comparación con los demás. La longitud de la vía A es incluso menor que la longitud del nervio C7 extraído en el lado izquierdo (lado no paralizado). Este hallazgo proporcionó la base anatómica para la elección de la vía preespinal para completar la cirugía de transferencia nerviosa. La cirugía CC7 se realizó en anastomosis directa por vía preespinal a las dos semanas después del TCE. El nervio cervical 7 (C7) en el lado no paralizado se transfirió directamente al lado paralizado en lugar de hacer sus conexiones cerebrales originales. La figura 3 muestra los resultados de la microscopía electrónica que revelaron que el nervio C7 transferido se había regenerado con éxito. El grosor de la vaina de mielina del nervio C7 transferido aumentó gradualmente, a partir de las 4 semanas después de la cirugía CC7, y fue casi comparable al del grupo control a las 8 semanas después de la cirugía CC7. En la figura 4 se identifica la reinervación muscular del nervio C7 transferido mediante registros electromiográficos. La estimulación eléctrica del extremo proximal de la anastomosis nerviosa C7 indujo de manera estable potenciales de acción en múltiples músculos de la extremidad anterior afectada a las 4 semanas del postoperatorio, de acuerdo con los resultados de la microscopía electrónica. La figura 5 muestra que el nervio C7 transferido contiene fibras motoras del asta ventral y fibras sensoriales de los ganglios de la raíz dorsal del segmento C7 de la médula espinal en el lado sano a través del etiquetado retrógrado de la subunidad B de la toxina del cólera (CTB).
La Figura 6 muestra que el modelo de ratón también mostró una recuperación motora significativa después de un TCE unilateral, lo que coincide con los resultados de los estudios clínicos. Para verificar el efecto de la cirugía CC7 en la recuperación de la función motora lesionada después de un TCE, se estableció un grupo TCE + Simulacro y un grupo Control + Simulado. Los ratones en el grupo TBI + Sham y el grupo TBI + CC7 recibieron los mismos procedimientos para la lesión TBI simultáneamente, mientras que los ratones en el grupo Control + Sham recibieron solo cirugía simulada. Mientras que los ratones del grupo TBI + CC7 se sometieron a una cirugía de transferencia nerviosa, los ratones del grupo TBI + simulado y el grupo Control + Sham se sometieron a una resección bilateral del nervio cervical 7 (C7). En las pruebas de cilindros, el grupo TBI + CC7 mostró una tasa de uso significativamente mayor de la extremidad anterior dañada que el grupo TBI a las 4 y 8 semanas después de la cirugía CC7 (p < 0,01). En las pruebas de caminar en cuadrícula, el grupo TBI + CC7 mostró una tasa de error más baja que el grupo TBI a las 4 semanas después de la cirugía CC7. Además, la tasa de error del grupo TBI + CC7 fue significativamente menor que la del grupo TBI a las 8 semanas después de la cirugía CC7 (p < 0,05). Estos resultados conductuales mostraron que la cirugía CC7 podría mejorar la función motora de la extremidad afectada en ratones con LCT. En conjunto, estos resultados sugieren que el nervio C7 transferido reconstruido por la cirugía CC7 a través de la vía preespinal se regeneró con éxito y reinervó la extremidad anterior deteriorada, lo que contribuyó a la restauración motora en ratones adultos con TCE unilateral.
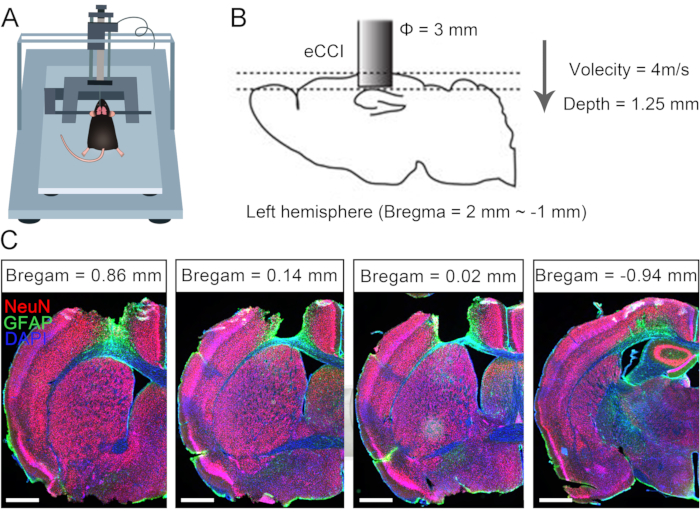
Figura 1: Caracterización del traumatismo craneoencefálico unilateral. (A) Esquema que muestra la posición del ratón en eCCI. (B) Los parámetros y el rango de daño de eCCI. (C) Sección coronal representativa que muestra la corteza lesionada (2 semanas después del TCE, barra de escala = 500 μm). Abreviatura: eCCI = impactador de contusión cortical eléctrica. Haga clic aquí para ver una versión más grande de esta figura.
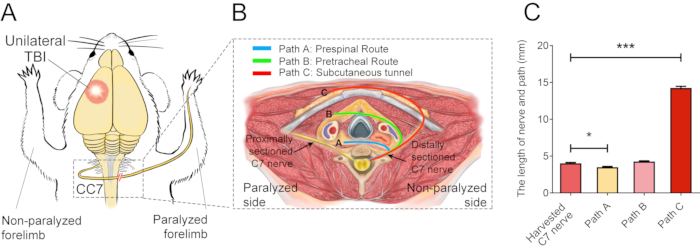
Figura 2: Diagrama elemental quirúrgico. (A) Diagrama esquemático que muestra el diseño experimental para realizar la transferencia del nervio C7 contralateral en ratones con LCT. El círculo rojo muestra la posición del traumatismo. La doble barra roja dentro del rectángulo discontinuo muestra el nervio suturado. (B) Una sección transversal muestra tres rutas alternativas de la transferencia contralateral del nervio C7 en los ratones. Ruta A, la línea azul representa la ruta preespinal del nervio transferido; La ruta B, la línea verde, representa la ruta pretraqueal del nervio transferido; El camino C, la línea roja, representa el túnel subcutáneo del nervio transferido. (C) El gráfico muestra la longitud de las rutas y el nervio C7 cosechado en (B). La longitud del trayecto A (3,3 ± 0,10 mm) fue significativamente menor que la longitud del nervio C7 extraído (4,05 ± 0,11 mm; * p < 0,05, ANOVA de una vía, n = 20 en cada grupo). La longitud del trayecto C (14,15 ± 0,20 mm) fue significativamente mayor que la del nervio C7 extraído (*** p < 0,001, ANOVA de una vía, n = 20 en cada grupo). La longitud del trayecto B fue de 4,2 ± 0,08 mm (n=20). Haga clic aquí para ver una versión más grande de esta figura.
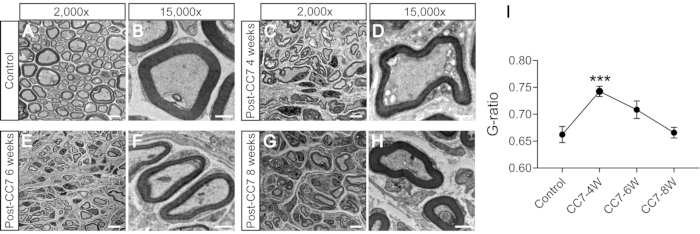
Figura 3: Análisis de microscopía electrónica de una sección transversal del nervio. (A,B) Imágenes del nervio en ratones de control. Barra de escala = 5 μm (A) y 1 μm (B). (C,D) Imágenes del nervio regenerado un mes después de la cirugía. Barra de escala = 5 μm (C) y 1 μm (D). (E, F) Imágenes del nervio regenerado en un momento cinco meses después de la cirugía. Barra de escala = 5 μm (E) y 1 μm (F). (G, H) Imagen del nervio regenerado a los dos meses de la cirugía. Barra de escala = 5 μm (G) y 1 μm (H). Aumento de A, C, E y G, 2.000x; aumento de B, D, F y H, 15.000x. (I) La relación G (la relación entre el diámetro interno y externo de la vaina de mielina) es menor en las muestras del grupo control que en las muestras de 4 semanas e igual a las muestras a las 6-8 semanas después de la cirugía (***: p < 0,001; comparación en diferentes grupos de axones con la prueba t; n = 3 ratones en cada grupo). Abreviaturas: CC7= transferencia contralateral del séptimo nervio cervical; CC7-XW = X semanas después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
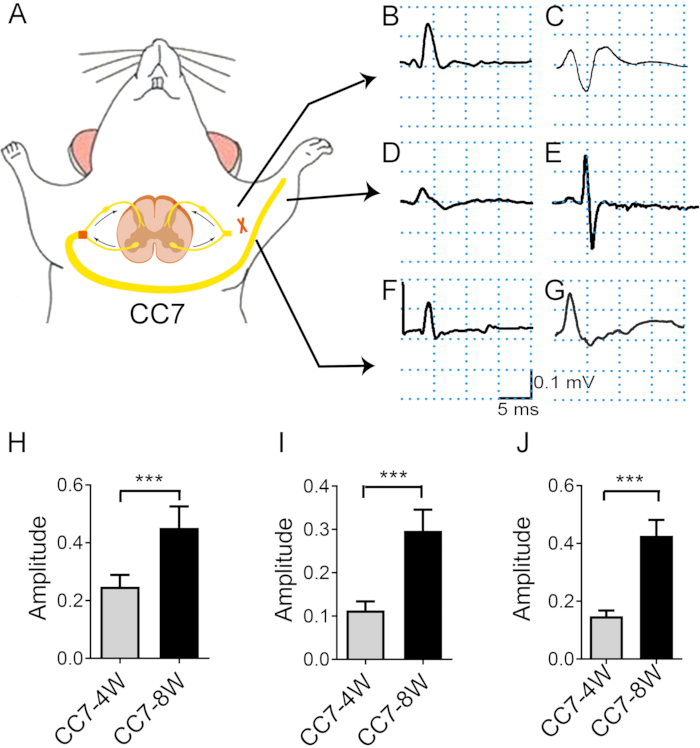
Figura 4: El análisis electromiográfico después de la transferencia nerviosa C7 contralateral indica la tasa de regeneración nerviosa. (A) Diagrama esquemático que muestra la estimulación por transferencia electrónica y el registro electromiográfico in vivo . La intensidad de la estimulación fue la misma durante toda la prueba (2 mA). El sitio de estimulación es el nervio C7 proximal a la anastomosis. (B, C) Fotografías que muestran el potencial de acción registrado en el pectoral mayor a las dos semanas (B) y cuatro semanas (C) después de la cirugía. (D, E) La EMG se registró en el extensor de los dedos 4 semanas (D) y 8 semanas (E) después de la cirugía. (F) A las tres semanas, aparecieron CMAP en el tríceps braquial. (G) A las cuatro y ocho semanas, los CMAP del tríceps braquial aumentaron. (H) La amplitud media del pectoral mayor alcanzó ~0,25 mV ± 0,16 mV a las 4 semanas frente a 0,45 mV ± 0,03 mV a las 8 semanas, mostrando una diferencia significativa entre los dos puntos temporales (*** p < 0,001, prueba t, n = 6 en cada grupo). (I) La amplitud media del tríceps braquial alcanzó ~0,15 mV ± 0,01 mV a las 4 semanas frente a 0,46 mV ± 0,02 mV a las 8 semanas, mostrando una diferencia significativa entre los dos puntos temporales (***: p < 0,001, prueba t, n = 6 en cada grupo). (J) La amplitud media del extensor de los dedos alcanzó ~0,11 mV ± 0,01 mV a las 4 semanas frente a 0,29 mV ± 0,02 mV a las 8 semanas, mostrando una diferencia significativa entre los dos puntos temporales (***: p < 0,001, prueba t, n = 6 en cada grupo). Abreviaturas: EMG = electromiografía; CMAP = potencial de acción muscular compuesto. Haga clic aquí para ver una versión más grande de esta figura.
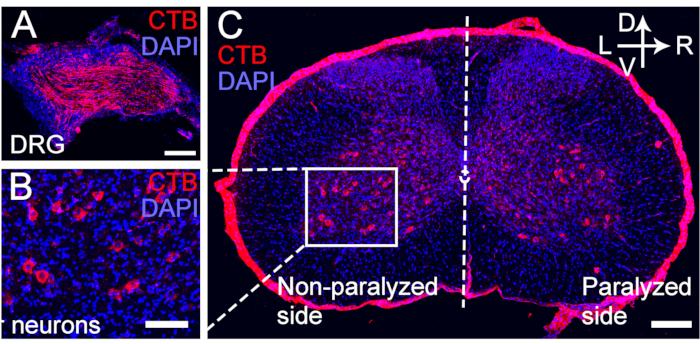
Figura 5: Marcaje retrógrado de CTB de las neuronas motoras y sensoriales del nervio C7 transferido. (A-C) La CTB se inyectó en el extremo distal de la anastomosis del nervio C7 a las 4 semanas después de la cirugía CC7. (A) Las neuronas sensoriales fueron marcadas para el DRG. (B, C) Las neuronas motoras del nervio C7 transferido fueron marcadas para el asta anterior espinal. Aumento, 20x. Barra de escala = 200 μm (A, B); 100 μm (C). Abreviaturas: CTB = subunidad B de la toxina del cólera; DRG = ganglio de la raíz dorsal; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
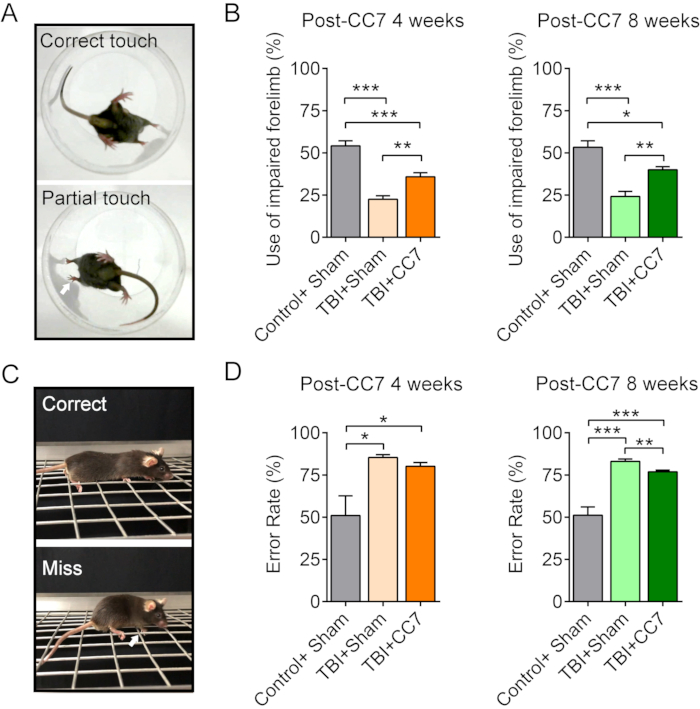
Figura 6: Cambios conductuales después de la cirugía CC7. (A) Las imágenes muestran la prueba del cilindro de los ratones. (B) Gráfico resumen que muestra el efecto de la transferencia de CC7 a las 4 semanas y 8 semanas después de la cirugía en los ratones con TCE (n = 6 ratones). p = 0,001; Prueba t no apareada. El uso promedio de la extremidad anterior deteriorada fue del 54,17% ± 3,01% en el grupo Control + Simulado frente al 22,5% ± 2,14% en el grupo TBI + Simulacro; El 35,83% ± 2,39% en el grupo TCE + CC7 a las 4 semanas después de la cirugía CC7, lo que indica una diferencia significativa (ANOVA de una vía; p < 0,05, n = 6 en cada grupo). A las 8 semanas después de la transferencia de CC7, el uso fue del 53,33% ± 3,80%, del 24,17% ± 3,01% y del 40,00% ± 1,83% en los grupos Control + Simulado, TBI + Grupo Simulado y TBI + CC7, respectivamente, una diferencia significativa (*p < 0,05, ANOVA de una vía, n = 6 en cada grupo). (C) Las imágenes muestran la prueba de caminar en cuadrícula. (D) El gráfico muestra que las tasas de error promedio de la extremidad anterior deteriorada en el grupo TBI + Sham fueron del 85,41% ± 1,59% (n = 6), lo que equivale al 80,17% ± 2,19% (n = 6) del grupo TBI + CC7, y ambos fueron mayores que el grupo Control + Sham (50,99% ± 11,69%). A las 8 semanas después de la cirugía, la tasa de error en el grupo TCE + CC7 fue de 76,87 ± 1,07% (n = 6), que es significativamente menor que la del grupo TCE + Simulado (83,06% ± 1,41%; p < 0,05, ANOVA de una vía, n = 6 en cada grupo). Abreviaturas: CC7= transferencia contralateral del séptimo nervio cervical; TBI = lesión cerebral traumática. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En la clínica, la cirugía de transferencia de nervios cruzados se ha utilizado para tratar a pacientes con lesión por avulsión del plexo braquial y después de daño cerebral, como accidente cerebrovascular y traumatismo craneoencefálico 7,9,12. En particular, el daño cerebral es una afección neurológica grave que puede provocar varias complicaciones, como epilepsia, hernia cerebral e infección13. No todos los pacientes con lesión cerebral unilateral son aptos para la cirugía CC7. En general, la cirugía CC7 se ha realizado en pacientes con hemiplejia central en fase crónica (6 meses después de la lesión) para evitar al máximo la influencia del edema cerebral. Los pacientes con deterioro cognitivo y cuadriplejia después de lesiones cerebrales están excluidos del tratamiento para la cirugía CC7.
La mayoría de los estudios han reportado el uso de un abordaje subcutáneo y anastomosis de injerto de nervio sural o cubital para transferir la raíz nerviosa C7 contralateral14,15. Sin embargo, la regeneración nerviosa por estos métodos requiere seis meses, lo que puede dificultar el proceso de recuperación motora e incluso influir potencialmente en la plasticidad cerebral14. En estudios previos, la transferencia contralateral de C7 se realizó en ratas, y el nervio C7 bilateral se utilizó a través de 4 hebras del nervio sural autoinjertado interposicional. Sin embargo, no ha habido informes de transferencia del nervio C7 a través de la vía preespinal en ratones. Realizamos cirugía CC7 de la ruta preespinal modificada en ratones y verificamos la velocidad de recuperación funcional después de la transferencia del nervio C7. En este estudio, la transferencia contralateral del nervio C7 a través de la vía preespinal mejoró la función de las extremidades paralizadas un mes después de la cirugía, lo que refleja un tiempo de recuperación más corto del modelo animal injertado de nervio. Por lo tanto, este modelo podría simular con precisión situaciones clínicas y sentar las bases para futuros experimentos.
Cómo diseccionar la raíz nerviosa y reducir el riesgo son cuestiones esenciales para la transferencia de C7. A diferencia de los humanos, el plexo braquial del ratón se encuentra en el tórax por debajo de la clavícula 5,16. Por lo tanto, la estrategia de acceso tuvo que ser alterada para permitir la observación de la raíz del nervio C7 y de la columna vertebral17. La esternotomía es un abordaje quirúrgico seguro y eficaz y se aplica comúnmente en experimentos con ratones en cirugía cardiotorácica 18,19. La lámina ventral C6 también es un obstáculo para la transferencia de nervios. Por lo tanto, se realizó una cirugía de esternotomía para diseccionar la raíz nerviosa C7 y cortar la lámina ventral C6 para acortar la distancia de transferencia.
Aunque la vía preespinal puede aumentar significativamente la tasa de éxito de la anastomosis directa de la cirugía de transferencia nerviosa, no todos los ratones pueden ser anastomosados directamente. Esto se debe principalmente a las diferencias anatómicas en estos ratones. El tronco medio (nervio C7) se fusiona con el tronco superior o inferior en un lugar muy cercano al agujero intervertebral. Por lo tanto, la longitud de los nervios C7 disponibles para la recolección es insuficiente. Actualmente, el único enfoque es el trasplante de nervios o el reemplazo de ratones. Este modelo se emplea típicamente en ratones de 8 semanas de edad (20-25 g), ya que los ratones son maduros y los nervios C7 tienen el tamaño adecuado para ser manipulados. Aunque este protocolo quirúrgico también es aplicable a ratones jóvenes, la dificultad de la operación aumentará significativamente en ratones más jóvenes.
La función motora de las extremidades anteriores de los ratones en el grupo TBI + CC7 aumentó significativamente al mes y a los dos meses, lo que sugiere que el nervio C7 transferido contribuyó a la recuperación de la extremidad anterior deteriorada. La remielinización es fundamental para la recuperación neuronal funcional. Un estudio previo mostró que las vainas de mielina de los nervios lesionados se regeneraban después de un mes, lo que concuerda con estos resultados20. Aquí, el nervio transferido maduró gradualmente, lo que fue consistente con la prueba de comportamiento. Se utilizó la electromiografía para probar aún más la tasa de recuperación funcional después de la transferencia nerviosa. Los resultados demostraron que el nervio transferido inervó el músculo afectado 4 semanas después de la operación. Cabe destacar que este estudio es el primero en determinar el momento de la reinervación con una anastomosis directa después de la cirugía de transferencia de nervios cruzados.
En resumen, simulamos la cirugía clínica para establecer un protocolo de anastomosis directa de los nervios del plexo braquial bilateral por vía preespinal en ratones y confirmamos la función del nervio desplazado. El modelo de ratón contribuyó a la elucidación de los mecanismos neurales subyacentes a la rehabilitación tras la transferencia de nervios cruzados después de lesiones del sistema nervioso central y periférico.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (82071406, 81902296 y 81873766).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
Referencias
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t, Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784(2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676(2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231(2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562(2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados