Method Article
Un modèle murin d’anastomose directe par voie prévertébrale pour une chirurgie de transfert de nerf croisé
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous avons simulé une chirurgie clinique pour établir un protocole d’anastomose directe des nerfs bilatéraux du plexus brachial par voie préspinale chez la souris, contribuant ainsi à l’étude des mécanismes neuronaux sous-jacents à la rééducation lors du transfert nerveux croisé après des lésions du système nerveux central et périphérique.
Résumé
La chirurgie de transfert de nerfs croisés a été une approche puissante pour réparer les membres supérieurs blessés chez les patients atteints de lésions d’avulsion du plexus brachial. Récemment, cette chirurgie a été appliquée de manière créative dans le traitement clinique des lésions cérébrales et a permis une rééducation substantielle du bras paralysé. Cette récupération fonctionnelle après la chirurgie suggère que l’intervention sensorimotrice périphérique induit une neuroplasticité profonde pour compenser la perte de fonction après une lésion cérébrale ; Cependant, le mécanisme neuronal sous-jacent est mal compris. Par conséquent, un modèle animal clinique émergent est nécessaire. Ici, nous avons simulé une chirurgie clinique pour établir un protocole d’anastomose directe des nerfs bilatéraux du plexus brachial via la voie préspinale chez la souris. Des expériences neuroanatomiques, électrophysiologiques et comportementales ont permis d’identifier que les nerfs transférés de ces souris réinnervaient avec succès le membre antérieur altéré et contribuaient à accélérer la récupération motrice après une lésion cérébrale. Par conséquent, le modèle murin a révélé les mécanismes neuronaux sous-jacents à la rééducation lors du transfert nerveux croisé après des lésions du système nerveux central et périphérique.
Introduction
Le plexus brachial (PA) se compose de cinq nerfs avec différents segments de la colonne vertébrale (C5-T1) responsables de la sensation et du mouvement dans le bras, la main et les doigts. Après la sortie de ces cinq nerfs BP de la moelle épinière, ils fusionnent pour former trois troncs nerveux : le supérieur (formé par la fusion de C5 et C6), le médial (à partir de C7) et l’inférieur (branches de C8 et T1). Les blessures graves, en particulier dues à des accidents de la route, entraînent souvent une avulsion des racines nerveuses de la tension artérielle, et un tel dysfonctionnement a un effet dévastateur sur les patients1. En tant qu’approche clinique puissante, la chirurgie de transfert de nerfs croisés a été réalisée pour réparer les lésions d’avulsion de la TA en reconnectant les extrémités nerveuses lésées au côté sain de la TA 2,3. Cette chirurgie se traduit par des améliorations fonctionnelles des mains blessées et une réorganisation directe du cortex sensorimoteur dans les deux hémisphères chez les patients4. Des études animales ont révélé qu’une réorganisation drastique des circuits corticaux était induite après le transfert de nerfscroisés 5. Étant donné que la modification sensorimotrice périphérique peut réactiver la plasticité dormante du cerveau mature, la chirurgie de transfert nerveux croisé présente également un grand potentiel dans la réparation des lésions cérébrales6.
Récemment, nous avons confirmé la possibilité de l’utilisation créative du transfert de nerfs croisés comme nouvelle stratégie de changement des nerfs périphériques pour les problèmes du système nerveux central. Un type de chirurgie de transfert de nerfs croisés, le transfert du septième nerf cervical controlatéral (CC7), a été appliqué pour obtenir une récupération fonctionnelle significative du bras paralysé en transférant le nerf C7 du côté non paralysé au côté paralysé chez le patient après une lésion cérébrale7. Une caractéristique unique de cette opération chirurgicale est que les signaux sensoriels et moteurs du membre supérieur paralysé communiquent à l’hémisphère contralésionnel par le nerf déplacé « croisement gauche-droite ». Notamment, la récupération fonctionnelle provoquée par la chirurgie CC7 ne se limite pas à la fonction innervée par le nerf C7 lui-même8. De plus, la chirurgie CC7 peut être utilisée non seulement pour traiter les enfants atteints de paralysie cérébrale, mais aussi pour réaliser la rééducation chez les patients d’âge moyen et âgés victimes d’un AVC. Par conséquent, il y a suffisamment de raisons de croire que le transfert nerveux croisé peut stimuler la neuroplasticité pour accélérer la récupération motrice des lésions cérébrales en modulant le système sensorimoteur périphérique.
Bien que la chirurgie de transfert de nerfs croisés ait permis une rééducation substantielle dans le traitement clinique des lésions du plexus brachial (BPI) et des lésions cérébrales, les mécanismes neuronaux sous-jacents à cette chirurgie restent mal compris. L’absence d’un modèle animal approprié présentant des caractéristiques cliniques a restreint l’étude des mécanismes internes. Traditionnellement, en clinique, la racine nerveuse C7 controlatérale à la lésion est transférée du côté blessé par une greffe nerveuse (par exemple, nerf cubital, nerf sural ou nerf saphène) et reliée au plexus brachial affecté (par exemple, nerf médian, racine C7 ou tronc inférieur)2,3,9. Une modification relativement nouvelle de cette chirurgie implique que la racine C7 non affectée soit directement transférée au nerf C7 affecté par voie préspinale sans aucun espace, ce qui suggère une solution optimale7. À l’heure actuelle, les souris présentent un avantage en termes de spécificité des types cellulaires et de diversité des souches génétiques et sont plus aptes à étudier les mécanismes neurophysiologiques. Ainsi, la chirurgie clinique a été simulée pour établir un protocole d’anastomose directe des racines nerveuses C7 bilatérales par voie préspinale chez la souris et contribuer à l’étude des mécanismes neuronaux sous-jacents à la rééducation lors du transfert nerveux croisé.
Protocole
Toutes les expériences sur les animaux ont été approuvées par le Comité institutionnel de soins aux animaux d’expérimentation de l’Université Fudan et l’Académie chinoise des sciences, conformément aux directives de l’Institut national de la santé. Des souris mâles adultes C57BL/6N âgées de huit semaines ont été utilisées.
1. Configuration préopératoire
- S’assurer d’un stock approprié d’instruments chirurgicaux stérilisés à l’autoclave, d’équipements, de médicaments analgésiques et de médicaments anesthésiques.
- Assurez-vous d’avoir suffisamment d’espace de travail sur une table d’opération.
- Préparez la table d’opération à l’aide d’un panneau de mousse chirurgicale personnalisé recouvert d’une couche comme lit pour la souris. Fixez un coussin chauffant sur le panneau de mousse avec du ruban adhésif médical recouvert de gaze stérile.
- Créez des écarteurs en pliant une aiguille d’acupuncture à l’aide d’une pince vasculaire, en la pliant en deux, puis en pliant la pointe de l’aiguille d’acupuncture pliée en un crochet. Fixez une bande de caoutchouc à l’extrémité de l’aiguille d’acupuncture et utilisez une punaise pour fixer l’extrémité de la bande de caoutchouc à la planche de mousse.
- Calibrer le stéréomicroscope ; Choisissez un stéréomicroscope avec une distance de mise au point adéquate. Couvrez les boutons de zoom/mise au point avec du papier d’aluminium stérilisé pour permettre au chirurgien de les ajuster pendant l’opération. La feuille d’aluminium stérilisée a été placée sur les boutons de zoom/mise au point, ce qui a permis au chirurgien de l’utiliser avec des gants stériles.
2. Anesthésie et préparation de la souris
- Peser la souris et anesthésier en fonction du poids corporel (isoflurane 3%). Assurez-vous que la souris ne réagit pas lorsque les espaces interdigitaux de sa patte sont pincés pour confirmer la profondeur de l’anesthésie. Une profondeur d’anesthésie adéquate doit être maintenue tout au long de l’intervention (1 % d’isoflurane).
- Appliquez la pommade ophtalmique bilatéralement sur les yeux pour éviter l’irritation ou le dessèchement de la cornée pendant la chirurgie.
- Préparez le site chirurgical en rasant la fourrure du cou et de la poitrine à l’aide d’une tondeuse automatique. Retirez et nettoyez les poils lâches.
- Placez la souris en décubitus dorsal sur le coussin chauffant recouvert d’une gaze stérile. Maintenez la température de la souris à 37 °C pendant toute l’opération. Fixez la souris avec du ruban adhésif médical pour provoquer l’abduction horizontale des membres antérieurs et empêcher les membres postérieurs et la queue de bouger. Un champ chirurgical jetable stérilisé avec une ouverture appropriée a été placé sur les souris.
3. Déroulement opératoire
- Injecter du tramadol comme analgésie préventive (20 mg/kg, i.p.). Marquez l’incision transversale sur le bord supérieur de la clavicule. Utilisez trois cycles de gommage alterné de solution de désinfection iodophore et d’éthanol pour désinfecter le site chirurgical. Confirmez la profondeur de l’anesthésie avec un pincement de l’orteil avant la chirurgie.
- À l’aide d’un microscope, faites une incision transversale de 4 mm le long de la marque à l’aide d’un scalpel stérile. Agrandissez l’incision pendant la procédure si nécessaire.
- Disséquez sans ménagement le fascia sous-cutané et identifiez le bord inférieur de la glande sous-maxillaire. Tirez la glande sous-maxillaire vers le haut pour exposer la fosse sus-claviculaire et le sternum.
REMARQUE : Il peut y avoir des vaisseaux sanguins de petit calibre dans cette zone. L’électrocautérisation peut être utilisée pour arrêter les saignements. - Faites une incision partielle de sternotomie médiane (~4 mm) en incisant le sternum de la tête à la queue le long de la ligne médiane. Protégez la plèvre, le cœur et les vaisseaux sanguins pendant la sternotomie.
- Identifiez le muscle sternohyoïdien. Tirez doucement sur le sternum à l’aide de deux petits écarteurs personnalisés faits d’aiguilles d’acupuncture et identifiez le muscle sternohyoïdien, au-dessus de la trachée et de l’œsophage. Rétractez ce muscle pour exposer l’artère carotide, la veine jugulaire interne, le nerf phrénique, le nerf vague, la trachée et l’œsophage.
REMARQUE : Rétractez doucement le sternum pour éviter le pneumothorax ouvert. Contrairement à l’homme, l’œsophage de la souris n’est pas derrière la trachée mais adjacent à la trachée sur le côté gauche. - Identifiez le plexus brachial gauche. Sur le bord latéral de la veine jugulaire interne gauche, tirez le fascia et le tissu adipeux vers l’extérieur pour exposer le plexus brachial. Recherchez le tronc supérieur, composé des nerfs C5 et C6, qui a trois branches. Identifiez le tronc moyen composé du nerf C7 et le tronc inférieur composé des nerfs C8 et T1, le long du tronc supérieur jusqu’à la queue de la souris.
REMARQUE : Il y a des vaisseaux sanguins longitudinaux à la surface du plexus brachial. Utilisez l’électrocautérisation pour éviter les saignements. Lors de la séparation du plexus brachial gauche, protégez le canal chyleux pour éviter une fistule chyleuse. - Récoltez le nerf C7 gauche. Disséquer la division antérieure et la division postérieure du tronc moyen (nerf C7) distalement jusqu’au niveau de la division au cordon sous la clavicule et bloquer le nerf C7 avec 0,1 mL de lidocaïne à 2 % par perfusion locale dans le tronc nerveux. Réséquer le nerf C7 à l’aide de ciseaux à ressort vannas à ses points de fusion avec le cordon latéral et le cordon postérieur. Coupez le nerf C7 de manière à ce que la longueur de chaque division soit similaire.
REMARQUE : Les divisions antérieure et postérieure du nerf C7 et les divisions antérieure et postérieure des troncs supérieur et inférieur s’étendent sur une longue distance avant la confluence, de sorte que le nerf C7 doit être suffisamment libéré avant la résection. En fait, le nerf C7 n’est pas toujours divisé en deux divisions ; Parfois, il est divisé en trois divisions ou même en quatre dans de rares cas. - Retirez la lame ventrale C6 gauche. Protégez soigneusement le nerf phrénique et sévèrez le muscle scalène antérieur au niveau du segment C6 pour exposer la racine nerveuse C7. Coupez les petites branches du nerf C7 innervant le muscle paraspinal avec des micropinces. Retirez doucement le nerf C7 et excissez soigneusement la lame ventrale C6.
REMARQUE : Il y a une proéminence osseuse entre la face médiale de l’artère carotide gauche et la face latérale de l’œsophage. Cette proéminence osseuse est la lamina ventralis de la 6ème vertèbre cervicale. Le muscle longitudinal du bord latéral de la lamina ventralis C6 est le muscle scalène antérieur, et le nerf phrénique passe à la surface du muscle scalène antérieur. - Récoltez le bon nerf C7. Sévèrez le muscle scalène antérieur du côté droit, similaire au côté gauche, et transectez la racine nerveuse C7 droite près du foramen intervertébral. Disséquez le nerf C7 droit à partir de son niveau de division.
REMARQUE : Coupez soigneusement le nerf C7 droit pour éviter d’endommager les vaisseaux sanguins sous le nerf. - Transférez le nerf C7 gauche.
- Retirez partiellement le longus colli musculaire à côté des corps vertébraux des deux côtés. Séparez et élargissez carrément l’espace entre la trachée-œsophage et le corps vertébral.
- Envoyez un demi-pli de sutures en nylon 5-0 du côté droit du corps vertébral vers le côté gauche par la voie prévertébrale.
- Attachez le nerf C7 gauche à l’aide d’un tube de perfusion et guidez le nerf vers le côté droit par la voie préspinale.
- Rétractez doucement la trachée et l’œsophage et faites couler les divisions antérieure et postérieure du nerf C7 gauche à la racine nerveuse C7 droite sans tension à l’aide de sutures en nylon 12-0. Suturez l’épineurium autour des nerfs avec 4-5 points de suture pour coapter fortement les nerfs.
REMARQUE : Il est crucial de choisir un tube de perfusion en plastique d’épaisseur appropriée. Un tube trop mince pourrait endommager le nerf, et un tube trop épais pourrait endommager la trachée et l’œsophage. De plus, l’espace entre la trachée-œsophage et le corps vertébral est un espace en forme de « V », et couper une partie du longus colli musculaire peut raccourcir la voie de transfert.
4. Fermeture de la plaie
- Irriguer la plaie avec une solution saline normale stérile et la sécher avec de la gaze stérile.
- Suturez le sternum et fermez la peau à l’aide de sutures monofilament 5-0.
5. Soins postopératoires
- Attendez que la souris se réveille de l’anesthésie. Transférez la souris dans une cage propre, sans litière, mais réchauffée avec une couverture chauffante. Observez la souris jusqu’à ce qu’elle soit ambulatoire. Utilisez le tramadol (20 mg/kg, i.p.) comme analgésie postopératoire.
- Placez les souris dans une cage de récupération et surveillez-la jusqu’à ce qu’elles se rétablissent. Rétablir l’eau et l’alimentation des souris après l’opération. Surveillez les souris après l’opération tous les jours pour détecter des signes de déficience ou d’infection, notamment la malnutrition, la posture voûtée et la fourrure ébouriffée. Deux semaines après la chirurgie, le retrait de la suture devrait avoir lieu.
REMARQUE : Appliquez la pommade à l’érythromycine sur la surface de la plaie tous les jours pendant trois jours consécutifs. - Si des complications, telles qu’un œdème de la plaie, sont observées, elles doivent être immédiatement résolues.
6. Analyse comportementale
REMARQUE : Tous les tests et analyses comportementaux ont été effectués par un observateur aveugle aux groupes expérimentaux.
- Test de cylindre
REMARQUE : Le test du cylindre évalue l’utilisation des membres antérieurs lors de l’exploration verticale spontanée à l’intérieur d’un cylindre à 4 et 8 semaines après la chirurgie21.- Placez les souris dans un cylindre transparent (diamètre 9 cm, hauteur 15 cm) sur un cadre surélevé.
- Pour faciliter l’observation et l’enregistrement, fixez un miroir à un angle de 45° sous le cylindre.
- Enregistrez l’élevage spontané de chaque souris observée à l’aide du miroir pendant 10 min.
- Déterminez manuellement la durée pendant laquelle (i) la patte droite, (ii) la patte gauche ou (iii) les deux pattes sont entrées en contact avec les parois vitrées. Comptez un total de 20 mouvements au cours de chaque séance. Excluez de l’analyse les souris qui ne sont pas actives pendant le test.
- Évaluez les performances du test comme suit :
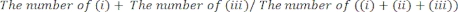
- Test de marche sur la grille
REMARQUE : Le test de la grille évalue le placement précis des pattes antérieures sur les barreaux d’une grille lors de l’exploration spontanée à 4 et 8 semaines après la chirurgie. Chapitre 22.- Placez les souris sur une grille métallique (20 cm x 24 cm) avec des trous carrés de 25 mm et laissez-les explorer librement pendant 10 minutes tout en enregistrant leur performance avec une caméra vidéo.
- Marquez une glissade dans l’un des cas suivants :
- Recherchez les cas où la patte manque complètement un échelon (auquel cas le membre tombe entre les barreaux et l’animal perd l’équilibre).
- Recherchez les cas où la patte est correctement placée sur un échelon mais glisse tout en supportant le poids du corps.
- Exprimez le résultat du test sous la forme d’un glissement du pied d’un membre antérieur droit / d’un glissement total du pied. Bien que ni le test de cylindre ni le test de marche sur grille ne nécessitent de formation, obtenez des scores de base en testant chaque animal une fois avant la chirurgie.
Résultats
Les lésions cérébrales unilatérales provoquent souvent un dysfonctionnement permanent du membre controlatéral en raison des limites de la plasticité neuronale compensative chez l’adulte10,11. Précédemment, nous avons rapporté que la chirurgie CC7 pouvait être utilisée pour traiter les membres supérieurs hémiplégiques chez les patients adultes après une lésion cérébrale7. Afin d’évaluer l’efficacité du protocole d’anastomose directe des nerfs C7 bilatéraux par voie préspinale, nous avons réalisé la chirurgie de transfert de nerfs croisés chez la souris à la suite d’un traumatisme craniocérébral unilatéral (TCC). La figure 1 décrit les procédures de TCC et vérifie l’étendue et l’effet des dommages. Tout d’abord, un impacteur de contusion corticale électrique (eCCI) a été utilisé pour endommager le cortex cérébral de l’hémisphère gauche (antéropostérieur = +1,0 mm à -2,0 mm, médiolatéral = 0,5 mm à 3,5 mm) chez des souris adultes afin d’entraîner une lésion cérébrale unilatérale. Après 2 semaines, les structures anatomiques ont confirmé que ce protocole de TCC détruisait presque complètement le cortex sensorimoteur, un lieu important pour initier les mouvements. Ces souris atteintes d’un traumatisme crânien unilatéral présentaient des anomalies motrices importantes du membre antérieur droit.
La figure 2 décrit les procédures CC7. Le diagramme de trajectoire de la chirurgie CC7 a révélé que la voie A, représentant la voie préspinale, était l’approche la plus courte par rapport aux autres. La longueur du trajet A est encore plus faible que la longueur du nerf C7 prélevé sur le côté gauche (côté non paralysé). Cette découverte a fourni la base anatomique pour le choix de la voie prévertébrale pour compléter la chirurgie de transfert nerveux. La chirurgie CC7 a été réalisée en anastomose directe par voie prévertébrale deux semaines après le traumatisme crânien. Le nerf cervical 7 (C7) du côté non paralysé a été directement transféré du côté paralysé au lieu d’établir ses connexions cérébrales d’origine. La figure 3 montre les résultats de la microscopie électronique qui a révélé que le nerf C7 transféré s’était régénéré avec succès. L’épaisseur de la gaine de myéline du nerf C7 transféré a augmenté progressivement, à partir de 4 semaines après la chirurgie CC7, et était presque comparable à celle du groupe témoin à 8 semaines après la chirurgie CC7. La figure 4 identifie la réinnervation musculaire du nerf C7 transféré à l’aide d’enregistrements électromyographiques. La stimulation électrique de l’extrémité proximale de l’anastomose du nerf C7 induit de manière stable des potentiels d’action dans plusieurs muscles du membre antérieur affecté à 4 semaines postopératoires, en accord avec les résultats de la microscopie électronique. La figure 5 montre que le nerf C7 transféré contient des fibres motrices de la corne ventrale et des fibres sensorielles des ganglions de la racine dorsale du segment C7 de la moelle épinière du côté sain grâce au marquage rétrograde de la sous-unité B de la toxine cholérique (CTB).
La figure 6 montre que le modèle murin présentait également une récupération motrice significative après un traumatisme crânien unilatéral, ce qui est cohérent avec les résultats des études cliniques. Pour vérifier l’effet de la chirurgie CC7 sur la récupération de la fonction motrice blessée après un traumatisme crânien, un groupe TCC + Sham et un groupe témoin + simulacre ont été établis. Les souris du groupe TCC + Sham et du groupe TBI + CC7 ont reçu simultanément les mêmes procédures pour les lésions TCC, tandis que les souris du groupe Control + Sham n’ont subi qu’une chirurgie fictive. Alors que les souris du groupe TBI + CC7 ont subi une chirurgie de transfert nerveux, les souris du groupe TBI + simulacre et du groupe témoin + Sham ont subi une résection bilatérale du nerf cervical 7 (C7). Dans les tests de cylindre, le groupe TBI + CC7 a montré un taux d’utilisation significativement plus élevé du membre antérieur altéré que le groupe TBI à la fois 4 et 8 semaines après la chirurgie CC7 (p < 0,01). Dans les tests de marche sur grille, le groupe TBI + CC7 a montré un taux d’erreur inférieur à celui du groupe TBI à 4 semaines après la chirurgie CC7. De plus, le taux d’erreur du groupe TCC + CC7 était significativement inférieur à celui du groupe TCC à 8 semaines après la chirurgie CC7 (p < 0,05). Ces résultats comportementaux ont montré que la chirurgie CC7 pouvait améliorer la fonction motrice du membre affecté chez les souris ayant subi un traumatisme crânien. Ensemble, ces résultats suggèrent que le nerf C7 transféré reconstruit par la chirurgie CC7 par voie prévertébrale a été régénéré avec succès et a réinnervé le membre antérieur altéré, contribuant ainsi à la restauration motrice chez les souris adultes ayant subi un traumatisme crânien unilatéral.
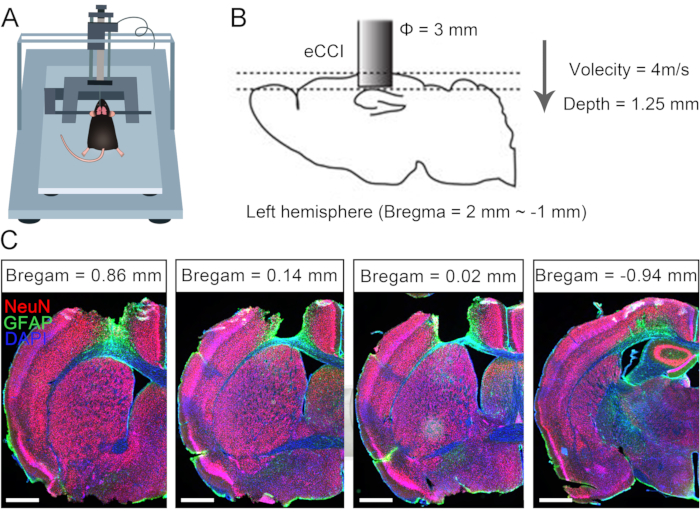
Figure 1 : Caractérisation d’un traumatisme crânien unilatéral. (A) Schéma montrant la position de la souris dans l’iCCI. (B) Les paramètres et la plage d’endommagement de l’eCCI. (C) Coupe coronaire représentative montrant le cortex lésionné (2 semaines après le traumatisme crânien, barre d’échelle = 500 μm). Abréviation : eCCI = electric cortical contusion impactor. Veuillez cliquer ici pour voir une version agrandie de cette figure.
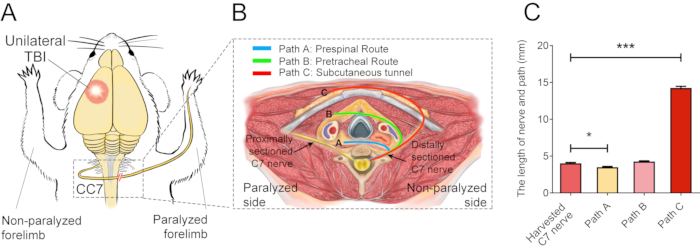
Figure 2 : Schéma chirurgical élémentaire. (A) Schéma de principe montrant le plan expérimental pour effectuer le transfert du nerf C7 controlatéral chez les souris ayant subi un traumatisme crânien. Le cercle rouge indique la position du traumatisme. La double barre oblique rouge à l’intérieur du rectangle pointillé montre le nerf suturé. (B) Une coupe transversale montre trois voies alternatives de transfert du nerf C7 controlatéral chez la souris. Chemin A, la ligne bleue représente la voie préspinale du nerf transféré ; Le chemin B, la ligne verte, représente la voie prétrachéale du nerf transféré ; Le chemin C, la ligne rouge, représente le tunnel sous-cutané du nerf transféré. (C) Le graphique montre la longueur des voies et le nerf C7 récolté en (B). La longueur du trajet A (3,3 ± 0,10 mm) était significativement inférieure à la longueur du nerf C7 prélevé (4,05 ± 0,11 mm ; * p < 0,05, ANOVA à un facteur, n = 20 dans chaque groupe). La longueur du trajet C (14,15 ± 0,20 mm) était significativement supérieure à celle du nerf C7 prélevé (*** p < 0,001, ANOVA à un facteur, n = 20 dans chaque groupe). La longueur du trajet B était de 4,2 ± 0,08 mm (n = 20). Veuillez cliquer ici pour voir une version agrandie de cette figure.
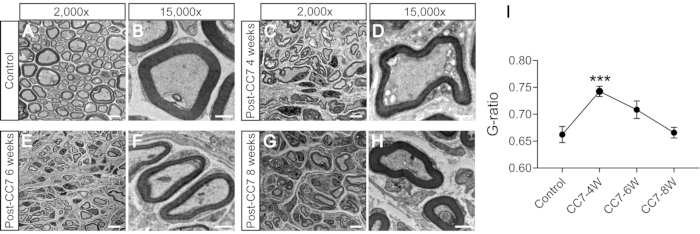
Figure 3 : L’analyse par microscopie électronique d’une coupe transversale du nerf. (A,B) Images du nerf chez les souris témoins. Barre d’échelle = 5 μm (A) et 1 μm (B). (C,D) Images du nerf régénéré un mois après la chirurgie. Barre d’échelle = 5 μm (C) et 1 μm (D). (E, F) Images du nerf régénéré à un moment donné, cinq mois après la chirurgie. Barre d’échelle = 5 μm (E) et 1 μm (F). (G, H) Image du nerf régénéré deux mois après la chirurgie. Barre d’échelle = 5 μm (G) et 1 μm (H). Grossissement de A, C, E et G, 2 000x ; grossissement de B, D, F et H, 15 000x. (I) Le rapport G (le rapport entre le diamètre interne et le diamètre extérieur de la gaine de myéline) est plus faible dans les échantillons du groupe témoin que dans les échantillons de 4 semaines et égal aux échantillons à 6-8 semaines après la chirurgie (*** : p < 0,001 ; comparaison à différents axones de groupe avec le test t ; n = 3 souris dans chaque groupe). Abréviations : CC7 = transfert du septième nerf cervical controlatéral ; CC7-XW = X semaines après la chirurgie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
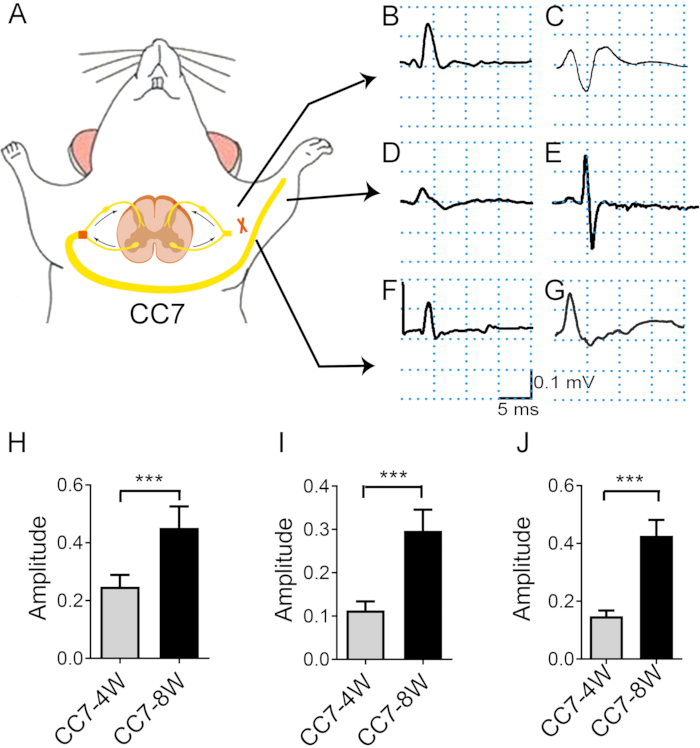
Figure 4 : L’analyse de l’électromyographie après le transfert du nerf C7 controlatéral indique le taux de régénération nerveuse. (A) Schéma de principe montrant la stimulation par transfert électronique et l’enregistrement de l’électromyographie in vivo. L’intensité de la stimulation a été la même tout au long du test (2 mA). Le site de stimulation est le nerf C7 proximal de l’anastomose. (B, C) Photographies montrant le potentiel d’action enregistré au grand pectoral à deux semaines (B) et quatre semaines (C) après la chirurgie. (D, E) L’EMG a été enregistré dans l’extenseur des doigts 4 semaines (D) et 8 semaines (E) après la chirurgie. (F) À trois semaines, des CMAP sont apparus dans le triceps brachial. (G) À quatre et huit semaines, les CMAP du triceps brachial ont augmenté. (H) L’amplitude moyenne du grand pectoral a atteint ~0,25 mV ± 0,16 mV à 4 semaines contre 0,45 mV ± 0,03 mV à 8 semaines, montrant une différence significative entre les deux points temporels (*** p < 0,001, test t, n = 6 dans chaque groupe). (I) L’amplitude moyenne du triceps brachial a atteint ~0,15 mV ± 0,01 mV à 4 semaines contre 0,46 mV ± 0,02 mV à 8 semaines, montrant une différence significative entre les deux points temporels (*** : p < 0,001, test t, n = 6 dans chaque groupe). (J) L’amplitude moyenne de l’extenseur des doigts a atteint ~0,11 mV ± 0,01 mV à 4 semaines contre 0,29 mV ± 0,02 mV à 8 semaines, montrant une différence significative entre les deux points de temps (*** : p < 0,001, test t, n = 6 dans chaque groupe). Abréviations : EMG = électromyographie ; CMAP = potentiel d’action musculaire composé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
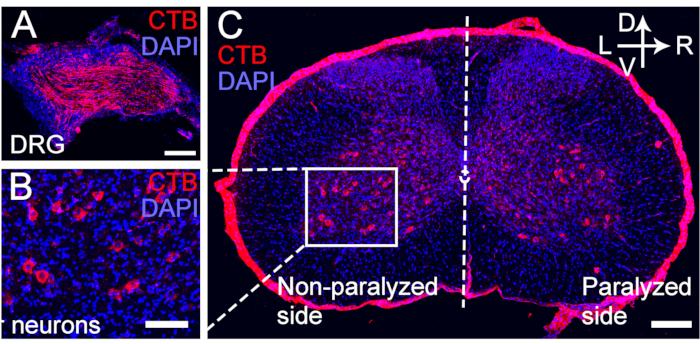
Figure 5 : Marquage rétrograde CTB des neurones moteurs et sensoriels du nerf C7 transféré. (A-C) Le CTB a été injecté à l’extrémité distale de l’anastomose du nerf C7 4 semaines après la chirurgie CC7. (UNE) Les neurones sensoriels ont été marqués pour le DRG. (B, C) Les motoneurones du nerf C7 transféré ont été marqués pour la corne antérieure de la colonne vertébrale. Grossissement, 20x. Barre d’échelle = 200 μm (A, B) ; 100 μm (C). Abréviations : CTB = sous-unité B de la toxine cholérique ; DRG = ganglion de la racine dorsale ; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
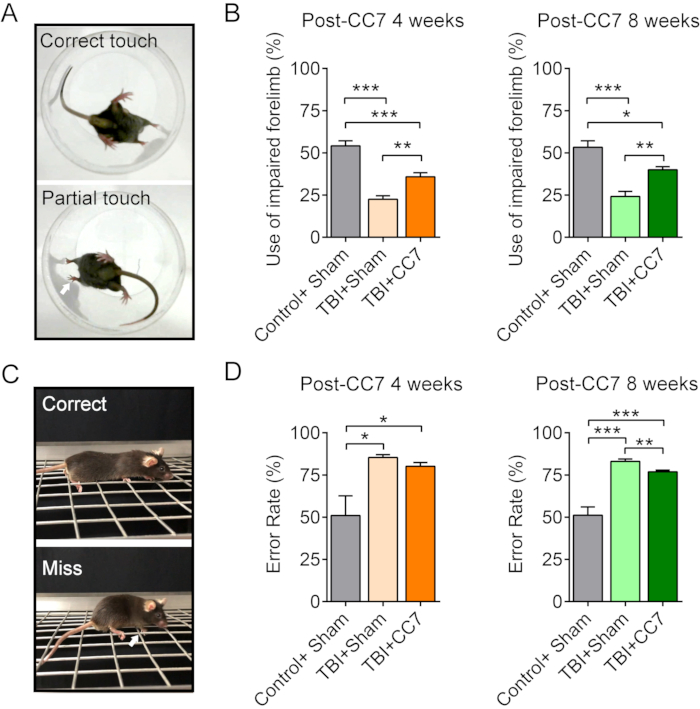
Figure 6 : Changements de comportement après une chirurgie CC7. (A) Les images montrent le test du cylindre des souris. (B) Graphique récapitulatif montrant l’effet du transfert de CC7 à 4 semaines et 8 semaines après la chirurgie sur les souris TCC (n = 6 souris). p = 0,001 ; Test t non apparié. L’utilisation moyenne du membre antérieur altéré était de 54,17 % ± 3,01 % dans le groupe témoin + simulacre contre 22,5 % ± 2,14 % dans le groupe TCC + simulacre ; 35,83 % ± 2,39 % dans le groupe TCC + CC7 à 4 semaines après la chirurgie CC7, ce qui indique une différence significative (ANOVA à un facteur ; p < 0,05, n = 6 dans chaque groupe). À 8 semaines après le transfert CC7, l’utilisation était de 53,33 % ± 3,80 %, 24,17 % ± 3,01 % et 40,00 % ± 1,83 % dans les groupes témoin + simulacre, TBI + simulacre et TBI + CC7, respectivement, une différence significative (*p < 0,05, ANOVA à un facteur, n = 6 dans chaque groupe). (C) Les images montrent le test de marche sur la grille. (D) Le graphique montre que les taux d’erreur moyens des membres antérieurs atteints d’insuffisance dans le groupe TCC + Simulacre étaient de 85,41 % ± 1,59 % (n = 6), ce qui équivaut à 80,17 % ± 2,19 % (n = 6) dans le groupe TCC + Simulacre (50,99 % ± 11,69 %). À 8 semaines après la chirurgie, le taux d’erreur dans le groupe TCC + CC7 était de 76,87 ± 1,07 % (n = 6), ce qui est significativement inférieur à celui du groupe TCC + Sham (83,06 % ± 1,41 % ; p < 0,05, ANOVA à un facteur, n = 6 dans chaque groupe). Abréviations : CC7 = transfert du septième nerf cervical controlatéral ; TCC = traumatisme crânien. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En clinique, la chirurgie de transfert de nerfs croisés a été utilisée pour traiter les patients présentant une lésion d’avulsion du plexus brachial et après des lésions cérébrales, telles qu’un accident vasculaire cérébral et un traumatisme crânien 7,9,12. Notamment, les lésions cérébrales sont une affection neurologique grave qui peut entraîner plusieurs complications, notamment l’épilepsie, la hernie cérébrale et l’infection13. Tous les patients atteints d’une lésion cérébrale unilatérale ne sont pas aptes à subir une chirurgie CC7. En général, la chirurgie CC7 a été réalisée chez les patients atteints d’hémiplégie centrale au stade chronique (6 mois après la lésion) afin d’éviter autant que possible l’influence de l’œdème cérébral. Les patients présentant des troubles cognitifs et une tétraplégie après des lésions cérébrales sont exclus du traitement de la chirurgie CC7.
La plupart des études ont rapporté l’utilisation d’une approche sous-cutanée et d’une anastomose de greffe de nerf sural ou ulnaire pour transférer la racine nerveuse C7 controlatérale14,15. Cependant, la régénération nerveuse par de telles méthodes nécessite six mois, ce qui peut entraver le processus de récupération motrice et même potentiellement influencer la plasticité cérébrale14. Dans des études antérieures, le transfert controlatéral de C7 a été effectué chez le rat, et le nerf C7 bilatéral a été utilisé via 4 brins du nerf sural autogreffé interpositionnel. Cependant, aucun transfert du nerf C7 par voie prévertébrale n’a été signalé chez la souris. Nous avons effectué une chirurgie CC7 de la voie préspinale modifiée chez la souris et vérifié la vitesse de récupération fonctionnelle après transfert du nerf C7. Dans cette étude, le transfert du nerf C7 controlatéral par voie prévertébrale a amélioré la fonction des membres paralysés un mois après la chirurgie, reflétant un temps de récupération plus court du modèle animal de greffe de nerf. Par conséquent, ce modèle pourrait simuler avec précision des situations cliniques et jeter les bases d’autres expériences.
Comment disséquer la racine nerveuse et réduire le risque sont des questions essentielles pour le transfert de C7. Contrairement à l’homme, le plexus brachial de la souris est situé dans la poitrine sous la clavicule 5,16. Par conséquent, la stratégie d’accès a dû être modifiée pour permettre l’observation de la racine du nerf C7 et de la colonne vertébrale17. La sternotomie est une approche opératoire sûre et efficace et est couramment appliquée dans les expériences sur la souris en chirurgie cardiothoracique18,19. La lame ventrale C6 est également un obstacle au transfert des nerfs. Ainsi, une chirurgie de sternotomie a été réalisée pour disséquer la racine nerveuse C7 et sectionner la lamina ventrali C6 afin de raccourcir la distance de transfert.
Bien que la voie préspinale puisse augmenter considérablement le taux de réussite de l’anastomose directe de la chirurgie de transfert nerveux, toutes les souris ne peuvent pas être anastomosées directement. Cela est principalement dû aux différences anatomiques de ces souris. Le tronc moyen (nerf C7) fusionne avec le tronc supérieur ou inférieur à un endroit très proche du foramen intervertébral. Ainsi, la longueur des nerfs C7 disponibles pour la récolte est insuffisante. À l’heure actuelle, la seule approche est la transplantation nerveuse ou le remplacement de souris. Ce modèle est généralement utilisé chez les souris âgées de 8 semaines (20 à 25 g), car les souris sont matures et les nerfs C7 sont de taille suffisante pour être manipulés. Bien que ce protocole chirurgical soit également applicable aux jeunes souris, la difficulté de l’opération augmentera considérablement chez les souris plus jeunes.
La fonction motrice des membres antérieurs des souris du groupe TBI + CC7 a été significativement augmentée à un mois et deux mois, ce qui suggère que le nerf C7 transféré a contribué à la récupération du membre antérieur altéré. La remyélinisation est essentielle à la récupération neuronale fonctionnelle. Une étude antérieure a montré que les gaines de myéline des nerfs lésés se régénéraient après un mois, ce qui est cohérent avec ces résultats20. Ici, le nerf transféré a progressivement mûri, ce qui était cohérent avec le test comportemental. L’électromyographie a été utilisée pour tester davantage le taux de récupération fonctionnelle après le transfert de nerfs. Les résultats ont démontré que le nerf transféré innervait le muscle affecté 4 semaines après l’opération. Notamment, cette étude est la première à déterminer le moment de la réinnervation avec une anastomose directe après une chirurgie de transfert nerveux croisé.
En résumé, nous avons simulé une chirurgie clinique pour établir un protocole d’anastomose directe des nerfs bilatéraux du plexus brachial par voie préspinale chez la souris et confirmé la fonction du nerf déplacé. Le modèle murin a contribué à l’élucidation des mécanismes neuronaux sous-jacents à la rééducation lors du transfert nerveux croisé après des lésions du système nerveux central et périphérique.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (82071406, 81902296 et 81873766).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
Références
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t, Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784(2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676(2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231(2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562(2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon