Method Article
Ein Mausmodell der direkten Anastomose über den präspinalen Weg für die kreuzende Nerventransferchirurgie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir simulierten klinische Operationen, um ein Protokoll der direkten Anastomose von bilateralen Plexusnerven brachialis über den präspinalen Weg in Mäusen zu erstellen und trugen so zur Untersuchung der neuronalen Mechanismen bei, die der Rehabilitation nach kreuzendem Nerventransfer nach Verletzungen des zentralen und peripheren Nervensystems zugrunde liegen.
Zusammenfassung
Die Kreuzungsnerventransferchirurgie ist ein wirksamer Ansatz zur Reparatur verletzter oberer Extremitäten bei Patienten mit Verletzungen des Plexus brachialis. In jüngster Zeit wurde diese Operation kreativ in der klinischen Behandlung von Hirnverletzungen eingesetzt und erreichte eine substanzielle Rehabilitation des gelähmten Arms. Diese funktionelle Erholung nach der Operation deutet darauf hin, dass die periphere sensomotorische Intervention eine tiefgreifende Neuroplastizität induziert, um den Funktionsverlust nach einer Hirnschädigung zu kompensieren. Der zugrundeliegende neuronale Mechanismus ist jedoch nur unzureichend verstanden. Daher ist ein emergentes klinisches Tiermodell erforderlich. Hier simulierten wir eine klinische Operation, um ein Protokoll der direkten Anastomose bilateraler Plexusnerven brachialis über den präspinalen Weg in Mäusen zu erstellen. Neuroanatomische, elektrophysiologische und Verhaltensexperimente halfen zu identifizieren, dass die übertragenen Nerven dieser Mäuse die beeinträchtigte Vordergliedmaße erfolgreich reinnervierten und zur Beschleunigung der motorischen Erholung nach einer Hirnverletzung beitrugen. Daher enthüllte das Mausmodell die neuronalen Mechanismen, die der Rehabilitation beim kreuzenden Nerventransfer nach Verletzungen des zentralen und peripheren Nervensystems zugrunde liegen.
Einleitung
Der Plexus brachialis (BP) besteht aus fünf Nerven mit unterschiedlichen Wirbelsäulensegmenten (C5-T1), die für Empfindungen und Bewegungen in Arm, Hand und Fingern verantwortlich sind. Nach dem Austritt dieser fünf Blutdrucknerven aus dem Rückenmark verschmelzen sie zu drei Nervenstämmen: dem oberen (gebildet durch die Verschmelzung von C5 und C6), dem medialen (von C7) und dem inferioren (Äste von C8 und T1). Schwere Verletzungen, insbesondere durch Verkehrsunfälle, führen häufig zu einem Abriss der Blutdrucknervenwurzeln, und eine solche Funktionsstörung hat verheerende Auswirkungen auf die Patienten1. Als leistungsfähiger klinischer Ansatz wurde die Kreuzungsnerventransferchirurgie durchgeführt, um Abrissverletzungen des Blutdrucks zu reparieren, indem die verletzten Nervenenden wieder mit der gesunden Seite des Blutdrucks verbundenwerden 2,3. Diese Operation führt bei Patienten zu funktionellen Verbesserungen der verletzten Hände und einer direkten Reorganisation des sensomotorischen Kortex in beiden Hemisphären4. Tierexperimentelle Studien haben gezeigt, dass eine drastische Reorganisation in den kortikalen Schaltkreisen nach der Kreuzung des Nerventransfers induziert wurde5. Da die periphere sensomotorische Modifikation die ruhende Plastizität des reifen Gehirns reaktivieren kann, zeigt die Kreuzungsnerventransferchirurgie auch ein großes Potenzial bei der Reparatur von Hirnverletzungen6.
Kürzlich haben wir die Möglichkeit der kreativen Nutzung des Kreuznerventransfers als neue periphere Nervenveränderungsstrategie für Probleme mit dem zentralen Nervensystem bestätigt. Eine Art Kreuzungsnerventransfer-Operation, der kontralaterale zervikale Siebtnervtransfer (CC7), wurde angewendet, um eine signifikante funktionelle Erholung des gelähmten Arms zu erreichen, indem der C7-Nerv beim Patienten nach einer Hirnverletzung von der nicht gelähmten Seite auf die gelähmte Seite übertragen wurde7. Eine Besonderheit dieses chirurgischen Eingriffs ist, dass die sensorischen und motorischen Signale der gelähmten oberen Extremität über den verschobenen Nerv "links-rechts-Crossover" an die kontraläsionale Hemisphäre übermittelt werden. Bemerkenswert ist, dass die durch die CC7-Operation verursachte funktionelle Wiederherstellung nicht auf die Funktion beschränkt ist, die vom C7-Nerv selbst innerviert wird8. Darüber hinaus kann die CC7-Chirurgie nicht nur zur Behandlung von Kindern mit Zerebralparese eingesetzt werden, sondern auch zur Rehabilitation von Schlaganfallpatienten mittleren und älteren Alters. Daher gibt es genügend Gründe für die Annahme, dass der kreuzende Nerventransfer die Neuroplastizität stimulieren kann, um die motorische Erholung von Hirnschäden durch Modulation des peripheren sensomotorischen Systems zu beschleunigen.
Obwohl die Kreuzungsnerventransferchirurgie eine erhebliche Rehabilitation in der klinischen Behandlung von Verletzungen des Plexus brachialis (BPI) und des Gehirns erreicht hat, sind die neuronalen Mechanismen, die dieser Operation zugrunde liegen, nach wie vor unzureichend verstanden. Das Fehlen eines geeigneten Tiermodells mit klinischen Merkmalen hat die Untersuchung interner Mechanismen eingeschränkt. Traditionell wird in der Klinik die kontralateral zur Läsion liegende C7-Nervenwurzel durch ein Nerventransplantat (z. B. Nervus ulnaris, Nervus suralis oder Nervus saphenosa) auf die verletzte Seite übertragen und mit dem betroffenen Plexus brachialis (z. B. Nervus medianus, Wurzel C7 oder unterer Stamm) verbunden2,3,9. Eine relativ neue Modifikation dieser Operation besteht darin, dass die nicht betroffene C7-Wurzel über den präspinalen Weg ohne Lücke direkt auf den betroffenen C7-Nerv übertragen wird, was eine optimale Lösung nahelegt7. Derzeit zeigen Mäuse einen Vorteil in der Zelltypspezifität und der genetischen Stammvielfalt und sind besser geeignet, neurophysiologische Mechanismen zu untersuchen. Daher wurde eine klinische Chirurgie simuliert, um ein Protokoll für die direkte Anastomose von bilateralen C7-Nervenwurzeln über den präspinalen Weg in Mäusen zu etablieren und zur Untersuchung der neuronalen Mechanismen beizutragen, die der Rehabilitation nach dem kreuzenden Nerventransfer zugrunde liegen.
Protokoll
Alle Tierversuche wurden vom Komitee für die institutionelle Pflege von Versuchstieren der Fudan-Universität und der Chinesischen Akademie der Wissenschaften in Übereinstimmung mit den Richtlinien des National Institute of Health genehmigt. Es wurden acht Wochen alte erwachsene männliche C57BL/6N-Mäuse verwendet.
1. Präoperativer Aufbau
- Stellen Sie einen angemessenen Vorrat an autoklavierten, sterilisierten chirurgischen Instrumenten, Geräten, Analgetika und Anästhetika sicher.
- Sorgen Sie für ausreichend Arbeitsfläche auf einem Operationstisch.
- Bereiten Sie den Operationstisch mit einer mit Windeln überzogenen, maßgeschneiderten chirurgischen Schaumstoffplatte als Bett für die Maus vor. Befestigen Sie ein Wärmekissen mit medizinischem Klebeband, das mit steriler Gaze bedeckt ist, auf der Schaumstoffplatte.
- Erstellen Sie Retraktoren, indem Sie eine Akupunkturnadel mit einer Gefäßzange biegen, in der Mitte falten und dann die Spitze der gefalteten Akupunkturnadel zu einem Haken biegen. Befestigen Sie einen Gummistreifen am Ende der Akupunkturnadel und befestigen Sie das Ende des Gummistreifens mit einer Reißzweckenreißzwecke an der Schaumstoffplatte.
- Kalibrieren Sie das Stereomikroskop; Wählen Sie ein Stereomikroskop mit einem ausreichenden Fokusabstand. Decken Sie die Zoom-/Fokustasten mit sterilisierter Aluminiumfolie ab, damit der Chirurg sie während der Operation einstellen kann. Die sterilisierte Aluminiumfolie wurde auf die Zoom-/Fokustasten gelegt, so dass der Chirurg sie mit sterilen Handschuhen verwenden konnte.
2. Anästhesie und Vorbereitung der Maus
- Wiegen Sie die Maus und betäuben Sie sie entsprechend dem Körpergewicht (Isofluran 3%). Stellen Sie sicher, dass die Maus nicht reagiert, wenn die Zwischenräume ihrer Pfote eingeklemmt werden, um die Tiefe der Anästhesie zu bestätigen. Während des gesamten Eingriffs sollte eine ausreichende Anästhesietiefe beibehalten werden (1% Isofluran).
- Tragen Sie die Augensalbe beidseitig auf die Augen auf, um eine Reizung oder Austrocknung der Hornhaut während der Operation zu verhindern.
- Bereiten Sie die Operationsstelle vor, indem Sie das Fell an Hals und Brust mit einer automatischen Haarschneidemaschine rasieren. Entferne und reinige die losen Haare.
- Legen Sie die Maus in Rückenlage auf das mit steriler Gaze bedeckte Wärmekissen. Halten Sie die Temperatur der Maus während des gesamten Vorgangs bei 37 °C. Fixieren Sie die Maus mit medizinischem Klebeband, um die Vordergliedmaßen horizontal abduzieren zu lassen und zu verhindern, dass sich die Hintergliedmaßen und der Schwanz bewegen. Den Mäusen wurde ein sterilisiertes Einweg-OP-Tuch mit entsprechender Öffnung aufgesetzt.
3. Operativer Ablauf
- Injizieren Sie Tramadol als präventive Analgesie (20 mg/kg, i.p.). Markieren Sie den Querschnitt am oberen Rand des Schlüsselbeins. Verwenden Sie drei Zyklen abwechselnder Peelings aus Jodophor-Desinfektionslösung und Ethanol, um die Operationsstelle zu desinfizieren. Bestätigen Sie die Tiefe der Anästhesie vor der Operation mit einem Zwicken der Zehen.
- Arbeiten Sie unter einem Mikroskop und machen Sie mit einem sterilen Skalpell einen 4 mm langen Querschnitt entlang der Markierung. Vergrößern Sie den Schnitt während des Eingriffs nach Bedarf.
- Stumpf durch die subkutane Faszie sezieren und den unteren Rand der Unterkieferdrüse identifizieren. Ziehen Sie die Unterkieferdrüse nach oben, um die Fossa supraclavicularis und das Brustbein freizulegen.
HINWEIS: In diesem Bereich können sich kleinkalibrige Blutgefäße befinden. Elektrokauter kann verwendet werden, um Blutungen zu stoppen. - Machen Sie einen partiellen medianen Sternotomieschnitt (~4 mm), indem Sie das Brustbein vom Kopf bis zum Schwanz entlang der Mittellinie einschneiden. Schützen Sie das Rippenfell, das Herz und die Blutgefäße während der Sternotomie.
- Identifiziere den Musculus sternohyoideus. Ziehen Sie vorsichtig am Brustbein mit zwei kleinen, maßgeschneiderten Retraktoren aus Akupunkturnadeln und identifizieren Sie den Sternohyoideus-Muskel über der Luftröhre und der Speiseröhre. Ziehen Sie diesen Muskel zurück, um die Halsschlagader, die innere Halsschlagader, den Nervus phrenicus, den Vagusnerv, die Luftröhre und die Speiseröhre freizulegen.
HINWEIS: Ziehen Sie das Brustbein vorsichtig zurück, um einen offenen Pneumothorax zu vermeiden. Anders als beim Menschen befindet sich die Speiseröhre der Maus nicht hinter der Luftröhre, sondern auf der linken Seite neben der Luftröhre. - Identifiziere den linken Plexus brachialis. Am lateralen Rand der linken inneren Halsvene ziehen Sie die Faszie und das Fettgewebe nach außen, um den Plexus brachialis freizulegen. Achten Sie auf den oberen Stamm, der aus den Nerven C5 und C6 besteht und drei Äste hat. Identifizieren Sie den mittleren Rumpf, der aus dem Nervus C7 besteht, und den unteren Rumpf, der aus den Nerven C8 und T1 besteht, entlang des oberen Rumpfes bis zum Schwanz der Maus.
HINWEIS: Auf der Oberfläche des Plexus brachialis befinden sich longitudinale Blutgefäße. Verwenden Sie Elektrokauter, um Blutungen zu vermeiden. Bei der Abtrennung des linken Plexus brachialis ist der chylöse Kanal zu schützen, um eine chylöse Fistel zu vermeiden. - Entnehmen Sie den linken C7-Nerv. Die vordere und hintere Teilung des mittleren Rumpfes (Nervus C7) wird distal bis zur Teilungsebene unter dem Schlüsselbein präpariert und der Nervus C7 mit 0,1 ml 2%igem Lidocain durch lokale Infusion in den Nervenstamm blockiert. Den Nervus C7 mit einer Vannas-Federschere an den Verbindungsstellen mit dem lateralen und hinteren Strang resezieren. Kürzen Sie den Nervus C7 so, dass die Länge beider Abschnitte ähnlich ist.
HINWEIS: Die vorderen und hinteren Abschnitte des Nervus C7 und die vorderen und hinteren Abschnitte des oberen und unteren Rumpfes verlaufen über eine lange Strecke vor dem Zusammenfluss, so dass der Nervus C7 vor der Resektion ausreichend befreit werden sollte. Tatsächlich ist der Nervus C7 nicht immer in zwei Abteilungen unterteilt; Manchmal ist sie in drei Abteilungen unterteilt, in seltenen Fällen sogar in vier. - Entfernen Sie die linke C6 Lamina ventralis. Schützen Sie den Nervus phrenicus vorsichtig und schneiden Sie den Musculus scalene anterior auf Höhe des C6-Segments ab, um die Nervenwurzel C7 freizulegen. Schneiden Sie kleine Äste des Nervs C7, der den paraspinalen Muskel innerviert, mit einer Mikrozange ab. Ziehen Sie den Nervus C7 vorsichtig heraus und entfernen Sie vorsichtig die Lamina ventralis C6.
HINWEIS: Zwischen der medialen Seite der linken Halsschlagader und der lateralen Seite der Speiseröhre besteht ein knöcherner Vorsprung. Bei diesem knöchernen Vorsprung handelt es sich um die Lamina ventralis des 6. Halswirbels. Der Längsmuskel des lateralen Randes der Lamina ventralis C6 ist der Musculus scalene anterior, und der Nervus phrenicus verläuft auf der Oberfläche des Musculus scalene anterior. - Ernten Sie den richtigen C7-Nerv. Den Musculus scalene anterior auf der rechten Seite, ähnlich wie auf der linken Seite, ausschneiden und die rechte Nervenwurzel C7 in der Nähe des Foramen intervertebralis durchtrennen. Sezieren Sie den rechten C7-Nerv von seiner Teilungsebene.
HINWEIS: Durchtrennen Sie vorsichtig den rechten C7-Nerv, um eine Schädigung der Blutgefäße unter dem Nerv zu vermeiden. - Transferieren Sie den linken Nerv C7.
- Entfernen Sie den muskulären Longus colli neben den Wirbelkörpern teilweise auf beiden Seiten. Trennen und erweitern Sie stumpf den Raum zwischen Luftröhre und Wirbelkörper.
- Schicken Sie eine halbgefaltete 5-0-Nylonnaht von der rechten Seite des Wirbelkörpers auf die linke Seite durch die präspinale Route.
- Verbinden Sie den linken C7-Nerv mit einem Infusionsschlauch und führen Sie den Nerv über den präspinalen Weg zur rechten Seite.
- Ziehen Sie die Luftröhre und die Speiseröhre vorsichtig zurück und verbinden Sie die vorderen und hinteren Abschnitte des linken C7-Nervs ohne Spannung mit 12-0-Nylonnähten mit der rechten C7-Nervenwurzel. Vernähen Sie das Epineurium um die Nerven mit 4-5 Stichen, um die Nerven stark zu konatieren.
HINWEIS: Es ist wichtig, einen Infusionsschlauch aus Kunststoff mit angemessener Dicke zu wählen. Ein zu dünner Schlauch könnte den Nerv schädigen, und ein zu dicker Schlauch könnte die Luftröhre und die Speiseröhre schädigen. Darüber hinaus ist der Raum zwischen der Luftröhre und dem Wirbelkörper ein "V"-förmiger Raum, und die Durchtrennung eines Teils des muskulären Longus colli kann den Übertragungsweg verkürzen.
4. Wundverschluss
- Spülen Sie die Wunde mit steriler normaler Kochsalzlösung und trocknen Sie sie mit steriler Gaze.
- Vernähen Sie das Brustbein und verschließen Sie die Haut mit 5-0 monofilen Nähten.
5. Nachsorge
- Warten Sie, bis die Maus aus der Narkose erwacht. Bringen Sie die Maus in einen sauberen Käfig ohne Einstreumaterial, aber mit einer wärmenden Decke gewärmt. Beobachten Sie die Maus, bis sie gehfähig ist. Verwenden Sie Tramadol (20 mg/kg, i.p.) als postoperative Analgesie.
- Setzen Sie die Mäuse in einen Erholungskäfig und überwachen Sie sie bis zur Genesung. Stellen Sie das Wasser und die Ernährung der Mäuse nach der Operation wieder her. Überwachen Sie die Mäuse postoperativ jeden Tag auf Anzeichen von Beeinträchtigungen oder Infektionen, einschließlich Unterernährung, gekrümmter Haltung und zerzaustem Fell. Zwei Wochen nach der Operation sollte die Naht entfernt werden.
HINWEIS: Tragen Sie die Erythromycin-Salbe an drei aufeinanderfolgenden Tagen täglich auf die Wundoberfläche auf. - Wenn Komplikationen wie Wundödeme beobachtet werden, sollten diese sofort behoben werden.
6. Verhaltensanalyse
ANMERKUNG: Alle Verhaltenstests und -analysen wurden von einem Beobachter durchgeführt, der für die Versuchsgruppen verblindet war.
- Zylinder-Test
HINWEIS: Der Zylindertest bewertet die Verwendung der Vordergliedmaßen während der spontanen vertikalen Exploration innerhalb eines Zylinders 4 und 8 Wochen nach der Operation21.- Legen Sie die Mäuse in einen durchsichtigen Zylinder (Durchmesser 9 cm, Höhe 15 cm) auf einen erhöhten Rahmen.
- Um die Beobachtung und Aufnahme zu erleichtern, befestigen Sie einen Spiegel in einem Winkel von 45° unter dem Zylinder.
- Zeichnen Sie die spontane Aufzucht jeder Maus, die mit Hilfe des Spiegels beobachtet wurde, 10 Minuten lang auf.
- Bestimmen Sie manuell die Zeitspanne, für die (i) die rechte Pfote, (ii) die linke Pfote oder (iii) beide Pfoten Kontakt mit den Glaswänden hatten. Zähle insgesamt 20 Bewegungen während jeder Sitzung. Schließen Sie Mäuse, die während des Tests nicht aktiv sind, von der Analyse aus.
- Bewerten Sie die Testleistung wie folgt:
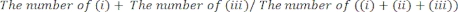
- Grid-Walk-Test
HINWEIS: Der Grid-Walk-Test beurteilt die genaue Platzierung der Vorderpfoten auf den Sprossen eines Gitters während der spontanen Exploration 4 und 8 Wochen nach der Operation. 22. Anmelden- Legen Sie die Mäuse auf ein Drahtgitter (20 cm x 24 cm) mit 25 mm quadratischen Löchern und lassen Sie sie 10 Minuten lang frei erkunden, während Sie ihre Performance mit einer Videokamera aufzeichnen.
- Erzielen Sie einen Fußschlupf in einem der folgenden Fälle:
- Suchen Sie nach Fällen, in denen die Pfote eine Sprosse völlig verfehlt (in diesem Fall fällt die Gliedmaße zwischen die Sprossen und das Tier verliert das Gleichgewicht).
- Suchen Sie nach Fällen, in denen die Pfote korrekt auf einer Sprosse platziert ist, aber beim Tragen des Körpergewichts abrutscht.
- Drücken Sie das Testergebnis als Fußrutschen der rechten Vordergliedmaße / vollständiges Abrutschen des Fußes aus. Obwohl weder für den Zylindertest noch für den Gittergangtest eine Schulung erforderlich ist, sollten Sie die Ausgangswerte ermitteln, indem Sie jedes Tier vor der Operation einmal testen.
Ergebnisse
Eine einseitige Hirnverletzung führt häufig zu einer dauerhaften Dysfunktion der kontralateralen Extremität, da die kompensative neuronale Plastizität bei Erwachsenen eingeschränkt ist10,11. Zuvor berichteten wir, dass die CC7-Chirurgie zur Behandlung halbseitig gelähmter oberer Gliedmaßen bei erwachsenen Patienten nach Hirnverletzung eingesetzt werden könnte7. Um die Wirksamkeit des Protokolls für die direkte Anastomose bilateraler C7-Nerven über den präspinalen Weg zu evaluieren, führten wir die Kreuzungsnerventransferoperation bei Mäusen nach einseitigem Schädel-Hirn-Trauma (SHT) durch. Abbildung 1 beschreibt die SHT-Verfahren und verifiziert den Schadensumfang und die Auswirkungen. Zunächst wurde ein elektrischer kortikaler Prellungsimpaktor (eCCI) verwendet, um die Großhirnrinde der linken Hemisphäre (anteroposterior = +1,0 mm bis -2,0 mm, mediolateral = 0,5 mm bis 3,5 mm) bei erwachsenen Mäusen zu schädigen, was zu einer einseitigen Hirnverletzung führte. Nach 2 Wochen bestätigten anatomische Strukturen, dass dieses SHT-Protokoll den sensomotorischen Kortex, einen wichtigen Ort für die Initiierung von Bewegungen, fast zerstört hat. Diese Mäuse mit einseitigem SHT wiesen signifikante motorische Defekte der rechten Vordergliedmaße auf.
Abbildung 2 beschreibt die CC7-Verfahren. Das Pfaddiagramm der CC7-Operation zeigte, dass Pfad A, der den präspinalen Weg darstellt, im Vergleich zu den anderen der kürzeste Zugang war. Die Länge des Weges A ist sogar geringer als die Länge des entnommenen C7-Nervs auf der linken Seite (nicht gelähmte Seite). Dieser Befund lieferte die anatomische Grundlage für die Wahl des präspinalen Weges zur vollständigen Nerventransferoperation. Die CC7-Operation wurde zwei Wochen nach dem SHT in direkter Anastomose über die präspinale Route durchgeführt. Der Nervus cervicalis 7 (C7) auf der nicht gelähmten Seite wurde direkt auf die gelähmte Seite übertragen, anstatt seine ursprünglichen Hirnverbindungen herzustellen. Abbildung 3 zeigt die Ergebnisse der Elektronenmikroskopie, die zeigten, dass sich der übertragene C7-Nerv erfolgreich regeneriert hatte. Die Dicke der Myelinscheide des übertragenen C7-Nervs nahm 4 Wochen nach der CC7-Operation allmählich zu und war fast vergleichbar mit der der Kontrollgruppe 8 Wochen nach der CC7-Operation. Abbildung 4 zeigt die muskuläre Reinnervation des transferierten C7-Nervs mit Hilfe elektromyographischer Ableitungen. Die elektrische Stimulation des proximalen Endes der C7-Nervenanastomose induzierte 4 Wochen postoperativ stabil Aktionspotentiale in mehreren Muskeln der betroffenen Vordergliedmaße, in Übereinstimmung mit den elektronenmikroskopischen Ergebnissen. Abbildung 5 zeigt, dass der übertragene Nervus C7 motorische Fasern aus dem ventralen Horn und sensorische Fasern aus den Spinalganglien des Rückenmarks C7-Segment auf der gesunden Seite durch retrograde Markierung der Choleratoxin-Untereinheit B (CTB) enthält.
Abbildung 6 zeigt, dass das Mausmodell auch eine signifikante motorische Erholung nach unilateralem SHT zeigte, was mit den Ergebnissen der klinischen Studien übereinstimmt. Um die Wirkung der CC7-Operation auf die Wiederherstellung der verletzten motorischen Funktion nach einem SHT zu überprüfen, wurden eine SHT + Scheingruppe und eine Kontrolle + Scheingruppe gebildet. Die Mäuse in der SHT + Scheingruppe und der TBI + CC7-Gruppe erhielten gleichzeitig die gleichen Verfahren für SHT-Verletzungen, während die Mäuse in der Kontroll- + Scheingruppe nur eine Scheinoperation erhielten. Während die Mäuse in der SHT + CC7-Gruppe eine Nerventransferoperation erhielten, wurden die Mäuse in der SHT+ Scheingruppe und der Kontroll+ Sham-Gruppe einer bilateralen zervikalen 7 (C7) Nervenresektion unterzogen. In Zylindertests zeigte die SHT + CC7-Gruppe sowohl 4 als auch 8 Wochen nach der CC7-Operation eine signifikant höhere Nutzungsrate der beeinträchtigten Vordergliedmaße als die SHT-Gruppe (p < 0,01). In Grid-Walking-Tests zeigte die SHT + CC7-Gruppe 4 Wochen nach der CC7-Operation eine niedrigere Fehlerrate als die SHT-Gruppe. Darüber hinaus war die Fehlerrate der SHT + CC7-Gruppe 8 Wochen nach der CC7-Operation signifikant niedriger als die der SHT-Gruppe (p < 0,05). Diese Verhaltensergebnisse zeigten, dass die CC7-Operation die motorische Funktion der betroffenen Gliedmaße bei SHT-Mäusen verbessern konnte. Zusammengenommen deuten diese Ergebnisse darauf hin, dass der übertragene C7-Nerv, der durch die CC7-Operation über den präspinalen Weg wieder aufgebaut wurde, erfolgreich regeneriert wurde und die beeinträchtigte Vordergliedmaße renervierte, was zur motorischen Wiederherstellung bei erwachsenen Mäusen mit einseitigem SHT beitrug.
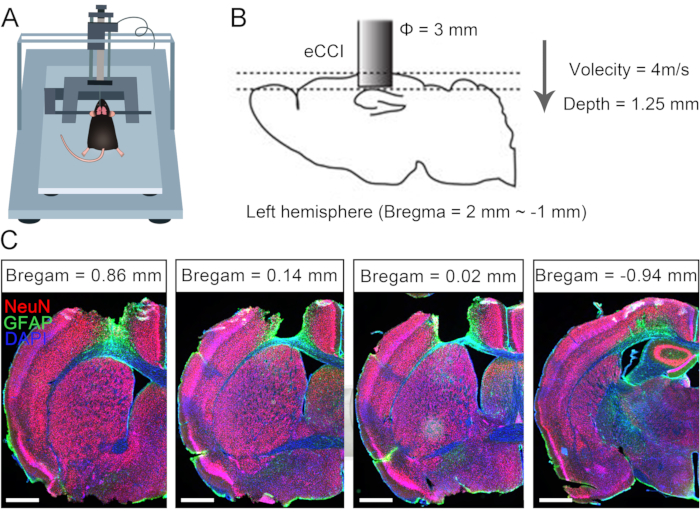
Abbildung 1: Charakterisierung eines einseitigen Schädel-Hirn-Traumas. (A) Schematische Darstellung der Mausposition in eCCI. (B) Die Parameter und der Schadensbereich von eCCI. (C) Repräsentativer koronaler Schnitt mit dem läsionierten Kortex (2 Wochen nach SHT, Skalenbalken = 500 μm). Abkürzung: eCCI = elektrischer kortikaler Kontusionsimpaktor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
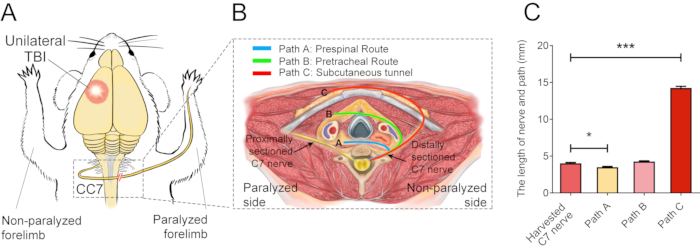
Abbildung 2: Das chirurgische Elementardiagramm. (A) Schematische Darstellung des experimentellen Aufbaus für die Durchführung des kontralateralen C7-Nerventransfers bei SHT-Mäusen. Der rote Kreis zeigt die Position des Traumas an. Der rote Doppelschrägstrich innerhalb des gestrichelten Rechtecks zeigt den genähten Nerv. (B) Ein Querschnitt zeigt drei alternative Wege des kontralateralen C7-Nerventransfers in den Mäusen. Pfad A, die blaue Linie stellt den präspinalen Verlauf des übertragenen Nervs dar; Pfad B, die grüne Linie, stellt den prätrachealen Weg des übertragenen Nervs dar; Pfad C, die rote Linie, stellt den subkutanen Tunnel des übertragenen Nervs dar. (C) Die Grafik zeigt die Länge der Routen und den entnommenen C7-Nerv in (B). Die Länge des Weges A (3,3 ± 0,10 mm) war signifikant geringer als die Länge des entnommenen C7-Nervs (4,05 ± 0,11 mm; * p < 0,05, einseitige ANOVA, n = 20 in jeder Gruppe). Die Länge des Pfades C (14,15 ± 0,20 mm) war signifikant größer als die des entnommenen C7-Nervs (*** p < 0,001, einseitige ANOVA, n = 20 in jeder Gruppe). Die Länge des Pfades B betrug 4,2 ± 0,08 mm (n=20). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
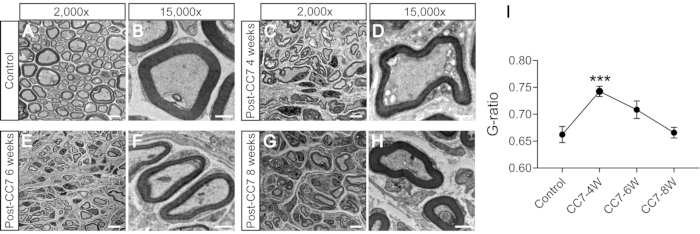
Abbildung 3: Die elektronenmikroskopische Analyse eines Querschnitts des Nervs. (A,B) Bilder des Nervs in Kontrollmäusen. Maßstabsleiste = 5 μm (A) und 1 μm (B). (C,D) Bilder des regenerierten Nervs einen Monat nach der Operation. Maßstabsleiste = 5 μm (C) und 1 μm (D). (E, F) Bilder des regenerierten Nervs an einem Punkt fünf Monate nach der Operation. Maßstabsleiste = 5 μm (E) und 1 μm (F). (G, H) Bild des regenerierten Nervs zwei Monate nach der Operation. Maßstabsleiste = 5 μm (G) und 1 μm (H). Vergrößerung von A, C, E und G, 2.000-fach; Vergrößerung von B, D, F und H, 15.000-fach. (I) Das G-Verhältnis (das Verhältnis des Innen- zum Außendurchmesser der Myelinscheide) ist in den Proben der Kontrollgruppe niedriger als in den 4-Wochen-Proben und entspricht den Proben 6-8 Wochen nach der Operation (***: p < 0,001; Vergleich bei verschiedenen Gruppenaxonen mit t-Test; n = 3 Mäuse in jeder Gruppe). Abkürzungen: CC7= kontralateraler zervikaler siebter Nervtransfer; CC7-XW = X Wochen nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
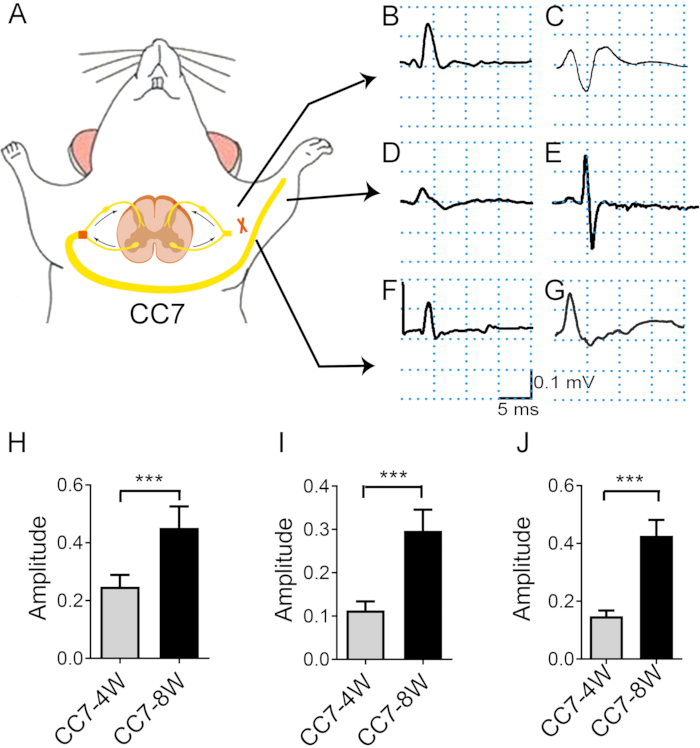
Abbildung 4: Die Elektromyographie-Analyse nach dem kontralateralen C7-Nerventransfer zeigt die Rate der Nervenregeneration. (A) Schematische Darstellung der elektronischen Transferstimulation und der In-vivo-Elektromyographie-Aufzeichnung . Die Stimulationsintensität war während des gesamten Tests gleich (2 mA). Die Stimulationsstelle ist der Nervus C7 proximal der Anastomose. (B, C) Fotos, die das Aktionspotenzial am großen Brustmuskel zwei Wochen (B) und vier Wochen (C) nach der Operation zeigen. (D, E) Das EMG wurde 4 Wochen (D) und 8 Wochen (E) postoperativ im Extensor digitorum aufgezeichnet. (F) Nach drei Wochen bildeten sich CMAPs im Trizeps brachii. (G) Nach vier und acht Wochen stiegen die CMAPs des Trizeps brachii an. (H) Die mittlere Amplitude des Pectoralis major erreichte ~0,25 mV ± 0,16 mV nach 4 Wochen gegenüber 0,45 mV ± 0,03 mV nach 8 Wochen, was einen signifikanten Unterschied zwischen den beiden Zeitpunkten zeigt (*** p < 0,001, t-Test, n = 6 in jeder Gruppe). (I) Die mittlere Amplitude des Trizeps brachii erreichte ~0,15 mV ± 0,01 mV nach 4 Wochen gegenüber 0,46 mV ± 0,02 mV nach 8 Wochen, was einen signifikanten Unterschied zwischen den beiden Zeitpunkten zeigt (***: p < 0,001, t-Test, n = 6 in jeder Gruppe). (J) Die mittlere Amplitude des Extensor digitorum erreichte ~0,11 mV ± 0,01 mV nach 4 Wochen gegenüber 0,29 mV ± 0,02 mV nach 8 Wochen, was einen signifikanten Unterschied zwischen den beiden Zeitpunkten zeigt (***: p < 0,001, t-Test, n = 6 in jeder Gruppe). Abkürzungen: EMG = Elektromyographie; CMAP = zusammengesetztes Muskelaktionspotential. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
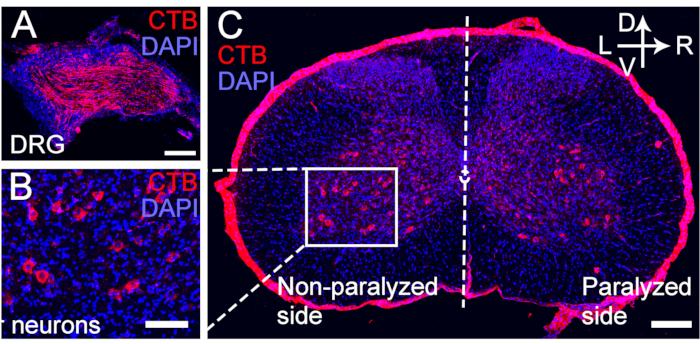
Abbildung 5: CTB-retrograde Markierung von motorischen und sensorischen Neuronen des übertragenen C7-Nervs. (A-C) CTB wurde 4 Wochen nach der CC7-Operation am distalen Ende der Anastomose des Nervus C7 injiziert. (A) Die sensorischen Neuronen wurden für die DRG markiert. (B, C) Die Motoneuronen des übertragenen Nervs C7 wurden für das Spinalvorderhorn markiert. Vergrößerung, 20x. Maßstabsleiste = 200 μm (A, B); 100 μm (C). Abkürzungen: CTB = Choleratoxin-Untereinheit B; DRG = Spinalganglion; DAPI = 4′,6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
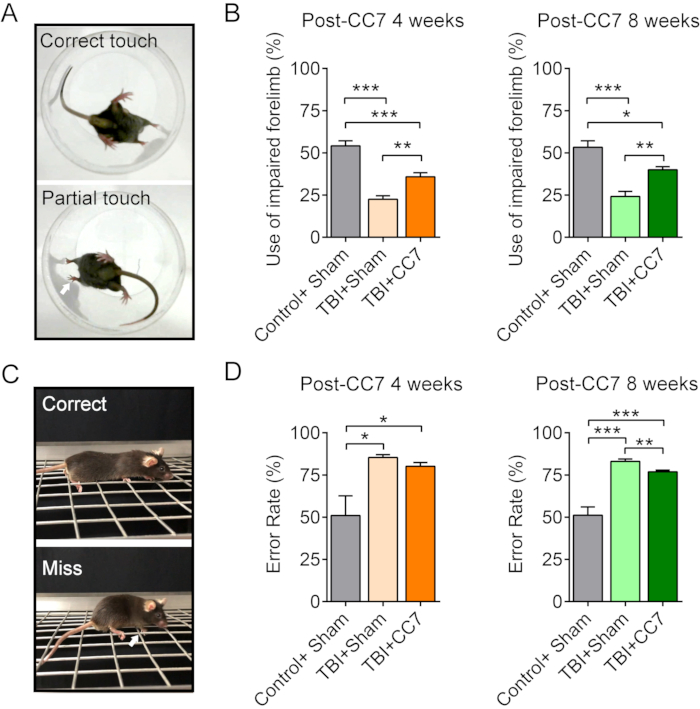
Abbildung 6: Verhaltensänderungen nach CC7-Operation. (A) Die Bilder zeigen den Zylindertest der Mäuse. (B) Zusammenfassende Grafik, die die Wirkung des CC7-Transfers 4 Wochen und 8 Wochen nach der Operation bei den SHT-Mäusen zeigt (n = 6 Mäuse). p = 0,001; ungepaarter t-Test. Die durchschnittliche Nutzung der beeinträchtigten Vordergliedmaße betrug 54,17 % ± 3,01 % in der Gruppe "Kontrolle + Schein" gegenüber 22,5 % ± 2,14 % in der SHT + Scheingruppe; 35,83 % ± 2,39 % in der SHT + CC7-Gruppe 4 Wochen nach der CC7-Operation, was auf einen signifikanten Unterschied hindeutet (Einweg-ANOVA; p < 0,05, n = 6 in jeder Gruppe). 8 Wochen nach der CC7-Übertragung betrug die Nutzung 53,33 % ± 3,80 %, 24,17 % ± 3,01 % und 40,00 % ± 1,83 % in der Kontroll- + Scheingruppe, TBI + Scheingruppe und TBI + CC7-Gruppe, ein signifikanter Unterschied (*p < 0,05, Einweg-ANOVA, n = 6 in jeder Gruppe). (C) Die Bilder zeigen den Grid-Walk-Test. (D) Die Grafik zeigt, dass die mittleren Fehlerraten der beeinträchtigten Vordergliedmaße in der SHT + Scheingruppe 85,41 % ± 1,59 % (n = 6) betrugen, was der SHT + CC7-Gruppe 80,17 % ± 2,19 % (n = 6) entspricht, und beide waren höher als in der Kontroll+Scheingruppe (50,99 % ± 11,69 %). 8 Wochen nach der Operation betrug die Fehlerrate in der SHT + CC7-Gruppe 76,87 ± 1,07 % (n = 6), was deutlich niedriger ist als die der SHT + Scheingruppe (83,06 % ± 1,41 %; p < 0,05, einseitige ANOVA, n = 6 in jeder Gruppe). Abkürzungen: CC7= kontralateraler zervikaler siebter Nervtransfer; SHT = Schädel-Hirn-Trauma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In der Klinik wurde die Kreuzungsnerventransferchirurgie zur Behandlung von Patienten mit Avulsionsverletzungen des Plexus brachialis und nach Hirnschäden wie Schlaganfall und SHT eingesetzt 7,9,12. Bemerkenswert ist, dass eine Hirnschädigung eine schwere neurologische Erkrankung ist, die zu verschiedenen Komplikationen führen kann, darunter Epilepsie, Hirnhernie und Infektionen13. Nicht alle Patienten mit einseitiger Hirnverletzung sind für eine CC7-Operation geeignet. Im Allgemeinen wurde die CC7-Operation bei Patienten mit zentraler Hemiplegie im chronischen Stadium (6 Monate nach der Verletzung) durchgeführt, um den Einfluss von Hirnödemen so weit wie möglich zu vermeiden. Patienten mit kognitiven Beeinträchtigungen und Tetraplegie nach Hirnverletzungen sind von der Behandlung der CC7-Operation ausgeschlossen.
In den meisten Studien wurde berichtet, dass ein subkutaner Zugang und eine Anastomose durch Sural- oder ulnares Nerventransplantat verwendet wurden, um die kontralaterale C7-Nervenwurzel zu übertragen14,15. Die Nervenregeneration mit solchen Methoden dauert jedoch sechs Monate, was den motorischen Erholungsprozess behindern und möglicherweise sogar die Plastizität des Gehirns beeinflussen kann14. In früheren Studien wurde ein kontralateraler C7-Transfer bei Ratten durchgeführt, und der bilaterale C7-Nerv wurde über 4 Stränge des interpositionellen autotransplantierten Suralnervs verwendet. Es gibt jedoch keine Berichte über einen C7-Nerventransfer über den präspinalen Weg bei Mäusen. Wir führten eine CC7-Operation der modifizierten präspinalen Route in Mäusen durch und überprüften die Geschwindigkeit der funktionellen Erholung nach C7-Nerventransfer. In dieser Studie verbesserte der kontralaterale C7-Nerventransfer über die präspinale Route die Funktion gelähmter Gliedmaßen einen Monat nach der Operation, was eine kürzere Erholungszeit des mit Nerventransplantat transplantierten Tiermodells widerspiegelt. Daher könnte dieses Modell klinische Situationen präzise simulieren und den Grundstein für weitere Experimente legen.
Wie man die Nervenwurzel präpariert und das Risiko reduziert, sind wesentliche Fragen für den C7-Transfer. Anders als beim Menschen befindet sich der Plexus brachialis bei der Maus im Brustkorb unterhalb des Schlüsselbeins 5,16. Daher musste die Zugangsstrategie geändert werden, um die Beobachtung der Wurzel des Nervus C7 und der Wirbelsäulezu ermöglichen 17. Die Sternotomie ist ein sicherer und effektiver operativer Ansatz und wird häufig in Mausexperimenten in der Herz-Thorax-Chirurgie angewendet18,19. Die C6 Lamina ventrali ist auch ein Hindernis für die Übertragung von Nerven. Daher wurde eine Sternotomie-Operation durchgeführt, um die C7-Nervenwurzel zu präparieren und die C6-Lamina ventrali zu durchtrennen, um die Übertragungsdistanz zu verkürzen.
Obwohl der präspinale Weg die Erfolgsrate der direkten Anastomose von Nerventransferoperationen signifikant erhöhen kann, können nicht alle Mäuse direkt anastomosiert werden. Das liegt vor allem an den anatomischen Unterschieden bei diesen Mäusen. Der mittlere Rumpf (Nervus C7) verschmilzt mit dem oberen oder unteren Rumpf an einer Stelle, die dem Foramen intervertebralis sehr nahe kommt. Somit ist die Länge der für die Entnahme zur Verfügung stehenden C7-Nerven nicht ausreichend. Derzeit ist der einzige Ansatz die Nerventransplantation oder der Ersatz von Mäusen. Dieses Modell wird typischerweise bei 8 Wochen alten Mäusen (20-25 g) eingesetzt, da die Mäuse reif sind und die C7-Nerven ausreichend groß sind, um behandelt zu werden. Obwohl dieses Operationsprotokoll auch auf junge Mäuse anwendbar ist, nimmt die Schwierigkeit der Operation bei jüngeren Mäusen deutlich zu.
Die motorische Funktion der Vordergliedmaßen der Mäuse in der SHT + CC7-Gruppe war nach einem Monat und zwei Monaten signifikant erhöht, was darauf hindeutet, dass der übertragene C7-Nerv zur Erholung der beeinträchtigten Vordergliedmaße beitrug. Die Remyelinisierung ist entscheidend für die funktionelle neuronale Erholung. Eine frühere Studie zeigte, dass sich die Myelinscheiden verletzter Nerven nach einem Monat regenerierten, was mit diesen Ergebnissen übereinstimmt20. Hier reifte der übertragene Nerv allmählich heran, was mit dem Verhaltenstest übereinstimmte. Die Elektromyographie wurde verwendet, um die Rate der funktionellen Erholung nach dem Nerventransfer weiter zu testen. Die Ergebnisse zeigten, dass der übertragene Nerv den betroffenen Muskel 4 Wochen nach der Operation innervierte. Bemerkenswert ist, dass diese Studie die erste ist, die den Zeitpunkt der Reinnervation mit einer direkten Anastomose nach einer Kreuzungsnerventransferoperation bestimmt.
Zusammenfassend lässt sich sagen, dass wir eine klinische Operation simuliert haben, um ein Protokoll für die direkte Anastomose von bilateralen Plexusnerven brachialis über den präspinalen Weg in Mäusen zu erstellen und die Funktion des verschobenen Nervs zu bestätigen. Das Mausmodell trug zur Aufklärung der neuronalen Mechanismen bei, die der Rehabilitation beim kreuzenden Nerventransfer nach Verletzungen des zentralen und peripheren Nervensystems zugrunde liegen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu deklarieren.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (82071406, 81902296 und 81873766) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | KDL | K-20200808 | |
| 12-0 nylon sutures | Chenghe | 20082 | |
| 5-0 silk braided | MERSILK,ETHICON | QK312 | |
| 75% ethanol | GENERAL-REAGENT | P1762077 | |
| Acupuncture needle | Chengzhen | 190420 | Use for making retractors |
| Automatic clipper | Codos | CHC-332 | |
| C57BL/6N mice | SLAC laboratory (Shanghai) | C57BL/6Slac | |
| Electrocautery | Gutta Cutter | SD-GG01 | |
| Erythromycin ointment | Baiyunshan | H1007 | |
| Iodophor disinfection solution | Lionser | 20190220 | |
| Medical tape | Transpore,3M | 1527C-0 | |
| Micro needle holder | Chenghe | X006-202003 | |
| Micro-forceps | Chenghe | B001-201908 | |
| Micro-scissors | 66VT | 1911-2S276 | |
| Operating microscope | OLYMPUS | SZX7 | |
| Ophthalmic scissor | Chenghe | X041D1251 | |
| Pentobarbital sodium | Sigma | 20170608 | |
| Plastic infusion tube | KDL | C-20191225 | |
| Sterile normal saline | KL | L121021109 | |
| Vascular forceps | Jinzhong | J31020 | |
| Warming pad | RWD | 69027 |
Referenzen
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Gu, Y., Xu, J., Chen, L., Wang, H., Hu, S. Long term outcome of contralateral C7 transfer: a report of 32 cases. Chinese Medical Journal. 115 (6), 866-868 (2002).
- Gu, Y. D., et al. Long-term functional results of contralateral C7 transfer. Journal of Reconstructive Microsurgery. 14 (1), 57-59 (1998).
- Feng, J. T., et al. Brain functional network abnormality extends beyond the sensorimotor network in brachial plexus injury patients. Brain Imaging and Behavior. 10 (4), 1198-1205 (2016).
- Stephenson, J. B. t, Li, R., Yan, J. G., Hyde, J., Matloub, H. Transhemispheric cortical plasticity following contralateral C7 nerve transfer: a rat functional magnetic resonance imaging survival study. The Journal of Hand Surgery. 38 (3), 478-487 (2013).
- Hübener, M., Bonhoeffer, T. Neuronal plasticity: beyond the critical period. Cell. 159 (4), 727-737 (2014).
- Zheng, M. X., et al. Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. The New England Journal of Medicine. 378 (1), 22-34 (2018).
- Spinner, R. J., Shin, A. Y., Bishop, A. T. Rewiring to regain function in patients with spastic hemiplegia. The New England Journal of Medicine. 378 (1), 83-84 (2018).
- Hua, X. Y., et al. Contralateral peripheral neurotization for hemiplegic upper extremity after central neurologic injury. Neurosurgery. 76 (2), 187-195 (2015).
- Robertson, C. S., et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. Journal of the American Medical Association. 312 (1), 36-47 (2014).
- Skolnick, B. E., et al. A clinical trial of progesterone for severe traumatic brain injury. The New England Journal of Medicine. 371 (26), 2467-2476 (2014).
- Wang, G. B., et al. Contralateral C7 to C7 nerve root transfer in reconstruction for treatment of total brachial plexus palsy: anatomical basis and preliminary clinical results. Journal of Neurosurgery. Spine. 29 (5), 491-499 (2018).
- Wilson, L., et al. The chronic and evolving neurological consequences of traumatic brain injury. The Lancet. Neurology. 16 (10), 813-825 (2017).
- Hua, X. Y., et al. Enhancement of contralesional motor control promotes locomotor recovery after unilateral brain lesion. Scientific Reports. 6, 18784(2016).
- Hua, X. Y., et al. Interhemispheric functional reorganization after cross nerve transfer: via cortical or subcortical connectivity. Brain Research. 1471, 93-101 (2012).
- Pan, F., Wei, H. F., Chen, L., Gu, Y. D. Different functional reorganization of motor cortex after transfer of the contralateral C7 to different recipient nerves in young rats with total brachial plexus root avulsion. Neuroscience Letters. 531 (2), 188-192 (2012).
- Yamashita, H., et al. Restoration of contralateral representation in the mouse somatosensory cortex after crossing nerve transfer. PLoS One. 7 (4), 35676(2012).
- Tavakoli, R., Nemska, S., Jamshidi, P., Gassmann, M., Frossard, N. Technique of minimally invasive transverse aortic constriction in mice for induction of left ventricular hypertrophy. Journal of Visualized Experiments: JoVE. (127), e56231(2017).
- Melhem, M., et al. A Hydrogel construct and fibrin-based glue approach to deliver therapeutics in a murine myocardial infarction model. Journal of Visualized Experiments: JoVE. (100), e52562(2015).
- Liu, B., et al. Myelin sheath structure and regeneration in peripheral nerve injury repair. Proceedings of the National Academy of Sciences of the United States of America. 116 (44), 22347-22352 (2019).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proceedings of the National Academy of Sciences of the United States of America. 109 (33), 2230-2239 (2012).
- Yoshikawa, A., Nakamachi, T., Shibato, J., Rakwal, R., Shioda, S. Comprehensive analysis of neonatal versus adult unilateral decortication in a mouse model using behavioral, neuroanatomical, and DNA microarray approaches. International Journal of Molecular Sciences. 15 (12), 22492-22517 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten