需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于化学发光的检测方法,用于检测自氧化和亚硝化化合物中的一氧化氮及其衍生物
摘要
在这里,我们提出了使用基于化学发光的高灵敏度测定来检测一氧化氮及其生物相关衍生物的方案。
摘要
体内一氧化氮(NO)活性是其直接作用,其衍生物由NO自氧化产生的作用以及亚硝化化合物的作用的综合结果。测量NO代谢物对于研究血管水平和其他组织中的NO活性至关重要,特别是在施用外源性NO的实验环境中。基于臭氧的化学发光测定可以精确测量液体(包括血浆,组织匀浆,细胞培养物)和气体混合物(例如,呼出的呼吸)中的NO和NO代谢物。NO与臭氧反应,在激发态下生成二氧化氮。随之而来的光发射允许光探测和产生反映样品NO含量的电信号。来自同一样品的等分试样可用于测量特定的NO代谢物,例如硝酸盐,亚硝酸盐,S-亚硝基硫醇和铁 - 亚硝酰基复合物。此外,无细胞血红蛋白消耗的NO也通过化学发光分析进行量化。提供了所有这些技术的说明。
引言
自从萨尔瓦多·蒙卡达(Salvador Moncada)和诺贝尔奖获得者罗伯特·富奇戈特(Robert Furchgott)、路易斯·伊格纳罗(Louis Ignarro)和费里德·穆拉德(Ferid Murad)将一氧化氮(NO)确定为先前已知的内皮源性松弛因子(EDRF)以来,NO的核心作用已在整个血管生物学、神经科学、代谢和宿主反应1,2、3、4、5、6、7等几个关键机制中得到确立。.外源性给予NO气体已成为新生儿肺动脉高压引起的呼吸衰竭的既定治疗方法8。一氧化氮气体也已被研究用于治疗呼吸道合胞病毒(RSV)感染,疟疾和其他感染性疾病,缺血再灌注损伤以及预防接受心脏手术的患者的急性肾损伤9,10,11,12。对精确测量技术的需求,以评估NO,其代谢物及其靶蛋白和化合物的水平来自机制和介入研究。
由于其高反应性,NO可能会根据其产生和/或释放的生物基质进行不同的反应。在没有血红蛋白(Hb)或其他氧血蛋白的情况下,NO几乎完全氧化成亚硝酸盐(NO2-)。
2常开 + O2 → 2常开 2
否2 + 否 → N2O3
N2O3 + H2O → NO2- + H+
NO首先与分子氧(O2)进行自氧化以产生二氧化氮(NO2),并与NO2 本身反应生成三氧化二氮(N2O3)。一个分子N2O3 与水(H2O)反应形成两个NO2-分子和 一个质子(H+)13。在全血中,14,15,NO和NO2- 迅速转化为硝酸盐(NO3-),因为这些分子与Hb的氧化血红素基团[Hb-Fe2 + -O2 或氧合血红蛋白(oxyHb)]发生激烈反应以产生NO3-。该反应与血红素基团向铁态[Hb-Fe3 + 或高铁血红蛋白(metHb)]的转变相结合:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3-
红细胞(RBC)屏障和紧邻内皮的空间是限制这种反应的主要因素,并允许内皮释放的一小部分NO作为EDRF16,17。事实上,循环中的无细胞Hb已知会破坏实验和临床环境中的血管舒张17,18。在红细胞内,根据氧合和NO2- 浓度,一部分NO与脱氧血红蛋白(Hb-Fe2 +)反应形成亚硝基铁Hb(Hb-Fe2 + - NO或HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
在RBC15,17中,NO2- 可以通过减少Hb-Fe 2+ 形成Hb-Fe3+ ,导致NO的释放,而NO又结合Hb-Fe2+-O2 (优先)或Hb-Fe2+。
NO衍生物的产生不应被视为严格单向的,因为NO可以从各种组织和不同酶(例如,肠道细菌或线粒体内,特别是在缺氧条件下)的NO2和NO3-再生19,20。
产生(或施用)的可变量的NO导致S-亚硝基硫醇的下游生成,主要是通过在亲核试剂存在下从N2O3 中转硝化硫醇,产生NO + 供体中间体(Nuc-NO+-NO2-):
N2O3 + RS- → RS-NO + NO2-
S-亚硝基硫醇产生的另一种可能性是氧化硫醇的亚硝基化(不与氧化硫醇反应):
RS• + NO → RS-NO
这种机理和NO2 的直接硫醇氧化可能只有在非常具体的条件下才有可能,这些条件在别处21中进行了描述。S-亚硝基硫醇的范围从轻分子(如S-亚硝基谷胱甘肽)到大的含硫醇蛋白质。S-亚硝基血红蛋白(S-NO-Hb)是通过β链(β93C)22中保守半胱氨酸残基的硫醇基团亚硝化形成的。
S-亚硝基硫醇的产生和代谢是重要调节机制的一部分。例子包括调节谷胱甘肽,半胱天冬酶,N-甲基-D-天冬氨酸(NMDA)和ryanodine受体23,24,25,26,27,28。亚硝化白蛋白(S-亚硝基白蛋白)先前被认为是体内NO生物学的主要介质,似乎是一种NO / NO + 转运蛋白,没有任何特定的附加生物活性29。
在测量生物基质中特定生物样品的NO及其衍生物的浓度时,重要的是要考虑酸度,氧化,温度和试剂的存在等特性。例子包括施用外源性NO供体,并且在急性炎症的情况下,过氧化氢(H2O2)与NO2 反应导致产生过氧亚硝酸盐(ONOO-)21等自由基的超正常浓度。除了采用的分析方法外,样品制备和储存的预分析阶段也是基础。应预测、考虑和阻断不代表 体内 NO活性的下游反应。一个有效的例子是S-NO-Hb的不稳定性,当血液样本被靶向测量22时,需要对血液样本进行专门的处理。
基于化学发光的测定是检测任何生物体液中NO及其主要代谢物[NO2-,NO3-,S-NO和铁- 亚硝酰基复合物(Fe-NO)]水平的金标准,包括组织匀浆30,31。这些方法依赖于化学发光检测器(CLD),这是一种容纳NO与臭氧(O3)反应的装置,在激发态(NO2 •)下产生NO2。NO2•的弛豫引起光子的发射,光子由光电倍增管检测到,产生与采样气体混合物32的NO含量成正比的电信号。表示CLD的简化原理图。

图 1:一氧化氮气体化学发光检测器的简化示意图。 基于化学发光的一氧化氮(NO)检测是在化学发光检测器(CLD)中引入的每个NO气体分子的化学计量生成一个光子。化学发光反应是在指定的腔室中获得的,该腔室由内部发生器提供臭氧(O3),该发生器通过与外部泵连接保持在负压,允许样品气体连续和恒定地流入。O3 的产生需要双原子氧(O2),该氧气由与CLD连接的专用O2 罐供应(其他制造商提供使用环境空气操作的CLD)。在反应室内,样品气体中含有的每一分子NO气体与氧气反应,产生一分子处于活化状态(NO2 *)的二氧化氮。通过返回到其基态,每个NO2 *分子发射一个光子,该光子由位于反应室附近的光电倍增管(PMT)检测。PMT与相关的放大器和中央处理单元产生与光子数和反应室中NO分子数量成比例的信号。 请点击此处查看此图的大图。
CLD的进样口可以连接到包含液体样品反应室的玻璃器皿系统。系统用氮气、氦气或氩气等惰性气体连续吹扫,将NO从反应室转移到CLD。液相样品通过专用膜注入吹扫容器。
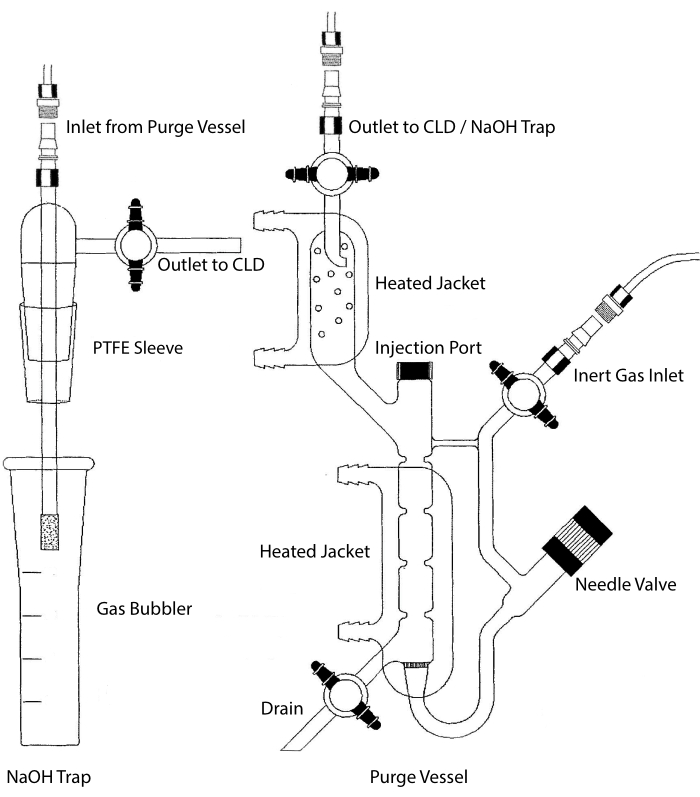
图 2:用于化学发光检测一氧化氮气体的吹扫容器的结构 吹扫容器(右)允许检测一氧化氮 (NO) 气体或任何其他化合物,当从液相试剂中释放时,可以很容易地转化为 NO 气体。惰性气体入口连接到惰性气体的源(罐),例如氩气,至强或双原子氮(N2)。针阀(向左打开)用于吹扫容器内的压力控制,可以完全拆卸以清洁容器。进样口由带有膜隔的盖子覆盖,用于样品进样。应经常更换膜。加热的夹套包围反应室并连接到热水浴中以在HCl测定中进行VCl3 。吹扫容器出口连接到化学发光检测器(CLD)或NaOH捕集器(HCl测定中VCl3 需要)。要排出反应室内容物,首先关闭惰性气体入口和吹扫容器出口处的旋塞阀,关闭针阀,取下注射口处的盖子,最后打开排放口处的旋塞阀。如果由于HCl的腐蚀性而进行HCl测定中的VCl3 ,则需要将NaOH陷阱(左)放置在吹扫容器和CLD之间。与CLD的连接始终需要在CLD和吹扫容器(或NaOH陷阱,如果使用)的输出之间放置一个强场电介质(IFD)滤波器。IFD过滤器去除空气中的颗粒物,并阻止液体通过吹扫容器。PTFE = 聚四氟乙烯。 请点击此处查看此图的大图。
因此,任何可以通过特定和受控化学反应转化为NO的化合物都可以在任何生物体液和组织匀浆24中以高灵敏度检测到。通过化学发光直接测量气相NO是在实验和临床环境中进行的。这些技术在别处有33,34,35的广泛描述。NO2-、S-亚硝基硫醇、S-亚硝化物蛋白和Fe-NOs的测量可以通过在三碘化物(I 3-)的反应混合物中加入样品来进行,三碘化物(I3-)化学计量法从所有这些化合物中释放出NO气体:
I3- → I2 + I-
2常2− +2I− +4H+ → 2常数 + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
而I3-不与NO 3-15反应。通过用酸化磺胺(AS)预处理样品等分试样(含或不含氯化汞(HgCl2),可以对每种化合物进行精确测量。具体而言,AS预处理去除所有NO2-含量。因此,CLD测量的NO含量仅反映了S-NOs和Fe-NOs浓度的总和。在AS注射之前,在样品等分试样中注射HgCl 2会导致NO2-由S-NO释放。用AS处理(导致NO2-去除)确保测量的NO含量仅反映Fe-NOs的浓度。评估之间的一系列减法允许计算三个NO导数22的精确浓度。

图3:在乙酸化学发光测定中I3-样品制备的步骤。说明了制备乙酸化学发光测定中I3-的顺序步骤。需要使用避光离心管。试管1,2和3是用于准备测定的试管。如果需要测量硝酸盐(NO3-),则需要另一个样品等分试样(管4)用于HCl测定中的VCl3。步骤由红色的数字表示。在加入样品体积之前,用磷酸盐缓冲盐水(PBS)或HgCl2预填充(步骤1)。按照指示加入样品体积(2),涡旋,并在室温(RT)下孵育2分钟。按照指示加入(3)PBS或酸化磺胺(AS),涡旋,并在室温下孵育3分钟。通过测定测量的浓度是每个管下报告的化合物浓度的总和。1号管将允许测量亚硝酸盐(NO2-),S-亚硝基硫醇(S-NO)和铁 - 亚硝基配合物(Fe-NOs)作为单个信号。对于硝酸盐(NO3-)测量,样品应同时在乙酸中与I3-和VCl3一起在HCl测定中运行,并且从管1获得的值应从从管4中获得的值中减去。*建议用于Hb分析以测定残留NO2-,S-亚硝基血红蛋白和铁-亚硝酰血红蛋白的量。请点击此处查看此图的大图。
对于 NO3- 测量,盐酸 (HCl) 中的氯化钒 (III) (VCl3) 用于将吹扫容器中的 NO3- 转化为 NO,以便使用 CLD 以化学计量法测量 NO3- :
2 无3-+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
为了实现足够快的转化,反应需要在90-95°C下进行。 从NO3- 减少到NO2- 与HCl将NO2- 还原为NO相结合,钒金属也减少了S-NOs,释放了它们的NO部分22,36。CLD在HCl中用VCl3 获得的最终浓度反映了NO3-,NO2和其他亚硝化化合物的总浓度。用I3- 从CLD产生的浓度中减去后一个值,可以计算NO3- 浓度36,37 (图3)。
在NO消耗测定中,NO供体如(Z)-1-[2-(2-氨基乙基)-N-(2-氨乙基)氨基]二禅-1-鎓-1,2-二乙酸(DETA-NONO酸酯)在吹扫容器中连续释放NO产生稳定的信号,允许定量注射样品中的无细胞氧Hb。吹扫容器中消耗的NO的量与样品38中oxyHb的量呈化学计量关系。
图中说明了测量血浆样品中 NO2-、NO3-、S-亚硝基硫醇、亚硝酰铁配合物和无细胞 Hb 消耗的实验方案。对红细胞环境中的NO的研究需要特定的样品处理,然后进行排阻色谱法以测量极其脆弱的S-NO-Hb和Hb-NO,并测定总Hb浓度15,22。样品制备有助于校正测量。在测定过程中,H2 O中NO2-的预先存在和NO2-的释放可导致人为测量更高浓度的NO衍生物,例如S-NO-Hb14,39。还介绍了样品制备的重要方面。
研究方案
该协议中指明的程序符合马萨诸塞州总医院的审查委员会。所使用的血液样本是在先前的一项研究中收集的,并且出于当前目的进行了去识别化 18.
注:有关管道和构成吹扫容器的玻璃器皿之间的最佳连接、清洗和一般维护的具体指导,请参阅制造商的说明。连接需要牢固且小心,以免损坏玻璃器皿。识别玻璃吹扫容器的组件:进气管路、带加热夹套和冷凝器的吹扫容器、氢氧化钠 (NaOH) 气体鼓泡器疏水阀、吹扫容器与鼓泡器之间的连接线、吹扫容器出口气体管路(至 CLD),配备强磁场电介质 (IFD) 过滤器。每次测量液体形式的代谢物(血浆,细胞培养物,组织匀浆)时,吹扫容器和CLD样品入口之间的IFD过滤线必须到位(方案中提供的所有测定)。样品制备取决于所分析的液体或组织以及感兴趣的化合物。分析前阶段的重要方面在第1节和第2节中介绍。特定测定的具体制备步骤包括在第3-5节中。第6-8节适用于所有测定。
1. 专用试剂的制备
注:关于更多详情,请参阅以前的出版物15,22。
- 通过将500mg磺胺溶解在10mL 1N HCl中,制备5%(290mM)酸化磺胺(AS)溶液以除去NO2-。该解决方案可稳定数月。
- 通过将67.9mg HgCl2溶解到5mL PBS中,制备50mM氯化汞(HgCl 2)溶液,用于从S-NOs中释放NO2-。保护储备溶液免受光照。
- 用800mM铁氰化物[K3Fe(CN)6]制备NO2-封闭溶液以氧化Hb与100mM N-乙基马来酰亚胺(NEM)一起阻断硫醇基团和(可选)10%壬基苯基聚乙二醇溶液(Nonidet p-40)以溶解红细胞膜。
- 将K3Fe(CN)6 加入去离子水和蒸馏水中(ddH2O,每升263.5克粉末)中,得到800mM的终浓度。
- 将NEM加入到ddH2O溶液(每升12.5g粉末,浓度为100mM)中的800 mM K3Fe(CN)6中,并混合溶液以溶解所有晶体。
- 将一份10%的NP-40加入800 mM NEM K3Fe(CN)6 100 mM NEM溶液(每升111 mL)的九份中,并充分混合(全血分析的强制性步骤)。
- 从其储备溶液中制备含有12 mM K3Fe(CN)6,10 mM NEM,100 μM二亚乙基三胺五乙酸(DTPA,用于金属螯合)和1%Nonidet p-40洗涤剂的S-NO-Hb稳定溶液。
- 通过将NEM晶体添加到PBS(25mg / mL,例如,250mg在10mL PBS中)来制备200mM NEM溶液,并混合溶液直到所有晶体溶解(在实验日制作)。
- 通过将K3Fe(CN)6加入ddH 2 O(263.5mg / mL,例如在5 mL ddH2O中加入1.32g,以制备800 mM的K3Fe(CN)6溶液,以获得800 mM的终浓度)(在实验日制作)。
- 通过将786mg DTPA加入200mL ddH2O中来制备10mM DTPA储备溶液,并用5N NaOH将pH调节至7.0以完全溶解DTPA。
- 在7.2 pH下向81.5 mL PBS中加入5 mL 200 mM NEM溶液,1.5 mL 800 mM K3Fe(CN)6 溶液和1 mL DTPA储备溶液,最后加入11 mL 10%NP-40,使最终体积达到100 mL。
2. 样品采集
注:有关样本收集的更多详细信息,请参阅以前出版的作品15,22,40。
- 采集全血
- 在肝素包被的导管中收集血液,首选静脉而不是动脉血管(除非特别要求),并且更喜欢导管放置而不是静脉穿刺(如果可能),导管或针孔至少为20 G或更大,以尽量减少溶血。
- 立即加入NO2- 封闭溶液(将溶液的1部分加入4份全血中),处理(第3或4部分),或冷冻并储存在-80°C。
- 收集血浆和红细胞 (红细胞)
- 将血液收集在肝素包被的管中,首选静脉血而不是动脉血(除非特别要求)和至少20 G或更大的针头,以尽量减少溶血,并在4°C下以4000× g 立即离心5分钟。
- 在新管中将上清液(血浆)与NO2- 封闭溶液(溶液的1份至4份上清液)混合并处理(第3或4节),或冷冻并储存在-80°C。
注意:对于NO消耗测定,不能使用NO2- 封闭溶液。该测定可以在没有血浆预处理的情况下进行。 - 将RBC沉淀从底部重悬于预先填充有S-NO稳定溶液的新管中(参见步骤1.4)(1mL沉淀至9mL溶液)并孵育5分钟。
- 将红细胞裂解物与G-25 Sephadex聚合物一起在施胶柱中通过,该聚合物先前已用ddH2O冲洗以进行排阻色谱
- 收集Hb级分进行处理(第4节)并使用Drabkin试剂测量Hb浓度(对于Hb测量,请参阅先前发表的工作22)。
注意:要制备和采样特定的组织/器官,请识别其肺门,并通过手术分离。切开静脉,穿刺动脉,并通过动脉注射肝素化盐水(10 U / mL)。当生理盐水开始在静脉切口处回流时切除组织。用机械均质机使组织均质化,同时向4份均质组织加入1份NO2-封闭溶液。
3. VCl3 在HCl测定制备中的应用
注:有关HCl测定制备中VCl3 的更多详细信息,请参阅先前发表的著作37,41。
注意:如果进行此测定时NaOH陷阱未正确就位,则CLD将被损坏。这是由于HCl的腐蚀性。
- 为标准曲线准备NO3- 的标准溶液
- 将85mg的NaNO3 溶解在10mL的ddH2O中,以获得0.1M NaNO3- (该溶液保持稳定数周)。
- 使用储备溶液通过在ddH2O中稀释来制备标准品,以获得5μM,10μM,20μM,40μM,80μM,200μM NaNO3的浓度,以便对血浆或尿液样品进行校准曲线(如果使用细胞培养物,则使用较低浓度)。
- 制备VCl3(氯化钒)饱和溶液,用于在吹扫容器中减少NO3-
注意:水和VCl3 的反应是放热的。在实验结束时,在添加酸和冲洗玻璃器皿时要注意玻璃器皿的高温度。- 首先在干净的烧瓶中加入VCl3 ,然后加入200mL的1M HCl,将1.6g VCl3 溶解在200mL的1M HCl中。
- 真空过滤溶液通过滤纸(如11μm滤纸,但任何滤纸都可以使用)。
注意:过滤后的溶液应变为透明蓝色,而未过滤的VCl3 溶液由于未溶解的颗粒而呈棕色。 - 保持饱和溶液覆盖铝箔或聚四氟乙烯(PTFE)胶带,因为化合物对光敏感。
- 准备循环水浴
- 将循环水浴装置连接到吹扫容器的水套。在启动之前,请确保线条干燥。
- 在95°C下开始水浴,并通过在管线周围涂上(非粘附)纸巾来验证水管上没有泄漏。
- 设置气泡式疏水阀
- 验证起泡器的PTFE套管是否就位且未损坏。
- 打开气体鼓泡器,将15 mL 1 M NaOH注入鼓泡器底座中。
- 重新定位气泡器,并通过将底部向顶部按压并稍微扭转两个部件来紧紧密封连接。不可能在不施加力的情况下转动起泡器的顶部,这表明密封是正确的。
- 将吹扫容器的出口连接到气泡疏水阀的入口。
4. I3- 在乙酸测定制备中
注:有关I3- 在乙酸测定制备中的更多详细信息,请参阅先前发表的著作15,22,38,41,42。
- 准备 NO2 的标准曲线-
- 通过将69mg亚硝酸钠(NaNO2)溶解在10mL ddH2O中以制备储备溶液,以获得100mM溶液。如果储存在密闭容器中,冷藏并避光,该解决方案是稳定的。
- 将储备溶液连续稀释到预先填充有900μL ddH2O的1.5mL微量离心管中:将100μL储备溶液加入第一个离心管中,混合,标记,并使用100μL管作为第二管,然后重复产生10mM,1mM,然后100μM。
- 进一步用ddH2O稀释,得到50μM,25μM,10μM,1μM和500nM NaNO2 等分试样,用于校准曲线。
- 为吹扫容器准备I3- 醋酸(可在室温(RT)下储存1周)22
- 将2克碘化钾(KI)和1.3克碘(I2)加入40毫升ddH2O和140毫升乙酸中。
- 通过搅拌混合物至少30分钟彻底混合。
- 制备样品以区分测定NO2-,S-亚硝基硫醇(如果收集Hb,则为S-NO-Hb)和铁-亚硝基复合物(如果收集Hb,则为Hb-NO)(图3)
- 将每个样品分成3个等分试样,其中270μL(如果测量S-NO-Hb和Hb-NO,则为900μL Hb),放入光保护微量离心管中,其中2个预先填充30μL的1x PBS(如果测量S-NO-Hb和Hb-NO,则为100μL),第三个管中装有30μLHgCl2 (如果测量S-NO-Hb和Hb-NO,则为100μL), 涡旋并在室温下孵育2分钟(图3)。
- 向含有HgCl2 的样品中加入30μL的5%AS以测量Fe-NOs(100μL用于Hb-NO),并向添加PBS的样品中加入30μL以测量S-NOs和Fe-NOs(S-NO-Hb和Hb-NO为100μL),并向已经预先填充了1x PBS的第三个样品中加入30μLPBS以测量NO2-,S-NOs和Fe-NOs(100μL用于Hb收集的残留NO2- , S-NO 和 Hb-NO)。涡旋并在室温下孵育3分钟(图3)。
5. 通过无细胞 Hb 设置无需消耗
注:有关更多详细信息,请参阅先前发表的工作38。
- 从具有已知浓度的纯化储备Hb溶液中制备标准氧合氢化溶液
- 通过加入 ddH2O 将储备溶液连续稀释到 1.5 mL 微量离心管中,以获得将用于校准曲线的溶液:62 μM、50 μM、25 μM、12.5 μM、6.25 μM、3.125 μM、1.56 μM。
- 准备DETA-壬酸酯溶液
- 在pH 7.4 PBS中加入10mg DETA-NONOATE到610μL的10μM NaOH中,以产生100mM的DETA-壬酸酯并将其保存在冰上。
6.启动化学发光检测器(CLD)并准备吹扫容器
注:关于吹扫容器的制备,参见先前发表的工作43。
- 验证与 CLD 之间的主要连接
- 将氧气管路连接到CLD,并以与CLD制造商一致的压力打开氧气罐。
- 确保强场电介质 (IFD) 滤波管路连接到 CLD,但未连接到吹扫容器或 NaOH 疏水阀
- 启动 CLD
- 在 CLD 界面上,开始运行液相检测的检测程序。
- 验证氧气供应是否充足。如果是这种情况,CLD将成功从其入口开始采样,并指示通过以毫伏(0-5 mV)为单位的信号进行检测。否则,CLD 将提示阴性诊断信号。
- 准备吹扫容器
- 关闭所有三个端口上的吹扫容器:将针阀完全拧到右侧,关闭入口和出口旋塞阀。
- 从吹扫容器中取出盖子,并向反应室中加入足够量的计划测定特异性试剂(表1),以便用于注射样品的注射针可以到达流体柱。
- 验证是否存在稳定的所需基线(表1)。
- 启动吹扫气体流量
- 确保惰性气罐(例如N2)装有两级调节器,并将惰性气罐与容器的进气口连接。
- 在调节器处以1-5 psi的出口压力打开气体,打开吹扫容器的入口,然后慢慢打开吹扫容器的针阀以允许气体流入。验证吹扫容器内的冒泡。
- 调节气体流量
- 记录CLD测量的电池压力,IFD过滤器管路对环境空气进行采样。
- 将盖子重新定位在吹扫容器上,将IFD过滤管线连接到吹扫容器(或HCl测定中VCl3 中的NaOH陷阱),然后打开吹扫容器的出口。
- 使用针阀在CLD水平上达到与环境空气中记录的相同的电池压力。
7. 实验
注意:有关实验的更多详细信息,请参阅先前发表的工作43。
- 启动化学发光信号采集程序
- 将 CLD 的串行端口连接到已安装采集程序的计算机串行端口。
- 运行分析程序。
- 单击" 获取",选择要保存 .data 文件的文件夹,键入文件名,然后单击" 保存"。
注意:请注意屏幕上的预设运行时间,因为当预设时间过去时,录制会自动停止。如果需要,可以增加预设的运行时间。
- 为重复进样做好准备
- 调整屏幕上的电压刻度,通过单击" 最小值 "和/或" 最大值 "按钮,然后输入所需值来控制目标基线。
- 用一个装有ddH 2 O的20或50mL管在样品之间冲洗注射器。
- 准备一盒现成的精致任务湿巾。
- 样品进样
注意:从校准曲线的标准溶液开始(从浓度最低的样品注入到最集中的样品),然后继续进行实验样品(考虑一式两份或一式三份)。- 在取出每个样品之前(以及每次注射后),用ddH2O冲洗注射器至少两次或更多次,并在任务擦拭时验证每次无阻碍地喷射水。
- 将注射器插入样品管中,同时将注射器和管子保持近距离,将柱塞拉至所需体积,同时确保没有气泡和/或未均质化的固体部件被捕获。
- 用任务刮刀清洁注射器的尖端,然后将注射器插入注射口处的隔膜帽中,并在验证注射器的尖端在反应室的液相内后注射。
- 在软件程序中标记注入并等待
- 验证进样是否导致信号向上变化(补充图1)(通过无细胞Hb测定在NO消耗量中向下),并通过单击样品名称下的灰色框键入 样品名称,然后单击 标记注射。
注意:如果样品注射没有产生信号,则怀疑注射器阻塞。 - 等待电信号再次达到基线(这通常需要3-4分钟)。此时间可用于执行步骤 7.3.1。
- 验证进样是否导致信号向上变化(补充图1)(通过无细胞Hb测定在NO消耗量中向下),并通过单击样品名称下的灰色框键入 样品名称,然后单击 标记注射。
- 在每次注射期间和之后重复步骤7.3和7.4中指示的所有步骤,直到实验结束。请记住运行保存溶液的样品(如果使用)
- 停止实验
- 单击 STOP 可中断信号采集,停止 CLD 并关闭水浴(如果测量了 NO3-)。
- 中断气流,打开针阀,从吹扫容器中取下盖子,在排水管下放置废物容器并打开排水旋塞阀。
注意:如果实验需要数据采集时间超过60分钟,则需要在运行60分钟后重新开始采集(重复步骤7.1.3)并创建一个新文件。
8. 测量和计算
注意:测量和计算是离线进行的,可以在不同的时间执行。
- 启动化学发光采集程序进行离线数据分析
- 启动程序,然后单击" 处理"。
- 选择实验文件,然后单击" 打开"。
- 计算每次给药的曲线下面积
- 该软件在屏幕上自动绘制基线(补充图2A,水平黄线)和每个样品给药产生的每个波的峰值轴(垂直黄线):验证其正确位置(或通过单击每条线并用鼠标或箭头移动它进行调整),然后单击 阈值确定 (补充图2B)。
注意:在无细胞Hb测量测定的NO消耗中,软件通常无法正确捕获样品进样产生的波形。通过放大每个波形,操作员可以轻松协助软件进行面积计算(补充图2)。 - 该软件自动绘制由每次样品给药引起的每个峰的起点(垂直绿线)和终点(垂直红线):验证其正确位置(或通过单击每条线并用鼠标或箭头移动它进行调整)并单击 积分 (补充图2C)。
注意:此时迹线中的某些区域可能会被错误地定义为注射,并且某些峰值可能会被自动计数两次。在步骤 8.2.2 中,可以重新识别和删除这两个错误 - 软件自动匹配实验期间标记的注入后的每个信号区域及其指定的名称:通过单击"下一个峰值"和"上一个 峰值 ",使用指定的名称导航每个 峰值(由黄色垂直线指示),然后单击" 全部确定" 按钮,最终获得屏幕上所有区域的计算结果。
- 为了纠正用户或程序所犯的所有命名或匹配错误,请根据需要使用 补充文件1中指示的按钮。
- 该软件在屏幕上自动绘制基线(补充图2A,水平黄线)和每个样品给药产生的每个波的峰值轴(垂直黄线):验证其正确位置(或通过单击每条线并用鼠标或箭头移动它进行调整),然后单击 阈值确定 (补充图2B)。
- 将校准曲线值传输到电子表格并生成线性回归方程(补充图 3)
- 通过复制粘贴将数据从 CLD 程序传输到新的电子表格。将数据表上的两列排列为"曲线下的样品浓度"和"面积",并在两列上添加匹配值零。
- 选择两列,单击" 插入>散点图",然后在" 图表设计 "菜单下,选择" 添加图表元素>趋势线>线性"。
- 右键单击生成的趋势线,单击"设置趋势线格式",然后单击"设置趋势线格式"菜单上的"在图表上显示方程式"和"在图表上显示 R 平方值"选项,以获得简单的线性校准方程。
- 转移每个样品的计算面积以计算其浓度(补充图3)
- 报告电子表格上的每个值。在下一列中,应用从步骤8.3.3获得的方程以获得每个进样样品的浓度,其中y是浓度(新柱的值),x是注射后测量的曲线下的面积。
注意:请记住考虑在保存溶液中测量的浓度(如果使用),并相应地减去值。
- 报告电子表格上的每个值。在下一列中,应用从步骤8.3.3获得的方程以获得每个进样样品的浓度,其中y是浓度(新柱的值),x是注射后测量的曲线下的面积。
结果
通过无细胞Hb测定的NO消耗用于含有已知浓度的无细胞氧Hb的样品(图4)。由于氧肝素的一个血红素在化学计量法中释放出一个NO分子,因此纯化的无细胞氧肝素用于构建测定的校准曲线(补充图3)。
无细胞Hb(用比色测定法测量)与心脏手术期间体外循环(CPB)患者NO消耗之间的剂量 - 反应关系如图 5所示。可以假设?...
讨论
由于灵敏度高,用于测定NO和相关化合物的基于化学发光的测定具有NO2- 污染的高风险。实验中使用的每种试剂(特别是NO2- 封闭溶液)和稀释剂(包括ddH2O)都应测试其NO2- 含量以校正背景信号。亚硝酸盐反应性极强,全血半衰期约为10分钟,并迅速产生NO3-。因此,血液采集和离心之间的时间或NO2- 阻断可能...
披露声明
L.B.获得K23 HL128882 / NHLBI NIH的工资支持,作为他在溶血和一氧化氮方面工作的首席研究员。LB获得了乔治梅森大学Mercatus中心的"COVID-19研究快速拨款"和iNO Therapeutics LLC的资助。B.Y.由NHLBI / #R21HL130956和国防部/日内瓦基金会(W81XWH-19-S-CCC1,Log DM190244)的赠款支持。B.Y.在MGH获得了一氧化氮发电的专利。
L.B.和B.Y.已于2021年6月7日提交了专利申请,要求在COVID-19疾病PCT申请号:PCT/US2021/036269中不递送。RWC从国际药品采购机制获得工资支持,作为技术开发的首席研究员,旨在对资源匮乏地区的儿童进行结核病的分散诊断。
致谢
本手稿中报告的协议是由马萨诸塞州总医院麻醉科Warren Zapol博士的重症监护麻醉研究实验室的先前研究员的累积贡献而实现的。我们感谢Akito Nakagawa,Francesco Zadek,Emanuele Vassena,Chong Lei,Yasuko Nagasaka,Ester Spagnolli和Emanuele Rezoagli博士的贡献。
材料
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
参考文献
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。