È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Saggi basati sulla chemiluminescenza per la rilevazione di ossido nitrico e suoi derivati da autoxidazione e composti nitrosi
In questo articolo
Riepilogo
Qui presentiamo protocolli per rilevare l'ossido nitrico e i suoi derivati biologicamente rilevanti utilizzando saggi basati sulla chemiluminescenza ad alta sensibilità.
Abstract
L'attività dell'ossido nitrico (NO) in vivo è il risultato combinato dei suoi effetti diretti, dell'azione dei suoi derivati generati dall'autossidazione dell'NO e degli effetti dei composti nitrosi. La misurazione dei metaboliti no è essenziale per studiare l'attività dell'NO sia a livello vascolare che in altri tessuti, specialmente nei contesti sperimentali in cui viene somministrato NO esogeno. I saggi di chemiluminescenza a base di ozono consentono misurazioni precise dei metaboliti NO e NO sia nei fluidi (inclusi plasma, omogeneizzati tissutali, colture cellulari) che nelle miscele di gas (ad esempio, respiro espirato). L'NO reagisce con l'ozono per generare biossido di azoto allo stato eccitato. La conseguente emissione luminosa permette il fotorilevamento e la generazione di un segnale elettrico che riflette il contenuto di NO del campione. Le aliquote dello stesso campione possono essere utilizzate per misurare specifici metaboliti NO, come nitrati, nitriti, S-nitrosotioli e complessi ferro-nitrosilici. Inoltre, l'NO consumato dall'emoglobina priva di cellule viene anche quantificato con l'analisi di chemiluminescenza. Viene fornita un'illustrazione di tutte queste tecniche.
Introduzione
Da quando Salvador Moncada e i premi Nobel Robert Furchgott, Louis Ignarro e Ferid Murad hanno identificato l'ossido nitrico (NO) come il fattore di rilassamento derivato dall'endotelio (EDRF) precedentemente noto, il ruolo centrale dell'NO è stato stabilito in diversi meccanismi chiave che abbracciano la biologia vascolare, le neuroscienze, il metabolismo e la risposta dell'ospite 1,2,3,4,5,6,7 . La somministrazione esogena di gas NO è diventata un trattamento consolidato per l'insufficienza respiratoria dovuta all'ipertensione polmonare nel neonato8. Il gas di ossido nitrico è stato anche studiato per il trattamento dell'infezione da virus respiratorio sinciziale (RSV), della malaria e di altre malattie infettive, del danno da ischemia-riperfusione e per la prevenzione del danno renale acuto in pazienti sottoposti a cardiochirurgia 9,10,11,12. La necessità di tecniche di misurazione precise per valutare i livelli di NO, i suoi metaboliti e quelli delle sue proteine e composti bersaglio deriva da studi sia meccanicistici che interventistici.
A causa della sua elevata reattività, l'NO può subire reazioni diverse a seconda della matrice biologica in cui viene prodotto e/o rilasciato. In assenza di emoglobina (Hb) o altre ossi-emoproteine, l'NO viene ossidato quasi completamente a nitrito (NO2-).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2- + H+
L'NO subisce prima l'autossidazione con ossigeno molecolare (O2) per produrre biossido di azoto (NO2) e reagisce con l'NO2 stesso per generare triossido di diazoto (N2O3). Una molecola di N2O3 reagisce con l'acqua (H2O) per formare due molecole di NO2- e un protone (H+)13. All'interno del sangue intero 14,15, NO e NO2- vengono rapidamente convertiti in nitrato (NO3-) poiché queste molecole reagiscono avidamente con i gruppi eme ossidati di Hb [Hb-Fe2+-O2 o ossiemoglobina (oxyHb)] per produrre NO3-. Questa reazione è accoppiata con la transizione del gruppo eme allo stato ferrico [Hb-Fe3+ o metaemoglobina (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3-
La barriera dei globuli rossi (RBC) e lo spazio immediatamente adiacente all'endotelio sono i principali fattori che limitano questa reazione e consentono a una piccola porzione di NO rilasciato dall'endotelio di agire come EDRF16,17. Infatti, l'Hb privo di cellule in circolazione è noto per interrompere la vasodilatazione in contesti sperimentali e clinici17,18. All'interno del RBC, a seconda dell'ossigenazione e della concentrazione di NO2-, una porzione di NO reagisce con la deossiemoglobina (Hb-Fe2+) per formare ferro-nitrosil Hb (Hb-Fe2+-NO o HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
Nell'RBC15,17, NO2- può formare Hb-Fe3+ riducendo Hb-Fe2+ portando al rilascio di NO, che a sua volta lega Hb-Fe2+-O 2 (preferenzialmente) o Hb-Fe2+.
La generazione di NO-derivati non deve essere considerata strettamente unidirezionale in quanto l'NO può essere rigenerato da NO2- e NO3- in vari tessuti e da diversi enzimi (ad esempio, da batteri intestinali o all'interno dei mitocondri, in particolare in condizioni ipossiche)19,20.
Una quantità variabile di NO prodotto (o somministrato) porta alla generazione a valle di S-nitrosotioli, principalmente mediante transnitrosazione tiolica da N2O3 in presenza di un nucleofilo che crea un intermedio donatore NO+ (Nuc-NO+-NO2-):
N2O3 + RS- → RS-NO + NO2-
Un'altra possibilità per la generazione di S-nitrosotioli è la nitrosilazione dei tioli ossidati (NO che reagisce con un tiolo ossidato):
RS• + NO → RS-NO
Questo meccanismo e l'ossidazione diretta del tiolo da parte di NO2 potrebbero essere possibili solo in condizioni molto specifiche descritte altrove21. Gli S-nitrosotioli vanno da molecole leggere come S-nitrosoglutatione a grandi proteine contenenti tiolo. La S-nitrosoemoglobina (S-NO-Hb) è formata dalla nitrosazione di un gruppo tiolo di un residuo di cisteina conservato nella catena β (β93C)22.
La generazione e il metabolismo degli S-nitrosotioli fanno parte di importanti meccanismi di regolazione. Gli esempi includono la regolazione di glutatione, caspasi, N-metil-D-aspartato (NMDA) e recettori della rianodina 23,24,25,26,27,28. Precedentemente considerata come uno dei principali mediatori della biologia dell'NO in vivo, l'albumina nitrosata (S-nitroso-albumina) sembra essere un trasportatore NO/NO+ senza alcuna specifica attività biologica aggiuntiva29.
Quando si misura la concentrazione di NO e dei suoi derivati da uno specifico campione biologico all'interno di una matrice biologica, è importante considerare caratteristiche come l'acidità, l'ossigenazione, la temperatura e la presenza di reagenti. Gli esempi includono donatori di NO esogeni somministrati e, nel contesto dell'infiammazione acuta, il perossido di idrogeno (H2O2) che reagisce con NO2 portando alla generazione di concentrazione supernormale di radicali liberi come il perossinitrito (ONOO-)21. Oltre al metodo analitico che viene impiegato, è fondamentale la fase preanalitica di preparazione e conservazione del campione. Le reazioni a valle che non rappresentano l'attività di NO in vivo devono essere previste, considerate e bloccate. Un esempio valido è l'instabilità di S-NO-Hb, che richiede un trattamento dedicato dei campioni di sangue quando è mirato per la misurazione22.
I saggi basati sulla chemiluminescenza sono il gold standard per rilevare i livelli di NO e dei suoi principali metaboliti [NO2-, NO3-, S-NO e complessi ferro-nitrosilici (Fe-NO)] in qualsiasi fluido biologico, compresi gli omogeneizzati tissutali30,31. Questi metodi si basano sul rivelatore di chemiluminescenza (CLD), un dispositivo che ospita la reazione di NO con l'ozono (O3), generando NO2 in uno stato eccitato (NO2•). Il rilassamento di NO2• provoca l'emissione di un fotone di luce che viene rilevato da un tubo fotomoltiplicatore, generando un segnale elettrico direttamente proporzionale al contenuto di NO della miscela di gas campionata32. È rappresentato uno schema semplificato del CLD.

Figura 1: Schema semplificato di un rivelatore a chemiluminescenza per gas di ossido nitrico. Il rilevamento basato sulla chemiluminescenza dell'ossido nitrico (NO) è la generazione stechiometrica di un fotone per molecola di gas NO che viene introdotta nel rivelatore di chemiluminescenza (CLD). La reazione di chemiluminescenza è ottenuta in una camera designata alimentata con ozono (O3) da un generatore interno, che viene mantenuto a pressione negativa dal collegamento con una pompa esterna, consentendo un afflusso continuo e costante di gas campione. La generazione di O3 richiede ossigeno biatomico (O2) che viene fornito da un serbatoio O2 dedicato collegato al CLD (altri produttori forniscono CLD funzionanti con aria ambiente). All'interno della camera di reazione, ogni molecola di gas NO contenuta nel gas campionato reagisce con l'ossigeno per produrre una molecola di biossido di azoto allo stato attivato (NO2*). Tornando al suo stato fondamentale, ogni molecola di NO2* emette un fotone che viene rilevato da un tubo fotomoltiplicatore (PMT) situato adiacente alla camera di reazione. Il PMT con l'amplificatore associato e l'unità di elaborazione centrale produce un segnale proporzionale al conteggio dei fotoni e al numero di molecole di NO nella camera di reazione. Fare clic qui per visualizzare una versione più grande di questa figura.
L'ingresso del campione del CLD può essere collegato a un sistema di vetreria contenente una camera di reazione per campioni liquidi. Il sistema viene continuamente spurgato con un gas inerte come azoto, elio o argon, trasferendo NO dalla camera di reazione al CLD. I campioni in fase liquida vengono iniettati attraverso una membrana dedicata nel recipiente di spurgo.
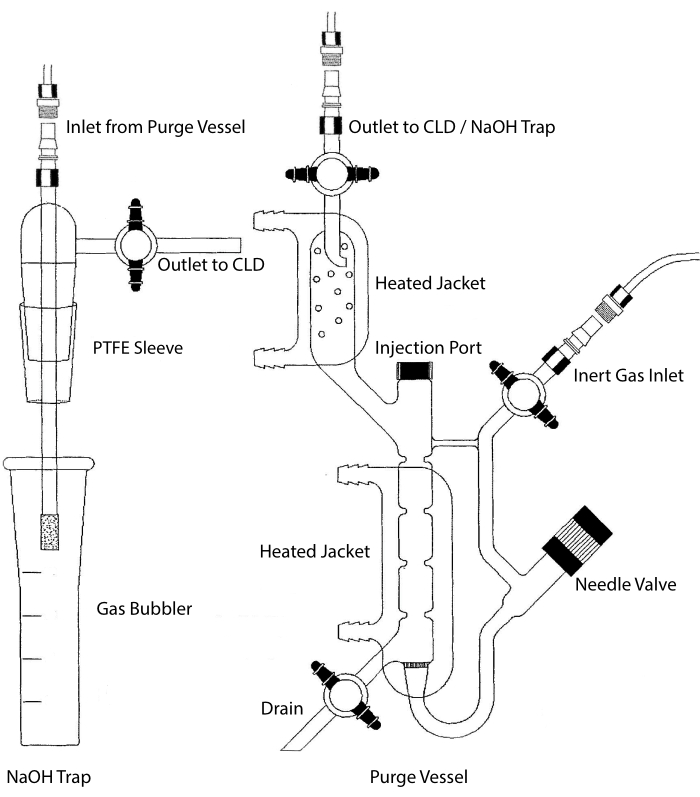
Figura 2: Struttura di un recipiente di spurgo per il rilevamento basato sulla chemiluminescenza del gas di ossido nitrico Il recipiente di spurgo (a destra) consente il rilevamento di gas di ossido nitrico (NO) o di qualsiasi altro composto che può essere facilmente convertito in gas NO quando rilasciato da un reagente in fase liquida. L'ingresso del gas inerte è collegato a una fonte (serbatoio) di un gas inerte come Argon, Xeon o azoto biatomico (N2). La valvola a spillo (si apre a sinistra) viene utilizzata per il controllo della pressione all'interno del recipiente di spurgo e può essere completamente rimossa per pulire la nave. La porta di iniezione è coperta da un cappuccio con un setto a membrana per l'iniezione del campione. La membrana deve essere sostituita spesso. Una camicia riscaldata circonda la camera di reazione ed è collegata a un bagno di acqua calda per eseguire il test VCl3 in HCl. L'uscita del recipiente di spurgo è collegata al rivelatore di chemiluminescenza (CLD) o alla trappola NaOH (necessaria per VCl3 nei saggi HCl). Per drenare il contenuto della camera di reazione, chiudere prima i rubinetti all'ingresso del gas inerte e all'uscita del recipiente di spurgo, chiudere la valvola a spillo, rimuovere il tappo alla porta di iniezione e infine aprire il rubinetto di arresto allo scarico. La trappola NaOH (a sinistra) deve essere posizionata in linea tra il recipiente di spurgo e il CLD se il VCl3 nel test HCl viene eseguito a causa della corrosività dell'HCl. Il collegamento al CLD richiede sempre un filtro dielettrico a campo intenso (IFD) da posizionare tra il CLD e l'uscita del recipiente di spurgo (o della trappola NaOH, se utilizzata). Il filtro IFD rimuove le particelle sospese nell'aria e impedisce al liquido di passare attraverso il recipiente di spurgo. PTFE = politetrafluoroetilene. Fare clic qui per visualizzare una versione più grande di questa figura.
Di conseguenza, qualsiasi composto che può essere convertito in NO attraverso una reazione chimica specifica e controllata può essere rilevato con elevata sensibilità in qualsiasi fluido biologico e omogeneizzato tissutale24. La misurazione diretta dell'NO in fase gassosa attraverso la chemiluminescenza viene eseguita sia in ambito sperimentale che clinico. Queste tecniche sono ampiamente descritte altrove 33,34,35. La misurazione di NO2-, S-nitrosotioli, proteine S-nitrosate e Fe-NO può essere eseguita aggiungendo campioni in una miscela di reazione con triioduro (I3-), che rilascia stechiometricamente gas NO da tutti questi composti:
I3- → I2 + I-
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mentre I3- non reagisce con NO 3-15. Misurazioni precise di ciascun composto sono rese possibili dal pretrattamento di aliquote campione con sulfanilamide acidificata (AS) con o senza cloruro mercurico (HgCl2). In particolare, il pre-trattamento con AS rimuove tutto il contenuto di NO2. Di conseguenza, il contenuto di NO misurato dal CLD riflette solo la somma della concentrazione di S-NO e Fe-NOs. L'iniezione di HgCl2 in un'aliquota del campione prima dell'iniezione di AS provoca il rilascio di NO2- da parte di S-NO. Il trattamento con AS (che porta alla rimozione di NO2-) assicura che il contenuto di NO misurato rifletta solo la concentrazione di Fe-NO. Una serie di sottrazioni tra le valutazioni permettono di calcolare la concentrazione precisa dei tre derivati no22.

Figura 3: Fasi della preparazione del campione per il saggio di chemiluminescenza dell'acido acetico I3- in. Vengono illustrate le fasi sequenziali per la preparazione del saggio di chemiluminescenza dell'acido acetico I3- in acido acetico. È richiesto l'uso di tubi centrifughi protetti dalla luce. I tubi 1, 2 e 3 sono quelli utilizzati per preparare il test. Un'altra aliquota di campionamento (tubo 4) è necessaria per il VCl3 nel saggio HCl se è richiesta la misurazione del nitrato (NO3-). I passi sono indicati da numeri in rosso. Preriempire (Fase 1) come indicato con tampone fosfato salino (PBS) o HgCl2 prima di aggiungere il volume del campione. Aggiungere il volume del campione (2) come indicato, vortice e incubare per 2 minuti a temperatura ambiente (RT). Aggiungere (3) PBS o sulfanilamide acidificata (AS) come indicato, vortice e incubare per 3 minuti a RT. Eseguire il test (4). La concentrazione misurata dal saggio è la somma della concentrazione dei composti riportati sotto ciascun tubo. Il tubo numero 1 consentirà misurazioni di nitriti (NO2-), S-nitrosotioli (S-NO) e complessi ferro-nitrosilici (Fe-NO) come un singolo segnale. Per la misurazione dei nitrati (NO3-), i campioni devono essere eseguiti sia con I3- in acido acetico che con VCl3 nei saggi HCl, e il valore ottenuto dal tubo 1 deve essere sottratto da quello ottenuto dal tubo 4. *quantità suggerite da utilizzare per l'analisi dell'Hb per la determinazione dell'NO2 residuo, della S-nitrosoemoglobina e dell'emoglobina ferro-nitrosil-emoglobina. Fare clic qui per visualizzare una versione più grande di questa figura.
Per la misurazione dell'NO3- il cloruro di vanadio (III) (VCl3) in acido cloridrico (HCl) viene utilizzato per la conversione di NO3- in NO nel recipiente di spurgo al fine di misurare stechiometricamente l'NO3- con il CLD:
2 NO3-+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Per ottenere una conversione sufficientemente veloce, la reazione deve essere eseguita a 90-95 °C. La riduzione da NO3- a NO2- è accoppiata con la riduzione di NO2- a NO da HCl. Il metallo vanadio riduce anche gli S-NO liberando la loro frazione di NO22,36. La concentrazione finale ottenuta da CLD con VCl3 in HCl riflette la concentrazione aggregata di NO3-, NO2 e altri composti nitrosi. La sottrazione di quest'ultimo valore dalla concentrazione prodotta con CLD con I3- consente il calcolo della concentrazione di NO3- 36,37 (Figura 3).
Nel test di consumo di NO, il rilascio continuo di NO nel vaso di spurgo da parte di donatori di NO come (Z)-1-[2-(2-amminoetil)-N-(2-ammonioetil)ammino]diazen-1-ium-1,2-diolato (DETA-NONOato) genera un segnale stabile che consente di quantificare l'ossiHb privo di cellule nei campioni iniettati. La quantità di NO consumata nel recipiente di spurgo è in una relazione stechiometrica con la quantità di oxyHb nel campione38.
Vengono illustrati i protocolli per la misurazione di NO2-, NO3-, S-nitrosotioli, complessi ferro-nitrosilici e consumo di NO da parte di Hb senza cellule in campioni di plasma. Gli studi sull'NO nell'ambiente RBC richiedono un trattamento specifico del campione seguito da cromatografia di esclusione per misurare S-NO-Hb e Hb-NO estremamente fragili accoppiati con la determinazione della concentrazione totale di Hb15,22. La preparazione del campione è strumentale alla correzione della misurazione. La preesistenza di NO2- in H2O e il rilascio di NO2- durante il test possono portare alla misurazione di concentrazioni artificialmente più elevate di derivati NO come S-NO-Hb14,39. Vengono inoltre presentati aspetti importanti della preparazione del campione.
Protocollo
Le procedure indicate in questo protocollo sono in conformità con il comitato di revisione del Massachusetts General Hospital. I campioni di sangue utilizzati erano stati raccolti durante uno studio precedente e sono stati de-identificati per lo scopo attuale18.
NOTA: vedere le istruzioni del produttore per indicazioni specifiche sui collegamenti ottimali tra tubi e bicchieri che costituiscono il recipiente di spurgo, il lavaggio e la manutenzione generale. Le connessioni devono essere solide e fatte con cura per non danneggiare la vetreria. Identificare i componenti del recipiente di spurgo del vetro: linea di ingresso del gas, recipiente di spurgo con camicia di riscaldamento e condensatore, trappola per gorgogliatori di gas idrossido di sodio (NaOH), linea di collegamento tra il recipiente di spurgo e il gorgogliatore, linea del gas di uscita del recipiente di spurgo (a CLD) dotata di un filtro dielettrico a campo intenso (IFD). Una linea filtrante IFD tra il recipiente di spurgo e l'ingresso del campione del CLD deve essere in posizione ogni volta che NON vengono misurati metaboliti in forma liquida (plasma, colture cellulari, omogeneizzati tissutali) (tutti i saggi presentati nel protocollo). La preparazione del campione dipende dal fluido o dal tessuto che viene analizzato e dai composti di interesse. Aspetti importanti della fase preanalitica sono trattati nelle sezioni 1 e 2. Le fasi di preparazione specifiche per test specifici sono incluse nelle sezioni 3-5. Le sezioni 6-8 si applicano a tutti i test.
1. Preparazione di reagenti dedicati
NOTA: Per maggiori dettagli, fare riferimento alle precedenti pubblicazioni15,22.
- Preparare la soluzione acidificata al 5% (290 mM) di sulfanilamide (AS) per la rimozione di NO2- sciogliendo 500 mg di sulfanilamide in 10 mL di 1N HCl. Questa soluzione è stabile per mesi.
- Preparare la soluzione di cloruro mercurico (HgCl2) da 50 mM per il rilascio di NO2 da S-NOs sciogliendo 67,9 mg di HgCl2 in 5 ml di PBS. Proteggere la soluzione madre dalla luce.
- Preparare la soluzione di NO2- bloccante con ferricianuro da 800 mM [K3Fe(CN)6] per ossidare Hb insieme a 100 mM N-etilmaleimmide (NEM) per bloccare i gruppi tiolici e (OPZIONALE) soluzione di glicole nonilfenile-polietilenico al 10% (Nonidet p-40) per solubilizzare le membrane dei globuli rossi.
- Aggiungere K3Fe(CN)6 all'acqua deionizzata e distillata (ddH2O, 263,5 g di polvere per litro) per ottenere una concentrazione finale di 800 mM.
- Aggiungere NEM agli 800 mM K3Fe(CN)6 in soluzione di ddH2O (12,5 g di polvere per litro per avere una concentrazione di 100 mM) e mescolare la soluzione per sciogliere tutti i cristalli.
- Aggiungere una parte del 10% di NP-40 a nove parti della soluzione NEM K3Fe(CN)6 100 mM da 800 mM NEM (111 ml per litro) e mescolare bene (passaggio obbligatorio per l'analisi del sangue intero).
- Preparare la soluzione di stabilizzazione S-NO-Hb contenente 12 mM K3Fe(CN)6, 10 mM NEM, acido dietilentriamminotentapentaacetico da 100 μM (DTPA, per la chelazione dei metalli) e detergente Nonidet p-40 all'1% dalle loro soluzioni stock.
- Preparare una soluzione NEM da 200 mM aggiungendo cristalli NEM al PBS (25 mg/mL, ad esempio 250 mg in 10 mL PBS) e mescolare la soluzione fino a quando tutti i cristalli sono disciolti (da produrre il giorno dell'esperimento).
- Preparare una soluzione di K3Fe(CN)6 da 800 mM aggiungendo K3Fe(CN)6 a ddH2O (263,5 mg/mL, ad esempio 1,32 g in 5 mL di ddH2O per ottenere una concentrazione finale di 800 mM) (da effettuare il giorno dell'esperimento).
- Preparare una soluzione madre di DTPA da 10 mM aggiungendo 786 mg di DTPA a 200 mL di ddH2O e regolare il pH a 7,0 con 5N NaOH per solubilizzare completamente DTPA.
- Aggiungere 5 mL di soluzione NEM da 200 mM, 1,5 mL di soluzione K3Fe(CN)6 da 800 mM e 1 mL di soluzione madre DTPA a 81,5 mL di PBS a 7,2 pH e, infine, aggiungere infine 11 mL di NP-40 al 10% per portare il volume finale a 100 mL.
2. Raccolta dei campioni
NOTA: Per maggiori dettagli sulla raccolta dei campioni, fare riferimento alle opere precedentemente pubblicate 15,22,40.
- Raccogli sangue intero
- Raccogliere il sangue in tubi rivestiti di eparina preferendo il vaso venoso a quello arterioso (a meno che non sia specificamente richiesto) e preferendo il posizionamento del catetere rispetto alla venipuntura (se possibile) con catetere o ago di almeno 20 G o più grande per ridurre al minimo l'emolisi.
- Aggiungere immediatamente la soluzione che blocca l'NO2 (1 parte della soluzione a 4 parti di sangue intero), elaborare (paragrafi 3 o 4) o congelare e conservare a -80 °C.
- Raccogliere plasma e globuli rossi (RBC)
- Raccogliere il sangue in tubi rivestiti di eparina preferendo il sangue venoso a quello arterioso (se non specificamente richiesto) e aghi di almeno 20 G o più grandi per ridurre al minimo l'emolisi e centrifugare immediatamente per 5 minuti a 4000 x g a 4 °C.
- Mescolare il surnatante (plasma) con la soluzione bloccante NO2 (1 parte della soluzione in 4 parti del surnatante) in un nuovo tubo e processo (sezioni 3 o 4), oppure congelare e conservare a -80 °C.
NOTA: per il test di consumo NO, non è possibile utilizzare la soluzione di blocco NO2. Il test può essere eseguito senza pretrattamento al plasma. - Risospesso il pellet RBC dal fondo in un nuovo tubo preriempito con soluzione di stabilizzazione S-NO (vedere fase 1.4) (1 mL di pellet a 9 mL di soluzione) e incubare per 5 min.
- Passare il lisato RBC in una colonna di dimensionamento con polimero G-25 Sephadex che è stato precedentemente risciacquato con ddH2O per cromatografia di esclusione
- Raccogliere la frazione Hb da processare (sezione 4) e misurare la concentrazione di Hb utilizzando il reagente di Drabkin (per la misurazione dell'Hb, fare riferimento al lavoroprecedentemente pubblicato 22).
NOTA: Per preparare e campionare un tessuto/organo specifico, identificare il suo ilo e isolarlo chirurgicamente. Incidere la vena, perforare l'arteria e iniettare con soluzione salina eparinizzata (10 U / mL) attraverso l'arteria. Asportare il tessuto quando la soluzione salina inizia a riflusso all'incisione venosa. Omogeneizzare il tessuto con un omogeneizzatore meccanico aggiungendo 1 parte di soluzione bloccante NO2 a 4 parti di tessuto omogeneizzato.
3. VCl3 nella preparazione del saggio HCl
NOTA: Per maggiori dettagli sul VCl3 nella preparazione del saggio HCl, fare riferimento ai lavori precedentemente pubblicati37,41.
ATTENZIONE: il CLD sarà danneggiato se la trappola NaOH non è correttamente in posizione durante l'esecuzione di questo test. Ciò è dovuto alla corrosività di HCl.
- Preparare soluzioni standard di NO3- per curve standard
- Sciogliere 85 mg di NaNO3 in 10 mL di ddH2O per ottenere 0,1 M NaNO3- (questa soluzione rimane stabile per alcune settimane).
- Utilizzare la soluzione madre per preparare gli standard mediante diluizione in ddH2O per ottenere concentrazioni di 5 μM, 10 μM, 20 μM, 40 μM, 80 μM, 200 μM NaNO3 al fine di eseguire una curva di calibrazione per campioni di plasma o urina (utilizzare concentrazioni più basse se si lavora con colture cellulari).
- Preparare la soluzione satura di VCl3 (cloruro di vanadio) per la riduzione di NO3- nel recipiente di spurgo
ATTENZIONE: La reazione dell'acqua e del VCl3 è esotermica. Prestare attenzione all'alta temperatura della vetreria quando si aggiunge acido e quando si risciacqua la vetreria alla fine dell'esperimento.- Sciogliere 1,6 g di VCl3 in 200 mL di 1 M HCl aggiungendo prima VCl3 in un matraccio pulito, quindi aggiungendo 200 mL di 1 M HCl.
- Filtrare sottovuoto la soluzione attraverso carta da filtro (ad esempio carta da filtro da 11 μm, ma è possibile utilizzare qualsiasi carta da filtro).
NOTA: la soluzione filtrata deve diventare blu chiaro, mentre la soluzione di VCl3 non filtrata è marrone a causa di particelle non disciolte. - Mantenere la soluzione satura coperta con un foglio di alluminio o nastro in politetrafluoroetilene (PTFE) poiché il composto è sensibile alla luce.
- Preparare il bagno d'acqua circolante
- Collegare un dispositivo a bagno d'acqua circolante alla camicia d'acqua del recipiente di spurgo. Assicurarsi che le linee siano asciutte prima dell'adescamento.
- Avviare il bagno d'acqua a 95 °C e verificare l'assenza di perdite sulle linee dell'acqua applicando (non aderenti) carta assorbente attorno alle linee.
- Impostare la trappola del gorgogliatore di gas
- Verificare che il manicotto in PTFE del gorgogliatore sia in posizione e che non sia danneggiato.
- Aprire il gorgogliatore di gas e iniettare 15 mL di 1 M NaOH nella base del gorgogliatore.
- Riposizionare il gorgogliatore di gas e sigillare saldamente la connessione premendo il fondo verso l'alto e ruotando leggermente le due parti. L'impossibilità di girare la parte superiore del gorgogliatore senza applicare forza indica una tenuta corretta.
- Collegare l'uscita del recipiente di spurgo all'ingresso della trappola del gorgogliatore di gas.
4. I3- nella preparazione del saggio dell'acido acetico
NOTA: Per maggiori dettagli su I3- nella preparazione del saggio dell'acido acetico, fare riferimento ai lavori precedentemente pubblicati 15,22,38,41,42.
- Preparare la curva standard per NO2-
- Preparare una soluzione madre sciogliendo 69 mg di nitrito di sodio (NaNO2) in 10 mL di ddH2O per ottenere una soluzione da 100 mM. Questa soluzione è stabile se conservata in un contenitore ermetico, refrigerata e protetta dalla luce.
- Diluire in serie la soluzione madre in un tubo microcentrifuga da 1,5 mL preriempito con 900 μL di ddH2O: aggiungere 100 μL della soluzione madre al primo tubo centrifugo, mescolare, etichettare e utilizzare 100 μL del tubo per il secondo tubo, quindi ripetere risultando 10 mM, 1 mM, quindi 100 μM.
- Diluire ulteriormente con ddH2O per ottenere aliquote NaNO 2 da 50 μM, 25 μM, 10 μM, 1 μM e 500 nM NaNO2 da utilizzare nella curva di taratura.
- Preparare l'acido acetico I3- in per il recipiente di spurgo (può essere conservato a temperatura ambiente (RT) per 1 settimana)22
- Aggiungere 2 g di ioduro di potassio (KI) e 1,3 g di iodio (I2) a 40 ml di ddH2O e 140 ml di acido acetico.
- Mescolare accuratamente mescolando il composto per almeno 30 minuti.
- Preparare i campioni per la determinazione differenziale di NO2-, S-nitrosotioli (S-NO-Hb, se viene raccolto Hb) e complessi ferro-nitrosilici (Hb-NO se viene raccolto Hb) (Figura 3)
- Dividere ciascun campione in 3 aliquote di 270 μL (900 μL di Hb se si misurano S-NO-Hb e Hb-NO) in tubi microcentrifuga protetti dalla luce, 2 dei quali preriempiti con 30 μL di 1x PBS (100 μL se misurano S-NO-Hb e Hb-NO) e il terzo tubo con 30 μL di HgCl2 (100 μL se misurano S-NO-Hb e Hb-NO), vortice e incubazione a RT per 2 minuti (Figura 3).
- Aggiungere 30 μL di 5% AS al campione con HgCl2 per misurare Fe-NO-NOs, (100 μL per Hb-NO) e a uno con PBS aggiunto per misurare S-NOs e Fe-NOs (100 μL per S-NO-Hb e Hb-NO) e aggiungere 30 μL di PBS al terzo già pre-riempito con 1x PBS per misurare NO2-, S-NOs e Fe-NOs (100 μL per NOresiduo 2- dalla raccolta di Hb, S-NO e Hb-NO). Vortice e incubazione a RT per 3 minuti (Figura 3).
5. NESSUN consumo con configurazione Hb senza celle
NOTA: Per maggiori dettagli, fare riferimento al lavoro precedentemente pubblicato38.
- Preparare soluzioni standard di oxyHb da una soluzione di Hb stock purificata con una concentrazione nota
- Diluire serialmente la soluzione madre in tubi microcentrifuga da 1,5 mL con aggiunta di ddH2O per ottenere le soluzioni che verranno utilizzate per la curva di calibrazione: 62 μM, 50 μM, 25 μM, 12,5 μM, 6,25 μM, 3.125 μM, 1,56 μM.
- Preparare la soluzione DETA-NONOate
- Aggiungere 10 mg di DETA-NONOate a 610 μL di NaOH 10 μM in pH 7,4 PBS per generare 100 mM di DETA-NONOato e mantenerlo sul ghiaccio.
6. Avviare il rilevatore di chemiluminescenza (CLD) e preparare il recipiente di spurgo
NOTA: Per la preparazione della nave di spurgo, fare riferimento al lavoro precedentemente pubblicato43.
- Verificare le connessioni principali da e verso il CLD
- Collegare la linea dell'ossigeno al CLD e aprire il serbatoio dell'ossigeno a una pressione concordata con il produttore del CLD.
- Assicurarsi che la linea filtrante IFD (Intense Field Dielectric) sia collegata al CLD ma non al recipiente di spurgo o alla trappola NaOH
- Avviare il CLD
- Sull'interfaccia CLD, avviare l'esecuzione del programma di rilevamento per i saggi in fase liquida.
- Verificare che l'apporto di ossigeno sia adeguato. In questo caso, il CLD inizierà con successo il campionamento dal suo ingresso e indicherà il rilevamento da parte di un segnale in millivolt (0-5 mV). In caso contrario, il CLD richiederà un segnale diagnostico negativo.
- Preparare il recipiente di spurgo
- Chiudere il recipiente di spurgo su tutte e tre le porte: avvitare completamente la valvola a spillo a destra, chiudere i rubinetti di ingresso e di uscita.
- Rimuovere il tappo dal recipiente di spurgo e aggiungere una quantità sufficiente del reagente specifico per il saggio pianificato alla camera di reazione (Tabella 1) in modo che l'ago della siringa utilizzato per iniettare i campioni possa raggiungere la colonna di fluido.
- Verificare la presenza di una linea di base desiderata stabile (Tabella 1).
- Avviare il flusso di gas di spurgo
- Assicurarsi che il serbatoio del gas inerte (ad esempio, N2) sia dotato di un regolatore a due stadi e collegare il serbatoio del gas inerte con l'ingresso del gas del recipiente.
- Aprire il gas con una pressione di uscita al regolatore di 1-5 psi, aprire l'ingresso del recipiente di spurgo e aprire lentamente la valvola a spillo del recipiente di spurgo per consentire l'afflusso di gas. Verificare il gorgogliamento all'interno del recipiente di spurgo.
- Regolare il flusso di gas
- Registrare la pressione della cella misurata dal CLD con la linea di filtraggio IFD che campiona l'aria ambiente.
- Riposizionare il cappuccio sul recipiente di spurgo, collegare la linea del filtro IFD al recipiente di spurgo (o alla trappola NaOH nel VCl3 nel test HCl) e aprire l'uscita del recipiente di spurgo.
- Utilizzare la valvola a spillo per raggiungere la stessa pressione della cella al livello CLD registrato nell'aria ambiente.
7. Esperimento
NOTA: Per maggiori dettagli sull'esperimento, fare riferimento al lavoroprecedentemente pubblicato 43.
- Avviare il programma di acquisizione del segnale di chemiluminescenza
- Collegare la porta seriale del CLD alla porta seriale del computer in cui è stato installato il programma di acquisizione.
- Eseguire il programma di analisi.
- Fare clic su Acquisisci, selezionare la cartella in cui salvare il file .data, digitare il nome del file e fare clic su Salva.
NOTA: notare il tempo di esecuzione preimpostato sullo schermo, poiché la registrazione si interrompe automaticamente allo scadere del tempo preimpostato. Se necessario, il tempo di esecuzione preimpostato può essere aumentato.
- Prepararsi per iniezioni ripetute di campioni
- Regolare la scala di tensione sullo schermo per avere il controllo sulla linea di base di destinazione facendo clic sui pulsanti Minimo e/o Massimo e quindi inserendo il valore desiderato.
- Avere un tubo da 20 o 50 ml riempito con ddH2O per risciacquare la siringa tra i campioni.
- Avere una scatola di salviette delicate prontamente disponibili.
- Iniezione del campione
NOTA: Iniziare dalle soluzioni standard per la curva di calibrazione (iniettare dai campioni meno concentrati a quelli più concentrati), quindi procedere ai campioni dell'esperimento (considerare di farlo in duplicati o triplicati).- Risciacquare la siringa almeno due volte o più con ddH2O prima di prelevare ogni campione (e dopo ogni iniezione) e verificare ogni volta l'espulsione di acqua senza ostacoli su una salvietta da attività.
- Inserire la siringa nella provetta del campione tenendo sia la siringa che il tubo a distanza ravvicinata, tirare lo stantuffo al volume desiderato assicurandosi che nessuna bolla d'aria e/o parti solide non omogeneizzate siano intrappolate.
- Pulire la punta della siringa con un tergicristallo, quindi inserire la siringa nel cappuccio dei setti in corrispondenza della porta di iniezione e iniettare dopo aver verificato che la punta della siringa rientri nella fase liquida nella camera di reazione.
- Contrassegnare l'iniezione nel programma software e attendere
- Verificare che l'iniezione causi un cambiamento verso l'alto nel segnale (Figura supplementare 1) (verso il basso nel consumo di NO mediante test Hb senza cellule) e digitare il nome del campione facendo clic sulla casella grigia in Nomi campione, quindi fare clic su Segna iniezione.
NOTA: sospetta ostruzione della siringa se l'iniezione del campione non genera un segnale. - Attendere che il segnale elettrico raggiunga nuovamente la linea di base (questo di solito richiede 3-4 minuti). Questa volta può essere utilizzato per eseguire il passaggio 7.3.1.
- Verificare che l'iniezione causi un cambiamento verso l'alto nel segnale (Figura supplementare 1) (verso il basso nel consumo di NO mediante test Hb senza cellule) e digitare il nome del campione facendo clic sulla casella grigia in Nomi campione, quindi fare clic su Segna iniezione.
- Ripetere tutti i passaggi indicati nei passaggi 7.3 e 7.4 durante e dopo ogni iniezione fino alla fine dell'esperimento. Ricordarsi di eseguire un campione della soluzione di conservazione (se utilizzata)
- Interrompere l'esperimento
- Fare clic su STOP per interrompere l'acquisizione del segnale, arrestare il CLD e spegnere il bagno d'acqua (se viene misurato NO3-).
- Interrompere il flusso di gas, aprire la valvola a spillo, rimuovere il tappo dal recipiente di spurgo, posizionare un contenitore per i rifiuti sotto lo scarico e aprire il rubinetto di scarico.
NOTA: se l'esperimento richiede l'acquisizione dei dati per più di 60 minuti, è necessario riavviare l'acquisizione dopo 60 minuti di tempo di esecuzione (ripetere il passaggio 7.1.3) e creare un nuovo file.
8. Misurazioni e calcoli
NOTA: le misurazioni e i calcoli vengono effettuati offline e possono essere eseguiti in un momento diverso.
- Avvia il programma di acquisizione della chemiluminescenza per l'analisi dei dati offline
- Avviare il programma e fare clic su Processo.
- Seleziona il file dell'esperimento, quindi fai clic su Apri.
- Calcola l'area sotto la curva per ogni somministrazione
- Il software traccia automaticamente sullo schermo la linea di base (Figura supplementare 2A, linea gialla orizzontale) e l'asse di picco di ogni onda generata da ciascuna somministrazione del campione (linee gialle verticali): verificarne la posizione corretta (o regolarla cliccando su ogni linea e spostandola con il mouse o le frecce) e cliccare su Soglia OK (Figura supplementare 2B).
NOTA: nel consumo di NO mediante test di misurazione Hb senza cellule, il software in genere non riesce a catturare correttamente la forma d'onda generata dall'iniezione del campione. Zoomando su ogni forma d'onda, l'operatore può facilmente assistere il software nel calcolo dell'area (Figura supplementare 2). - Il software rappresenta automaticamente l'inizio (linea verde verticale) e la fine (linea rossa verticale) di ogni picco causato da ciascuna somministrazione del campione: verificarne la corretta posizione (o regolarla cliccando su ogni linea e spostandola con il mouse o le frecce) e cliccare su Integra (Figura supplementare 2C).
NOTA: alcune aree della traccia possono essere erroneamente definite come iniezioni a questo punto e alcuni picchi possono essere contati automaticamente due volte. Entrambi gli errori possono essere nuovamente identificati e rimossi durante il passaggio 8.2.2 - Il software abbina automaticamente ogni area del segnale a seguito di un'iniezione segnata durante l'esperimento e il suo nome assegnato: naviga ogni picco (indicato da una linea verticale gialla) con il nome assegnato cliccando su Next Peak e Previous Peak, quindi clicca sul pulsante All OK per ottenere finalmente il calcolo per tutte le aree sullo schermo.
- Al fine di correggere tutti gli errori di denominazione o di corrispondenza commessi dall'utente o dal programma, utilizzare secondo necessità i pulsanti indicati nel file supplementare 1.
- Il software traccia automaticamente sullo schermo la linea di base (Figura supplementare 2A, linea gialla orizzontale) e l'asse di picco di ogni onda generata da ciascuna somministrazione del campione (linee gialle verticali): verificarne la posizione corretta (o regolarla cliccando su ogni linea e spostandola con il mouse o le frecce) e cliccare su Soglia OK (Figura supplementare 2B).
- Trasferire i valori della curva di calibrazione in un foglio di calcolo e generare un'equazione di regressione lineare (Figura supplementare 3)
- Trasferire i dati dal programma CLD a un nuovo foglio di calcolo tramite copia-incolla. Disporre le due colonne del foglio dati come Concentrazione campione e Area sotto la curva e aggiungere un valore corrispondente pari a zero su entrambe le colonne.
- Selezionare le due colonne, fare clic su Inserisci > Dispersione, quindi nel menu Progettazione grafico selezionare Aggiungi elemento grafico > linea di tendenza > lineare.
- Fare clic con il pulsante destro del mouse sulla linea di tendenza generata, fare clic su Formato linea di tendenza, quindi fare clic sulle opzioni Visualizza equazioni sul grafico e Visualizza valore R-quadrato su Grafico nel menu Formato linea di tendenza per ottenere una semplice equazione di calibrazione lineare.
- Trasferire l'area calcolata di ciascun campione per calcolarne la concentrazione (Figura supplementare 3)
- Segnala ogni valore sul foglio di calcolo. Nella colonna successiva, applicare l'equazione ottenuta dal punto 8.3.3 per ottenere la concentrazione di ciascun campione iniettato, dove y è la concentrazione (valore della nuova colonna) e x è l'area sotto la curva misurata dopo l'iniezione.
NOTA: Ricordarsi di prendere in considerazione la concentrazione misurata nella soluzione di conservazione (se utilizzata) e sottrarre i valori di conseguenza.
- Segnala ogni valore sul foglio di calcolo. Nella colonna successiva, applicare l'equazione ottenuta dal punto 8.3.3 per ottenere la concentrazione di ciascun campione iniettato, dove y è la concentrazione (valore della nuova colonna) e x è l'area sotto la curva misurata dopo l'iniezione.
Risultati
Il consumo di NO mediante il saggio hb senza cellule è stato utilizzato in campioni contenenti concentrazioni note di ossiHb privo di cellule (Figura 4). Poiché un eme di oxyHb rilascia stechiometricamente una molecola NO nel test, l'oxyHb privo di cellule purificate viene utilizzato per costruire la curva di calibrazione per il test (Figura supplementare 3).
La relazione dose-risposta tra Hb senza cellule (misurata con un test colorimetrico) e ...
Discussione
A causa dell'elevata sensibilità, i saggi basati sulla chemiluminescenza per la determinazione dell'NO e dei composti correlati hanno un alto rischio di contaminazione da NO2-. Ogni reagente (in particolare la soluzione che blocca l'NO2) e il diluente (incluso il ddH2O) utilizzati nell'esperimento devono essere testati per il suo contenuto di NO2- per correggere il segnale di fondo. Il nitrito è estremamente reattivo con un'emivita nel sangue ...
Divulgazioni
L.B. riceve supporto salariale da K23 HL128882 / NHLBI NIH come ricercatore principale per il suo lavoro sull'emolisi e l'ossido nitrico. LB riceve sovvenzioni da "Fast Grants for COVID-19 research" presso il Mercatus Center della George Mason University e da iNO Therapeutics LLC. B.Y. è supportato da sovvenzioni di un NHLBI/#R21HL130956 e DOD/The Geneva Foundation (W81XWH-19-S-CCC1, Log DM190244). B.Y. ha ricevuto brevetti presso MGH sulla generazione elettrica di ossido nitrico.
L.B. e B.Y. hanno depositato la domanda di brevetto per NO delivery nel numero di domanda PCT della malattia COVID-19: PCT / US2021 / 036269 depositato il 7 giugno 2021. RWC riceve sostegno salariale da Unitaid come ricercatore principale per lo sviluppo tecnologico finalizzato alla diagnosi decentralizzata della tubercolosi nei bambini situati in contesti a basso consumo di risorse.
Riconoscimenti
I protocolli riportati in questo manoscritto sono stati resi possibili dai contributi accumulati di precedenti borsisti del laboratorio di ricerca sull'anestesia in terapia intensiva del Dr. Warren Zapol, Dipartimento di Anestesia presso il Massachusetts General Hospital. Riconosciamo il contributo dei dottori Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli ed Emanuele Rezoagli.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon