Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayos basados en quimioluminiscencia para la detección de óxido nítrico y sus derivados de la autoxidación y compuestos nitrosados
En este artículo
Resumen
Aquí, presentamos protocolos para detectar el óxido nítrico y sus derivados biológicamente relevantes utilizando ensayos basados en quimioluminiscencia con alta sensibilidad.
Resumen
La actividad del óxido nítrico (NO) in vivo es el resultado combinado de sus efectos directos, la acción de sus derivados generados a partir de la autoxidación del NO y los efectos de los compuestos nitrosados. La medición de los metabolitos de NO es esencial para estudiar la actividad del NO tanto a nivel vascular como en otros tejidos, especialmente en los entornos experimentales donde se administra NO exógeno. Los ensayos de quimioluminiscencia a base de ozono permiten mediciones precisas de metabolitos de NO y NO tanto en fluidos (incluidos plasma, homogeneizados de tejidos, cultivos celulares) como en mezclas de gases (por ejemplo, aliento exhalado). El NO reacciona con el ozono para generar dióxido de nitrógeno en un estado excitado. La consiguiente emisión de luz permite la fotodetección y la generación de una señal eléctrica que refleje el contenido de NO de la muestra. Las alícuotas de la misma muestra se pueden usar para medir metabolitos específicos de NO, como nitrato, nitrito, S-nitrosotioles y complejos hierro-nitrosil. Además, el NO consumido por la hemoglobina libre de células también se cuantifica con el análisis de quimioluminiscencia. Se proporciona una ilustración de todas estas técnicas.
Introducción
Desde que Salvador Moncada y los premios Nobel Robert Furchgott, Louis Ignarro y Ferid Murad identificaron el óxido nítrico (NO) como el factor de relajación derivado del endotelial (EDRF) previamente conocido, el papel central del NO se ha establecido en varios mecanismos clave que abarcan toda la biología vascular, las neurociencias, el metabolismo y la respuesta del huésped 1,2,3,4,5,6,7 . La administración exógena de NO gas se ha convertido en un tratamiento establecido para la insuficiencia respiratoria por hipertensión pulmonar en el recién nacido8. El gas óxido nítrico también se ha investigado para el tratamiento de la infección por virus sincitial respiratorio (VSR), la malaria y otras enfermedades infecciosas, la lesión por isquemia-reperfusión y para la prevención de la lesión renal aguda en pacientes sometidos a cirugía cardíaca 9,10,11,12. La necesidad de técnicas de medición precisas para evaluar los niveles de NO, sus metabolitos y los de sus proteínas y compuestos objetivo surge de estudios mecanicistas e intervencionistas.
Debido a su alta reactividad, el NO puede sufrir diferentes reacciones dependiendo de la matriz biológica en la que se produzca y/o libere. En ausencia de hemoglobina (Hb) u otras oxihemoproteínas, el NO se oxida casi por completo a nitrito (NO2-).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2- + H+
El NO primero se somete a la autoxidación con oxígeno molecular (O2) para producir dióxido de nitrógeno (NO2) y reacciona con el propio NO2 para generar trióxido de dinitrógeno (N2O3). Una molécula de N2O3 reacciona con el agua (H2O) para formar dos moléculas de NO2- y un protón (H+)13. Dentro de la sangre total, 14,15, NO y NO 2- se convierten rápidamente en nitrato (NO 3-) ya que estas moléculas reaccionan ávidamente con los grupos hemo oxidados de Hb [Hb-Fe2+-O2 u oxihemoglobina (oxyHb)] para producir NO3-. Esta reacción se combina con la transición del grupo hemo al estado férrico [Hb-Fe3+ o metahemoglobina (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3-
La barrera de glóbulos rojos (RBC) y el espacio inmediatamente adyacente al endotelio son los principales factores que limitan esta reacción y permiten que una pequeña porción del NO liberado por el endotelio actúe como EDRF16,17. De hecho, se sabe que la Hb libre de células en la circulación interrumpe la vasodilatación en entornos experimentales y clínicos17,18. Dentro del RBC, dependiendo de la oxigenación y la concentración de NO2-, una porción de NO reacciona con la desoxihemoglobina (Hb-Fe2+) para formar hierro-nitrosil Hb (Hb-Fe2+-NO o HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
En el RBC15,17, NO2- puede formar Hb-Fe3+ reduciendo Hb-Fe2+ dando lugar a la liberación de NO, que a su vez se une a Hb-Fe2+-O 2 (preferentemente) o Hb-Fe2+.
La generación de derivados del NO no debe considerarse estrictamente unidireccional, ya que el NO puede regenerarse a partir de NO2 y NO 3 en diversos tejidos y por diferentes enzimas (por ejemplo, por bacterias intestinales o dentro de las mitocondrias, particularmente en condiciones hipóxicas)19,20.
Una cantidad variable de NO producido (o administrado) conduce a la generación aguas abajo de S-nitrosotioles, principalmente por transnitrosación de tiol de N2O3 en presencia de un nucleófilo creando un intermediario donante de NO+ (Nuc-NO+-NO2-):
N2O3 + RS- → RS-NO + NO2-
Otra posibilidad para la generación de S-nitrosotioles es la nitrosilación de tioles oxidados (NO reaccionando con un tiol oxidado):
RS• + NO → RS-NO
Este mecanismo y la oxidación directa del tiol por NO2 podrían ser posibles sólo en condiciones muy específicas que se describen en otra parte21. Los S-nitrosotioles van desde moléculas ligeras como S-nitrosoglutatión hasta proteínas grandes que contienen tiol. La S-nitrosohemoglobina (S-NO-Hb) se forma por nitrosación de un grupo tiol de un residuo de cisteína conservado en la cadena β (β93C)22.
La generación y el metabolismo de los S-nitrosotioles forman parte de importantes mecanismos reguladores. Los ejemplos incluyen la regulación del glutatión, las caspasas, el N-metil-D-aspartato (NMDA) y los receptores de rianodina 23,24,25,26,27,28. Anteriormente considerada como un mediador importante de la biología del NO in vivo, la albúmina nitrosada (S-nitroso-albúmina) parece ser un transportador de NO/NO+ sin ninguna actividad biológica adicional específica29.
Al medir la concentración de NO y sus derivados de una muestra biológica específica dentro de una matriz biológica, es importante considerar características como la acidez, la oxigenación, la temperatura y la presencia de reactivos. Los ejemplos incluyen donantes de NO exógenos administrados y, en el contexto de la inflamación aguda, peróxido de hidrógeno (H2O2) que reacciona con NO2 que conduce a la generación de concentración sobrenormal de radicales libres como el peroxinitrito (ONOO-)21. Además del método analítico que se emplea, la fase preanalítica de preparación y almacenamiento de muestras es fundamental. Las reacciones posteriores que no representen la actividad de NO in vivo se predecirán, considerarán y bloquearán. Un ejemplo válido es la inestabilidad de S-NO-Hb, que requiere un tratamiento dedicado de muestras de sangre cuando se dirige a la medición22.
Los ensayos basados en quimioluminiscencia son el estándar de oro para detectar los niveles de NO y sus principales metabolitos [NO2-, NO3-, S-NO y complejos hierro-nitrosil (Fe-NO)] en cualquier fluido biológico, incluidos los homogeneizados tisulares30,31. Estos métodos se basan en el detector de quimioluminiscencia (CLD), un dispositivo que alberga la reacción de NO con ozono (O3), generando NO2 en un estado excitado (NO2•). La relajación del NO2• provoca la emisión de un fotón de luz que es detectado por un tubo fotomultiplicador, generando una señal eléctrica que es directamente proporcional al contenido de NO de la mezcla de gases muestreada32. Se representa un esquema simplificado de la CLD.

Figura 1: Esquema simplificado de un detector de quimioluminiscencia para gas de óxido nítrico. La detección basada en quimioluminiscencia de óxido nítrico (NO) es la generación estequiométrica de un fotón por molécula de gas NO que se introduce en el detector de quimioluminiscencia (CLD). La reacción de quimioluminiscencia se obtiene en una cámara designada suministrada con ozono (O3) de un generador interno, que se mantiene a presión negativa mediante conexión con una bomba externa, lo que permite la entrada continua y constante de gas de muestra. La generación de O3 requiere oxígeno diatómico (O2) que es suministrado por un tanque de O2 dedicado conectado con el CLD (otros fabricantes proporcionan CLD que funcionan con aire ambiente). Dentro de la cámara de reacción, cada molécula de gas NO contenida en el gas muestreado reacciona con el oxígeno para producir una molécula de dióxido de nitrógeno en el estado activado (NO2*). Al volver a su estado fundamental, cada molécula de NO2* emite un fotón que es detectado por un tubo fotomultiplicador (PMT) ubicado adyacente a la cámara de reacción. El PMT con el amplificador asociado y la unidad central de procesamiento produce una señal proporcional al recuento de fotones y al número de moléculas de NO en la cámara de reacción. Haga clic aquí para ver una versión más grande de esta figura.
La entrada de muestra del CLD se puede conectar a un sistema de cristalería que contiene una cámara de reacción para muestras líquidas. El sistema se purga continuamente con un gas inerte como nitrógeno, helio o argón, transfiriendo NO de la cámara de reacción a la CLD. Las muestras en fase líquida se inyectan a través de una membrana dedicada en el recipiente de purga.
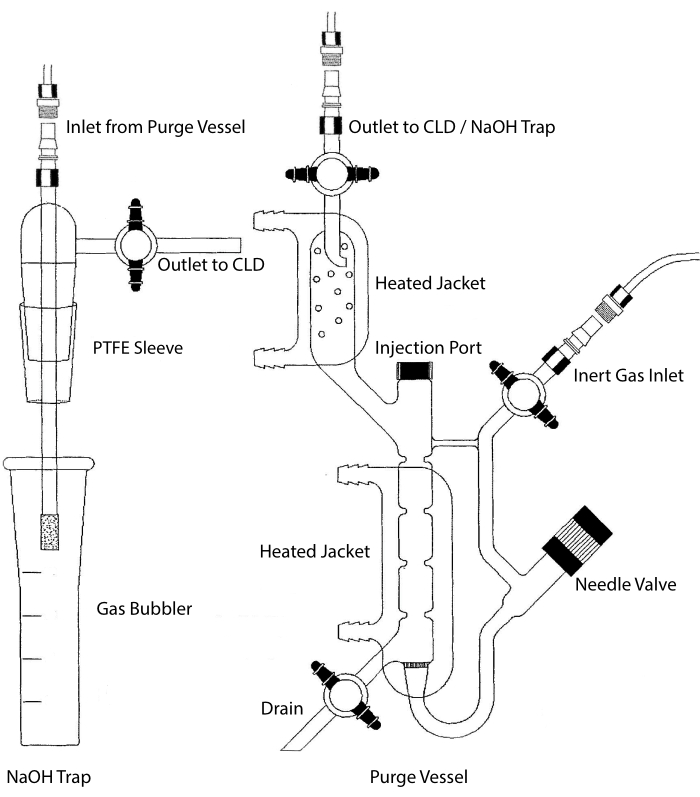
Figura 2: Estructura de un recipiente de purga para la detección basada en quimioluminiscencia de gas de óxido nítrico El recipiente de purga (derecha) permite la detección de gas de óxido nítrico (NO) o cualquier otro compuesto que se pueda convertir fácilmente en gas NO cuando se libera de un reactivo en fase líquida. La entrada de gas inerte está conectada a una fuente (tanque) de un gas inerte como Argón, Xeon o nitrógeno diatómico (N2). La válvula de la aguja (se abre a la izquierda) se utiliza para el control de la presión dentro del recipiente de purga y se puede quitar completamente para limpiar el recipiente. El puerto de inyección está cubierto por una tapa con un tabique de membrana para la inyección de muestra. La membrana debe reemplazarse con frecuencia. Una camisa calentada rodea la cámara de reacción y se conecta a un baño de agua caliente para realizar el ensayo VCl3 en HCl. La salida del vaso de purga está conectada al detector de quimioluminiscencia (CLD) o a la trampa de NaOH (requerida para VCl3 en ensayos de HCl). Para drenar el contenido de la cámara de reacción, primero cierre las llaves de paso en la entrada de gas inerte y la salida del recipiente de purga, cierre la válvula de la aguja, retire la tapa en el puerto de inyección y finalmente abra la llave de paso en el drenaje. Se requiere que la trampa de NaOH (izquierda) se coloque en línea entre el recipiente de purga y el CLD si se realiza el ensayo VCl3 en HCl debido a la corrosividad del HCl. La conexión al CLD siempre requiere que se coloque un filtro dieléctrico de campo intenso (IFD) entre el CLD y la salida del recipiente de purga (o la trampa de NaOH, si se usa). El filtro IFD elimina las partículas en el aire y evita que el líquido pase a través del recipiente de purga. PTFE = politetrafluoroetileno. Haga clic aquí para ver una versión más grande de esta figura.
Como consecuencia, cualquier compuesto que pueda convertirse en NO a través de una reacción química específica y controlada puede ser detectado con alta sensibilidad en cualquier fluido biológico y homogeneizado tisular24. La medición directa del NO en fase gaseosa a través de la quimioluminiscencia se realiza tanto en entornos experimentales como clínicos. Estas técnicas se describen ampliamente en otra parte 33,34,35. La medición de NO2-, S-nitrosotioles, proteínas S-nitrosatadas y Fe-NOs se puede realizar agregando muestras en una mezcla de reacción con triyoduro (I3-), que libera estequiométricamente gas NO de todos estos compuestos:
I3- → I2 + I-
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mientras que I3- no reacciona con NO 3-15. Las mediciones precisas de cada compuesto son posibles mediante el tratamiento previo de las alícuotas de muestra con sulfanilamida acidificada (AS) con o sin cloruro mercúrico (HgCl2). Específicamente, el pretratamiento con AS elimina todo el contenido de NO2. Como consecuencia, el contenido de NO medido por el CLD solo refleja la suma de la concentración de S-NOs y Fe-NOs. La inyección de HgCl2 en una muestra alícuota antes de la inyección de AS hace que S-NO libere NO2-. El tratamiento con AS (que conduce a la eliminación de NO2- ) garantiza que el contenido de NO medido solo refleje la concentración de Fe-NOs. Una serie de restas entre las evaluaciones permiten calcular la concentración precisa de los tres derivados de NO22.

Figura 3: Pasos en la preparación de la muestra para el ensayo de quimioluminiscencia de ácido acético I3- in. Se ilustran los pasos secuenciales para la preparación del ensayo de quimioluminiscencia de ácido acético I3- in. Se requiere el uso de tubos de centrífuga protegidos contra la luz. Los tubos 1, 2 y 3 son los que se utilizan para prepararse para el ensayo. Se necesita otra alícuota de muestra (tubo 4) para el ensayo VCl3 en HCl si se requiere la medición de nitrato (NO3-). Los pasos se indican con números en rojo. Prellene (Paso 1) como se indica con solución salina tampón de fosfato (PBS) o HgCl2 antes de agregar el volumen de la muestra. Agregue el volumen de muestra (2) como se indica, vórtice e incube durante 2 min a temperatura ambiente (RT). Agregue (3) PBS o sulfanilamida acidificada (AS) según lo indicado, vórtice e incube durante 3 min a RT. Ejecute el ensayo (4). La concentración medida por el ensayo es la suma de la concentración de los compuestos reportados debajo de cada tubo. El tubo número 1 permitirá mediciones de nitrito (NO2-), S-nitrosotioles (S-NO) y complejos hierro-nitrosil (Fe-NOs) como una sola señal. Para la medición del nitrato (NO3-), las muestras se ejecutarán con I3- en ácido acético y VCl3 en ensayos de HCl, y el valor obtenido del tubo 1 deberá restarse del obtenido del tubo 4. *cantidades sugeridas para ser utilizadas para el análisis de Hb para la determinación de NO 2-residual, S-nitrosohemoglobina y hierro-nitrosil-hemoglobina. Haga clic aquí para ver una versión más grande de esta figura.
Para la medición de NO3, el cloruro de vanadio (III) (VCl3) en ácido clorhídrico (HCl) se utiliza para la conversión de NO3 a NO en el recipiente de purga con el fin de medir NO3- estequiométricamente con la EPC:
2 NO3-+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Para lograr una conversión suficientemente rápida, la reacción debe realizarse a 90-95 ° C. La reducción de NO3 a NO 2 se combina con la reducción de NO2 a NO por HCl. El metal de vanadio también reduce los S-NO liberando su fracción de NO22,36. La concentración final obtenida por CLD con VCl3 en HCl refleja la concentración agregada de NO3-, NO2 y otros compuestos nitrosados. La sustracción de este último valor de la concentración obtenida con CLD con I3- permite el cálculo de la concentración de NO3- 36,37 (Figura 3).
En el ensayo de consumo de NO, la liberación continua de NO en el recipiente de purga por donantes de NO como (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolate (DETA-NONOate) genera una señal estable que permite cuantificar el oxiHb libre de células en las muestras inyectadas. La cantidad de NO consumido en el recipiente de purga está en una relación estequiométrica con la cantidad de oxyHb en la muestra38.
Se ilustran los protocolos para la medición de NO2-, NO3-, S-nitrosotioles, complejos hierro-nitrosil y no consumo de NO por Hb libre de células en muestras de plasma. Los estudios sobre el NO en el entorno de los glóbulos rojos requieren un tratamiento muestral específico seguido de cromatografía de exclusión para medir S-NO-Hb y Hb-NO extremadamente frágiles junto con la determinación de la concentración total de Hb15,22. La preparación de la muestra es fundamental para corregir la medición. La preexistencia de NO2- en H2O y la liberación de NO2- durante el ensayo pueden conducir a la medición de concentraciones artificialmente más altas de derivados de NO como S-NO-Hb14,39. También se presentan aspectos importantes de la preparación de la muestra.
Protocolo
Los procedimientos indicados en este protocolo están de acuerdo con la junta de revisión del Hospital General de Massachusetts. Las muestras de sangre que se utilizaron habían sido recogidas durante un estudio previo y fueron desidentificadas para el propósito actual18.
NOTA: Consulte las instrucciones del fabricante para obtener orientación específica sobre las conexiones óptimas entre los tubos y la cristalería que constituyen el recipiente de purga, el lavado y el mantenimiento general. Las conexiones deben ser firmes y cuidadosamente hechas para no dañar la cristalería. Identifique los componentes del recipiente de purga de vidrio: línea de entrada de gas, recipiente de purga con camisa de calefacción y condensador, trampa de burbujeo de gas de hidróxido de sodio (NaOH), línea de conexión entre el recipiente de purga y el burbujeador, línea de gas de salida del recipiente de purga (a CLD) dotada de un filtro dieléctrico de campo intenso (IFD). Una línea de filtro IFD entre el vaso de purga y la entrada de muestra del CLD debe estar en su lugar cada vez que se miden metabolitos no-tónicos en forma líquida (plasma, cultivos celulares, homogeneizados de tejidos) (todos los ensayos presentados en el protocolo). La preparación de la muestra depende del fluido o tejido que se analice y de los compuestos de interés. Los aspectos importantes de la fase preanalítica se tratan en las secciones 1 y 2. Los pasos específicos de preparación para ensayos específicos se incluyen en las secciones 3-5. Las secciones 6-8 se aplican a todos los ensayos.
1. Preparación de reactivos dedicados
NOTA: Para más detalles, consulte las publicaciones anteriores15,22.
- Preparar una solución de sulfanilamida (AS) acidificada al 5% (290 mM) para la eliminación de NO2- disolviendo 500 mg de sulfanilamida en 10 mL de 1N HCl. Esta solución es estable durante meses.
- Preparar una solución de cloruro mercúrico (HgCl2) de 50 mM para la liberación de NO2 de los S-NO disolviendo 67,9 mg de HgCl2 en 5 ml de PBS. Proteja la solución madre de la luz.
- Preparar una solución bloqueadora de NO2 con ferricianuro de 800 mM [K3Fe(CN)6] para oxidar la Hb junto con 100 mM de N-etilmaleimida (NEM) para bloquear los grupos tiol y (OPCIONAL) solución de nonilfenil-polietilenglicol al 10% (Nonidet p-40) para solubilizar las membranas de los glóbulos rojos.
- Añadir K3Fe(CN)6 al agua desionizada y destilada (ddH2O, 263,5 g de polvo por litro) para obtener una concentración final de 800 mM.
- Agregue NEM a los 800 mM K3Fe(CN)6 en solución ddH2O (12,5 g de polvo por litro para tener una concentración de 100 mM) y mezcle la solución para disolver todos los cristales.
- Agregue una parte de NP-40 al 10% a nueve partes de la solución NEM K3Fe(CN)6 100 mM nem de 800 mM (111 ml por litro) y mezcle bien (paso obligatorio para el análisis de sangre total).
- Preparar la solución estabilizante S-NO-Hb que contenga 12 mM K3Fe(CN)6, 10 mM NEM, 100 μM de ácido dietiletiltriaminapentaacético (DTPA, para quelación de metales) y detergente Nonidet p-40 al 1% de sus soluciones madre.
- Prepare una solución de NEM de 200 mM agregando cristales de NEM a PBS (25 mg / ml, por ejemplo, 250 mg en 10 ml de PBS) y mezcle la solución hasta que todos los cristales se disuelvan (que se hará el día del experimento).
- Preparar una solución de 800 mM K3Fe(CN)6 añadiendo K3Fe(CN)6 a ddH2O (263,5 mg/mL, por ejemplo, 1,32 g en 5 mL de ddH2O para obtener una concentración final de 800 mM) (que se realizará el día del experimento).
- Prepare una solución madre de DTPA de 10 mM agregando 786 mg de DTPA a 200 ml de ddH2O y ajuste el pH a 7.0 con 5N NaOH para solubilizar completamente DTPA.
- Agregue 5 ml de solución NEM de 200 mM, 1.5 ml de solución de 800 mM K3Fe(CN)6 y 1 ml de solución madre de DTPA a 81.5 ml de PBS a 7.2 pH, y finalmente, agregue 11 ml de NP-40 al 10% por fin para llevar el volumen final a 100 ml.
2. Recogida de muestras
NOTA: Para obtener más detalles sobre la recolección de muestras, consulte las obras publicadas anteriormente 15,22,40.
- Recolectar sangre entera
- Recolectar sangre en tubos recubiertos de heparina que prefieran los vasos venosos sobre los arteriales (a menos que se requiera específicamente) y prefieran la colocación de catéteres sobre la venopunción (si es posible) con catéter o aguja perforada de al menos 20 G o más para minimizar la hemólisis.
- Agregue inmediatamente la solución bloqueadora de NO2 (1 parte de la solución a 4 partes de sangre total), procese (secciones 3 o 4) o congele y almacene a -80 °C.
- Recolectar plasma y glóbulos rojos (glóbulos rojos)
- Recolectar sangre en tubos recubiertos de heparina que prefieran la sangre venosa sobre la arterial (a menos que se requiera específicamente) y agujas de al menos 20 G o más para minimizar la hemólisis y la centrífuga inmediatamente durante 5 min a 4000 x g a 4 °C.
- Mezclar el sobrenadante (plasma) con la solución bloqueadora de NO2( (1 parte de la solución por 4 partes del sobrenadante) en un nuevo tubo y proceso (secciones 3 o 4), o congelar y almacenar a -80 °C.
NOTA: Para el ensayo de consumo de NO, no se puede utilizar la solución de bloqueo de NO2. El ensayo se puede realizar sin pretratamiento con plasma. - Vuelva a suspender el pellet de rbC desde el fondo a un nuevo tubo precargado con solución estabilizante S-NO (consulte el paso 1.4) (1 ml de pellet a 9 ml de solución) e incube durante 5 min.
- Pasar el lisado de glóbulos rojos en una columna de dimensionamiento con polímero G-25 Sephadex que ha sido previamente enjuagado con ddH2O para cromatografía de exclusión
- Recoger la fracción de Hb para procesar (sección 4) y medir la concentración de Hb utilizando el reactivo de Drabkin (para la medición de Hb, consulte el trabajo publicado anteriormente22).
NOTA: Para preparar y tomar muestras de un tejido /órgano específico, identificar su hilio y aislarlo quirúrgicamente. Incise la vena, perfore la arteria e inyecte solución salina heparinizada (10 U/ml) a través de la arteria. Extirpar el tejido cuando la solución salina comienza a retroceder en la incisión venosa. Homogeneizar el tejido con un homogeneizador mecánico mientras se agrega 1 parte de solución bloqueadora de NO2 a 4 partes de tejido homogeneizado.
3. VCl3 en la preparación del ensayo de HCl
NOTA: Para obtener más detalles sobre VCl3 en la preparación del ensayo de HCl, consulte los trabajos publicados anteriormente37,41.
PRECAUCIÓN: El CLD se dañará si la trampa de NaOH no está correctamente en su lugar al realizar este ensayo. Esto se debe a la corrosividad del HCl.
- Preparar soluciones estándar de NO3- para curva estándar
- Disolver 85 mg de NaNO3 en 10 mL de ddH2O para obtener 0,1 M de NaNO3- (esta solución permanece estable durante unas semanas).
- Utilice la solución madre para preparar estándares por dilución en ddH2O para obtener concentraciones de 5 μM, 10 μM, 20 μM, 40 μM, 80 μM, 200 μM NaNO3 con el fin de realizar una curva de calibración para muestras de plasma u orina (use concentraciones más bajas si trabaja con cultivos celulares).
- Preparar la solución saturada de VCl3 (cloruro de vanadio) para la reducción de NO3 en el recipiente de purga
PRECAUCIÓN: La reacción del agua y VCl3 es exotérmica. Preste atención a la alta temperatura de la cristalería al agregar ácido y al enjuagar la cristalería al final del experimento.- Disolver 1,6 g de VCl3 en 200 mL de 1 M HCl añadiendo primero VCl3 en un matraz limpio y añadiendo 200 mL de 1 M HCl.
- Filtre al vacío la solución a través de papel de filtro (como papel de filtro de 11 μm, pero se puede usar cualquier papel de filtro).
NOTA: La solución filtrada se volverá azul claro, mientras que la solución VCl3 sin filtrar es marrón debido a las partículas no disueltas. - Mantenga la solución saturada cubierta con papel de aluminio o cinta de politetrafluoroetileno (PTFE), ya que el compuesto es sensible a la luz.
- Preparar el baño de agua circulante
- Conecte un dispositivo de baño de agua circulante a la camisa de agua del recipiente de purga. Asegúrese de que las líneas estén secas antes del cebado.
- Comience el baño de agua a 95 ° C y verifique la ausencia de fugas en las líneas de agua aplicando toallas de papel (no adherentes) alrededor de las líneas.
- Configurar la trampa de burbujas de gas
- Verifique que la funda de PTFE del burbujeador esté en su lugar y que no esté dañada.
- Abra el burbujeador de gas e inyecte 15 ml de 1 M de NaOH en la base del burbujeador.
- Vuelva a colocar el burbujeador de gas y selle la conexión herméticamente presionando la parte inferior hacia la parte superior y girando ligeramente las dos partes. La imposibilidad de girar la parte superior del burbujeador sin aplicar fuerza indica un sellado correcto.
- Conecte la salida del recipiente de purga a la entrada de la trampa de burbujas de gas.
4. I3- en la preparación del ensayo de ácido acético
NOTA: Para obtener más detalles sobre I3- en la preparación del ensayo de ácido acético, consulte los trabajos publicados anteriormente 15,22,38,41,42.
- Preparar la curva estándar para NO2-
- Preparar una solución madre disolviendo 69 mg de nitrito de sodio (NaNO2) en 10 mL de ddH2O para obtener una solución de 100 mM. Esta solución es estable si se almacena en un recipiente hermético, refrigerado y protegido de la luz.
- Diluir en serie la solución madre en un tubo de microcentrífuga de 1,5 ml prellenado con 900 μL de ddH2O: Agregue 100 μL de la solución madre al primer tubo de centrífuga, mezcle, etiquete y use 100 μL del tubo para el segundo tubo, luego repita dando como resultado 10 mM, 1 mM, luego 100 μM.
- Diluir posteriormente con ddH2O para obtener alícuotas de 50 μM, 25 μM, 10 μM, 1 μM y 500 nM de NaNO2 para ser utilizadas en la curva de calibración.
- Preparar el I3- en ácido acético para el recipiente de purga (se puede almacenar a temperatura ambiente (RT) durante 1 semana)22
- Añadir 2 g de yoduro de potasio (KI) y 1,3 g de yodo (I2) a 40 ml de ddH2O y 140 ml de ácido acético.
- Mezclar bien revolviendo la mezcla durante al menos 30 min.
- Preparar las muestras para la determinación diferencial de NO2-, S-nitrosotioles (S-NO-Hb, si se recoge Hb) y complejos hierro-nitrosil (Hb-NO si se recoge Hb) (Figura 3)
- Divida cada muestra en 3 alícuotas de 270 μL (900 μL de Hb si se mide S-NO-Hb y Hb-NO) en tubos de microcentrífugas protegidos contra la luz, 2 de ellos precargados con 30 μL de 1x PBS (100 μL si se mide S-NO-Hb y Hb-NO) y el tercer tubo con 30 μL de HgCl2 (100 μL si se mide S-NO-Hb y Hb-NO), vórtice e incubar en RT durante 2 min (Figura 3).
- Añadir 30 μL de AS al 5% a la muestra con HgCl2 para medir Fe-NOs, (100 μL para Hb-NO) y a una con PBS añadido para medir S-NOs y Fe-NOs (100 μL para S-NO-Hb y Hb-NO) y añadir 30 μL de PBS a la tercera ya precargada con 1x PBS para medir NO2-, S-NOs y Fe-NOs (100 μL para NOresidual 2- de la recolección de Hb, S-NO y Hb-NO). Vórtice e incube en RT durante 3 min (Figura 3).
5. NO consumo por configuración de Hb sin celdas
NOTA: Para obtener más detalles, consulte el trabajo publicado anteriormente38.
- Preparar soluciones estándar de oxyHb a partir de una solución de Hb de stock purificada con una concentración conocida
- Diluir en serie la solución madre en tubos de microcentrífuga de 1,5 ml mediante la adición de ddH2O para obtener las soluciones que se utilizarán para la curva de calibración: 62 μM, 50 μM, 25 μM, 12,5 μM, 6,25 μM, 3,125 μM, 1,56 μM.
- Preparar la solución DETA-NONOate
- Añadir 10 mg de DETA-NONOato a 610 μL de 10 μM de NaOH en pH 7,4 PBS para generar 100 mM de DETA-NONOato y mantenerlo en hielo.
6. Inicie el detector de quimioluminiscencia (CLD) y prepare el recipiente de purga
NOTA: Para la preparación del buque de purga, consulte el trabajo publicado anteriormente43.
- Verificar las conexiones principales hacia y desde el CLD
- Conecte la línea de oxígeno al CLD y abra el tanque de oxígeno a una presión que esté de acuerdo con el fabricante del CLD.
- Asegúrese de que la línea de filtro dieléctrico de campo intenso (IFD) esté conectada al CLD, pero no al recipiente de purga o a la trampa de NaOH
- Iniciar el CLD
- En la interfaz CLD, comience a ejecutar el programa de detección para ensayos en fase líquida.
- Verifique que el suministro de oxígeno sea adecuado. Si este es el caso, el CLD iniciará con éxito el muestreo desde su entrada e indicará la detección mediante una señal en milivoltios (0-5 mV). De lo contrario, el CLD provocará una señal de diagnóstico negativa.
- Preparar el recipiente de purga
- Cierre el recipiente de purga en los tres puertos: atornille completamente la válvula de aguja a la derecha, cierre las llaves de paso de entrada y salida.
- Retire la tapa del recipiente de purga y agregue una cantidad suficiente del reactivo específico para el ensayo planificado a la cámara de reacción (Tabla 1) para que la aguja de la jeringa utilizada para inyectar las muestras pueda alcanzar la columna de fluido.
- Verificar la presencia de una línea de base deseada estable (Tabla 1).
- Iniciar el flujo de gas de purga
- Asegúrese de que el tanque de gas inerte (por ejemplo, N2) esté equipado con un regulador de dos etapas y conecte el tanque de gas inerte con la entrada de gas del recipiente.
- Abra el gas con una presión de salida en el regulador de 1-5 psi, abra la entrada del recipiente de purga y abra lentamente la válvula de aguja del recipiente de purga para permitir la entrada de gas. Verifique el burbujeo dentro del recipiente de purga.
- Ajustar el flujo de gas
- Registre la presión de la celda medida por el CLD con la línea de filtro IFD que muestrea el aire ambiente.
- Vuelva a colocar la tapa en el recipiente de purga, conecte la línea de filtro IFD al recipiente de purga (o a la trampa de NaOH en el ensayo VCl3 en HCl) y abra la salida del recipiente de purga.
- Use la válvula de aguja para alcanzar la misma presión celular a nivel de CLD que se registra en el aire ambiente.
7. Experimenta
NOTA: Para obtener más detalles sobre el experimento, consulte el trabajo publicado anteriormente43.
- Iniciar el programa de adquisición de señales de quimioluminiscencia
- Conecte el puerto serie del CLD al puerto serie del equipo en el que se ha instalado el programa de adquisición.
- Ejecute el programa de análisis.
- Haga clic en Adquirir, seleccione la carpeta para guardar el archivo .data, escriba el nombre del archivo y haga clic en Guardar.
NOTA: Observe el tiempo de ejecución preestablecido en la pantalla, ya que la grabación se detiene automáticamente cuando transcurre el tiempo preestablecido. Si es necesario, se puede aumentar el tiempo de ejecución preestablecido.
- Prepárese para inyecciones de muestra repetidas
- Ajuste la escala de voltaje en la pantalla para tener control sobre la línea base objetivo haciendo clic en los botones Mínimo y / o Máximo y luego ingresando el valor deseado.
- Tenga un tubo de 20 o 50 ml lleno de ddH2O para enjuagar la jeringa entre las muestras.
- Tenga una caja de toallitas de tareas delicadas fácilmente disponibles.
- Inyección de muestra
NOTA: Comience desde las soluciones estándar para la curva de calibración (inyecte de las muestras menos concentradas a las más concentradas), luego proceda a las muestras del experimento (considere hacerlo por duplicado o triplicado).- Enjuague la jeringa al menos dos veces o más con ddH2O antes de retirar cada muestra (y después de cada inyección) y verifique cada vez que la eyección de agua sin obstrucciones en una toallita de tarea.
- Inserte la jeringa en el tubo de muestra mientras mantiene la jeringa y el tubo a una distancia cercana, tire del émbolo hasta el volumen deseado mientras se asegura de que no queden atrapadas burbujas de aire y / o partes sólidas no homogeneizadas.
- Limpie la punta de la jeringa con un limpiaparabrisas de tareas, luego inserte la jeringa en la tapa de los septos en el puerto de inyección e inyecte después de verificar que la punta de la jeringa esté dentro de la fase líquida en la cámara de reacción.
- Marque la inyección en el programa de software y espere
- Verifique que la inyección cause un cambio hacia arriba en la señal (Figura suplementaria 1) (hacia abajo en el consumo de NO por ensayo de Hb libre de células) y escriba el nombre de la muestra haciendo clic en el cuadro gris debajo de Nombres de muestra, luego haga clic en Marcar inyección.
NOTA: Sospecha de obstrucción de la jeringa si la inyección de muestra no genera una señal. - Espere a que la señal eléctrica vuelva a alcanzar la línea de base (esto generalmente toma de 3 a 4 minutos). Esta vez se puede utilizar para realizar el paso 7.3.1.
- Verifique que la inyección cause un cambio hacia arriba en la señal (Figura suplementaria 1) (hacia abajo en el consumo de NO por ensayo de Hb libre de células) y escriba el nombre de la muestra haciendo clic en el cuadro gris debajo de Nombres de muestra, luego haga clic en Marcar inyección.
- Repita todos los pasos indicados en los pasos 7.3 y 7.4 durante y después de cada inyección hasta el final del experimento. Recuerde ejecutar una muestra de la solución de conservación (si se utiliza)
- Detener el experimento
- Haga clic en STOP para interrumpir la adquisición de la señal, detener el CLD y apagar el baño de agua (si se mide NO3-).
- Interrumpa el flujo de gas, abra la válvula de la aguja, retire la tapa del recipiente de purga, coloque un contenedor de desechos debajo del desagüe y abra la llave de paso de drenaje.
NOTA: Si el experimento requiere la adquisición de datos durante más de 60 minutos, es necesario reiniciar la adquisición después de 60 minutos de tiempo de ejecución (repita el paso 7.1.3) y crear un nuevo archivo.
8. Mediciones y cálculos
NOTA: Las mediciones y los cálculos se realizan fuera de línea y se pueden realizar en un momento diferente.
- Inicie el programa de adquisición de quimioluminiscencia para el análisis de datos fuera de línea
- Inicie el programa y haga clic en Procesar.
- Seleccione el archivo de experimento y, a continuación, haga clic en Abrir.
- Calcular el área bajo la curva para cada administración
- El software grafica automáticamente en pantalla la línea de base (Figura suplementaria 2A, línea amarilla horizontal) y el eje máximo de cada onda generada por cada administración de muestra (líneas amarillas verticales): verifique su posición correcta (o ajuste haciendo clic en cada línea y moviéndola con el mouse o las flechas) y haga clic en Umbral OK (Figura suplementaria 2B).
NOTA: En el ensayo de medición de Hb sin células de consumo de NO, el software no suele lograr capturar correctamente la forma de onda generada por la inyección de muestra. Al hacer zoom en cada forma de onda, el operador puede ayudar fácilmente al software en el cálculo del área (Figura suplementaria 2). - El software grafica automáticamente el principio (línea verde vertical) y el final (línea roja vertical) de cada pico causado por cada administración de muestra: verifique su posición correcta (o ajuste haciendo clic en cada línea y moviéndola con el mouse o las flechas) y haga clic en Integrar (Figura suplementaria 2C).
NOTA: Algunas áreas en el rastro pueden definirse erróneamente como inyecciones en este punto, y algunos picos pueden contarse automáticamente dos veces. Ambos errores se pueden volver a identificar y eliminar durante el paso 8.2.2 - El software hace coincidir automáticamente cada área de señal después de una inyección marcada durante el experimento y su nombre asignado: navegue por cada pico (indicado por una línea vertical amarilla) con el nombre asignado haciendo clic en Siguiente pico y Pico anterior, luego haga clic en el botón Todo OK para finalmente obtener el cálculo para todas las áreas en la pantalla.
- Para corregir todos los errores de nomenclatura o coincidencia cometidos por el usuario o por el programa, utilice según sea necesario los botones indicados en el Archivo suplementario 1.
- El software grafica automáticamente en pantalla la línea de base (Figura suplementaria 2A, línea amarilla horizontal) y el eje máximo de cada onda generada por cada administración de muestra (líneas amarillas verticales): verifique su posición correcta (o ajuste haciendo clic en cada línea y moviéndola con el mouse o las flechas) y haga clic en Umbral OK (Figura suplementaria 2B).
- Transfiera los valores de la curva de calibración a una hoja de cálculo y genere una ecuación de regresión lineal (Figura suplementaria 3)
- Transfiera los datos del programa CLD a una nueva hoja de cálculo a través de copiar y pegar. Organice las dos columnas de la hoja de datos como Concentración de muestra y Área bajo la curva, y agregue un valor coincidente de cero en ambas columnas.
- Seleccione las dos columnas, haga clic en Insertar > dispersión, luego, en el menú Diseño del gráfico , seleccione Agregar elemento de gráfico > línea de tendencia > Lineal.
- Haga clic con el botón derecho en la línea de tendencia generada, haga clic en Formato de línea de tendencia, luego haga clic en las opciones Mostrar ecuaciones en el gráfico y Mostrar el valor R-cuadrado en el gráfico en el menú Formato de línea de tendencia para obtener una ecuación de calibración lineal simple.
- Transferir el área calculada de cada muestra para calcular su concentración (Figura suplementaria 3)
- Informa de todos los valores de la hoja de cálculo. En la siguiente columna, aplique la ecuación obtenida del paso 8.3.3 para obtener la concentración de cada muestra inyectada, donde y es la concentración (valor de la nueva columna) y x es el área bajo la curva medida después de la inyección.
NOTA: Recuerde tener en cuenta la concentración medida en la solución de conservación (si se utiliza) y restar los valores en consecuencia.
- Informa de todos los valores de la hoja de cálculo. En la siguiente columna, aplique la ecuación obtenida del paso 8.3.3 para obtener la concentración de cada muestra inyectada, donde y es la concentración (valor de la nueva columna) y x es el área bajo la curva medida después de la inyección.
Resultados
El consumo de NO por el ensayo de Hb libre de células se utilizó en muestras que contenían concentraciones conocidas de oxyHb libre de células (Figura 4). Como un hemo de oxyHb libera estequiométricamente una molécula de NO en el ensayo, se utiliza oxyHb libre de células purificadas para construir la curva de calibración para el ensayo (Figura suplementaria 3).
La relación dosis-respuesta entre la Hb libre de células (medida con un ensay...
Discusión
Debido a la alta sensibilidad, los ensayos basados en quimioluminiscencia para la determinación de NO y compuestos relacionados tienen un alto riesgo de contaminación por NO2. Cada reactivo (especialmente la solución de bloqueo de NO2) y diluyente (incluido ddH2O) utilizado en el experimento debe probarse por su contenido de NO2- para corregir la señal de fondo. El nitrito es extremadamente reactivo con una vida media en sangre total alreded...
Divulgaciones
L.B. recibe apoyo salarial de K23 HL128882 / NHLBI NIH como investigador principal por su trabajo en hemólisis y óxido nítrico. LB recibe subvenciones de "Fast Grants for COVID-19 research" en el Mercatus Center de la Universidad George Mason y de iNO Therapeutics LLC. B.Y. cuenta con el apoyo de subvenciones de un NHLBI / #R21HL130956 y DOD / The Geneva Foundation (W81XWH-19-S-CCC1, Log DM190244). B.Y. recibió patentes en MGH sobre la generación eléctrica de óxido nítrico.
L.B. y B.Y. han presentado una solicitud de patente para la NO entrega en la enfermedad COVID-19 Número de solicitud PCT: PCT/US2021/036269 presentada el 7 de junio de 2021. RWC recibe apoyo salarial de Unitaid como investigador principal para el desarrollo de tecnología destinada al diagnóstico descentralizado de la tuberculosis en niños ubicados en entornos de bajos recursos.
Agradecimientos
Los protocolos reportados en este manuscrito fueron posibles gracias a las contribuciones acumuladas de becarios anteriores del laboratorio de Investigación de Anestesia en Cuidados Críticos del Dr. Warren Zapol, Departamento de Anestesia del Hospital General de Massachusetts. Reconocemos la contribución de los Dres. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli y Emanuele Rezoagli.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Referencias
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados