Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Хемилюминесцентные анализы для обнаружения оксида азота и его производных от аутоксидации и нитрозированных соединений
В этой статье
Резюме
Здесь мы представляем протоколы обнаружения оксида азота и его биологически значимых производных с использованием хемилюминесцентных анализов с высокой чувствительностью.
Аннотация
Активность оксида азота (NO) in vivo представляет собой комбинированные результаты его прямых эффектов, действия его производных, полученных в результате аутоксидации NO, и эффектов нитрозированных соединений. Измерение метаболитов NO имеет важное значение для изучения активности NO как на сосудистом уровне, так и в других тканях, особенно в экспериментальных условиях, где вводят экзогенный NO. Хемилюминесцентные анализы на основе озона позволяют точно измерять метаболиты NO и NO как в жидкостях (включая плазму, гомогенаты тканей, клеточные культуры), так и в газовых смесях (например, выдыхаемое дыхание). NO реагирует с озоном с образованием диоксида азота в возбужденном состоянии. Последующее световое излучение позволяет фотодетектировать и генерировать электрический сигнал, отражающий содержание NO в образце. Аликвоты из одного и того же образца могут быть использованы для измерения конкретных метаболитов NO, таких как нитраты, нитриты, S-нитрозотиолы и комплексы железа-нитрозила. Кроме того, NO, потребляемое бесклеточным гемоглобином, также количественно определяется с помощью хемилюминесцентного анализа. Приведена иллюстрация всех этих методов.
Введение
С тех пор, как Сальвадор Монкада и нобелевские лауреаты Роберт Фурчготт, Луи Игнарро и Ферид Мурад определили оксид азота (NO) как ранее известный эндотелиальный фактор релаксации (EDRF), центральная роль NO была установлена в нескольких ключевых механизмах, охватывающих всю сосудистую биологию, нейронауки, метаболизм и реакцию хозяина 1,2,3,4,5,6,7 . Экзогенное введение газа NO стало устоявшимся методом лечения дыхательной недостаточности из-за легочной гипертензии у новорожденного8. Газ оксида азота также исследовался для лечения респираторно-синцитиальной вирусной (РСВ) инфекции, малярии и других инфекционных заболеваний, ишемии-реперфузионного повреждения, а также для профилактики острого повреждения почек у пациентов, перенесших кардиохирургию 9,10,11,12. Потребность в точных методах измерения для оценки уровней NO, его метаболитов и его целевых белков и соединений возникает как в результате механистических, так и интервенционных исследований.
Из-за своей высокой реакционной способности NO может подвергаться различным реакциям в зависимости от биологической матрицы, в которой он производится и/или высвобождается. При отсутствии гемоглобина (Hb) или других оксигемопротеинов NO окисляется почти полностью до нитритов (NO2-).
2NO + O2 → 2NO2
НЕТ2 + НЕТ → N2O3
N2O3 + H2O → NO2- + H+
NO сначала подвергается аутоксидации молекулярным кислородом (O2) с образованием диоксида азота (NO2) и реагирует с самим NO2 с образованием триоксида диазогена (N2O3). Одна молекулаN2O3 реагирует с водой (H2O) с образованием двух молекул NO2- и протона (H+)13. В цельной крови14,15 NO и NO2- быстро превращаются в нитрат (NO3-), поскольку эти молекулы жадно реагируют с окисленными гемовыми группами Hb [Hb-Fe2+-O2 или оксигемоглобин (oxyHb)] с образованием NO3-. Эта реакция сочетается с переходом гемовой группы в железосодержащее состояние [Hb-Fe3+ или метгемоглобин (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3-
Барьер эритроцитов (ЭРИАК) и пространство, непосредственно прилегающее к эндотелию, являются основными факторами, ограничивающими эту реакцию и позволяющими небольшой части NO, высвобождаемого эндотелием, действовать как EDRF16,17. Фактически, бесклеточный Hb в циркуляции, как известно, нарушает вазодилатацию в экспериментальных и клинических условиях17,18. В эритроцитах, в зависимости от оксигенации и концентрации NO2-, часть NO реагирует с дезоксигемоглобином (Hb-Fe2+) с образованием железа-нитрозила Hb (Hb-Fe2+-NO или HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
В RBC15,17 NO2- может образовывать Hb-Fe3+ путем снижения Hb-Fe2+, что приводит к высвобождению NO, что, в свою очередь, связывает Hb-Fe2+-O2 (предпочтительно) или Hb-Fe2+.
Генерацию NO-производных не следует считать строго однонаправленной, поскольку NO может быть регенерирован из NO2- и NO3- в различных тканях и различными ферментами (например, кишечными бактериями или в митохондриях, особенно в гипоксических условиях)19,20.
Переменное количество NO, продуцируемого (или вводимого) приводит к последующей генерации S-нитрозотиолов, главным образом путем транснитрозации тиола изN2O3 в присутствии нуклеофила, создающего донорский промежуточный продукт NO+ (Nuc-NO+-NO2-):
N2O3 + RS- → RS-NO + NO2-
Другой возможностью генерации S-нитрозотиол является нитрозилирование окисленных тиолов (NO, реагирующих с окисленным тиолом):
RS• + НЕТ → RS-NO
Этот механизм и прямое окисление тиола NO2 могут быть возможны только в очень специфических условиях, которые описаны в другом месте21. S-нитрозотиолы варьируются от легких молекул, таких как S-нитрозоглутатион, до крупных тиолсодержащих белков. S-нитрозогемоглобин (S-NO-Hb) образуется путем нитрозации тиольной группы консервированного цистеинового остатка в β цепи (β93C)22.
Генерация и метаболизм S-нитрозотиолов являются частью важных регуляторных механизмов. Примеры включают регуляцию глутатиона, каспаз, N-метил-D-аспартата (NMDA) и рианодиновых рецепторов 23,24,25,26,27,28. Ранее считавшийся основным медиатором биологии NO in vivo, нитрозированный альбумин (S-нитрозо-альбумин), по-видимому, является переносчиком NO/NO+ без какой-либо конкретной дополнительной биологической активности29.
При измерении концентрации NO и его производных из конкретного биологического образца в биологической матрице важно учитывать такие характеристики, как кислотность, оксигенация, температура и наличие реагентов. Примеры включают вводимые экзогенные доноры NO и, в условиях острого воспаления, перекись водорода (H2O2), реагирующую с NO2 , приводящую к образованию сверхнормальной концентрации свободных радикалов, таких как пероксинитрит (ONOO-)21. В дополнение к используемому аналитическому методу, предварительный аналитический этап подготовки и хранения образцов является основополагающим. Последующие реакции, которые не представляют активность IN vivo NO, должны прогнозироваться, учитываться и блокироваться. Достоверным примером является нестабильность S-NO-Hb, требующая специальной обработки образцов крови, когда она нацелена на измерение22.
Анализы на основе хемилюминесценции являются золотым стандартом для обнаружения уровней NO и его основных метаболитов [NO2-, NO3-, S-NO и железо-нитрозиловых комплексов (Fe-NO)] в любой биологической жидкости, включая тканевые гомогенаты30,31. Эти методы основаны на детекторе хемилюминесценции (CLD), устройстве, в котором находится реакция NO с озоном (O3), генерируя NO2 в возбужденном состоянии (NO2•). Релаксация NO2• вызывает испускание фотона света, который обнаруживается трубкой фотоумножителя, генерируя электрический сигнал, прямо пропорциональный содержанию NO в отобранной газовой смеси32. Представлена упрощенная схема CLD.

Рисунок 1: Упрощенная схема хемилюминесцентного детектора для газа оксида азота. Обнаружение оксида азота (NO) на основе хемилюминесценции представляет собой стехиометрическую генерацию одного фотона на молекулу газа NO, которая вводится в детектор хемилюминесценции (CLD). Реакцию хемилюминесценции получают в назначенной камере, снабжаемой озоном (О3) от внутреннего генератора, который поддерживается при отрицательном давлении путем соединения с внешним насосом, обеспечивая непрерывный и постоянный приток пробного газа. Для генерации O3 требуется двухатомный кислород (O2), который подается из специального резервуара O2 , подключенного к CLD (другие производители предоставляют CLD, работающие с окружающим воздухом). В реакционной камере каждая молекула газа NO, содержащаяся в отобранном газе, реагирует с кислородом с образованием одной молекулы диоксида азота в активированном состоянии (NO2*). Возвращаясь в основное состояние, каждая молекула NO2* испускает один фотон, который обнаруживается трубкой фотоумножителя (PMT), расположенной рядом с реакционной камерой. PMT с соответствующим усилителем и центральным процессором производит сигнал, пропорциональный количеству фотонов и количеству молекул NO в реакционной камере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Входное отверстие для образцов CLD может быть соединено со стеклянной системой, содержащей реакционную камеру для жидких образцов. Система непрерывно продувается инертным газом, таким как азот, гелий или аргон, перенося NO из реакционной камеры в CLD. Образцы жидкой фазы впрыскиваются через специальную мембрану в продувочный сосуд.
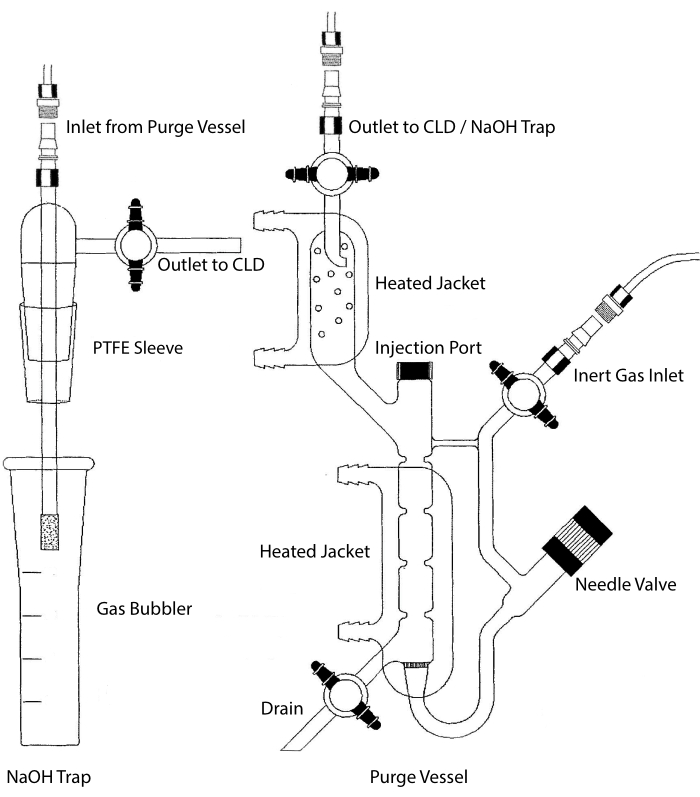
Рисунок 2: Структура продувочного сосуда для обнаружения на основе хемилюминесценции газа оксида азота Продувочный сосуд (справа) позволяет обнаруживать газ оксида азота (NO) или любое другое соединение, которое может быть легко преобразовано в газ NO при высвобождении из реагента жидкой фазы. Входное отверстие инертного газа соединено с источником (резервуаром) инертного газа, такого как аргон, ксеон или двухатомный азот (N2). Игольчатый клапан (открывается влево) используется для контроля давления в продувочном сосуде и может быть полностью удален для очистки сосуда. Инъекционный порт закрыт колпачком с мембранной перегородкой для инъекции образца. Мембрану следует часто заменять. Нагретая рубашка окружает реакционную камеру и подключается к бане с горячей водой для выполнения анализа VCl3 в HCl. Выходное отверстие продувочного сосуда подключается к хемилюминесцентному детектору (CLD) или к ловушке NaOH (требуется для VCl3 в анализах HCl). Чтобы слить содержимое реакционной камеры, сначала закройте запорные краны на входе инертного газа и выпускном отверстии продувочного сосуда, закройте игольчатый клапан, снимите колпачок в инжекторном отверстии и, наконец, откройте запорный кран в сливе. Ловушку NaOH (слева) необходимо разместить в линии между продувочным сосудом и CLD, если анализ VCl3 в HCl выполняется из-за коррозионной активности HCl. Для подключения к CLD всегда требуется диэлектрический фильтр интенсивного поля (IFD), который должен быть размещен между CLD и выходом продувочного сосуда (или ловушки NaOH, если используется). Фильтр IFD удаляет взвешенные в воздухе частицы и предотвращает прохождение жидкости через продувочный сосуд. PTFE = политетрафторэтилен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Как следствие, любое соединение, которое может быть преобразовано в NO посредством специфической и контролируемой химической реакции, может быть обнаружено с высокой чувствительностью в любой биологической жидкости и гомогенатеткани 24. Прямое измерение газовой фазы NO посредством хемилюминесценции проводится как в экспериментальных, так и в клинических условиях. Эти методы подробно описаны в других местах 33,34,35. Измерение NO2-, S-нитрозотиолов, S-нитрозированных белков и Fe-NOs может быть выполнено путем добавления образцов в реакционную смесь с трийодидом (I3-), который стехиометрически высвобождает газ NO из всех этих соединений:
I3- → I2 + I-
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
в то время как I3- не реагирует с NO 3-15. Точные измерения каждого соединения становятся возможными благодаря предварительной обработке образцов аликвот подкисленным сульфаниламидом (АС) с хлоридом ртути или без него (HgCl2). В частности, предварительная обработка AS удаляет все содержание NO 2. Как следствие, содержание NO, измеренное ЦБМ, отражает только сумму концентраций S-NOs и Fe-NOs. ИнъекцияHgCl2 в образец аликвоты перед инъекцией AS приводит к высвобождению NO2- S-NO. Обработка АС (приводящая к удалению NO2- гарантирует, что измеренное содержание NO отражает только концентрацию Fe-NOs. Ряд вычитаний между оценками позволяет рассчитать точную концентрацию трех производных NO22.

Рисунок 3: Этапы пробоподготовки для I3- в хемилюминесцентном анализе уксусной кислоты. Проиллюстрированы последовательные этапы приготовления I3- в хемилюминесцентном анализе уксусной кислоты. Требуется использование светонепроницаемых центрифужных трубок. Трубки 1, 2 и 3 используются для подготовки к анализу. Еще одна аликвота образца (пробирка 4) необходима для анализа VCl3 в HCl, если требуется измерение нитрата (NO3-). Шаги обозначены цифрами красным цветом. Предварительное заполнение (этап 1), как указано, фосфатным буферным физиологическим раствором (PBS) или HgCl2 перед добавлением объема образца. Добавьте объем образца (2), как указано, вихрь и инкубируйте в течение 2 мин при комнатной температуре (RT). Добавьте (3) PBS или подкисленный сульфаниламид (AS), как указано, вихрь, и инкубируйте в течение 3 мин на RT. Запустите анализ (4). Концентрация, измеренная с помощью анализа, представляет собой сумму концентрации соединений, указанных под каждой пробиркой. Трубка No1 позволит измерять нитриты (NO2-), S-нитрозотиолы (S-NO) и комплексы железа-нитрозила (Fe-NOs) в качестве единого сигнала. Для измерения нитратов (NO3-) образцы обрабатываются с использованием как I3- в уксусной кислоте, так и VCl3 в анализах HCl, а значение, полученное из трубки 1, должно быть вычтено из значения, полученного из трубки 4. *предлагаемые количества, которые будут использоваться для анализа Hb для определения остаточного NO2-, S-нитрозогемоглобина и железо-нитрозил-гемоглобина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для измерения NO3- хлорид ванадия (III) (VCl3) в соляной кислоте (HCl) используется для преобразования NO3- в NO в продувочном сосуде с целью измерения NO3- стехиометрически с помощью CLD:
2 NO3-+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Для достижения достаточно быстрого преобразования реакцию необходимо проводить при 90-95 °C. Восстановление с NO3- до NO2- сочетается с восстановлением NO2- до NO HCl. Металл ванадия также уменьшает S-NOs, высвобождая их NO часть22,36. Конечная концентрация, полученная с помощью CLD с VCl3 в HCl, отражает совокупную концентрацию NO3-, NO2 и других нитрозированных соединений. Вычитание последнего значения из концентрации, полученной с помощью CLD с I3- позволяет рассчитать концентрацию NO3- 36,37 (рисунок 3).
В анализе потребления NO непрерывное высвобождение NO в продувочном сосуде донорами NO, такими как (Z)-1-[2-(2-аминоэтил)-N-(2-аммониоэтил)амино]диазен-1-иум-1,2-диолат (DETA-NONOate), генерирует стабильный сигнал, позволяющий количественно определять бесклеточный oxyHb в введенных образцах. Количество NO, потребляемого в продувочном сосуде, находится в стехиометрической зависимости от количества оксиHb в образце38.
Проиллюстрированы протоколы измерения потребления NO2-, NO3-, S-нитрозотиолов, железо-нитрозиловых комплексов и NO бесклеточным Hb в образцах плазмы. Исследования NO в среде эритроцитов требуют специальной обработки образца с последующей эксклюзионной хроматографией для измерения чрезвычайно хрупких S-NO-Hb и Hb-NO в сочетании с определением общей концентрации Hb15,22. Пробоподготовка играет важную роль в коррекции измерений. Предварительное существование NO2- вH2Oи высвобождение NO2- во время анализа может привести к измерению искусственно более высоких концентраций производных NO, таких как S-NO-Hb14,39. Также представлены важные аспекты пробоподготовки.
протокол
Процедуры, указанные в этом протоколе, соответствуют совету по обзору Массачусетской больницы общего профиля. Образцы крови, которые использовались, были собраны во время предыдущего исследования и были деидентифицированы для текущей цели18.
ПРИМЕЧАНИЕ: Смотрите инструкции производителя для получения конкретных указаний относительно оптимальных соединений между трубками и стеклянной посудой, составляющей продувочный сосуд, промывку и общее техническое обслуживание. Соединения должны быть прочными и аккуратно выполненными, чтобы не повредить стеклянную посуду. Определите компоненты стеклянного продувочного сосуда: впускную линию газа, продувочный сосуд с нагревательной рубашкой и конденсатором, газовую ловушку гидроксида натрия (NaOH), соединительную линию между продувочным сосудом и барботером, газовую линию выхода продувочного сосуда (к CLD), оснащенную фильтром интенсивного поля диэлектрика (IFD). Линия фильтра IFD между продувочным сосудом и входным отверстием образца CLD должна быть на месте каждый раз, когда измеряются метаболиты NO в жидкой форме (плазма, клеточные культуры, тканевые гомогенаты) (все анализы, представленные в протоколе). Подготовка образца зависит от жидкости или ткани, которая анализируется, и от интересующих соединений. Важные аспекты преаналитического этапа рассматриваются в разделах 1 и 2. Конкретные этапы подготовки к конкретным анализам включены в разделы 3-5. Разделы 6-8 применяются ко всем анализам.
1. Приготовление специальных реагентов
ПРИМЕЧАНИЕ: Для получения более подробной информации см. предыдущие публикации15,22.
- Готовят 5% (290 мМ) подкисленный раствор сульфаниламида (АС) для удаления NO 2-путем растворения 500 мг сульфаниламида в 10 мл 1N HCl. Это решение стабильно в течение нескольких месяцев.
- Готовят 50 мМ раствора хлорида ртути (HgCl2) для высвобождения NO2 из S-NOs путем растворения 67,9 мгHgCl2 в 5 мл PBS. Защитите складской раствор от света.
- Готовят NO 2-блокирующий раствор с 800 мМ феррицианида [K3Fe(CN)6] для окисления Hb вместе со 100 мМ N-этилмалеймида (NEM) для блокирования тиол-групп и (НЕОБЯЗАТЕЛЬНО) 10% раствора нонилфенил-полиэтиленгликоля (Nonidet p-40) для солюбилизации мембран эритроцитов.
- Добавьте K3Fe(CN)6 в деионизированную и дистиллированную воду (ddH2O, 263,5 г порошка на литр) для получения конечной концентрации 800 мМ.
- Добавьте NEM к 800 мМ K3Fe(CN)6 в растворе ddH2O (12,5 г порошка на литр с концентрацией 100 мМ) и перемешайте раствор для растворения всех кристаллов.
- Добавьте одну часть 10% NP-40 к девяти частям 800 мМ NEM K3Fe(CN)6 100 мМ РАСТВОР NEM (111 мл на литр) и хорошо перемешайте (обязательный этап для анализа цельной крови).
- Из их исходных растворов готовят стабилизирующий раствор S-NO-Hb, содержащий 12 мМ K3Fe(CN)6, 10 мМ NEM, 100 мкМ диэтилентриаминпентауксусной кислоты (DTPA, для хелатирования металлов) и 1% моющего средства Nonidet p-40.
- Приготовьте раствор NEM 200 мМ, добавив кристаллы NEM в PBS (25 мг/мл, например, 250 мг в 10 мл PBS) и перемешайте раствор до тех пор, пока все кристаллы не растворятся (должны быть сделаны в день эксперимента).
- Готовят раствор 800 мМ K3Fe(CN)6 , добавляя K3Fe(CN)6 к ddH2O (263,5 мг/мл, например, 1,32 г в 5 мл ddH2Oдля получения конечной концентрации 800 мМ) (для получения в день эксперимента).
- Приготовьте стандартный раствор DTPA 10 мМ, добавив 786 мг DTPA к 200 мл ddH2Oи отрегулируйте pH до 7,0 с 5N NaOH для полной солюбилизации DTPA.
- Добавьте 5 мл раствора NEM 200 мМ, 1,5 мл раствора 800 мМ K3Fe(CN)6 и 1 мл стандартного раствора DTPA к 81,5 мл PBS при 7,2 рН и, наконец, добавьте 11 мл 10% NP-40, чтобы довести конечный объем до 100 мл.
2. Сбор образцов
ПРИМЕЧАНИЕ: Для получения более подробной информации о выборочном сборе см. ранее опубликованные работы 15,22,40.
- Соберите цельную кровь
- Собирайте кровь в трубках, покрытых гепарином, предпочитая венозный артериальный сосуд (если это специально не требуется) и предпочитая установку катетера вместо венипунктуры (если это возможно) с катетером или иглой не менее 20 г или больше, чтобы свести к минимуму гемолиз.
- Немедленно добавляют NO 2-блокирующий раствор (1 часть раствора на 4 части цельной крови), обрабатывают (разделы 3 или 4) или замораживают и хранят при -80 °C.
- Сбор плазмы и эритроцитов (эритроцитов)
- Собирайте кровь в трубках, покрытых гепарином, предпочитая венозную артериальную кровь (если это специально не требуется) и иглы не менее 20 г или более, чтобы свести к минимуму гемолиз и центрифугу немедленно в течение 5 мин при 4000 х г при 4 °C.
- Смешайте супернатант (плазму) с NO 2-блокирующим раствором (1 часть раствора на 4 части супернатанта) в новой пробирке и обработайте (секции 3 или 4) или заморозьте и храните при -80 °C.
ПРИМЕЧАНИЕ: Для анализа потребления NO нельзя использовать раствор, блокирующий NO2. Анализ может быть выполнен без предварительной обработки плазмы. - Повторно суспендируют гранулу RBC со дна в новую трубку, предварительно заполненную стабилизирующим раствором S-NO (см. этап 1.4) (1 мл гранулы на 9 мл раствора) и инкубируют в течение 5 мин.
- Пропустите лизат RBC в калибровочную колонну с полимером G-25 Sephadex, который ранее был промыт ddH2O для эксклюзионной хроматографии
- Соберите фракцию Hb для обработки (раздел 4) и измерения концентрации Hb с помощью реагента Драбкина (для измерения Hb см. ранее опубликованную работу22).
ПРИМЕЧАНИЕ: Подготовить и взять образец конкретной ткани / органа, идентифицировать его хилум и хирургическим путем изолировать его. Прорежьте вену, проколите артерию и введите гепаринизированный физиологический раствор (10 Ед /мл) через артерию. Иссекайте ткань, когда физиологический раствор начинает оттекать при венозном разрезе. Гомогенизировать ткань механическим гомогенизатором, добавляя 1 часть NO 2-блокирующего раствора к 4 частям гомогенизированной ткани.
3. VCl3 в подготовке анализа HCl
ПРИМЕЧАНИЕ: Для получения более подробной информации о VCl3 в подготовке анализа HCl обратитесь к ранее опубликованным работам37,41.
ВНИМАНИЕ: CLD будет поврежден, если ловушка NaOH не будет должным образом установлена при выполнении этого анализа. Это связано с коррозионной активностью HCl.
- Подготовка стандартных растворов NO3- для стандартной кривой
- Растворить 85 мг NaNO3 в 10 мл ddH2Oдо получения 0,1 M NaNO3- (этот раствор остается стабильным в течение нескольких недель).
- Используйте исходный раствор для приготовления эталонов путем разбавления в ddH2Oдля получения концентраций 5 мкМ, 10 мкМ, 20 мкМ, 40 мкМ, 80 мкМ, 200 мкМ NaNO3 с целью выполнения калибровочной кривой для образцов плазмы или мочи (используйте более низкие концентрации при работе с клеточными культурами).
- Приготовьте насыщенный раствор VCl3 (хлорид ванадия) для уменьшения NO3- в продувочном сосуде
ВНИМАНИЕ: Реакция воды и VCl3 является экзотермической. Обратите внимание на высокую температуру стеклянной посуды при добавлении кислоты и при ополаскивании стеклянной посуды в конце эксперимента.- Растворить 1,6 г VCl3 в 200 мл 1 M HCl, сначала добавив VCl3 в чистую колбу, а затем добавив 200 мл 1 M HCl.
- Вакуумная фильтрация раствора через фильтровальную бумагу (например, фильтровальную бумагу 11 мкм, но можно использовать любую фильтровальную бумагу).
ПРИМЕЧАНИЕ: Отфильтрованный раствор должен стать прозрачным синим, в то время как нефильтрованный раствор VCl3 имеет коричневый цвет из-за нерастворенных частиц. - Держите насыщенный раствор покрытым либо алюминиевой фольгой, либо политетрафторэтиленовой (PTFE) лентой, так как соединение является светочувствительным.
- Подготовьте плавающую водяную баню
- Подключите циркуляционную водяную баню к водяной рубашке продувочного сосуда. Убедитесь, что линии сухие перед грунтовкой.
- Начните водяную баню при 95 °C и проверьте отсутствие утечек на водопроводных линиях, применив (неслучайные) бумажные полотенца вокруг линий.
- Настройка газовой пузырьковой ловушки
- Убедитесь, что втулка из PTFE пузырька находится на месте и что она не повреждена.
- Откройте газовый пузырь и впрыскивайте 15 мл 1 М NaOH в основание пузырькового аппарата.
- Переместите газовый пузырь и плотно запечатайте соединение, прижав дно к верху и слегка скручив две части. Невозможность поворота верхней части барботера без приложения усилия свидетельствует о правильном уплотнении.
- Подключите выходное отверстие продувочного сосуда к входному отверстию газовой пузырьковой ловушки.
4. I3- в препарате для анализа уксусной кислоты
ПРИМЕЧАНИЕ: Для получения более подробной информации о I3- в препарате для анализа уксусной кислоты обратитесь к ранее опубликованным работам 15,22,38,41,42.
- Подготовьте стандартную кривую для NO2-
- Готовят стоковый раствор, растворяя 69 мг нитрита натрия (NaNO2) в 10 мл ddH2Oс получением 100 мМ раствора. Этот раствор стабилен, если хранится в герметичном контейнере, охлаждается и защищен от света.
- Последовательно разбавляют исходный раствор в 1,5 мл микроцентрифужной трубки, предварительно заполненной 900 мкл ddH2O: добавляют 100 мкл исходного раствора в первую центрифужную трубку, смешивают, маркируют и используют 100 мкл трубки для второй трубки, затем повторяют, получая 10 мМ, 1 мМ, затем 100 мкМ.
- Далее разбавляют ddH2Oс получением 50 мкМ, 25 мкМ, 10 мкМ, 1 мкМ и 500 нМ аликвот NaNO2 , которые будут использоваться в калибровочной кривой.
- Подготовьте I3- в уксусной кислоте для продувочного сосуда (можно хранить при комнатной температуре (RT) в течение 1 недели)22
- Добавьте 2 г йодида калия (KI) и 1,3 г йода (I2) до 40 мл ddH2Oи 140 мл уксусной кислоты.
- Тщательно перемешайте, перемешивая смесь в течение не менее 30 минут.
- Подготовьте образцы для дифференциального определения NO2-, S-нитрозотиолов (S-NO-Hb, если собирается Hb) и железо-нитрозиловых комплексов (Hb-NO, если собирается Hb) (Рисунок 3)
- Разделить каждый образец на 3 аликвоты по 270 мкл (900 мкл Hb при измерении S-NO-Hb и Hb-NO) в защищенных светом микроцентрифужных пробирках, 2 из которых предварительно заполнены 30 мкл 1x PBS (100 мкл при измерении S-NO-Hb и Hb-NO) и третья трубка с 30 мкл HgCl2 (100 мкл при измерении S-NO-Hb и Hb-NO), вихрь и инкубация при РТ в течение 2 мин (рисунок 3).
- Добавить 30 мкл 5% AS к образцу сHgCl2 для измерения Fe-NOs (100 мкл для Hb-NO) и к образцу с добавлением PBS для измерения S-NOs и Fe-NOs (100 мкл для S-NO-Hb и Hb-NO) и добавить 30 мкл PBS к третьему, уже предварительно заполненному 1x PBS для измерения NO2-, S-NOs и Fe-NOs (100 мкл для остаточного NO2- из сбора Hb, S-NO и Hb-NO). Вихрь и инкубация при RT в течение 3 мин (рисунок 3).
5. НЕТ потребления бесклеточной установкой Hb
ПРИМЕЧАНИЕ: Для получения более подробной информации обратитесь к ранее опубликованной работе38.
- Готовят стандартные растворы oxyHb из очищенного раствора Hb с известной концентрацией
- Последовательно разбавляют исходный раствор в микроцентрифужные трубки объемом 1,5 мл путем добавления ddH2Oдля получения растворов, которые будут использоваться для калибровочной кривой: 62 мкМ, 50 мкМ, 25 мкМ, 12,5 мкМ, 6,25 мкМ, 3,125 мкМ, 1,56 мкМ.
- Подготовка раствора DETA-NONOate
- Добавьте 10 мг DETA-NONOate к 610 мкл 10 мкм NaOH в рН 7,4 PBS, чтобы получить 100 мМ DETA-NONOate и сохранить его на льду.
6. Запустите детектор хемилюминесценции (CLD) и подготовьте продувочный сосуд
ПРИМЕЧАНИЕ: Для подготовки промывочного сосуда обратитесь к ранее опубликованной работе43.
- Проверка основных подключений к cld и с него
- Подключите кислородную линию к CLD и откройте кислородный баллон при давлении, согласованном с производителем CLD.
- Убедитесь, что линия фильтра интенсивного поля диэлектрика (IFD) подключена к CLD, но не к продувочному сосуду или ловушке NaOH
- Запуск cld
- На интерфейсе CLD запустите программу обнаружения анализов жидкой фазы.
- Убедитесь, что подача кислорода достаточна. В этом случае CLD успешно начнет отбор проб из своего входа и укажет на обнаружение сигналом в милливольтах (0-5 мВ). В противном случае CLD вызовет отрицательный диагностический сигнал.
- Подготовьте продувочный сосуд
- Закройте продувочный сосуд на всех трех портах: полностью прикрутите игольчатый клапан вправо, закройте впускной и выпускной запорные краны.
- Снимите колпачок из продувочного сосуда и добавьте в реакционную камеру достаточное количество реагента, специфичного для запланированного анализа (таблица 1), чтобы игла шприца, используемая для введения образцов, могла достичь колонки жидкости.
- Проверка наличия стабильного желаемого базового уровня (таблица 1).
- Запуск потока продувочного газа
- Убедитесь, что резервуар для инертного газа (например, N2) оснащен двухступенчатым регулятором, и соедините резервуар для инертного газа с газовым входом сосуда.
- Откройте газ с давлением на выходе на регуляторе 1-5 фунтов на квадратный дюйм, откройте входное отверстие продувочного сосуда и медленно откройте игольчатый клапан продувочного сосуда, чтобы обеспечить приток газа. Проверьте пузырьки в продувочном сосуде.
- Регулировка расхода газа
- Регистрируйте давление в ячейках, измеренное CLD, с помощью фильтрующей линии IFD для отбора проб окружающего воздуха.
- Переставьте колпачок на продувочный сосуд, подключите линию фильтра IFD к продувочному сосуду (или к ловушке NaOH в анализе VCl3 в анализе HCl) и откройте выходное отверстие продувочного сосуда.
- Используйте игольчатый клапан для достижения того же давления в ячейке на уровне CLD, которое регистрируется в окружающем воздухе.
7. Эксперимент
ПРИМЕЧАНИЕ: Для получения более подробной информации об эксперименте обратитесь к ранее опубликованной работе43.
- Запустите программу получения сигналов хемилюминесценции
- Подключите последовательный порт контроллера CLD к последовательному порту компьютера, в который была установлена программа сбора данных.
- Запустите программу анализа.
- Нажмите « Получить», выберите папку для сохранения файла .data, введите имя файла и нажмите « Сохранить».
ПРИМЕЧАНИЕ: Обратите внимание на предустановленное время выполнения на экране, так как запись автоматически останавливается по истечении заданного времени. При необходимости предустановленное время работы может быть увеличено.
- Подготовка к повторным инъекциям образцов
- Отрегулируйте шкалу напряжения на экране, чтобы иметь контроль над целевой базовой линией, нажав на кнопки Минимум и / или Максимум , а затем введя желаемое значение.
- Иметь трубку объемом 20 или 50 мл, заполненную ddH2O, чтобы промыть шприц между образцами.
- Имейте коробку деликатных салфеток для задач, легко доступных.
- Инъекция образца
ПРИМЕЧАНИЕ: Начните со стандартных растворов для калибровочной кривой (впрыскивание из наименее концентрированных в наиболее концентрированные образцы), затем перейдите к экспериментальным образцам (рассмотрите возможность сделать это в дубликатах или трех экземплярах).- Промывайте шприц по крайней мере дважды или более ddH2Oперед извлечением каждого образца (и после каждой инъекции) и проверяйте каждый раз беспрепятственный выброс воды на заданную салфетку.
- Вставьте шприц в пробочку, удерживая шприц и трубку на близком расстоянии, подтяните плунжер до нужного объема, гарантируя, что пузырь воздуха и/или негомогенизированные твердые части не будут захвачены.
- Очистите наконечник шприца с помощью рабочего стеклоочистителя, затем вставьте шприц в колпачок перегородки в отверстии для инъекции и введите после проверки того, что наконечник шприца находится в жидкой фазе в реакционной камере.
- Отметьте инъекцию в программе и ждите
- Убедитесь, что инъекция вызывает изменение сигнала в сторону повышения (дополнительный рисунок 1) (вниз в потреблении NO бесклеточным анализом Hb), и введите имя образца, щелкнув серое поле в разделе «Имена образцов», затем нажмите « Пометить инъекцию».
ПРИМЕЧАНИЕ: Заподозрите непроходимость шприца, если инъекция образца не генерирует сигнал. - Подождите, пока электрический сигнал снова достигнет исходного уровня (обычно это занимает 3-4 минуты). Это время можно использовать для выполнения шага 7.3.1.
- Убедитесь, что инъекция вызывает изменение сигнала в сторону повышения (дополнительный рисунок 1) (вниз в потреблении NO бесклеточным анализом Hb), и введите имя образца, щелкнув серое поле в разделе «Имена образцов», затем нажмите « Пометить инъекцию».
- Повторяйте все шаги, указанные в шагах 7.3 и 7.4, во время и после каждой инъекции до конца эксперимента. Не забудьте запустить образец решения для сохранения (если используется)
- Остановить эксперимент
- Нажмите кнопку STOP, чтобы прервать прием сигнала, остановите CLD и выключите водяную баню (если измеряется NO 3-).
- Прервите поток газа, откройте игольчатый клапан, снимите крышку с продувочного сосуда, поместите контейнер для отходов под слив и откройте сливной запорный кран.
ПРИМЕЧАНИЕ: Если эксперимент требует сбора данных в течение более 60 минут, необходимо перезапустить сбор через 60 минут времени работы (повторите шаг 7.1.3) и создать новый файл.
8. Измерения и расчеты
ПРИМЕЧАНИЕ: Измерения и расчеты производятся в автономном режиме и могут быть выполнены в другое время.
- Запустите программу сбора хемилюминесценции для автономного анализа данных
- Запустите программу и нажмите «Процесс».
- Выберите файл эксперимента и нажмите кнопку Открыть.
- Вычисление площади под кривой для каждого администрирования
- Программа автоматически выводит на экран базовую линию (Дополнительный рисунок 2A, горизонтальная желтая линия) и пиковую ось каждой волны, генерируемой каждым образцом администрирования (вертикальные желтые линии): проверяет их правильное положение (или корректирует, нажимая на каждую линию и перемещая ее мышью или стрелками) и нажимает на Threshold OK (Дополнительный рисунок 2B).
ПРИМЕЧАНИЕ: При потреблении NO бесклеточным измерительным анализом Hb программному обеспечению обычно не удается правильно захватить форму сигнала, генерируемую инъекцией образца. Увеличивая каждую форму сигнала, оператор может легко помочь программному обеспечению в расчете площади (дополнительный рисунок 2). - Программа автоматически отображает начало (вертикальная зеленая линия) и конец (вертикальная красная линия) каждого пика, вызванного каждым образцом администрирования: проверяет их правильное положение (или корректирует, нажимая на каждую линию и перемещая ее мышью или стрелками) и нажимает на Integrate (Дополнительный рисунок 2C).
ПРИМЕЧАНИЕ: Некоторые области в следе могут быть ошибочно определены как инъекции в этой точке, а некоторые пики могут быть автоматически подсчитаны дважды. Обе ошибки могут быть повторно идентифицированы и устранены на этапе 8.2.2 - Программа автоматически сопоставляет каждую область сигнала после инъекции, отмеченной во время эксперимента, и присвоенное ей имя: перемещайтесь по каждому пику (обозначенному желтой вертикальной линией) с назначенным именем, нажимая на Next Peak и Previous Peak, затем нажимаете на кнопку All OK , чтобы наконец получить расчет для всех областей на экране.
- Чтобы исправить все ошибки именования или сопоставления, допущенные пользователем или программой, используйте по мере необходимости кнопки, указанные в Дополнительном файле 1.
- Программа автоматически выводит на экран базовую линию (Дополнительный рисунок 2A, горизонтальная желтая линия) и пиковую ось каждой волны, генерируемой каждым образцом администрирования (вертикальные желтые линии): проверяет их правильное положение (или корректирует, нажимая на каждую линию и перемещая ее мышью или стрелками) и нажимает на Threshold OK (Дополнительный рисунок 2B).
- Перенос значений калибровочной кривой в электронную таблицу и создание уравнения линейной регрессии (дополнительный рисунок 3)
- Перенос данных из программы CLD в новую электронную таблицу путем копирования-вставки. Расположите два столбца в таблице как «Концентрация образца» и « Площадь под кривой» и добавьте соответствующее нулевое значение для обоих столбцов.
- Выберите два столбца, нажмите « Вставить > scatter», затем в меню «Дизайн диаграммы» выберите «Добавить элемент диаграммы» > «Линия тренда» > «Линейный».
- Щелкните правой кнопкой мыши на сгенерированной линии тренда, выберите Формат линии тренда, затем выберите параметры Отображать уравнения на графике и Отображать значение R-квадрата на графике в меню Формат линии тренда , чтобы получить простое линейное калибровочное уравнение.
- Перенесите рассчитанную площадь каждого образца для расчета его концентрации (дополнительный рисунок 3)
- Сообщайте о каждом значении в электронной таблице. В следующей колонке применяют уравнение, полученное на этапе 8.3.3, для получения концентрации каждого инъецируемого образца, где y - концентрация (значение новой колонки) и x - площадь под кривой, измеренной после инъекции.
ПРИМЕЧАНИЕ: Не забудьте принять во внимание концентрацию, измеренную в консервационном растворе (если он используется), и соответственно вычесть значения.
- Сообщайте о каждом значении в электронной таблице. В следующей колонке применяют уравнение, полученное на этапе 8.3.3, для получения концентрации каждого инъецируемого образца, где y - концентрация (значение новой колонки) и x - площадь под кривой, измеренной после инъекции.
Результаты
No-потребление бесклеточным анализом Hb использовалось в образцах, содержащих известные концентрации бесклеточного оксиHb (рисунок 4). Поскольку один гем оксиHb стехиометрически высвобождает одну молекулу NO в анализе, очищенный бесклеточный oxyHb используется для построени...
Обсуждение
Из-за высокой чувствительности хемилюминесцентные анализы для определения NO и связанных с ним соединений имеют высокий риск загрязнения NO2-. Каждый реагент (особенно NO 2-блокирующий раствор) и разбавитель (включая ddH2O), используемые в эксперименте, должны бы...
Раскрытие информации
L.B. получает поддержку заработной платы от K23 HL128882 / NHLBI NIH в качестве главного исследователя для своей работы по гемолизу и оксиду азота. LB получает гранты от «Fast Grants for COVID-19 research» в Mercatus Center Университета Джорджа Мейсона и от iNO Therapeutics LLC. B.Y. поддерживается грантами NHLBI/#R21HL130956 и DOD/The Geneva Foundation (W81XWH-19-S-CCC1, Log DM190244). B.Y. получил патенты в MGH на электрическую генерацию оксида азота.
L.B. и B.Y. подали патентную заявку на NO доставку при заболевании COVID-19 Номер заявки PCT: PCT/US2021/036269 подана 7 июня 2021 года. RWC получает поддержку заработной платы от Unitaid в качестве главного исследователя по разработке технологий, направленных на децентрализованную диагностику туберкулеза у детей, находящихся в условиях ограниченных ресурсов.
Благодарности
Протоколы, описанные в этой рукописи, стали возможными благодаря накопленному вкладу предыдущих сотрудников лаборатории исследований анестезии в реаниматологии доктора Уоррена Запола, отделение анестезии в Массачусетской больнице общего профиля. Мы признаем вклад докторов Акито Накагавы, Франческо Задека, Эмануэле Вассены, Чонг Лея, Ясуко Нагасака, Эстер Спаньолли и Эмануэле Резоальи.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Ссылки
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены