É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaios baseados em chemiluminescência para detecção de óxido nítrico e seus derivados de Autoxidação e Compostos Nitrosated
Neste Artigo
Resumo
Aqui, apresentamos protocolos para detectar óxido nítrico e seus derivados biologicamente relevantes usando ensaios baseados em chemiluminescência com alta sensibilidade.
Resumo
A atividade de óxido nítrico (NO) in vivo é o resultado combinado de seus efeitos diretos, a ação de seus derivados gerados a partir da autoxidação no no, e os efeitos dos compostos nitrosos. Medir metabólitos NO é essencial para estudar nenhuma atividade tanto em níveis vasculares quanto em outros tecidos, especialmente nos ambientes experimentais onde o NO exógeno é administrado. Os ensaios de chemiluminescência à base de ozônio permitem medições precisas de metabólitos NO e NO em ambos os fluidos (incluindo plasma, homogeneizadores de tecido, culturas celulares) e misturas de gás (por exemplo, respiração exalada). NÃO reage com ozônio para gerar dióxido de nitrogênio em um estado animado. A consequente emissão de luz permite a fotodetecção e a geração de um sinal elétrico refletindo o teor NO da amostra. Alíquotas da mesma amostra podem ser usadas para medir metabólitos não específicos, como nitrato, nitrito, S-nitrosothiols e complexos ferro-nitrosilo. Além disso, o NO consumido pela hemoglobina livre de células também é quantificado com a análise de quimiluminescência. Uma ilustração de todas essas técnicas é fornecida.
Introdução
Desde que Os ganhadores do Salvador Moncada e do Nobel Robert Furchgott, Louis Ignarro e Ferid Murad identificaram o óxido nítrico (NO) como o anteriormente conhecido fator de relaxamento derivado da endotelia (EDRF), o papel central do NO foi estabelecido em vários mecanismos-chave que abrangem toda a biologia vascular, neurociências, metabolismo e resposta ao hospedeiro 1,2,3,4,5,6,7 . A administração exógena do GÁS NO tornou-se um tratamento estabelecido para insuficiência respiratória devido à hipertensão pulmonar no recém-nascido8. O gás óxido nítrico também tem sido investigado para o tratamento da infecção pelo vírus sincicial respiratório (RSV), malária e outras doenças infecciosas, lesão de isquemia-reperfusão e para prevenção de lesão renal aguda em pacientes submetidos à cirurgia cardíaca 9,10,11,12. A necessidade de técnicas precisas de medição para avaliar os níveis de NO, seus metabólitos e os de suas proteínas e compostos-alvo surge tanto de estudos mecanicistas quanto intervencionistas.
Devido à sua alta reatividade, a NO pode sofrer reações diferentes dependendo da matriz biológica em que é produzida e/ou liberada. Na ausência de hemoglobina (Hb) ou outras hemoproteínas de oxi, a NO é oxidada quase completamente ao nitrito (NO2-).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2- + H+
O NO primeiro sofre autoxidação com oxigênio molecular (O2) para produzir dióxido de nitrogênio (NO2) e reage com o próprio NO2 para gerar trióxido de dinitrogen (N2O3). Uma molécula de N2O3 reage com água (H2O) para formar duas moléculas de NO2- e um próton (H+)13. Dentro de sangue inteiro14,15, NO e NO2- são rapidamente convertidos em nitrato (NO3-) como essas moléculas reagem avidamente com os grupos de heme oxidado de Hb [Hb-Fe2+-O2 ou oximosoglobina (oxicodona)] para produzir NO3-. Esta reação é associada à transição do grupo heme para o estado férrico [Hb-Fe3+ ou methemoglobina (metHb)]:
HB-Fe2+-O2 + NO → Hb-Fe3+ + NO3-
A barreira das células vermelhas do sangue (RBC) e o espaço imediatamente adjacente ao endotélio são os principais fatores que limitam essa reação e permitem que uma pequena porção do NO liberada pelo endotélio atue como EDRF16,17. Na verdade, o Hb livre de células na circulação é conhecido por interromper a vasodilatação em ambientes experimentais e clínicos17,18. Dentro da RBC, dependendo da oxigenação e da concentração NO2, uma porção de NO reage com desoxihemoglobina (Hb-Fe2+) para formar ferro-nitrosol Hb (Hb-Fe2+-NO ou HbNO):
HB-Fe2+ + NO → Hb-Fe2+-NO
Na RBC15,17, o NO2- pode formar o Hb-Fe3+ reduzindo o Hb-Fe2+ levando ao lançamento do NO, que por sua vez liga o Hb-Fe2+-O2 (preferencialmente) ou o Hb-Fe2+.
A geração de no-derivados não deve ser considerada estritamente unidirecional, pois o NO pode ser regenerado a partir de NO2- e NO3- em vários tecidos e por diferentes enzimas (por exemplo, por bactérias intestinais ou dentro das mitocôndrias, particularmente sob condições hipoxicas)19,20.
Uma quantidade variável de NO produzido (ou administrado) leva à geração a jusante de S-nitrosothiols, principalmente por transinrose de thiol a partir de N2O3 na presença de um nucleófilo criando um intermediário doador NO+ (Nuc-NO+-NO2-):
N2O3 + RS- → RS-NO + NO2-
Outra possibilidade para a geração de S-nitrosothiols é a nitrosiagem de tiais oxidados (NÃO reage com um tiol oxidado):
RS• + NO → RS-NO
Este mecanismo e oxidação direta de thiol pelo NO2 só podem ser possíveis em condições muito específicas que são descritas em outros lugares21. Os s-nitrosothiols variam de moléculas leves como S-nitrosoglutathione a grandes proteínas que contêm tiol. A s-nitrosohemoglobina (S-NO-Hb) é formada por nitrosão de um grupo de tiol de um resíduo de cisteína conservado na cadeia de β (β93C)22.
A geração e o metabolismo dos S-nitrosothiols fazem parte de importantes mecanismos regulatórios. Exemplos incluem regulação de glutathione, caspases, N-metil-D-Aspartato (NMDA) e receptores de ryanodo 23,24,25,26,27,28. Anteriormente considerado como um grande mediador da NO biology in vivo, a albumina nitrosa (S-nitroso-albumina) parece ser um transportador NO/NO+ sem qualquer atividade biológica adicional específica29.
Ao medir a concentração de NO e seus derivados de uma amostra biológica específica dentro de uma matriz biológica, é importante considerar características como acidez, oxigenação, temperatura e presença de reagentes. Exemplos incluem doadores exógenos administrados NO e, no cenário de inflamação aguda, peróxido de hidrogênio (H2O2) reagindo com o NO2 levando à geração de concentração supernormal de radicais livres como a peroxitorita (ONOO-)21. Além do método analítico que é empregado, a fase pré-analítica da preparação e armazenamento da amostra é fundamental. Reações a jusante que não representam a atividade in vivo NO devem ser previstas, consideradas e bloqueadas. Um exemplo válido é a instabilidade do S-NO-Hb, que exige um tratamento dedicado de amostras de sangue quando é direcionado para a medição22.
Ensaios baseados em chemiluminescência são o padrão-ouro para detectar os níveis de NO e seus principais metabólitos [NO2-, NO3-, S-NO e complexos ferro-nitrosol (Fe-NO)] em qualquer fluido biológico, incluindo homogeneiza tecidos30,31. Esses métodos dependem do detector de chemiluminescência (CLD), um dispositivo que abriga a reação de NO com ozônio (O3), gerando o Nº2 em estado animado (NO2•). Relaxamento do NO2• causa emissão de um fóton de luz detectado por um tubo fotomultiplier, gerando um sinal elétrico diretamente proporcional ao teor NO da mistura de gás amostrado32. Um esquema simplificado do CLD está representado.

Figura 1: Esquema simplificado de um detector de quimiluminescência para gás óxido nítrico. A detecção baseada em óxido nítrico (NO) é a geração estequiométrica de uma molécula de gás NO que é introduzida no detector de quimiominascência (CID). A reação de chemiluminescência é obtida em uma câmara designada fornecida com ozônio (O3) de um gerador interno, que é mantida em pressão negativa por conexão com uma bomba externa, permitindo entrada contínua e constante de gás amostral. A geração de O3 requer oxigênio diatômico (O2) que é fornecido por um tanque O2 dedicado conectado com o CLD (outros fabricantes fornecem CLDs operando com ar ambiente). Dentro da câmara de reação, cada molécula de gás NO contido no gás amostrado reage com oxigênio para produzir uma molécula de dióxido de nitrogênio no estado ativado (NO2*). Ao retornar ao seu estado terrestre, cada molécula NO2* emite um fóton que é detectado por um tubo fotomultiplier (PMT) localizado ao lado da câmara de reação. O TPM com o amplificador associado e unidade de processamento central produz um sinal proporcional à contagem de fótons e ao número de nenhuma molécula na câmara de reação. Clique aqui para ver uma versão maior desta figura.
A entrada amostral do CLD pode ser conectada a um sistema de vidro contendo uma câmara de reação para amostras líquidas. O sistema é continuamente purgado com um gás inerte como nitrogênio, hélio ou argônio, transferindo NÃO da câmara de reação para o CLD. Amostras de fase líquida são injetadas através de uma membrana dedicada no vaso de purga.
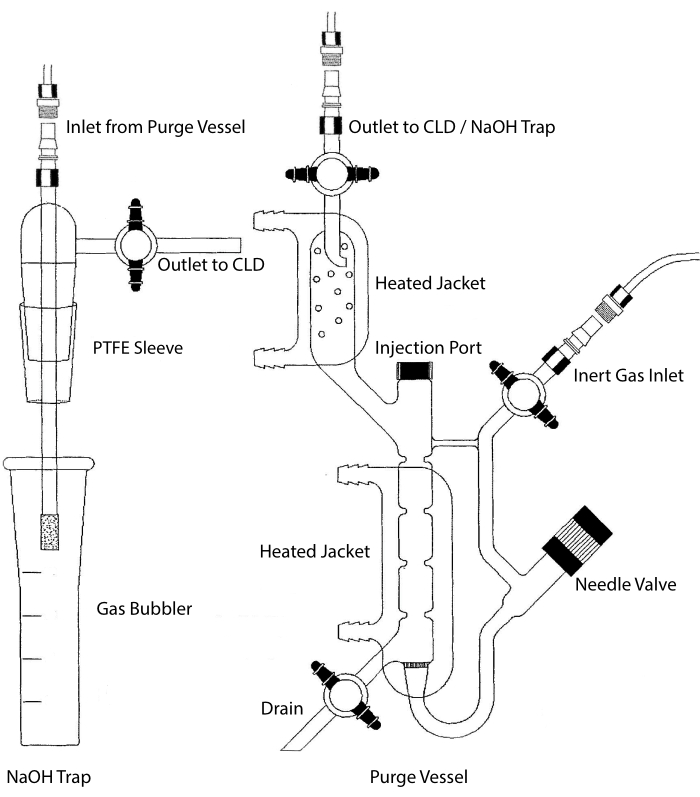
Figura 2: Estrutura de um vaso de purga para detecção baseada em óxido nítrico à base de quimiotrica O vaso de purga (à direita) permite a detecção de gás óxido nítrico (NO) ou qualquer outro composto que possa ser facilmente convertido em nenhum gás quando liberado de um reagente de fase líquida. A entrada de gás inerte está conectada a uma fonte (tanque) de um gás inerte como Argon, Xeon ou nitrogênio diatômico (N2). A válvula da agulha (abre à esquerda) é usada para controle de pressão dentro do vaso de purga e pode ser completamente removida para limpar o vaso. A porta de injeção é coberta por uma tampa com um septo de membrana para injeção de amostra. A membrana deve ser substituída com frequência. Uma jaqueta aquecida envolve a câmara de reação e é conectada a um banho de água quente para realizar o teste VCl3 em HCl. A saída do vaso de purgação está conectada ao detector de quimiominascência (CLD) ou à armadilha NaOH (necessária para vcl3 em ensaios HCl). Para drenar o conteúdo da câmara de reação, primeiro feche as torneiras na entrada de gás inerte e a saída do vaso de purga, feche a válvula da agulha, remova a tampa no porta de injeção e, finalmente, abra a torneira no ralo. A armadilha NaOH (esquerda) é necessária para ser colocada em linha entre o vaso de purga e o CLD se o ensaio VCl3 em HCl for realizado devido à corrosão do HCL. A conexão com o CLD sempre requer um filtro de campo intenso (IFD) a ser colocado entre o CLD e a saída do vaso de purga (ou a armadilha NaOH, se usado). O filtro IFD remove partículas aéreas e impede que o líquido passe pelo vaso de purga. PTFE = politetrafluoroetileno. Clique aqui para ver uma versão maior desta figura.
Como consequência, qualquer composto que possa ser convertido em NÃO através de uma reação química específica e controlada pode ser detectado com alta sensibilidade em qualquer fluido biológico e homogeneizar tecido24. A medição direta da fase de gás NO através da chemiluminescência é realizada tanto em ambientes experimentais quanto clínicos. Essas técnicas são amplamente descritas em outros lugares 33,34,35. A medição de NO2-, S-nitrosothiols, proteínas S-nitrosated e Fe-NOs pode ser realizada adicionando amostras em uma mistura de reação com triiodeto (I3-), que não libera gás estelioetricamente de todos esses compostos:
I3- → I2 + I-
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
enquanto eu3- não reage com o NO 3-15. Medições precisas de cada composto são possíveis pelo pré-tratamento de alíquotas amostrais com sulfanilamida acidificada (AS) com ou sem cloreto mercúrico (HgCl2). Especificamente, o pré-tratamento com AS remove todo o conteúdo NO 2. Como consequência, o conteúdo NO medido pelo CLD reflete apenas a soma da concentração de S-NOs e Fe-NOs. A injeção de HgCl2 em uma alíquota de amostra antes da injeção de AS faz com que o NO2- seja liberado pelo S-NO. O tratamento com AS (levando à remoção nº2) garante que o teor de NÃO medido só reflete a concentração de Fe-NOs. Uma série de subtrações entre as avaliações permitem calcular a concentração precisa dos três derivados NO22.

Figura 3: Etapas na preparação da amostra para o ensaio i3- em ácido acético quemiluminescence. Os passos sequenciais para a preparação do ensaio i3- em ácido acético chemiluminescence são ilustrados. É necessário o uso de tubos de centrífuga protegidos pela luz. Os tubos 1, 2 e 3 são os usados para se preparar para o ensaio. Outra alíquota de amostra (tubo 4) é necessária para o ensaio VCl3 em HCl se for necessária a medição do nitrato (NO3-). As etapas são indicadas por números em vermelho. Pré-preenchimento (Passo 1) conforme indicado com soro fisiológico tampão de fosfato (PBS) ou HgCl2 antes de adicionar o volume amostral. Adicione o volume amostral (2) conforme indicado, vórtice e incubar por 2 minutos à temperatura ambiente (RT). Adicionar (3) PBS ou sulfanilamida acidificada (AS) conforme indicado,vórtice e incubar por 3 min no RT. Execute o ensaio (4). A concentração medida pelo ensaio é a soma da concentração dos compostos relatados sob cada tubo. O tubo número 1 permitirá medições de nitrito (NO2-), S-nitrosothiols (S-NO) e complexos ferro-nitrosilo (Fe-NOs) como um único sinal. Para a medição do nitrato (NO3-), as amostras devem ser executadas com i3- em ácido acético e VCl3 em ensaios de HCl, e o valor obtido a partir do tubo 1 deve ser subtraído do obtido do tubo 4. *Quantidades sugeridas a serem utilizadas para análise de Hb para determinação de resíduos NO2-, S-nitrosohemoglobina e ferro-nitrosibina-hemoglobina. Clique aqui para ver uma versão maior desta figura.
Para a medição Nº3, o cloreto de vanádio (III) (VCl3) em ácido clorídrico (HCl) é usado para conversão de NO3- a NO no vaso de purga, a fim de medir o nº3- estequiometricalmente com o CLD:
2 NO3-+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Para conseguir uma conversão suficientemente rápida, a reação precisa ser realizada a 90-95 °C. A redução de NO3- para NO2- é associada à redução de NO2- para NO por HCl. O metal vanadium também reduz os S-NOs liberando seu NO moiety22,36. A concentração final obtida pelo CLD com VCl3 em HCl reflete a concentração agregada de NO3-, NO2 e outros compostos nitrosados. A subtração do último valor da concentração rendeda com CLD com I3- permite o cálculo de Nº3- concentração36,37 (Figura 3).
No ensaio de consumo NO, a liberação contínua de NÃO no recipiente de purga por NENHUM doador como (Z)-1-[2-(2-aminoetil)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolato (DETA-NONOato) gera um sinal estável permitindo quantificar oxiHb sem células nas amostras injetadas. A quantidade de NÃO consumida no vaso de purga está em uma relação estequiométrica com a quantidade de oxicodona na amostra38.
Protocolos para medição de NO2-, NO3-, S-nitrosothiols, complexos ferro-nitrosilo e NO consumo por Hb livre de células em amostras de plasma são ilustrados. Estudos sobre NÃO no ambiente RBC requerem tratamento amostral específico seguido de cromatografia de exclusão para medir s-no-hb e hb-no extremamente frágeis, juntamente com a determinação da concentração total de Hb15,22. A preparação da amostra é fundamental na correção da medição. A pré-existência do NO2- em H2O e liberação do Nº2- durante o ensaio pode levar à medição de concentrações artificialmente maiores de nenhum derivado, como o S-NO-Hb14,39. Aspectos importantes da preparação da amostra também são apresentados.
Protocolo
Os procedimentos indicados neste protocolo estão de acordo com o conselho de revisão do Hospital Geral de Massachusetts. As amostras de sangue utilizadas foram coletadas durante um estudo anterior e foram desidentifidas para a finalidade atual18.
NOTA: Consulte as instruções do fabricante para obter orientações específicas sobre as conexões ideais entre tubos e vidros que constituem o vaso de purga, a lavagem e a manutenção geral. As conexões precisam ser firmes e cuidadosamente feitas para não danificar os vidros. Identifique os componentes do vaso de purga de vidro: linha de entrada de gás, vaso de purga com jaqueta de aquecimento e condensador, armadilha de bolha de gás de hidróxido de sódio (NaOH), linha de conexão entre o vaso de purga e o borbulhador, linha de gás de saída de purga (para CLD) dotada de um filtro dieletrico de campo intenso (IFD). Uma linha de filtro IFD entre o vaso de purga e a entrada amostral do CLD deve estar no lugar toda vez que não metabólitos em forma líquida (plasma, culturas celulares, homogeneizadores teciduais) (todos os ensaios apresentados no protocolo). A preparação da amostra depende do fluido ou tecido analisado e dos compostos de interesse. Aspectos importantes da fase pré-analítica são abordados nas seções 1 e 2. As etapas específicas de preparação para ensaios específicos estão incluídas nas seções 3-5. As seções 6-8 aplicam-se a todos os ensaios.
1. Preparação de reagentes dedicados
NOTA: Para mais detalhes, consulte as publicações anteriores15,22.
- Prepare 5% (290 mM) solução de sulfanilamida acidificada (AS) para remoção nº2, dissolvendo 500 mg de sulfanilamida em 10 mL de 1N HCl. Esta solução está estável há meses.
- Prepare a solução de cloreto mercurico de 50 mM (HgCl2) para o NO2- liberação de S-NOs dissolvendo 67,9 mgs de HgCl2 em 5 mL de PBS. Proteja a solução de estoque da luz.
- Prepare a solução de bloqueio NO 2 com ferricyanida de 800 mM [K3Fe(CN)6] para oxidar hb juntamente com 100 mM N-ethylmaleimida (NEM) para bloquear grupos de tiol e (OPCIONAL) solução glicol não-fenil-polietileno (Nonidet p-40) para solubilizar membranas celulares vermelhas.
- Adicione K3Fe(CN)6 à água desionizada e destilada (ddH2O, 263,5 g de pó por litro) para obter uma concentração final de 800 mM.
- Adicione NEM aos 800 mM K3Fe(CN)6 na solução ddH2O (12,5 g de pó por litro para ter concentração de 100 mM) e misture a solução para dissolver todos os cristais.
- Adicione uma parte de 10% NP-40 a nove partes da solução NEM K3Fe(CN) 6 100 mM NEM (111 mL por litro) e misture bem (passo obrigatório para análise de sangue integral).
- Prepare a solução de estabilização S-NO-Hb contendo 12 mM K3Fe(CN)6, 10 mM NEM, 100 μM de ácido dietilenetriaminepentaactic (DTPA, para quelação metálica) e 1% de detergente nãoidet p-40 de suas soluções de estoque.
- Prepare uma solução NEM de 200 mM adicionando cristais NEM ao PBS (25 mg/mL, por exemplo, 250 mgs em PBS de 10 mL) e misture a solução até que todos os cristais sejam dissolvidos (a ser feito no dia do experimento).
- Prepare uma solução de 800 mM K3Fe(CN)6 adicionando K3Fe(CN)6 a ddH2O (263,5 mg/mL, por exemplo, 1,32 g em 5 mL de ddH2O para obter concentração final de 800 mM) (a ser feita no dia do experimento).
- Prepare uma solução de estoque DTPA de 10 mM adicionando 786 mg de DTPA a 200 mL de ddH2O e ajuste pH para 7.0 com 5N NaOH para solubilizar totalmente o DTPA.
- Adicione 5 mL de solução NEM de 200 mM, 1,5 mL de solução 800 mM K3Fe(CN)6 e 1 mL de solução de estoque DTPA para 81,5 mL de PBS a 7,2 pH e, finalmente, adicione 11 mL de 10% NP-40 finalmente para trazer volume final a 7,2 mL.
2. Coleta de amostras
NOTA: Para obter mais detalhes sobre a coleta de amostras, consulte as obras publicadas anteriormente 15,22,40.
- Coletar sangue inteiro
- Coletar sangue em tubos revestidos de heparina preferindo venoso sobre vaso arterial (a menos que especificamente necessário) e preferindo a colocação do cateter em vez de venipuntura (se possível) com cateter ou furo de agulha de pelo menos 20 G ou maior para minimizar a hemólise.
- Adicione imediatamente a solução de bloqueio NO 2 (1 parte da solução para 4 partes de sangue inteiro), processe (seções 3 ou 4) ou congele e armazene a -80 °C.
- Coletar plasma e glóbulos vermelhos (RBCs)
- Coletar sangue em tubos revestidos de heparina que preferem sangue venoso em vez de sangue arterial (a menos que especificamente necessário) e agulhas de pelo menos 20 G ou maiores para minimizar a hemolise e centrífuga imediatamente por 5 min a 4000 x g a 4 °C.
- Misture o supernatante (plasma) com a solução de bloqueio NO 2 (1 parte da solução para 4 partes do supernatante) em um novo tubo e processo (seções 3 ou 4), ou congele e armazene a -80 °C.
NOTA: Para o ensaio de não consumo, a solução de bloqueio NO 2 não pode ser utilizada. O ensaio pode ser realizado sem pré-tratamento de plasma. - Resuspende a pelota RBC de baixo para um novo tubo pré-preenchido com solução de estabilização S-NO (ver passo 1.4) (1 mL de pelota a 9 mL de solução) e incubar por 5 min.
- Passe o lise RBC em uma coluna de dimensionamento com polímero sephadex G-25 que foi previamente enxaguado com ddH2O para cromatografia de exclusão
- Colete a fração hb para processar (seção 4) e para medir a concentração de Hb usando o reagente de Drabkin (para medição de Hb, consulte o trabalho publicado anteriormente22).
NOTA: Para preparar e provar um tecido/órgão específico, identifique seu hilum e isole-o cirurgicamente. Incisar a veia, perfurar a artéria e injetar soro fisiológico heparinizado (10 U/mL) através da artéria. Extirpara o tecido quando a solução salina começar a retrofluir na incisão venosa. Homogeneize o tecido com um homogeneizador mecânico ao adicionar 1 parte da solução de bloqueio NO 2 a 4 partes do tecido homogeneizado.
3. VCl3 na preparação do ensaio HCl
NOTA: Para obter mais detalhes sobre a preparação do ensaio de VCl3 no HCl, consulte os trabalhos publicados anteriormente37,41.
ATENÇÃO: O CLD será danificado se a armadilha NaOH não estiver corretamente no lugar ao realizar este ensaio. Isso é devido à corrosão do HCL.
- Prepare soluções padrão de NO3- para curva padrão
- Dissolver 85 mg de NaNO3 em 10 mL de ddH2O para obter 0,1 M NaNO3- (esta solução permanece estável por algumas semanas).
- Use a solução de estoque para preparar padrões por diluição em ddH2O para obter concentrações de 5 μM, 10 μM, 20 μM, 40 μM, 80 μM, 200 μM NaNO3 para realizar uma curva de calibração para amostras de plasma ou urina (use concentrações mais baixas se trabalhar com culturas celulares).
- Prepare a solução saturada VCl3 (cloreto de vanádio) para a redução no3º no vaso de purga
ATENÇÃO: A reação da água e do VCl3 é exotérmica. Preste atenção à alta temperatura do vidro ao adicionar ácido e ao enxaguar os vidros no final do experimento.- Dissolva 1,6 g de VCl3 em 200 mL de 1 M HCl adicionando primeiro VCl3 em um frasco limpo e adicionando 200 mL de 1 M HCl.
- Filtro de vácuo a solução através de papel filtro (como papel filtro de 11 μm, mas qualquer papel filtro pode ser usado).
NOTA: A solução filtrada deve tornar-se azul claro, enquanto a solução VCl3 não filtrada é marrom devido a partículas não resolvidas. - Mantenha a solução saturada coberta com papel alumínio ou fita de politetrafluoroetileno (PTFE), pois o composto é sensível à luz.
- Prepare o banho de água circulante
- Conecte um dispositivo de banho de água circulante à capa de água do vaso de purga. Certifique-se de que as linhas estão secas antes de escorar.
- Inicie o banho de água a 95 °C e verifique a ausência de vazamentos nas linhas de água aplicando toalhas de papel (não adesivas) ao redor das linhas.
- Configure a armadilha do bubbler de gás
- Verifique se a manga PTFE do bolha está no lugar e se ela não está danificada.
- Abra o bolha de gás e injete 15 mL de 1 M NaOH na base do borbulhante.
- Reposicione o bolha de gás e sele firmemente a conexão pressionando a parte inferior em direção ao topo e torcendo ligeiramente as duas partes. A impossibilidade de girar a parte superior do borbulhante sem aplicar força indica um selo correto.
- Conecte a saída do recipiente de purga à entrada da armadilha do borbulhante de gás.
4. I3- na preparação do ensaio de ácido acético
NOTA: Para mais detalhes sobre i3- na preparação do ensaio de ácido acético, consulte os trabalhos publicados anteriormente 15,22,38,41,42.
- Prepare a curva padrão para o NO2-
- Prepare uma solução de estoque dissolvendo 69 mg de nitrito de sódio (NaNO2) em 10 mL de ddH2O para obter solução de 100 mM. Esta solução é estável se armazenada em um recipiente hermético, refrigerado e protegido contra a luz.
- Diluir a solução de estoque em tubo de microcentrifuuge de 1,5 mL pré-preenchido com 900 μL de ddH2O: Adicionar 100 μL da solução de estoque ao primeiro tubo de centrífugas, misturar, rotular e usar 100 μL do tubo para o segundo tubo, em seguida, repetir resultando em 10 mM, 1 mM, em seguida, 100 μM.
- Diluir ainda mais com alíquotas ddH2O para obter 50 μM, 25 μM, 10 μM, 1 μM e 500 nM NaNO2 alíquotas a serem utilizadas na curva de calibração.
- Prepare o i3- em ácido acético para o vaso de purga (pode ser armazenado à temperatura ambiente (RT) por 1 semana)22
- Adicione 2 g de iodeto de potássio (KI) e 1,3 g de iodo (I2) a 40 mL de ddH2O e 140 mL de ácido acético.
- Misture bem mexendo a mistura por pelo menos 30 min.
- Prepare as amostras para a determinação diferencial de no2-, S-nitrosothiols (S-NO-Hb, se Hb for coletado) e complexos ferro-nitrosol (Hb-NO se Hb for coletado) (Figura 3)
- Divida cada amostra em 3 alíquotas de 270 μL (900 μL de Hb se medir S-NO-Hb e Hb-NO) em tubos de microcentrifuuge protegidos pela luz, 2 deles pré-preenchidos com 30 μL de 1x PBS (100 μL se medir S-NO-Hb e Hb-NO) e o terceiro tubo com 30 μL de HgCl2 (100 μL se medir S-NO-Hb e Hb-NO), vórtice e incubação em RT por 2 min (Figura 3).
- Adicione 30 μL de 5% de AS à amostra com HgCl2 para medir Fe-NOs, (100 μL para Hb-NO) e para um com PBS adicionado para medir S-NOs e Fe-NOs (100 μL para S-NO-Hb e Hb-NO) e adicionar 30 μL de PBS ao terceiro já pré-preenchido com PBS 1x para medir o NO2-, S-NOs e Fe-NOs (100 μL para resíduos NO2- da coleção Hb, S-NO e Hb-NO). Vórtice e incubação em RT por 3 min (Figura 3).
5. NO consumo por configuração hb sem células
NOTA: Para mais detalhes, consulte o trabalho publicado anteriormente38.
- Prepare soluções padrão de oxiHb a partir de uma solução Hb de estoque purificado com uma concentração conhecida
- Diluir a solução de estoque em tubos de microcentrífugo de 1,5 mL por adição de ddH2O para obter as soluções que serão utilizadas para a curva de calibração: 62 μM, 50 μM, 25 μM, 12,5 μM, 6,25 μM, 3,125 μM, 1,56 μM.
- Prepare a solução DETA-NONOate
- Adicione 10 mg de DETA-NONOate a 610 μL de 10 μM NaOH em pH 7.4 PBS para gerar 100 mM de DETA-NONOate e mantê-lo no gelo.
6. Inicie o detector de quimiluminescência (CLD) e prepare o vaso de purga
NOTA: Para a preparação do vaso de purga, consulte o trabalho publicado anteriormente43.
- Verifique as principais conexões de e para o CLD
- Conecte a linha de oxigênio ao CLD e abra o tanque de oxigênio a uma pressão que esteja de acordo com o fabricante do CLD.
- Certifique-se de que a linha de filtro Dielectric intense field (IFD) esteja conectada ao CLD, mas não ao vaso de purga ou à armadilha NaOH
- Inicie o CLD
- Na interface CLD, comece a executar o programa de detecção para ensaios de fase líquida.
- Verifique se o suprimento de oxigênio é adequado. Se este for o caso, o CLD começará com sucesso a amostragem a partir de sua entrada e indicará a detecção por um sinal em milivolts (0-5 mV). Caso contrário, o CLD solicitará um sinal de diagnóstico negativo.
- Prepare o vaso de purga
- Feche o recipiente de purga nas três portas: enrosque totalmente a válvula da agulha à direita, feche as torneiras de entrada e saída.
- Remova a tampa do vaso de purga e adicione uma quantidade suficiente do reagente específico ao ensaio planejado à câmara de reação (Tabela 1) para que a agulha de seringa usada para injetar as amostras possa atingir a coluna de fluido.
- Verifique a presença de uma linha de base estável desejada (Tabela 1).
- Inicie o fluxo de gás de purga
- Certifique-se de que o tanque de gás inerte (por exemplo, N2) esteja equipado com um regulador de dois estágios e conecte o tanque de gás inerte com a entrada de gás do navio.
- Abra o gás com uma pressão de saída no regulador de 1-5 psi, abra a entrada do vaso de purga e abra lentamente a válvula de agulha do vaso de purga para permitir a entrada de gás. Verifique borbulhar dentro do vaso de purga.
- Ajuste o fluxo de gás
- Registre a pressão celular medida pelo CLD com a linha de filtro IFD amostrando ar ambiente.
- Reposicione a tampa no vaso de purga, conecte a linha do filtro IFD ao vaso de purga (ou à armadilha NaOH no ensaio VCl3 em HCl) e abra a saída do vaso de purga.
- Use a válvula da agulha para atingir a mesma pressão celular no nível cld que é registrado no ar ambiente.
7. Experimento
NOTA: Para obter mais detalhes sobre o experimento, consulte o trabalho publicado anteriormente43.
- Inicie o programa de aquisição de sinal de chemiluminescence
- Conecte a porta serial do CLD à porta serial do computador na qual o programa de aquisição foi instalado.
- Execute o programa de análise.
- Clique em Adquirir, selecione a pasta para salvar o arquivo .data, digite o nome do arquivo e clique em Salvar.
NOTA: Observe o tempo de execução predefinido na tela, pois a gravação pára automaticamente quando o tempo predefinido decorre. Se necessário, o tempo de execução predefinido pode ser aumentado.
- Prepare-se para repetidas injeções de amostra
- Ajuste a escala de tensão na tela para ter controle sobre a linha de base direcionada clicando nos botões Mínimo e/ou Máximo e, em seguida, digitando o valor desejado.
- Tenha um tubo de 20 ou 50 mL preenchido com ddH2O para enxaguar a seringa entre as amostras.
- Tenha uma caixa de limpezas de tarefas delicadas prontamente disponíveis.
- Injeção de amostra
NOTA: Comece a partir das soluções padrão para a curva de calibração (injetar das amostras menos concentradas para as mais concentradas), em seguida, proceda às amostras de experimento (considere fazê-lo em duplicatas ou triplicados).- Enxágüe a seringa pelo menos duas ou mais vezes com ddH2O antes de retirar cada amostra (e após cada injeção) e verifique cada vez que a ejeção de água desobstruída em uma limpeza de tarefa.
- Insira a seringa no tubo de amostra enquanto segura a seringa e o tubo a uma distância próxima, puxe o êmbolo para o volume desejado, garantindo que nenhuma bolha de ar e/ou partes sólidas não homogeneizadas fiquem presas.
- Limpe a ponta da seringa com um limpador de tarefas, depois insira a seringa na tampa de septa na porta de injeção e injete depois de verificar se a ponta da seringa está dentro da fase líquida na câmara de reação.
- Marque a injeção no programa de software e espere
- Verifique se a injeção causa uma mudança para cima no sinal (Figura Suplementar 1) (para baixo no consumo NO por ensaio hb livre de células) e digite o nome da amostra clicando na caixa cinza em Nomes de Amostra, em seguida, clique em Mark Injection.
NOTA: Obstrução da seringa suspeita se a injeção de amostra não gerar um sinal. - Aguarde o sinal elétrico para chegar novamente à linha de base (isso geralmente leva de 3 a 4 minutos). Este tempo pode ser usado para realizar a etapa 7.3.1.
- Verifique se a injeção causa uma mudança para cima no sinal (Figura Suplementar 1) (para baixo no consumo NO por ensaio hb livre de células) e digite o nome da amostra clicando na caixa cinza em Nomes de Amostra, em seguida, clique em Mark Injection.
- Repita todas as etapas indicadas nas etapas 7.3 e 7.4 durante e após cada injeção até o final do experimento. Lembre-se de executar uma amostra da solução de preservação (se usado)
- Pare o experimento
- Clique em STOP para interromper a aquisição do sinal, pare o CLD e desligue o banho de água (se o NO3- for medido).
- Interrompa o fluxo de gás, abra a válvula da agulha, remova a tampa do recipiente de purga, coloque um recipiente de lixo sob o ralo e abra a torneira de drenagem.
NOTA: Se o experimento exigir aquisição de dados por mais de 60 minutos, é necessário reiniciar a aquisição após 60 minutos de tempo de execução (repetir a etapa 7.1.3) e fazer um novo arquivo.
8. Medições e cálculos
NOTA: As medições e os cálculos são feitos offline e podem ser realizados em um momento diferente.
- Inicie o programa de aquisição de chemiluminescence para análise de dados offline
- Inicie o programa e clique em Process.
- Selecione o arquivo de experimento e clique em Abrir.
- Calcule a área sob a curva para cada administração
- O softwaregrafa automaticamente na tela a linha de base (Figura Suplementar 2A, linha amarela horizontal) e o eixo máximo de cada onda gerada por cada administração de amostra (linhas amarelas verticais): verificar sua posição correta (ou ajustar clicando em cada linha e movendo-a com o mouse ou as setas) e clique em Threshold OK (Figura Suplementar 2B).
NOTA: No ensaio de medição de HB sem células, o software normalmente não consegue capturar corretamente a forma de onda gerada pela injeção de amostra. Ao ampliar cada forma de onda, o operador pode facilmente auxiliar o software no cálculo da área (Figura Suplementar 2). - O softwaregrafa automaticamente o início (linha verde vertical) e a extremidade (linha vermelha vertical) de cada pico causado por cada administração de amostra: verifique sua posição correta (ou ajuste clicando em cada linha e movendo-a com o mouse ou as setas) e clique em Integrar (Figura Suplementar 2C).
NOTA: Algumas áreas do rastreamento podem ser equivocadamente definidas como injeções neste momento, e alguns picos podem ser contados automaticamente duas vezes. Ambos os erros podem ser reidentifiquem e removidos durante a etapa 8.2.2 - O software corresponde automaticamente a cada área de sinal após uma injeção marcada durante o experimento e seu nome atribuído: navegue por cada pico (indicado por uma linha vertical amarela) com o nome atribuído clicando no Next Peak e no Anterior Peak, em seguida, clique no botão Tudo OK para finalmente obter o cálculo para todas as áreas na tela.
- Para corrigir todos os erros de nomeação ou correspondência cometidos pelo usuário ou pelo programa, use conforme necessário os botões indicados no Arquivo Suplementar 1.
- O softwaregrafa automaticamente na tela a linha de base (Figura Suplementar 2A, linha amarela horizontal) e o eixo máximo de cada onda gerada por cada administração de amostra (linhas amarelas verticais): verificar sua posição correta (ou ajustar clicando em cada linha e movendo-a com o mouse ou as setas) e clique em Threshold OK (Figura Suplementar 2B).
- Transfira os valores da curva de calibração para uma planilha e gere uma equação de regressão linear (Figura Suplementar 3)
- Transfira os dados do programa CLD para uma nova planilha através de pasta de cópia. Organize as duas colunas na folha de dados como Concentração de Amostra e Área Sob a Curva, e adicione um valor combinado de zero em ambas as colunas.
- Selecione as duas colunas, clique em Inserir > Dispersão e, em seguida, no menu Chart Design , selecione Adicionar elemento gráfico > linha de tendência > Linear.
- Clique com o botão direito do mouse na linha de tendência gerada, clique em Format Trendline e clique nas opções Exibir Equações no Gráfico e Exibir valor R-quadrado no gráfico no menu Format Trendline para obter uma simples equação de calibração linear.
- Transfira a área calculada de cada amostra para calcular sua concentração (Figura Suplementar 3)
- Informe todos os valores da planilha. Na coluna seguinte, aplique a equação obtida a partir da etapa 8.3.3 para obter a concentração de cada amostra injetada, onde y é a concentração (valor da nova coluna) e x é a área sob a curva medida após a injeção.
NOTA: Lembre-se de levar em conta a concentração medida na solução de preservação (se utilizada) e subtrair os valores em conformidade.
- Informe todos os valores da planilha. Na coluna seguinte, aplique a equação obtida a partir da etapa 8.3.3 para obter a concentração de cada amostra injetada, onde y é a concentração (valor da nova coluna) e x é a área sob a curva medida após a injeção.
Resultados
O ensaio de Não-consumo por Hb livre de células foi utilizado em amostras contendo concentrações conhecidas de oxicodona livre de células (Figura 4). Como um heme de oxyHb stoichiometricamente libera uma molécula NO no ensaio, o oxyHb purificado sem células é usado para construir a curva de calibração para o ensaio (Figura Suplementar 3).
A relação dose-resposta entre hb livre de células (medida com um assiiz colorimétrico) e NO cons...
Discussão
Devido à alta sensibilidade, ensaios baseados em chemiluminescência para a determinação de NO e compostos relacionados têm alto risco de contaminação nº2. Cada reagente (especialmente a solução de bloqueio NO 2) e dilutante (incluindo ddH2O) usado no experimento devem ser testados para seu conteúdo NO 2 para corrigir o sinal de fundo. O nitrito é extremamente reativo com meia-vida em sangue inteiro em torno de 10 minutos e rapidament...
Divulgações
L.B. recebe apoio salarial da K23 HL128882/NHLBI NIH como principal investigador por seu trabalho em hemólise e óxido nítrico. A LB recebe bolsas de "Bolsas Rápidas para pesquisa COVID-19" no Mercatus Center da Universidade George Mason e na iNO Therapeutics LLC. A B.Y. é apoiada por subsídios de uma NHLBI/#R21HL130956 e do DOD/The Geneva Foundation (W81XWH-19-S-CCC1, Log DM190244). B.Y. recebeu patentes na MGH sobre a geração elétrica de óxido nítrico.
L.B. e B.Y. registraram pedido de patente para não entrega no número de solicitação pct da doença COVID-19: PCT/US2021/036269 arquivado em 7 de junho de 2021. A RWC recebe apoio salarial da Unitaid como principal pesquisadora para o desenvolvimento tecnológico voltada para o diagnóstico descentralizado da tuberculose em crianças localizadas em ambientes de baixo recurso.
Agradecimentos
Os protocolos relatados neste manuscrito foram possíveis pelas contribuições acumuladas de bolsistas anteriores do laboratório de Pesquisa de Anestesia em Cuidados Críticos do Dr. Warren Zapol. Reconhecemos a contribuição dos Drs. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli e Emanuele Rezoagli.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Sigma | 45754 | 500 mL - liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL - liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL - liquid |
| Iodine | SAFC | 207772 | 100 g - solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g - solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g - crystalline |
| Nitric Oxide Analyzer + Bundle Software - Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% - 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g - powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g - solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g - crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump - Bundled with analyzer |
| Sodium Heparin - BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg - pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g - powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g - crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g - solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g - solid - Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Referências
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3':5'-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados