Method Article
刺激和分析 果蝇 中枢脑中的成人神经发生
摘要
本文提供了对成年 果蝇 造成穿透性创伤性脑损伤(PTBI)的详细方案,并检查由此产生的神经发生。
摘要
对疾病或损伤作出反应的神经发生的分子和细胞机制尚不清楚。然而,了解这些机制对于开发神经再生疗法至关重要。 果蝇黑色素胃 是神经发育研究的领先模型,但历史上尚未被用来研究成人大脑再生。这主要是因为成人大脑表现出非常低的有丝分裂活动。尽管如此,对成年 果蝇 中枢脑的穿透性创伤性脑损伤(PTBI)会触发新神经元和新神经胶质细胞的产生。 果蝇 中可用的强大遗传工具与这里描述的简单但严格的损伤方案相结合,现在使成年 果蝇 大脑成为神经再生研究的强大模型。此处提供了(1)成人中枢脑穿透伤和(2)解剖,免疫组化和损伤后成像的详细说明。这些方案产生高度可重复的结果,并将促进额外的研究,以剖析神经再生背后的机制。
引言
大脑和神经系统的损害是全世界死亡和残疾的主要原因。每年约有 150 万美国人遭受创伤性脑损伤 (TBI)1,而仅在美国,估计就有 600 万人患有神经退行性疾病,如帕金森病和阿尔茨海默病2。疾病和大脑损伤都可能导致神经变性,导致感觉、认知和运动缺陷3。由于大脑复杂的生理学,开发人脑修复的治疗策略一直很困难。黑 腹果蝇 等模式生物为识别神经变性的基本机制和潜在的治疗靶点4提供了一个简单的系统。
一个多世纪以来,果蝇 果蝇黑腹果 蝇一直是一种强大的模式生物,推动了遗传学、发育生物学和神经科学领域的发展5,6。 果蝇 大脑仅包含约 90,000 个神经元7,比普通人类大脑少 100 万倍8,但它们有许多相似之处。人类和苍蝇的大脑都利用神经递质GABA,谷氨酸,乙酰胆碱以及生物胺多巴胺和血清素9。 果蝇 和人类神经元的功能也类似,具有共享的突触结构和相似的神经细胞类型10。 果蝇 较小的大脑尺寸和先进遗传学技术的可用性,结合 果蝇 和哺乳动物之间分子,细胞和生理机制的保守,使 果蝇 研究人员能够提出在哺乳动物模型中不切实际或难以回答的问题。
我们目前对 果蝇成人神经发生的理解,无论是在体内平衡期间还是在损伤后,仍然有限。关于正常发育过程中的神经发生,人们已经知道更多。例如,神经元和神经胶质细胞是在前体细胞发育过程中产生的,称为神经母细胞10,11。至少有三种不同类型的神经母细胞在中枢脑中被区分出来。I型和II型谱系神经母细胞在蛹形成后约20-30小时退出细胞周期12。相比之下,蘑菇体神经母细胞是最后终止细胞分裂的,并且在蛹形成后约85-90小时 通过 收割者依赖性凋亡来终止细胞分裂13。在闭合后,成年 果蝇 大脑的分裂细胞很少(~1个细胞/脑),主要是神经胶质细胞14。成体视叶具有能够进行神经发生的缓慢循环的神经母细胞15,而成年中枢脑则没有已知的神经母细胞。神经祖细胞的稀缺性和有限的细胞增殖与成年哺乳动物大脑的情况非常相似,突显了 果蝇 中成虫神经发生机制对人类的潜在相关性。
在损伤后发现成年 果蝇 视叶中成人神经发生水平低15 ,导致成人 果蝇 中枢脑也可能能够进行成人神经发生16的假设。该协议描述了在成年 果蝇 中创建一个严格的,可重复的中枢脑损伤模型,可用于研究成人中枢脑的神经发生。鉴于人类和 果蝇 大脑结构和功能之间的相似性,这些发现可能导致确定受伤和患病人脑中治疗性神经发生的关键靶标。
研究方案
该协议遵循威斯康星大学麦迪逊分校的动物护理指南。
1. 为PTBI生成成年果蝇
- 对于标准十字架,放置20处女y[1] w[1];UAS-mCD8-GFP;;OK107-GAL417成年雌性和10年[1] w[1]17成年雄性苍蝇一起装在装有食物的小瓶(见材料表)中。要有大量同步后代,请同时设置10-20个杂交。标准杂交产生基因型的F1后代:y[1] w[1];UAS-mCD8-GFP/+;;OK107-GAL4/+.
- 将小瓶置于25°C进行交配和产卵。为了最大化后代,每2-4天将亲本转移到新的小瓶中,将早期的小瓶保持在25°C。 在父母首次放入其中18天后丢弃每个小瓶,以确保没有F2后代。
注意:每组亲本可以产生3组后代("育雏")。 - 检查后约10天,当F1后代将开始关闭时。
- 将小瓶置于25°C进行交配和产卵。为了最大化后代,每2-4天将亲本转移到新的小瓶中,将早期的小瓶保持在25°C。 在父母首次放入其中18天后丢弃每个小瓶,以确保没有F2后代。
- 对于谱系研究,使用基因型的F1永久双胞胎雄性15:w;FRT40A, UAS-CD2-RFP, UAS-GFP-Mir/FRT40A, UAS-CD8-GFP, UAS-CD2-Mir;tub-GAL80ts/act-GAL4 UAS-flp.为了保持一致性,每次都朝同一方向交叉。
- 要产生永久双胞胎雄性,放置20处女w;FRT40A, UAS-CD2-RFP, UAS-GFP-Mir;浴缸-GAL80ts/TM6B母头和10瓦;FRT40A, UAS-CD8-GFP, UAS-CD2-Mir;act-GAL4 UAS-flp/TM6B15 成年雄性一起装在装有食物的小瓶中。
- 将小瓶置于17°C进行交配和产卵。每7天将父母转移到新食物的小瓶中,将所有小瓶保持在17°C。 在父母首次放入其中35天后丢弃每个小瓶,以确保没有F2后代。
- 大约21天后检查,当F1后代将开始关闭时。
2.穿透性创伤性脑损伤(PTBI; 图 1)
- 对新关闭的 F1 苍蝇进行分类。在闭合后6小时内选择年轻雄性。将这些雄性放在装有食物的干净小瓶中,每瓶有40只或更少的苍蝇。
注意:这最容易在上午中午完成,方法是麻醉CO2 垫上的苍蝇,并识别内脏中仍然有胎粪(通过腹壁可见为深绿色斑点)的成年雄性。 - 如果计划用EdU标记分裂细胞,则在损伤前用5-乙炔基-2'-脱氧尿苷(EdU)预喂6小时(见 材料表)。有关详细信息,请参阅步骤 3。
- 通过将约100个针放入装有70%乙醇的1.5mL微量离心管中,对细针(见 材料表)进行至少5分钟的消毒。
- 通过喷洒70%乙醇对CO2 垫和画笔进行消毒,并用干净的无绒纸巾擦干。工具清洁干燥后,将40名或更少的F1男性转移回干净的垫子上。
- 在飞行垫上将F1雄性分成2组。一组将作为对照,未受伤的苍蝇。第二个实验组将接受PTBI。
- 使用镊子,从微量离心管中拉出4-5个新的Minutien销,并将它们放置在CO2 垫的边缘附近。在解剖范围下,选择一个具有尖锐尖端的直小针。
注意:在实验中使用单个 Minutien 引脚将降低变异性。重复使用锋利的针脚。将损坏或钝的销放在单独的1.5 mL微量离心管中,其中含有70%乙醇,以便安全处置。 - 如果处理来自标准十字架的苍蝇,请打开体视显微镜发光二极管(LED)灯,该灯配有适当的绿色荧光蛋白(GFP)激发和发射滤光片。这允许在440-460 nM下激发,并允许500-560 nM的可视化。
注意:使用此灯和过滤器设置,蘑菇体的细胞体将通过头部角质层发出绿色荧光(图1C)。对于永久双胞胎苍蝇或其他基因型的苍蝇,可以使用用于体视显微镜的标准白光照明器来可视化头部角质层上的地标,以靶向蘑菇体的损伤(图1C)。 - 使用镊子拿起并握住选定的Minutien别针(对于右撇子,这通常是右手),另一只手(通常是左手)握画笔。从实验组中选择一只苍蝇,并将苍蝇定位,使您拥有头部胶囊的背侧视图,苍蝇的头部向右。将刷子放在胸背前部,然后轻轻向下推以稳定苍蝇。
- 将细针的尖端对准头部右侧的蘑菇体细胞体,并穿透头部胶囊。如果使用标志性特征,则瞄准眼部和眼睛背缘之间的背头角质层(图1)。
- 完成损伤后,使用画笔将头部轻轻推离Minutien别针。
- 如果将大脑用于RNA-Seq或qRT-PCR,请在头部左侧进行第二次损伤。
- 重复步骤2.8-2.10,使实验组中的所有苍蝇受伤。
- 一旦所有苍蝇都受伤了,将对照和受伤的苍蝇放入装有食物的标记,单独的小瓶中。将小瓶水平放置(即侧面),同时苍蝇从麻醉中恢复,并在随后的老化过程中防止苍蝇被食物捕获。
- 将标准杂交蝇置于25°C,永久双胞胎蝇在30°C下老化。
- 对于年龄超过24小时的苍蝇,每1-2天将它们放在干净的食物上。
3. 电子教育标签
- 在二甲基亚砜(DMSO)中制备10mM 5-乙炔基-2'-脱氧尿苷(EdU)的储备。这可以在-20°C下储存长达12个月。
- 在10%蔗糖中制备200μL50μM EdU。在PTBI之前,用EdU预喂食苍蝇6小时。
- 将200μL50μM EdU放入10%蔗糖中,放在23毫米圆形3级滤纸上(参见 材料表),否则为空小瓶。
- 将苍蝇放入小瓶中。然后用棉塞密封小瓶。
- 将小瓶水平放置在25°C的加湿培养箱中6小时。
- 按照步骤 2.3-2.10 中所述执行 PTBI。
- 将苍蝇放回含有EdU的小瓶中。用棉塞密封小瓶。
- 将小瓶水平放置在25°C的加湿培养箱中长达24小时。请按照下面描述的步骤之一(步骤 3.8.1-3.8.3)操作。
- 如步骤4所述,使用固定剂,洗涤缓冲液和封闭缓冲液(不含叠氮化物)并在抗体染色前进行EdU检测反应来解剖和固定大脑。
- 将苍蝇转移到含有新滤纸和200μL50μM EdU的10%蔗糖的干净小瓶中。将小瓶水平放置到25°C培养箱中。在标记期间每24小时重复一次。然后,按照步骤4中所述,使用不含叠氮化物的缓冲液解剖并固定大脑,并在抗体染色前进行EdU检测反应。
- 为了使用EdU进行脉冲追逐标记,在脉冲期间喂食EdU,每24小时将苍蝇转移到含有新滤纸和200μL50μM的10%蔗糖的清洁小瓶中。在脉搏期(例如,4天)之后,将果蝇转移到含有标准果蝇食物的小瓶中。将小瓶侧放在25°C培养箱中另外3天。然后,按照步骤4中所述,使用不含叠氮化物的缓冲液解剖并固定大脑,并在抗体染色前进行EdU检测反应。
4. 解剖、免疫组化和安装
- 准备1.5 mL微量离心管,其中100μL固定剂:PEM中4%甲醛(100mM哌嗪-N,N'-双(2-乙烷磺酸)[PIPES],1mM EGTA,1mM MgSO4,pH 7.0)(见 材料表)并置于冰上。
注意:在一个管子中可以处理多达20个单一基因型和病症的大脑。 - 准备一个解剖板,其中有一个小池(约100μL)的70%乙醇和三个小的磷酸盐缓冲盐水池(PBS;100 mM的K2HPO4,140mM的NaCl,pH 7.0)。
- 在用70%乙醇消毒的CO2 垫上麻醉约10只对照或实验蝇。
- 用手术刀将头与每只苍蝇的躯干分开。
- 用70%乙醇润湿的画笔收集头部,并将头部在解剖板上的乙醇池中放置2-5分钟。
注意:这会使大脑稍微脱水,使它们更容易从头部角质层上解剖。 - 将头部转移到~100μL的PBS池中并解剖出大脑,将每个大脑移动到干净的~100μLPBS池中。使用两对制表师镊子打开头部角质层的后部,并用一对镊子固定角质层,同时使用第二对镊子的闭合尖端轻轻地将大脑从角质层中撬出。
- 使用P200移液器将解剖的大脑转移到含有100μL固定溶液的微量离心管中,该移液器配备了塑料尖端,该塑料尖端已被切割和倾斜以允许进入大脑。
- 在室温下固定20-25分钟。用P200或玻璃移液器小心地卸下固定物。
- 用1毫升"PT"(PBS加0.1%Triton X-100)清洗固定的大脑四次,让大脑在每次洗涤之间安顿几分钟。
注意:如果大脑在洗涤之间没有迅速沉降,它们可能仍然附着脂肪体和/或气管。 - 在室温下将样品置入 1 mL PBS 加 0.1% Triton X-100 和 2% 牛血清白蛋白 (PBT) 中约 1 小时。
- 除去封闭溶液,用100μL一抗溶液在PBT中在4°C下孵育样品过夜。本研究中使用的一抗是兔抗PH3(1:500)和小鼠抗法西克林II(1:20)(见 材料表)。
- 用1 mL PT洗涤样品五次,让大脑在每次洗涤之间沉降几分钟。
- 除去最终洗涤物,在4°C下孵育100μL二抗溶液过夜。 这里使用的二抗是抗兔568(1:400)和抗小鼠Cy5(1:100)(见 材料表)。
- 用1 mL PT洗涤样品五次,让大脑在每次洗涤之间沉降几分钟。在最终洗涤过程中,加入4',6-二氨基-2-苯基吲哚,二盐酸盐(DAPI;100的10μM溶液)10分钟以染色细胞核。取出洗涤液,在每个管中留下50-100μL。
- 通过在每个载玻片的中间放置一个自粘增强标签,并在每个标签的中心放置一个50μL防褪色安装介质液滴来准备显微镜载玻片(见 材料表)。加固标签将盖玻片保持在滑块上方,防止安装的大脑变得过于扁平。
- 使用装有切割和斜面塑料尖端的P200,小心地将大脑从每个微量离心管转移到准备好的载玻片上,尽可能少地使用洗涤缓冲液。一张幻灯片上可以安装多达10个大脑。
- 使用镊子轻轻地重新定位大脑,然后在每张载玻片上放置盖玻片并用指甲油密封载玻片。将大脑的方向从后侧向上或前侧朝上,但不应相互接触。
注意:由于很难通过整个大脑获得高质量的共聚焦图像,因此应在每个方向上安装一些大脑。 - 将准备好的载玻片平放并在4°C的黑暗中储存直至成像。对于长期储存(长达1年),载玻片可以储存在-20°C。
5. 共聚焦成像
注:使用激光扫描共聚焦显微镜的图像大脑,激发激光和发射滤光片立方体适用于DAPI和荧光二抗(即分别为405nm,488nm和568nm,633nm)。
- 打开显微镜、激光器、控制器和计算机的电源。
- 打开采集软件。
- 在采集模式下,最多选择四个通道,并设置所需通道的顺序扫描参数。将每个通道的激光功率增加到5-10%。
- 将载玻片放在显微镜上。
- 选择要使用落射荧光附件成像的大脑(见 材料表)。
- 在采集模式下,选择 1024 x 1024 像素作为帧尺寸。
- 在采集模式下,选择 Z轴堆叠选项,指示Z轴应以2μm部分拍摄,然后聚焦样品,选择要成像的顶部和底部焦平面。
- 使用20倍物镜收集整个大脑的Z-stack图像,并使用60倍物镜收集特定的大脑区域,例如蘑菇体。
6. 数据分析
- 手动和/或使用图像分析软件量化增殖细胞和永久孪生克隆的数量(见 材料表)。使用软件时,选择面积至少为 10 μm 的感兴趣区域 (ROI)。
结果
PTBI刺激细胞增殖
为了确定中枢脑PTBI后神经发生的程度,在闭合后6小时内收集和受伤的年轻成年男性中测量增殖反应。使用抗磷酸组氨酸3(PH3)在损伤后24小时观察到增殖显着增加,这是积极经历有丝分裂的细胞的标志物。在PTBI后24小时观察到对照中枢脑中的约3个PH3 +细胞和受伤的中枢脑中的11个PH3 +细胞(图2A-D)。大多数分裂细胞位于损伤部位附近。细胞分裂的第二种测定用于量化单次损伤的累积细胞增殖,并评估新产生的细胞存活的程度。5-乙炔基-2'-脱氧尿苷(EdU)是一种胸苷类似物,可以掺入新合成的DNA中,并永久标记经过DNA合成的细胞。苍蝇被给予4天的EdU脉冲,然后是3天的追逐。这表明标记的细胞是活的,并且在增殖后至少存活3天。到7天时,对照中枢脑平均有2个EdU +细胞,受伤的中枢脑平均分别有11个EdU +细胞(图2E)。这与使用PH3抗体在受伤后24小时获得的结果相似。当在14天时测量细胞增殖时,未受伤的对照组平均每个中枢脑1个EdU +细胞,而受伤的大脑平均29个EdU +细胞(图2E),表明细胞增殖至少持续到PTBI后的第二周。
细胞增殖是年龄依赖性的
在闭合后的前24小时内观察到中枢脑中最大的增殖反应(图3)。到闭合后7天,穿透性损伤仍然导致增殖显着增加,平均每个中枢脑有6个PH3 +细胞。尽管如此,到闭合后14天,细胞在PTBI后分裂的能力显着降低到1个分裂细胞,类似于对照脑(图3)。因此,PTBI后细胞增殖的潜力是年龄依赖性的。
新创建的神经元可以投射以校正目标区域
为了评估PTBI后的神经再生,使用了永久双胞胎标记系统15。永久孪生谱系追踪用绿色荧光蛋白(GFP)或红色荧光蛋白(RFP)永久标记分裂细胞及其后代15。在2天和2周时,在受伤的样本中检测到的永久双胞胎克隆比对照组更多(图4A-E)。值得注意的是,在受伤后2周,约50%的PTBI大脑中存在新的蘑菇体神经元(图4N)。这些新的神经元将其树突适当地投射到蘑菇体花萼上,并将轴突适当地投射到蘑菇体裂片上(图4D,F,G)。这表明新产生的细胞可能是参与修复受损蘑菇体的功能神经元。大脑中似乎再生的其他区域包括椭球体(EB)(图4H,I),触角叶(AL)(图4J,K)和侧角(LH)(图4L,M),它们分别拥有大约26%,26%和20%的大克隆(图4N)。这些结果强调了该系统在研究成人神经发生方面的效用。图5显示了PTBI之后的事件序列并导致新神经元生成的建议模型。
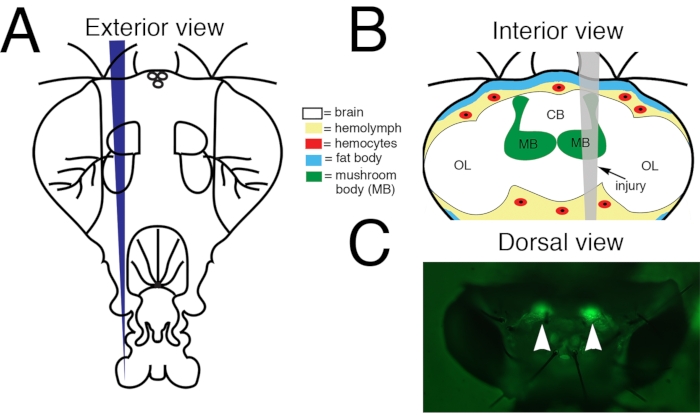
图1:成人 果蝇 中枢脑的穿透性创伤性脑损伤(PTBI)。 (A)成年蝇头的外部示意图。这是正面视图。因此,动物的右侧是观看者的左侧。(B)成年 果蝇 头部的内部示意图,损伤轨迹以灰色表示。这是一个后视图。因此,在这张照片和随后的图中,大脑的右侧是右侧。中枢脑PTBI影响多种大脑结构,包括蘑菇体(绿色)和脑外组织,包括脂肪体(蓝色)和血细胞(红色)。CB = 中枢脑区域。OL = 视叶区域。(C)活体成年头部的背视图,其中蘑菇体(箭头)标有绿色荧光蛋白(GFP)。这是"标准基因型"(有关详细信息,请参阅文本)。PTBI方案可重复地导致蘑菇体损伤。此 图改编自 参考文献 16。 请点击此处查看此图的放大版本。
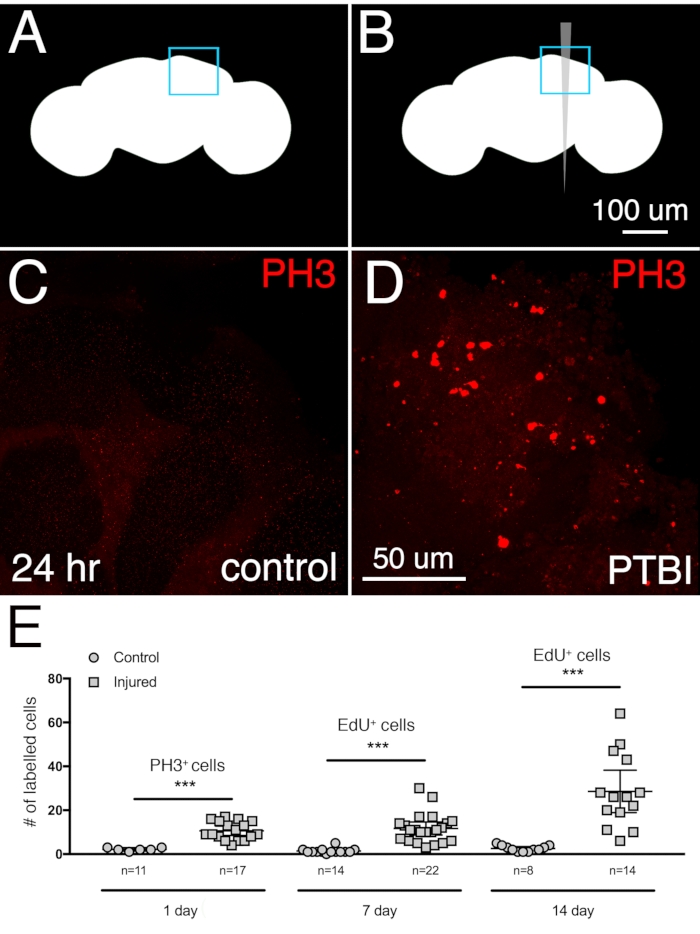
图2:PTBI刺激细胞增殖。 未受伤的对照(A)和PTBI(B)原理图。右上角的蓝色方框表示在面板(C)和(D)中以较高放大倍率显示的大脑区域。(C,D)使用PH3抗体(红色)测定损伤后24 h的细胞增殖。在对照脑(C)中,PH3 +细胞很少,MB附近也没有。然而,在PTBI大脑(D)中,MB附近有PH3 +细胞。(E)增殖细胞的定量。这些数字反映了整个大脑中的增殖细胞,而不仅仅是在蘑菇体附近。在24小时,未受伤的对照脑平均有3个PH3 +细胞/脑(n = 11个脑,28个细胞),而PTBI后24小时,大脑平均有11个PH3 +细胞/脑(n = 17个脑,181个细胞)。在7天时,未受伤的对照组只有很少的EdU +细胞,平均为2个EdU +细胞/脑(n = 15个大脑,24个细胞),而7天后PTBI的大脑平均有11个EdU +细胞/脑(n = 22个大脑,238个细胞)。在14天时,未受伤的对照组平均有1个EdU +细胞/脑(n = 8个大脑,11个细胞),而14天后PTBI的大脑平均有29个EdU +细胞/脑(n = 14个大脑,400个细胞)。对于这组实验,使用在闭合后6小时内的年轻成年男性。对照和PTBI样品在3个时间点的不成对t检验分别产生p<0.0001,p<0.0001和p<0.0002。误差线反映标准偏差 (SD)。此 图改编自 参考文献 16。 请点击此处查看此图的放大版本。
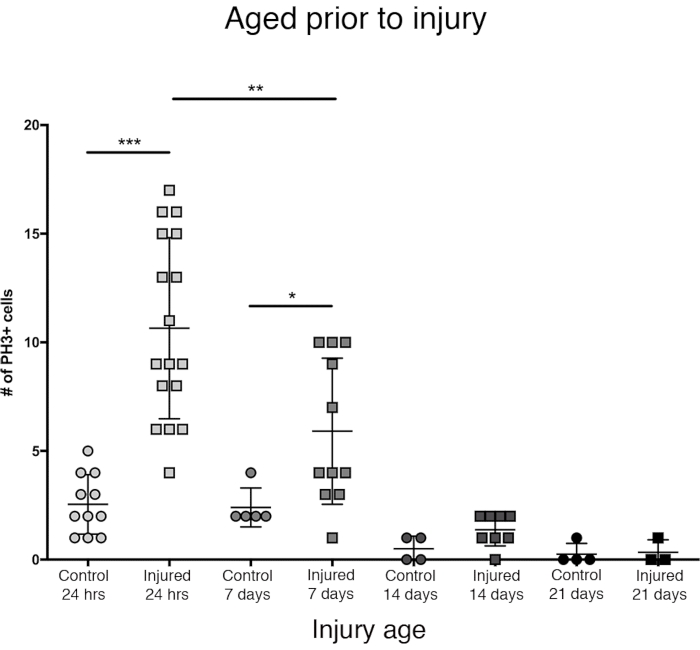
图 3:对 PTBI 的增殖反应随着年龄的增长而降低。 为了探索年龄是否影响损伤后发生的细胞增殖量,将新近闭合的成年雄性与PTBI前7天,14天和28天的动物进行比较,使用抗PH3测定损伤后24小时的细胞增殖。在闭合后6小时内受伤的苍蝇平均有11个PH3 +细胞/脑(n = 17个大脑,182个细胞),而在年龄匹配的对照组(n = 11个大脑,28个细胞)中平均有3个PH3 +细胞/脑。年龄至7天的苍蝇,然后接受PTBI,平均具有6个PH3 +细胞/脑(n = 11个大脑,65个细胞),而年龄匹配的对照组平均为2个PH3 +细胞/脑(n = 5个大脑,12个细胞)。当苍蝇在PTBI之前老化至14天并在24小时后测定时,平均有1个PH3 +细胞/脑(n = 8个大脑,11个细胞)与年龄匹配的对照组相似,其平均值也为1个PH3 +细胞/脑(n = 4个大脑,2个细胞)。28天未受伤的对照(n = 4,1个细胞)和PTBI(n = 3,1个细胞)的苍蝇平均为0 PH3 +细胞/脑。用于控制这些 4 个时间点比较的 PTBI 的不成对 t 检验分别为 p<0.0001、p<0.04、p<0.07 和 p<0.84。此图改编自参考文献 16。 请点击此处查看此图的放大版本。
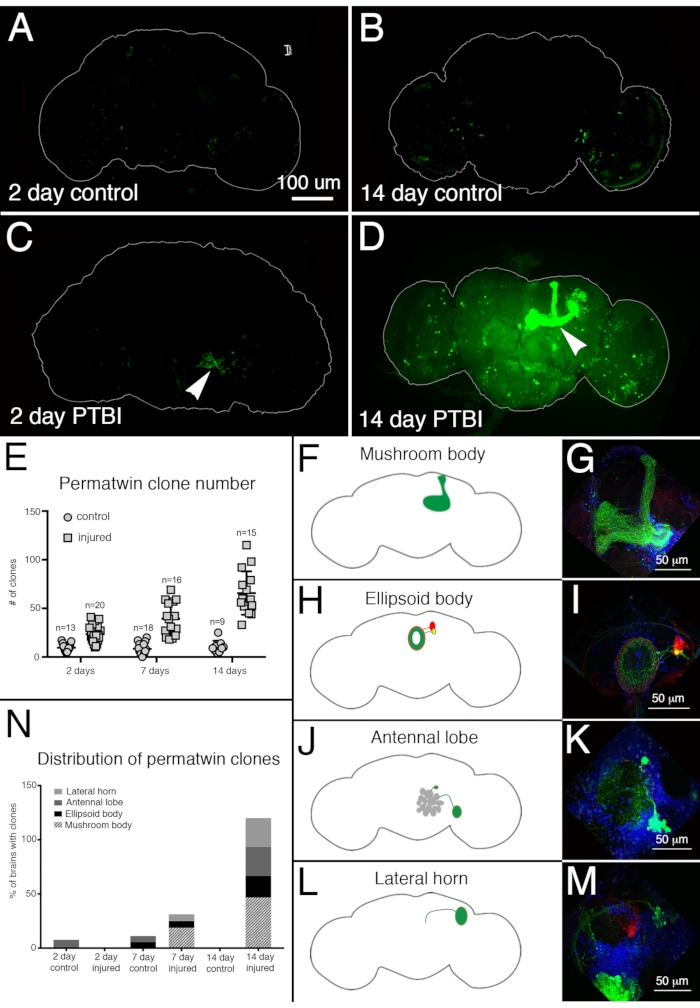
图 4:永久双胞胎谱系追踪显示 PTBI 后大脑再生和轴突的适当靶向。 利用永久双胞胎谱系追踪系统15 分析PTBI后的神经发生。该系统用绿色荧光蛋白(GFP)或红色荧光蛋白(RFP)永久标记分裂的细胞和后代。在17°C下饲养苍蝇,以在发育过程中保持系统关闭。携带永久双胞胎转基因的F1雄性在关闭时收集,然后受伤并置于30°C下恢复2或14天。(A)在2天未受伤的对照中,有一些GFP +细胞散布在整个大脑中。(B)在14天时,对照中枢脑中存在的GFP +细胞相对较少。(C)相比之下,2天受伤的大脑有更多的GFP +细胞,这些细胞倾向于聚集在受伤附近(箭头)。(D)在损伤后14天,损伤部位附近有大型克隆。其中一些克隆具有沿蘑菇体束(箭头)投射的轴突。此处仅显示 GFP 通道;PTBI样本中也有类似的RFP+克隆。控制未受伤的大脑(n = 13)在2天时平均有10个克隆,而2天的PTBI大脑(n = 20)平均有23个克隆(p<0.00002)。在7天时,对照组大脑平均每个大脑有9个克隆(n = 18),而7天的PTBI大脑平均每个大脑有39个克隆(n = 16)(p值<0.00000002)。这明显超过损伤后 2 天观察到的克隆数量(p 值<0.0009)。在14天的对照脑中,每个大脑平均有10个克隆,这与2天和7天的对照没有显着差异。然而,在PTBI后14天,平均有66个GFP +克隆,这明显高于年龄匹配的对照组(p<0.0000003)或PTBI后2天的大脑(p值<0.0001)。 (F-M) PTBI刺激大脑中多个区域的克隆形成。左侧的面板是PTBI后14天发现大型克隆的大脑区域的示意图(A, H, J, L)。右边的面板显示了代表性大脑(G, I, K, M)的高放大倍率。许多14天的大脑都有投射到特定目标区域的克隆。这些包括蘑菇体(MB)(F,G),椭球体(EB)(H,I),触角叶(AL)(J,K)和侧角(LH)(L,M)。(N)克隆数和克隆大小均随PTBI后时间的增加而增加,在对照组和受伤脑中,计算出具有大克隆的大脑区域的比例分别为2、7和14 d。在2天时,约8%的对照脑(n = 13)显示AL克隆,而在2天受伤的大脑中没有AL克隆(n = 20)。在7天的对照脑(n = 18)中,6%患有AL,6%有EB克隆。在PTBI后7天(n = 16),6%的大脑也有AL克隆,6%有EB克隆,19%有大MB克隆。在14天时,对照脑(n = 9)没有表现出任何具有克隆的特定区域,而47%的PTBI大脑(n = 15)具有MB克隆,20%的PTBI大脑具有AL克隆,27%的PTBI大脑具有EB克隆,27%具有LH克隆。此图改编自参考文献 16。 请点击此处查看此图的放大版本。
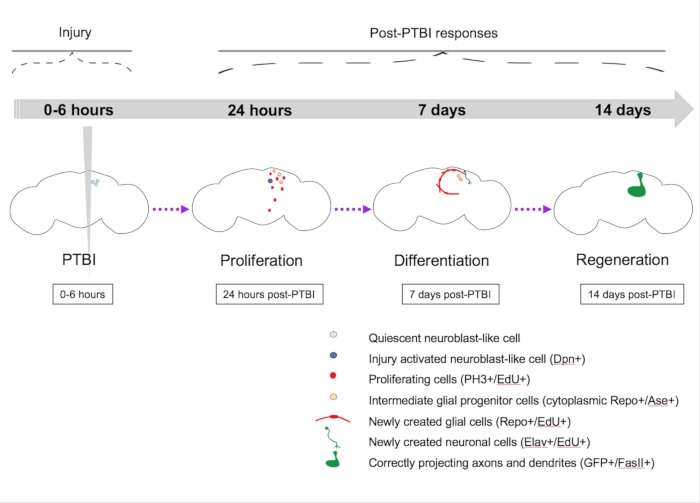
图5:穿透性创伤性脑损伤(PTBI)后再生的摘要模型。 在年轻的成年 果蝇中,中枢脑中存在静止的神经母细胞样细胞,缺乏规范神经母细胞基因的表达。到PTBI后24小时,静止的神经母细胞样细胞被激活,表达神经母细胞基因,并开始增殖。在 PTBI 后 4 小时和 24 小时,都会出现一波细胞死亡16。在7天时,增殖率仍然很高,许多新细胞已经采用了成熟的细胞身份,成为神经元或神经胶质细胞。在PTBI后14天,具有轴突和树突的新神经元的大克隆正确投射到各自的目标区域。运动缺陷也在14天内恢复,这表明成年 果蝇 可以在功能和结构上再生。此图改编自参考文献 16。 请点击此处查看此图的放大版本。
讨论
虽然之前已经描述了成年果蝇大脑的穿透性损伤15,17,18,但这些损伤集中在视叶而不是中枢脑。此外,迄今缺乏关于如何实施伤害的详细说明。该协议描述了一种对成年 果蝇 中枢脑进行穿透性损伤的模型,该模型再现了PTBI后成人神经发生的统计学显着证据。
这种PTBI方案的可重复性部分是由于蘑菇体作为损伤靶区。蘑菇体很大,由约2200个神经元组成,具有复杂的树突和轴突乔木,形成大型且高度刻板的阵列18。蘑菇体神经元的细胞体位于大脑表面附近,可以使用绿色荧光蛋白(GFP)的表达通过头部角质层进行可视化 (图1C)。 蘑菇体前体是发育过程中最后经历细胞凋亡的神经干细胞13,12,19。因此,许多蘑菇体神经元在eclosion时非常年轻。这导致了一种假设,即蘑菇体可能比其他大脑区域具有更多的有丝分裂潜力16。此外,蘑菇体对学习和记忆至关重要18。这允许人们询问PTBI触发的神经发生是否会导致功能恢复。
其他有助于结果可重复性的因素包括使用基因型一致的异交苍蝇,每次在同一方向上进行杂交,精确控制饲养和老化温度,以及分别分析雄性和雌性。使用来自外杂交的F1苍蝇可以降低分析大脑纯合子自发突变的可能性。 y[1] w[1]的标准十字;UAS-mCD8-GFP;;OK107-GAL4 成年雌性到 y[1] w[1] 成年雄蝇导致基因型 y[1]w[1]的F1后代;UAS-mCD8-GFP/+;;OK107-GAL4/+. OK107-GAL4 在蘑菇体的所有内在神经元中表达,并驱动膜结合报告 器UAS-mCD8-GFP 的表达,允许可视化蘑菇体及其投影。对于永久双胞胎十字架,十字架必须始终保持在17°C,以保持血统追踪系统关闭。这确保了在发育过程中没有分裂细胞被标记,并且只有成人出生的神经元和神经胶质细胞被标记。为此,飞行室也可以保持在17°C。 虽然对永久双胞胎系统的初始描述15 建议在18°C下饲养苍蝇,但这可能导致显着的背景标记。
为了保持一致性,还建议在执行PTBI时将控制未受伤的苍蝇保持在CO2 垫上。这确保了两组苍蝇具有相同的麻醉暴露。此外,希望可重复性完全穿透头部。但是,必须注意不要将销尖弯曲到垫子上,使其无法用于将来的伤害。对于熟练的从业者来说,PTBI苍蝇几乎没有意外伤害。尽管如此,在受伤期间用力按压胸部以稳定苍蝇可能是致命的。评估意外伤害程度的一种方法是量化受伤后24小时PTBI苍蝇的死亡率。对于单侧受伤的苍蝇,对于初学者来说,这可能是50%或更高。因此,为了确保观察到的结果是由于PTBI而不是意外伤害,建议初学者在几周内每天对约20只苍蝇进行PTBI,并且在24小时死亡率始终<10%之前不要分析产生的大脑。
为了量化中枢脑PTBI刺激的增殖量,可以采用抗磷酸组氨酸H3(PH3)免疫染色和5-乙炔基-2'-脱氧尿苷(EdU)掺入。抗PH3在中期之前和整个中期标记细胞,将检测限制在只有一小部分活跃分裂的细胞。因此,抗PH3染色只能提供部分增殖的一瞥。EdU是一种胸腺嘧啶类似物,可以掺入新合成的DNA中。通过在受伤前后喂养苍蝇EdU,可以更全面地了解受伤后正在分裂或分裂的细胞。任何分裂的细胞都被永久标记的事实对于识别缓慢循环的细胞和测定初始增殖后细胞的存活率都很有帮助。由于不明原因,但可能是由于血脑屏障的通透性有限,EdU标记效率低下,并且未充分报告成人大脑中的细胞增殖。在PTBI后24小时,对照和实验大脑中PH3 +和EdU +细胞的数量相似,并且观察到永久双胞胎克隆中只有一部分新细胞含有EdU16,这证明了这一点。为了最大限度地标记,必须用EdU预先喂养苍蝇,因为受伤的苍蝇在PTBI后的几个小时内不会恢复喂养。通过在EdU溶液中添加食用色素并通过腹部角质层监测肠道中染料的量来评估喂养16。
需要注意的是,虽然我们在步骤4中提供了脑部解剖方案,但可以使用替代技术。其中一些在以前发布的协议中可用20,21,22。 Drosophila melanogaster 提供了一种低成本的模型,具有强大的遗传和分子工具,可用于研究多种组织再生的机制,包括肠道和神经系统的组成部分。这里概述了一种新颖且可重复的损伤模型,可用于研究对脑损伤的反应。使用这些协议获得的数据支持这样一种观点,即成年 果蝇 中枢大脑保留了增殖能力,从而产生新的神经元来应对损伤。这些观察结果需要进一步研究成人神经发生的程度及其潜在的分子机制。一旦在这个系统中确定了参与神经再生的成分,我们就可以将我们对成年 果蝇 神经发生的知识转化为人类。
披露声明
作者没有利益冲突。
致谢
我们感谢Stacey Rimkus和Becky Katzenberger的技术援助,并感谢Eduardo Moreno分享永久双胞胎股票。我们要感谢Barry Ganetzky和David Wassarman的热烈讨论,这些讨论无疑改善了科学,并感谢Kent Mok,Cayla Guerra和Bailey Spiegelberg对实验室的贡献。FasII抗体由Corey Goodman开发,并从发育研究杂交瘤库获得,该库由NIH的NICHD创建,并在爱荷华大学生物系,爱荷华市,IA 52242维护。本研究中使用的大多数 果蝇 菌株都是从布卢明顿果蝇库存中心(BDSC;NIH P40OD018537).这项工作得到了NIH T32 GM007133(KLC)的支持;美国国立卫生研究院NS090190 (GBF);美国国立卫生研究院NS102698 (GBF);威斯康星大学研究生院(GBF);以及威斯康星大学麦迪逊分校科学与工程女性领导学院(WISELI)(GBF)。
材料
| Name | Company | Catalog Number | Comments |
| #11 disposable scalpels | Santa Cruz Biotechnology | sc-395923 | used for separating Drosophila heads from trunks prior to brain dissection |
| 150 mm diameter black Sylgard dishes | Dow | 1696157 | made in the laboratory with reagents from Dow; used for brain dissection |
| 18 mm coverslips | any | for mounting brains on microscope slides | |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | ThermoFisher | D1306 | for immunohistochemistry |
| 70% Ethanol | made from 95% ethanol sourced variously | ||
| anti-mouse Cy5 | Jackson ImmunoResearch | 715-175-151 | for immunohistochemistry |
| anti-rabbit 568 | ThermoFisher | A11036 | for immunohistochemistry |
| bovine serum albumin (BSA) | SIgma Aldrich | A7030 | for immunohistochemisty |
| Clear nail polish | any | for sealing coverslips | |
| Click-It EdU labeling kit | InVitrogen | C10640 | to detect newly synthesized DNA |
| CO2 bubbler | Genesee Scientific | 59-181 | for anesthesia |
| CO2 pad | Genesee Scientific | 59-114 | for anesthesia |
| CO2 regulator and supply | any | for anesthesia | |
| Confocal microscope | any | for imaging fixed, stained and mounted brains | |
| cotton plugs | Genesee Scientific | 51-101 | for EdU labeling |
| Drosophila vials | Genesee Scientific | 32-109 | for EdU labeling |
| Fix buffer (Pipes, EGTA, Magnesium; PEM) | components sourced from various companies | for fixing adult brains; 100 mM piperazine-N,N’-bis(2-ethanesulfonic acid) [PIPES], 1 mM EGTA, 1 mM MgSO4, pH 7.0 | |
| Formaldehyde | Sigma Aldrich | 252549 | for fixing adult brains, added to PEM |
| Grade 3 round Whatman filters, 23 mm round | Tisch Scientific | 1003-323 | for EdU labeling |
| Microfuge tubes | any | for fixing and staining reactions and for storing Minutien pins | |
| Microscope slides | any | for mounting brains | |
| Minutien pins | Fine Science Tools | 26002-10 | for brain injury; 12.5 μm diameter tip and 100 μm diameter rod |
| mouse anti-Fasiclin II | Developmental Studies Hybridoma Bank | 1D4-s | for immunohistochemistry |
| NIGHTSEA stereo microscope fluorescence adaptor | Electron Microscopy Sciences | SFA-GR | fluorescence setup for dissecting microscope |
| P20, P200 and P1000 pipettors and tips | any | for measuring solutions | |
| phosphate buffered saliine (PBS) | components sourced from various companies | for dissecting brains and making immunohistochemistry blocking and washing solutions; 100 mM of K2HPO4, 140 mM of NaCl, pH 7.0 | |
| phosphate buffered saline with 0.1% Triton X-100 (PT) | components sourced from various companies | for washing dissected brains | |
| phosphate buffered saline with 0.1% Triton X-100 + 2% bovine serum albumin (PBT) | components sourced from various companies | blocking solution for immunohistochemistry and for diluting antibodies | |
| rabbit anti-PH3 | Santa Cruz Biotechnology, Inc | sc-8656-R | for immunohistochemistry |
| Reinforcement labels | Avery | 5721 | to maintain space between the microscope slide and the coverslip |
| Size 0 paintbrushes | any | to manipulate and stabilize adult Drosophila during injury | |
| Triton X-100 | Sigma Aldrich | 93443 | |
| Two pair of #5 watchmakers forceps | Fine Science Tools | 11255-20 | used to hold the Minutien pins and for brain dissections |
| Vectashield | Vector Laboratories | H-1000 | mounting medium for microscope slides |
参考文献
- Thurman, D., et al. Report to Congress: Traumatic brain injury in the United States. , Available from: https://www.cdc.gov/traumaticbraininjury/pubs/tbi_report_to_congress.html (1999).
- NIEHS. , Available from: https://www.nih.gov/research/supported/health/neurodegenerative/index.cfm (2021).
- Morton, N. V., Wehman, P. Psychosocial and emotional sequelae of individuals with traumatic brain injury: A literature review and recommendations. Brain Injury. 9 (1), 81-92 (2017).
- Bonini, N. M., Berger, S. L. The sustained impact of model organisms-in genetics and epigenetics. Genetics. 205, 1-4 (2017).
- Brace, E. J., DiAntonio, A. Models of axon regeneration in Drosophila. Experimental Neurology. 287, Pt 3 310-317 (2017).
- Hao, Y., Collins, C. Intrinsic mechanisms for axon regeneration: insights from injured axons in Drosophila. Current Opinion in Genetics & Development. 44, 84-91 (2017).
- Chiang, A. S., et al. Three-dimensional reconstruction of brain-wide wiring networks in Drosophila at single-cell resolution. Current Biology. 21 (1), 1-11 (2011).
- Meinertzhagen, I. A. The organisation of invertebrate brains: cells, synapses and circuits. Acta Zoologica. 91 (1), 64-71 (2010).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: A history lesson for the future. Nature Reviews Neuroscience. 11 (7), 514-522 (2010).
- Lessing, D., Bonini, N. M. Maintaining the brain: insight into human neurodegeneration from Drosophila melanogaster mutants. Nature Reviews Genetics. 10 (6), 359-370 (2009).
- Boone, J. Q., Doe, C. Q. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells. Developmental Neurobiology. 68 (9), 1185-1195 (2008).
- Ito, K., Hotta, Y. Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster. Developmental Biology. 149 (1), 134-148 (1992).
- Siegrist, S. E., Haque, N. S., Chen, C. H., Hay, B. A., Hariharan, I. K. Inactivation of both Foxo and reaper promotes long-term adult neurogenesis in Drosophila. Current Biology. 20 (7), 643-648 (2010).
- von Trotha, J. W., Egger, B., Brand, A. H. Cell proliferation in the Drosophila adult brain revealed by clonal analysis and bromodeoxyuridine labelling. Neural Development. 4, 9(2009).
- Fernandez-Hernandez, I., Rhiner, C., Moreno, E. Adult neurogenesis in Drosophila. Cell Reports. 3 (6), 1857-1865 (2013).
- Crocker, K. L., et al. Neurogenesis in the adult Drosophila brain. Genetics. , (2021).
- Plavicki, J., Mader, S., Pueschel, E., Peebles, P., Boekhoff-Falk, G. Homeobox gene distal-less is required for neuronal differentiation and neurite outgrowth in the Drosophila olfactory system. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1578-1583 (2012).
- Aso, Y. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Ito, K., Awano, W., Suzuki, K., Hiromi, Y., Yamamoto, D. The Drosophila mushroom body is a quadruple structure of clonal units each of which contains a virtually identical set of neurones and glial cells. Development. 124 (4), 761-771 (1997).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A. Simple one-step dissection protocol for whole-mount preparation of adult Drosophila brains. Journal of Visualized Experiments. (118), e55128(2016).
- Kelly, S. M., Elchert, A., Kahl, M. Dissection and immunofluorescent staining of mushroom body and photoreceptor neurons in adult Drosophila melanogaster brains. Journal of Visualized Experiments. (129), e56174(2017).
- Arain, U., Valentino, P., Islam, I. M., Erclik, T. Dissection, immunohistochemistry and mounting of larval and adult Drosophila brains for optic lobe visualization. Journal of Visualized Experiments. (170), e61273(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。