Method Article
Стимуляция и анализ нейрогенеза взрослых в центральном мозге дрозофилы
В этой статье
Резюме
В этой статье представлены подробные протоколы нанесения проникающей черепно-мозговой травмы (PTBI) взрослой дрозофиле и изучения результирующего нейрогенеза.
Аннотация
Молекулярные и клеточные механизмы, лежащие в основе нейрогенеза в ответ на болезнь или травму, не совсем понятны. Тем не менее, понимание этих механизмов имеет решающее значение для разработки нейронной регенеративной терапии. Drosophila melanogaster является ведущей моделью для исследований развития нейронов, но исторически не использовалась для исследования регенерации мозга взрослых. Это в первую очередь связано с тем, что взрослый мозг проявляет очень низкую митотическую активность. Тем не менее, проникающая черепно-мозговая травма (PTBI) в центральный мозг взрослой дрозофилы вызывает генерацию новых нейронов и новой глии. Мощные генетические инструменты, доступные у дрозофилы , в сочетании с простым, но строгим протоколом травмы, описанным здесь, теперь делают мозг взрослой дрозофилы надежной моделью для исследований нейронной регенерации. Здесь приведены подробные инструкции для (1) проникающих повреждений центрального мозга взрослого человека и (2) рассечения, иммуногистохимии и визуализации после травмы. Эти протоколы дают высоковоспроизводимые результаты и облегчат дополнительные исследования для препарирования механизмов, лежащих в основе нейронной регенерации.
Введение
Повреждение мозга и нервной системы является основной причиной смерти и инвалидности во всем мире. Примерно 1,5 миллиона американцев страдают черепно-мозговыми травмами (ЧМТ) каждый год1, в то время как, по оценкам, 6 миллионов человек только в Соединенных Штатах страдают от нейродегенеративных заболеваний, таких как болезнь Паркинсона и Альцгеймера2. Как заболевание, так и повреждение головного мозга могут вызвать нервную дегенерацию, приводящую к сенсорным, когнитивным и двигательным дефектам3. Разработка терапевтических стратегий восстановления человеческого мозга была затруднена из-за сложной физиологии мозга. Модельные организмы, такие как Drosophila melanogaster, обеспечивают простую систему для идентификации фундаментальных механизмов, лежащих в основе нейродегенерации и потенциальных терапевтических целей4.
Плодовая муха Drosophila melanogaster уже более века является мощным модельным организмом, продвигая области генетики, биологии развития и неврологии5,6. Мозг дрозофилы содержит всего ~ 90 000 нейронов7, что в миллион раз меньше, чем средний человеческий мозг8, но они имеют много общего. Как человеческий, так и мышиный мозг используют нейротрансмиттеры ГАМК, глутамат, ацетилхолин и биогенные амины дофамин и серотонин9. Дрозофила и нейроны человека также функционируют аналогично, с общей синаптической архитектурой и аналогичными типами нейронных клеток10. Меньший размер мозга дрозофилы и наличие передовых методов генетики в сочетании с сохранением молекулярных, клеточных и физиологических механизмов между дрозофилой и млекопитающими позволяет исследователям дрозофилы задавать вопросы, на которые непрактично или трудно ответить в моделях млекопитающих.
Наше нынешнее понимание нейрогенеза взрослых у дрозофилы, как во время гомеостаза, так и после травмы, остается ограниченным. Больше известно о нейрогенезе при нормальном развитии. Например, нейроны и глия создаются во время развития из клеток-предшественников, называемых нейробластами10,11. По крайней мере, три различных типа нейробластов были выделены в центральном мозге. Нейробласты линии I и II типа выходят из клеточного цикла через ~20-30 ч после образования пупариума12. Напротив, нейробласты грибного тела являются последними, кто прекращает деление клеток и делает это через Жнец-зависимый апоптоз ~ 85-90 ч после образования пупариума13. После эклозии мозг взрослой дрозофилы имеет несколько делящихся клеток (~ 1 клетка / мозг), преимущественно glia14. Взрослые зрительные доли обладают медленно циклическими нейробластами, способными к нейрогенезу15, в то время как взрослый центральный мозг не имеет известных нейробластов. Дефицит нейронных предшественников и ограниченная пролиферация клеток сильно напоминают ситуацию в мозге взрослых млекопитающих, подчеркивая потенциальную актуальность механизмов взрослого нейрогенеза у дрозофилы для человека.
Открытие низких уровней взрослого нейрогенеза в зрительных долях взрослой дрозофилы после травмы15 привело к гипотезе о том, что центральный мозг взрослой дрозофилы также может быть способен к взрослому нейрогенезу16. Этот протокол описывает создание строгой, воспроизводимой модели центральной черепно-мозговой травмы у взрослых дрозофил , которая может быть использована для исследования нейрогенеза в центральном мозге взрослого человека. Учитывая сходство между архитектурой и функцией мозга человека и дрозофилы , эти открытия могут привести к выявлению критических целей для терапевтического нейрогенеза в поврежденном и больном человеческом мозге.
протокол
Этот протокол следует руководящим принципам ухода за животными UW-Madison.
1. Генерация взрослой дрозофилы для PTBI
- Для стандартного креста поместите 20 девственных y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL417 взрослых самок и 10 y[1] w[1]17 взрослых самцов летают вместе во флаконах (см. Таблицу материалов), содержащих пищу. Чтобы иметь большое количество синхронного потомства, установите 10-20 скрещиваний одновременно. Стандартный кросс порождает F1 потомство генотипа: y[1] w[1]; UAS-mCD8-GFP/+;; OK107-GAL4/+.
- Поместите флаконы при температуре 25 °C для спаривания и яйцекладки. Чтобы максимизировать потомство, переводите родителей в новые флаконы каждые 2-4 дня, поддерживая более ранние флаконы при 25 °C. Выбросьте каждый флакон через 18 дней после того, как родители были впервые помещены в него, чтобы убедиться, что нет потомства F2.
ПРИМЕЧАНИЕ: 3 набора потомства («выводков») могут быть получены от каждого набора родителей. - Проверьте через ~10 дней, когда потомство F1 начнет эклозировать.
- Поместите флаконы при температуре 25 °C для спаривания и яйцекладки. Чтобы максимизировать потомство, переводите родителей в новые флаконы каждые 2-4 дня, поддерживая более ранние флаконы при 25 °C. Выбросьте каждый флакон через 18 дней после того, как родители были впервые помещены в него, чтобы убедиться, что нет потомства F2.
- Для исследований родословной используйте F1 перма-близнецов мужского пола15 генотипа: w; FRT40A, UAS-CD2-RFP, UAS-GFP-Мир/FRT40A, UAS-CD8-GFP, UAS-CD2-Мир; ванна-GAL80ts/act-GAL4 UAS-flp. Для согласованности делайте этот крест в одном и том же направлении каждый раз.
- Чтобы создать самцов-близнецов, поместите 20 девственников w; FRT40A, UAS-CD2-RFP, UAS-GFP-Мир; ванна-GAL80ts/TM6B женские и 10 вт; ФРТ40А, БАС-CD8-GFP, БАС-CD2-Мир; act-GAL4 UAS-flp/TM6B15 взрослые самцы вместе во флаконах, содержащих пищу.
- Поместите флаконы при температуре 17 °C для спаривания и яйцекладки. Переводите родителей во флаконы с новой пищей каждые 7 дней, поддерживая все флаконы при температуре 17 °C. Выбросьте каждый флакон через 35 дней после того, как родители были впервые помещены в него, чтобы убедиться, что нет потомства F2.
- Проверьте через ~21 день, когда потомство F1 начнет экклозироваться.
2. Проникающая черепно-мозговая травма (ПТБИ; Рисунок 1)
- Сортируйте недавно эклозированных мух F1. Отбирают молодых самцов в течение 6 ч после эклозии. Поместите этих самцов в чистые флаконы, содержащие пищу, с 40 или менее мухами на флакон.
ПРИМЕЧАНИЕ: Это легче всего достигается в середине утра путем обезболивания мух на площадке CO2 и выявления взрослых самцов, у которых все еще есть меконий (видимый как темно-зеленоватое пятно через брюшную стенку) в кишечнике. - Предварительно кормят 5-этинил-2'-дезоксиуридином (ЭдУ) (см. Таблицу материалов) за 6 ч до травмы, если планируется маркировка делящихся клеток ЭдУ. Подробности см. в шаге 3.
- Дезинфицируйте штифты Minutien (см. Таблицу материалов) в течение не менее 5 минут, помещая ~100 штифтов в микроцентрифужную трубку объемом 1,5 мл, заполненную 70% этанолом.
- Продезинфицируйте прокладку CO2 и кисть, распылив 70% этанола и вытрите насухо чистой безворсовой тканью. Как только инструменты будут чистыми и сухими, перенесите 40 или менее отсортированных самцов F1 обратно на чистую площадку.
- Разделите самцов F1 на 2 группы на налетной площадке. Одна группа будет служить в качестве контрольных, неповрежденных мух. Вторая экспериментальная группа будет подвергнута PTBI.
- Используя щипцы, вытащите 4-5 новых штифтов Minutien из трубки микроцентрифуги и поместите их к краю площадки CO2 . Под рассекающим прицелом выберите прямую булавку Minutien с острым острием.
ПРИМЕЧАНИЕ: Использование одного контакта Minutien для эксперимента уменьшит изменчивость. Повторно используйте острые булавки. Поместите поврежденные или тупые штифты в отдельную микроцентрифужную трубку объемом 1,5 мл, содержащую 70% этанола для безопасной утилизации. - При работе с мухами из стандартного кросса включите стереомикроскоп светодиодной (LED) лампой, оснащенной соответствующими фильтрами возбуждения и излучения для зеленого флуоресцентного белка (GFP). Это позволяет возбуждать при 440-460 нМ и позволяет визуализировать 500-560 нМ.
ПРИМЕЧАНИЕ: С помощью этой лампы и фильтра клеточные тела гриба будут флуоресцировать зеленым цветом через головную кутикулу (рисунок 1C). Для мух-близнецов или мух других генотипов стандартный осветитель белого света для стереомикроскопа может быть использован для визуализации ориентиров на кутикуле головы для нацеливания травмы на тело гриба (рисунок 1C). - Используйте щипцы, чтобы поднять и держать выбранную булавку Minutien в одной руке (для правшей это обычно правая рука) и кисть в другой (обычно левой) руке. Выберите муху из экспериментальной группы и расположите муху так, чтобы у вас был спинной вид головной капсулы с головой мухи справа. Поместите щетку на переднюю часть спинной грудной клетки и осторожно надавите вниз, чтобы стабилизировать муху.
- Направьте наконечник булавки Minutien на тела клеток гриба с правой стороны головы и проникните в капсулу головы. При использовании ориентиров нацеливайтесь на кутикулу спинной головки между оцеллиями и дорсальным ободом глаза (рисунок 1).
- После завершения травмы используйте кисть, чтобы осторожно оттолкнуть голову от булавки Minutien.
- При использовании мозга для RNA-Seq или qRT-PCR, сделайте вторую травму на левой стороне головы.
- Повторите шаги 2.8-2.10, чтобы травмировать всех мух в экспериментальной группе.
- После того, как все мухи получили травмы, поместите контрольные и травмированные мухи в маркированные отдельные флаконы, содержащие пищу. Положите флаконы горизонтально (то есть на бока), пока мухи восстанавливаются после анестезии и во время последующего старения, чтобы мухи не попали в пищу.
- Поместите стандартные поперечные мухи при 25 ° C, а постоянные двойные мухи при 30 ° C до возраста.
- Для мух в возрасте дольше 24 ч выкладывайте их на чистую пищу каждые 1-2 дня.
3. Маркировка EdU
- Готовят запас 10 мМ 5-этинил-2'-дезоксиуридина (ЭдУ) в диметилсульфоксиде (ДМСО). Он может храниться при -20 °C до 12 месяцев.
- Готовят 200 мкл 50 мкМ ЭдЕ в 10% сахарозе. Предварительно подкармливается с EdU за 6 ч до PTBI.
- Поместите 200 мкл 50 мкМ EdU в 10% сахарозу на 23-миллиметровую круглую фильтровальную бумагу марки 3 (см. Таблицу материалов) в пустой флакон.
- Поместите мух во флакон. Затем запечатайте флакон ватной пробкой.
- Положите флакон горизонтально в увлажненный инкубатор при 25 °C в течение 6 ч.
- Выполняйте ПТБИ, как описано в шагах 2.3-2.10.
- Поместите мух обратно в флакон, содержащий EdU. Запечатайте флакон ватной пробкой.
- Положите флакон горизонтально в увлажненный инкубатор при 25 °C на срок до 24 ч. Выполните один из шагов, описанных ниже (шаг 3.8.1-3.8.3).
- Рассекайте и фиксируйте мозг, как описано на этапе 4, используя фиксатор, буфер промывания и блокирующий буфер без азида и с реакцией обнаружения EdU, проводимой перед окрашиванием антител.
- Переложите мух в чистый флакон, содержащий новую фильтровальную бумагу и 200 мкл 50 мкМ EdU в 10% сахарозы. Положите флакон горизонтально в инкубатор при температуре 25 °C. Повторяйте каждые 24 ч в течение всего срока маркировки. Затем рассекните и зафиксируйте мозг, как описано на этапе 4, используя буферы без азида с реакцией обнаружения EdU, проводимой перед окрашиванием антител.
- Чтобы пульсировать метку с EdU, подавайте EdU на импульсный период, переносите мух каждые 24 ч в чистый флакон, содержащий новую фильтровальную бумагу и 200 мкл 50 мкМ в 10% сахарозе. После зернобобового периода (например, 4 дня) переведите мух во флакон, содержащий стандартный корм для дрозофилы. Поместите флакон на бок в инкубатор при температуре 25 °C еще на 3 дня. Затем рассекните и зафиксируйте мозг, как описано на этапе 4, используя буферы без азида с реакцией обнаружения EdU, проводимой перед окрашиванием антител.
4. Рассечение, иммуногистохимия и монтаж
- Готовят 1,5 мл микроцентрифужных трубок со 100 мкл фиксатора: 4% формальдегида в ПЭМ (100 мМ пиперазин-N,N'-бис(2-этанесульфоновая кислота) [PIPES], 1 мМ ЭГТА, 1 мМ MgSO4, рН 7,0) (см. Таблицу материалов) и помещают на лед.
ПРИМЕЧАНИЕ: До 20 мозгов одного генотипа и состояния могут быть обработаны в одной трубке. - Приготовьте рассеченную пластину с одним небольшим бассейном (~100 мкл) 70% этанола и тремя небольшими пулами фосфатно-буферного физиологического раствора (PBS; 100 мМ K2HPO4, 140 мМ NaCl, рН 7,0).
- Обезболить ~ 10 контрольных или экспериментальных мух на co2-подушке , которая была продезинфицирована 70% этанолом.
- Отделите голову от туловища каждой мухи с помощью скальпеля.
- Соберите головки с помощью кисти, смоченной в 70% этаноле, и поместите головки на 2-5 мин в бассейн с этанолом на пластине для рассечения.
ПРИМЕЧАНИЕ: Это немного обезвоживает мозг и облегчает его рассечение от кутикулы головы. - Переместите головки в пул PBS ~ 100 мкл и рассекните мозг, переместив каждый мозг в чистый пул PBS ~ 100 мкл. Выполните это, используя две пары щипцов часовщика, чтобы открыть заднюю часть головы кутикулы и удерживать кутикулу одной парой щипцов, осторожно вытаскивая мозг из кутикулы, используя закрытый кончик второй пары щипцов.
- Переместите рассеченный мозг в микроцентрифужную трубку, содержащую 100 мкл фиксирующего раствора, используя пипетку P200, оснащенную пластиковым наконечником, который был разрезан и скошен, чтобы разрешить проникновение мозга.
- Зафиксировать на 20-25 мин при комнатной температуре. Аккуратно снимите крепление с помощью P200 или стеклянной пипетки.
- Промывайте фиксированные мозги четыре раза 1 мл «PT» (PBS плюс 0,1% Triton X-100), позволяя мозгу успокоиться в течение нескольких минут между каждой промывкой.
ПРИМЕЧАНИЕ: Если мозг не оседает быстро между промывками, он, вероятно, будет иметь все еще жирное тело и / или трахею. - Блочные образцы в 1 мл PBS плюс 0,1% Triton X-100 и 2% бычьего сывороточного альбумина (PBT) в течение ~1 ч при комнатной температуре.
- Удаляют блокирующий раствор и инкубируют образцы со 100 мкл раствора первичных антител в течение ночи при 4 °C в ПБТ. Основными антителами, используемыми в этом исследовании, являются анти-PH3 кролика (1:500) и мышиный антифасиклин II (1:20) (см. Таблицу материалов).
- Промывайте образцы пять раз 1 мл ПТ, позволяя мозгу оседать в течение нескольких минут между каждой промывкой.
- Удаляют окончательную промывку и инкубируют в 100 мкл раствора вторичных антител на ночь при 4 °C. Вторичными антителами, используемыми здесь, являются анти-кролик 568 (1:400) и анти-мыши Cy5 (1:100) (см. Таблицу материалов).
- Промывайте образцы пять раз 1 мл ПТ, позволяя мозгу оседать в течение нескольких минут между каждой промывкой. Во время заключительной промывки добавляют 4',6-диамидино-2-фенилиндол, дигидрохлорид (DAPI; 1:100 раствора 10 мкМ) в течение 10 мин для окрашивания ядер. Снимите стирку, оставив в каждой пробирке по 50-100 мкл.
- Подготовьте предметные стекла микроскопа, поместив одну самоклеящуюся арматурную этикетку на середину каждого слайда и каплю 50 мкл монтажной среды против выцветания в центре каждой этикетки (см. Таблицу материалов). Арматурная этикетка удерживает крышку немного выше слайдов и предотвращает чрезмерное сплющивание смонтированных мозгов.
- Осторожно перенесите мозги из каждой микроцентрифужной трубки на подготовленную горку с как можно меньшим буфером промывки, используя P200, оснащенный вырезанным и скошенным пластиковым наконечником. Целых 10 мозгов могут быть установлены на одном слайде.
- Используйте щипцы, чтобы аккуратно изменить положение мозга, прежде чем поместить крышку на каждый слайд и запечатать слайд лаком для ногтей. Ориентируйте мозг либо задней стороной вверх, либо передней стороной вверх, но не должны касаться друг друга.
ПРИМЕЧАНИЕ: Поскольку трудно получить высококачественные конфокальные изображения через весь мозг, некоторые мозги должны быть установлены в каждой ориентации. - Хранить подготовленные слайды ровно и в темноте при температуре 4 °C до получения изображения. Для длительного хранения (до 1 года) слайды могут храниться при -20 °C.
5. Конфокальная визуализация
ПРИМЕЧАНИЕ: Изображение мозга с помощью лазерно-сканирующего конфокального микроскопа с лазерами возбуждения и кубами эмиссионного фильтра, соответствующими DAPI и флуоресцентным вторичным антителам (т.е. 405 нм, 488 нм и 568 нм, 633 нм соответственно).
- Включите питание микроскопа, лазеров, контроллера и компьютера.
- Откройте программное обеспечение для приобретения.
- В режиме получения выберите до четырех каналов и задайте параметр последовательного сканирования нужных каналов. Увеличьте мощность лазера для каждого канала до 5-10%.
- Поместите слайд на микроскоп.
- Выберите мозг для визуализации с помощью эпифлуоресцентного прикрепления (см. Таблицу материалов).
- В режиме «Получение» выберите размер кадра размером 1024 x 1024 пикселя.
- В режиме «Сбор» выберите опцию Z-стек, укажите, что Z-стек должен быть взят на участках размером 2 мкм, и сфокусируйтесь на образце, выбрав верхнюю и нижнюю фокальные плоскости для изображения.
- Собирайте Z-стековые изображения всего мозга, используя 20-кратный объектив и конкретные области мозга, такие как грибное тело, используя 60-кратный объектив.
6. Анализ данных
- Количественно оцените пролиферирующие клетки и количество клонов перма-близнецов вручную и/или с помощью программного обеспечения для анализа изображений (см. Таблицу материалов). При использовании программного обеспечения выберите интересующие области (ROI) с областями не менее 10 мкм.
Результаты
PTBI стимулирует пролиферацию клеток
Чтобы определить степень нейрогенеза после центрального ПТБИ головного мозга, пролиферативный ответ измеряли у молодых взрослых мужчин, собранных и травмированных в течение 6 ч после эклозии. Значительное увеличение пролиферации наблюдалось через 24 ч после травмы с использованием антифосфогистона 3 (PH3), маркера для клеток, активно подвергающихся митозу. Приблизительно 3 клетки PH3+ в контрольном центральном мозге и 11 клеток PH3+ в поврежденном центральном мозге наблюдаются через 24 ч после PTBI (рисунок 2A-D). Большинство делящихся клеток расположены вблизи места повреждения. Второй анализ деления клеток был использован для количественной оценки кумулятивной пролиферации клеток от одного повреждения и для оценки степени, в которой вновь созданные клетки выжили. 5-этинил-2'-дезоксиуридин (EdU) является аналогом тимидина, который может быть включен во вновь синтезированную ДНК и постоянно маркировать клетки, подвергшиеся синтезу ДНК. Мухам давали 4-дневный пульс EdU, за которым следовала 3-дневная погоня. Это показало, что меченые клетки были жизнеспособными и выживали по крайней мере через 3 дня после пролиферации. К 7 дням в контрольном центральном мозге было в среднем 2 клетки EdU+ и в среднем 11 клеток EdU+ в поврежденном центральном мозге соответственно (рисунок 2E). Это похоже на результаты, полученные через 24 ч после травмы с использованием антитела PH3. Когда пролиферация клеток измеряется через 14 дней, неповрежденные контрольные группы в среднем составляли 1 клетку EdU+ на центральный мозг, в то время как поврежденный мозг в среднем составлял 29 клеток EdU+ (рисунок 2E), демонстрируя, что пролиферация клеток продолжается, по крайней мере, на второй неделе после PTBI.
Пролиферация клеток зависит от возраста
Наибольший пролиферативный ответ в центральном мозге наблюдался в течение первых 24 ч после эклозии (рисунок 3). Через 7 дней после эклозии проникающая травма все еще вызывает значительное увеличение пролиферации, в среднем 6 клеток PH3 + на центральный мозг. Тем не менее, через 14 дней после эклозии способность клеток делиться после PTBI значительно снижается до 1 делящейся клетки, аналогично способности контрольного мозга (рисунок 3). Таким образом, потенциал для пролиферации клеток после PTBI зависит от возраста.
Вновь созданные нейроны могут проецироваться на коррекцию целевых областей
Для оценки нейронной регенерации после PTBI использовалась система маркировки перма-близнецов15. Перма-близнецовая линия прослеживает постоянные метки делящихся клеток и их потомства зеленым флуоресцентным белком (GFP) или красным флуоресцентным белком (RFP)15. Через 2 дня и 2 недели в поврежденных образцах было обнаружено больше клонов перма-близнецов, чем в контрольной группе (рисунок 4A-E). Примечательно, что были новые нейроны грибного тела в ~ 50% мозга PTBI через 2 недели после травмы (рисунок 4N). Эти новые нейроны проецировали свои дендриты соответствующим образом на чашечку тела гриба, а их аксоны соответствующим образом на доли тела гриба (рисунок 4D, F, G). Это указывает на то, что вновь созданные клетки могут быть функциональными нейронами, участвующими в восстановлении поврежденных грибных тел. Другие области мозга, которые, по-видимому, регенерируют, включают эллипсоидное тело (EB) (рисунок 4H, I), антеннальные доли (AL) (рисунок 4J, K) и боковой рог (LH) (рисунок 4L, M), которые обладали большими клонами примерно в 26%, 26% и 20% случаев соответственно (рисунок 4N). Эти результаты подчеркивают полезность этой системы для исследования взрослого нейрогенеза. Предложенная модель последовательности событий, следующих за PTBI и приводящих к генерации новых нейронов, показана на рисунке 5.
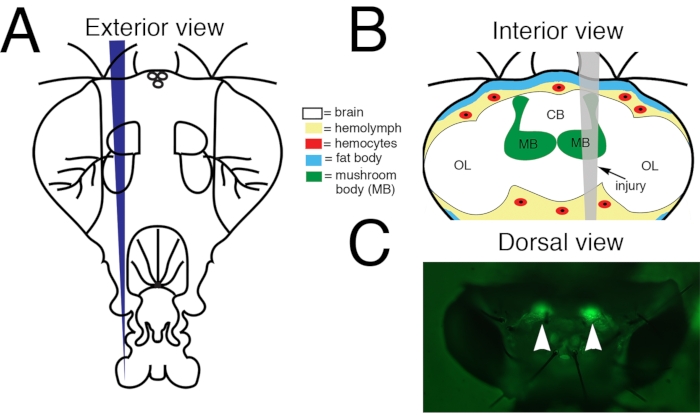
Рисунок 1: Проникающая черепно-мозговая травма (ПТБИ) в центральный мозг дрозофилы взрослого человека. (A) Схема внешней стороны головы взрослой мухи. Это фронтальный вид. Таким образом, правая сторона животного находится слева от зрителя. (B) Схема внутренней части головы взрослой дрозофилы с траекторией травмы, обозначенной серым цветом. Это задний вид. Таким образом, на этом изображении и последующих фигурах правая сторона мозга находится справа. Центральный мозг ПТБИ воздействует на несколько структур мозга, включая грибное тело (зеленый) и ткани вне мозга, включая жировое тело (синий) и гемоциты (красный). CB = центральная область мозга. OL= область зрительной доли. (C) Дорсальный вид живой взрослой головы, в которой грибные тела (наконечники стрел) помечены зеленым флуоресцентным белком (GFP). Это «стандартный генотип» (подробности см. в тексте). Протокол PTBI воспроизводимо приводит к повреждению грибных тел. Этот рисунок был адаптирован из Reference16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
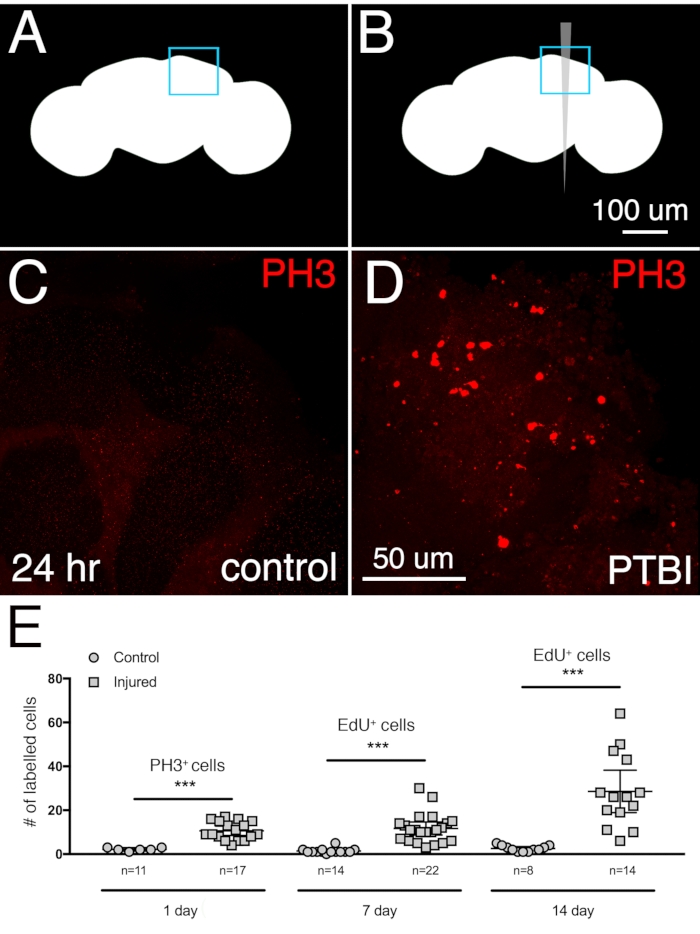
Рисунок 2: PTBI стимулирует пролиферацию клеток. Схемы неповрежденного контроля (A) и PTBI (B). Синие поля в правом верхнем углу указывают на области мозга, показанные при более высоком увеличении на панелях (C) и (D). (С,Г) Антитело PH3 (красное) использовалось для анализа пролиферации клеток через 24 ч после травмы. В контрольном мозге (C) мало клеток PH3+ и ни одна из них не приближается к МБ. Однако в мозге PTBI (D) есть клетки PH3 + вблизи MB. Е) Количественная оценка пролиферирующих клеток. Цифры отражают пролиферацию клеток во всем мозге, а не только в непосредственной близости от грибного тела. Через 24 ч у нетраненого контрольного мозга было в среднем 3 клетки PH3+ / мозг (n = 11 мозгов, 28 клеток), в то время как через 24 часа после PTBI мозг имел в среднем 11 клеток PH3 + / мозг (n = 17 мозгов, 181 клетка). Через 7 дней у неповрежденных контрольных групп было мало клеток EdU+, в среднем 2 клетки EdU+ / мозг (n = 15 мозгов, 24 клетки), в то время как 7-дневный мозг после PTBI имел в среднем 11 клеток EdU + / мозг (n = 22 мозга, 238 клеток). Через 14 дней нетравмированные контрольные группы имеют в среднем 1 EdU+ клетку / мозг (n = 8 мозгов, 11 клеток), в то время как 14-дневный мозг после PTBI имеет в среднем 29 клеток EdU + / мозг (n = 14 мозгов, 400 клеток). Для этого набора экспериментов использовали молодых взрослых мужчин в течение 6 ч эклозии. Непарные t-тесты контрольных образцов и образцов PTBI в 3-х временных точках дают значения p<0,0001, p<0,0001 и p<0,0002 соответственно. Полосы погрешностей отражают стандартное отклонение (SD). Этот рисунок был адаптирован из Reference16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
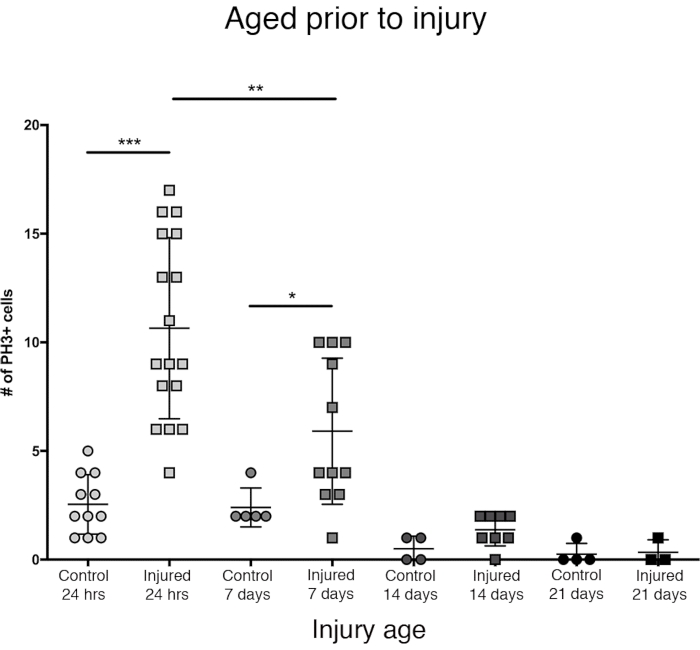
Рисунок 3: Пролиферативная реакция на ПТБИ уменьшается с возрастом. Чтобы выяснить, влияет ли возраст на количество пролиферации клеток, которая происходит после травмы, недавно эклозированных взрослых самцов сравнивали с животными в возрасте 7 дней, 14 дней и 28 дней до PTBI, используя анти-PH3 для анализа пролиферации клеток через 24 часа после травмы. Мухи, травмированные в течение 6 ч после эклозии, имели в среднем 11 клеток PH3+ / мозг (n = 17 мозгов, 182 клетки) по сравнению со средним показателем 3 КЛЕТОК PH3 + / мозг в контрольной группе, соответствующей возрасту (n = 11 мозгов, 28 клеток). Мухи в возрасте до 7 дней, а затем подвергшиеся ПТБИ, имели в среднем 6 клеток PH3+ / мозг (n = 11 мозгов, 65 клеток) по сравнению с возрастными контрольными группами со средним показателем 2 PH3 + клеток / мозг (n = 5 мозгов, 12 клеток). Когда мухи были в возрасте до 14 дней до PTBI и анализировали через 24 часа, было в среднем 1 клетка PH3 + / мозг (n = 8 мозгов, 11 клеток), похожих на контрольную группу, соответствующую возрасту, которая также в среднем составляла 1 клетку PH3 + / мозг (n = 4 мозга, 2 клетки). 28-дневный неповрежденный контроль (n = 4, 1 клетка) и PTBI (n = 3, 1 клетка) летают в среднем 0 PH3 + клетки / мозг. Непарные t-тесты для PTBI для контрольных сравнений в этих 4-х временных точках составляют p<0,0001, p<0,04, p<0,07 и p<0,84 соответственно. Этот рисунок был адаптирован из Reference16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
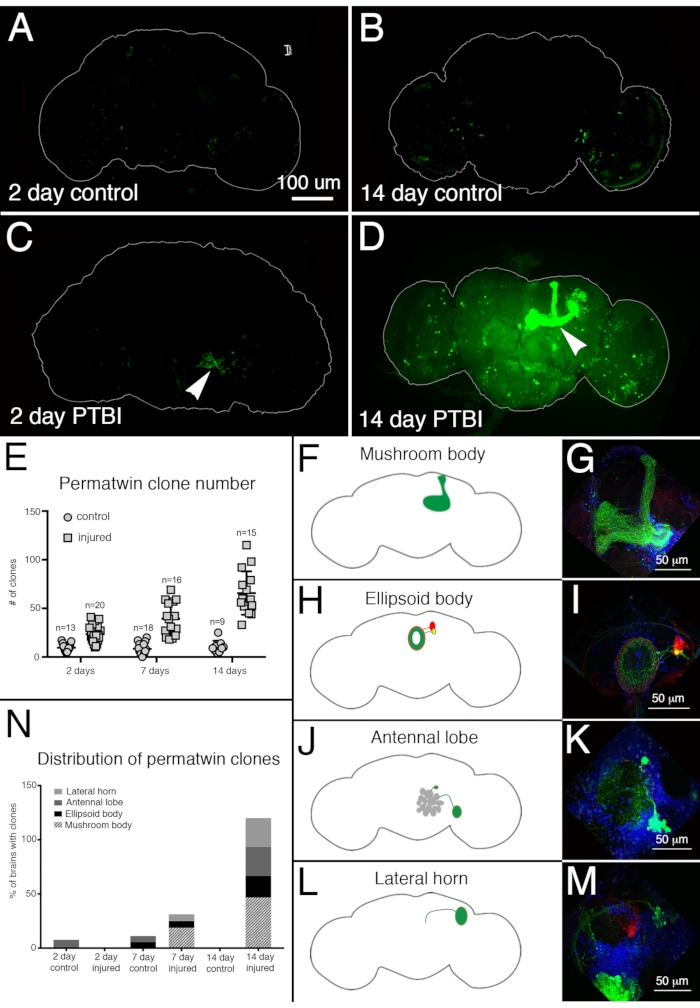
Рисунок 4: Трассировка линии перма-близнецов демонстрирует регенерацию мозга и соответствующее нацеливание на аксоны после PTBI. Система отслеживания линий perma-twin15 использовалась для анализа нейрогенеза после PTBI. Эта система постоянно маркирует делящиеся клетки и потомство зеленым флуоресцентным белком (GFP) или красным флуоресцентным белком (RFP). Мухи выращивались при температуре 17 °C, чтобы система не работала во время разработки. Самцы F1, несущие трансгены перма-близнецов, были собраны после эклозии, затем травмированы и помещены при 30 ° C для восстановления в течение 2 или 14 дней. (A) В 2-дневном невредимом контроле есть некоторые клетки GFP+, разбросанные по всему мозгу. (B) Через 14 дней в контрольном центральном мозге присутствует относительно мало клеток GFP+. (C) Для сравнения, 2-дневные поврежденные мозги имеют больше клеток GFP +, которые, как правило, группируются рядом с травмой (наконечник стрелы). (D) Через 14 дней после травмы вблизи места травмы появляются крупные клоны. Некоторые из этих клонов имеют аксоны, которые проецируются вдоль трактов тела гриба (наконечник стрелы). Здесь показан только канал GFP; в образцах PTBI были аналогичные клоны RFP+. (E) Количество клонов увеличивается со временем после PTBI.Контрольные неповрежденные мозги (n = 13) имеют в среднем 10 клонов через 2 дня, в то время как 2-дневные мозги PTBI (n = 20) имеют в среднем 23 клона (p<0,00002). Через 7 дней контрольный мозг имел в среднем 9 клонов на мозг (n = 18), в то время как 7-дневный мозг PTBI имел в среднем 39 клонов на мозг (n = 16) (p-значение<0,00000002). Это значительно больше, чем количество клонов, наблюдаемых через 2 дня после травмы (p-значение<0,0009). В 14-дневном контрольном мозге имеется в среднем 10 клонов на мозг, что существенно не отличается от 2-дневного и 7-дневного контроля. Тем не менее, через 14 дней после PTBI существует в среднем 66 клонов GFP +, что значительно больше, чем в контрольной группе, соответствующей возрасту (p<0,0000003), либо в 2-дневном мозге после PTBI (p-значение<0,0001). Полосы ошибок отражают SD. (F-M) PTBI стимулирует образование клонов в нескольких областях мозга. Панели с левой стороны представляют собой схемы областей мозга, где были обнаружены крупные клоны через 14 дней после PTBI (A, H, J, L). Панели справа показывают высокие увеличения репрезентативных мозгов (G, I, K, M). Многие 14-дневные мозги имели клоны, которые проецировались на определенные целевые области. К ним относятся грибное тело (MB) (F,G), эллипсоидное тело (EB) (H,I), антеннальная доля (AL) (J,K) и боковой рог (LH) (L,M). (N) Как число клонов, так и размер клона увеличиваются со временем после PTBI.Пропорции областей мозга с большими клонами были рассчитаны через 2, 7 и 14 дней в контрольной группе и поврежденном мозге. Через 2 дня ~ 8% контрольного мозга (n = 13) показали клоны AL, в то время как в 2-дневных поврежденных мозгах не было клонов AL (n = 20). В 7-дневном контрольном мозге (n = 18) у 6% был AL и у 6% были клоны EB. Через 7 дней после PTBI (n = 16) 6% мозгов также имели клоны AL, 6% имели клоны EB и 19% имели большие клоны MB. Через 14 дней контрольный мозг (n = 9) не демонстрировал каких-либо конкретных областей с клонами, в то время как 47% мозгов PTBI (n = 15) имели клоны MB, 20% мозгов PTBI имели клоны AL, а 27% мозгов PTBI имели клоны EB, а 27% имели клоны LH. Этот рисунок был адаптирован из Reference16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
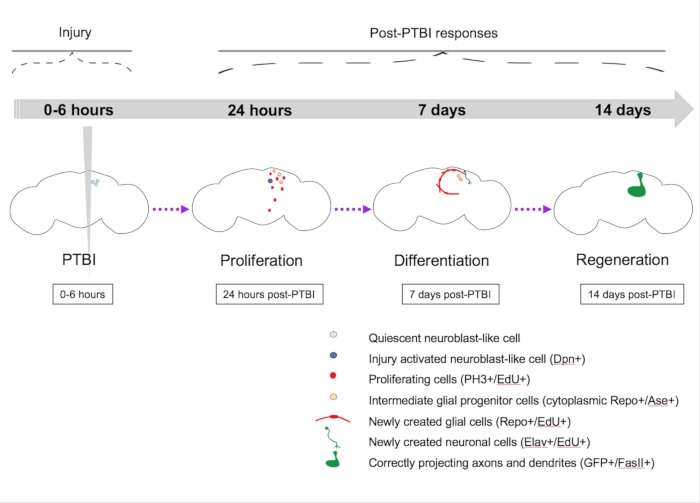
Рисунок 5: Сводная модель регенерации после проникающей черепно-мозговой травмы (ПТБИ). У молодых взрослых дрозофил есть покоящиеся нейробластоподобные клетки в центральном мозге, которым не хватает экспрессии канонических генов нейробластов. К 24 часам после PTBI покоящиеся нейробластоподобные клетки активируются, экспрессируют гены нейробластов и начинают размножаться. Как через 4 ч, так и через 24 ч после PTBI наблюдается волна гибели клеток16. Через 7 дней скорость пролиферации все еще высока, и многие из новых клеток приняли идентичность зрелых клеток, став нейронами или глией. Через 14 дней после PTBI большие клоны новых нейронов с аксонами и дендритами правильно проецируются в соответствующие целевые области. Локомоторные дефекты также восстанавливаются к 14 дням, предполагая, что взрослая дрозофила может регенерировать функционально и структурно. Этот рисунок был адаптирован из Reference16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Хотя проникающие повреждения мозга взрослых дрозофил были описаны ранее15,17,18, эти травмы были сосредоточены на зрительных долях, а не на центральном мозге. Кроме того, подробные инструкции о том, как проводить травмы, до сих пор отсутствуют. Этот протокол описывает модель проникающего повреждения центрального мозга взрослой дрозофилы, которая воспроизводит статистически значимые доказательства нейрогенеза взрослых после PTBI.
Воспроизводимость этого протокола PTBI частично обусловлена телом гриба как целевой областью повреждения. Тело гриба большое, состоящее из ~2200 нейронов со сложными дендрритными и аксонными беседками в больших и сильно стереотипных массивах18. Клеточные тела нейронов грибного тела лежат вблизи поверхности мозга и могут быть визуализированы через головную кутикулу с использованием экспрессии зеленого флуоресцентного белка (GFP) (рисунок 1C). Предшественники грибного тела являются последними нервными стволовыми клетками, подвергшимися апоптозу во время развития13,12,19. Таким образом, многие нейроны грибного тела довольно молоды на момент эклозии. Это привело к гипотезе о том, что грибное тело может иметь больший митотический потенциал, чем другие области мозга16. Кроме того, грибное тело имеет решающее значение для обучения и памяти18. Это позволяет задаться вопросом, приводит ли нейрогенез, вызванный PTBI, к функциональному восстановлению.
Другие факторы, которые способствуют воспроизводимости результатов, включают использование скрещенных мух с последовательными генотипами, выполнение скрещиваний в одном и том же направлении каждый раз, точный контроль температур выращивания и старения и анализ самцов и самок отдельно. Использование мух F1 из ауткросса снижает вероятность гомозиготного анализа мозга на предмет спонтанных мутаций. Стандартный крест y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL4 взрослых самок к y[1] w[1] взрослым самцам мух приводит к F1 потомству генотипа y[1] w[1]; UAS-mCD8-GFP/+;; OK107-GAL4/+. OK107-GAL4 экспрессируется во всех внутренних нейронах тела гриба и управляет экспрессией мембранно-связанного репортера UAS-mCD8-GFP, позволяя визуализировать грибные тела и их проекции. Для перма-близнецовых крестов кресты должны постоянно оставаться при 17 °C, чтобы система отслеживания линий была отключена. Это гарантирует, что во время развития не будут помечены делящиеся клетки и что будут помечены только взрослые нейроны и глия. С этой целью летное отделение также может поддерживаться при температуре 17 °C. Хотя первоначальное описание системы perma-twin15 рекомендовало взращивать мух при 18 °C, это может привести к значительной фоновой маркировке.
Для согласованности также рекомендуется держать контроль неповрежденных мух на площадке CO2 , когда один выполняет PTBI. Это гарантирует, что оба набора мух имеют одинаковую анестезирующую экспозицию. Кроме того, желательно для воспроизводимости полностью проникнуть в голову. Тем не менее, необходимо соблюдать осторожность, чтобы не согнуть кончик штифта против колодки, что сделает его непригодным для будущих травм. Для опытных практиков существует небольшой непреднамеренный вред для мух PTBI. Тем не менее, слишком сильное давление на грудную клетку, чтобы стабилизировать муху во время травмы, может быть смертельным. Одним из способов оценки степени непреднамеренной травмы является количественная оценка смертности мух PTBI через 24 часа после травмы. Для односторонне травмированных мух это может быть 50% и выше для начинающих. Поэтому, чтобы гарантировать, что наблюдаемые результаты связаны с PTBI, а не с непреднамеренной травмой, рекомендуется, чтобы новички практиковали введение PTBI на ~ 20 мух ежедневно в течение нескольких недель и не анализировали полученный мозг до тех пор, пока 24-часовая смертность не будет последовательно <10%.
Для количественной оценки количества пролиферации, стимулируемой центральным ПТБИ головного мозга, можно использовать как иммуноокрашивание антифосфогистона H3 (PH3), так и включение 5-этинил-2'-дезоксиуридина (EdU). Anti-PH3 маркирует клетки до и на протяжении всей метафазы, ограничивая обнаружение только частью активно делящихся клеток. Таким образом, окрашивание анти-PH3 обеспечивает лишь частичное проблеск пролиферации. EdU является аналогом тимидина, который может быть включен во вновь синтезированную ДНК. Кормя мух EdU до и после травмы, можно получить более полную картину клеток, которые либо делятся, либо разделились после травмы. Тот факт, что любые клетки, которые делятся, постоянно маркируются, полезен как для идентификации медленно циклических клеток, так и для анализа выживаемости клеток после первоначальной пролиферации. По неясным причинам, но, возможно, из-за ограниченной проницаемости гематоэнцефалического барьера, маркировка EdU неэффективна и недостаточно сообщает о пролиферации клеток во взрослом мозге. Об этом свидетельствует сходное количество клеток PH3+ и EdU+ как в контрольном, так и в экспериментальном мозге через 24 ч после PTBI и наблюдение, что только подмножество новых клеток в клонах перма-близнецов включает EdU16. Для максимальной маркировки важно предварительно кормить мух EdU, потому что травмированные мухи не возобновляют кормление в течение нескольких часов после PTBI. Кормление оценивали путем добавления пищевого красителя в раствор EdU и мониторинга количества красителя в кишечнике через брюшную кутикулу16.
Следует отметить, что, хотя мы предоставили протокол вскрытия мозга на этапе 4, могут быть использованы альтернативные методы. Некоторые из них доступны в ранее опубликованных протоколах20,21,22. Drosophila melanogaster предлагает недорогую модель с мощными генетическими и молекулярными инструментами, которые могут быть использованы для изучения механизмов, лежащих в основе регенерации нескольких тканей, включая кишечник и компоненты нервной системы. Здесь изложена новая и воспроизводимая модель травмы, которая может быть использована для изучения реакции на черепно-мозговую травму. Данные, полученные с использованием этих протоколов, подтверждают идею о том, что центральный мозг взрослой дрозофилы сохраняет пролиферативную способность, генерируя новые нейроны в ответ на травму. Эти наблюдения требуют дальнейшего изучения как степени взрослого нейрогенеза, так и лежащих в его основе молекулярных механизмов. Как только компоненты, участвующие в нейронной регенерации, будут идентифицированы в этой системе, мы сможем преобразовать наши знания о нейрогенезе взрослых дрозофилы к людям.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы благодарны Стейси Римкус и Бекки Катценбергер за техническую помощь и Эдуардо Морено за совместное использование акций перма-близнецов. Мы хотели бы поблагодарить Барри Ганецки и Дэвида Вассармана за оживленные дискуссии, которые, несомненно, улучшили науку, а также Кента Мока, Кайлу Герру и Бейли Шпигельберга за их вклад в лабораторию. Антитела FasII были разработаны Кори Гудманом и получены из Банка исследований развития hybridoma, созданного NICHD NIH и поддерживаемого в Университете Айовы, Департамент биологии, Айова-Сити, IA 52242. Большинство штаммов дрозофилы , используемых в этом исследовании, были получены из Bloomington Drosophila Stock Center (BDSC; NIH P40OD018537). Эта работа была поддержана NIH T32 GM007133 (KLC); NIH NS090190 (GBF); NIH NS102698 (GBF); Высшая школа Висконсинского университета (GBF); и Институт лидерства женщин в науке и технике UW-Madison (WISELI) (GBF).
Материалы
| Name | Company | Catalog Number | Comments |
| #11 disposable scalpels | Santa Cruz Biotechnology | sc-395923 | used for separating Drosophila heads from trunks prior to brain dissection |
| 150 mm diameter black Sylgard dishes | Dow | 1696157 | made in the laboratory with reagents from Dow; used for brain dissection |
| 18 mm coverslips | any | for mounting brains on microscope slides | |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | ThermoFisher | D1306 | for immunohistochemistry |
| 70% Ethanol | made from 95% ethanol sourced variously | ||
| anti-mouse Cy5 | Jackson ImmunoResearch | 715-175-151 | for immunohistochemistry |
| anti-rabbit 568 | ThermoFisher | A11036 | for immunohistochemistry |
| bovine serum albumin (BSA) | SIgma Aldrich | A7030 | for immunohistochemisty |
| Clear nail polish | any | for sealing coverslips | |
| Click-It EdU labeling kit | InVitrogen | C10640 | to detect newly synthesized DNA |
| CO2 bubbler | Genesee Scientific | 59-181 | for anesthesia |
| CO2 pad | Genesee Scientific | 59-114 | for anesthesia |
| CO2 regulator and supply | any | for anesthesia | |
| Confocal microscope | any | for imaging fixed, stained and mounted brains | |
| cotton plugs | Genesee Scientific | 51-101 | for EdU labeling |
| Drosophila vials | Genesee Scientific | 32-109 | for EdU labeling |
| Fix buffer (Pipes, EGTA, Magnesium; PEM) | components sourced from various companies | for fixing adult brains; 100 mM piperazine-N,N’-bis(2-ethanesulfonic acid) [PIPES], 1 mM EGTA, 1 mM MgSO4, pH 7.0 | |
| Formaldehyde | Sigma Aldrich | 252549 | for fixing adult brains, added to PEM |
| Grade 3 round Whatman filters, 23 mm round | Tisch Scientific | 1003-323 | for EdU labeling |
| Microfuge tubes | any | for fixing and staining reactions and for storing Minutien pins | |
| Microscope slides | any | for mounting brains | |
| Minutien pins | Fine Science Tools | 26002-10 | for brain injury; 12.5 μm diameter tip and 100 μm diameter rod |
| mouse anti-Fasiclin II | Developmental Studies Hybridoma Bank | 1D4-s | for immunohistochemistry |
| NIGHTSEA stereo microscope fluorescence adaptor | Electron Microscopy Sciences | SFA-GR | fluorescence setup for dissecting microscope |
| P20, P200 and P1000 pipettors and tips | any | for measuring solutions | |
| phosphate buffered saliine (PBS) | components sourced from various companies | for dissecting brains and making immunohistochemistry blocking and washing solutions; 100 mM of K2HPO4, 140 mM of NaCl, pH 7.0 | |
| phosphate buffered saline with 0.1% Triton X-100 (PT) | components sourced from various companies | for washing dissected brains | |
| phosphate buffered saline with 0.1% Triton X-100 + 2% bovine serum albumin (PBT) | components sourced from various companies | blocking solution for immunohistochemistry and for diluting antibodies | |
| rabbit anti-PH3 | Santa Cruz Biotechnology, Inc | sc-8656-R | for immunohistochemistry |
| Reinforcement labels | Avery | 5721 | to maintain space between the microscope slide and the coverslip |
| Size 0 paintbrushes | any | to manipulate and stabilize adult Drosophila during injury | |
| Triton X-100 | Sigma Aldrich | 93443 | |
| Two pair of #5 watchmakers forceps | Fine Science Tools | 11255-20 | used to hold the Minutien pins and for brain dissections |
| Vectashield | Vector Laboratories | H-1000 | mounting medium for microscope slides |
Ссылки
- Thurman, D., et al. Report to Congress: Traumatic brain injury in the United States. , Available from: https://www.cdc.gov/traumaticbraininjury/pubs/tbi_report_to_congress.html (1999).
- NIEHS. , Available from: https://www.nih.gov/research/supported/health/neurodegenerative/index.cfm (2021).
- Morton, N. V., Wehman, P. Psychosocial and emotional sequelae of individuals with traumatic brain injury: A literature review and recommendations. Brain Injury. 9 (1), 81-92 (2017).
- Bonini, N. M., Berger, S. L. The sustained impact of model organisms-in genetics and epigenetics. Genetics. 205, 1-4 (2017).
- Brace, E. J., DiAntonio, A. Models of axon regeneration in Drosophila. Experimental Neurology. 287, Pt 3 310-317 (2017).
- Hao, Y., Collins, C. Intrinsic mechanisms for axon regeneration: insights from injured axons in Drosophila. Current Opinion in Genetics & Development. 44, 84-91 (2017).
- Chiang, A. S., et al. Three-dimensional reconstruction of brain-wide wiring networks in Drosophila at single-cell resolution. Current Biology. 21 (1), 1-11 (2011).
- Meinertzhagen, I. A. The organisation of invertebrate brains: cells, synapses and circuits. Acta Zoologica. 91 (1), 64-71 (2010).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: A history lesson for the future. Nature Reviews Neuroscience. 11 (7), 514-522 (2010).
- Lessing, D., Bonini, N. M. Maintaining the brain: insight into human neurodegeneration from Drosophila melanogaster mutants. Nature Reviews Genetics. 10 (6), 359-370 (2009).
- Boone, J. Q., Doe, C. Q. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells. Developmental Neurobiology. 68 (9), 1185-1195 (2008).
- Ito, K., Hotta, Y. Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster. Developmental Biology. 149 (1), 134-148 (1992).
- Siegrist, S. E., Haque, N. S., Chen, C. H., Hay, B. A., Hariharan, I. K. Inactivation of both Foxo and reaper promotes long-term adult neurogenesis in Drosophila. Current Biology. 20 (7), 643-648 (2010).
- von Trotha, J. W., Egger, B., Brand, A. H. Cell proliferation in the Drosophila adult brain revealed by clonal analysis and bromodeoxyuridine labelling. Neural Development. 4, 9(2009).
- Fernandez-Hernandez, I., Rhiner, C., Moreno, E. Adult neurogenesis in Drosophila. Cell Reports. 3 (6), 1857-1865 (2013).
- Crocker, K. L., et al. Neurogenesis in the adult Drosophila brain. Genetics. , (2021).
- Plavicki, J., Mader, S., Pueschel, E., Peebles, P., Boekhoff-Falk, G. Homeobox gene distal-less is required for neuronal differentiation and neurite outgrowth in the Drosophila olfactory system. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1578-1583 (2012).
- Aso, Y. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Ito, K., Awano, W., Suzuki, K., Hiromi, Y., Yamamoto, D. The Drosophila mushroom body is a quadruple structure of clonal units each of which contains a virtually identical set of neurones and glial cells. Development. 124 (4), 761-771 (1997).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A. Simple one-step dissection protocol for whole-mount preparation of adult Drosophila brains. Journal of Visualized Experiments. (118), e55128(2016).
- Kelly, S. M., Elchert, A., Kahl, M. Dissection and immunofluorescent staining of mushroom body and photoreceptor neurons in adult Drosophila melanogaster brains. Journal of Visualized Experiments. (129), e56174(2017).
- Arain, U., Valentino, P., Islam, I. M., Erclik, T. Dissection, immunohistochemistry and mounting of larval and adult Drosophila brains for optic lobe visualization. Journal of Visualized Experiments. (170), e61273(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены