Method Article
Estimulando e analisando neurogênese adulta no cérebro central de Drosophila
Neste Artigo
Resumo
Este artigo fornece protocolos detalhados para infligir Lesão Cerebral Traumática Penetrante (PTBI) à Drosophila adulta e examinar a neurogênese resultante.
Resumo
Os mecanismos moleculares e celulares subjacentes à neurogênese em resposta a doenças ou lesões não são bem compreendidos. No entanto, compreender esses mecanismos é crucial para o desenvolvimento de terapias regenerativas neurais. Drosophila melanogaster é um modelo líder para estudos de desenvolvimento neural, mas historicamente não tem sido explorado para investigar a regeneração cerebral adulta. Isso ocorre principalmente porque o cérebro adulto exibe atividade mitótica muito baixa. No entanto, a penetração da lesão cerebral traumática (PTBI) no cérebro central de Drosophila adulto desencadeia a geração de novos neurônios e nova glia. As poderosas ferramentas genéticas disponíveis em Drosophila combinadas com o simples, mas rigoroso protocolo de lesão descrito aqui agora fazem do cérebro de Drosophila adulto um modelo robusto para a pesquisa de regeneração neural. Desde que aqui estão instruções detalhadas para (1) lesões penetrantes no cérebro central adulto e (2) dissecção, imunohistoquímica e imagem pós-lesão. Esses protocolos produzem resultados altamente reprodutíveis e facilitarão estudos adicionais para dissecar mecanismos subjacentes à regeneração neural.
Introdução
Danos no cérebro e no sistema nervoso são uma das principais causas de morte e incapacidade em todo o mundo. Cerca de 1,5 milhão de americanos sofrem lesões cerebrais traumáticas (TCE) todos os anos1, enquanto estima-se que 6 milhões de indivíduos só nos Estados Unidos sofrem de doenças neurodegenerativas, como Parkinson e Doença de Alzheimer2. Tanto a doença quanto a lesão no cérebro podem causar degeneração neural, levando a defeitos sensoriais, cognitivos e motores3. Desenvolver estratégias terapêuticas para reparação cerebral humana tem sido difícil devido à complexa fisiologia do cérebro. Organismos modelo como o Drosophila melanogaster fornecem um sistema simples para identificar os mecanismos fundamentais subjacentes à neurodegeneração e potenciais alvos terapêuticos4.
A mosca-das-frutas Drosophila melanogaster tem sido um poderoso organismo modelo por mais de um século, avançando nos campos da genética, biologia do desenvolvimento e neurociência5,6. O cérebro de Drosophila compreende apenas ~90.000 neurônios7, um milhão de vezes menos do que o cérebro humano médio8, mas eles têm muitas semelhanças. Tanto cérebros humanos quanto moscas utilizam os neurotransmissores GABA, glutamato, acetilcolina, e as aminas biogênicas dopamina e serotonina9. Drosophila e neurônios humanos também funcionam da mesma forma, com uma arquitetura sináptica compartilhada e tipos de células neurais análogas10. O menor tamanho cerebral de Drosophila e a disponibilidade de técnicas genéticas avançadas, em combinação com a conservação de mecanismos moleculares, celulares e fisiológicos entre drosophila e mamíferos, permite que os pesquisadores de Drosophila façam perguntas impraticáveis ou difíceis de responder em modelos mamíferos.
Nosso entendimento atual da neurogênese adulta em Drosophila, tanto durante a homeostase quanto após a lesão, permanece limitado. Mais se sabe sobre neurogênese durante o desenvolvimento normal. Por exemplo, neurônios e glia são criados durante o desenvolvimento a partir de células precursoras, chamados neuroblastos10,11. Pelo menos três tipos diferentes de neuroblastos foram distinguidos no cérebro central. Tanto os neuroblastos de linhagem tipo I quanto tipo II saem do ciclo celular ~20-30 h após a formação do puparium12. Em contraste, os neuroblastos do corpo do cogumelo são os últimos a encerrar a divisão celular e fazê-lo através da apoptose dependente do Ceifador ~85-90 h após a formação do puparium13. Após a eclosão, o cérebro de Drosophila adulto tem poucas células divisórias (~1 célula/cérebro), predominantemente glia14. Os lobos ópticos adultos possuem neuroblastos de ciclismo lento capazes de neurogênese15, enquanto o cérebro central adulto não tem neuroblastos conhecidos. A escassez de progenitores neurais e a proliferação celular limitada se assemelha fortemente à situação no cérebro adulto dos mamíferos, ressaltando a relevância potencial dos mecanismos da neurogênese adulta em Drosophila para os seres humanos.
A descoberta de baixos níveis de neurogênese adulta nos lobos ópticos de Drosophila adultos após lesões15 levou à hipótese de que o cérebro central de Drosophila adulto também poderia ser capaz de neurogênese adulta16. Este protocolo descreve a criação de um modelo rigoroso e reprodutível de lesão cerebral central em Drosophila adulto que pode ser usado para investigar neurogênese no cérebro central adulto. Dadas as semelhanças entre a arquitetura e a função cerebral humana e drosophila , essas descobertas podem levar à identificação de alvos críticos para neurogênese terapêutica em cérebros humanos feridos e doentes.
Protocolo
Este protocolo segue as diretrizes de cuidados com animais da UW-Madison.
1. Gerando Drosophila adulto para TCE
- Para a cruz padrão, coloque 20 virgens y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL417 fêmeas adultas e 10 y[1] w[1]17 machos adultos voam juntos em frascos (ver Tabela de Materiais) contendo alimentos. Para ter um grande número de descendentes síncronsos, configure 10-20 cruzes ao mesmo tempo. O cruzado padrão dá origem à prole da F-1 do genótipo: y[1] w[1]; UAS-mCD8-GFP/+;; OK107-GAL4/+.
- Coloque os frascos a 25 °C para acasalamento e colocação de ovos. Para maximizar a prole, transfira os pais para novos frascos a cada 2-4 dias, mantendo os frascos anteriores a 25 °C. Descarte cada frasco 18 dias após os pais serem colocados nele pela primeira vez para garantir que não haja prole F2.
NOTA: 3 conjuntos de descendentes ("ninhadas") podem ser gerados a partir de cada conjunto de pais. - Verifique após ~10 dias, quando a prole da F-1 começará a se escoar.
- Coloque os frascos a 25 °C para acasalamento e colocação de ovos. Para maximizar a prole, transfira os pais para novos frascos a cada 2-4 dias, mantendo os frascos anteriores a 25 °C. Descarte cada frasco 18 dias após os pais serem colocados nele pela primeira vez para garantir que não haja prole F2.
- Para estudos de linhagem, use F1 perma-twin males15 de genótipo: w; FRT40A, UAS-CD2-RFP, UAS-GFP-Mir/FRT40A, UAS-CD8-GFP, UAS-CD2-Mir; banheira-GAL80ts/act-GAL4 UAS-flp. Para consistência, faça essa cruz na mesma direção cada vez.
- Para gerar machos perma-gêmeos, coloque 20 virgens w; FRT40A, UAS-CD2-RFP, UAS-GFP-Mir; banheira-GAL80ts/TM6B fêmeas e 10 w; FRT40A, UAS-CD8-GFP, UAS-CD2-Mir; act-GAL4 UAS-flp/TM6B15 machos adultos juntos em frascos contendo alimentos.
- Coloque os frascos a 17 °C para acasalamento e colocação de ovos. Transfira os pais para frascos de novos alimentos a cada 7 dias, mantendo todos os frascos a 17 °C. Descarte cada frasco 35 dias após os pais serem colocados nele pela primeira vez para garantir que não haja prole F2.
- Verifique após ~21 dias, quando a prole da F-1 começará a se escoar.
2. Lesão cerebral traumática penetrante (PTBI; Figura 1)
- Classificar moscas recém-fechadas da F1. Selecione machos jovens dentro de 6 h após a eclosão. Coloque esses machos em frascos limpos contendo alimentos, com 40 ou menos moscas por frasco.
NOTA: Isso é mais facilmente realizado no meio da manhã, anestesiando moscas na almofada de CO2 e identificando machos adultos que ainda têm mecônio (visível como uma mancha escura esverdeada através da parede abdominal) em suas entranhas. - Pré-alimentação com 5-ethynyl-2'-desoxyuridina (EdU) (ver Tabela de Materiais) por 6 h antes da lesão se planeja rotular células divisórias com EdU. Veja o passo 3 para obter detalhes.
- Higienize os pinos Minutien (ver Tabela de Materiais) por pelo menos 5 min, colocando ~100 pinos em um tubo de microcentrifuuge de 1,5 mL cheio com 70% de etanol.
- Higienize o co2 pad e um pincel pulverizando 70% de etanol e limpe com um tecido limpo sem fiapos. Uma vez que as ferramentas estejam limpas e secas, transfira 40 ou menos machos de F1 classificados de volta para a almofada limpa.
- Separe os machos de F1 em 2 grupos na plataforma. Um grupo servirá como um controle, moscas não feridas. O segundo grupo experimental será submetido ao PTBI.
- Usando fórceps, puxe 4-5 novos pinos Minutien para fora do tubo de microcentrifuuge e coloque-os perto da borda da almofada de CO2 . Sob o escopo de dissecação, escolha um pino minutien reto com um ponto afiado.
NOTA: O uso de um único pino Minutien para um experimento reduzirá a variabilidade. Reutilize pinos afiados. Coloque pinos danificados ou sem corte em um tubo de microcentrifus de 1,5 mL separado contendo 70% de etanol para descarte seguro. - Se trabalhar com moscas da cruz padrão, ligue a lâmpada de diodo emissor de luz de microscópio estéreo (LED) equipada com os filtros de excitação e emissão adequados para proteína de fluorescência verde (GFP). Isso permite a excitação em 440-460 nM e permite visualização de 500-560 nM.
NOTA: Com esta lâmpada e conjunto de filtros, os corpos celulares do corpo do cogumelo fluorescem verde através da cutícula da cabeça (Figura 1C). Para moscas ou moscas perma-twin de outros genótipos, um iluminador de luz branca padrão para o microscópio estéreo pode ser usado para visualizar marcos na cutícula da cabeça para direcionar a lesão ao corpo do cogumelo (Figura 1C). - Use os fórceps para pegar e segurar o pino Minutien selecionado em uma mão (para pessoas destras, esta é geralmente a mão direita) e o pincel na outra (geralmente esquerda). Escolha uma mosca do grupo experimental e posicione a mosca de tal forma que você tenha uma visão dorsal da cápsula da cabeça com a cabeça da mosca para a direita. Coloque o pincel no anterior do tórax dorsal e empurre suavemente para baixo para estabilizar a mosca.
- Aponte a ponta do pino Minutien para os corpos celulares do corpo do cogumelo no lado direito da cabeça e penetre a cápsula da cabeça. Se usar pontos de referência, direja a cutícula dorsal da cabeça entre o ocelli e a borda dorsal do olho (Figura 1).
- Após completar a lesão, use o pincel para empurrar a cabeça suavemente para fora do pino Minutien.
- Se usar o cérebro para RNA-Seq ou qRT-PCR, faça uma segunda lesão no lado esquerdo da cabeça.
- Repita os passos 2.8-2.10 para ferir todas as moscas do grupo experimental.
- Uma vez que todas as moscas tenham sido feridas, coloque o controle e as moscas feridas em frascos rotulados e separados contendo comida. Coloque os frascos horizontalmente (ou seja, em seus lados) enquanto as moscas se recuperam da anestesia e durante o envelhecimento subsequente para evitar que as moscas se enloucoram na comida.
- Coloque moscas transversais padrão a 25 °C, e perma-twin voa a 30 °C para envelhecer.
- Para moscas com idade superior a 24 horas, coloque-as em alimentos limpos a cada 1-2 dias.
3. Rotulagem edu
- Prepare um estoque de 10 mM 5-ethynyl-2'-desoxyuridina (EdU) em sulfoxida de dimetil (DMSO). Isso pode ser armazenado a -20 °C por até 12 meses.
- Prepare 200 μL de 50 μM EdU em 10% de sacarose. O pré-feed voa com EdU por 6 h antes do PTBI.
- Coloque 200 μL de 50 μM EdU em 10% de sacarose em um papel filtro redondo de 23 mm (ver Tabela de Materiais) em um frasco vazio.
- Coloque as moscas no frasco. Em seguida, sele o frasco com um plugue de algodão.
- Coloque o frasco horizontalmente em uma incubadora umidificada a 25 °C por 6 h.
- Realizar PTBI conforme descrito nas etapas 2.3-2.10.
- Coloque as moscas de volta no frasco contendo EdU. Sele o frasco com um plugue de algodão.
- Coloque o frasco horizontalmente em uma incubadora umidificada a 25 °C por até 24 h. Siga um dos passos descritos abaixo (passo 3.8.1-3.8.3).
- Dissecar e corrigir cérebros conforme descrito na etapa 4 usando tampão de lavagem e tampão de bloqueio sem azida e com a reação de detecção da EdU realizada antes da coloração de anticorpos.
- Transfira as moscas para um frasco limpo contendo um novo papel filtro e 200 μL de 50 μM EdU em 10% de sacarose. Coloque o frasco horizontalmente em uma incubadora de 25 °C. Repita a cada 24 horas durante a duração da rotulagem. Em seguida, dissecar e corrigir cérebros como descrito na etapa 4 usando tampões sem azida com a reação de detecção da EdU realizada antes da coloração de anticorpos.
- Para o rótulo de perseguição de pulso com EdU, alimente edu para o período de pulso, transfira as moscas a cada 24 horas para um frasco limpo contendo um novo papel filtro e 200 μL de 50 μM em 10% de sacarose. Após o período de pulso (por exemplo, 4 dias), transfira as moscas para um frasco contendo alimentos padrão de Drosophila. Coloque o frasco de lado em uma incubadora de 25 °C por mais 3 dias. Em seguida, dissecar e corrigir cérebros como descrito na etapa 4 usando tampões sem azida com a reação de detecção da EdU realizada antes da coloração de anticorpos.
4. Dissecção, imunohistoquímica e montagem
- Prepare tubos de microcentrifuuge de 1,5 mL com 100 μL de fixação: 4% formaldeído em PEM (100 mM piperazine-N,N'-bis(2-ácido evolulfônico) [PIPES], 1 mM EGTA, 1 mM MgSO4, pH 7.0) (ver Tabela de Materiais) e coloque no gelo.
NOTA: Até 20 cérebros de um único genótipo e condição podem ser processados em um único tubo. - Prepare uma placa de dissecção com uma pequena piscina (~100 μL) de 70% de etanol e três pequenas piscinas de soro fisiológico tamponado de fosfato (PBS; 100 mM de K2HPO4, 140 mM de NaCl, pH 7.0).
- Anesthetize ~10 controle ou moscas experimentais em uma almofada de CO2 que foi higienizada com 70% de etanol.
- Separe a cabeça do tronco de cada mosca usando um bisturi.
- Recolhe as cabeças com um pincel molhado em 70% de etanol e coloque cabeças por 2-5 min na piscina de etanol na placa de dissecção.
NOTA: Isso desidrata ligeiramente os cérebros e os torna mais fáceis de dissecar longe da cutícula da cabeça. - Transfira as cabeças para uma piscina de ~100 μL de PBS e disseca os cérebros, movendo cada cérebro para uma piscina limpa de ~100 μL de PBS. Execute isso usando dois pares de relojoeiros fórceps para abrir a parte de trás da cutícula da cabeça e segurando a cutícula com um par de fórceps enquanto gentilmente tira o cérebro da cutícula usando a ponta fechada do segundo par de fórceps.
- Transfira os cérebros dissecados para um tubo de microcentrifuuge contendo 100 μL da solução de fixação usando um pipettor P200 equipado com uma ponta plástica que foi cortada e chanfrada para permitir a entrada do cérebro.
- Fixar por 20-25 min em temperatura ambiente. Remova cuidadosamente a correção com um P200 ou uma pipeta de vidro.
- Lave os cérebros fixos quatro vezes com 1 mL de 'PT' (PBS mais 0,1% Triton X-100), permitindo que os cérebros se contentem por vários minutos entre cada lavagem.
NOTA: Se os cérebros não se estabelecerem rapidamente entre as lavagens, é provável que ainda tenham corpo gordo e/ou traqueia ligados. - Bloqueie amostras em 1 mL de PBS mais Triton X-100 e 2% de albumina de soro bovino (PBT) por ~1 h em temperatura ambiente.
- Remova a solução de bloqueio e incuba amostras com 100 μL de solução de anticorpos primários durante a noite a 4 °C em PBT. Os anticorpos primários utilizados neste estudo são o coelhinho anti-PH3 (1:500) e o anti-Fasiclin II (1:20) (ver Tabela de Materiais).
- Lave amostras cinco vezes com 1 mL de PT, permitindo que os cérebros se contentem por vários minutos entre cada lavagem.
- Remova a lavagem final e incuba em 100 μL de solução de anticorpos secundários durante a noite a 4 °C. Os anticorpos secundários utilizados aqui são o anti-coelho 568 (1:400) e o anti-rato Cy5 (1:100) (ver Tabela de Materiais).
- Lave amostras cinco vezes com 1 mL de PT, permitindo que os cérebros se contentem por vários minutos entre cada lavagem. Durante a lavagem final, adicione 4',6-Diamidino-2-Phenylindole, Dihidrochlorida (DAPI; 1:100 de uma solução de 10 μM) por 10 minutos para manchar os núcleos. Retire a lavagem, deixando 50-100 μL em cada tubo.
- Prepare slides de microscópio colocando uma etiqueta de reforço autoadesiva única no meio de cada slide e uma gota de 50 μL de mídia de montagem anti-fade no centro de cada rótulo (ver Tabela de Materiais). O rótulo de reforço mantém a tampa ligeiramente acima dos slides e evita que os cérebros montados fiquem excessivamente achatados.
- Transfira cuidadosamente os cérebros de cada tubo de microcentrifuuge para um slide preparado com o mínimo de tampão de lavagem possível usando um P200 equipado com uma ponta de plástico cortada e chanfrada. Até 10 cérebros podem ser montados em um único slide.
- Use fórceps para reposicionar suavemente os cérebros antes de colocar uma mancha em cada slide e selar o slide com esmalte. Oriente os cérebros com lado posterior para cima ou lado anterior para cima, mas não deve estar se tocando.
NOTA: Como é difícil obter imagens confocal de alta qualidade através de um cérebro inteiro, alguns cérebros devem ser montados em cada orientação. - Armazene os slides preparados plano e no escuro a 4 °C até a imagem. Para armazenamento a longo prazo (até 1 ano), os slides podem ser armazenados a -20 °C.
5. Imagem confocal
NOTA: Cérebros de imagem usando um microscópio confocal de varredura a laser com lasers de excitação e cubos de filtro de emissão apropriados ao DAPI e aos anticorpos secundários fluorescentes (ou seja, 405 nm, 488 nm e 568 nm, 633 nm, respectivamente).
- Ligue a potência do microscópio, lasers, controlador e computador.
- Abra o software de aquisição.
- No modo Aquisição, selecione até quatro canais e defina o parâmetro para digitalização sequencial dos canais desejados. Aumente a potência laser para cada canal para 5-10%.
- Coloque um slide no microscópio.
- Escolha um cérebro a ser imageado usando o acessório de epifluorescência (ver Tabela de Materiais).
- No modo Aquisição, selecione 1024 x 1024 pixels como a dimensão do quadro.
- No modo Aquisição, selecione a opção pilha Z, indique que a pilha Z deve ser tomada em seções de 2 μm e foque através da amostra, selecionando os planos focais superior e inferior a serem imagens.
- Colete imagens de pilha Z de cérebros inteiros usando uma 20x de regiões cerebrais objetivas e específicas, como o corpo de cogumelos usando um objetivo de 60x.
6. Análise de dados
- Quantifique as células proliferadoras e o número de clones perma-twin manualmente e/ou usando o software de análise de imagem (ver Tabela de Materiais). Ao usar software, selecione regiões de interesse (ROIs) com áreas de pelo menos 10 μm.
Resultados
PTBI estimula a proliferação celular
Para determinar a extensão da neurogênese após um PTBI cerebral central, a resposta proliferativa foi medida em machos adultos jovens coletados e feridos dentro de 6 horas de eclosão. Observou-se aumento significativo na proliferação 24 h após a lesão usando antifosfohistone 3 (PH3), um marcador para células que se submetem ativamente à mitose. Aproximadamente 3 células PH3+ no cérebro central de controle e 11 células PH3+ nos cérebros centrais feridos são observadas 24 h pós-PTBI (Figura 2A-D). A maioria das células divisórias estão localizadas perto do local da lesão. Um segundo ensaio para a divisão celular foi usado para quantificar a proliferação celular cumulativa de uma única lesão e avaliar até que ponto as células recém-criadas sobreviveram. 5-ethynyl-2'-desoxyuridina (EdU) é um analógico de timmidina que pode ser incorporado em DNA recém-sintetizado e células de rotulagem permanente que foram submetidas à síntese de DNA. As moscas receberam um pulso de 4 dias de EdU, seguido de uma perseguição de 3 dias. Isso revelou que as células rotuladas eram viáveis e sobreviveram pelo menos 3 dias após a proliferação. Em 7 dias, havia uma média de 2 células EdU+ no controle do cérebro central e uma média de 11 células EdU+ nos cérebros centrais feridos, respectivamente (Figura 2E). Isto é semelhante aos resultados obtidos 24 h pós-lesão usando o anticorpo PH3. Quando a proliferação celular é medida em 14 dias, os controles não feridos mediam 1 células EdU+ por cérebro central, enquanto os cérebros feridos tiveram uma média de 29 células EdU+ (Figura 2E), demonstrando que a proliferação celular continua pelo menos até a segunda semana após um PTBI.
A proliferação celular depende da idade
A maior resposta proliferativa no cérebro central foi observada nas primeiras 24 horas após a eclosão (Figura 3). Em 7 dias após a eclosão, uma lesão penetrante ainda causa um aumento significativo na proliferação, com uma média de 6 PH3+células por cérebro central. Ainda assim, em 14 dias após a eclosão, a capacidade de divisão das células após o PTBI diminui significativamente para 1 célula divisória, semelhante à dos cérebros de controle (Figura 3). Assim, o potencial de proliferação celular pós-PTBI é dependente da idade.
Neurônios recém-criados podem projetar para corrigir áreas-alvo
Para avaliar a regeneração neural pós-PTBI, utilizou-se o sistema de rotulagem perma-twin15. O rastreamento de linhagem perma-twin rotula permanentemente células divisórias e sua descendência com uma proteína fluorescente verde (GFP) ou proteína fluorescente vermelha (RFP)15. Mais clones perma-gêmeos foram detectados em amostras feridas, em 2 dias e 2 semanas, do que em controles (Figura 4A-E). Notavelmente, havia novos neurônios corporais de cogumelos em ~50% dos cérebros ptbi 2 semanas após a lesão (Figura 4N). Esses novos neurônios projetaram seus dendritos apropriadamente para o calyx do corpo do cogumelo e seus axônios apropriadamente para os lobos do corpo do cogumelo (Figura 4D,F,G). Isso indica que as células recém-criadas podem ser neurônios funcionais envolvidos no reparo dos corpos de cogumelos danificados. Outras áreas do cérebro que pareciam se regenerar incluem o corpo elipsoide (EB) (Figura 4H,I), os lobos antenas (AL) (Figura 4J,K) e o chifre lateral (LH) (Figura 4L,M) que possuía grandes clones aproximadamente 26%, 26% e 20% do tempo, respectivamente (Figura 4N). Esses resultados ressaltam a utilidade deste sistema para a investigação da neurogênese adulta. Um modelo proposto para a sequência de eventos após o PTBI e levando à geração de novos neurônios é mostrado na Figura 5.
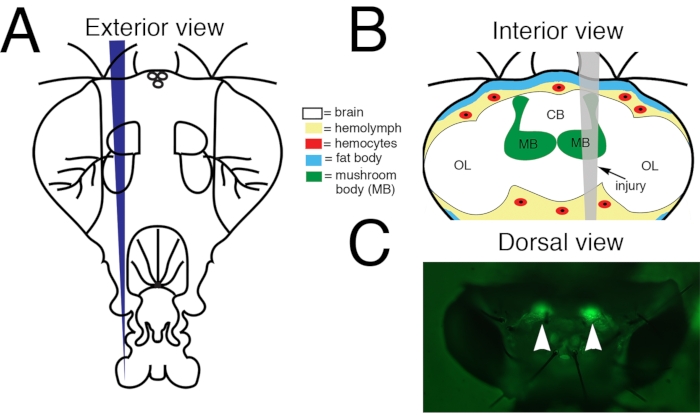
Figura 1: Lesão Cerebral Traumática Penetrante (PTBI) para o cérebro central de Drosophila adulto. (A) Esquema do exterior de uma cabeça de mosca adulta. Esta é uma vista frontal. Assim, o lado direito do animal é à esquerda do espectador. (B) Esquemático do interior de uma cabeça de Drosophila adulta com a trajetória da lesão indicada em cinza. Esta é uma visão posterior. Assim, nesta imagem e figuras subsequentes, o lado direito do cérebro é para a direita. O PTBI cerebral central impacta múltiplas estruturas cerebrais, incluindo o corpo de cogumelo (verde) e tecidos fora do cérebro, incluindo o corpo de gordura (azul) e hemócitos (vermelho). CB = região cerebral central. Região de lobo óptico OL= ótica. (C) Visão dorsal de uma cabeça adulta viva na qual corpos de cogumelos (pontas de flecha) são rotulados com uma proteína fluorescente verde (GFP). Este é o 'genótipo padrão' (veja texto para detalhes). O protocolo PTBI reproduzivelmente a lesão aos corpos de cogumelos. Esta Figura foi adaptada do Reference16. Clique aqui para ver uma versão maior desta figura.
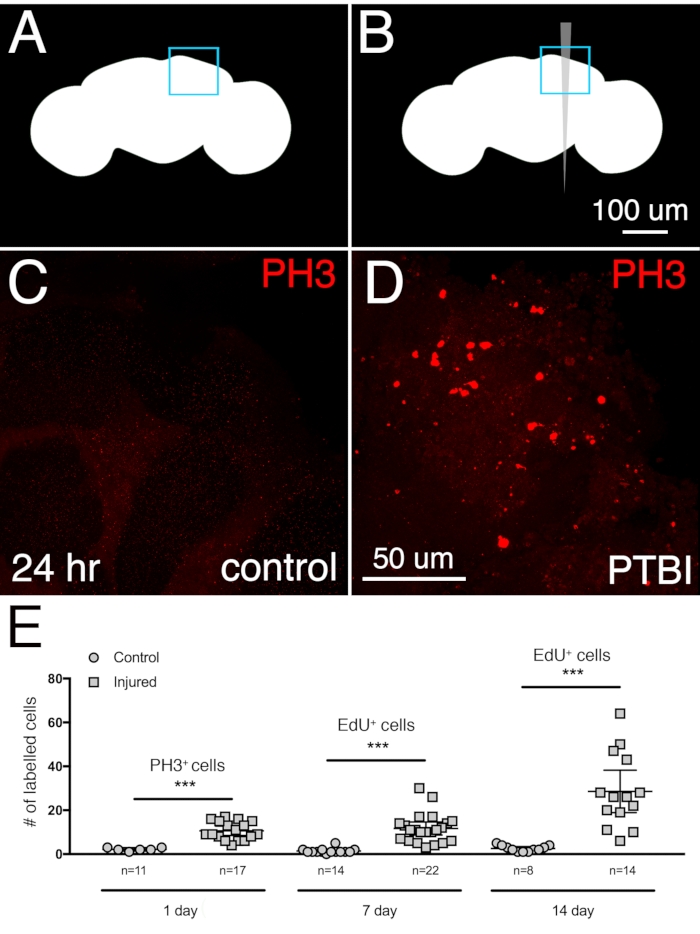
Figura 2: O PTBI estimula a proliferação celular. Esquemas de controle não lesionado (A) e PTBI (B). As caixas azuis nos cantos superiores direito indicam as regiões cerebrais mostradas em maior ampliação em painéis (C) e (D). (C,D) O anticorpo PH3 (vermelho) foi usado para avaliar a proliferação celular 24 h após lesão. Em cérebros de controle (C), há poucas células PH3+ e nenhuma perto do MB. No entanto, em cérebros ptbi (D), há células PH3+ perto do MB. (E) Quantificação de células proliferadoras. Os números refletem células proliferadoras em todo o cérebro, não apenas nas proximidades do corpo de cogumelos. Às 24 horas, os cérebros de controle ilesos tinham uma média de 3 células/cérebro PH3+ (n = 11 cérebros, 28 células), enquanto 24 h pós-PTBI, cérebros tinham uma média de 11 células/cérebro PH3+(n = 17 cérebros, 181 células). Em 7 dias, os controles ilesos têm poucas células EdU+, com uma média de 2 células/cérebros EdU+(n = 15 cérebros, 24 células), enquanto cérebros pós-PTBI de 7 dias tinham uma média de 11 células/cérebro EdU+ (n = 22 cérebros, 238 células). Aos 14 dias, os controles ilesos têm uma média de 1 célula/cérebro EdU+ (n = 8 cérebros,11 células), enquanto os cérebros pós-PTBI de 14 dias têm uma média de 29 células/cérebro EdU+ (n = 14 cérebros, 400 células). Para este conjunto de experimentos, foram utilizados machos adultos jovens dentro de 6h de eclosão. Os t-testes não verificados de controle e amostras de PTBI nos valores de rendimento de 3 pontos de p<0,0001, p<0,0001 e p<0,0002, respectivamente. As barras de erro refletem o desvio padrão (SD). Esta Figura foi adaptada do Reference16. Clique aqui para ver uma versão maior desta figura.
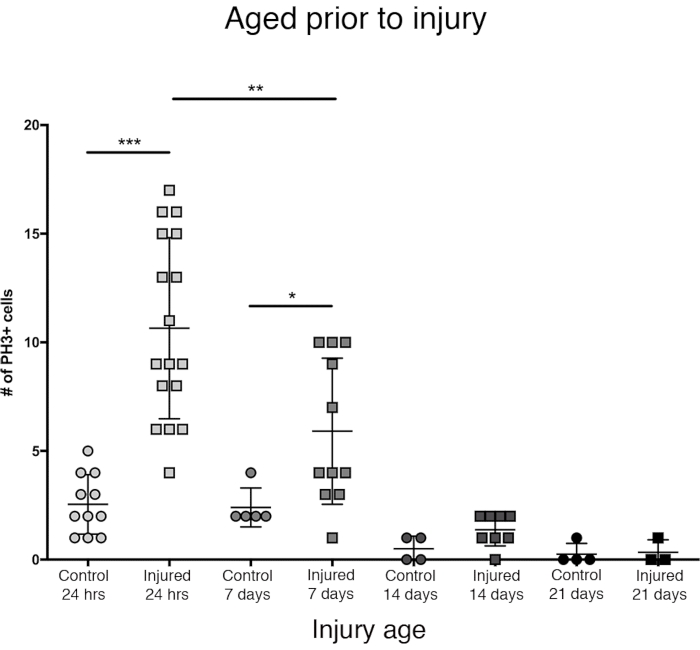
Figura 3: A resposta proliferativa ao PTBI diminui com a idade. Para explorar se a idade impacta a quantidade de proliferação celular que ocorre após a lesão, os machos adultos recém-eclosados foram comparados a animais com idade de 7 dias, 14 dias e 28 dias antes do PTBI, usando anti-PH3 para avaliar a proliferação celular 24 horas após a lesão. Moscas feridas dentro de 6 h de eclosão tinham uma média de 11 células/cérebro PH3+ (n = 17 cérebros, 182 células) em comparação com uma média de 3 células PH3+ /cérebro em controles com idade compatível (n = 11 cérebros, 28 células). Moscas com idade até 7 dias, então submetidas ao PTBI, tinham uma média de 6 células/cérebro PH3+(n = 11 cérebros, 65 células) em comparação com controles de idade com uma média de 2 células/cérebro PH3+(n = 5 cérebros, 12 células). Quando as moscas envelheciam até 14 dias antes do PTBI e eram avaliadas 24 horas depois, havia uma média de 1 célula/cérebro PH3+ (n = 8 cérebros, 11 células) semelhante aos controles com correspondência etária, que também mediam 1 célula/cérebro PH3+(n = 4 cérebros, 2 células). 28 dias de controle ileso (n = 4, 1 célula) e PTBI (n = 3, 1 célula) voa ambas com média 0 PH3+células/cérebro. Os t-tests não pagos para PTBI para controlar comparações nesses 4 pontos são p<0,0001, p<0,04, p<0,07 e p<0,84, respectivamente. Esta Figura foi adaptada do Reference16. Clique aqui para ver uma versão maior desta figura.
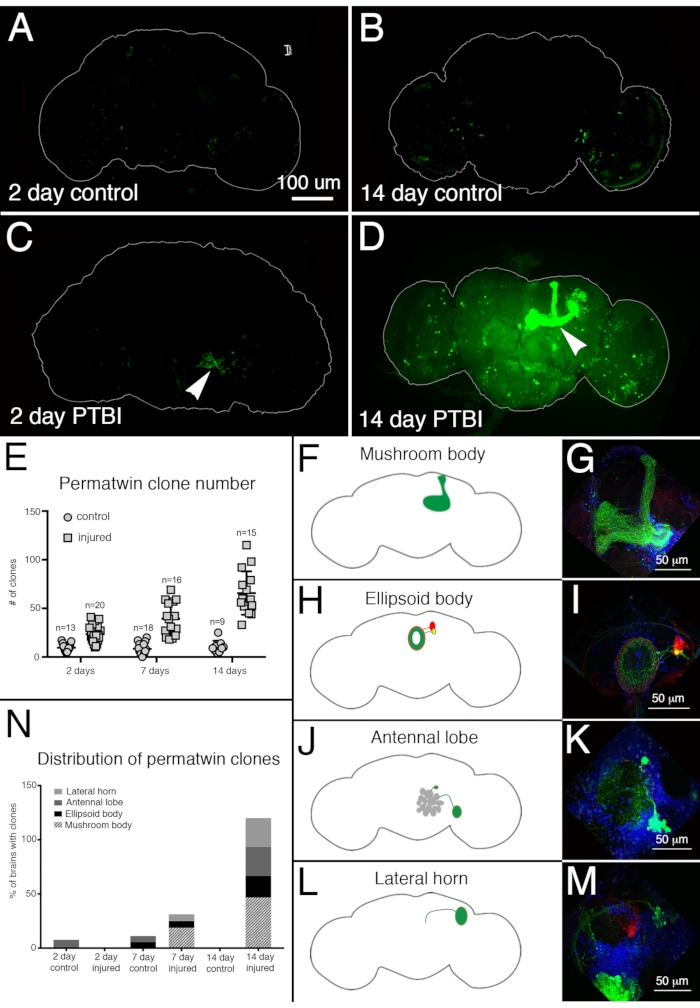
Figura 4: O rastreamento de linhagem perma-gêmeo demonstra a regeneração cerebral e o direcionamento adequado de axônios após o PTBI. O sistema de rastreamento de linhagem perma-gêmeo15 foi utilizado para analisar neurogênese após PTBI. Este sistema rotula permanentemente células e descendentes com uma proteína fluorescente verde (GFP) ou proteína fluorescente vermelha (RFP). As moscas foram criadas a 17 °C para manter o sistema desligado durante o desenvolvimento. Os machos de F1 portadores de transgenes perma-gêmeos foram coletados no momento da eclosão, depois feridos e colocados a 30 °C para se recuperarem por 2 ou 14 dias. (A) Em controles não feridos de 2 dias, há algumas células GFP+ espalhadas pelo cérebro. (B) Aos 14 dias, há relativamente poucas células GFP+ presentes no cérebro central de controle. (C) Em comparação, cérebros lesionados de 2 dias têm mais células GFP+ que tendem a se agrupar perto da lesão (ponta de flecha). (D) Aos 14 dias após a lesão, há grandes clones perto do local da lesão. Alguns desses clones têm axônios que projetam ao longo dos tratos do corpo do cogumelo (ponta de flecha). Apenas o canal GFP é mostrado aqui; havia clones RFP+ semelhantes nas amostras de PTBI. (E) O número de clones aumenta ao longo do tempo pós-PTBI.Controlar cérebros não feridos (n = 13) têm uma média de 10 clones em 2 dias, enquanto cérebros ptbi de 2 dias (n = 20) têm uma média de 23 clones (p<0,00002). Aos 7 dias, os cérebros de controle tinham uma média de 9 clones por cérebro (n = 18), enquanto os cérebros de 7 dias de PTBI tinham uma média de 39 clones por cérebro (n = 16) (p-valor<0,00000002). Isso é significativamente maior do que o número de clones vistos em 2 dias após a lesão (p-valor<0.0009). Em cérebros de controle de 14 dias, há uma média de 10 clones por cérebro, o que não é significativamente diferente dos controles de 2 dias e 7 dias. No entanto, em 14 dias após o PTBI, há uma média de 66 clones GFP+, o que é significativamente mais do que controles com correspondência etária (p<0,0000003) ou cérebros pós-PTBI de 2 dias (p-valor<0,0001). As barras de erro refletem o SD. (F-M) PTBI estimula a formação de clones em várias regiões do cérebro. Painéis do lado esquerdo são esquemas de regiões cerebrais onde grandes clones foram encontrados 14 dias após PTBI (A, H, J, L). Painéis à direita mostram altas ampliações de cérebros representativos (G, I, K, M). Muitos cérebros de 14 dias tinham clones que projetavam áreas específicas. Estes incluíam o corpo de cogumelo (MB) (F,G), o corpo elipsoide (EB) (H,I), o lobo antena (AL) (J,K) e o chifre lateral (LH) (L,M). (N) Tanto o número de clones quanto o tamanho do clone aumentam com o tempo pós-PTBI.As proporções de regiões cerebrais com grandes clones foram calculadas em 2, 7 e 14 dias em controles e cérebros feridos. Aos 2 dias, ~8% dos cérebros de controle (n = 13) mostraram clones de AL, enquanto não havia clones de AL em cérebros feridos de 2 dias (n = 20). Em cérebros de controle de 7 dias (n = 18), 6% tinham AL e 6% tinham clones de EB. Em 7 dias pós-PTBI (n = 16), 6% dos cérebros também tinham clones de AL, 6% tinham clones de EB e 19% tinham clones mb grandes. Aos 14 dias, cérebros de controle (n = 9) não apresentaram áreas específicas com clones, enquanto 47% dos cérebros de PTBI (n = 15) tinham clones MB, 20% dos cérebros ptbi tinham clones de AL, e 27% dos cérebros de PTBI tinham clones de EB, e 27% tinham clones de LH. Esta Figura foi adaptada do Reference16. Clique aqui para ver uma versão maior desta figura.
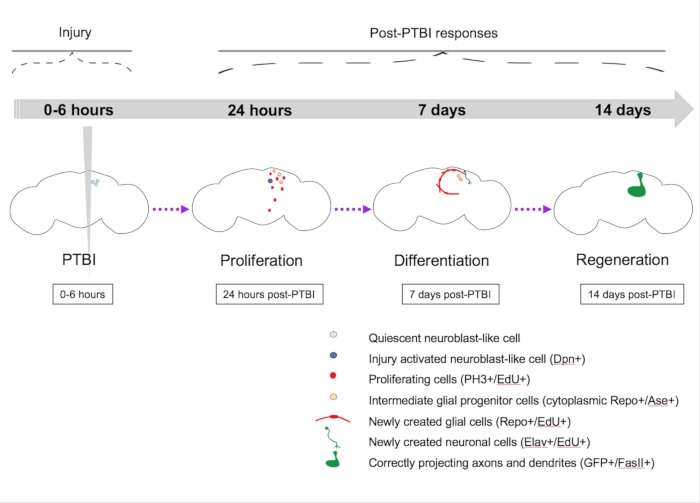
Figura 5: Modelo sumário para regeneração após lesão cerebral traumática penetrante (PTBI). Em Drosophila adulto jovem, há células quiescentes semelhantes a neuroblastos dentro do cérebro central que não têm expressão de genes neuroblastos canônicos. Por 24 h pós-PTBI, as células quiescentes semelhantes ao neuroblasto são ativadas, expressam genes neuroblastos e começaram a proliferar. Em 4h e 24 h pós-PTBI, há uma onda de morte celular16. Aos 7 dias, a taxa de proliferação ainda é alta, e muitas das novas células adotaram identidades celulares maduras, tornando-se neurônios ou glia. Aos 14 dias pós-PTBI, grandes clones de novos neurônios com axônios e dendritos projetam corretamente suas respectivas áreas alvo. Os defeitos locomotores também são restaurados por 14 dias, sugerindo que a Drosophila adulta pode se regenerar funcional e estruturalmente. Esta Figura foi adaptada do Reference16. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora lesões penetrantes no cérebro adulto de Drosophila tenham sido descritas anteriormente15,17,18, essas lesões se concentraram nos lobos ópticos e não no cérebro central. Além disso, faltam instruções detalhadas de como realizar os ferimentos. Este protocolo descreve um modelo para lesão penetrante no cérebro central de Drosophila adulto que reproduz evidências estatisticamente significativas para neurogênese adulta após PTBI.
A reprodutibilidade deste protocolo ptbi deve-se, em parte, ao corpo do cogumelo como a região alvo da lesão. O corpo de cogumelo é grande, consistindo de ~2200 neurônios com dendrita complexa e arbors de axon em grandes e altamente estereotipadas matrizes18. Os corpos celulares dos neurônios do corpo dos cogumelos ficam perto da superfície do cérebro e podem ser visualizados através da cutícula da cabeça usando a expressão de proteína fluorescente verde (GFP) (Figura 1C). Precursores do corpo de cogumelos são as últimas células-tronco neurais a se submeterem à apoptose durante o desenvolvimento13,12,19. Assim, muitos neurônios corporais de cogumelos são muito jovens na época da eclosão. Isso levou à hipótese de que o corpo de cogumelo pode ter mais potencial mitotístico do que outras regiões cerebrais16. Além disso, o corpo de cogumelo é fundamental para o aprendizado e memória18. Isso permite perguntar se a neurogênese desencadeada pelo PTBI leva à recuperação funcional.
Outros fatores que contribuem para a reprodutibilidade dos resultados incluem o uso de moscas ultrapassadas de genótipos consistentes, a realização de cruzes na mesma direção de cada vez, o controle preciso das temperaturas de criação e envelhecimento, e a análise de machos e fêmeas separadamente. O uso de moscas de F1 de um outcross reduz a probabilidade de analisar cérebros homozigos para mutações espontâneas. A cruz padrão de y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL4 fêmeas adultas para y[1] moscas machos adultas resulta em prole F1 do genótipo y[1] w[1]; UAS-mCD8-GFP/+;; OK107-GAL4/+. OK107-GAL4 é expresso em todos os neurônios intrínsecos do corpo do cogumelo e impulsiona a expressão do repórter uas-mCD8-GFP ligado à membrana permitindo a visualização de corpos de cogumelos e suas projeções. Para as cruzes perma-twin, as cruzes devem permanecer a 17 °C o tempo todo para manter o sistema de rastreamento de linhagem desligado. Isso garante que nenhuma célula divisória seja rotulada durante o desenvolvimento e que apenas neurônios e glia nascidos em adultos sejam rotulados. Para isso, a sala de voo também pode ser mantida a 17 °C. Embora a descrição inicial do sistema perma-twin15 recomendado para a criação voa a 18 °C, isso pode levar a uma rotulagem de fundo significativa.
Para consistência, também é recomendado manter o controle de moscas não feridas na almofada de CO2 enquanto se realiza o PTBI. Isso garante que ambos os conjuntos de moscas tenham exposição anestésico idêntica. Além disso, é desejável que a reprodutibilidade penetre completamente a cabeça. No entanto, deve-se tomar cuidado para não dobrar a ponta do pino contra a almofada, tornando-a inutilizável para lesões futuras. Para profissionais qualificados, há pouco dano não intencional às moscas do PTBI. No entanto, pressionar muito forte no tórax para estabilizar a mosca durante a lesão pode ser letal. Uma maneira de avaliar a extensão da lesão não intencional é quantificar a mortalidade de moscas de PTBI 24 h após a lesão. Para moscas com ferimentos unilaterais, isso pode ser 50% ou mais para iniciantes. Portanto, para garantir que os desfechos observados sejam devidos ao TCE e não à lesão não intencional, é aconselhável que iniciantes pratiquem a administração de PTBI em ~20 moscas diariamente ao longo de várias semanas e não analisem os cérebros resultantes até que a mortalidade de 24 horas seja consistentemente <10%.
Para quantificar a quantidade de proliferação estimulada pelo PTBI cerebral central, tanto a imunostaining anti-fosfohistone H3 (PH3) quanto a incorporação de 5-ethynyl-2'-deoxyuridina (EdU) podem ser empregadas. Anti-PH3 rotula células antes e ao longo da metafase, limitando a detecção a apenas uma fração das células que dividem ativamente. Assim, a coloração anti-PH3 proporciona apenas um vislumbre parcial da proliferação. EdU é um analógico de timmidina que pode ser incorporado em DNA recém-sintetizado. Alimentando moscas EdU antes e depois da lesão, é possível obter uma imagem mais completa das células que estão se dividindo ou se dividiram após a lesão. O fato de que todas as células que se dividem são permanentemente marcadas é útil tanto para a identificação de células de ciclismo lentas quanto para avaliar a sobrevivência das células após a proliferação inicial. Por razões pouco claras, mas talvez devido à permeabilidade limitada da barreira hematoencefálica, a rotulagem da EdU é ineficiente e subestima a proliferação celular no cérebro adulto. Isso é evidenciado pelos números semelhantes de células PH3+ e EdU+ em cérebros de controle e experimentais a 24 h pós-PTBI e observando que apenas um subconjunto de novas células em clones perma-twin incorporam EdU16. Para rotulagem máxima, é essencial pré-alimentar as moscas com EdU porque moscas feridas não retomam a alimentação por várias horas após o PTBI. A alimentação foi avaliada adicionando coloração alimentar à solução EdU e monitorando a quantidade de corante no intestino através da cutícula abdominal16.
Deve-se notar que, embora tenhamos fornecido um protocolo de dissecção cerebral na etapa 4, técnicas alternativas podem ser usadas. Vários deles estão disponíveis em protocolos publicados anteriormente20,21,22. Drosophila melanogaster oferece um modelo de baixo custo com poderosas ferramentas genéticas e moleculares que podem ser usadas para estudar os mecanismos subjacentes à regeneração de múltiplos tecidos, incluindo o intestino e componentes do sistema nervoso. Um modelo de lesão novo e reprodutível que pode ser usado para estudar a resposta à lesão cerebral é descrito aqui. Dados obtidos por esses protocolos apoiam a ideia de que o cérebro central de Drosophila adulto retém a capacidade de proliferação, gerando novos neurônios em resposta à lesão. Essas observações justificam uma investigação mais aprofundada tanto da extensão da neurogênese adulta quanto de seus mecanismos moleculares subjacentes. Uma vez que os componentes envolvidos na regeneração neural são identificados neste sistema, podemos converter nosso conhecimento da neurogênese de Drosophila adulta em humanos.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Somos gratos a Stacey Rimkus e Becky Katzenberger por assistência técnica e a Eduardo Moreno por compartilhar as ações perma-twin. Gostaríamos de agradecer a Barry Ganetzky e David Wassarman por discussões animadas que, sem dúvida, melhoraram a ciência e Kent Mok, Cayla Guerra e Bailey Spiegelberg por suas contribuições para o laboratório. Os anticorpos FasII foram desenvolvidos por Corey Goodman e obtidos do Banco Hybridoma de Estudos de Desenvolvimento, criado pelo NICHD do NIH e mantido na Universidade de Iowa, Departamento de Biologia, Iowa City, IA 52242. A maioria das cepas de Drosophila utilizadas neste estudo foram obtidas do Bloomington Drosophila Stock Center (BDSC; NIH P40OD018537). Este trabalho foi apoiado pelo NIH T32 GM007133 (KLC); NIH NS090190 (GBF); NIH NS102698 (GBF); a Escola de Pós-Graduação da Universidade de Wisconsin (GBF); e o UW-Madison Women in Science and Engineering Leadership Institute (WISELI) (GBF).
Materiais
| Name | Company | Catalog Number | Comments |
| #11 disposable scalpels | Santa Cruz Biotechnology | sc-395923 | used for separating Drosophila heads from trunks prior to brain dissection |
| 150 mm diameter black Sylgard dishes | Dow | 1696157 | made in the laboratory with reagents from Dow; used for brain dissection |
| 18 mm coverslips | any | for mounting brains on microscope slides | |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | ThermoFisher | D1306 | for immunohistochemistry |
| 70% Ethanol | made from 95% ethanol sourced variously | ||
| anti-mouse Cy5 | Jackson ImmunoResearch | 715-175-151 | for immunohistochemistry |
| anti-rabbit 568 | ThermoFisher | A11036 | for immunohistochemistry |
| bovine serum albumin (BSA) | SIgma Aldrich | A7030 | for immunohistochemisty |
| Clear nail polish | any | for sealing coverslips | |
| Click-It EdU labeling kit | InVitrogen | C10640 | to detect newly synthesized DNA |
| CO2 bubbler | Genesee Scientific | 59-181 | for anesthesia |
| CO2 pad | Genesee Scientific | 59-114 | for anesthesia |
| CO2 regulator and supply | any | for anesthesia | |
| Confocal microscope | any | for imaging fixed, stained and mounted brains | |
| cotton plugs | Genesee Scientific | 51-101 | for EdU labeling |
| Drosophila vials | Genesee Scientific | 32-109 | for EdU labeling |
| Fix buffer (Pipes, EGTA, Magnesium; PEM) | components sourced from various companies | for fixing adult brains; 100 mM piperazine-N,N’-bis(2-ethanesulfonic acid) [PIPES], 1 mM EGTA, 1 mM MgSO4, pH 7.0 | |
| Formaldehyde | Sigma Aldrich | 252549 | for fixing adult brains, added to PEM |
| Grade 3 round Whatman filters, 23 mm round | Tisch Scientific | 1003-323 | for EdU labeling |
| Microfuge tubes | any | for fixing and staining reactions and for storing Minutien pins | |
| Microscope slides | any | for mounting brains | |
| Minutien pins | Fine Science Tools | 26002-10 | for brain injury; 12.5 μm diameter tip and 100 μm diameter rod |
| mouse anti-Fasiclin II | Developmental Studies Hybridoma Bank | 1D4-s | for immunohistochemistry |
| NIGHTSEA stereo microscope fluorescence adaptor | Electron Microscopy Sciences | SFA-GR | fluorescence setup for dissecting microscope |
| P20, P200 and P1000 pipettors and tips | any | for measuring solutions | |
| phosphate buffered saliine (PBS) | components sourced from various companies | for dissecting brains and making immunohistochemistry blocking and washing solutions; 100 mM of K2HPO4, 140 mM of NaCl, pH 7.0 | |
| phosphate buffered saline with 0.1% Triton X-100 (PT) | components sourced from various companies | for washing dissected brains | |
| phosphate buffered saline with 0.1% Triton X-100 + 2% bovine serum albumin (PBT) | components sourced from various companies | blocking solution for immunohistochemistry and for diluting antibodies | |
| rabbit anti-PH3 | Santa Cruz Biotechnology, Inc | sc-8656-R | for immunohistochemistry |
| Reinforcement labels | Avery | 5721 | to maintain space between the microscope slide and the coverslip |
| Size 0 paintbrushes | any | to manipulate and stabilize adult Drosophila during injury | |
| Triton X-100 | Sigma Aldrich | 93443 | |
| Two pair of #5 watchmakers forceps | Fine Science Tools | 11255-20 | used to hold the Minutien pins and for brain dissections |
| Vectashield | Vector Laboratories | H-1000 | mounting medium for microscope slides |
Referências
- Thurman, D., et al. Report to Congress: Traumatic brain injury in the United States. , Available from: https://www.cdc.gov/traumaticbraininjury/pubs/tbi_report_to_congress.html (1999).
- NIEHS. , Available from: https://www.nih.gov/research/supported/health/neurodegenerative/index.cfm (2021).
- Morton, N. V., Wehman, P. Psychosocial and emotional sequelae of individuals with traumatic brain injury: A literature review and recommendations. Brain Injury. 9 (1), 81-92 (2017).
- Bonini, N. M., Berger, S. L. The sustained impact of model organisms-in genetics and epigenetics. Genetics. 205, 1-4 (2017).
- Brace, E. J., DiAntonio, A. Models of axon regeneration in Drosophila. Experimental Neurology. 287, Pt 3 310-317 (2017).
- Hao, Y., Collins, C. Intrinsic mechanisms for axon regeneration: insights from injured axons in Drosophila. Current Opinion in Genetics & Development. 44, 84-91 (2017).
- Chiang, A. S., et al. Three-dimensional reconstruction of brain-wide wiring networks in Drosophila at single-cell resolution. Current Biology. 21 (1), 1-11 (2011).
- Meinertzhagen, I. A. The organisation of invertebrate brains: cells, synapses and circuits. Acta Zoologica. 91 (1), 64-71 (2010).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: A history lesson for the future. Nature Reviews Neuroscience. 11 (7), 514-522 (2010).
- Lessing, D., Bonini, N. M. Maintaining the brain: insight into human neurodegeneration from Drosophila melanogaster mutants. Nature Reviews Genetics. 10 (6), 359-370 (2009).
- Boone, J. Q., Doe, C. Q. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells. Developmental Neurobiology. 68 (9), 1185-1195 (2008).
- Ito, K., Hotta, Y. Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster. Developmental Biology. 149 (1), 134-148 (1992).
- Siegrist, S. E., Haque, N. S., Chen, C. H., Hay, B. A., Hariharan, I. K. Inactivation of both Foxo and reaper promotes long-term adult neurogenesis in Drosophila. Current Biology. 20 (7), 643-648 (2010).
- von Trotha, J. W., Egger, B., Brand, A. H. Cell proliferation in the Drosophila adult brain revealed by clonal analysis and bromodeoxyuridine labelling. Neural Development. 4, 9(2009).
- Fernandez-Hernandez, I., Rhiner, C., Moreno, E. Adult neurogenesis in Drosophila. Cell Reports. 3 (6), 1857-1865 (2013).
- Crocker, K. L., et al. Neurogenesis in the adult Drosophila brain. Genetics. , (2021).
- Plavicki, J., Mader, S., Pueschel, E., Peebles, P., Boekhoff-Falk, G. Homeobox gene distal-less is required for neuronal differentiation and neurite outgrowth in the Drosophila olfactory system. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1578-1583 (2012).
- Aso, Y. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Ito, K., Awano, W., Suzuki, K., Hiromi, Y., Yamamoto, D. The Drosophila mushroom body is a quadruple structure of clonal units each of which contains a virtually identical set of neurones and glial cells. Development. 124 (4), 761-771 (1997).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A. Simple one-step dissection protocol for whole-mount preparation of adult Drosophila brains. Journal of Visualized Experiments. (118), e55128(2016).
- Kelly, S. M., Elchert, A., Kahl, M. Dissection and immunofluorescent staining of mushroom body and photoreceptor neurons in adult Drosophila melanogaster brains. Journal of Visualized Experiments. (129), e56174(2017).
- Arain, U., Valentino, P., Islam, I. M., Erclik, T. Dissection, immunohistochemistry and mounting of larval and adult Drosophila brains for optic lobe visualization. Journal of Visualized Experiments. (170), e61273(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados