Method Article
Stimuler et analyser la neurogenèse adulte dans le cerveau central de la drosophile
Dans cet article
Résumé
Cet article fournit des protocoles détaillés pour infliger une lésion cérébrale traumatique pénétrante (PTBI) à la drosophile adulte et examiner la neurogenèse qui en résulte.
Résumé
Les mécanismes moléculaires et cellulaires sous-jacents à la neurogenèse en réponse à une maladie ou à une blessure ne sont pas bien compris. Cependant, la compréhension de ces mécanismes est cruciale pour développer des thérapies régénératives neuronales. Drosophila melanogaster est un modèle de premier plan pour les études sur le développement neuronal, mais n’a historiquement pas été exploité pour étudier la régénération du cerveau adulte. C’est principalement parce que le cerveau adulte présente une très faible activité mitotique. Néanmoins, la pénétration d’une lésion cérébrale traumatique (PTBI) dans le cerveau central de la drosophile adulte déclenche la génération de nouveaux neurones et de nouvelles glies. Les puissants outils génétiques disponibles chez la drosophile combinés au protocole de blessure simple mais rigoureux décrit ici font maintenant du cerveau de la drosophile adulte un modèle robuste pour la recherche sur la régénération neuronale. Vous trouverez ici des instructions détaillées pour (1) les lésions pénétrantes du cerveau central adulte et (2) la dissection, l’immunohistochimie et l’imagerie post-blessure. Ces protocoles donnent des résultats hautement reproductibles et faciliteront des études supplémentaires pour disséquer les mécanismes sous-jacents à la régénération neuronale.
Introduction
Les dommages au cerveau et au système nerveux sont une cause majeure de décès et d’invalidité dans le monde entier. Environ 1,5 million d’Américains souffrent de lésions cérébrales traumatiques (TCC) chaque année1, tandis qu’environ 6 millions de personnes aux États-Unis souffrent de maladies neurodégénératives, telles que la maladie de Parkinson et la maladie d’Alzheimer2. Les maladies et les lésions cérébrales peuvent provoquer une dégénérescence neuronale, entraînant des défauts sensoriels, cognitifs et moteurs3. Le développement de stratégies thérapeutiques pour la réparation du cerveau humain a été difficile en raison de la physiologie complexe du cerveau. Les organismes modèles tels que Drosophila melanogaster fournissent un système simple pour identifier les mécanismes fondamentaux sous-jacents à la neurodégénérescence et les cibles thérapeutiques potentielles4.
La mouche des fruits Drosophila melanogaster est un organisme modèle puissant depuis plus d’un siècle, faisant progresser les domaines de la génétique, de la biologie du développement et des neurosciences5,6. Le cerveau de la drosophile ne comprend que ~ 90 000 neurones7, soit un million de fois moins que le cerveau humain moyen8, mais ils présentent de nombreuses similitudes. Les cerveaux humains et volants utilisent les neurotransmetteurs GABA, glutamate, acétylcholine et les amines biogènes dopamine et sérotonine9. La drosophile et les neurones humains fonctionnent également de la même manière, avec une architecture synaptique partagée et des types de cellules neurales analogues10. La plus petite taille du cerveau de la drosophile et la disponibilité de techniques génétiques avancées, combinées à la conservation des mécanismes moléculaires, cellulaires et physiologiques entre la drosophile et les mammifères, permettent aux chercheurs sur la drosophile de poser des questions peu pratiques ou difficiles à répondre dans les modèles mammifères.
Notre compréhension actuelle de la neurogenèse adulte chez la drosophile, à la fois pendant l’homéostasie et après une blessure, reste limitée. On en sait plus sur la neurogenèse au cours du développement normal. Par exemple, les neurones et la glie sont créés au cours du développement à partir de cellules précurseurs, appelées neuroblastes10,11. Au moins trois types différents de neuroblastes ont été distingués dans le cerveau central. Les neuroblastes de la lignée de type I et de type II quittent le cycle cellulaire environ 20 à 30 h après la formation du puparium12. En revanche, les neuroblastes du corps du champignon sont les derniers à mettre fin à la division cellulaire et le font via l’apoptose dépendante de Reaper ~ 85-90 h après la formation du puparium13. Après l’éclosion, le cerveau de la drosophile adulte a peu de cellules en division (~ 1 cellule / cerveau), principalement glie14. Les lobes optiques adultes possèdent des neuroblastes à cycle lent capables de neurogenèse15, tandis que le cerveau central adulte n’a pas de neuroblastes connus. La rareté des progéniteurs neuronaux et la prolifération cellulaire limitée ressemblent fortement à la situation dans le cerveau des mammifères adultes, soulignant la pertinence potentielle des mécanismes de la neurogenèse adulte chez la drosophile pour l’homme.
La découverte de faibles niveaux de neurogenèse adulte dans les lobes optiques de la drosophile adulte après une blessure15 a conduit à l’hypothèse que le cerveau central de la drosophile adulte pourrait également être capable de neurogenèse adulte16. Ce protocole décrit la création d’un modèle rigoureux et reproductible de lésion cérébrale centrale chez la drosophile adulte qui peut être utilisé pour étudier la neurogenèse dans le cerveau central adulte. Compte tenu des similitudes entre l’architecture et le fonctionnement du cerveau humain et de la drosophile , ces découvertes pourraient conduire à l’identification de cibles critiques pour la neurogenèse thérapeutique dans les cerveaux humains blessés et malades.
Protocole
Ce protocole suit les directives de soins aux animaux de UW-Madison.
1. Générer de la drosophile adulte pour le PTBI
- Pour la croix standard, placez 20 vierges y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL417 femelles adultes et 10 ans[1] w[1]17 mâles adultes volent ensemble dans des flacons (voir tableau des matériaux) contenant de la nourriture. Pour avoir un grand nombre de descendants synchrones, mettez en place 10 à 20 croisements en même temps. Le croisement standard donne naissance à la descendance F1 du génotype : y[1] w[1] ; UAS-mCD8-GFP/+;; OK107-GAL4/+.
- Placer les flacons à 25 °C pour l’accouplement et la ponte. Pour maximiser la progéniture, transférez les parents dans de nouveaux flacons tous les 2 à 4 jours, en maintenant les flacons plus tôt à 25 ° C. Jetez chaque flacon 18 jours après que les parents y ont été placés pour la première fois pour vous assurer qu’il n’y a pas de progéniture F2.
REMARQUE: 3 ensembles de progéniture (« couvées ») peuvent être générés à partir de chaque ensemble de parents. - Vérifiez après ~ 10 jours, quand la progéniture F1 commencera à s’écrémer.
- Placer les flacons à 25 °C pour l’accouplement et la ponte. Pour maximiser la progéniture, transférez les parents dans de nouveaux flacons tous les 2 à 4 jours, en maintenant les flacons plus tôt à 25 ° C. Jetez chaque flacon 18 jours après que les parents y ont été placés pour la première fois pour vous assurer qu’il n’y a pas de progéniture F2.
- Pour les études de lignée, utilisez F1 mâles perma-jumeaux15 de génotype: w; FRT40A, UAS-CD2-RFP, UAS-GFP-Mir/FRT40A, UAS-CD8-GFP, UAS-CD2-Mir; tub-GAL80ts/act-GAL4 UAS-flp. Par souci de cohérence, faites cette croix dans la même direction à chaque fois.
- Pour générer des mâles perma-jumeaux, placez 20 w vierges; FRT40A, UAS-CD2-RFP, UAS-GFP-Mir; tub-GAL80ts/TM6B femelles et 10 w; FRT40A, UAS-CD8-GFP, UAS-CD2-Mir; act-GAL4 UAS-flp/TM6B15 mâles adultes ensemble dans des flacons contenant de la nourriture.
- Placer les flacons à 17 °C pour l’accouplement et la ponte. Transférer les parents dans des flacons de nouveaux aliments tous les 7 jours, en maintenant tous les flacons à 17 ° C. Jetez chaque flacon 35 jours après que les parents y ont été placés pour la première fois pour vous assurer qu’il n’y a pas de progéniture F2.
- Vérifiez après ~ 21 jours, quand la progéniture F1 commencera à s’éteindre.
2. Lésion cérébrale traumatique pénétrante (PTBI; Graphique 1)
- Triez les mouches F1 nouvellement écloses. Sélectionnez les jeunes mâles dans les 6 heures suivant l’éclosion. Placez ces mâles dans des flacons propres contenant de la nourriture, avec 40 mouches ou moins par flacon.
REMARQUE: Ceci est plus facilement accompli en milieu de matinée en anesthésiant les mouches sur le coussin de CO2 et en identifiant les mâles adultes qui ont encore du méconium (visible comme une tache verdâtre foncée à travers la paroi abdominale) dans leurs intestins. - Pré-alimentation avec de la 5-éthyynyl-2'-désoxyuridine (EdU) (voir tableau des matériaux) pendant 6 h avant la blessure si vous prévoyez d’étiqueter les cellules en division avec de l’EdU. Voir l’étape 3 pour plus de détails.
- Désinfectez les broches Minutien (voir tableau des matériaux) pendant au moins 5 minutes en plaçant environ 100 broches dans un tube de microcentrifugeuse de 1,5 mL rempli d’éthanol à 70 %.
- Désinfectez le tampon de CO2 et un pinceau en pulvérisant 70% d’éthanol et essuyez-le avec un tissu propre non pelucheux. Une fois que les outils sont propres et secs, transférez 40 mâles F1 triés ou moins sur le tampon propre.
- Séparez les mâles de F1 en 2 groupes sur le fly pad. Un groupe servira de contrôle aux mouches non blessées. Le deuxième groupe expérimental sera soumis au PTBI.
- À l’aide de pinces, retirez 4 à 5 nouvelles broches Minutien du tube de microcentrifugation et placez-les près du bord du tampon de CO2 . Sous la lunette de dissection, choisissez une broche Minutien droite avec une pointe pointue.
REMARQUE: L’utilisation d’une seule broche Minutien pour une expérience réduira la variabilité. Réutilisez les broches pointues. Placez les broches endommagées ou émoussées dans un tube de microcentrifugation séparé de 1,5 mL contenant 70 % d’éthanol pour une élimination sécuritaire. - Si vous travaillez avec des mouches de la croix standard, allumez la lampe à diode électroluminescente (LED) du stéréomicroscope équipée des filtres d’excitation et d’émission appropriés pour la protéine de fluorescence verte (GFP). Cela permet une excitation à 440-460 nM et permet une visualisation de 500-560 nM.
REMARQUE: Avec cet ensemble de lampes et de filtres, les corps cellulaires du corps du champignon vont fluorescence vert à travers la cuticule de la tête (Figure 1C). Pour les mouches perma-jumelles ou les mouches d’autres génotypes, un illuminateur de lumière blanche standard pour le stéréomicroscope peut être utilisé pour visualiser les points de repère sur la cuticule de la tête afin de cibler la blessure au corps du champignon (Figure 1C). - Utilisez la pince pour ramasser et tenir l’épingle Minutien sélectionnée dans une main (pour les droitiers, il s’agit généralement de la main droite) et le pinceau dans l’autre main (généralement gauche). Choisissez une mouche dans le groupe expérimental et positionnez la mouche de manière à avoir une vue dorsale de la capsule de tête avec la tête de la mouche à droite. Placez la brosse sur la partie antérieure du thorax dorsal et poussez doucement vers le bas pour stabiliser la mouche.
- Dirigez la pointe de l’épingle Minutien sur les corps cellulaires du corps du champignon sur le côté droit de la tête et pénétrez dans la capsule de la tête. Si vous utilisez des repères, ciblez la cuticule de la tête dorsale entre les ocelles et le bord dorsal de l’œil (Figure 1).
- Après avoir terminé la blessure, utilisez le pinceau pour pousser doucement la tête hors de l’épingle Minutien.
- Si vous utilisez le cerveau pour RNA-Seq ou qRT-PCR, faites une deuxième blessure sur le côté gauche de la tête.
- Répétez les étapes 2.8 à 2.10 pour blesser toutes les mouches du groupe expérimental.
- Une fois que toutes les mouches ont été blessées, placez le témoin et les mouches blessées dans des flacons étiquetés et séparés contenant de la nourriture. Posez les flacons horizontalement (c.-à-d. sur les côtés) pendant que les mouches se remettent de l’anesthésie et pendant le vieillissement subséquent pour empêcher les mouches de se coincer dans la nourriture.
- Placez les mouches croisées standard à 25 ° C et les mouches perma-jumelles à 30 ° C pour vieillir.
- Pour les mouches âgées de plus de 24 heures, placez-les sur des aliments propres tous les 1-2 jours.
3. Étiquetage EdU
- Préparer un stock de 10 mM de 5-éthyynyl-2'-désoxyuridine (EdU) dans du sulfoxyde de diméthyle (DMSO). Celui-ci peut être conservé à -20 °C jusqu’à 12 mois.
- Préparer 200 μL de 50 μM d’EdU dans du saccharose à 10 %. Pré-alimentation des mouches avec EdU pendant 6 h avant PTBI.
- Placer 200 μL de 50 μM EdU dans du saccharose à 10 % sur un papier filtre rond de grade 3 de 23 mm (voir tableau des matériaux) dans un flacon autrement vide.
- Placez les mouches dans le flacon. Scellez ensuite le flacon avec un bouchon de coton.
- Déposer le flacon horizontalement dans un incubateur humidifié à 25 °C pendant 6 h.
- Effectuer le PTBI comme décrit aux étapes 2.3-2.10.
- Replacez les mouches dans le flacon contenant de l’EdU. Scellez le flacon avec un bouchon de coton.
- Déposer le flacon horizontalement dans un incubateur humidifié à 25 °C pendant 24 h. Suivez l’une des étapes décrites ci-dessous (étape 3.8.1-3.8.3).
- Disséquez et fixez les cerveaux comme décrit à l’étape 4 en utilisant un fixateur, un tampon de lavage et un tampon de blocage sans azoture et avec la réaction de détection EdU effectuée avant la coloration des anticorps.
- Transférer les mouches dans un flacon propre contenant un nouveau papier filtre et 200 μL de 50 μM d’EdU dans 10% de saccharose. Déposer le flacon horizontalement dans un incubateur à 25 °C. Répétez toutes les 24 heures pendant la durée de l’étiquetage. Ensuite, disséquez et fixez les cerveaux comme décrit à l’étape 4 à l’aide de tampons sans azoture avec la réaction de détection EdU effectuée avant la coloration des anticorps.
- Pour chasser les impulsions avec EdU, nourrissez EdU pour la période de pouls, transférez les mouches toutes les 24 h dans un flacon propre contenant un nouveau papier filtre et 200 μL de 50 μM dans du saccharose à 10%. Après la période de pouls (p. ex., 4 jours), transférer les mouches dans un flacon contenant de la nourriture standard pour drosophiles. Placez le flacon sur le côté dans un incubateur à 25 °C pendant 3 jours supplémentaires. Ensuite, disséquez et fixez les cerveaux comme décrit à l’étape 4 à l’aide de tampons sans azoture avec la réaction de détection EdU effectuée avant la coloration des anticorps.
4. Dissection, immunohistochimie et montage
- Préparer des tubes de microcentrifugation de 1,5 mL avec 100 μL de fixateur : 4 % de formaldéhyde dans le PEM (100 mM de pipérazine-N,N'-bis(acide 2-éthanesulfonique) [TUYAUX], 1 mM d’EGTA, 1 mM MgSO4, pH 7,0) (voir tableau des matériaux) et placer sur la glace.
REMARQUE: Jusqu’à 20 cerveaux d’un seul génotype et d’une seule condition peuvent être traités dans un seul tube. - Préparer une plaque de dissection avec une petite piscine (~100 μL) d’éthanol à 70 % et trois petits bassins de solution saline tamponnée au phosphate (PBS; 100 mM de K2HPO4, 140 mM de NaCl, pH 7,0).
- Anesthésiez ~10 mouches témoins ou expérimentales sur un tampon de CO2 qui a été désinfecté avec 70% d’éthanol.
- Séparez la tête du tronc de chaque mouche à l’aide d’un scalpel.
- Collectez les têtes avec un pinceau mouillé dans de l’éthanol à 70% et placez les têtes pendant 2 à 5 minutes dans la piscine d’éthanol sur la plaque de dissection.
REMARQUE: Cela déshydrate légèrement les cerveaux et les rend plus faciles à disséquer loin de la cuticule de la tête. - Transférez les têtes dans un pool de PBS d’environ 100 μL et disséquez les cerveaux, en déplaçant chaque cerveau vers un pool propre d’environ 100 μL de PBS. Effectuez cette opération à l’aide de deux paires de pinces Watchmakers pour ouvrir l’arrière de la cuticule de la tête et en tenant la cuticule avec une paire de pinces tout en sortant doucement le cerveau de la cuticule à l’aide de la pointe fermée de la deuxième paire de pinces.
- Transférer les cerveaux disséqués dans un tube de microcentrifugation contenant 100 μL de la solution de fixation à l’aide d’un pipetteur P200 équipé d’une pointe en plastique qui a été coupée et biseautée pour permettre l’entrée des cerveaux.
- Fixer pendant 20-25 min à température ambiante. Retirez soigneusement la fixation avec une pipette P200 ou en verre.
- Lavez les cerveaux fixes quatre fois avec 1 mL de « PT » (PBS plus 0,1% Triton X-100), permettant aux cerveaux de se déposer pendant plusieurs minutes entre chaque lavage.
REMARQUE: Si les cerveaux ne s’installent pas rapidement entre les lavages, ils sont susceptibles d’avoir encore du corps gras et / ou de la trachée attachés. - Bloquer les échantillons dans 1 mL de PBS plus 0,1 % de Triton X-100 et 2 % d’albumine sérique bovine (PBT) pendant environ 1 h à température ambiante.
- Retirer la solution bloquante et incuber les échantillons avec 100 μL de solution d’anticorps primaire pendant la nuit à 4 °C dans le PBT. Les principaux anticorps utilisés dans cette étude sont l’anti-PH3 du lapin (1:500) et l’anti-fasicline II de la souris (1:20) (voir la table des matériaux).
- Laver les échantillons cinq fois avec 1 mL de PT, ce qui permet au cerveau de se déposer pendant plusieurs minutes entre chaque lavage.
- Retirer le lavage final et incuber dans 100 μL de solution d’anticorps secondaire pendant la nuit à 4 °C. Les anticorps secondaires utilisés ici sont anti-lapin 568 (1:400) et anti-souris Cy5 (1:100) (voir tableau des matériaux).
- Laver les échantillons cinq fois avec 1 mL de PT, ce qui permet au cerveau de se déposer pendant plusieurs minutes entre chaque lavage. Lors du lavage final, ajouter le 4',6-Diamidino-2-Phénylindole, Dihydrochloride (DAPI; 1:100 d’une solution de 10 μM) pendant 10 min pour colorer les noyaux. Retirez le lavage en laissant 50-100 μL dans chaque tube.
- Préparez les lames de microscope en plaçant une seule étiquette de renforcement auto-adhésive au milieu de chaque lame et une gouttelette de 50 μL de support de montage anti-décoloration au centre de chaque étiquette (voir Tableau des matériaux). L’étiquette de renforcement maintient le couvercle légèrement au-dessus des glissières et empêche les cerveaux montés de s’aplatir excessivement.
- Transférez soigneusement les cerveaux de chaque tube de microcentrifugation sur une lame préparée avec le moins de tampon de lavage possible à l’aide d’un P200 équipé d’une pointe en plastique coupée et biseautée. Jusqu’à 10 cerveaux peuvent être montés sur une seule diapositive.
- Utilisez des pinces pour repositionner doucement le cerveau avant de placer un couvercle sur chaque glissière et de sceller la glissière avec du vernis à ongles. Orientez le cerveau avec le côté postérieur vers le haut ou le côté antérieur vers le haut, mais ne devriez pas se toucher.
REMARQUE: Parce qu’il est difficile d’obtenir des images confocales de haute qualité à travers un cerveau entier, certains cerveaux doivent être montés dans chaque orientation. - Conserver les lames préparées à plat et dans l’obscurité à 4 °C jusqu’à l’imagerie. Pour un stockage à plus long terme (jusqu’à 1 an), les lames peuvent être stockées à -20 °C.
5. Imagerie confocale
REMARQUE: Imagez les cerveaux à l’aide d’un microscope confocal à balayage laser avec des lasers d’excitation et des cubes de filtre d’émission appropriés au DAPI et aux anticorps secondaires fluorescents (c.-à-d. 405 nm, 488 nm et 568 nm, 633 nm, respectivement).
- Allumez l’alimentation du microscope, des lasers, du contrôleur et de l’ordinateur.
- Ouvrez le logiciel d’acquisition.
- En mode Acquisition, sélectionnez jusqu’à quatre canaux et définissez le paramètre d’analyse séquentielle des canaux souhaités. Augmentez la puissance du laser pour chaque canal à 5-10%.
- Placez une lame sur le microscope.
- Choisissez un cerveau à imager à l’aide de l’accessoire d’épifluorescence (voir Tableau des matériaux).
- En mode Acquisition, sélectionnez 1024 x 1024 pixels comme dimension d’image.
- En mode Acquisition, sélectionnez l’option Z-stack, indiquez que Z-stack doit être prélevé à des sections de 2 μm et faites la mise au point à travers l’échantillon, en sélectionnant les plans focaux supérieur et inférieur à imager.
- Collectez des images Z-stack de cerveaux entiers à l’aide d’un objectif 20x et de régions cérébrales spécifiques telles que le corps du champignon à l’aide d’un objectif 60x.
6. Analyse des données
- Quantifier les cellules proliférantes et le nombre de clones de perma-jumeaux manuellement et/ou à l’aide du logiciel d’analyse d’images (voir Tableau des matériaux). Lorsque vous utilisez un logiciel, sélectionnez les régions d’intérêt (ROI) avec des zones d’au moins 10 μm.
Résultats
Le PTBI stimule la prolifération cellulaire
Pour déterminer l’étendue de la neurogenèse après un TCC du cerveau central, la réponse proliférative a été mesurée chez les jeunes hommes adultes recueillis et blessés dans les 6 heures suivant l’eclosion. Une augmentation significative de la prolifération a été observée 24 heures après la blessure en utilisant l’anti-phosphohistone 3 (PH3), un marqueur pour les cellules subissant activement la mitose. Environ 3 cellules PH3+ dans les cerveaux centraux témoins et 11 cellules PH3+ dans les cerveaux centraux blessés sont observées 24 heures après le PTBI (Figure 2A-D). La majorité des cellules en division sont situées près du site de la blessure. Un deuxième test de division cellulaire a été utilisé pour quantifier la prolifération cellulaire cumulative d’une seule blessure et pour évaluer la mesure dans laquelle les cellules nouvellement créées ont survécu. La 5-éthyhyyl-2'-désoxyuridine (EdU) est un analogue de la thymidine qui peut être incorporé dans l’ADN nouvellement synthétisé et marquer de manière permanente les cellules qui ont subi une synthèse de l’ADN. Les mouches ont reçu un pouls de 4 jours d’EdU, suivi d’une poursuite de 3 jours. Cela a révélé que les cellules marquées étaient viables et ont survécu au moins 3 jours après la prolifération. En 7 jours, il y avait en moyenne 2 cellules EdU+ dans le cerveau central de contrôle et une moyenne de 11 cellules EdU+ dans le cerveau central blessé, respectivement (Figure 2E). Ceci est similaire aux résultats obtenus 24 heures après la blessure en utilisant l’anticorps PH3. Lorsque la prolifération cellulaire est mesurée à 14 jours, les témoins non blessés ont en moyenne 1 cellule EdU+ par cerveau central, tandis que les cerveaux blessés ont en moyenne 29 cellules EdU+ (Figure 2E), démontrant que la prolifération cellulaire se poursuit au moins jusqu’à la deuxième semaine suivant un PTBI.
La prolifération cellulaire dépend de l’âge
La plus grande réponse proliférative dans le cerveau central a été observée dans les 24 premières heures après l’éclosion (Figure 3). 7 jours après l’éclosion, une lésion pénétrante provoque toujours une augmentation significative de la prolifération, avec une moyenne de 6 cellules PH3+ par cerveau central. Pourtant, 14 jours après l’éclosion, la capacité des cellules à se diviser après un PTBI diminue considérablement à 1 cellule en division, similaire à celle des cerveaux témoins (Figure 3). Ainsi, le potentiel de prolifération cellulaire post-PTBI dépend de l’âge.
Les neurones nouvellement créés peuvent projeter pour corriger les zones cibles
Pour évaluer la régénération neuronale post-PTBI, le système de marquage perma-twin15 a été utilisé. Le traçage de la lignée des jumeaux permanents marque en permanence les cellules en division et leur descendance avec une protéine fluorescente verte (GFP) ou une protéine fluorescente rouge (RFP)15. Plus de clones de perma-jumeaux ont été détectés dans des échantillons blessés, à 2 jours et 2 semaines, que chez les témoins (figure 4A-E). Notamment, il y avait de nouveaux neurones du corps des champignons dans environ 50% des cerveaux PTBI 2 semaines après la blessure (Figure 4N). Ces nouveaux neurones ont projeté leurs dendrites de manière appropriée vers le calice du corps du champignon et leurs axones de manière appropriée vers les lobes du corps du champignon (Figure 4D, F, G). Cela indique que les cellules nouvellement créées peuvent être des neurones fonctionnels impliqués dans la réparation des corps de champignons endommagés. D’autres zones du cerveau qui semblaient se régénérer comprennent le corps ellipsoïde (EB) (Figure 4H,I), les lobes antennes (AL) (Figure 4J,K) et la corne latérale (LH) (Figure 4L,M) qui possédaient de grands clones environ 26%, 26% et 20% du temps, respectivement (Figure 4N). Ces résultats soulignent l’utilité de ce système pour l’étude de la neurogenèse adulte. Un modèle proposé pour la séquence d’événements suivant le PTBI et conduisant à la génération de nouveaux neurones est illustré à la figure 5.
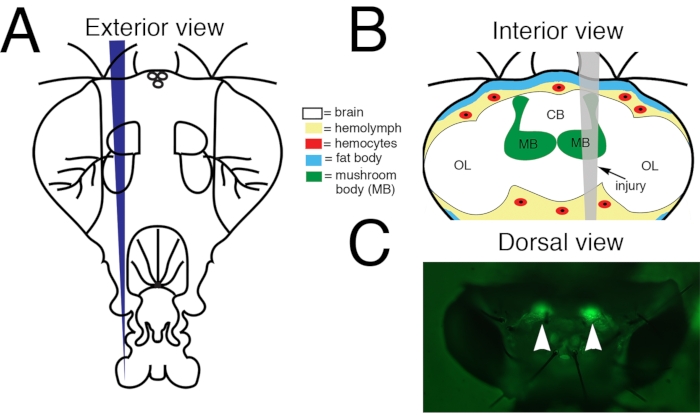
Figure 1 : Lésion cérébrale traumatique pénétrante (PTBI) dans le cerveau central de la drosophile adulte. (A) Schéma de l’extérieur d’une tête de mouche adulte. C’est une vue frontale. Ainsi, le côté droit de l’animal est à la gauche du spectateur. (B) Schéma de l’intérieur d’une tête de drosophile adulte avec la trajectoire de la blessure indiquée en gris. Il s’agit d’une vue postérieure. Ainsi, dans cette image et les figures suivantes, le côté droit du cerveau est à droite. Le PTBI central du cerveau affecte plusieurs structures cérébrales, y compris le corps du champignon (vert) et les tissus à l’extérieur du cerveau, y compris le corps gras (bleu) et les hémocytes (rouge). CB = région centrale du cerveau. OL= région du lobe optique. (C) Vue dorsale d’une tête adulte vivante dans laquelle les corps de champignons (pointes de flèches) sont marqués avec une protéine fluorescente verte (GFP). Il s’agit du « génotype standard » (voir le texte pour plus de détails). Le protocole PTBI entraîne de manière reproductible des lésions des corps de champignons. Cette figure a été adaptée de la référence 16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
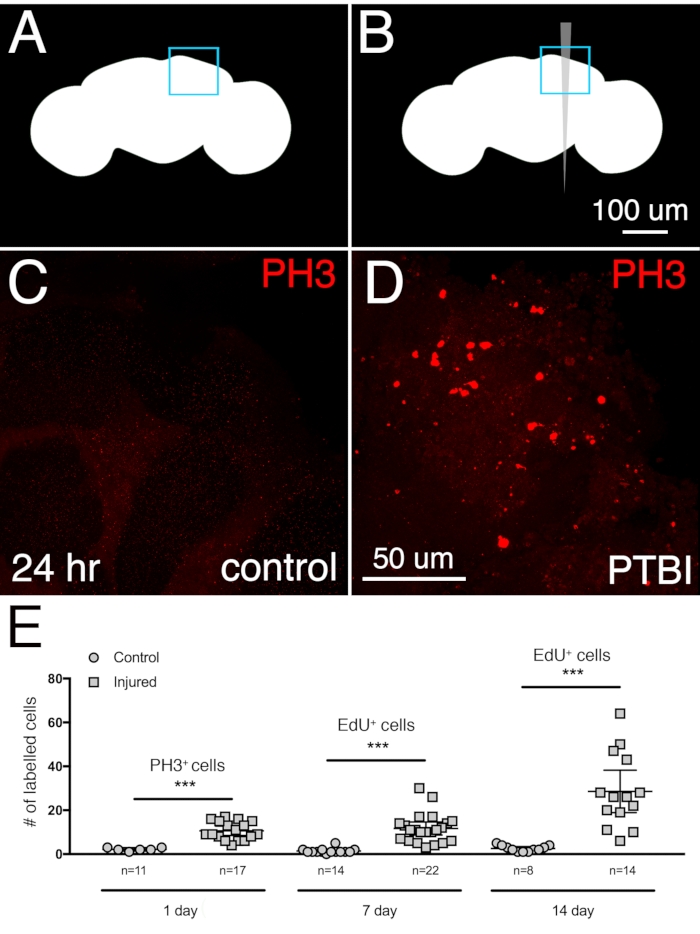
Figure 2 : Le PTBI stimule la prolifération cellulaire. Schémas de contrôle non blessé (A) et PTBI (B). Les cases bleues dans les coins supérieurs droits indiquent les régions du cerveau montrées à un grossissement plus élevé dans les panneaux (C) et (D). (C,D) L’anticorps PH3 (rouge) a été utilisé pour mesurer la prolifération cellulaire 24 heures après la blessure. Dans les cerveaux témoins (C), il y a peu de cellules PH3+ et aucune près du MB. Cependant, dans les cerveaux PTBI (D), il y a des cellules PH3+ près du MB. E) Quantification des cellules proliférantes. Les chiffres reflètent la prolifération des cellules dans tout le cerveau, pas seulement à proximité du corps du champignon. À 24 h, les cerveaux témoins non blessés avaient en moyenne 3 cellules PH3+ / cerveau (n = 11 cerveaux, 28 cellules), tandis que 24 heures après le PTBI, les cerveaux avaient en moyenne 11 cellules PH3 + / cerveau (n = 17 cerveaux, 181 cellules). À 7 jours, les témoins non blessés ont peu de cellules EdU+, avec une moyenne de 2 cellules EdU+ / cerveau (n = 15 cerveaux, 24 cellules), tandis que les cerveaux post-PTBI de 7 jours avaient une moyenne de 11 cellules EdU + / cerveau (n = 22 cerveaux, 238 cellules). À 14 jours, les témoins non blessés ont en moyenne 1 cellule/cerveau EdU+ (n = 8 cerveaux, 11 cellules), tandis que les cerveaux post-PTBI de 14 jours ont en moyenne 29 cellules EdU+ /cerveau (n = 14 cerveaux, 400 cellules). Pour cet ensemble d’expériences, de jeunes mâles adultes dans les 6 heures suivant l’eclosion ont été utilisés. Tests t non appariés d’échantillons de contrôle et de PTBI aux valeurs de rendement de 3 points temporels de p<0,0001, p<0,0001 et p<0,0002, respectivement. Les barres d’erreur reflètent l’écart-type (ET). Cette figure a été adaptée de la référence 16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
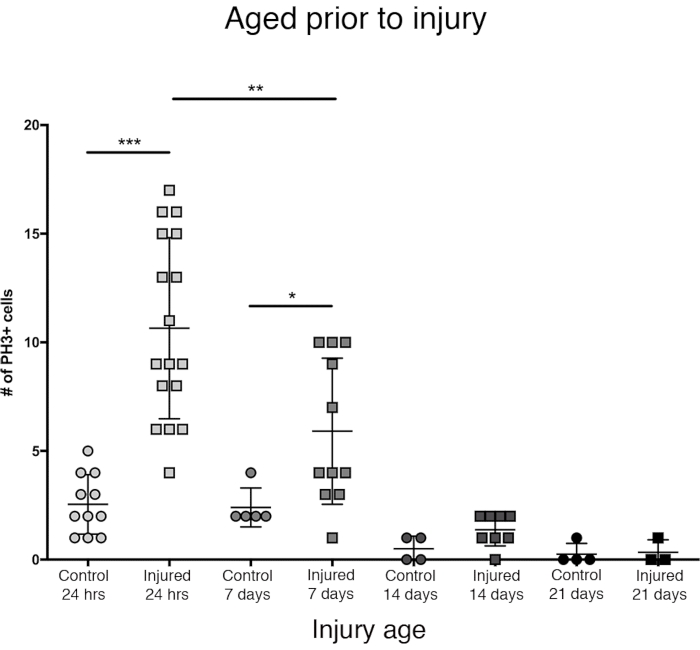
Figure 3 : La réponse proliférative au PTBI diminue avec l’âge. Pour déterminer si l’âge influe sur la prolifération cellulaire qui se produit après une blessure, les mâles adultes nouvellement éclos ont été comparés à des animaux âgés de 7 jours, 14 jours et 28 jours avant le PTBI, en utilisant un anti-PH3 pour mesurer la prolifération cellulaire 24 heures après la blessure. Les mouches blessées dans les 6 heures suivant l’éclosion avaient en moyenne 11 cellules PH3+ / cerveau (n = 17 cerveaux, 182 cellules) comparativement à une moyenne de 3 cellules PH3 + / cerveau chez les témoins appariés selon l’âge (n = 11 cerveaux, 28 cellules). Les mouches âgées de 7 jours, puis soumises à un PTBI, avaient en moyenne 6 cellules PH3+ / cerveau (n = 11 cerveaux, 65 cellules) par rapport aux témoins appariés selon l’âge avec une moyenne de 2 cellules PH3 + / cerveau (n = 5 cerveaux, 12 cellules). Lorsque les mouches étaient âgées de 14 jours avant le PTBI et testées 24 heures plus tard, il y avait en moyenne 1 cellule / cerveau PH3 + (n = 8 cerveaux, 11 cellules) similaire aux témoins appariés selon l’âge, qui avaient également une moyenne de 1 cellule / cerveau PH3 + (n = 4 cerveaux, 2 cellules). Les mouches témoins non blessées de 28 jours (n = 4, 1 cellule) et PTBI (n = 3, 1 cellule) ont toutes deux atteint en moyenne 0 cellule PH3 + / cerveau. Les tests t non appariés pour ptbi pour contrôler les comparaisons à ces 4 points de temps sont p<0,0001, p<0,04, p<0,07 et p<0,84, respectivement. Cette figure a été adaptée de la référence 16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
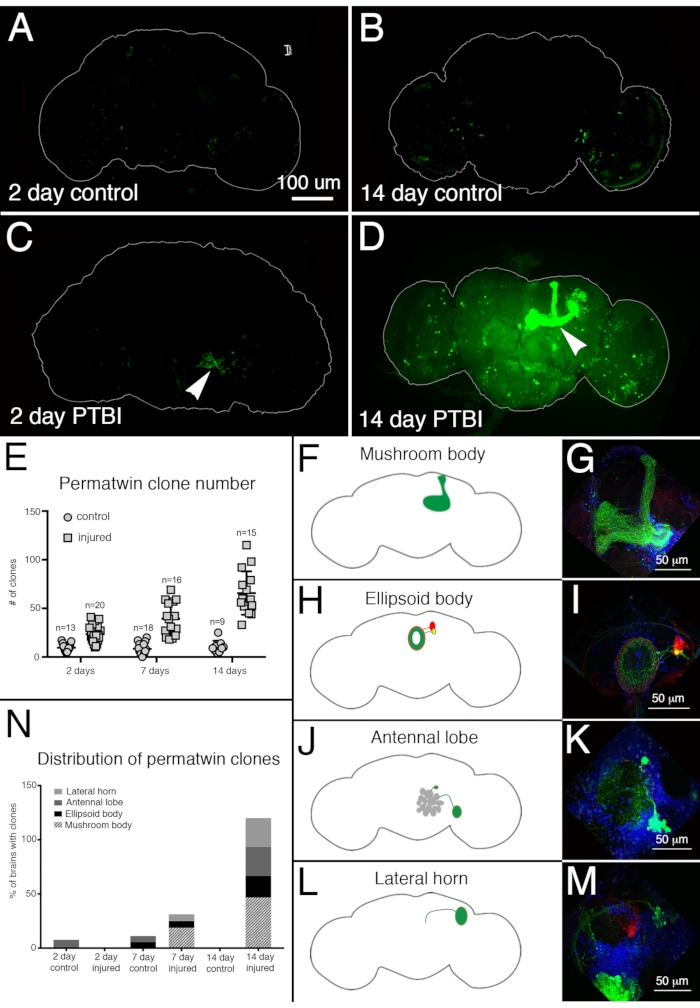
Figure 4 : Le traçage de la lignée des jumeaux perma illustre la régénération du cerveau et le ciblage approprié des axones après un TSPT. Le système de traçage de la lignée perma-jumelle15 a été utilisé pour analyser la neurogenèse après PTBI. Ce système marque en permanence les cellules en division et la progéniture avec une protéine fluorescente verte (GFP) ou une protéine fluorescente rouge (RFP). Les mouches ont été élevées à 17 °C pour garder le système éteint pendant le développement. Les mâles F1 porteurs de transgènes perma-jumeaux ont été prélevés lors de l’eclosion, puis blessés et placés à 30 °C pour récupérer pendant 2 ou 14 jours. (A) Chez les témoins non blessés de 2 jours, certaines cellules GFP+ sont dispersées dans le cerveau. (B) À 14 jours, il y a relativement peu de cellules GFP+ présentes dans le cerveau central de contrôle. (C) En comparaison, les cerveaux blessés de 2 jours ont plus de cellules GFP + qui ont tendance à se regrouper près de la blessure (pointe de flèche). (D) 14 jours après la blessure, il y a de gros clones près du site de la blessure. Certains de ces clones ont des axones qui se projettent le long des étendues du corps du champignon (pointe de flèche). Seul le canal GFP est affiché ici; il y avait des clones RFP+ similaires dans les échantillons PTBI. (E) Le nombre de clones augmente au fil du temps post-PTBI.Contrôler les cerveaux non blessés (n = 13) ont en moyenne 10 clones à 2 jours, tandis que les cerveaux PTBI à 2 jours (n = 20) ont une moyenne de 23 clones (p<0,00002). À 7 jours, les cerveaux témoins avaient en moyenne 9 clones par cerveau (n = 18), tandis que les cerveaux PTBI de 7 jours avaient en moyenne 39 clones par cerveau (n = 16) (valeur p<0,00000002). C’est nettement plus que le nombre de clones vus 2 jours après la blessure (valeur p<0,0009). Dans les cerveaux témoins de 14 jours, il y a en moyenne 10 clones par cerveau, ce qui n’est pas significativement différent des contrôles de 2 jours et de 7 jours. Cependant, à 14 jours après le PTBI, il y a en moyenne 66 clones GFP+, ce qui est significativement plus que les témoins appariés selon l’âge (p<0,0000003) ou les cerveaux post-PTBI de 2 jours (valeur p<0,0001). Les barres d’erreur reflètent SD. (F-M) PTBI stimule la formation de clones dans plusieurs régions du cerveau. Les panneaux sur le côté gauche sont des schémas de régions du cerveau où de grands clones ont été trouvés 14 jours après le PTBI (A, H, J, L). Les panneaux de droite montrent des grossissements élevés de cerveaux représentatifs (G, I, K, M). De nombreux cerveaux de 14 jours avaient des clones qui se projetaient vers des zones cibles particulières. Ceux-ci comprenaient le corps du champignon (MB) (F, G), le corps ellipsoïde (EB) (H, I), le lobe antennel (AL) (J, K) et la corne latérale (LH) (L, M). (N) Le nombre de clones et la taille des clones augmentent avec le temps post-PTBI.Les proportions de régions cérébrales avec de grands clones ont été calculées à 2, 7 et 14 jours chez les témoins et les cerveaux blessés. À 2 jours, ~ 8% des cerveaux témoins (n = 13) ont montré des clones AL, alors qu’il n’y avait pas de clones AL dans les cerveaux blessés de 2 jours (n = 20). Dans les cerveaux témoins de 7 jours (n = 18), 6% avaient AL et 6% avaient des clones EB. À 7 jours après le PTBI (n = 16), 6 % des cerveaux avaient également des clones AL, 6 % avaient des clones EB et 19 % avaient de gros clones MB. À 14 jours, les cerveaux témoins (n = 9) ne présentaient aucune zone spécifique avec des clones, tandis que 47 % des cerveaux PTBI (n = 15) avaient des clones MB, 20 % des cerveaux PTBI avaient des clones AL, et 27 % des cerveaux PTBI avaient des clones EB, et 27 % avaient des clones LH. Cette figure a été adaptée de la référence 16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
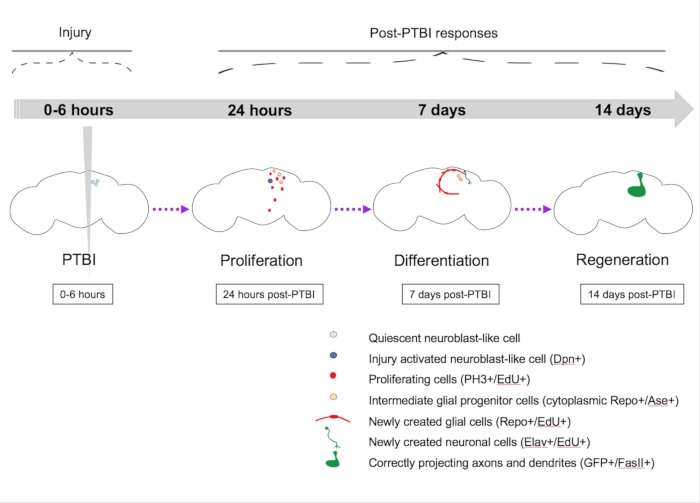
Figure 5 : Modèle sommaire de régénération à la suite d’une lésion cérébrale traumatique pénétrante (ITPT). Chez la drosophile jeune adulte, il existe des cellules de type neuroblaste quiescentes dans le cerveau central qui n’expriment pas les gènes canoniques des neuroblastes. 24 heures après le PTBI, les cellules de type neuroblaste quiescentes sont activées, expriment des gènes neuroblastiques et ont commencé à proliférer. À la fois 4 h et 24 h après le PTBI, il y a une vague de mort cellulaire16. À 7 jours, le taux de prolifération est encore élevé et de nombreuses nouvelles cellules ont adopté des identités cellulaires matures, devenant des neurones ou des glies. 14 jours après le PTBI, de grands clones de nouveaux neurones avec des axones et des dendrites se projettent correctement vers leurs zones cibles respectives. Les défauts locomoteurs sont également restaurés par 14 jours, ce qui suggère que la drosophile adulte peut se régénérer fonctionnellement et structurellement. Cette figure a été adaptée de la référence 16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Bien que des lésions pénétrantes du cerveau de la drosophile adulte aient été décrites précédemment15,17,18, ces blessures se sont concentrées sur les lobes optiques et non sur le cerveau central. En outre, des instructions détaillées sur la façon de procéder aux blessures font jusqu’à présent défaut. Ce protocole décrit un modèle de lésion pénétrante du cerveau central de la drosophile adulte qui reproduit des preuves statistiquement significatives de la neurogenèse adulte après PTBI.
La reproductibilité de ce protocole PTBI est due, en partie, au corps du champignon en tant que région cible de la blessure. Le corps du champignon est grand, composé d’environ 2200 neurones avec des tonnelles complexes de dendrite et d’axone dans de grands réseaux hautement stéréotypés18. Les corps cellulaires des neurones du corps des champignons se trouvent près de la surface du cerveau et peuvent être visualisés à travers la cuticule de la tête en utilisant l’expression de la protéine fluorescente verte (GFP) (Figure 1C). Les précurseurs du corps des champignons sont les dernières cellules souches neurales à subir une apoptose au cours du développement13,12,19. Ainsi, de nombreux neurones du corps des champignons sont assez jeunes au moment de l’éclosion. Cela a conduit à l’hypothèse que le corps du champignon pourrait avoir plus de potentiel mitotique que d’autres régions du cerveau16. De plus, le corps du champignon est essentiel à l’apprentissage et à la mémoire18. Cela permet de se demander si la neurogenèse déclenchée par le PTBI conduit à une récupération fonctionnelle.
D’autres facteurs qui contribuent à la reproductibilité des résultats comprennent l’utilisation de mouches croisées de génotypes cohérents, la réalisation de croisements dans la même direction à chaque fois, le contrôle précis des températures d’élevage et de vieillissement et l’analyse séparée des mâles et des femelles. L’utilisation de mouches F1 à partir d’un croisement réduit la probabilité d’analyser les cerveaux homozygotes pour détecter les mutations spontanées. La croix standard de y[1] w[1]; UAS-mCD8-GFP;; OK107-GAL4 femelles adultes à y[1] w[1] mouches mâles adultes entraîne la descendance F1 du génotype y[1] w[1]; UAS-mCD8-GFP/+;; OK107-GAL4/+. OK107-GAL4 est exprimé dans tous les neurones intrinsèques du corps du champignon et conduit à l’expression du rapporteur lié à la membrane UAS-mCD8-GFP permettant la visualisation des corps des champignons et de leurs projections. Pour les croix perma-twin, les croix doivent rester à 17 °C en tout temps pour que le système de traçage de la lignée reste éteint. Cela garantit qu’aucune cellule en division n’est marquée pendant le développement et que seuls les neurones et la glie nés à l’âge adulte sont marqués. À cette fin, la salle des mouches peut également être maintenue à 17 ° C. Bien que la description initiale du système perma-twin15 recommandait d’élever des mouches à 18 °C, cela peut conduire à un étiquetage de fond important.
Pour plus de cohérence, il est également recommandé de garder les mouches non blessées sur le tampon de CO2 pendant que l’on effectue le PTBI. Cela garantit que les deux ensembles de mouches ont une exposition anesthésique identique. En outre, il est souhaitable que la reproductibilité pénètre complètement dans la tête. Cependant, il faut veiller à ne pas plier la pointe de la broche contre le coussinet, ce qui la rend inutilisable pour de futures blessures. Pour les praticiens qualifiés, il y a peu de dommages involontaires aux mouches PTBI. Néanmoins, appuyer trop fort sur le thorax pour stabiliser la mouche pendant la blessure peut être mortel. Une façon d’évaluer l’étendue de la blessure involontaire consiste à quantifier la mortalité des mouches PTBI 24 heures après la blessure. Pour les mouches blessées unilatéralement, cela peut être de 50% ou plus pour les débutants. Par conséquent, pour s’assurer que les résultats observés sont dus au PTBI et non à des blessures involontaires, il est conseillé aux débutants de s’entraîner à administrer du PTBI sur environ 20 mouches par jour pendant plusieurs semaines et de ne pas analyser les cerveaux résultants jusqu’à ce que la mortalité de 24 heures soit systématiquement <10%.
Pour quantifier la quantité de prolifération stimulée par le PTBI du cerveau central, on peut utiliser à la fois l’immunocoloration anti-phosphohistone H3 (PH3) et l’incorporation de 5-éthyyl-2'-désoxyuridine (EdU). L’anti-PH3 marque les cellules avant et tout au long de la métaphase, limitant la détection à une fraction seulement des cellules en division active. Ainsi, la coloration anti-PH3 ne donne qu’un aperçu partiel de la prolifération. EdU est un analogue de la thymidine qui peut être incorporé dans l’ADN nouvellement synthétisé. En nourrissant les mouches EdU avant et après la blessure, il est possible d’obtenir une image plus complète des cellules qui se divisent ou se sont divisées après la blessure. Le fait que toutes les cellules qui se divisent soient marquées en permanence est utile à la fois pour l’identification des cellules à cycle lent et pour tester la survie des cellules après la prolifération initiale. Pour des raisons peu claires, mais peut-être en raison de la perméabilité limitée de la barrière hémato-encéphalique, l’étiquetage EdU est inefficace et sous-estime la prolifération cellulaire dans le cerveau adulte. Ceci est mis en évidence par le nombre similaire de cellules PH3+ et EdU+ dans les cerveaux témoins et expérimentaux à 24 heures après le PTBI et en observant que seul un sous-ensemble de nouvelles cellules dans les clones de jumeaux perma incorpore EdU16. Pour un étiquetage maximal, il est essentiel de pré-nourrir les mouches avec de l’EdU car les mouches blessées ne reprennent pas leur alimentation pendant plusieurs heures après le PTBI. L’alimentation a été évaluée en ajoutant du colorant alimentaire à la solution d’EdU et en surveillant la quantité de colorant dans l’intestin à travers la cuticule abdominale16.
Il est à noter que bien que nous ayons fourni un protocole de dissection cérébrale à l’étape 4, des techniques alternatives peuvent être utilisées. Plusieurs d’entre eux sont disponibles dans des protocoles précédemment publiés20,21,22. Drosophila melanogaster offre un modèle à faible coût avec de puissants outils génétiques et moléculaires qui peuvent être utilisés pour étudier les mécanismes sous-jacents à la régénération de plusieurs tissus, y compris l’intestin et les composants du système nerveux. Un nouveau modèle de blessure reproductible qui peut être utilisé pour étudier la réponse aux lésions cérébrales est décrit ici. Les données obtenues à l’aide de ces protocoles soutiennent l’idée que le cerveau central de la drosophile adulte conserve la capacité proliférative, générant de nouveaux neurones en réponse à une blessure. Ces observations justifient une étude plus approfondie de l’étendue de la neurogenèse adulte et de ses mécanismes moléculaires sous-jacents. Une fois que les composants impliqués dans la régénération neuronale sont identifiés dans ce système, nous pouvons convertir nos connaissances sur la neurogenèse de la drosophile adulte en humains.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Nous remercions Stacey Rimkus et Becky Katzenberger pour leur assistance technique et Eduardo Moreno pour le partage des stocks de perma-twin. Nous tenons à remercier Barry Ganetzky et David Wassarman pour leurs discussions animées qui ont sans aucun doute amélioré la science et Kent Mok, Cayla Guerra et Bailey Spiegelberg pour leurs contributions au laboratoire. Les anticorps FasII ont été développés par Corey Goodman et obtenus à partir de la Developmental Studies Hybridoma Bank, créée par le NICHD du NIH et maintenue à l’Université de l’Iowa, Département de biologie, Iowa City, IA 52242. La plupart des souches de drosophiles utilisées dans cette étude ont été obtenues du Bloomington Drosophila Stock Center (BDSC; NIH P40OD018537). Ce travail a été soutenu par NIH T32 GM007133 (KLC); NIH NS090190 (GBF); NIH NS102698 (GBF); la Graduate School (GBF) de l’Université du Wisconsin; et l’UW-Madison Women in Science and Engineering Leadership Institute (WISELI) (GBF).
matériels
| Name | Company | Catalog Number | Comments |
| #11 disposable scalpels | Santa Cruz Biotechnology | sc-395923 | used for separating Drosophila heads from trunks prior to brain dissection |
| 150 mm diameter black Sylgard dishes | Dow | 1696157 | made in the laboratory with reagents from Dow; used for brain dissection |
| 18 mm coverslips | any | for mounting brains on microscope slides | |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | ThermoFisher | D1306 | for immunohistochemistry |
| 70% Ethanol | made from 95% ethanol sourced variously | ||
| anti-mouse Cy5 | Jackson ImmunoResearch | 715-175-151 | for immunohistochemistry |
| anti-rabbit 568 | ThermoFisher | A11036 | for immunohistochemistry |
| bovine serum albumin (BSA) | SIgma Aldrich | A7030 | for immunohistochemisty |
| Clear nail polish | any | for sealing coverslips | |
| Click-It EdU labeling kit | InVitrogen | C10640 | to detect newly synthesized DNA |
| CO2 bubbler | Genesee Scientific | 59-181 | for anesthesia |
| CO2 pad | Genesee Scientific | 59-114 | for anesthesia |
| CO2 regulator and supply | any | for anesthesia | |
| Confocal microscope | any | for imaging fixed, stained and mounted brains | |
| cotton plugs | Genesee Scientific | 51-101 | for EdU labeling |
| Drosophila vials | Genesee Scientific | 32-109 | for EdU labeling |
| Fix buffer (Pipes, EGTA, Magnesium; PEM) | components sourced from various companies | for fixing adult brains; 100 mM piperazine-N,N’-bis(2-ethanesulfonic acid) [PIPES], 1 mM EGTA, 1 mM MgSO4, pH 7.0 | |
| Formaldehyde | Sigma Aldrich | 252549 | for fixing adult brains, added to PEM |
| Grade 3 round Whatman filters, 23 mm round | Tisch Scientific | 1003-323 | for EdU labeling |
| Microfuge tubes | any | for fixing and staining reactions and for storing Minutien pins | |
| Microscope slides | any | for mounting brains | |
| Minutien pins | Fine Science Tools | 26002-10 | for brain injury; 12.5 μm diameter tip and 100 μm diameter rod |
| mouse anti-Fasiclin II | Developmental Studies Hybridoma Bank | 1D4-s | for immunohistochemistry |
| NIGHTSEA stereo microscope fluorescence adaptor | Electron Microscopy Sciences | SFA-GR | fluorescence setup for dissecting microscope |
| P20, P200 and P1000 pipettors and tips | any | for measuring solutions | |
| phosphate buffered saliine (PBS) | components sourced from various companies | for dissecting brains and making immunohistochemistry blocking and washing solutions; 100 mM of K2HPO4, 140 mM of NaCl, pH 7.0 | |
| phosphate buffered saline with 0.1% Triton X-100 (PT) | components sourced from various companies | for washing dissected brains | |
| phosphate buffered saline with 0.1% Triton X-100 + 2% bovine serum albumin (PBT) | components sourced from various companies | blocking solution for immunohistochemistry and for diluting antibodies | |
| rabbit anti-PH3 | Santa Cruz Biotechnology, Inc | sc-8656-R | for immunohistochemistry |
| Reinforcement labels | Avery | 5721 | to maintain space between the microscope slide and the coverslip |
| Size 0 paintbrushes | any | to manipulate and stabilize adult Drosophila during injury | |
| Triton X-100 | Sigma Aldrich | 93443 | |
| Two pair of #5 watchmakers forceps | Fine Science Tools | 11255-20 | used to hold the Minutien pins and for brain dissections |
| Vectashield | Vector Laboratories | H-1000 | mounting medium for microscope slides |
Références
- Thurman, D., et al. Report to Congress: Traumatic brain injury in the United States. , Available from: https://www.cdc.gov/traumaticbraininjury/pubs/tbi_report_to_congress.html (1999).
- NIEHS. , Available from: https://www.nih.gov/research/supported/health/neurodegenerative/index.cfm (2021).
- Morton, N. V., Wehman, P. Psychosocial and emotional sequelae of individuals with traumatic brain injury: A literature review and recommendations. Brain Injury. 9 (1), 81-92 (2017).
- Bonini, N. M., Berger, S. L. The sustained impact of model organisms-in genetics and epigenetics. Genetics. 205, 1-4 (2017).
- Brace, E. J., DiAntonio, A. Models of axon regeneration in Drosophila. Experimental Neurology. 287, Pt 3 310-317 (2017).
- Hao, Y., Collins, C. Intrinsic mechanisms for axon regeneration: insights from injured axons in Drosophila. Current Opinion in Genetics & Development. 44, 84-91 (2017).
- Chiang, A. S., et al. Three-dimensional reconstruction of brain-wide wiring networks in Drosophila at single-cell resolution. Current Biology. 21 (1), 1-11 (2011).
- Meinertzhagen, I. A. The organisation of invertebrate brains: cells, synapses and circuits. Acta Zoologica. 91 (1), 64-71 (2010).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: A history lesson for the future. Nature Reviews Neuroscience. 11 (7), 514-522 (2010).
- Lessing, D., Bonini, N. M. Maintaining the brain: insight into human neurodegeneration from Drosophila melanogaster mutants. Nature Reviews Genetics. 10 (6), 359-370 (2009).
- Boone, J. Q., Doe, C. Q. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells. Developmental Neurobiology. 68 (9), 1185-1195 (2008).
- Ito, K., Hotta, Y. Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster. Developmental Biology. 149 (1), 134-148 (1992).
- Siegrist, S. E., Haque, N. S., Chen, C. H., Hay, B. A., Hariharan, I. K. Inactivation of both Foxo and reaper promotes long-term adult neurogenesis in Drosophila. Current Biology. 20 (7), 643-648 (2010).
- von Trotha, J. W., Egger, B., Brand, A. H. Cell proliferation in the Drosophila adult brain revealed by clonal analysis and bromodeoxyuridine labelling. Neural Development. 4, 9(2009).
- Fernandez-Hernandez, I., Rhiner, C., Moreno, E. Adult neurogenesis in Drosophila. Cell Reports. 3 (6), 1857-1865 (2013).
- Crocker, K. L., et al. Neurogenesis in the adult Drosophila brain. Genetics. , (2021).
- Plavicki, J., Mader, S., Pueschel, E., Peebles, P., Boekhoff-Falk, G. Homeobox gene distal-less is required for neuronal differentiation and neurite outgrowth in the Drosophila olfactory system. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1578-1583 (2012).
- Aso, Y. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Ito, K., Awano, W., Suzuki, K., Hiromi, Y., Yamamoto, D. The Drosophila mushroom body is a quadruple structure of clonal units each of which contains a virtually identical set of neurones and glial cells. Development. 124 (4), 761-771 (1997).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A. Simple one-step dissection protocol for whole-mount preparation of adult Drosophila brains. Journal of Visualized Experiments. (118), e55128(2016).
- Kelly, S. M., Elchert, A., Kahl, M. Dissection and immunofluorescent staining of mushroom body and photoreceptor neurons in adult Drosophila melanogaster brains. Journal of Visualized Experiments. (129), e56174(2017).
- Arain, U., Valentino, P., Islam, I. M., Erclik, T. Dissection, immunohistochemistry and mounting of larval and adult Drosophila brains for optic lobe visualization. Journal of Visualized Experiments. (170), e61273(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon