Method Article
使用多分析物免疫珠测定法对Covid-19进行血清转换的动态监测
* 这些作者具有相同的贡献
摘要
本文介绍了一种方便的方法,用于同时监测两种免疫球蛋白同种型(IgA、IgM 或 IgG)的抗体滴度的动态变化,这些变化是由对 SARS-CoV-2 感染或疫苗接种的免疫反应引起的。该"多分析物Covid-19免疫反应面板"采用三种基于编码微球的间接免疫测定,这些微球使用具有"双通道"功能的基于流的多路复用读取器读取。
摘要
用于协同询问多种生物标志物的多重技术已经存在了几十年;然而,在同一分析物上评估多个表位的方法仍然有限。本报告介绍了一种多重免疫珠测定的开发和优化,该测定法用于对与 SARS-CoV-2 感染或疫苗接种的免疫反应相关的常见免疫球蛋白同种型(例如 IgA、IgM 和 IgG)进行血清学检测。使用具有双通道功能的基于流动的多重荧光阅读器完成测定。优化侧重于分析物捕获时间、检测抗体浓度和检测抗体孵育时间。使用"双通道"模式为IgG / IgM或IgA / IgM血清型组合建立了分析测定性能特征(例如,测定范围(包括定量的下限和上限);以及测定内和测定间精度)。IgG的分析物捕获时间为30分钟,IgM为60分钟,IgA的分析物捕获时间为120分钟,适用于大多数应用,从而提供了测定性能和通量的平衡。观察到最佳检测抗体在4μg/ mL下孵育30分钟,并推荐用于一般应用,给定整体出色的精度(百分比方差系数(%CV)≤20%)和观察到的灵敏度值。对于每种测定(Spike S1,核衣壳和膜糖蛋白),IgG同种型的动态范围跨越了几个数量级,这支持在临床应用中以1:500稀释因子进行稳健的滴度评估。最后,将优化方案应用于监测完成SARS-CoV-2疫苗方案的受试者(n = 4)的Spike S1血清转换。在该队列中,观察到Spike S1 IgG水平在第二次给药后14天达到最大滴度,其信号强度远高于IgM或IgA同种型(约40倍)。有趣的是,我们观察到高度可变的Spike S1 IgG滴度衰减率在很大程度上取决于受试者,这将是未来研究的主题。
引言
同时测量生物样品中多种与疾病相关的生物标志物,可以对病理过程进行描述性和预测性分析。虽然传统的单一分析物免疫学程序,如酶联免疫吸附测定(ELISA),一直是临床和研究环境中定量分析的基石,但这些技术在通量、每次测量所需的标本数量以及成本效益方面可能存在重大限制,这些因素极大地限制了在整个病程中经常交织在一起的多种生物元素的研究1.基于微球的多路复用技术已成为诊断和研究设施不可或缺的平台,因为它能够结合分析以提高实验室通量,减轻样品稀缺性,并减少重复测试,从而最大限度地节省成本1,2,3,4。最近,通过具有双报告器功能的仪器进一步增强了这种多路复用能力。双报告基因功能实现了两个用于检测的荧光通道,提供了另一个维度的多重检测,允许在同一分析物上检测多个表位。
严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)是当前2019年冠状病毒病(COVID-19)大流行5的病原体。虽然RT-PCR检测对于在病程开始时确认感染至关重要,但抗体滴度的血清学检查已被证明对于准确和完整地批评个体先前的暴露或恢复至关重要;对免疫接种的反应;和/或评估Covid-19疫苗接种效果6,7。
本报告描述了利用基于流的多重阅读器双重报告系统测量多种SARS-CoV-2病毒抗原血清转换的方法。具体而言,描述了针对 3-plex SARS-CoV-2 抗原组合(包括 Spike S1、核衣壳体和膜(又名基质)糖蛋白的测定)的两种抗体亚型(配置为 IgG/IgM 或 IgA/IgM)的并发检测。这种方法为捕获纵向血清转换提供了理想的企业,并为抗击Covid-19大流行提供了宝贵的工具。
研究方案
所有受试者均在书面知情同意下入组,并得到拉什大学医学中心机构审查委员会(IRB)的完全批准,该协议ORA 20101207遵守伦理研究行为的所有机构指南。通过常规放血术将血液收集到薰衣草真空吸尘器(K2EDTA)中,并使用推荐的方案进行处理。将得到的血浆在-80°C下存档,直到进行评估。
1. 抗原偶联微球的制备
- 选择三个不同的磁微球小瓶,具有独特的磁珠区域,记录每个使用的微孔的磁珠ID和批次信息。
注意:对于每个不同的微球区域,将遵循以下步骤。微球对光敏感,应避免长时间暴露在光线下。在洗涤步骤中,请注意不要干扰微球。如果受到干扰,允许第二次60秒的分离。 - 涡旋微球储备60秒,超声处理5分钟,然后使用解离聚集的珠子。
- 将 1.0 x 106 个磁珠转移到 1.5 mL 低蛋白结合微量离心管中。
- 将管子插入磁选机中,并允许分离60秒。当管子仍在磁选机中时,小心地除去上清液而不干扰珠粒。
- 从磁选机中取出管子,用100μLHP级水重悬磁珠,涡旋30秒。将管放回磁选机中60秒,然后除去上清液。重复此洗涤方案两次。
- 从磁选机中取出管子,并通过涡旋将洗涤的微球重悬于90μL100mM单基磷酸钠,pH 6.2(活化缓冲液)中30秒。
- 向微球中加入10μL50mg / mL磺基NHS(用活化缓冲液稀释)并轻轻涡旋10秒。加入10μL50mg / mL EDC溶液(用活化缓冲液稀释)并轻轻涡旋10秒。在室温(RT)下孵育微球20分钟,每10分钟进行一次温和的涡旋。
- 用50 mM MES重复洗涤步骤1.4-1.5,pH 5.0(耦合缓冲液)代替LC / MS级水,总共两次洗涤。
- 从磁选机中取出管子,并通过涡旋将微球与100μL耦合缓冲液重悬30秒,然后立即加入所需量的蛋白质。
- 使用偶联缓冲液使总体积达到150μL。通过涡流混合偶联反应30 s,并在室温下旋转孵育2小时。
注意:对于本文定义的测定,用以下蛋白质浓度进行偶联:Spike S1:5μg;核衣壳: 5 微克;膜:12.5微克。 - 用磷酸盐缓冲盐(PBS)-1%山羊血清白蛋白,0.01%聚山梨醇酯-20(淬火缓冲液)代替LC / MS级水重复洗涤步骤1.4,共洗涤两次。通过涡旋将洗涤的微球重悬于含有0.05%叠氮化钠的100μL淬灭缓冲液中30秒。
注意:在进行任何其他程序之前,允许珠子完全淬灭至少6小时。 - 使用自动细胞计数器或血细胞计数器计数回收微球的数量。记录观察到的磁珠浓度。
- 在黑暗中将耦合的微球在4°C下冷藏。
2. 程序
- 检测性能(基本方案)
- 通过涡流重悬耦合的微球30 s,超声处理〜60-90 s。
- 从相应的管中取出所需量的每个胶体,并将珠胶体组合在新的1.5 mL微量离心管中。
- 将管子插入磁选机,并允许分离60秒。当管子仍在磁选机中时,小心地除去上清液而不干扰珠粒。
- 从分离器中取出珠子,用100μLPBS-1%牛血清白蛋白,0.01%聚山梨醇酯-20(测定缓冲液)重悬微球,并涡旋30秒。将管子放入磁选机中,并允许分离60秒。重复此洗涤方案(即步骤2.1.3-2.1.4)两次
- 通过添加适当体积的测定缓冲液来调节3-plex工作微球混合物的浓度,以为每个靶标产生每1μL100个微球的最终浓度。
- 等分试样将步骤2.1.5制备的微球混合物等分试样放入384孔板的每个孔中或将25μL放入96孔板的每个孔中。
- 在测定缓冲液中将血浆/血清标本稀释500倍。根据所需的滴定制备标准试样。
- 加入12.5μL测定缓冲液作为空白样品,并将每个稀释的样品或标准品加入384孔样品板的每个指定孔中,或将25μL空白,稀释的样品或标准品加入96孔样品板的每个孔中。
- 用铝密封或铝箔覆盖板,并在设置为700 rpm的平板振荡器上以RT孵育1小时。
注:稀释曲线示意图见 表1。 - 按照步骤2.1.11中规定的测定缓冲液,以4μg/ mL制备抗人检测抗体(二抗溶液)溶液。
- 制备山羊抗人IgM,与超亮436(SB)/山羊抗人IgA结合,藻红素(PE)偶联物检测抗体在4μg/ mL;或山羊抗人IgM,SB偶联物/山羊抗人IgG,PE偶联物检测抗体在4μg/ mL。
注意:对于384孔板格式,需要12.5μL/孔制备的二抗溶液,对于96孔板格式,需要25μL /孔。 - 将板放在磁选机上,快速洗涤,然后用力倒置在生物危害容器上以从孔中除去液体。在盘子仍然倒置的情况下,用力将盘子拍打在厚厚的纸上。
- 如前所述,用100μL测定缓冲液洗涤每个孔,并通过在生物危害容器上强力倒置除去液体。重复这些步骤(2.1.12-2.1.13),总共进行两次洗涤。将所有用过的纸张丢弃到生物危害容器中。
- 向384孔板的每个孔中加入12.5μL二抗工作溶液,或向96孔板的每个孔中加入25μL。用铝密封或铝箔覆盖板,并在设置为700rpm的板振荡器上以RT孵育30分钟。
- 重复洗涤步骤 2.1.12-2.1.13
- 将75μL测定缓冲液加入384孔板的每个孔中,或将100μL加入96孔板的每个孔中。用铝密封或铝箔覆盖板,并在设置为700rpm的板振荡器上以RT孵育5分钟。
- 根据系统手册,通过仪器分析仪分析 60 μL。
- 优化标本捕获孵育时间
- 在步骤2.1.9中使用30分钟,60分钟和120分钟的孵育时间的持续时间执行2.1节中的步骤。
注意:可以使用不同的板进行孵育,也可以通过在步骤2.1.6暂停进行,直到进入步骤2.1.9为止。达到所需的孵化时间。 - 根据制造商的建议,使用60μL测定混合物在分析仪上继续板读数。
- 在步骤2.1.9中使用30分钟,60分钟和120分钟的孵育时间的持续时间执行2.1节中的步骤。
- 二抗浓度优化
- 按照第2.1节中的详细说明执行此过程,但二抗工作溶液(在步骤2.1.10-2.1.11中制备)中试剂的最终浓度除外,修改如下:
山羊抗人(或兔子)IgM,SB结合物检测抗体在8,4,2,1和0.5μg/ mL。
山羊抗人(或兔)IgA,PE偶联物检测抗体在8,4,2,1和0.5μg/ mL。
山羊抗人(或兔)IgG,PE偶联物检测抗体在8,4,2,1和0.5μg/ mL。
山羊抗人(或兔)IgG,PE偶联物/山羊抗人(或兔)IgM,SB偶联物检测抗体,8,4,2,1和0.5μg/ mL。
山羊抗人(或兔)IgA,PE偶联物/山羊抗人(或兔)IgM,SB偶联物检测抗体,8,4,2,1和0.5μg/ mL。 - 根据制造商的建议,使用60μL测定混合物在分析仪上继续板读数。
- 按照第2.1节中的详细说明执行此过程,但二抗工作溶液(在步骤2.1.10-2.1.11中制备)中试剂的最终浓度除外,修改如下:
- 优化二抗孵育时间
- 按照步骤2.1.14中定义的孵育持续时间15分钟,30分钟,60分钟和120分钟执行2.1节中详述的该过程。
- 根据制造商的建议,使用60μL测定混合物在分析仪上继续板读数。
- 使用优化的双通道检测法评估受试者标本
- 在与完成Covid-19疫苗(即第二剂)给药相关的第-21、-11、-1/0、+14、+28、+60、+90和+120天收集受试者血浆样本(n = 4)。
注意:第0天表示完成疫苗接种的时间点。 - 使用基础方案(第2.1节)作为IgG / IgM或IgA / IgM双通道测定进行所有测定。
- 将结果归一化到每个特定免疫球蛋白和测定的最大观察到的中位荧光强度(MFI)值。
- 在与完成Covid-19疫苗(即第二剂)给药相关的第-21、-11、-1/0、+14、+28、+60、+90和+120天收集受试者血浆样本(n = 4)。
结果
典型分析结果和性能评估
免疫珠测定通常在几个(对数)数量级上进行评估时提供乙状曲线,如图 1所示的每个面板所示。用户必须通过实验定义多重检测中每种分析物的最佳浓度范围,以确定整个定量范围,确保不会对极端值(接近定量下限 [LLOQ] 或定量上限 [ULOQ] 的区域)进行过度采样。然而,测定所需的实际范围取决于生物基质中靶分析物(即"未知物")在给定稀释因子下的分布。此外,尽管标准曲线通常通过线性回归和4或5参数拟合算法进行解释,但给定曲线的线性部分通常通过线性(y = mx + b)定量模型提供最大的定量精度置信度。将校准曲线与给定稀释因子下未知值的观察值相匹配应该是定量测定开发的目标。
在这方面,对Spike S1,核衣壳和膜抗体中的每一种进行了基于1:5连续稀释系列的7点标准曲线,其范围在1μg/ mL和0.000064μg/ mL之间,对于Spike S1和Nucleocapsid,以及5μg/ mL和0.00032μg/ mL的膜,如图 1所示。每个测定的下限检测(LLOD)被定义为产生与其背景可区分的信号的最低分析物浓度。LLOD可以通过前面描述的方程8,9,LLOD = LoB + 1.645(SD低浓度 样品)来识别。LoB是空白的下限,当期望零值时,它是从空白中产生的分析物的"表观"浓度,可以使用此等式LoB = 平均空白 + 1.645(SD空白)8来确定。基于这种方法,Spike S1测定的MFI值范围为134.38至20191.2,其中134.38 MFI代表0.00024μg/ mL,定义为LLOD。对于膜测定,实际MFI范围为52.24至4764.9,其中52.24 MFI计算为0.004885μg/ mL并分配为LLOD。核衣壳测定的MFI范围为517.9至19666.34,其中517.9指定为0.00024μg/ mL,即LLOD。检测上限(ULOD)定义为分析物的浓度,在此浓度之后,MFI的变化不再是线性的,并且信号响应饱和。应该注意的是,除了核衣壳曲线外,这些曲线的完整Sigmoid特征对于测试的标准品是不可观察到的。然而,给定迄今为止(在1:500稀释度下)测定的所有未知物的观察到的MFI值在每种分析物的呈现曲线范围内,并且通过线性回归使用4或5-参数拟合轻松定量。
检测精度
测定内精度:在同一板上进行四次重复测定以评估测定精度,计算为%CV,或标准偏差和平均值乘以100的商。为这些制表选择了标准点2和5,值在 表2中编目。%CV值的典型可接受上限阈值为≤20%,这些数据被观察到,但膜IgG的标准2除外,这可能是由背景水平引起的,可以通过消除外围值(未显示数据)来纠正。应该注意的是,在膜测定中观察到读取值的明显不稳定性,其中MFI值为<200,最常见于IgA和IgM同种型。
检测间精度:为每个测定制备三个不同批次的磁珠组并进行测试,如测定内精度所定义(如上图和 图1所示)。通过从三个批次中每个批次的平均结果中计算%CV来评估测定间变异性,如 表3所示。同样,可接受%CV的上限阈值设置为≤20%,这存在于所有测试条件下(与膜IgG的标准2具有相似的效果,如上所述)。应该注意的是,在定制测定开发过程中,在相同免疫反应子的多个批次中通常观察到净MFI值的批次间差异。使用从商业上获得的抗靶抗体(例如,兔抗Spike S1)竖立的校准曲线,然后使用抗物种检测抗体,可以提供分析结果的一致性,并允许在不同时间段的多个批次之间进行比较。
人类样本的检测间精度:在首次报告SARS-CoV-2感染症状后一个月内,对收集的人血浆样本(n = 5)重复评估检测间精度;通过三个不同批次的测定(即,磁珠组的不同制备)完成。这些结果如 表4 所示,并证明了%CV值的精度,典型阈值上限值为≤20%。Spike S1,核衣壳和膜IgG滴度的平均%CV值分别为9.9%(范围2.6%-18%),11.0%(范围3.5%-24.4%)和7.6%(范围3.2%-12.9%)。对这三种分析物的IgM和IgA滴度进行了类似的观察,均提供%CV值<20%。唯一的例外是膜蛋白的受试者5 IgM滴度,随后被排除在异常值之外。人类受试者评估的精度值与上面看到的兔抗体的精度值一致,这表明这些测定可以很容易地重新配置以评估多个物种中抗原的滴度,而对测定精度几乎没有影响。如上所述,在膜测定中观察到的MFI值为<200的膜测定值存在明显的不稳定性,最常见于IgA和IgM同种型。
一抗浓度优化
用抗原偶联珠子评估分析物"捕获时间",并通过修改初级孵育的长度(30分钟,1小时,2小时和4小时)来测试血浆标本或标准品中的抗体。平均MFI的差异表示为特定孵育的商和最大孵育时间,在 图2中称为%Max.,在30分钟孵育(最小持续时间)和4小时孵育(最大持续时间)之间。120 min时的值对于Spike S1,膜和核衣壳抗体的IgG滴度是最佳的,表明具有快速的一抗结合动力学,允许灵活地增加测定通量。然而,对于IgA和IgM(未显示的数据)同种型观察到较慢的动力学,在4小时时间点显示峰值捕获水平,如图 2所示。总体而言,在接近测定饱和度和在生产中运行每个测定的实际时间权宜之计之间存在平衡(以最大化通量)。有了这个,在这些发现中,在IgG的最小孵育时间30分钟,IgM的60分钟和IgA的120分钟的最小孵育时间内观察到合适的定量信号。
二抗浓度优化
测试了五种浓度的二抗(山羊抗人IgG,PE偶联;山羊抗人IgA,PE偶联;山羊抗人IgM,SB偶联)(0.5,1,2,4和8μg/ mL)。所有抗体均显示宽范围的信号,在任何条件下都没有明显的信号饱和度,从而确保了对任何浓度的线性测量。例如,使用山羊抗人IgM的Spike S1测定产生的平均信号,SB偶联在0.5μg/ mL下是最大信号(8μg/ mL)产生的MFI的13.2%,而从4μg/ mL产生的MFI是最大信号中表现出的MFI的73.3%。来自其他Spike S1抗体同种型,膜抗体和核衣壳抗体的信号范围的详细信息包含在 表5 和 图3中。作为一个实践点,最佳二抗浓度与前面所述的4μg/ mL二抗浓度之间的主要影响反映在测定灵敏度和测定成本方面。也就是说,对于抗体滴度低或有价值样品量低的应用,8 μg/mL 二抗浓度可能是可取的,但与这些测定相关的成本将大大高于使用先前定义的 4 μg/mL 浓度。相反,观察到高抗体滴度的情况(例如,经历过Covid-19疫苗接种或血清量不限的个体)将通过应用较低量的二抗(例如,1μg/ mL)获得成本效益。
二抗孵育优化
还通过修改孵育时间(15,30,60和120分钟)来研究二抗孵育持续时间的潜在影响。通常,对于Spike S1,膜和核衣壳抗体,15分钟孵育(最短持续时间)和120分钟孵育(最大持续时间)之间的平均MFI的差异分别不超过30%,55%和50%,分别超过Spike S1,膜和核衣壳抗体,表明二抗结合的快速动力学步骤和增加测定通量的手段。 表6 包括所有孵育时间的信号变化的详细信息。从该分析的不同孵化中观察到的信号的图示如图 4所示。
双通道性能和特异性
对于每种分析物,将单个报告基因格式运行(仅IgG-PE,仅IgA-PE或仅IgM-SB)与以双报告基因格式运行时为同一分析物生成的信号进行比较(例如,仅Spike S1 IgG-PE与Spike S1 IgG-PE与双报告器格式中的Spike S1 IgM-SB组合)。使用两种格式产生的信号的测定精度(以%CV表示)来分析本实验结果中的关系。Spike S1检测的IgM,IgG和IgA的%CV值分别为6.19%,16.4%和23%。对于膜测定,IgM,IgG和IgA的%CV值分别为3.3%,7.9%和16.4%。最后,核衣壳测定分别为IgM,IgG和IgA提供8.7%,10.3%和24.2%的%CV值。IgM和IgA同种型的精确值表明,由于这些类别的免疫球蛋白之间存在已知的结合动力学差异,较长的孵育时间可能产生更好的测定结果。 图4 显示了不同浓度的二抗的两种病型之间的一致性。
为了确认报告者通道的特异性,一次测试单个报告通道,同时将另一个通道分配为空白以询问非特异性信号(出血效应)。这些发现表明,鉴于在整个条件频谱中的高特异性,两个报告通道之间的交叉信号污染可以忽略不计。这些发现如图 5所示。总体而言,我们观察到通道1到通道2的干扰率为6.45%。然而,当考虑信号的大小时,我们在双报告模式下观察到以下潜在的干扰水平:尖峰IgG / IgM为71.98%,Spike IgA / IgM为28.11%;膜IgG / IgM为7.41%,膜IgA / IgM为134.61%;核衣壳IgG / IgM为146.03%,核衣壳IgA / IgM为112.13%。在指定的配置中,这将需要测量Spike IgM与IgA同种型,膜IgM与IgM同种型,以及未以双通道格式进行的核衣壳测量。这一发现可能需要探索标记策略的反转,从而在通道2中测量IgA和IgG,在通道1中测量IgM。
Covid-19疫苗接种后血清转换事件的评估
在对IgA,IgM和IgG进行评估后,在从疫苗接种前到完成Covid-19系列疫苗接种后四个月的时间点,使用Spike S1测定对四名受试者进行了血清转换监测。测量在双通道模式下完成(IgG / IgM和IgA / IgM,IgM值取平均值)。所有受试者都按照标准做法接受疫苗作为2阶段免疫接种,第一剂和第二剂之间间隔21天。每个受试者免疫反应的曲线如图6A-C所示。在评估的所有免疫球蛋白的背景水平上观察到核衣壳和膜抗原的免疫反应值(数据未显示),这与疫苗接种前一段时间内没有记录的先前SARS-CoV-2感染的受试者一致。总体而言,观察到的Spike S1 IgA和IgM值比IgG同种型滴度低约40倍,IgM和IgG同种型的峰值滴度最早在14天达到峰值,IgA同种型在第二次给药(第0天)和第二次给药后14天之间达到峰值滴度, 取决于主题。值得注意的是,Spike S1 IgG滴度在完成疫苗接种后的四个月内以高度可变的速率开始衰减,以受试者依赖性的方式。
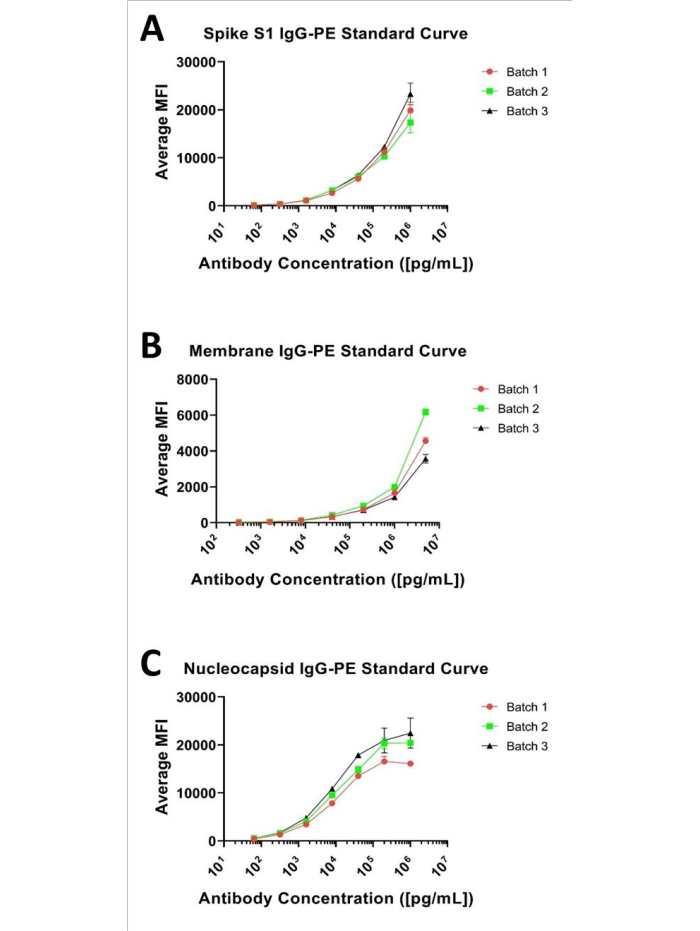
图 1:代表性的 3 重标准曲线。 三种分析物的代表性标准曲线;呈现为 7 点 1:5 连续稀释曲线,起始值为 (A) 1 μg/mL(对于 Spike S1)、(B) 5 μg/mL(对于膜)和 (C) 1 μg/mL(对于核衣壳和抗体)。 请点击此处查看此图的大图。

图2:一抗/样品孵育时间优化: 一抗/样品的不同孵育时间(抗体捕获)产生的平均MFI信号,范围为30分钟至4小时,标准品1-7(如 表1所示)。 请点击此处查看此图的大图。

图 3:二抗浓度优化和双通道性能。 曲线显示了从测试的二抗浓度(范围为0.5-8μg/ mL)产生的平均MFI(归一化为该系列中的最高记录值)。每个实例都作为单通道和双通道测定进行,以了解实验格式的差异。 请点击此处查看此图的大图。

图 4:二抗孵育时间优化,双通道格式。 观察到的MFI值(归一化为系列中的最高记录值)与二抗孵育时间的代表性图。实验以双通道测定的形式进行,如(A-C)IgA / IgM或(D-F)IgG / IgM组合。请点击此处查看此图的大图。

图5:双通道测定的特异性评估。 双通道测定格式的测定结果,其中一种组合被指定为空白,以说明不存在跨通道荧光或干扰。 请点击此处查看此图的大图。
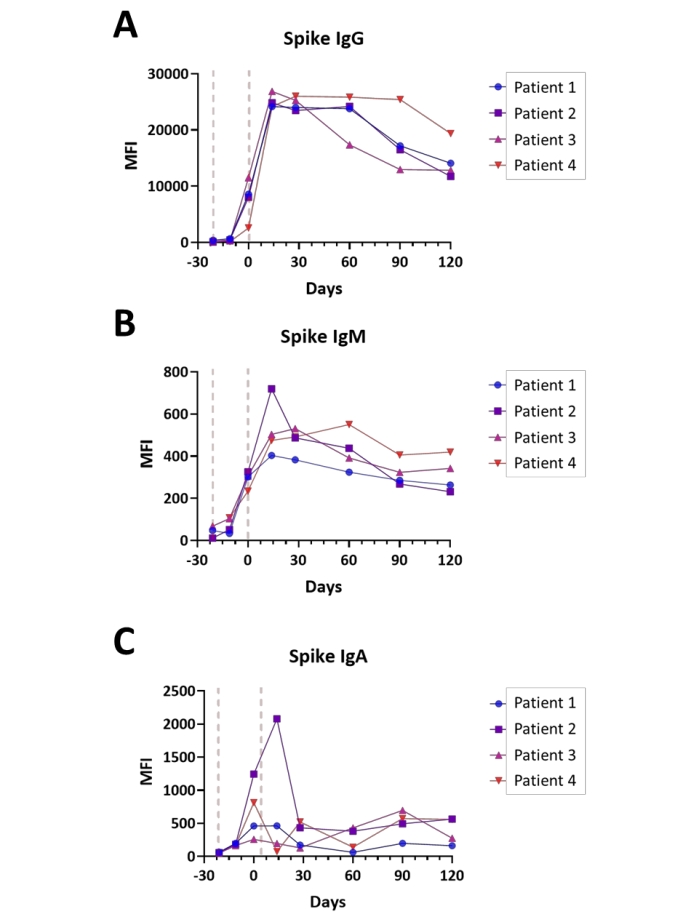
图6:接种Covid-19后血清转换的图示。 图例说明了Covid-19疫苗接种过程中(疫苗接种前 - 完成后4个月)Spike S1抗原的(A)IgG,(B)IgM和(C)Spike S1抗原的IgA抗体的相对滴度;时间以相对于完成疫苗接种系列的天数显示;指示疫苗管理的一般要点(红线)。实验以双通道模式进行,如实验方案中所述。 请点击此处查看此图的大图。
| 标准号码 | 稀释系列 | 抗尖峰 S1 或 N (μg/mL) | 防膜(微克/毫升) |
| 空白 | 空白 | - | - |
| 1 | 标准7 1:1 | 1 | 5 |
| 2 | 标准6 1:5 | 0.2 | 1 |
| 3 | 标准5 1:25 | 0.04 | 0.2 |
| 4 | 标准4 1:125 | 0.008 | 0.04 |
| 5 | 标准3 1:625 | 0.0016 | 0.008 |
| 6 | 标准2 1:3125 | 0.00032 | 0.0016 |
| 7 | 标准1 1:15625 | 0.000064 | 0.00032 |
表 1: 标准曲线的稀释系列: 用于IgG血清型标准曲线的稀释因子表;对于α-Spike S1和α-核衣壳,以1 μg/mL开始的7点1:5连续稀释曲线表示,对于α膜抗体,则以5 μg/mL开始。
| 分析物 | 样本 | 代表 1 | 代表 2 | 代表 3 | 代表 4 | 大道 | 标清 | %CV |
| 尖峰 S1 | 性病2 | 369.4 | 356.9 | 295.2 | 271.5 | 323.3 | 47.4 | 14.6 |
| 性病5 | 3869.1 | 3437 | 3970.2 | 4240.7 | 3879.3 | 334 | 8.6 | |
| 膜 | 性病2 | 40.6 | 37.7 | 49.9 | 27.8 | 39 | 9.1 | 23.3 |
| 性病5 | 733.2 | 731.3 | 724 | 678.1 | 716.7 | 26 | 3.6 | |
| 核 | 性病2 | 1746.7 | 1790.8 | 1577.3 | 1664.8 | 1694.9 | 94.2 | 5.6 |
| 性病5 | 15598.1 | 14735.5 | 18369.5 | 17408.5 | 16527.9 | 1657.7 | 10 |
表 2:检测内精度: 在同一实验中,使用单个测定批次,从标准2(STD2)和标准5(STD5)的四个标准抗体混合物的重复中计算出的方差百分比系数(%CV)。为重复和平均值提供的值表示观察到的 MFI 值。
| 分析物 | 样本 | 第1批 | 第2批 | 第3批 | 大道 | 标清 | %CV |
| 尖峰 S1 | 性病2 | 383.2 | 424.4 | 379.9 | 395.8 | 24.8 | 6.3 |
| 性病5 | 5639.7 | 6062.5 | 6384.3 | 6028.8 | 373.4 | 6.2 | |
| 膜 | 性病2 | 39.1 | 58.5 | 59.1 | 52.2 | 11.4 | 21.8 |
| 性病5 | 732.3 | 941.4 | 701.1 | 791.6 | 130.7 | 16.5 | |
| 核 | 性病2 | 1342.6 | 1621 | 1718.2 | 1560.6 | 195 | 12.5 |
| 性病5 | 13543.9 | 14843.2 | 17883.4 | 15423.5 | 2227.2 | 14.4 |
表3:标准样品的检测间精度: 从三个不同批次的测定中计算的百分比方差系数(%CV),在同一实验中以标准2和标准5进行评估。为重复和平均值提供的值表示观察到的 MFI 值。
| 乙二醇聚醚-聚乙烯 | IgM-SB | 伊加-聚乙烯 | |||||
| 马夫兰地 | %CV | 马夫兰地 | %CV | 马夫兰地 | %CV | ||
| 尖峰 S1 | 主题 1 | 8002.3 | 17.7 | 1949.5 | 1.3 | 2045.8 | 5.5 |
| 主题 2 | 19155.8 | 7.3 | 918.6 | 4.1 | 1684.5 | 3.9 | |
| 主题 3 | 17865.6 | 18.0 | 549.4 | 3.8 | 961.3 | 8.1 | |
| 主题 4 | 11901.1 | 2.6 | 1603 | 4.8 | 8736.4 | 5.5 | |
| 主题 5 | 9801.8 | 4.0 | 1014.1 | 3.0 | 2747.6 | 9.3 | |
| 核 | 主题 1 | 15097.8 | 11.3 | 1049.7 | 9.9 | 5276.5 | 3.9 |
| 主题 2 | 15204.3 | 12.1 | 265.9 | 5.2 | 6761.3 | 11.9 | |
| 主题 3 | 18471.7 | 24.4 | 329.1 | 4.5 | 14308 | 2.9 | |
| 主题 4 | 16424.7 | 3.5 | 2418.1 | 0.1 | 4234.7 | 4.2 | |
| 主题 5 | 13344.9 | 3.6 | 225.6 | 10.0 | 13436.5 | 9.7 | |
| 膜 | 主题 1 | 514.6 | 8.6 | 180.6 | 14.0 | 141.2 | 9.8 |
| 主题 2 | 196.8 | 5.2 | 57 | 20.7 | 55.5 | 13.0 | |
| 主题 3 | 553.7 | 12.9 | 54.5 | 21.2 | 191.2 | 18.6 | |
| 主题 4 | 377.9 | 3.2 | 68.1 | 22.1 | 62 | 2.3 | |
| 主题 5 | 325.4 | 8.2 | 11.4 | 91.6 | 74.6 | 20.8 |
表4:人本样品的检测间精度: 平均方差百分比系数(%CV)是通过用来自五名患有SARS-CoV-2感染的人类受试者的血浆样品(稀释500倍)测试的三批测定计算得出的。
| 尖峰 S1 | 膜 | 核 | |||||
| 微克/毫升 | 马夫兰地 | % 最大值 | 马夫兰地 | % 最大值 | 马夫兰地 | % 最大值 | |
| 断续器 | 0.5 | 186 | 13.2 | 32 | 25.2 | 132.7 | 13.6 |
| 1 | 304.2 | 21.6 | 45.8 | 36 | 194.4 | 19.9 | |
| 2 | 664.5 | 47.2 | 78.8 | 61.9 | 458.2 | 47 | |
| 4 | 1032.1 | 73.3 | 101.3 | 79.6 | 707.8 | 72.6 | |
| 8 | 1407.1 | 100 | 127.2 | 100 | 975 | 100 | |
| 断续器 | 0.5 | 809.7 | 4.9 | 27.5 | 15 | 1355.6 | 6.3 |
| 1 | 1696.9 | 10.2 | 40.6 | 22.2 | 2782.1 | 13 | |
| 2 | 4543.8 | 27.3 | 68.3 | 37.3 | 6661.2 | 31.2 | |
| 4 | 10003.5 | 60 | 110.7 | 60.5 | 12605.6 | 59 | |
| 8 | 16662.8 | 100 | 182.9 | 100 | 21360.6 | 100 | |
| 断续器 | 0.5 | 797.4 | 19.3 | 31.1 | 47.2 | 2056.5 | 16.1 |
| 1 | 1529.5 | 37 | 41.4 | 62.8 | 3869 | 30.4 | |
| 2 | 2261.3 | 54.7 | 48.6 | 73.3 | 6648.9 | 52.2 | |
| 4 | 2320.4 | 56.2 | 48.3 | 73.2 | 6548.1 | 51.4 | |
| 8 | 4132.2 | 100 | 65.9 | 100 | 12744.8 | 100 | |
表 5:二抗浓度优化: 由不同浓度的二抗产生的平均MFI信号,范围从0.5μg/ mL到8μg/ mL。每个信号的值也以8 μg/mL("最大值")时信号的百分比表示,以显示相对信号幅度。
| 尖峰 S1 | 膜 | 核 | |||||
| 孵育时间(分钟) | 马夫兰地 | % 最大值 | 马夫兰地 | % 最大值 | 马夫兰地 | % 最大值 | |
| 断续器 | 15 | 1185 | 72.2 | 40.4 | 48.9 | 609.5 | 53.3 |
| 30 | 1416.6 | 86.3 | 58.4 | 70.7 | 894.2 | 78.2 | |
| 60 | 1324.8 | 80.7 | 73.6 | 89.1 | 945.6 | 82.7 | |
| 120 | 1641.2 | 100 | 82.6 | 100 | 1143.2 | 100 | |
| 断续器 | 15 | 12917.6 | 80.5 | 244.4 | 44.9 | 15429.8 | 80.8 |
| 30 | 14915.4 | 92.9 | 434.7 | 79.9 | 18797 | 98.5 | |
| 60 | 15340.3 | 95.6 | 421.4 | 77.5 | 18694.4 | 97.9 | |
| 120 | 16050.3 | 100 | 544 | 100 | 19085.8 | 100 | |
| 断续器 | 15 | 3141.9 | 78.2 | 75 | 66.8 | 9103 | 86.6 |
| 30 | 3569.1 | 88.8 | 83.9 | 74.8 | 9563.8 | 91 | |
| 60 | 3539.1 | 88 | 86 | 76.6 | 9555.7 | 90.9 | |
| 120 | 4020 | 100 | 112.2 | 100 | 10512.9 | 100 |
表6:二抗孵育时间优化: 二抗的不同孵育时间产生的平均MFI信号范围为15分钟至120分钟。每个信号的值也表示为120分钟("Max.")时信号的百分比,以显示相对信号幅度。
讨论
对SARS-CoV-2暴露的免疫反应的欣赏,结合基于RT-PCR的感染状况监测,已被很好地描述为澄清Covid-19恢复过程的处方,作为识别具有潜在治疗价值的恢复期血浆的一种手段,并在人群规模的基础上调查感染率10,11。了解人类受试者血清转换的不同例子包括蛋白质(抗原)阵列12,免疫印迹13,快速免疫层析构建体14和酶联免疫吸附测定(ELISA)15,16,17。上述每种技术都可以单独评估多种免疫球蛋白同种型,只需稍作修改。然而,这些程序实际上无法被重新利用,以允许对多种同种型进行并行分析,如本手稿所述,将成本和通量因素作为基于人群的规模测试策略管理的限制。其中一些应用还提供了并行连接多种抗原水平的机会,如呈现的或改变的格式,例如多重ELISA18,19。最后,免疫珠平台提供了并行20,21 评估多种抗原水平的可能性,但仅限于每次测定的单个表位(即免疫球蛋白同种型),除非使用具有"双通道"测定功能的最新仪器。
在本报告中,列举了在免疫珠测定中使用仪器在"双通道"模式下对多种表位进行可靠测量的方案,这些方案是Covid-19疫苗接种个体血清转换的案例研究。该方法使用手动测定设计表现出出色的精度(%CV值通常为<20%),这些设计可以通过集成实验室自动化系统进行改进。所有选定分析物和表位的测定灵敏度和动态范围均适用于常规评估。尽管缺乏市售抗抗抗原 IgA 和 IgM 免疫反应原限制了 IgG 同种型的定量,但这种限制并不排除提供半定量评估或相对于特定标本(作为校准剂22,23)的评估的能力。
经过验证的免疫珠测定被分配用于研究一组接种了Covid-19疫苗的个体的血清转换。与其他类似平台相比,该仪器系列允许在手动工作流程中每天在数百个人中发现血清转换,在自动化方案中每天发现数千人血清转换。总体而言,这些发现证实,"双通道"方法对于同一测定中并行描述多个表位具有适当的敏感性,并且在多分析物上下文中是可行的。分别使用藻红素和超亮436荧光团进行的通道1和通道2的灵敏度差异可能需要设计特定的实验,以确保为给定的实验获得可行的分析结果。也就是说,为患病率较低的表位或分析物保留通道1可能是必要的,以维持包括未知值的观察值的测定的动态范围。除了这一考虑之外,分析设计是显而易见的,分析能力有限的实验室应该很容易获得。当然,在考虑信道1到信道2的干扰时,应该权衡这一考虑因素,正如我们 在图5中指出的那样,当以双通道格式测量时,来自高丰度同种型的干扰可能会对那些丰度低得多的干扰造成误导性的分析误差。如果在测定设计阶段处理不当,这种干扰分析物浓度高度不同的情况的可能性可能代表对方法的重大限制。
总之,提出了一种快速测量与Covid-19感染或疫苗接种的免疫反应相关的主要免疫球蛋白同种型的抗体滴度的方法。以纵向方式应用这种方法来评估血清转换可以提供见解,这些见解可以更好地用于管理和/或监测疾病过程,或者指导潜在的Covid-19加强疫苗计划。
披露声明
Borgia博士是本手稿中使用的血清学测试的发明者,该手稿正在申请专利。本文仅以描述性方式呈现,没有提供统计分析,以避免作者冲突引入的潜在偏见。
致谢
作者希望感谢Rush生物标志物开发核心使用其设施,Rush Biorepository用于受试者注册和生物标本处理,以及Walder基金会的芝加哥冠状病毒评估网络(Chicago CAN)倡议拨款编号SCI16(J.R.S.和J.A.B.)和21-00147(J.R.S.和J.A.B.)以及游泳穿越美国基金会(J.A.B.)的奖项。
材料
| Name | Company | Catalog Number | Comments |
| 384-well black side polystyrene microtiter plates | Thermo Fisher | 12-565-346 | |
| Activation buffer (0.1 M NaH2PO4, pH 6.2) | Prepared in house | ||
| Assay buffer (PBS, 1% Bovine Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| Bovine Serum Albumin, heat shock fraction | MilliporeSigma | A-7888-50G | |
| Coupling buffer (50 mM MES, pH 5.0) | Prepared in house | ||
| COVID 19 M Coronavirus Recombinant Matrix Protein (6xHis tag) | MyBioSource | MBS8574735 | |
| Disposable pipette tips | |||
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Thermo Fisher | PIA35391 | |
| Goat Albumin, Fraction V Powder | MilliporeSigma | A2514-1G | |
| IgA Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB205009 | |
| IgG Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB204009 | |
| IgG Goat anti-Rabbit, R-PE, Polyclonal | Thermo Fisher | OB403009 | |
| IgM Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB202009 | |
| IgM Mouse anti-Human, SB 436, Clone SA-DA4 | Thermo Fisher | 62999842 | |
| Instrument Analyzer | Luminex Corp. | INTELLIFLEX-RUO | |
| Low-Bind microcentrifuge tubes (1.5 mL) | Thermo Fisher | 13-698-794 | |
| MagPlex-C Microspheres, Region XXX | Luminex Corp. | MC10XXX-01 | |
| MES hydrate (2-(N-Morpholino) ethane sulfonic acid hydrate) | MilliporeSigma | M2933 | |
| Microplate aluminum sealing tape | Thermo Fisher | 07-200-683 | |
| Polysorbate-20 | Thermo Fisher | BP337-500 | |
| Quality Biological Inc. PBS, pH 7.2 | Thermo Fisher | 50-751-7328 | |
| Quench buffer (PBS, 1% Goat Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Protein (His tag) | Sino Biologicals | 40588-V08B | |
| SARS-CoV-2 (2019-nCoV) Spike Protein (S1 Subunit, His tag) | Sino Biologicals | 40591-V08H | |
| SARS-CoV-2 (2019-nCoV) Spike RBD Antibody, Rabbit pAb | Sino Biologicals | 40592-T62 | |
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Antibody, Rabbit mAb | Sino Biologicals | 40588-R0004 | |
| SARS-CoV-2 (COVID-19) Membrane Antibody (IN), Rabbit pAb | ProSci | 10-516 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Fisher | PIA39269 | |
| Wash Buffer (PBS, 0.01% Polysorbate-20) | Prepared in house | ||
| Water, LC/MS grade | Thermo Fisher | W-64 |
参考文献
- Tighe, P. J., Ryder, R. R., Todd, I., Fairclough, L. C. ELISA in the multiplex era: potentials and pitfalls. Proteomics - Clinical Applications. 9, 406-422 (2015).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments: JoVE. (65), e4084 (2012).
- Powell, R. L., et al. A multiplex microsphere-based immunoassay increases the sensitivity of siv-specific antibody detection in serum samples and mucosal specimens collected from rhesus macaques infected with SIVmac239. BioResearch Open Access. 2 (3), 171-178 (2013).
- Volpetti, F., Garcia-Cordero, J., Maerkl, S. J. A microfluidic platform for high-throughput multiplexed protein quantitation. PLoS One. 10 (2), 0117744 (2015).
- Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., Al-Nasser, A. D. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens. 9 (3), 231 (2020).
- Asif, M., Xu, Y., Xiao, F., Sun, Y. Diagnosis of COVID-19, vitality of emerging technologies and preventive measures. Chemical Engineering Journal. 423, 130189 (2021).
- La Marca, A., Capuzzo, M., Paglia, T., Roli, L., Trenti, T., Nelson, S. M. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reproductive Biomedicine Online. 41 (3), 483-499 (2020).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews. 29, 49-52 (2008).
- Tarhoni, I., et al. Relationship between circulating tumor-associated autoantibodies and clinical outcomes in advanced-stage NSCLC patients receiving PD-1/-L1 directed immune checkpoint inhibition. Journal of Immunological Methods. 490, 112956 (2021).
- Deeks, J. J., et al. Antibody tests for identification of current and past infection with SARS-CoV-2. The Cochrane Database of Systematic Reviews. 6, 013652 (2020).
- Mahalingam, S., et al. Landscape of humoral immune responses against SARS-CoV-2 in patients with COVID-19 disease and the value of antibody testing. Heliyon. 7 (4), 06836 (2021).
- Ruano-Gallego, D., et al. A multiplex antigen microarray for simultaneous IgG and IgM detection against SARS-CoV-2 reveals higher seroprevalence than reported. Microbial Biotechnology. 14 (3), 1228-1236 (2021).
- Shah, J., et al. IgG and IgM antibody formation to spike and nucleocapsid proteins in COVID-19 characterized by multiplex immunoblot assays. BMC Infectious Diseases. 21 (1), 325 (2021).
- Gambino, C. M., et al. Comparison of a rapid immunochromatographic test with a chemiluminescence immunoassay for detection of anti-SARS-CoV-2 IgM and IgG. Biochemia Medica (Zagreb). 30 (3), 030901 (2020).
- Algaissi, A., et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Scientific Reports. 10, 16561 (2020).
- Chiereghin, A., et al. Recent advances in the evaluation of serological assays for the diagnosis of SARS-CoV-2 infection and COVID-19. Frontiers in Public Health. 8, 620222 (2020).
- Nicol, T., et al. Assessment of SARS-CoV-2 serological tests for the diagnosis of COVID-19 through the evaluation of three immunoassays: Two automated immunoassays (Euroimmun and Abbott) and one rapid lateral flow immunoassay (NG Biotech). Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 129, 104511 (2020).
- Butt, J., et al. From multiplex serology to serolomics-A novel approach to the antibody response against the SARS-CoV-2 proteome. Viruses. 13 (5), 749 (2021).
- Byrum, J. R., et al. multiSero: open multiplex-ELISA platform for analyzing antibody responses to SARS-CoV-2 infection. medRxiv. , (2021).
- Dobano, C., et al. Highly sensitive and specific multiplex antibody assays to quantify immunoglobulins m, a, and g against SARS-CoV-2 antigens. Journal of Clinical Microbiology. 59 (2), 01731 (2021).
- Schultz, J. S., et al. Development and validation of a multiplex microsphere immunoassay using dried blood spots for SARS-CoV-2 seroprevalence: Application in first responders in first responders in Colorado, USA. Journal of Clinical Microbiology. 59 (6), 00290 (2021).
- Beavis, K. G., et al. Evaluation of the EUROIMMUN anti-SARS-CoV-2 ELISA assay for detection of IgA and IgG antibodies. Journal of Clinical Virology: The Official Publication of the Pan Americal Society for Clinical Virology. 129, 104468 (2020).
- Jung, J., et al. Clinical performance of a semi-quantitative assay for SARS-CoV2 IgG and SARS-CoV2 IgM antibodies. Clinica Chimica Acta: International Journal of Clinical Chemistry. 510, 790-795 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。