Method Article
ניטור דינמי של Seroconversion באמצעות בדיקת אימונו-בייד רב-אנליטית לקוביד-19
* These authors contributed equally
In This Article
Summary
מאמר זה מתאר שיטה נוחה לניטור שינויים דינמיים בטיטרים של נוגדנים עבור שני איזוטיפים של אימונוגלובולינים בו זמנית (IgA, IgM או IgG) הנובעים מתגובה חיסונית לזיהום SARS-CoV-2 או לחיסון. 'פאנל התגובה החיסונית הרב-אנליטית של Covid-19' משתמש בשלושה מבחנים חיסוניים עקיפים הבנויים על מיקרו-ספירות מקודדות הנקראות באמצעות קורא מולטיפלקס מבוסס זרימה עם יכולת 'דו-ערוצית'.
Abstract
טכנולוגיות מולטיפלקס לחקירת סמנים ביולוגיים מרובים בתיאום קיימות כבר כמה עשורים; עם זאת, שיטות להערכת אפיטופים מרובים על אותו אנאליט נותרו מוגבלות. דו"ח זה מתאר את הפיתוח והאופטימיזציה של בדיקה חיסונית מרובת בדיקה לצורך בדיקות סרולוגיות של איזוטיפים נפוצים של אימונוגלובולינים (למשל, IgA, IgM ו-IgG) הקשורים לתגובה חיסונית לזיהום או לחיסון SARS-CoV-2. הבדיקות נעשו באמצעות קורא פלואורסצנטי מרובה מבוסס זרימה עם יכולת דו-ערוצית. האופטימיזציות התמקדו בזמן לכידת האנליטים, באיתור ריכוז נוגדנים ובזמן הדגירה של נוגדני זיהוי. מאפייני ביצועי הבדיקה האנליטית (לדוגמה, טווח הבדיקה (כולל הגבולות התחתונים והעליונים של הכמות); ודיוק תוך-זמני ובין-בדיקות) נקבעו עבור צירוף סרוטיפ IgG/IgM או IgA/IgM במקביל באמצעות מצב 'ערוץ כפול'. זמני לכידת Analyte של 30 דקות עבור IgG, 60 דקות עבור IgM ו -120 דקות עבור IgA היו מתאימים לרוב היישומים, וסיפקו איזון של ביצועי הבדיקה והתפוקה. נצפו דגירות נוגדנים אופטימליות של 4 מיקרוגרם/מ"ל במשך 30 דקות, והן מומלצות ליישומים כלליים, בהתחשב בדיוק המצוין הכולל (אחוז מקדם השונות (%CV) ≤ 20%) וערכי הרגישות שנצפו. הטווח הדינמי של איזוטיפ ה-IgG השתרע על פני מספר סדרי גודל עבור כל בדיקה (Spike S1, Nucleocapsid ו-Membrane glycoproteins), התומך בהערכות טיטר חזקות בגורם דילול של 1:500 עבור יישומים קליניים. לבסוף, הפרוטוקול הממוטב יושם על ניטור seroconversion ספייק S1 עבור נבדקים (n = 4) שהשלימו משטר חיסון SARS-CoV-2. בתוך קבוצה זו, רמות ה-IgG של ספייק S1 נצפו כמגיעות לטייטרים מרביים לאחר 14 יום לאחר מתן המנה השנייה, בעוצמת אות גבוהה בהרבה (פי 40 כ-40) מאשר איזוטיפים של IgM או IgA. באופן מעניין, ראינו שיעורי דעיכה משתנים מאוד של ספייק S1 IgG שנצפו שיעורי דעיכה שהיו תלויים במידה רבה בנושא, שיהיו הנושא של מחקרים עתידיים.
Introduction
מדידה סימולטנית של סמנים ביולוגיים מרובים הקשורים למחלות בדגימות ביולוגיות מאפשרת תובנות תיאוריות ומנבאות על תהליכים פתולוגיים. בעוד שפרוצדורות אימונולוגיות קונבנציונליות של אנליטה בודדת, כגון מבחני אימונוסורבנטים הקשורים לאנזים (ELISAs), היו אבן הפינה של ניתוחים כמותיים הן במסגרת הקלינית והן במסגרת המחקרית, לטכניקות אלה יכולות להיות מגבלות משמעותיות לגבי התפוקה, כמות הדגימות הנדרשת לכל מדידה, וחסכוניות המגבילה מאוד את המחקר של אלמנטים ביולוגיים מרובים השזורים זה בזה לעתים קרובות במהלך המחלה1 . טכנולוגיית ריבוב מבוססת מיקרוספרה הפכה לפלטפורמה חיונית עבור מתקני אבחון ומחקר כאחד בזכות יכולתה לשלב מבחנים כדי לשפר את תפוקת המעבדה, לצמצם את המחסור בדגימות ולהפחית בדיקות חוזרות ונשנות כדי למקסם את החיסכון בעלויות 1,2,3,4. לאחרונה, הוכנסה הרחבה נוספת של כוח ריבוב זה עם מכשירים בעלי יכולות דיווח כפול. תכונת הכתב הכפול מיישמת שני ערוצים פלואורסצנטיים לזיהוי, ומספקת ממד נוסף של ריבוב, המאפשר זיהוי של אפיטופים מרובים על אותו אנאליט.
תסמונת נשימתית חריפה חמורה נגיף קורונה 2 (SARS-CoV-2) הוא הפתוגן האחראי למחלת נגיף הקורונה הנוכחית 2019 (COVID-19) מגיפה5. בעוד שבדיקת RT-PCR חיונית לאישור זיהום בתחילת קורס המחלה, בדיקות סרולוגיות של טיטרים נוגדנים הוכיחו את עצמן כהכרחיות לביקורת מדויקת ומלאה של אנשים לגבי חשיפה או החלמה קודמת; תגובה לחיסון; ו/או הערכה של יעילות החיסון נגד קוביד-19 6,7.
דו"ח זה תוחם שיטות למדידת seroconversion עבור אנטיגנים נגיפיים מרובים מסוג SARS-CoV-2 המשתמשים במערכת דיווח כפול מבוססת זרימה, מרובבת קוראים. באופן ספציפי, מתואר זיהוי בו-זמני של שני תתי-סוגים של נוגדנים (המוגדרים כ-IgG/IgM או IgA/IgM) עבור פאנל אנטיגנים 3-plex SARS-CoV-2 הכולל בדיקות עבור גליקופרוטאינים של ספייק S1, נוקליאוקפסיד וממברנה (המכונה גם מטריקס). גישה זו מספקת מיזם אידיאלי ללכידת סרו-קונברסיה אורכית ותורמת כלי רב ערך בארסנל נגד מגיפת Covid-19.
Protocol
כל הנבדקים נרשמו בהסכמה מדעת בכתב עם אישור מלא של מועצת הביקורת המוסדית (IRB) של המרכז הרפואי של אוניברסיטת פרוטוקול ORA 20101207 עם כל ההנחיות המוסדיות לביצוע מחקר אתי שנצפו. הדם נאסף באמצעות פלבוטומיה קונבנציונלית לתוך ווקטיינרים של לבנדר (K2EDTA) ועובד עם פרוטוקולים מומלצים. הפלזמה שהתקבלה אורכבה בטמפרטורה של -80 מעלות צלזיוס עד לביצוע ההערכות.
1. הכנת מיקרו-ספירות מצומדות אנטיגן
- בחר שלושה בקבוקונים שונים של מיקרו-ספירות מגנטיות עם אזורי חרוזים ייחודיים, רישום מזהה חרוזים ומידע רב עבור כל בקבוקון בשימוש.
הערה: השלבים הבאים יבוצעו עבור כל אזור מיקרוספרה נפרד. מיקרו-כדורים רגישים לאור ויש להגן עליהם מפני חשיפה ממושכת לאור. במהלך שלבי הכביסה, היזהרו שלא להפריע למיקרוספרות. אם אתה מופרע, אפשר הפרדה שנייה של 60 שניות. - וורטקס מלאי המיקרוספרה במשך 60 שניות וסוניקאט במשך 5 דקות לפני השימוש כדי לנתק חרוזים מצטברים.
- מעבירים 1.0 x 106 חרוזים לצינורות מיקרו-צנטריפוג' בעלי 1.5 מ"ל בעלי חלבון נמוך.
- הכנס את הצינור למפריד מגנטי ואפשר להפרדה להתרחש במשך 60 שניות. כאשר הצינור עדיין במפריד המגנטי, הסר בזהירות את ה- supernatant מבלי להפריע לכדור החרוז.
- הסר את הצינור מהמפריד המגנטי, החייא את החרוזים עם 100 μL של מים ברמת HPLC, ומערבולת במשך 30 שניות. מניחים את הצינור בחזרה לתוך המפריד המגנטי במשך 60 שניות, ולאחר מכן מסירים את ה-supernatant. חזור על פרוטוקול שטיפה זה פעמיים.
- הסר את הצינור מהמפריד המגנטי והחזיר את המיקרוספרות השטופות ב- 90 μL של 100 mM נתרן פוספט מונובסי, pH 6.2 (מאגר הפעלה) על ידי מערבולת במשך 30 שניות.
- הוסיפו 10 מיקרול"ל של 50 מ"ג/מ"ל Sulfo-NHS (מדולל עם מאגר הפעלה) למיקרו-ספירות ולמערבולת בעדינות במשך 10 שניות. הוסיפו 10 μL של תמיסת EDC של 50 מ"ג/מ"ל (מדוללת עם מאגר הפעלה) ומערבולת בעדינות למשך 10 שניות. דגירה של מיקרוספרות למשך 20 דקות בטמפרטורת החדר (RT) עם מערבולת עדינה כל 10 דקות.
- חזור על שלבי שטיפה 1.4-1.5 עם 50 mM MES, pH 5.0 (חיץ צימוד) במקום מים ברמת LC/MS לסך הכל שתי שטיפות.
- הסר את הצינור מהמפריד המגנטי והחזיר את החרוזים עם 100 μL של חיץ צימוד על ידי מערבולת במשך 30 שניות ומיד לאחר מכן תוספת של כמות החלבון הרצויה.
- הביאו את הנפח הכולל ל-150 μL באמצעות מאגר צימוד. ערבבו את תגובת הצימוד על ידי מערבולת במשך 30 שניות ודגירה למשך 2 שעות על ידי סיבוב ב-RT.
הערה: עבור מבחנים המוגדרים כאן, בוצעו הצמדות עם ריכוזי החלבונים הבאים: ספייק S1: 5 מיקרוגרם; נוקליאוקפסיד: 5 מיקרוגרם; ממברנה: 12.5 מיקרוגרם. - חזור על שלב שטיפה 1.4 עם תמיסת מלח מוחזקת פוספט (PBS)-1% אלבומין בסרום עיזים, 0.01% פוליסורבט-20 (חיץ מרווה) במקום מים בדרגה LC/MS בסך הכל לשתי שטיפות. החזירו את המיקרו-כדורים השטופים ב-100 μL של Quench Buffer המכיל 0.05% נתרן אזיד על ידי מערבולת במשך 30 שניות.
הערה: התירו לחרוזים להרוות באופן מלא במשך 6 שעות לפחות לפני שתמשיכו בכל הליך אחר. - ספרו את מספר המיקרו-ספירות שהתאוששו באמצעות מונה תאים אוטומטי או המוציטומטר. תעד את ריכוז החרוזים שנצפה.
- יש לקרר את המיקרוספרות המצומדות בטמפרטורה של 4 מעלות צלזיוס בחושך.
2. נהלים
- ביצועי בדיקה (פרוטוקול בסיס)
- החייאת המיקרו-ספירות המצומדות על ידי מערבולת במשך 30 שניות וסוניקאט במשך כ-60-90 שניות.
- הסר את הכמות הנדרשת של כל קולואיד חרוזים מהצינור המתאים ושלב את קולואידי החרוזים בצינור מיקרוצנטריפוג חדש של 1.5 מ"ל.
- הכנס את הצינור למפריד מגנטי ואפשר להפרדה להתרחש במשך 60 שניות. כאשר הצינור עדיין במפריד המגנטי, הסר בזהירות את ה- supernatant מבלי להפריע לכדור החרוז.
- הסר את החרוזים מהמפריד, החזירו את החרוזים עם 100 μL של אלבומין סרום PBS-1% בקר, 0.01% Polysorbate-20 (Assay Buffer) ומערבולת במשך 30 שניות. מקם את הצינור במפריד מגנטי ואפשר להפרדה להתרחש במשך 60 שניות. חזור על פרוטוקול כביסה זה (כלומר, שלבים 2.1.3-2.1.4) פעמיים
- התאם את הריכוז של תערובת המיקרוספרה העובדת 3-plex על ידי הוספת נפח מתאים של Assay Buffer כדי ליצור ריכוז סופי של 100 מיקרוספרות לכל 1 μL עבור כל מטרה.
- Aliquot 12.5 μL של תערובת המיקרוספרה שהוכנה בשלב 2.1.5 לכל באר של צלחת של 384 באר או 25 μL לתוך כל באר של צלחת 96 באר.
- דיללו את דגימות הפלזמה/סרום פי 500 ב-Assay Buffer. להכין דגימות סטנדרטיות על פי טיטרציה הרצויה.
- הוסיפו 12.5 μL של Assay Buffer כדגימה הריקה והוסיפו כל אחת מהדגימות המדוללות או התקן לכל באר ייעודית של לוח דגימה של 384 בארות או 25 μL של הדגימה הריקה והמדוללת או התקן לכל באר של לוח דגימה בן 96 בארות.
- כסו את הצלחת בחותם אלומיניום או בנייר כסף ודגרו במשך שעה אחת ב-RT על שייקר צלחת שנקבע ל-700 סל"ד.
הערה: סכמטית עבור עקומות הדילול מופיעה בטבלה 1. - הכינו תמיסה של נוגדנים נגד בני אדם לזיהוי (פתרונות נוגדנים משניים) ב-4 מיקרוגרם/מ"ל עם Assay Buffer כמפורט בשלב 2.1.11.
- הכן עז-אנטי-אדם IgM, מצומד עם סופר בהיר 436 (SB)/עז-אנטי-אנושי IgA, Phycoerythrin (PE) מצומד מזהה נוגדנים ב 4 מיקרוגרם / מ"ל; או IgM עז-אנטי-אנושי, SB מצומד/עז-אנטי-אנושי IgG, PE מצומד מזהה נוגדנים ב 4 מיקרוגרם/מ"ל.
הערה: עבור פורמט צלחת 384-well, נדרש 12.5 μL/באר של תמיסת הנוגדן המשנית המוכנה, ולפורמט של צלחת 96 באר, נדרש 25 μL/well. - הניחו את הצלחת על מפריד מגנטי, שטפו במהירות והתהפכו בכוח על מיכל ביו-האזרד כדי להסיר את הנוזל מהבארות. כשהצלחת עדיין הפוכה, הקש בכוח על הצלחת על ערימת נייר עבה.
- יש לשטוף כל באר עם 100 μL של Assay Buffer ולהסיר את הנוזל על ידי היפוך כוחני מעל מיכל biohazard, כפי שתואר קודם לכן. חזור על שלבים אלה (2.1.12-2.1.13) ובסך הכל שתי שטיפות. השליכו את כל ערימות הנייר המשומשות לתוך מיכל ביו-האזרד.
- הוסיפו 12.5 μL של תמיסת הנוגדן המשני לכל באר של צלחת 384 קידוח או 25 μL לכל באר של צלחת של 96 בארות. מכסים את הצלחת בחותם אלומיניום או בנייר כסף ומדגרים למשך 30 דקות ב-RT על שייקר צלחת שנקבע ל-700 סל"ד.
- חזור על שלבי שטיפה 2.1.12-2.1.13
- הוסיפו 75 μL של Assay Buffer לכל באר של צלחת של 384 בארות או 100 μL לכל באר של צלחת של 96 בארות. מכסים את הצלחת בחותם אלומיניום או בנייר כסף ומדגרים למשך 5 דקות ב-RT על שייקר צלחת שנקבע ל-700 סל"ד.
- נתח 60 μL באמצעות מנתח המכשירים על פי מדריך המערכת.
- אופטימיזציה של זמן הדגירה של לכידת הדגימה
- בצע את השלבים בסעיף 2.1 באמצעות משך זמני הדגירה של 30 דקות, 60 דקות ו-120 דקות בשלב 2.1.9.
הערה: ניתן לבצע דגירות עם לוחות נפרדים או על ידי השהיה בשלב 2.1.6 עד למועד המשך לשלב 2.1.9. כדי להשיג את זמני הדגירה הרצויים. - המשך עם קריאת הצלחת על המנתח באמצעות 60 μL של תערובת הבדיקה על פי המלצות היצרן.
- בצע את השלבים בסעיף 2.1 באמצעות משך זמני הדגירה של 30 דקות, 60 דקות ו-120 דקות בשלב 2.1.9.
- אופטימיזציה של ריכוז נוגדנים משני
- בצע הליך זה כמפורט בסעיף 2.1, למעט הריכוזים הסופיים של ריאגנטים בתמיסת העבודה של הנוגדנים המשניים (שהוכן בשלב 2.1.10-2.1.11) שונה כדלקמן:
עז-אנטי-אדם (או ארנב) IgM, נוגדנים לזיהוי צמד-SB ב-8, 4, 2, 1 ו-0.5 מיקרוגרם/מ"ל.
עז-אנטי-אדם (או ארנב) IgA, PE-מצומדת נוגדנים לזיהוי 8, 4, 2, 1 ו-0.5 מיקרוגרם/מ"ל.
נוגדנים לזיהוי עזים נגד אדם (או ארנב) IgG, PE-מצומדים ב-8, 4, 2, 1 ו-0.5 מיקרוגרם/מ"ל.
עז-אנטי-אדם (או ארנב) IgG, PE-מצומד/עז-אנטי-אדם (או ארנב) IgM, נוגדנים לזיהוי מצומדים SB ב-8, 4, 2, 1 ו-0.5 מיקרוגרם/מ"ל.
עז-אנטי-אדם (או ארנב) IgA, PE-מצומד/עז-אנטי-אדם (או ארנב) IgM, נוגדנים לזיהוי מצומדים SB ב-8, 4, 2, 1 ו-0.5 מיקרוגרם/מ"ל. - המשך עם קריאת הצלחת על המנתח באמצעות 60 μL של תערובת הבדיקה על פי המלצות היצרן.
- בצע הליך זה כמפורט בסעיף 2.1, למעט הריכוזים הסופיים של ריאגנטים בתמיסת העבודה של הנוגדנים המשניים (שהוכן בשלב 2.1.10-2.1.11) שונה כדלקמן:
- אופטימיזציה של זמן הדגירה של נוגדנים משניים
- בצע הליך זה כמפורט בסעיף 2.1 עם 15 דקות, 30 דקות, 60 דקות ו-120 דקות של משך דגירה המוגדר בשלב 2.1.14.
- המשך עם קריאת הצלחת על המנתח באמצעות 60 μL של תערובת הבדיקה על פי המלצות היצרן.
- הערכה של דגימות נושא עם מבחנים דו-ערוציים ממוטבים
- אסוף דגימות פלזמה של נבדקים (n = 4) בימים -21, -11, -1/0, +14, +28, +60, +90, +90 ו-+120 ביחס להשלמת מתן החיסון נגד קוביד-19 (כלומר, מנה שנייה).
הערה: יום 0 מייצג את נקודת הזמן לפיה החיסון הושלם. - בצע את כל הבדיקות באמצעות פרוטוקול הבסיס (סעיף 2.1.) כבדיקה דו-ערוצית של IgG/IgM או IgA/IgM.
- נרמל את התוצאות לערך העוצמה הפלואורסצנטית החציונית (MFI) המרבי שנצפה עבור כל אימונוגלובולין ובדיקה ספציפיים.
- אסוף דגימות פלזמה של נבדקים (n = 4) בימים -21, -11, -1/0, +14, +28, +60, +90, +90 ו-+120 ביחס להשלמת מתן החיסון נגד קוביד-19 (כלומר, מנה שנייה).
תוצאות
תוצאות בדיקה טיפוסיות והערכות ביצועים
בדיקות אימונו-ביצ'יות מספקות בדרך כלל עקומה סיגמואידלית כאשר הן מוערכות על פני מספר סדרי גודל (לוג), כפי שמודגם בכל אחד מהלוחות המוצגים באיור 1. על המשתמש להגדיר באופן ניסיוני את טווח הריכוז האופטימלי עבור כל אנאליט במולטיפלקס כדי לקבוע את כל טווח הכמות, ולהבטיח שלא לדגום יתר על המידה את הקצוות (אזורים המתקרבים לגבול התחתון של הכמות [LLOQ] או לגבול העליון של הכמות [ULOQ]). עם זאת, הטווח הממשי הנדרש לבדיקה מוכתב על ידי התפלגות האנליטים של המטרה במטריצה ביולוגית (כלומר, ה'לא ידועים') בגורם דילול נתון. יתר על כן, למרות שעקומות סטנדרטיות מתפרשות בדרך כלל באמצעות רגרסיה ליניארית עם אלגוריתם התאמה פרמטרי של 4 או 5, החלק הליניארי של עקומה נתונה מספק בדרך כלל את הביטחון הגדול ביותר בדיוק כמותי עם מודל ליניארי (y = mx + b) של כמות. התאמת עקומת הכיול לערכים הנצפים עבור גורם דילול לא ידוע בגורם דילול נתון צריכה להיות המטרה בפיתוח בדיקה כמותית.
בהקשר זה, הוערכה עקומה סטנדרטית בת 7 נקודות המבוססת על סדרת דילול סדרתי של 1:5 עבור כל אחד מהנוגדנים Spike S1, Nucleocapsid ו-Membrane הנעים בין 1 מיקרוגרם/מ"ל לבין 0.000064 מיקרוגרם/מ"ל עבור ספייק S1 ונוקליאוקפסיד ו-5 מיקרוגרם/מ"ל ו-0.00032 מיקרוגרם/מ"ל עבור ממברנה, כפי שמוצג באיור 1. גבול הגילוי התחתון (LLOD) עבור כל בדיקה הוגדר כריכוז האנליטים הנמוך ביותר שהניב אות נבדל מהרקע שלו. ניתן לזהות LLOD על ידי המשוואה שתוארה קודם לכן 8,9, LLOD = LoB + 1.645 (מדגם SDבריכוז נמוך). LoB הוא הגבול התחתון של ריק, והריכוז "הנראה לעין" של האנליט הוא המופק מהריק כאשר צפוי ערך אפס, וניתן לברר אותו באמצעות משוואה זו LoB = ממוצעריק + 1.645(SDריק)8. בהתבסס על שיטה זו, ערכי ה-MFI עבור מבחן Spike S1 נעו בין 134.38 ל-20191.2, כאשר 134.38 MFI מייצגים 0.00024 מיקרוגרם/מ"ל ומוגדרים כ-LLOD. עבור בדיקת הממברנה, טווח ה-MFI המעשי היה 52.24 עד 4764.9, כאשר 52.24 MFI חושב להיות 0.004885 מיקרוגרם/מ"ל והוקצה כ-LLOD. טווח ה-MFI של בדיקת הנוקליאוקפסיד היה 517.9 עד 19666.34, כאשר 517.9 הוגדר כ-0.00024 מיקרוגרם/מ"ל, שהיה ה-LLOD. הגבול העליון של הגילוי (ULOD) מוגדר כריכוז האנליט שלאחריו השינוי ב-MFI כבר אינו ליניארי, ותגובת האות רוויה. יש לציין כי האופי הסיגמואידלי המלא של עקומות אלה אינו ניתן לצפייה עבור הסטנדרטים שנבדקו, למעט עקומת הנוקליאוקפסיד. עם זאת, בהינתן שערכי ה-MFI הנצפים עבור כל הלא ידועים שנבדקו עד כה (בדילול של 1:500) נמצאים בטווח העקומה המוצג עבור כל אנאליט והם ניתנים לכימות בקלות באמצעות התאמה פרמטרית של 4 או 5 באמצעות רגרסיה ליניארית.
דיוק הבדיקה
דיוק תוך-בדיקה: ארבעה שכפולים של מבחנים בוצעו על אותה לוחית כדי להעריך את דיוק הבדיקה, שחושב כ-%CV, או המניין של סטיית התקן והממוצע כפול 100. נקודות סטנדרטיות 2 ו- 5 נבחרו עבור טבלאות אלה, עם ערכים מקוטלגים בטבלה 2. סף הגבול העליון המקובל האופייני לערכי %CV הוא ≤20%, שנצפה עבור נתונים אלה, למעט זה של תקן 2 של IgG ממברנה, שככל הנראה נובע מרמות רקע וניתן לתקן אותו על ידי ביטול ערכים מרוחקים (נתונים שאינם מוצגים). יש לציין כי חוסר יציבות לכאורה לקרוא ערך נצפה עבור מבחני ממברנה שבהם ערכי MFI היו <200, הנפוץ ביותר במקרה של איזוטיפים IgA ו- IgM.
דיוק בין בדיקות: שלוש קבוצות נפרדות של ערכות חרוזים הוכנו עבור כל בדיקה ונבדקו, כפי שהוגדר לדיוק תוך-בדיקה (לעיל וכפי שניתן לראות באיור 1). השונות בין המבחנים הוערכה על-ידי חישוב %CV מהתוצאות הממוצעות עבור כל אחת משלוש האצוות, כפי שמוצג בטבלה 3. שוב, סף הגבול העליון עבור %CV מקובל מוגדר על ≤20%, אשר קיים עבור כל התנאים שנבדקו (עם השפעה דומה עם תקן 2 של ממברנה IgG, כפי שנראה לעיל). יש לציין כי השתנות מאצווה לאצווה בערכי MFI נטו נצפית בדרך כלל בתוך אצוות מרובות של אותם אימונוריאגנטים במהלך פיתוח בדיקה מותאמת אישית. השימוש בעקומת כיול שהוקמה מנוגדן אנטי-מטרה שהושג באופן מסחרי (למשל, ארנב נגד ספייק S1) ואחריו נוגדן לזיהוי אנטי-מינים יכולים לספק עקביות בתוצאות האנליטיות ולאפשר השוואות בין מספר אצוות בפרקי זמן שונים.
דיוק בין בדיקות עם דגימות אנושיות: ההערכה של דיוק בין בדיקות חזרה על עצמה עם דגימות פלזמה אנושיות (n = 5) שנאספו תוך חודש מהתסמינים שדווחו לראשונה לזיהום SARS-CoV-2; שהושגו עם שלוש קבוצות נפרדות של מבחנים (כלומר, תכשירים שונים של מערכי החרוזים). תוצאות אלה מתוארות בטבלה 4 ומדגימות דיוק עם ערך %CV עם ערך גבול הסף העליון הטיפוסי של ≤20%. ערכי ה-%CV הממוצעים של ה-Spike S1, הנוקליאוקפסיד והממברנה IgG חושבו כ-9.9% (טווח של 2.6%-18%), 11.0% (טווח של 3.5%-24.4%) ו-7.6% (טווח של 3.2%-12.9%), בהתאמה. תצפיות דומות נעשו עם טיטרים IgM ו- IgA של שלושת האנליטים הללו, כולם מספקים ערכי %CV <20%. היוצא מן הכלל היחיד לכך היה נושא 5 IgM titers עבור חלבון ממברנה, אשר לאחר מכן לא נכלל כחריג. ערכי הדיוק של הערכות הנבדקים האנושיים עולים בקנה אחד עם אלה שנראו לעיל עבור נוגדני הארנב, מה שמרמז על כך שניתן להגדיר מחדש את הבדיקות הללו בקלות כדי להעריך את הטיטרים של האנטיגנים במספר מינים עם השפעה מועטה על דיוק הבדיקה. כפי שצוין לעיל, היה חוסר יציבות לכאורה לקרוא ערכים שנצפו עבור מבחני ממברנה שבהם ערכי MFI היו <200, הנפוץ ביותר במקרה של איזוטיפים IgA ו- IgM.
אופטימיזציה ראשונית של ריכוז נוגדנים
'זמן הלכידה' של האנליטים הוערך עם החרוזים המצומדים לאנטיגן, והנוגדנים בדגימות הפלזמה או בתקנים נבדקו על ידי שינוי אורך הדגירה הראשונית (30 דקות, שעה, 2 שעות ו-4 שעות). ההפרש ב-MFI הממוצע מוצג כמניין של דגירה מסוימת וזמן הדגירה המרבי, המכונה %Max., באיור 2, בין דגירה של 30 דקות (משך מינימלי) לדגירה של 4 שעות (משך מרבי). ערכים של 120 דקות היו אופטימליים עבור טיטרים של IgG עבור ה-Spike S1, הממברנה והנוגדנים הנוקליאוקפסידים, מה שמצביע על קינטיקה של נוגדנים ראשוניים מהירים, מה שמאפשר גמישות בהגדלת תפוקת הבדיקה. עם זאת, קינטיקה איטית יותר נצפתה עבור האיזוטיפים של IgA ו-IgM (הנתונים לא מוצגים), והדגימו רמות שיא של לכידה בנקודת הזמן של 4 שעות, כפי שניתן לראות באיור 2. באופן כללי, קיים איזון בין רוויית הבדיקה המתקרבת לבין תועלת הזמן המעשית להפעלת כל בדיקה בעת הייצור (כדי למקסם את התפוקה). עם זאת, אותות מתאימים למטרות כמותיות בזמני דגירה מינימליים של 30 דקות עבור IgG, 60 דקות עבור IgM, ו 120 דקות עבור IgA נצפו בממצאים אלה.
אופטימיזציה משנית של ריכוז הנוגדנים
נבדקו חמישה ריכוזים של נוגדנים משניים (IgG אנטי-אנושי של עזים, PE-מצומדים; עזים נגד אדם IgA, PE-מצומד; עז אנטי-אנושית IgM, SB-מצומדת) (0.5, 1, 2, 4 ו-8 מיקרוגרם/מ"ל). כל הנוגדנים חשפו טווחים רחבים של אותות, ללא רוויית אותות ברורה בשום מצב, ובכך הבטיחו מדידה ליניארית לאף אחד מהריכוזים. לדוגמה, האות הממוצע שנוצר מבדיקת ספייק S1 באמצעות IgM אנטי-אנושי של עז, SB מצומד ב-0.5 מיקרוגרם/מ"ל היה 13.2% מה-MFI שנוצר מהאות המקסימלי (8 מיקרוגרם/מ"ל), בעוד ש-MFI שנוצר מ-4 מיקרוגרם/מ"ל היה 73.3% מה-MFI שבא לידי ביטוי באות המרבי. פרטים על טווח האותות מהאיזוטיפים האחרים של נוגדני ספייק S1, נוגדני הממברנה והנוגדנים לנוקליאוקפסיד כלולים בטבלה 5 ובאיור 3. כנקודה מעשית, ההשפעה העיקרית בין ריכוז הנוגדנים המשני האופטימלי לבין ריכוז הנוגדנים המשני של 4 מיקרוגרם/מ"ל שצוינו קודם לכן משתקפת במונחים של רגישות לבדיקה ועלות הבדיקה. כלומר, ריכוז נוגדנים משני של 8 מיקרוגרם/מ"ל עשוי להיות רצוי ליישום עם טיטרים נמוכים של נוגדנים או כמויות נמוכות של דגימה בעלת ערך, אך העלות הכרוכה בבדיקות אלה תהיה גבוהה משמעותית מהשימוש בריכוז 4 מיקרוגרם/מ"ל שהוגדר קודם לכן. להיפך, מקרים שבהם היו אמורים להיות נצפים טיטרים גבוהים של נוגדנים (כגון אנשים שחוו חיסונים נגד קוביד-19 או עם כמויות בלתי מגבילות של סרה) יראו עלות-תועלת באמצעות יישום הכמויות הנמוכות יותר של נוגדנים משניים (למשל, 1 מיקרוגרם/מ"ל).
אופטימיזציה של דגירה משנית של נוגדנים
ההשפעה הפוטנציאלית של משך הדגירה של הנוגדנים המשניים נחקרה גם על ידי שינוי אורך הדגירה (15, 30, 60 ו -120 דקות). באופן כללי, ההפרש ב-MFI הממוצע כפי שהוא מוצג כמניין של דגירה מסוימת וזמן הדגירה המרבי, המכונה %Max, בין דגירה של 15 דקות (משך מינימום) לבין דגירה של 120 דקות (משך מרבי) לא עלה על 30%, 55% ו-50% עבור הספייק S1, הממברנה והנוגדנים הנוקליאוקפסידים, בהתאמה, מה שמצביע על שלב קינטי מהיר בקשירת נוגדנים משנית ואמצעי להגדלת תפוקת הבדיקה. טבלה 6 כוללת פרטים על שינויי אותות עבור כל זמני הדגירה. איורים של האותות שנצפו מדגירות שונות של ניתוח זה מוצגים באיור 4.
ביצועים דו-ערוציים וספציפיות
עבור כל אנליט, הושוותה הרצה בפורמט כתב יחיד (IgG-PE בלבד, IgA-PE בלבד, או IgM-SB בלבד) לאות שנוצר עבור אותו אנאליט כאשר הוא הופעל בתבנית של כתב כפול (לדוגמה, ספייק S1 IgG-PE בלבד לעומת ספייק S1 IgG-PE בשילוב עם ספייק S1 IgM-SB בפורמט של כתב כפול). דיוק הבדיקה (המבוטא כ-%CV) עבור האותות שנוצרו בשני הפורמטים שימש לניתוח הקשר בממצאי ניסוי זה. ערכי ה-CV% של מבחני ספייק S1 היו 6.19%, 16.4% ו-23% עבור IgM, IgG ו-IgA, בהתאמה. עבור בדיקת הממברנה, ערכי %CV היו 3.3%, 7.9% ו-16.4% עבור IgM, IgG ו-IgA, בהתאמה. לבסוף, בדיקת Nucleocapsid סיפקה ערכי %CV ב-8.7%, 10.3% ו-24.2% עבור IgM, IgG ו-IgA, בהתאמה. ערכי הדיוק שנצפו עבור האיזוטיפים של IgM ו- IgA מצביעים על כך שזמן דגירה ארוך יותר עשוי להעניק תוצאות בדיקה מעולות בשל ההבדלים הקינטיים הקשירים הידועים בין סוגים אלה של אימונוגלובולינים. איור 4 מראה את ההסכמה בין הפורמטים של ריכוזים שונים של נוגדנים משניים.
כדי לאשר את הספציפיות של ערוצי הכתבים, ערוץ כתבים יחיד נבדק בבת אחת ואילו הערוץ השני הוקצה כריק כדי לברר על האות הלא ספציפי (אפקט הדימום). ממצאים אלה מצביעים על כך שקיים זיהום זניח של אותות צולבים בין שני ערוצי הכתבים, בהתחשב בייחודיות הגבוהה על פני ספקטרום התנאים. ממצאים אלה מומחשים באיור 5. בסך הכל, צפינו בהפרעה של 6.45% בערוץ 1 לערוץ 2. עם זאת, כאשר הובא בחשבון גודל האותות, צפינו ברמות ההפרעה הפוטנציאליות הבאות במצב דיווח כפול: ספייק IgG/ IgM ב-71.98%, ספייק IgA/ IgM ב-28.11%; ממברנה IgG / IgM ב 7.41%, ממברנה IgA / IgM ב 134.61%; ונוקליאוקפסיד IgG/ IgM עם 146.03%, נוקליאוקפסיד IgA/ IgM עם 112.13%. בתצורה שצוינה, הדבר יחייב מדידה של Spike IgM בשילוב עם איזוטיפ IgA, IgM ממברנה עם איזוטיפ IgM, ומדידות נוקליאוקפסיד שאינן מבוצעות בפורמט דו-ערוצי. ממצא זה עשוי לחייב חקירה של היפוך אסטרטגיית התיוג לפיה IgA ו-IgG יימדדו בערוץ 2 וב-IgM בערוץ 1.
הערכה של אירועי סרקונוורסיה בעקבות חיסון Covid-19
Seroconversion היה במעקב בארבעה נבדקים לאחר הערכה של IgA, IgM ו- IgG עם בדיקת ספייק S1 בנקודות זמן שנעו בין טרום חיסון לארבעה חודשים לאחר השלמת סדרת החיסונים Covid-19. המדידות הושגו במצב ערוץ כפול (IgG/ IgM ו-IgA/ IgM, עם ממוצע ערכי IgM). כל הנבדקים קיבלו את החיסון כחיסון דו-שלבי, לפי הנוהג המקובל, עם מרווח של 21 יום בין המנה הראשונה לשנייה. חלקות של התגובה החיסונית של כל נבדק מוצגות באיור 6A-C. ערכי התגובה החיסונית של האנטיגנים נוקליאוקפסיד וממברנה נצפו ברמות הרקע של כל האימונוגלובולינים שנבדקו (נתונים שלא הוצגו), מה שהיה עקבי עם העובדה שלנבדקים לא היה זיהום קודם מתועד של SARS-CoV-2 בתקופה שקדמה לחיסון. בסך הכל, ערכי ה-Spike S1 IgA וה-IgM שנצפו היו נמוכים בערך פי 40 מהטיטרים האיזוטיפיים של IgG, כאשר שיא הטיטרים היה פסגה כבר 14 יום הן עבור איזוטיפים של IgM והן עבור איזוטיפים של IgG והאיזוטיפ של IgA הגיע לשיא הטיטרים בין זמן המנה השנייה (יום 0) ל-14 יום לאחר המנה השנייה, בהתאם לנושא. יש לציין כי טיטרים של ספייק S1 IgG מתחילים להתפורר במהלך ארבעת החודשים שלאחר השלמת החיסון בשיעור משתנה מאוד, באופן התלוי בנושא.
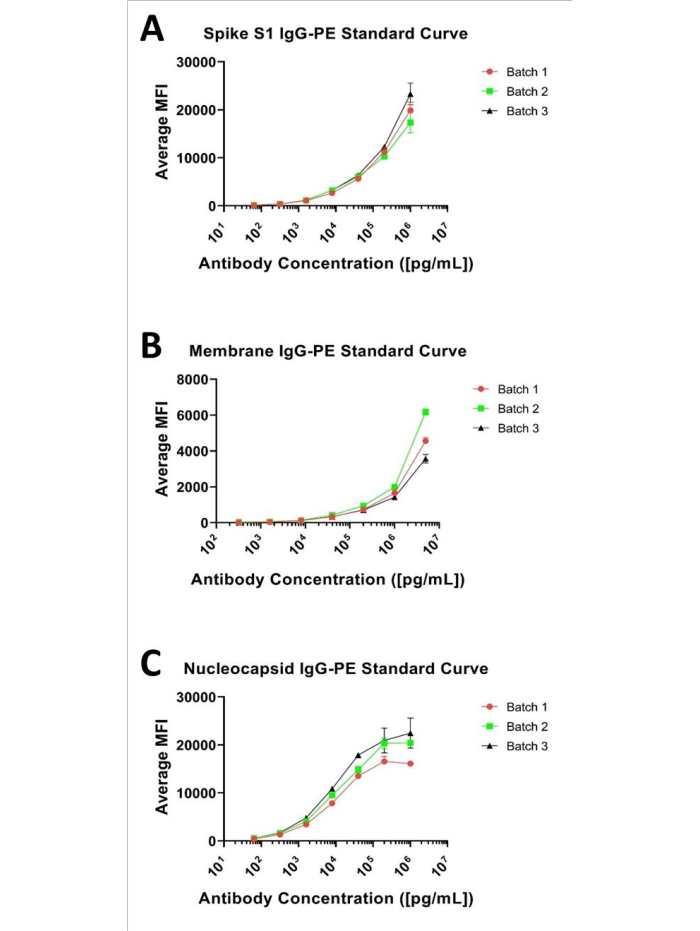
איור 1: עקומות סטנדרטיות מייצגות של 3-plex. עקומות סטנדרטיות מייצגות עבור שלושת האנליטים; מוצג כעקומת דילול סדרתית של 7 נקודות, 1:5, המתחילה ב-(A) 1 מיקרוגרם/מ"ל עבור ספייק S1, (B) 5 מיקרוגרם/מ"ל עבור ממברנה, ו-(C) 1 מיקרוגרם/מ"ל עבור נוקליאוקפסיד ונוגדנים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: אופטימיזציה ראשונית של זמן הדגירה של נוגדנים/דגימות: אות ה-MFI הממוצע המופק מזמני דגירה שונים של נוגדנים/דגימות ראשוניות (לכידת נוגדנים) הנעים בין 30 דקות ל-4 שעות עבור תקנים 1-7 (כפי שמצוין בטבלה 1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: אופטימיזציות משניות של ריכוזי נוגדנים וביצועים דו-ערוציים. עקומות ממחישות את ממוצע ה-MFI (המנורמל לערך המתועד הגבוה ביותר בסדרה) המופק מריכוזי נוגדנים משניים שנבדקו, הנעים בין 0.5-8 מיקרוגרם למ"ל. כל מופע בוצע הן כבדיקה חד-ערוצית והן כבדיקה דו-ערוצית כדי להעריך את ההבדלים בפורמט הניסיוני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: אופטימיזציה של זמן הדגירה של נוגדנים משניים, פורמט דו-ערוצי. תרשימים מייצגים של ערכי MFI שנצפו (מנורמלים לערך המתועד הגבוה ביותר בסדרה) ביחס לזמן הדגירה עם נוגדנים משניים. הניסויים בוצעו כמבחנים דו-ערוציים כצירופים (A-C) IgA/IgM או (D-F) IgG/IgM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: הערכות ספציפיות לבדיקות דו-ערוציות. תוצאות הבדיקה של תבנית הבדיקה הדו-ערוצית כאשר אחד מכל צירוף מוגדר כריק כדי להמחיש את היעדר פלורסנט חוצה ערוצים או הפרעות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
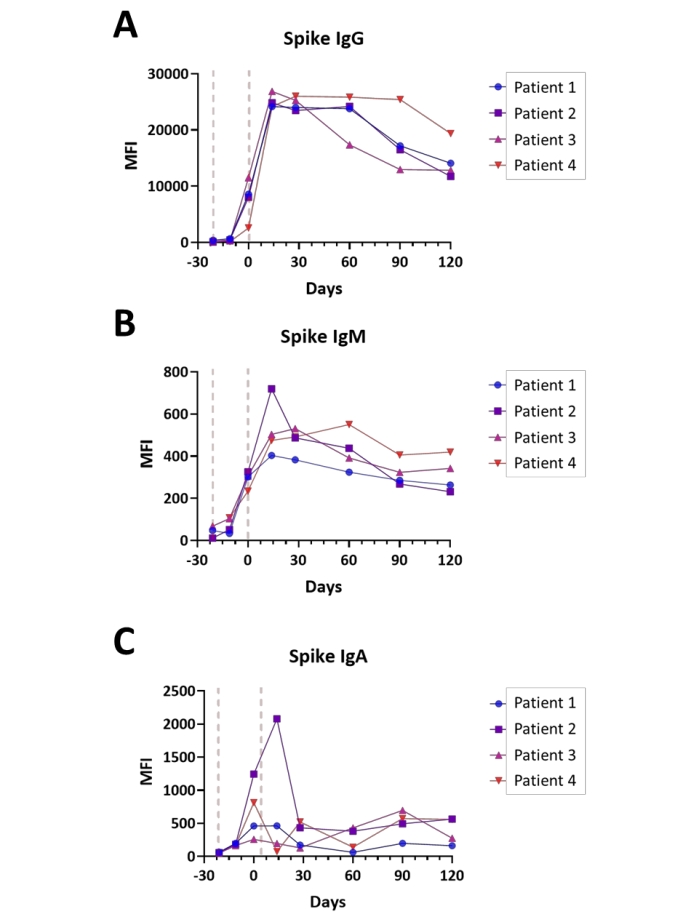
איור 6: המחשה של seroconversion בעקבות חיסון Covid-19. מגרשים הממחישים את הטיטרים היחסיים של (A) IgG, (B) IgM, ו-(C) נוגדני IgA לאנטיגן ספייק S1 במהלך חיסון Covid-19 (טרום חיסון - 4 חודשים לאחר השלמתו); הזמן מוצג בימים יחסית להשלמת סדרת החיסונים; נקודות כלליות של מתן החיסון מסומנות (קווים אדומים). הניסויים בוצעו במצב ערוץ כפול, כמתואר בפרוטוקול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מספר סטנדרטי | סדרת דילול | אנטי-ספייק S1 או N (מיקרוגרם/מ"ל) | אנטי-קרום (מיקרוגרם/מ"ל) |
| ריק | ריק | - | - |
| 1 | STD7 1:1 | 1 | 5 |
| 2 | STD6 1:5 | 0.2 | 1 |
| 3 | STD5 1:25 | 0.04 | 0.2 |
| 4 | STD4 1:125 | 0.008 | 0.04 |
| 5 | STD3 1:625 | 0.0016 | 0.008 |
| 6 | STD2 1:3125 | 0.00032 | 0.0016 |
| 7 | STD1 1:15625 | 0.000064 | 0.00032 |
טבלה 1: סדרות דילול עבור עקומות סטנדרטיות: טבלת גורמי דילול המשמשים לעקומות הסטנדרטיות עבור סרוטיפ IgG; מוצג כעקומת דילול סדרתית של 7 נקודות, 1:5, המתחילה ב-1 מיקרוגרם/מ"ל עבור α-Spike S1 ו-α-Nucleocapsid ו-5 מיקרוגרם/מ"ל עבור נוגדנים α-ממברנה.
| אנאליטה | לדוגמה | נציג 1 | נציג 2 | נציג 3 | נציג 4 | Ave | SD | % קורות חיים |
| ספייק S1 | STD2 | 369.4 | 356.9 | 295.2 | 271.5 | 323.3 | 47.4 | 14.6 |
| STD5 | 3869.1 | 3437 | 3970.2 | 4240.7 | 3879.3 | 334 | 8.6 | |
| קרום | STD2 | 40.6 | 37.7 | 49.9 | 27.8 | 39 | 9.1 | 23.3 |
| STD5 | 733.2 | 731.3 | 724 | 678.1 | 716.7 | 26 | 3.6 | |
| נוקליאוקפסיד | STD2 | 1746.7 | 1790.8 | 1577.3 | 1664.8 | 1694.9 | 94.2 | 5.6 |
| STD5 | 15598.1 | 14735.5 | 18369.5 | 17408.5 | 16527.9 | 1657.7 | 10 |
טבלה 2: דיוק תוך-בדיקה: מקדם השונות באחוזים (%CV) המחושב מארבעה שכפולים של תערובות נוגדנים סטנדרטיות בתקן 2 (STD2) ובתקן 5 (STD5) עם אצווה אחת של בדיקה באותו ניסוי. ערכים המסופקים עבור שכפולים וממוצעים מייצגים את ערכי ה- MFI שנצפו.
| אנאליטה | לדוגמה | אצווה 1 | אצווה 2 | אצווה3 | Ave | SD | % קורות חיים |
| ספייק S1 | STD2 | 383.2 | 424.4 | 379.9 | 395.8 | 24.8 | 6.3 |
| STD5 | 5639.7 | 6062.5 | 6384.3 | 6028.8 | 373.4 | 6.2 | |
| קרום | STD2 | 39.1 | 58.5 | 59.1 | 52.2 | 11.4 | 21.8 |
| STD5 | 732.3 | 941.4 | 701.1 | 791.6 | 130.7 | 16.5 | |
| נוקליאוקפסיד | STD2 | 1342.6 | 1621 | 1718.2 | 1560.6 | 195 | 12.5 |
| STD5 | 13543.9 | 14843.2 | 17883.4 | 15423.5 | 2227.2 | 14.4 |
טבלה 3: דיוק בין בדיקות עם דוגמאות סטנדרטיות: מקדם אחוז השונות (%CV) מחושב משלוש קבוצות נפרדות של מבחנים, שהוערכו בתקן 2 ובתקן 5 באותו ניסוי. ערכים המסופקים עבור שכפולים וממוצעים מייצגים את ערכי ה- MFI שנצפו.
| IgG-PE | IgM-SB | IgA-PE | |||||
| Ave. MFI | % קורות חיים | Ave. MFI | % קורות חיים | Ave. MFI | % קורות חיים | ||
| ספייק S1 | נושא 1 | 8002.3 | 17.7 | 1949.5 | 1.3 | 2045.8 | 5.5 |
| נושא 2 | 19155.8 | 7.3 | 918.6 | 4.1 | 1684.5 | 3.9 | |
| נושא 3 | 17865.6 | 18.0 | 549.4 | 3.8 | 961.3 | 8.1 | |
| נושא 4 | 11901.1 | 2.6 | 1603 | 4.8 | 8736.4 | 5.5 | |
| נושא 5 | 9801.8 | 4.0 | 1014.1 | 3.0 | 2747.6 | 9.3 | |
| נוקליאוקפסיד | נושא 1 | 15097.8 | 11.3 | 1049.7 | 9.9 | 5276.5 | 3.9 |
| נושא 2 | 15204.3 | 12.1 | 265.9 | 5.2 | 6761.3 | 11.9 | |
| נושא 3 | 18471.7 | 24.4 | 329.1 | 4.5 | 14308 | 2.9 | |
| נושא 4 | 16424.7 | 3.5 | 2418.1 | 0.1 | 4234.7 | 4.2 | |
| נושא 5 | 13344.9 | 3.6 | 225.6 | 10.0 | 13436.5 | 9.7 | |
| קרום | נושא 1 | 514.6 | 8.6 | 180.6 | 14.0 | 141.2 | 9.8 |
| נושא 2 | 196.8 | 5.2 | 57 | 20.7 | 55.5 | 13.0 | |
| נושא 3 | 553.7 | 12.9 | 54.5 | 21.2 | 191.2 | 18.6 | |
| נושא 4 | 377.9 | 3.2 | 68.1 | 22.1 | 62 | 2.3 | |
| נושא 5 | 325.4 | 8.2 | 11.4 | 91.6 | 74.6 | 20.8 |
טבלה 4: דיוק בין בדיקות עם דגימות אנושיות: מקדם ממוצע של שונות באחוזים (%CV) מחושב משלוש קבוצות של מבחנים שנבדקו עם דגימות פלזמה (מדולל פי 500) מחמישה נבדקים אנושיים עם זיהומי SARS-CoV-2.
| ספייק S1 | קרום | נוקליאוקפסיד | |||||
| מיקרוגרם/מ"ל | Ave. MFI | % מקסימום. | Ave. MFI | % מקסימום. | Ave. MFI | % מקסימום. | |
| IgM | 0.5 | 186 | 13.2 | 32 | 25.2 | 132.7 | 13.6 |
| 1 | 304.2 | 21.6 | 45.8 | 36 | 194.4 | 19.9 | |
| 2 | 664.5 | 47.2 | 78.8 | 61.9 | 458.2 | 47 | |
| 4 | 1032.1 | 73.3 | 101.3 | 79.6 | 707.8 | 72.6 | |
| 8 | 1407.1 | 100 | 127.2 | 100 | 975 | 100 | |
| IgG | 0.5 | 809.7 | 4.9 | 27.5 | 15 | 1355.6 | 6.3 |
| 1 | 1696.9 | 10.2 | 40.6 | 22.2 | 2782.1 | 13 | |
| 2 | 4543.8 | 27.3 | 68.3 | 37.3 | 6661.2 | 31.2 | |
| 4 | 10003.5 | 60 | 110.7 | 60.5 | 12605.6 | 59 | |
| 8 | 16662.8 | 100 | 182.9 | 100 | 21360.6 | 100 | |
| איגה | 0.5 | 797.4 | 19.3 | 31.1 | 47.2 | 2056.5 | 16.1 |
| 1 | 1529.5 | 37 | 41.4 | 62.8 | 3869 | 30.4 | |
| 2 | 2261.3 | 54.7 | 48.6 | 73.3 | 6648.9 | 52.2 | |
| 4 | 2320.4 | 56.2 | 48.3 | 73.2 | 6548.1 | 51.4 | |
| 8 | 4132.2 | 100 | 65.9 | 100 | 12744.8 | 100 | |
טבלה 5: אופטימיזציה משנית של ריכוז הנוגדנים: אות ה-MFI הממוצע מופק מריכוזים שונים של נוגדנים משניים הנעים בין 0.5 מיקרוגרם/מ"ל ל-8 מיקרוגרם/מ"ל. הערך של כל אות מוצג גם כאחוז מהאות ב-8 מיקרוגרם/מ"ל ("מקסימום") כדי להדגים את גודל האות היחסי.
| ספייק S1 | קרום | נוקליאוקפסיד | |||||
| זמן הדגירה (מינימום) | Ave. MFI | % מקסימום. | Ave. MFI | % מקסימום. | Ave. MFI | % מקסימום. | |
| IgM | 15 | 1185 | 72.2 | 40.4 | 48.9 | 609.5 | 53.3 |
| 30 | 1416.6 | 86.3 | 58.4 | 70.7 | 894.2 | 78.2 | |
| 60 | 1324.8 | 80.7 | 73.6 | 89.1 | 945.6 | 82.7 | |
| 120 | 1641.2 | 100 | 82.6 | 100 | 1143.2 | 100 | |
| IgG | 15 | 12917.6 | 80.5 | 244.4 | 44.9 | 15429.8 | 80.8 |
| 30 | 14915.4 | 92.9 | 434.7 | 79.9 | 18797 | 98.5 | |
| 60 | 15340.3 | 95.6 | 421.4 | 77.5 | 18694.4 | 97.9 | |
| 120 | 16050.3 | 100 | 544 | 100 | 19085.8 | 100 | |
| איגה | 15 | 3141.9 | 78.2 | 75 | 66.8 | 9103 | 86.6 |
| 30 | 3569.1 | 88.8 | 83.9 | 74.8 | 9563.8 | 91 | |
| 60 | 3539.1 | 88 | 86 | 76.6 | 9555.7 | 90.9 | |
| 120 | 4020 | 100 | 112.2 | 100 | 10512.9 | 100 |
טבלה 6: אופטימיזציה משנית של זמן הדגירה של נוגדנים: אות ה-MFI הממוצע הופק מזמני דגירה שונים של נוגדנים משניים שנעו בין 15 דקות ל-120 דקות. הערך של כל אות מיוצג גם כאחוז מהאות ב-120 דקות ("מקסימום") כדי להדגים את גודל האות היחסי.
Discussion
ההערכה של תגובה חיסונית לחשיפה ל- SARS-CoV-2, בשילוב עם מעקב מבוסס RT-PCR אחר מצב הזיהום, תוארה היטב כמרשם להבהרת מהלך ההחלמה מקוביד-19, לשמש כאמצעי לזיהוי פלזמת החלמה עם ערך טיפולי פוטנציאלי, ולסקר את שיעורי ההדבקה על בסיס אוכלוסייה10,11. דוגמאות שונות להבנת סרוקונוורסיה אצל נבדקים אנושיים כוללות מערכי חלבונים (אנטיגן)12, אימונובלוטים13, מבנים אימונוכרומטוגרפיים מהירים14, ובדיקות אימונוסורבנטיות הקשורות לאנזים (ELISAs)15,16,17. כל אחת מהטכניקות הנ"ל יכולה להעריך איזוטיפים מרובים של אימונוגלובולינים בנפרד עם שינויים קלים. עם זאת, נהלים אלה אינם מסוגלים להיות מיושמים מחדש באופן מעשי כדי לאפשר ניתוח מקביל של איזוטיפים מרובים, כפי שמוצג בכתב יד זה, מה שהופך את גורמי העלות והתפוקה כמגבלות לניהולם על אסטרטגיית בדיקה בקנה מידה מבוסס אוכלוסייה. כמה מהיישומים הללו מספקים גם את ההזדמנות לשרשר רמות של אנטיגנים מרובים במקביל, כפי שהוצגו או בפורמטים שהשתנו, כגון מולטיפלקס ELISA18,19. לבסוף, פלטפורמת האימונו-ביצות מספקת את האפשרות להעריך רמות של אנטיגנים מרובים במקביל ל-20,21, אך הוגבלה לאפיטופ יחיד (כלומר, איזוטיפ אימונוגלובולינים) לכל בדיקה, אלא אם כן, עם זאת, נעשה שימוש במכשיר האחרון עם יכולות הבדיקה 'הדו-ערוציות'.
בדו"ח זה מפורטים פרוטוקולים הקובעים מדידה אמינה של אפיטופים מרובים בבדיקת אימונו-קדם באמצעות המכשיר במצב 'דו-ערוצי' במקרה בוחן של seroconversion של אנשים מחוסנים ב-Covid-19. השיטה הפגינה דיוק מצוין (ערכי CV של%, בדרך כלל <20%) באמצעות עיצובי בדיקה ידניים שניתן לשפר עם שילוב של מערכות אוטומטיות מעבדתיות. רגישות הבדיקה והטווח הדינמי של כל האנליטים והאפיטופים שנבחרו התאימו להערכות שגרתיות. אף על פי שהיעדר אנטי-אנטיגן IgA ו-IgM immunoreagents הזמינים מסחרית הגביל את הכמות לאיזוטיפ של IgG, הגבלה כזו אינה מונעת את היכולת להציע הערכות או הערכות כמותיות למחצה ביחס לדגימה מסוימתכקליברנט 22,23.
הבדיקה החיסונית המאומתת הוקצתה כדי לחקור סרוקונוורסיה בקבוצה של אנשים שחוסנו בחיסון נגד קוביד-19. בניגוד לפלטפורמות דומות אחרות, משפחת המכשור מאפשרת חיפוש של seroconversion במאות אנשים ביום בזרימת עבודה ידנית ואלפי ביום בתוכנית אוטומטית. באופן כללי, ממצאים אלה מאשרים כי לגישת 'הערוצים הכפולים' יש רגישות מתאימה לתיאור אפיטופים מרובים במקביל למאמר זהה והיא בת קיימא בהקשר רב-אנליטי. הבדל ברגישויות לערוץ 1 ולערוץ 2, כפי שבוצעו עם פיקוריתרין ופלואורופורים Super Bright 436, בהתאמה, עשוי להצדיק תכנון של ניסוי ספציפי כדי להבטיח תוצאות אנליטיות בנות קיימא שנרכשו עבור ניסוי נתון. כלומר, ההסתייגות של ערוץ 1 עבור אפיטופים או אנליטים של שכיחות נמוכה יותר עשויה להיות נחוצה כדי לשמור על טווח דינמי של הבדיקה הכולל את הערכים הנצפים של לא ידועים. מעבר לשיקול זה, תכנון הבדיקה היה ברור ואמור להיות נגיש למעבדות בעלות יכולות אנליטיות מוגבלות. אין ספק שיש לשקול את השיקול הזה כאשר בוחנים את ההפרעה של ערוץ 1 לערוץ 2, כפי שציינו באיור 5, לפיו הפרעה מאיזוטיפים של שפע גבוה יותר עלולה לגרום לטעויות אנליטיות מטעות עבור אלה שנמצאים בשפע נמוך בהרבה כאשר הם נמדדים בתבנית דו-ערוצית. פוטנציאל זה להתערבות במצבים עם ריכוזי אנאליטים שונים מאוד עשוי להוות מגבלה משמעותית לגישה אם לא תטופל כראוי בשלב תכנון הבדיקה.
לסיכום, הוצגה שיטה למדידה מהירה של טיטרים של נוגדנים מהאיזוטיפים העיקריים של אימונוגלובולינים הקשורים לתגובה חיסונית לזיהום או לחיסון של Covid-19. יישום גישה זו באופן אורכי להערכת seroconversion עשוי לספק תובנות שניתן להשתמש בהן טוב יותר כדי לנהל ו / או לפקח על מהלך המחלה או, לחלופין, להנחות תוכניות חיסון פוטנציאליות נגד דחף Covid-19.
Disclosures
ד"ר בורג'ה הוא ממציא המבחן הסרולוגי המשמש בכתב יד זה, הממתין לפטנט. המאמר מוצג באופן תיאורי בלבד ללא ניתוחים סטטיסטיים המוצגים כדי למנוע הטיה פוטנציאלית שהוצגה על ידי קונפליקט המחברים.
Acknowledgements
המחברים מבקשים להודות לליבת הפיתוח של Rush Biomarker על השימוש במתקנים שלהם, ל-Rush Biorepository לרישום נושאים ולעיבוד ביו-פסימנים, וליוזמת רשת הערכת נגיף הקורונה של קרן וולדר בשיקגו (Chicago CAN) שמספרי המענקים SCI16 (J.R.S. ו-J.A.B.) ו-21-00147 (J.R.S. ו-J.A.B.) ופרס מקרן Swim Across America (J.A.B.).
Materials
| Name | Company | Catalog Number | Comments |
| 384-well black side polystyrene microtiter plates | Thermo Fisher | 12-565-346 | |
| Activation buffer (0.1 M NaH2PO4, pH 6.2) | Prepared in house | ||
| Assay buffer (PBS, 1% Bovine Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| Bovine Serum Albumin, heat shock fraction | MilliporeSigma | A-7888-50G | |
| Coupling buffer (50 mM MES, pH 5.0) | Prepared in house | ||
| COVID 19 M Coronavirus Recombinant Matrix Protein (6xHis tag) | MyBioSource | MBS8574735 | |
| Disposable pipette tips | |||
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Thermo Fisher | PIA35391 | |
| Goat Albumin, Fraction V Powder | MilliporeSigma | A2514-1G | |
| IgA Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB205009 | |
| IgG Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB204009 | |
| IgG Goat anti-Rabbit, R-PE, Polyclonal | Thermo Fisher | OB403009 | |
| IgM Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB202009 | |
| IgM Mouse anti-Human, SB 436, Clone SA-DA4 | Thermo Fisher | 62999842 | |
| Instrument Analyzer | Luminex Corp. | INTELLIFLEX-RUO | |
| Low-Bind microcentrifuge tubes (1.5 mL) | Thermo Fisher | 13-698-794 | |
| MagPlex-C Microspheres, Region XXX | Luminex Corp. | MC10XXX-01 | |
| MES hydrate (2-(N-Morpholino) ethane sulfonic acid hydrate) | MilliporeSigma | M2933 | |
| Microplate aluminum sealing tape | Thermo Fisher | 07-200-683 | |
| Polysorbate-20 | Thermo Fisher | BP337-500 | |
| Quality Biological Inc. PBS, pH 7.2 | Thermo Fisher | 50-751-7328 | |
| Quench buffer (PBS, 1% Goat Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Protein (His tag) | Sino Biologicals | 40588-V08B | |
| SARS-CoV-2 (2019-nCoV) Spike Protein (S1 Subunit, His tag) | Sino Biologicals | 40591-V08H | |
| SARS-CoV-2 (2019-nCoV) Spike RBD Antibody, Rabbit pAb | Sino Biologicals | 40592-T62 | |
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Antibody, Rabbit mAb | Sino Biologicals | 40588-R0004 | |
| SARS-CoV-2 (COVID-19) Membrane Antibody (IN), Rabbit pAb | ProSci | 10-516 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Fisher | PIA39269 | |
| Wash Buffer (PBS, 0.01% Polysorbate-20) | Prepared in house | ||
| Water, LC/MS grade | Thermo Fisher | W-64 |
References
- Tighe, P. J., Ryder, R. R., Todd, I., Fairclough, L. C. ELISA in the multiplex era: potentials and pitfalls. Proteomics - Clinical Applications. 9, 406-422 (2015).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments: JoVE. (65), e4084 (2012).
- Powell, R. L., et al. A multiplex microsphere-based immunoassay increases the sensitivity of siv-specific antibody detection in serum samples and mucosal specimens collected from rhesus macaques infected with SIVmac239. BioResearch Open Access. 2 (3), 171-178 (2013).
- Volpetti, F., Garcia-Cordero, J., Maerkl, S. J. A microfluidic platform for high-throughput multiplexed protein quantitation. PLoS One. 10 (2), 0117744 (2015).
- Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., Al-Nasser, A. D. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens. 9 (3), 231 (2020).
- Asif, M., Xu, Y., Xiao, F., Sun, Y. Diagnosis of COVID-19, vitality of emerging technologies and preventive measures. Chemical Engineering Journal. 423, 130189 (2021).
- La Marca, A., Capuzzo, M., Paglia, T., Roli, L., Trenti, T., Nelson, S. M. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reproductive Biomedicine Online. 41 (3), 483-499 (2020).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews. 29, 49-52 (2008).
- Tarhoni, I., et al. Relationship between circulating tumor-associated autoantibodies and clinical outcomes in advanced-stage NSCLC patients receiving PD-1/-L1 directed immune checkpoint inhibition. Journal of Immunological Methods. 490, 112956 (2021).
- Deeks, J. J., et al. Antibody tests for identification of current and past infection with SARS-CoV-2. The Cochrane Database of Systematic Reviews. 6, 013652 (2020).
- Mahalingam, S., et al. Landscape of humoral immune responses against SARS-CoV-2 in patients with COVID-19 disease and the value of antibody testing. Heliyon. 7 (4), 06836 (2021).
- Ruano-Gallego, D., et al. A multiplex antigen microarray for simultaneous IgG and IgM detection against SARS-CoV-2 reveals higher seroprevalence than reported. Microbial Biotechnology. 14 (3), 1228-1236 (2021).
- Shah, J., et al. IgG and IgM antibody formation to spike and nucleocapsid proteins in COVID-19 characterized by multiplex immunoblot assays. BMC Infectious Diseases. 21 (1), 325 (2021).
- Gambino, C. M., et al. Comparison of a rapid immunochromatographic test with a chemiluminescence immunoassay for detection of anti-SARS-CoV-2 IgM and IgG. Biochemia Medica (Zagreb). 30 (3), 030901 (2020).
- Algaissi, A., et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Scientific Reports. 10, 16561 (2020).
- Chiereghin, A., et al. Recent advances in the evaluation of serological assays for the diagnosis of SARS-CoV-2 infection and COVID-19. Frontiers in Public Health. 8, 620222 (2020).
- Nicol, T., et al. Assessment of SARS-CoV-2 serological tests for the diagnosis of COVID-19 through the evaluation of three immunoassays: Two automated immunoassays (Euroimmun and Abbott) and one rapid lateral flow immunoassay (NG Biotech). Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 129, 104511 (2020).
- Butt, J., et al. From multiplex serology to serolomics-A novel approach to the antibody response against the SARS-CoV-2 proteome. Viruses. 13 (5), 749 (2021).
- Byrum, J. R., et al. multiSero: open multiplex-ELISA platform for analyzing antibody responses to SARS-CoV-2 infection. medRxiv. , (2021).
- Dobano, C., et al. Highly sensitive and specific multiplex antibody assays to quantify immunoglobulins m, a, and g against SARS-CoV-2 antigens. Journal of Clinical Microbiology. 59 (2), 01731 (2021).
- Schultz, J. S., et al. Development and validation of a multiplex microsphere immunoassay using dried blood spots for SARS-CoV-2 seroprevalence: Application in first responders in first responders in Colorado, USA. Journal of Clinical Microbiology. 59 (6), 00290 (2021).
- Beavis, K. G., et al. Evaluation of the EUROIMMUN anti-SARS-CoV-2 ELISA assay for detection of IgA and IgG antibodies. Journal of Clinical Virology: The Official Publication of the Pan Americal Society for Clinical Virology. 129, 104468 (2020).
- Jung, J., et al. Clinical performance of a semi-quantitative assay for SARS-CoV2 IgG and SARS-CoV2 IgM antibodies. Clinica Chimica Acta: International Journal of Clinical Chemistry. 510, 790-795 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved