Method Article
Monitoramento Dinâmico da Soroconversão usando um Ensaio de Imunobead Multianalyte para Covid-19
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve um método conveniente para monitorar mudanças dinâmicas em tituladores de anticorpos para dois isótipos de imunoglobulina simultaneamente (IgA, IgM ou IgG) resultante de uma resposta imune à infecção ou vacinação SARS-CoV-2. Este 'Multianalyte Covid-19 Immune Response Panel' emprega três imunoensaias indiretas baseadas em microesferas codificadas que são lidas usando um leitor multiplex baseado em fluxo com capacidade de 'canal duplo'.
Resumo
As tecnologias multiplex para interrogar vários biomarcadores em conjunto existem há várias décadas; no entanto, os métodos para avaliar vários epítopos no mesmo analito permanecem limitados. Este relatório descreve o desenvolvimento e otimização de um ensaio de imunoesfera multiplexado para testes sorológicos de isótipos comuns de imunoglobulina (por exemplo, IgA, IgM e IgG) associados a uma resposta imune à infecção ou vacinação SARS-CoV-2. Os ensaios foram realizados usando um leitor fluorescente multiplex baseado em fluxo com capacidade de canal duplo. Otimizações focadas no tempo de captura de analitos, concentração de anticorpos de detecção e tempo de incubação de anticorpos de detecção. Características de desempenho de ensaios analíticos (por exemplo, faixa de ensaio (incluindo limites inferiores e superiores de quantitação); e precisão intra e inter-ensaio) foram estabelecidas para a combinação de sorotipo IgG/IgM ou IgA/IgM em conjunto usando o modo 'dual channel'. Os tempos de captura de analito de 30 min para IgG, 60 min para IgM e 120 min para IgA foram adequados para a maioria das aplicações, proporcionando um equilíbrio de desempenho e throughput de ensaio. Foram observadas incubações de anticorpos de detecção ideais a 4 μg/mL por 30 min e recomendadas para aplicações gerais, dada a excelente precisão geral (coeficiente percentual de variância (%CV) ≤ 20%) e valores de sensibilidade observados. O alcance dinâmico do isótipo IgG abrangeu várias ordens de magnitude para cada ensaio (Spike S1, Nucleocapsid e glicoproteínas de membrana), que suporta avaliações robustas de titer em um fator de diluição de 1:500 para aplicações clínicas. Finalmente, o protocolo otimizado foi aplicado ao monitoramento da soroconversão de Spike S1 para sujeitos (n = 4) que completaram um regime vacinal SARS-CoV-2. Dentro desta coorte, os níveis de Spike S1 IgG foram observados para atingir os títulos máximos aos 14 dias após a administração da segunda dose, a uma intensidade de sinal muito maior (~40 vezes) do que os isótipos IgM ou IgA. Curiosamente, observamos altas variáveis as taxas de decadência de títulos spike S1 IgG que eram em grande parte dependentes de sujeitos, o que será tema de estudos futuros.
Introdução
A medição simultânea de biomarcadores múltiplos relacionados a doenças em amostras biológicas permite insights descritivos e preditivos em processos patológicos. Embora os procedimentos imunológicos de analito único simples convencionais, como ensaios imunosorbentes ligados à enzima (ELISAs), tenham sido a pedra angular das análises quantitativas em ambientes clínicos e de pesquisa, essas técnicas podem ter limitações substanciais em relação ao throughput, à quantidade de espécimes necessárias para cada medição e ao custo-efetividade que limitam muito o estudo de múltiplos elementos biológicos que são frequentemente entrelaçados ao longo do cursoda doença 1 . A tecnologia de multiplexação baseada em microesfera tornou-se uma plataforma indispensável tanto para as instalações de diagnóstico quanto de pesquisa para sua capacidade de combinar ensaios para melhorar o throughput laboratorial, mitigar a escassez de amostras e reduzir testes repetitivos para maximizar a economia decustos 1,2,3,4. Recentemente, um aumento adicional dessa potência multiplexa-de-multiplexing foi introduzido com instrumentos que possuem capacidades de dois repórteres. O recurso de dois repórteres implementa dois canais fluorescentes para detecção, fornecendo outra dimensão de multiplexação, permitindo a detecção de vários epítopos no mesmo analito.
Síndrome respiratória aguda grave coronavirus 2 (SARS-CoV-2) é o patógeno responsável pela atual doença coronavírus 2019 (COVID-19) pandemia5. Embora o teste de RT-PCR seja crucial para a confirmação da infecção no início do curso da doença, exames sorológicos de títulos de anticorpos têm se mostrado imperativos para a crítica precisa e completa dos indivíduos em relação a uma exposição ou recuperação prévia; uma resposta à imunização; e/ou avaliação da eficácia vacinal covid-19 6,7.
Este relatório delineia métodos para medir a soroconversão para múltiplos antígenos virais SARS-CoV-2 que utilizam um sistema de relatórios duplos de leitor de multiplex baseado em fluxo. Especificamente, a detecção simultânea de dois subtipos de anticorpos (configurados como IgG/IgM ou IgA/IgM) para um painel de antígenos SARS-CoV-2 3-plex que inclui ensaios para Glicoproteínas de Spike S1, Nucleocapsid e Membrana (também conhecida como Matrix). Esta abordagem fornece uma empresa ideal para a captura de soroconversão longitudinal e contribui com uma ferramenta valiosa no arsenal contra a pandemia Covid-19.
Protocolo
Todos os sujeitos foram inscritos com consentimento por escrito informado com a aprovação completa do Centro Médico institucional (IRB) do Rush University Medical Center sob protocolo ORA 20101207 com todas as diretrizes institucionais para a conduta de pesquisa ética observadas. O sangue foi coletado via flebotomia convencional em vacutainers de lavanda (K2EDTA) e processado com protocolos recomendados. O plasma resultante foi arquivado a -80 °C até que as avaliações fossem realizadas.
1. Preparação de microesferas conjugadas por antígeno
- Selecione três frascos diferentes de microesferas magnéticas com regiões de contas únicas, registrando iD de contas e informações de lotes para cada frasco usado.
NOTA: As seguintes etapas serão seguidas para cada região de microesfera distinta. As microesferas são sensíveis à luz e devem ser protegidas da exposição prolongada à luz. Durante as etapas de lavagem, tenha cuidado para não perturbar as microesferas. Se perturbado, permita uma segunda separação de 60 anos. - Vórtice o estoque de microesfera para 60 s e sonicate por 5 minutos antes de usar para dissociar contas agregadas.
- Transfira 1,0 x 106 contas para tubos de microcentrifuge de baixa proteína de 1,5 mL.
- Insira o tubo em um separador magnético e permita que a separação ocorra por 60 s. Com o tubo ainda no separador magnético, remova cuidadosamente o sobrenatante sem perturbar a pelota de contas.
- Remova o tubo do separador magnético, resuspenda as contas com 100 μL de água de grau HPLC e vórtice para 30 s. Coloque o tubo de volta no separador magnético por 60 s e, posteriormente, remova o sobrenante. Repita este protocolo de lavagem duas vezes.
- Remova o tubo do separador magnético e resuspenja as microesferas lavadas em 90 μL de fosfato de sódio monobásico de 100 mM, pH 6.2 (Buffer de Ativação) por vórtice para 30 s.
- Adicione 10 μL de 50 mg/mL Sulfo-NHS (diluído com Buffer de Ativação) às microesferas e vórtice suavemente por 10 s. Adicione 10 μL de solução EDC de 50 mg/mL (diluída com buffer de ativação) e vórtice suavemente para 10 s. Incubar microesferas por 20 minutos à temperatura ambiente (RT) com um vórtice suave a cada 10 minutos.
- Repetir as etapas de lavagem 1.4-1.5 com 50 mM MES, pH 5.0 (Tampão de Acoplamento) em vez de água de grau LC/MS para um total de duas lavagens.
- Remova o tubo do separador magnético e ressuspenda as contas com 100 μL de Tampão de Acoplamento por vórtice por vórtice para 30 s seguido imediatamente pela adição da quantidade desejada de proteína.
- Leve o volume total para 150 μL com buffer de acoplamento. Misture a reação de acoplamento por vórtice para 30 s e incubar por 2h por rotação na RT.
NOTA: Para ensaios aqui definidos, foram realizadas conjugações com as seguintes concentrações proteicas: Spike S1: 5 μg; Nucleocapsid: 5 μg; Membrana: 12,5 μg. - Repito passo de lavagem 1.4 com Salina Tampão Tampão fosfato (PBS)-1% Goat Serum Albumin, 0,01% Polysorbate-20 (Tampão de Súfato) em vez de água de grau LC/MS para um total de duas lavagens. Resuspenha as microesferas lavadas em 100 μL de Tampão de Súmia contendo 0,05% de azida de sódio por vórtice para 30 s.
NOTA: Permita que as contas se saciam totalmente por pelo menos 6h antes de prosseguir para qualquer outro procedimento. - Conte o número de microesferas recuperadas usando um contador celular automatizado ou um hemócito. Regisso da concentração observada de contas.
- Leve à geladeira as microesferas acopladas a 4 °C no escuro.
2. Procedimentos
- Desempenho do ensaio (protocolo base)
- Resuspend as microesferas acopladas por vórtice para 30 s e sonicate para ~60-90 s.
- Remova a quantidade necessária de cada coloide de contas do respectivo tubo e combine os coloides de contas em um novo tubo de microcentrifuge de 1,5 mL.
- Insira o tubo em um separador magnético e permita que a separação ocorra por 60 segundos. Com o tubo ainda no separador magnético, remova cuidadosamente o sobrenatante sem perturbar a pelota de contas.
- Remova as contas do separador, resuspenque as contas com 100 μL de pbs-1% de albumina de soro bovino, 0,01% Polisorbate-20 (Assay Buffer) e vórtice para 30 s. Coloque o tubo em um separador magnético e permita que a separação ocorra por 60 s. Repita este protocolo de lavagem (ou seja, passos 2.1.3-2.1.4) duas vezes
- Ajuste a concentração da mistura de microesfera de trabalho de 3 plex adicionando um volume apropriado de Tampão de Ensaio para gerar uma concentração final de 100 microesferas por 1 μL para cada alvo.
- Alíquota de 12,5 μL da mistura de microesfera preparada na etapa 2.1.5 em cada poço de uma placa de 384-well ou 25 μL em cada poço de uma placa de 96 poços.
- Diluir as amostras de plasma/soro 500 vezes em Assay Buffer. Prepare os espécimes padrão de acordo com a titulação desejada.
- Adicione 12,5 μL de Tampão de Ensaio como amostra em branco e adicione cada um do espécime diluído ou padrão em cada poço designado de uma placa de espécime de 384 poços ou 25 μL do espécime em branco, diluído ou padrão em cada poço de uma placa de espécime de 96 poços.
- Cubra a placa com uma vedação de alumínio ou folha e incubar por 1h no RT em um agitador de pratos definido a 700 rpm.
NOTA: O esquema para as curvas de diluição está fornecido na Tabela 1. - Prepare uma solução de anticorpos de detecção anti-humana (soluções secundárias de anticorpos) a 4 μg/mL com Tampão de Ensaio conforme especificado na etapa 2.1.11.
- Prepare O IgM anti-humano de cabra, conjugado com Super Bright 436 (SB)/Goat-anti-human IgA, Phycoerythrin (PE) Conjugate detecções anticorpos a 4 μg/mL; ou IgM anti-humano de cabra, SB Conjugate/Goat-anti-humano IgG, Anticorpos de detecções conjugados PE a 4 μg/mL.
NOTA: Para um formato de placa de 384 poços, é necessário 12,5 μL/bem da solução de anticorpos secundários preparada, e para um formato de placa de 96 poços, é necessário 25 μL/well. - Coloque a placa em um separador magnético, lave rapidamente e inverta com força sobre um recipiente de risco biológico para remover o líquido dos poços. Com a placa ainda invertida, bata com força a placa contra um maço de papel grosso.
- Lave cada poço com 100 μL de Tampão de Ensaio e remova o líquido por inversão forçada sobre um recipiente de risco biológico, como descrito anteriormente. Repita estas etapas (2.1.12-2.1.13) para um total de duas lavagens. Descarte todos os maços de papel usados em um recipiente de risco biológico.
- Adicione 12,5 μL da solução secundária de trabalho de anticorpos para cada poço de uma placa de 384 poços ou 25 μL a cada poço de uma placa de 96 poços. Cubra a placa com uma vedação de alumínio ou folha e incubar por 30 minutos em RT em um agitador de placa situado a 700 rpm.
- Repetito passos de lavagem 2.1.12-2.1.13
- Adicione 75 μL de tampão de ensaio em cada poço de uma placa de 384 poços ou 100 μL em cada poço de uma placa de 96 poços. Cubra a placa com uma vedação de alumínio ou folha e incubar por 5 min no RT em um agitador de pratos definido a 700 rpm.
- Analise 60 μL através do analisador de instrumentos de acordo com o manual do sistema.
- Otimização do tempo de incubação de captura de espécimes
- Realize as etapas na seção 2.1 utilizando duração de tempo de incubação de 30 min, 60 min e 120 min na etapa 2.1.9.
NOTA: As incubações podem ser realizadas com placas distintas ou parando na etapa 2.1.6 até o momento de proceder à etapa 2.1.9. para alcançar os tempos de incubação desejados. - Proceda com a leitura da placa no analisador utilizando 60 μL da mistura de ensaio de acordo com as recomendações do fabricante.
- Realize as etapas na seção 2.1 utilizando duração de tempo de incubação de 30 min, 60 min e 120 min na etapa 2.1.9.
- Otimização da concentração de anticorpos secundários
- Realize este procedimento conforme detalhado na seção 2.1, com exceção das concentrações finais de reagentes na solução de trabalho de anticorpos secundários (preparada na Etapa 2.1.10-2.1.11) modificadas da seguinte forma:
IgM anti-humano de cabra (ou coelho), anticorpos de detecção de conjugados SB em 8, 4, 2, 1 e 0,5 μg/mL.
IgA anti-humano de cabra (ou coelho), anticorpos de detecção conjugados pe em 8, 4, 2, 1 e 0,5 μg/mL.
IgG anti-humano de cabra (ou coelho), anticorpos de detecção conjugados pe em 8, 4, 2, 1 e 0,5 μg/mL.
IgG anti-humano de cabra (ou coelho), PE-conjugado/Cabra-anti-humano (ou coelho) IgM, anticorpos de detecção de sb-conjugados em 8, 4, 2, 1 e 0,5 μg/mL.
IgM anti-humano de cabra (ou coelho), PE-conjugado/Cabra-anti-humano (ou coelho) IgM, anticorpos de detecção de sb-conjugados em 8, 4, 2, 1 e 0,5 μg/mL. - Proceda com a leitura da placa no analisador utilizando 60 μL da mistura de ensaio de acordo com as recomendações do fabricante.
- Realize este procedimento conforme detalhado na seção 2.1, com exceção das concentrações finais de reagentes na solução de trabalho de anticorpos secundários (preparada na Etapa 2.1.10-2.1.11) modificadas da seguinte forma:
- Otimização do tempo secundário de incubação de anticorpos
- Realize este procedimento conforme detalhado na seção 2.1 com 15 min, 30 min, 60 min e 120 min de duração de incubação definida na etapa 2.1.14.
- Proceda com a leitura da placa no analisador utilizando 60 μL da mistura de ensaio de acordo com as recomendações do fabricante.
- Avaliação de espécimes sujeitos com ensaios otimizados de dois canais
- Coletar amostras de plasma sujeitos (n = 4) nos dias -21, -11, -1/0, +14, +28, +60, +90 e +120 relativos à conclusão da administração da vacina Covid-19 (ou seja, segunda dose).
NOTA: O dia 0 representa o ponto de tempo pelo qual a vacinação foi concluída. - Execute todos os ensaios usando o Protocolo base (seção 2.1.) como um ensaio de canal duplo IgG/IgM ou IgA/IgM.
- Normalize os resultados para o valor máximo observado de Intensidade Fluorescente Mediana (IMFI) para cada imunoglobulina específica e ensaio.
- Coletar amostras de plasma sujeitos (n = 4) nos dias -21, -11, -1/0, +14, +28, +60, +90 e +120 relativos à conclusão da administração da vacina Covid-19 (ou seja, segunda dose).
Resultados
Resultados típicos de ensaios e avaliações de desempenho
Os ensaios de imunoesferas geralmente fornecem uma curva sigmoidal quando avaliados sobre várias ordens (log) de magnitude, como ilustrado em cada um dos painéis apresentados na Figura 1. O usuário deve definir experimentalmente a faixa de concentração ideal para cada analito no multiplex para determinar toda a gama de quantitação, garantindo não sobrepernaturar os extremos (áreas que se aproximam do limite inferior de quantitação [LLOQ] ou limite superior de quantitação [ULOQ]). A faixa real necessária para um ensaio, no entanto, é ditada pela distribuição dos analitos alvos em uma matriz biológica (ou seja, as 'incógnitas') em um determinado fator de diluição. Além disso, embora as curvas padrão sejam tipicamente interpretadas via regressão linear com um algoritmo de ajuste 4 ou 5 paramétricos, a porção linear de uma determinada curva normalmente fornece a maior confiança na precisão quantitativa com um modelo linear (y = mx + b) de quantitação. A correspondência da curva de calibração com os valores observados para um desconhecido em um determinado fator de diluição deve ser o objetivo no desenvolvimento de ensaios quantitativos.
A este respeito, uma curva padrão de 7 pontos baseada em uma série de diluição serial de 1:5 foi avaliada para cada um de Spike S1, Anticorpos nucleocapsídeos e membranas que variam entre 1 μg/mL e 0,000064 μg/mL para Spike S1 e Nucleocapsid e 5 μg/mL e 0,00032 μg/mL para membrana, como mostrado na Figura 1. O limite inferior de detecção (LLOD) para cada ensaio foi definido como a menor concentração de analitos que produziu um sinal distinguível de seu fundo. O LLOD pode ser identificado pela equação descrita anteriormente 8,9, LLOD = LoB + 1.645 (amostrade baixa concentração de SD). LoB é o limite inferior do espaço em branco, e é a concentração "aparente" de analito que é produzido a partir do branco quando um valor zero é esperado, e pode ser verificado usando esta equação LoB = Médiaem branco + 1.645 (SDem branco)8. Com base nesse método, os valores de MEF para o ensaio Spike S1 variaram de 134,38 a 20191.2, com 134,38 MFI representando 0,00024 μg/mL e definido como LLOD. Para o ensaio de membrana, a faixa prática de IFI foi de 52,24 a 4764,9, com 52,24 MFI calculados para 0,004885 μg/mL e atribuídos como LLOD. A faixa de IMfi para o ensaio nucleocapsídeo foi de 517,9 a 19666,34, com 517,9 especificados como 0,00024 μg/mL, que foi o LLOD. O limite superior de detecção (ULOD) é definido como a concentração de analito após o qual a mudança no IMFI não é mais linear, e a resposta ao sinal está saturada. Deve-se notar que o caráter sigmoidal completo dessas curvas não é observável para os padrões testados, com exceção da curva Nucleocapsid. No entanto, dado os valores de IFI observados para todas as incógnitas avaliadas até o momento (em uma diluição de 1:500) estão dentro da faixa de curva apresentada para cada analito e são facilmente quantificados usando um ajuste paramétrico de 4 ou 5 via regressão linear.
Precisão de ensaio
Precisão intra-ensaio: Quatro réplicas de ensaios foram realizadas na mesma placa para avaliar a precisão do ensaio, calculada como %CV, ou o quociente do desvio padrão e a média multiplicada por 100. Os pontos padrão 2 e 5 foram selecionados para essas tabulações, com valores catalogados na Tabela 2. O limite limite superior aceitável típico para valores %CV é ≤20%, o que foi observado para esses dados, com exceção ao padrão 2 do IgG de Membrana, que provavelmente resulta dos níveis de fundo e pode ser corrigido eliminando valores peraquáveis (dados não mostrados). Deve-se notar que observou-se uma aparente instabilidade para o valor de leitura para ensaios de membrana onde os valores de FI foram <200, mais comumente no caso de isótipos IgA e IgM.
Precisão de ensaio inter- ensaio: Três lotes distintos de conjuntos de contas foram preparados para cada ensaio e testados, conforme definido para precisão intra-ensaio (acima e como visto na Figura 1). A variabilidade do ensaio interseto foi avaliada pelo cálculo do %CV a partir dos resultados médios de cada um dos três lotes, conforme mostrado na Tabela 3. Novamente, o limite superior para um %CV aceitável é fixado em ≤20%, o que existe para todas as condições testadas (com efeito semelhante com o padrão 2 de IgG de membrana, como visto acima). Deve-se notar que a variabilidade em lote a lote nos valores de MFI líquidos é comumente observada dentro de vários lotes dos mesmos imunorreagentes durante o desenvolvimento de ensaios personalizados. O uso de uma curva de calibração erguida a partir de um anticorpo anti-alvo obtido comercialmente (por exemplo, anti-Spike S1) seguido por um anticorpo de detecção de antiespécies pode fornecer consistência nos resultados analíticos e permitir comparações entre vários lotes em diferentes períodos de tempo.
Precisão de ensaio com amostras humanas: A avaliação da precisão entre ensaios foi repetida com amostras de plasma humano (n = 5) coletadas dentro de um mês dos sintomas relatados pela primeira vez para uma infecção por SARS-CoV-2; realizados com três lotes distintos de ensaios (ou seja, diferentes preparações dos conjuntos de contas). Esses resultados são retratados na Tabela 4 e demonstram precisão com um valor %CV com o valor limite superior típico de ≤20%. Os valores médios %CV para os títulos De Nucleocapsid e Membrana IgG foram calculados em 9,9% (faixa 2,6%-18%), 11,0% (faixa 3,5%-24,4%) e 7,6% (faixa 3,2%-12,9%), respectivamente. Observações semelhantes foram feitas com os títulos IgM e IgA desses três analitos, todos fornecendo valores %CV <20%. A única exceção a isso foi o assunto 5 títulos IgM para a proteína membrana, que foi posteriormente excluído como um outlier. Os valores de precisão para as avaliações do sujeito humano são consistentes com os vistos acima para os anticorpos de coelho, o que sugere que esses ensaios podem ser prontamente reconfigurados para avaliar os títulos dos antígenos em várias espécies com pouco impacto na precisão do ensaio. Como observado acima, houve uma aparente instabilidade na leitura de valores observados para ensaios de membrana onde os valores de FI foram <200, mais comumente no caso de isótipos IgA e IgM.
Otimização da concentração de anticorpos primários
O "tempo de captura" analito foi avaliado com as contas conjugadas por antígeno, e os anticorpos nos espécimes de plasma ou nos padrões foram testados modificando o comprimento da incubação primária (30 min, 1 h, 2 h e 4h). A diferença na média de IM é apresentada como quociente de uma incubação específica e do tempo máximo de incubação, denominado % Max., na Figura 2, entre uma incubação de 30 min (duração mínima) e uma incubação de 4h (duração máxima). Os valores em 120 min foram ideais para os títulos IgG para os corpos spike S1, a membrana e os anticorpos nucleocapsídeos, indicando uma cinética de ligação de anticorpos de forma primária rápida, permitindo flexibilidade para aumentar o throughput do ensaio. No entanto, cinéticas mais lentas foram observadas para os isótipos IgA e IgM (dados não mostrados), demonstrando níveis de pico de captura no ponto de tempo de 4h, como mostrado na Figura 2. No geral, há um equilíbrio entre a aproximação da saturação do ensaio e a conveniência de tempo prática para executar cada ensaio quando em produção (para maximizar o throughput). Com isso, foram observados sinais adequados para fins quantitativos em tempos mínimos de incubação de 30 minutos para IgG, 60 min para IgM e 120 min para IgA.
Otimização da concentração de anticorpos secundários
Foram testadas cinco concentrações de anticorpos secundários (IgG anti-humano de cabra, conjugado por PE; IgA anti-humano de cabra, conjugado por Pm; IgM anti-humano de cabra, conjugado pela SB) (0,5, 1, 2, 4 e 8 μg/mL). Todos os anticorpos revelaram amplas faixas de sinal, sem saturação de sinal óbvio em nenhuma condição, garantindo assim uma medição linear para qualquer uma das concentrações. Como exemplo, o sinal médio gerado a partir do ensaio Spike S1 utilizando IgM anti-humano de cabra, SB conjugado a 0,5 μg/mL foi de 13,2% do MFI gerado a partir do sinal máximo (8 μg/mL), enquanto a FI gerada a partir de 4 μg/mL foi de 73,3% do MFI manifestado no sinal máximo. Detalhes da gama de sinais dos outros isótipos de anticorpos Spike S1, os anticorpos de membrana e os anticorpos nucleocapsídeos estão incluídos na Tabela 5 e Figura 3. Como ponto prático, o impacto primário entre a concentração de anticorpos secundários ideal e a concentração de anticorpos secundários de 4 μg/mL anteriormente declarada é refletido em termos de sensibilidade de ensaio e custo de ensaio. Ou seja, uma concentração de anticorpos secundários de 8 μg/mL pode ser desejável para aplicação com títulos de anticorpos baixos ou baixas quantidades de amostra valiosa, mas o custo associado a esses ensaios seria consideravelmente maior do que o uso da concentração de 4 μg/mL previamente definida. Inversamente, casos em que seriam observados altos títulos de anticorpos (como indivíduos que experimentaram vacinas Covid-19 ou com quantidades não limitantes de soro) veriam um custo-benefício através da aplicação das menores quantidades de anticorpos secundários (por exemplo, 1 μg/mL).
Otimização da incubação de anticorpos secundários
A influência potencial da duração da incubação de anticorpos secundários também foi investigada pela modificação do comprimento da incubação (15, 30, 60 e 120 min). Geralmente, a diferença na média do IFI apresentada como quociente de uma incubação específica e o tempo máximo de incubação, denominado %Max, entre uma incubação de 15 min (duração mínima) e uma incubação de 120 min (duração máxima) não excedeu 30%, 55% e 50% para o Spike S1, a Membrana e os anticorpos nucleocapsídeos, respectivamente, indicando um passo cinético rápido na ligação de anticorpos secundários e um meio de aumentar a produtividade do ensaio. A Tabela 6 inclui detalhes sobre as alterações de sinal para todos os tempos de incubação. Ilustrações dos sinais observados de diferentes incubações desta análise são mostradas na Figura 4.
Desempenho e especificidade de dois canais
Para cada analito, uma única execução de formato de repórter (somente IgG-PE, somente IgA-PE ou somente IgM-SB) foi comparada ao sinal gerado para o mesmo analito quando foi executado em um formato de dois repórteres (por exemplo, Spike S1 IgG-PE apenas contra Spike S1 IgG-PE em combinação com Spike S1 IgM-SB no formato de dois repórteres). A precisão do ensaio (expressa como %CV) para os sinais criados nos dois formatos foram utilizadas para analisar a relação nos achados deste experimento. Os valores %CV dos ensaios Spike S1 foram de 6,19%, 16,4% e 23% para IgM, IgG e IgA, respectivamente. Para o ensaio de membrana, os valores %CV foram de 3,3%, 7,9% e 16,4% para IgM, IgG e IgA, respectivamente. Por fim, o ensaio nucleocapsídeo forneceu valores %CV em 8,7%, 10,3% e 24,2% para IgM, IgG e IgA, respectivamente. Os valores de precisão observados para os isótipos IgM e IgA sugerem que um tempo de incubação mais longo pode conferir resultados superiores de ensaio devido às diferenças cinéticas de ligação conhecidas entre essas classes de imunoglobulinas. A Figura 4 mostra a concordância entre os formatos de diferentes concentrações de anticorpos secundários.
Para confirmar a especificidade dos canais de repórteres, um único canal de repórteres foi testado em um momento, enquanto o outro canal foi designado como um espaço em branco para saber sobre o sinal não específico (efeito sangramento). Esses achados indicam que há uma contaminação insignificante de sinais cruzados entre os dois canais de repórteres, dada a alta especificidade em todo o espectro de condições. Estes achados são ilustrados na Figura 5. No geral, observamos uma interferência de 6,45% entre o canal 1 e o canal 2. No entanto, quando a magnitude dos sinais foi contabilizada, observamos os seguintes níveis potenciais de interferência no modo de dois repórteres: Spike IgG/ IgM em 71,98%, Spike IgA/ IgM em 28,11%; Membrana IgG/IgM a 7,41%, Membrana IgA/ IgM a 134,61%; e Nucleocapsid IgG/ IgM em 146,03%, Nucleocapsid IgA/ IgM em 112,13%. Na configuração especificada, isso exigiria a medição do Spike IgM em combinação com o isótipo IgA, IgM de membrana com o isótipo IgM e medições nucleocapsid não realizadas em formato de canal duplo. Esse achado pode exigir a exploração da inversão da estratégia de rotulagem pela qual o IgA e o IgG sejam medidos no canal 2 e IgM no Canal 1.
Avaliação de eventos de soroconversão após a vacinação covid-19
A soroconversão foi monitorada em quatro indivíduos após avaliação do IgA, IgM e IgG com o ensaio Spike S1 em pontos de tempo que variam de pré-vacinação a quatro meses após a conclusão da série de vacinação Covid-19. As medições foram realizadas no modo dual channel (IgG/ IgM e IgA/IgM, com valores IgM médios). Todos os indivíduos receberam a vacina como imunização em duas etapas, por prática padrão, com intervalo de 21 dias entre a primeira e a segunda doses. Parcelas da resposta imune de cada sujeito são mostradas na Figura 6A-C. Os valores de resposta imune para os antígenos nucleocapsídeos e membranas foram observados em níveis de fundo para todas as imunoglobulinas avaliadas (dados não mostrados), o que foi consistente com os sujeitos que não tinham nenhuma infecção anterior do SARS-CoV-2 no tempo anterior à vacinação. No geral, os valores observados spike S1 IgA e IgM foram aproximadamente 40 vezes mais baixos que os títulos isótipos IgG, com os títulos de pico sendocresting tão logo 14 dias para isótipos IgM e IgG e o isótipo IgA atingindo picos de titulação entre a hora da segunda dose (dia 0) e 14 dias pós-dose, dependendo do assunto. Notavelmente, os títulos do Spike S1 IgG começam a se deteriorar durante os quatro meses seguintes à conclusão da vacinação a uma taxa altamente variável, de forma dependente do sujeito.
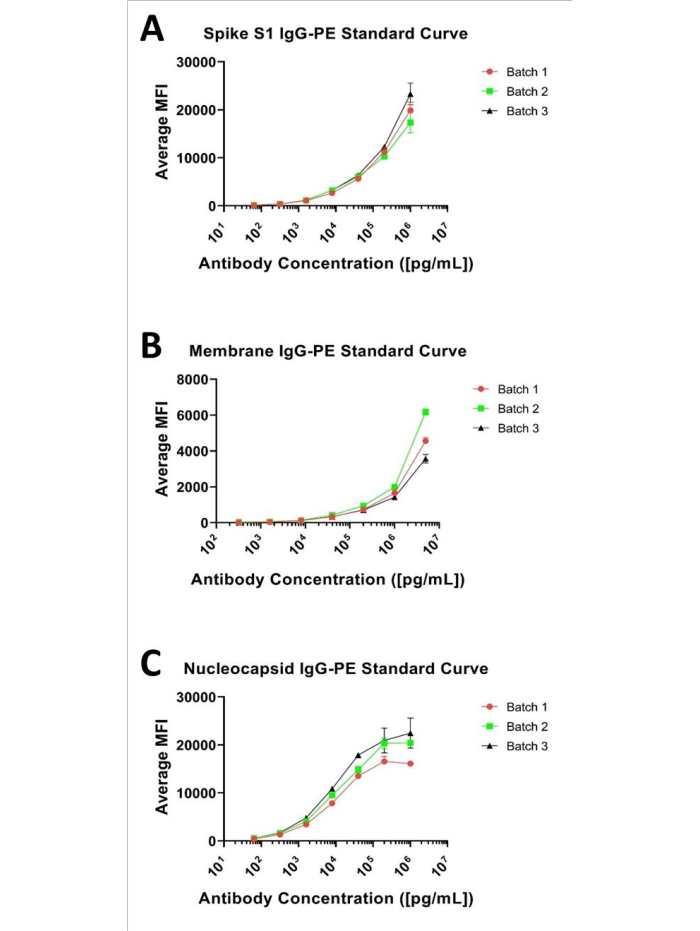
Figura 1: Curvas padrão representativas de 3 plex. Curvas padrão representativas para os três analitos; apresentado como uma curva de diluição de 7 pontos, 1:5 a partir de (A) 1 μg/mL para Spike S1, (B) 5 μg/mL para membrana e (C) 1 μg/mL para nucleocásid e anticorpos. Clique aqui para ver uma versão maior desta figura.

Figura 2: Otimização do tempo de incubação de anticorpos/amostras primárias: O sinal médio de MFI produzido a partir de diferentes tempos de incubação de anticorpos/amostras primárias (captura de anticorpos) variando de 30 min a 4 h para os padrões 1-7 (conforme indicado na Tabela 1). Clique aqui para ver uma versão maior desta figura.

Figura 3: Otimizações secundárias de concentração de anticorpos e desempenho de dois canais. As curvas ilustram a média de IM (normalizada ao maior valor registrado na série) produzida a partir de concentrações secundárias de anticorpos testados, variando de 0,5-8 μg/mL. Cada instância foi realizada tanto como um ensaio de um único e duplo canal para apreciar diferenças no formato experimental. Clique aqui para ver uma versão maior desta figura.

Figura 4: Otimização de tempo de incubação de anticorpos secundários, formato dual-channel. Parcelas representativas dos valores MFI observados (normalizados ao maior valor registrado na série) no que diz respeito ao tempo de incubação com anticorpos secundários. Os experimentos foram realizados como ensaios de dois canais como (A-C) IgA/IgM ou (D-F) combinações IgG/IgM. Clique aqui para ver uma versão maior desta figura.

Figura 5: Avaliações de especificidade para ensaios de canal duplo. Resultados do ensaio de dois canais com uma de cada combinação designada como o branco para ilustrar a falta de fluorescente ou interferência entre canais. Clique aqui para ver uma versão maior desta figura.
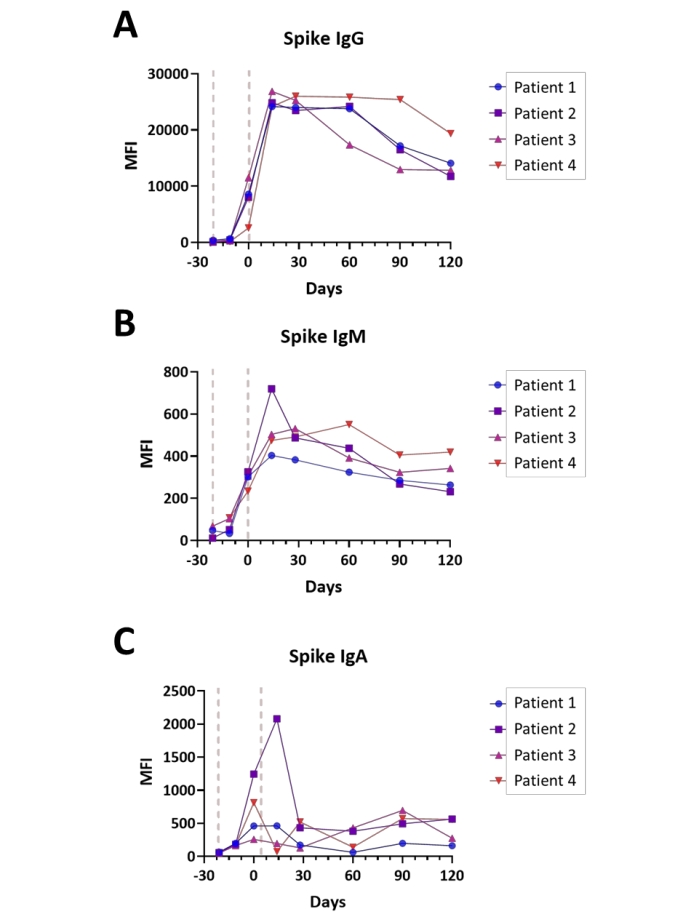
Figura 6: Ilustração da soroconversão após a vacinação covid-19. Parcelas que ilustram os títulos relativos de (A) IgG, (B) IgM e (C) anticorpos IgA para o antígeno Spike S1 durante o curso da vacinação Covid-19 (Pré-vacinação - 4 meses após a conclusão); o tempo é mostrado em dias relativos ao término da série de vacinação; são indicados pontos gerais da administração da vacina (linhas vermelhas). Os experimentos foram realizados no modo dual channel, conforme descrito no Protocolo. Clique aqui para ver uma versão maior desta figura.
| Número padrão | Série de diluição | Anti-Spike S1 ou N (μg/mL) | Anti-membrana (μg/mL) |
| Em branco | Em branco | - | - |
| 1 | STD7 1:1 | 1 | 5 |
| 2 | STD6 1:5 | 0.2 | 1 |
| 3 | STD5 1:25 | 0.04 | 0.2 |
| 4 | STD4 1:125 | 0.008 | 0.04 |
| 5 | DST3 1:625 | 0.0016 | 0.008 |
| 6 | STD2 1:3125 | 0.00032 | 0.0016 |
| 7 | DST1 1:15625 | 0.000064 | 0.00032 |
Tabela 1: Série de diluição para curvas padrão: Tabela de fatores de diluição utilizados para as curvas padrão para o sorotipo IgG; apresentado como uma curva de diluição serial de 7 pontos, 1:5 a partir de 1 μg/mL para α-Spike S1 e α-Nucleocapsid e 5 μg/mL para anticorpos α-membrana.
| Analito | Amostra | Rep 1 | Rep 2 | Rep 3 | Rep 4 | Av. | Sd | %CV |
| Spike S1 | STD2 | 369.4 | 356.9 | 295.2 | 271.5 | 323.3 | 47.4 | 14.6 |
| STD5 | 3869.1 | 3437 | 3970.2 | 4240.7 | 3879.3 | 334 | 8.6 | |
| Membrana | STD2 | 40.6 | 37.7 | 49.9 | 27.8 | 39 | 9.1 | 23.3 |
| STD5 | 733.2 | 731.3 | 724 | 678.1 | 716.7 | 26 | 3.6 | |
| Nucleocapsídeo | STD2 | 1746.7 | 1790.8 | 1577.3 | 1664.8 | 1694.9 | 94.2 | 5.6 |
| STD5 | 15598.1 | 14735.5 | 18369.5 | 17408.5 | 16527.9 | 1657.7 | 10 |
Tabela 2: Precisão intra-ensaio: Coeficiente percentual de variância (%CV) calculado a partir de quatro réplicas de misturas de anticorpos padrão no padrão 2 (STD2) e padrão 5 (STD5) com um único lote de ensaio no mesmo experimento. Os valores previstos para as réplicas e médias representam os valores MFI observados.
| Analito | Amostra | Lote 1 | Lote 2 | Lote3 | Av. | Sd | %CV |
| Spike S1 | STD2 | 383.2 | 424.4 | 379.9 | 395.8 | 24.8 | 6.3 |
| STD5 | 5639.7 | 6062.5 | 6384.3 | 6028.8 | 373.4 | 6.2 | |
| Membrana | STD2 | 39.1 | 58.5 | 59.1 | 52.2 | 11.4 | 21.8 |
| STD5 | 732.3 | 941.4 | 701.1 | 791.6 | 130.7 | 16.5 | |
| Nucleocapsídeo | STD2 | 1342.6 | 1621 | 1718.2 | 1560.6 | 195 | 12.5 |
| STD5 | 13543.9 | 14843.2 | 17883.4 | 15423.5 | 2227.2 | 14.4 |
Tabela 3: Precisão de ensaio inter-ensaio com amostras padrão: Coeficiente percentual de variância (%CV) calculado a partir de três lotes distintos de ensaios, avaliados no padrão 2 e padrão 5 no mesmo experimento. Os valores previstos para as réplicas e médias representam os valores MFI observados.
| IgG-PE | IgM-SB | IgA-PE | |||||
| Av. MFI | %CV | Av. MFI | %CV | Av. MFI | %CV | ||
| Spike S1 | Assunto 1 | 8002.3 | 17.7 | 1949.5 | 1.3 | 2045.8 | 5.5 |
| Assunto 2 | 19155.8 | 7.3 | 918.6 | 4.1 | 1684.5 | 3.9 | |
| Assunto 3 | 17865.6 | 18.0 | 549.4 | 3.8 | 961.3 | 8.1 | |
| Assunto 4 | 11901.1 | 2.6 | 1603 | 4.8 | 8736.4 | 5.5 | |
| Assunto 5 | 9801.8 | 4.0 | 1014.1 | 3.0 | 2747.6 | 9.3 | |
| Nucleocapsídeo | Assunto 1 | 15097.8 | 11.3 | 1049.7 | 9.9 | 5276.5 | 3.9 |
| Assunto 2 | 15204.3 | 12.1 | 265.9 | 5.2 | 6761.3 | 11.9 | |
| Assunto 3 | 18471.7 | 24.4 | 329.1 | 4.5 | 14308 | 2.9 | |
| Assunto 4 | 16424.7 | 3.5 | 2418.1 | 0.1 | 4234.7 | 4.2 | |
| Assunto 5 | 13344.9 | 3.6 | 225.6 | 10.0 | 13436.5 | 9.7 | |
| Membrana | Assunto 1 | 514.6 | 8.6 | 180.6 | 14.0 | 141.2 | 9.8 |
| Assunto 2 | 196.8 | 5.2 | 57 | 20.7 | 55.5 | 13.0 | |
| Assunto 3 | 553.7 | 12.9 | 54.5 | 21.2 | 191.2 | 18.6 | |
| Assunto 4 | 377.9 | 3.2 | 68.1 | 22.1 | 62 | 2.3 | |
| Assunto 5 | 325.4 | 8.2 | 11.4 | 91.6 | 74.6 | 20.8 |
Tabela 4: Precisão de ensaio inter-ensaio com amostras humanas: Coeficiente percentual médio de variância (%CV) calculado a partir de três lotes de ensaios testados com amostras de plasma (diluídos 500 vezes) de cinco indivíduos humanos com infecções por SARS-CoV-2.
| Spike S1 | Membrana | Nucleocapsídeo | |||||
| μg/mL | Av. MFI | % Max. | Av. MFI | % Max. | Av. MFI | % Max. | |
| Grão-mestre | 0.5 | 186 | 13.2 | 32 | 25.2 | 132.7 | 13.6 |
| 1 | 304.2 | 21.6 | 45.8 | 36 | 194.4 | 19.9 | |
| 2 | 664.5 | 47.2 | 78.8 | 61.9 | 458.2 | 47 | |
| 4 | 1032.1 | 73.3 | 101.3 | 79.6 | 707.8 | 72.6 | |
| 8 | 1407.1 | 100 | 127.2 | 100 | 975 | 100 | |
| IgG | 0.5 | 809.7 | 4.9 | 27.5 | 15 | 1355.6 | 6.3 |
| 1 | 1696.9 | 10.2 | 40.6 | 22.2 | 2782.1 | 13 | |
| 2 | 4543.8 | 27.3 | 68.3 | 37.3 | 6661.2 | 31.2 | |
| 4 | 10003.5 | 60 | 110.7 | 60.5 | 12605.6 | 59 | |
| 8 | 16662.8 | 100 | 182.9 | 100 | 21360.6 | 100 | |
| IgA | 0.5 | 797.4 | 19.3 | 31.1 | 47.2 | 2056.5 | 16.1 |
| 1 | 1529.5 | 37 | 41.4 | 62.8 | 3869 | 30.4 | |
| 2 | 2261.3 | 54.7 | 48.6 | 73.3 | 6648.9 | 52.2 | |
| 4 | 2320.4 | 56.2 | 48.3 | 73.2 | 6548.1 | 51.4 | |
| 8 | 4132.2 | 100 | 65.9 | 100 | 12744.8 | 100 | |
Tabela 5: Otimização da concentração de anticorpos secundários: O sinal MFI médio produzido a partir de diferentes concentrações de anticorpos secundários variando de 0,5 μg/mL a 8 μg/mL. O valor de cada sinal também é apresentado como uma porcentagem do sinal a 8 μg/mL ("Max.") para demonstrar magnitude relativa do sinal.
| Spike S1 | Membrana | Nucleocapsídeo | |||||
| Tempo de incubação (min.) | Av. MFI | % Max. | Av. MFI | % Max. | Av. MFI | % Max. | |
| Grão-mestre | 15 | 1185 | 72.2 | 40.4 | 48.9 | 609.5 | 53.3 |
| 30 | 1416.6 | 86.3 | 58.4 | 70.7 | 894.2 | 78.2 | |
| 60 | 1324.8 | 80.7 | 73.6 | 89.1 | 945.6 | 82.7 | |
| 120 | 1641.2 | 100 | 82.6 | 100 | 1143.2 | 100 | |
| IgG | 15 | 12917.6 | 80.5 | 244.4 | 44.9 | 15429.8 | 80.8 |
| 30 | 14915.4 | 92.9 | 434.7 | 79.9 | 18797 | 98.5 | |
| 60 | 15340.3 | 95.6 | 421.4 | 77.5 | 18694.4 | 97.9 | |
| 120 | 16050.3 | 100 | 544 | 100 | 19085.8 | 100 | |
| IgA | 15 | 3141.9 | 78.2 | 75 | 66.8 | 9103 | 86.6 |
| 30 | 3569.1 | 88.8 | 83.9 | 74.8 | 9563.8 | 91 | |
| 60 | 3539.1 | 88 | 86 | 76.6 | 9555.7 | 90.9 | |
| 120 | 4020 | 100 | 112.2 | 100 | 10512.9 | 100 |
Tabela 6: Otimização do tempo de incubação de anticorpos secundários: O sinal MFI médio produzido a partir de diferentes tempos de incubação de anticorpos secundários variando de 15 min a 120 min. O valor de cada sinal também é representado como uma porcentagem do sinal em 120 min ("Max.") para demonstrar magnitude relativa do sinal.
Discussão
A apreciação de uma resposta imune à exposição sars-cov-2, em conjunto com a vigilância baseada em RT-PCR do estado de infecção, foi bem descrita como uma prescrição para esclarecer o curso de recuperação do Covid-19, para servir como um meio de identificar plasma convalescente com potencial valor terapêutico, e para levantamento das taxas de infecção em escala populacional10,11. Diferentes exemplos para a compreensão da soroconversão em seres humanos incluem matrizes de proteína (antígeno)12, imunoblots13, construções imunocromatográficas rápidas14 e ensaios imunossorbentes ligados à enzima (ELISAs)15,16,17. Cada uma dessas técnicas acima mencionadas pode avaliar vários isótipos de imunoglobulina individualmente com pequenas modificações. Esses procedimentos, no entanto, não são capazes de ser praticamente reaproveitados para permitir a análise paralela de múltiplos isótipos, como apresentado neste manuscrito, tornando os fatores de custo e throughput como limitações para sua administração em uma estratégia de teste de escala populacional. Várias dessas aplicações também oferecem a oportunidade de concatenar níveis de múltiplos antígenos em paralelo, seja apresentado ou em formatos alterados, como um multiplex ELISA18,19. Finalmente, a plataforma imunobead fornece a possibilidade de avaliar níveis de múltiplos antígenos emparalelo 20,21, mas foi limitada a um único epítope (ou seja, isótipo de imunoglobulina) por ensaio, a menos que, no entanto, o instrumento recente com capacidades de ensaio de "dual-channel".
Neste relatório, são enumerados protocolos que estabelecem a medição confiável de vários epítopos em um ensaio de imunoesfera utilizando o instrumento no modo "dual-channel" em um estudo de caso de soroconversão de indivíduos vacinados por Covid-19. O método demonstrou excelente precisão (%valores CV tipicamente <20%) utilizando projetos de ensaios manuais que podem ser melhorados com a integração de sistemas automatizados de laboratório. A sensibilidade do ensaio e o alcance dinâmico para todos os analitos e epítopos selecionados foram adequados para avaliações de rotina. Embora a falta de imunoreagentes IgA e IgM disponíveis comercialmente tenha limitado a quantitação ao isótipo IgG, tal restrição não exclui a capacidade de oferecer avaliações ou avaliações semi-quantitativas relativas a uma amostra específica como calibrante22,23.
O ensaio de imunoesfera validado foi alocado para investigar a soroconversão em uma coorte de indivíduos imunizados com a vacina Covid-19. Contrastada com outras plataformas semelhantes, a família de instrumentação permite a prospecção de soroconversão em centenas de indivíduos por dia em um fluxo de trabalho manual e milhares por dia em um esquema automatizado. No geral, esses achados confirmam que a abordagem "dual-channel" tem sensibilidade apropriada para a descrição de vários epítopos em paralelo para o ensaio idêntico e é viável em um contexto multianálise. Uma diferença de sensibilidades ao canal 1 e ao canal 2, como realizado com ficoerythrin e fluoroforos Super Bright 436, respectivamente, pode justificar o desenho de um experimento específico para garantir que resultados analíticos viáveis sejam adquiridos para um determinado experimento. Ou seja, a reserva do canal 1 para epítopos ou analitos de menor prevalência pode ser necessária para manter uma faixa dinâmica do ensaio que inclui os valores observados de desconhecidos. Além dessa consideração, o design de ensaios era óbvio e deveria ser facilmente acessível a laboratórios com capacidades analíticas limitadas. Certamente, essa consideração deve ser ponderada ao considerar a interferência do canal 1 para o canal 2, como observamos para a Figura 5, em que a interferência de isótipos de maior abundância pode causar erros analíticos enganosos para aqueles em abundância muito menor quando medidos em um formato de canal duplo. Esse potencial de interferência em situações com concentrações de analitos altamente diferentes pode representar uma limitação significativa à abordagem se não for adequadamente manuseado na fase de projeto de ensaio.
Em conclusão, foi apresentado um método para medir rapidamente os isótipos de anticorpos dos principais isótipos de imunoglobulina associados a uma resposta imune à infecção ou vacinação covid-19. Aplicar essa abordagem de forma longitudinal para avaliar a soroconversão pode fornecer insights que poderiam ser melhor utilizados para gerenciar e/ou monitorar o curso da doença ou, alternadamente, orientar potenciais programas de vacinação de reforço Covid-19.
Divulgações
Dr. Borgia é o inventor do teste sorológico usado neste manuscrito que está pendente de patente. O artigo é apresentado de forma descritiva apenas sem análises estatísticas apresentadas para evitar viés potencial introduzido pelo conflito autor autor.
Agradecimentos
Os autores desejam agradecer ao Rush Biomarker Development Core pelo uso de suas instalações, o Rush Biorepository para inscrição de sujeitos e processamento de bioespecimen, e a Iniciativa de Avaliação de Coronavírus de Chicago (Chicago CAN) da Walder Foundation (Chicago CAN) concedem números SCI16 (J.R.S. e J.A.B.) e 21-00147 (J.R.S. e J.A.B.) e um prêmio da Swim Across America Foundation (J.A.B.).
Materiais
| Name | Company | Catalog Number | Comments |
| 384-well black side polystyrene microtiter plates | Thermo Fisher | 12-565-346 | |
| Activation buffer (0.1 M NaH2PO4, pH 6.2) | Prepared in house | ||
| Assay buffer (PBS, 1% Bovine Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| Bovine Serum Albumin, heat shock fraction | MilliporeSigma | A-7888-50G | |
| Coupling buffer (50 mM MES, pH 5.0) | Prepared in house | ||
| COVID 19 M Coronavirus Recombinant Matrix Protein (6xHis tag) | MyBioSource | MBS8574735 | |
| Disposable pipette tips | |||
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Thermo Fisher | PIA35391 | |
| Goat Albumin, Fraction V Powder | MilliporeSigma | A2514-1G | |
| IgA Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB205009 | |
| IgG Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB204009 | |
| IgG Goat anti-Rabbit, R-PE, Polyclonal | Thermo Fisher | OB403009 | |
| IgM Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB202009 | |
| IgM Mouse anti-Human, SB 436, Clone SA-DA4 | Thermo Fisher | 62999842 | |
| Instrument Analyzer | Luminex Corp. | INTELLIFLEX-RUO | |
| Low-Bind microcentrifuge tubes (1.5 mL) | Thermo Fisher | 13-698-794 | |
| MagPlex-C Microspheres, Region XXX | Luminex Corp. | MC10XXX-01 | |
| MES hydrate (2-(N-Morpholino) ethane sulfonic acid hydrate) | MilliporeSigma | M2933 | |
| Microplate aluminum sealing tape | Thermo Fisher | 07-200-683 | |
| Polysorbate-20 | Thermo Fisher | BP337-500 | |
| Quality Biological Inc. PBS, pH 7.2 | Thermo Fisher | 50-751-7328 | |
| Quench buffer (PBS, 1% Goat Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Protein (His tag) | Sino Biologicals | 40588-V08B | |
| SARS-CoV-2 (2019-nCoV) Spike Protein (S1 Subunit, His tag) | Sino Biologicals | 40591-V08H | |
| SARS-CoV-2 (2019-nCoV) Spike RBD Antibody, Rabbit pAb | Sino Biologicals | 40592-T62 | |
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Antibody, Rabbit mAb | Sino Biologicals | 40588-R0004 | |
| SARS-CoV-2 (COVID-19) Membrane Antibody (IN), Rabbit pAb | ProSci | 10-516 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Fisher | PIA39269 | |
| Wash Buffer (PBS, 0.01% Polysorbate-20) | Prepared in house | ||
| Water, LC/MS grade | Thermo Fisher | W-64 |
Referências
- Tighe, P. J., Ryder, R. R., Todd, I., Fairclough, L. C. ELISA in the multiplex era: potentials and pitfalls. Proteomics - Clinical Applications. 9, 406-422 (2015).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments: JoVE. (65), e4084(2012).
- Powell, R. L., et al. A multiplex microsphere-based immunoassay increases the sensitivity of siv-specific antibody detection in serum samples and mucosal specimens collected from rhesus macaques infected with SIVmac239. BioResearch Open Access. 2 (3), 171-178 (2013).
- Volpetti, F., Garcia-Cordero, J., Maerkl, S. J. A microfluidic platform for high-throughput multiplexed protein quantitation. PLoS One. 10 (2), 0117744(2015).
- Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., Al-Nasser, A. D. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens. 9 (3), 231(2020).
- Asif, M., Xu, Y., Xiao, F., Sun, Y. Diagnosis of COVID-19, vitality of emerging technologies and preventive measures. Chemical Engineering Journal. 423, Lausanne, Switzerland. 130189(2021).
- La Marca, A., Capuzzo, M., Paglia, T., Roli, L., Trenti, T., Nelson, S. M. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reproductive Biomedicine Online. 41 (3), 483-499 (2020).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews. 29, Suppl 1 49-52 (2008).
- Tarhoni, I., et al. Relationship between circulating tumor-associated autoantibodies and clinical outcomes in advanced-stage NSCLC patients receiving PD-1/-L1 directed immune checkpoint inhibition. Journal of Immunological Methods. 490, 112956(2021).
- Deeks, J. J., et al. Antibody tests for identification of current and past infection with SARS-CoV-2. The Cochrane Database of Systematic Reviews. 6, 013652(2020).
- Mahalingam, S., et al. Landscape of humoral immune responses against SARS-CoV-2 in patients with COVID-19 disease and the value of antibody testing. Heliyon. 7 (4), 06836(2021).
- Ruano-Gallego, D., et al. A multiplex antigen microarray for simultaneous IgG and IgM detection against SARS-CoV-2 reveals higher seroprevalence than reported. Microbial Biotechnology. 14 (3), 1228-1236 (2021).
- Shah, J., et al. IgG and IgM antibody formation to spike and nucleocapsid proteins in COVID-19 characterized by multiplex immunoblot assays. BMC Infectious Diseases. 21 (1), 325(2021).
- Gambino, C. M., et al. Comparison of a rapid immunochromatographic test with a chemiluminescence immunoassay for detection of anti-SARS-CoV-2 IgM and IgG. Biochemia Medica (Zagreb). 30 (3), 030901(2020).
- Algaissi, A., et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Scientific Reports. 10, 16561(2020).
- Chiereghin, A., et al. Recent advances in the evaluation of serological assays for the diagnosis of SARS-CoV-2 infection and COVID-19. Frontiers in Public Health. 8, 620222(2020).
- Nicol, T., et al. Assessment of SARS-CoV-2 serological tests for the diagnosis of COVID-19 through the evaluation of three immunoassays: Two automated immunoassays (Euroimmun and Abbott) and one rapid lateral flow immunoassay (NG Biotech). Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 129, 104511(2020).
- Butt, J., et al. From multiplex serology to serolomics-A novel approach to the antibody response against the SARS-CoV-2 proteome. Viruses. 13 (5), 749(2021).
- Byrum, J. R., et al. multiSero: open multiplex-ELISA platform for analyzing antibody responses to SARS-CoV-2 infection. medRxiv. , (2021).
- Dobano, C., et al. Highly sensitive and specific multiplex antibody assays to quantify immunoglobulins m, a, and g against SARS-CoV-2 antigens. Journal of Clinical Microbiology. 59 (2), 01731(2021).
- Schultz, J. S., et al. Development and validation of a multiplex microsphere immunoassay using dried blood spots for SARS-CoV-2 seroprevalence: Application in first responders in first responders in Colorado, USA. Journal of Clinical Microbiology. 59 (6), 00290(2021).
- Beavis, K. G., et al. Evaluation of the EUROIMMUN anti-SARS-CoV-2 ELISA assay for detection of IgA and IgG antibodies. Journal of Clinical Virology: The Official Publication of the Pan Americal Society for Clinical Virology. 129, 104468(2020).
- Jung, J., et al. Clinical performance of a semi-quantitative assay for SARS-CoV2 IgG and SARS-CoV2 IgM antibodies. Clinica Chimica Acta: International Journal of Clinical Chemistry. 510, 790-795 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados