Method Article
Monitoreo dinámico de la seroconversión mediante un ensayo de inmunodaxia multianalto para Covid-19
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo describe un método conveniente para monitorear los cambios dinámicos en los títulos de anticuerpos para dos isotipos de inmunoglobulina simultáneamente (ya sea IgA, IgM o IgG) como resultado de una respuesta inmune a la infección por SARS-CoV-2 o la vacunación. Este 'Panel de Respuesta Inmune Covid-19 Multianalito' emplea tres inmunoensayos indirectos construidos sobre microesferas codificadas que se leen utilizando un lector multiplex basado en flujo con capacidad de 'doble canal'.
Resumen
Las tecnologías multiplex para interrogar múltiples biomarcadores en concierto han existido durante varias décadas; sin embargo, los métodos para evaluar múltiples epítopos en el mismo analito siguen siendo limitados. Este informe describe el desarrollo y la optimización de un ensayo de inmunodamento multiplexado para pruebas serológicas de isotipos comunes de inmunoglobulina (por ejemplo, IgA, IgM e IgG) asociados con una respuesta inmune a la infección o vacunación por SARS-CoV-2. Los ensayos se realizaron utilizando un lector fluorescente multiplex basado en flujo con capacidad de doble canal. Las optimizaciones se centraron en el tiempo de captura de analitos, la concentración de anticuerpos de detección y el tiempo de incubación de anticuerpos de detección. Se establecieron características de rendimiento del ensayo analítico (por ejemplo, rango de ensayo (incluidos los límites inferior y superior de cuantificación); y precisión intra e interensayo) para la combinación de serotipos IgG/IgM o IgA/IgM en tándem utilizando el modo de "canal dual". Los tiempos de captura de analitos de 30 min para IgG, 60 min para IgM y 120 min para IgA fueron adecuados para la mayoría de las aplicaciones, proporcionando un equilibrio entre el rendimiento y el rendimiento del ensayo. Se observaron incubaciones óptimas de anticuerpos de detección a 4 μg/ml durante 30 min y se recomiendan para aplicaciones generales, dada la excelente precisión general (porcentaje de coeficiente de varianza (%CV) ≤ 20%) y los valores de sensibilidad observados. El rango dinámico para el isotipo IgG abarcó varios órdenes de magnitud para cada ensayo (Espiga S1, Nucleocápside y glicoproteínas de membrana), lo que admite evaluaciones de títulos robustos a un factor de dilución de 1:500 para aplicaciones clínicas. Finalmente, el protocolo optimizado se aplicó para monitorear la seroconversión de Spike S1 para sujetos (n = 4) que completaron un régimen de vacuna contra el SARS-CoV-2. Dentro de esta cohorte, se observó que los niveles de IgG de Spike S1 alcanzaron títulos máximos a los 14 días después de la administración de la segunda dosis, a una intensidad de señal mucho más alta (~ 40 veces) que los isotipos de IgM o IgA. Curiosamente, observamos tasas de desintegración del título de IgG Spike S1 altamente variables que dependían en gran medida del sujeto, lo que será el tema de estudios futuros.
Introducción
La medición simultánea de múltiples biomarcadores relacionados con la enfermedad en muestras biológicas permite obtener información descriptiva y predictiva sobre los procesos patológicos. Si bien los procedimientos inmunológicos convencionales de un solo analito, como los ensayos de inmunoabsorción ligados a enzimas (ELISA), han sido la piedra angular de los análisis cuantitativos tanto en entornos clínicos como de investigación, estas técnicas pueden tener limitaciones sustanciales con respecto al rendimiento, la cantidad de muestra requerida para cada medición y la rentabilidad que limitan en gran medida el estudio de múltiples elementos biológicos que con frecuencia se entrelazan a lo largo del curso de la enfermedad1 . La tecnología de multiplexación basada en microesferas se ha convertido en una plataforma indispensable para las instalaciones de diagnóstico e investigación por su capacidad de combinar ensayos para mejorar el rendimiento del laboratorio, mitigar la escasez de muestras y reducir las pruebas repetitivas para maximizar el ahorro de costos 1,2,3,4. Recientemente, se ha introducido un mayor aumento de este poder de multiplexación con instrumentos que poseen capacidades de doble reportero. La función de doble reportero implementa dos canales fluorescentes para la detección, suministrando otra dimensión de multiplexación, lo que permite la detección de múltiples epítopos en el mismo analito.
El coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) es el patógeno responsable de la actual pandemia de enfermedad por coronavirus 2019 (COVID-19)5. Si bien las pruebas de RT-PCR son cruciales para la confirmación de la infección al comienzo del curso de la enfermedad, los exámenes serológicos de los títulos de anticuerpos han demostrado ser imperativos para la crítica precisa y completa de los individuos con respecto a una exposición o recuperación previa; una respuesta a la inmunización; y/o una evaluación de la eficacia de la vacunación contra el Covid-19 6,7.
Este informe delinea los métodos para medir la seroconversión de múltiples antígenos virales del SARS-CoV-2 que utilizan un sistema de informes duales de lector multiplex basado en flujo. Específicamente, se describe la detección concurrente de dos subtipos de anticuerpos (configurados como IgG / IgM o IgA / IgM) para un panel de antígenos 3-plex del SARS-CoV-2 que incluye ensayos para glicoproteínas Spike S1, Nucleocápside y Membrana (también conocida como Matrix). Este enfoque proporciona una empresa ideal para la captura de la seroconversión longitudinal y aporta una herramienta valiosa en el arsenal contra la pandemia de Covid-19.
Protocolo
Todos los sujetos se inscribieron con consentimiento informado por escrito con la aprobación completa de la Junta de Revisión Institucional (IRB) del Centro Médico de la Universidad de Rush bajo el protocolo ORA 20101207 con todas las pautas institucionales para la realización de investigaciones éticas observadas. La sangre se recolectó a través de flebotomía convencional en vacutainers de lavanda (K2EDTA) y se procesó con los protocolos recomendados. El plasma resultante se archivó a -80 °C hasta que se realizaron las evaluaciones.
1. Preparación de microesferas conjugadas con antígenos
- Seleccione tres viales diferentes de microesferas magnéticas con regiones de cuentas únicas, registrando la identificación de la cuenta y la información del lote para cada vial utilizado.
NOTA: Se seguirán los siguientes pasos para cada región distinta de la microesfera. Las microesferas son sensibles a la luz y deben protegerse de la exposición prolongada a la luz. Durante los pasos de lavado, tenga cuidado de no perturbar las microesferas. Si se le molesta, permita una segunda separación de 60 s. - Vórtice el stock de microesferas durante 60 s y sonice durante 5 minutos antes de su uso para disociar las cuentas agregadas.
- Transfiera 1.0 x 106 perlas a un tubo de microcentrífuga de baja unión a proteínas de 1.5 ml.
- Inserte el tubo en un separador magnético y permita que la separación ocurra durante 60 s. Con el tubo todavía en el separador magnético, retire cuidadosamente el sobrenadante sin molestar la bolita de perlas.
- Retire el tubo del separador magnético, vuelva a suspender las perlas con 100 μL de agua de grado HPLC y vórtice durante 30 s. Coloque el tubo de nuevo en el separador magnético durante 60 s y, posteriormente, retire el sobrenadante. Repita este protocolo de lavado dos veces.
- Retire el tubo del separador magnético y resuspenda las microesferas lavadas en 90 μL de fosfato de sodio monobásico de 100 mM, pH 6.2 (tampón de activación) por vórtice durante 30 s.
- Añadir 10 μL de 50 mg/mL de Sulfo-NHS (diluido con Activation Buffer) a las microesferas y vórtice suavemente durante 10 s. Añadir 10 μL de solución de EDC de 50 mg/ml (diluida con activation buffer) y vórtice suavemente durante 10 s. Incubar microesferas durante 20 min a temperatura ambiente (RT) con un vórtice suave cada 10 min.
- Repita los pasos de lavado 1.4-1.5 con 50 mM MES, pH 5.0 (Coupling Buffer) en lugar de agua de grado LC/MS para un total de dos lavados.
- Retire el tubo del separador magnético y vuelva a suspender las perlas con 100 μL de tampón de acoplamiento por vórtice durante 30 s seguido inmediatamente por la adición de la cantidad deseada de proteína.
- Lleve el volumen total a 150 μL con el búfer de acoplamiento. Mezclar la reacción de acoplamiento por vórtice durante 30 s e incubar durante 2 h por rotación en RT.
NOTA: Para los ensayos definidos en este documento, se realizaron conjugaciones con las siguientes concentraciones de proteínas: Spike S1: 5 μg; Nucleocápside: 5 μg; Membrana: 12,5 μg. - Repita el paso de lavado 1.4 con solución salina tamponada con fosfato (PBS)-1% albúmina sérica de cabra, 0.01% polisorbato-20 (tampón de enfriamiento) en lugar de agua de grado LC / MS para un total de dos lavados. Resuspend las microesferas lavadas en 100 μL de Quench Buffer que contiene 0,05% de azida de sodio por vórtice durante 30 s.
NOTA: Permita que las cuentas se apaguen completamente durante al menos 6 h antes de proceder a cualquier otro procedimiento. - Cuente el número de microesferas recuperadas utilizando un contador celular automatizado o un hemocitómetro. Registre la concentración de cuentas observada.
- Refrigere las microesferas acopladas a 4 °C en la oscuridad.
2. Procedimientos
- Rendimiento del ensayo (protocolo base)
- Resuspend las microesferas acopladas por vórtice durante 30 s y sonicate por ~60-90 s.
- Retire la cantidad requerida de cada coloide de perla del tubo respectivo y combine los coloides de perlas en un nuevo tubo de microcentrífuga de 1,5 ml.
- Inserte el tubo en un separador magnético y permita que la separación ocurra durante 60 segundos. Con el tubo todavía en el separador magnético, retire cuidadosamente el sobrenadante sin molestar la bolita de perlas.
- Retire las perlas del separador, resuspenda las perlas con 100 μL de pbS-1% de albúmina sérica bovina, 0.01% de polisorbato-20 (tampón de ensayo) y vórtice durante 30 s. Coloque el tubo en un separador magnético y permita que se produzca la separación durante 60 s. Repita este protocolo de lavado (es decir, los pasos 2.1.3-2.1.4) dos veces
- Ajuste la concentración de la mezcla de microesferas de trabajo de 3 plex agregando un volumen apropiado de Tampón de ensayo para generar una concentración final de 100 microesferas por 1 μL para cada objetivo.
- Alícuota 12,5 μL de la mezcla de microesferas preparada en la etapa 2.1.5 en cada pocillo de una placa de 384 pocillos o 25 μL en cada pocillo de una placa de 96 pocillos.
- Diluya las muestras de plasma/suero 500 veces en Assay Buffer. Prepare especímenes estándar de acuerdo con la titulación deseada.
- Agregue 12.5 μL de tampón de ensayo como muestra en blanco y agregue cada una de las muestras diluidas o estándar en cada pozo designado de una placa de muestra de 384 pocillos o 25 μL de la muestra en blanco diluida o estándar en cada pocillo de una placa de muestra de 96 pocillos.
- Cubra la placa con un sello o papel de aluminio e incube durante 1 h en RT en un agitador de placas a 700 rpm.
NOTA: El esquema para las curvas de dilución se proporciona en la Tabla 1. - Preparar una solución de anticuerpos anti-detección humana (soluciones secundarias de anticuerpos) a 4 μg/ml con Assay Buffer como se especifica en el paso 2.1.11.
- Preparar IgM antihumana de cabra, conjugada con Super Bright 436 (SB)/Cabra-anti-igA humana, ficoeritrina (PE) Anticuerpos de detección conjugada a 4 μg/ml; o IgM cabra-anti-humano, SB Conjugado/Cabra-anti-humano IgG, PE Anticuerpos de detección conjugada a 4 μg/mL.
NOTA: Para un formato de placa de 384 pocillos, se requieren 12,5 μL/pocillo de la solución de anticuerpos secundaria preparada, y para un formato de placa de 96 pocillos, se requieren 25 μL/pocillo. - Coloque la placa en un separador magnético, lave rápidamente e invierta con fuerza sobre un recipiente de riesgo biológico para eliminar el líquido de los pozos. Con la placa aún invertida, golpee con fuerza la placa contra un fajo grueso de papel.
- Lave cada pozo con 100 μL de Tampón de ensayo y retire el líquido mediante una inversión forzada sobre un recipiente de riesgo biológico, como se describió anteriormente. Repita estos pasos (2.1.12-2.1.13) para un total de dos lavados. Deseche todos los fajos de papel usados en un recipiente de riesgo biológico.
- Agregue 12.5 μL de la solución de trabajo de anticuerpos secundarios a cada pocillo de una placa de 384 pocillos o 25 μL a cada pocillo de una placa de 96 pocillos. Cubra la placa con un sello o papel de aluminio e incube durante 30 minutos a RT en un agitador de placas a 700 rpm.
- Repita los pasos de lavado 2.1.12-2.1.13
- Agregue 75 μL de tampón de ensayo en cada pozo de una placa de 384 pocillos o 100 μL en cada pocillo de una placa de 96 pocillos. Cubra la placa con un sello o papel de aluminio e incube durante 5 minutos a RT en un agitador de placas a 700 rpm.
- Analice 60 μL a través del analizador de instrumentos de acuerdo con el manual del sistema.
- Optimización del tiempo de incubación de la captura de muestras
- Realice los pasos de la sección 2.1 utilizando la duración de los tiempos de incubación de 30 min, 60 min y 120 min en el paso 2.1.9.
NOTA: Las incubaciones se pueden realizar con placas distintas o haciendo una pausa en el paso 2.1.6 hasta el momento de proceder al paso 2.1.9. para alcanzar los tiempos de incubación deseados. - Proceda con la lectura de la placa en el analizador utilizando 60 μL de la mezcla del ensayo de acuerdo con las recomendaciones del fabricante.
- Realice los pasos de la sección 2.1 utilizando la duración de los tiempos de incubación de 30 min, 60 min y 120 min en el paso 2.1.9.
- Optimización de la concentración secundaria de anticuerpos
- Realice este procedimiento como se detalla en la sección 2.1, con excepción de las concentraciones finales de reactivos en la solución secundaria de trabajo de anticuerpos (preparada en la etapa 2.1.10-2.1.11) modificada de la siguiente manera:
Anticuerpos de detección de igM antihumanos (o conejos) de cabra, SB a 8, 4, 2, 1 y 0,5 μg/ml.
IgA antihumano (o conejo) de cabra, anticuerpos de detección de PE-conjugados a 8, 4, 2, 1 y 0,5 μg/ml.
IgG antihumano (o conejo) de cabra, anticuerpos de detección de PE-conjugados a 8, 4, 2, 1 y 0,5 μg/ml.
IgG de cabra-anti-humano (o conejo), PE-conjugado/Cabra-anti-humano (o conejo) IgM, anticuerpos de detección sb-conjugados a 8, 4, 2, 1 y 0,5 μg/mL.
IgA de cabra-anti-humano (o conejo), PE-conjugado/Cabra-anti-humano (o conejo) IgM, anticuerpos de detección sb-conjugados a 8, 4, 2, 1 y 0,5 μg/mL. - Proceda con la lectura de la placa en el analizador utilizando 60 μL de la mezcla del ensayo de acuerdo con las recomendaciones del fabricante.
- Realice este procedimiento como se detalla en la sección 2.1, con excepción de las concentraciones finales de reactivos en la solución secundaria de trabajo de anticuerpos (preparada en la etapa 2.1.10-2.1.11) modificada de la siguiente manera:
- Optimización del tiempo de incubación de anticuerpos secundarios
- Realice este procedimiento como se detalla en la sección 2.1 con 15 min, 30 min, 60 min y 120 min de duración de incubación definida en el paso 2.1.14.
- Proceda con la lectura de la placa en el analizador utilizando 60 μL de la mezcla del ensayo de acuerdo con las recomendaciones del fabricante.
- Evaluación de especímenes sujetos con ensayos optimizados de doble canal
- Recolectar muestras de plasma del sujeto (n = 4) en los días -21, -11, -1/0, +14, +28, +60, +90 y +120 en relación con la finalización de la administración de la vacuna Covid-19 (es decir, la segunda dosis).
NOTA: El día 0 representa el punto de tiempo en el que se completó la vacunación. - Realizar todos los ensayos utilizando el Protocolo Base (sección 2.1.) como ensayo de doble canal IgG/IgM o IgA/IgM.
- Normalice los resultados al valor máximo observado de intensidad fluorescente media (IMF) para cada inmunoglobulina y ensayo específicos.
- Recolectar muestras de plasma del sujeto (n = 4) en los días -21, -11, -1/0, +14, +28, +60, +90 y +120 en relación con la finalización de la administración de la vacuna Covid-19 (es decir, la segunda dosis).
Resultados
Resultados típicos de ensayos y evaluaciones de rendimiento
Los ensayos de immunobead comúnmente proporcionan una curva sigmoidal cuando se evalúan en varios (log) órdenes de magnitud, como se ilustra en cada uno de los paneles presentados en la Figura 1. El usuario debe definir experimentalmente el rango de concentración óptimo para cada analito en el múltiplex para determinar el rango completo de cuantificación, asegurando no muestrear en exceso los extremos (áreas que se acercan al límite inferior de cuantificación [LLOQ] o al límite superior de cuantificación [ULOQ]). El rango real requerido para un ensayo, sin embargo, está dictado por la distribución de los analitos objetivo en una matriz biológica (es decir, las "incógnitas") en un factor de dilución dado. Además, aunque las curvas estándar se interpretan típicamente a través de la regresión lineal con un algoritmo de ajuste paramétrico 4 o 5, la porción lineal de una curva dada generalmente proporciona la mayor confianza en la precisión cuantitativa con un modelo lineal (y = mx + b) de cuantificación. Hacer coincidir la curva de calibración con los valores observados para un desconocido en un factor de dilución dado debe ser el objetivo en el desarrollo de ensayos cuantitativos.
En este sentido, se evaluó una curva estándar de 7 puntos basada en una serie de dilución en serie 1:5 para cada uno de los anticuerpos Spike S1, Nucleocápside y Membrana que oscilan entre 1 μg/mL y 0.000064 μg/mL para Spike S1 y Nucleocápside y 5 μg/mL y 0.00032 μg/mL para Membrana, como se muestra en la Figura 1. El límite inferior de detección (LLOD) para cada ensayo se definió como la concentración más baja de analito que produjo una señal distinguible de su fondo. LLOD se puede identificar por la ecuación descrita anteriormente 8,9, LLOD = LoB + 1.645 (muestra debaja concentración SD). LoB es el límite inferior de espacio en blanco, y es la concentración "aparente" de analito que se produce a partir del espacio en blanco cuando se espera un valor cero, y se puede determinar utilizando esta ecuación LoB= Blanco medio + 1.645 (SDen blanco)8. Sobre la base de este método, los valores de IMF para el ensayo Spike S1 variaron de 134.38 a 20191.2, con 134.38 MFI que representan 0.00024 μg / mL y se definen como LLOD. Para el ensayo de membrana, el rango práctico de IMF fue de 52.24 a 4764.9, con 52.24 MFI calculado en 0.004885 μg / mL y asignado como LLOD. El rango de IMF para el ensayo de nucleocápside fue de 517.9 a 19666.34, con 517.9 especificado como 0.00024 μg / mL, que fue el LLOD. El límite superior de detección (ULOD) se define como la concentración de analito después de la cual el cambio en la IMF ya no es lineal y la respuesta de la señal está saturada. Cabe señalar que el carácter sigmoidal completo de estas curvas no es observable para los estándares probados, con la excepción de la curva de nucleocápside. Sin embargo, dado que los valores de IMF observados para todas las incógnitas ensayadas hasta la fecha (a una dilución de 1:500) están dentro del rango de curvas presentado para cada analito y se cuantifican fácilmente utilizando un ajuste paramétrico de 4 o 5 mediante regresión lineal.
Precisión del ensayo
Precisión intraensayo: Se realizaron cuatro réplicas de ensayos en la misma placa para evaluar la precisión del ensayo, calculada como el %CV, o el cociente de la desviación estándar y el promedio multiplicado por 100. Se seleccionaron los puntos estándar 2 y 5 para estas tabulaciones, con valores catalogados en la Tabla 2. El umbral límite superior aceptable típico para los valores %CV es ≤20%, lo que se observó para estos datos, con la excepción del estándar 2 de IgG de membrana, que probablemente resulta de los niveles de fondo y puede rectificarse eliminando los valores periféricos (datos no mostrados). Cabe señalar que se observó una aparente inestabilidad para leer el valor para los ensayos de membrana donde los valores de IMF fueron <200, más comúnmente en el caso de los isotipos IgA e IgM.
Precisión entre ensayos: Se prepararon tres lotes distintos de conjuntos de cuentas para cada ensayo y se probaron, según se define para la precisión intraensayo (arriba y como se ve en la Figura 1). La variabilidad entre ensayos se evaluó calculando el %CV a partir de los resultados medios para cada uno de los tres lotes, como se muestra en la Tabla 3. Una vez más, el umbral límite superior para un %CV aceptable se establece en ≤20%, que existe para todas las condiciones probadas (con un efecto similar con el estándar 2 de IgG de membrana, como se vio anteriormente). Cabe señalar que la variabilidad de lote a lote en los valores netos de IMF se observa comúnmente dentro de múltiples lotes de los mismos inmunorreagentes durante el desarrollo de ensayos personalizados. El uso de una curva de calibración erigida a partir de un anticuerpo anti-objetivo obtenido comercialmente (por ejemplo, conejo anti-Spike S1) seguido de un anticuerpo de detección anti-especie puede proporcionar consistencia en los resultados analíticos y permitir comparaciones entre múltiples lotes en diferentes períodos de tiempo.
Precisión entre ensayos con muestras humanas: La evaluación de la precisión entre ensayos se repitió con muestras de plasma humano (n = 5) recogidas dentro de un mes de los primeros síntomas notificados de una infección por SARS-CoV-2; logrado con tres lotes distintos de ensayos (es decir, diferentes preparaciones de los conjuntos de cuentas). Estos resultados se muestran en la Tabla 4 y demuestran precisión con un valor %CV con el valor límite típico del umbral superior de ≤20%. Los valores promedio de %CV para los títulos de IgG de Pico S1, Nucleocápside y Membrana se calcularon en 9.9% (rango 2.6%-18%), 11.0% (rango 3.5%-24.4%) y 7.6% (rango 3.2%-12.9%), respectivamente. Se realizaron observaciones similares con los títulos de IgM e IgA de estos tres analitos, todos proporcionando valores %CV <20%. La única excepción a esto fueron los títulos de IgM del Sujeto 5 para la proteína de membrana, que posteriormente se excluyó como un valor atípico. Los valores de precisión para las evaluaciones de sujetos humanos son consistentes con los vistos anteriormente para los anticuerpos de conejo, lo que sugiere que estos ensayos pueden reconfigurarse fácilmente para evaluar títulos de los antígenos en múltiples especies con poco impacto en la precisión del ensayo. Como se señaló anteriormente, hubo una aparente inestabilidad para leer los valores observados para los ensayos de membrana donde los valores de MFI fueron <200, más comúnmente en el caso de los isotipos IgA e IgM.
Optimización de la concentración de anticuerpos primarios
El "tiempo de captura" del analito se evaluó con las perlas conjugadas con antígenos, y los anticuerpos en las muestras de plasma o en los estándares se probaron modificando la duración de la incubación primaria (30 min, 1 h, 2 h y 4 h). La diferencia en la IMF media se presenta como el cociente de una incubación específica y el tiempo máximo de incubación, denominado % Máx., en la Figura 2, entre una incubación de 30 min (duración mínima) y una incubación de 4 h (duración máxima). Los valores a 120 min fueron óptimos para los títulos de IgG para los anticuerpos Spike S1, Membrane y Nucleocapsid, lo que indica una cinética de unión de anticuerpos primaria rápida, lo que permite flexibilidad para aumentar el rendimiento del ensayo. Sin embargo, se observaron cinéticas más lentas para los isotipos IgA e IgM (datos no mostrados), demostrando niveles máximos de captura en el punto de tiempo de 4 h, como se muestra en la Figura 2. En general, existe un equilibrio entre el acercamiento a la saturación del ensayo y la conveniencia práctica del tiempo para ejecutar cada ensayo cuando está en producción (para maximizar el rendimiento). Con esto, se observaron señales adecuadas para fines cuantitativos a tiempos mínimos de incubación de 30 min para IgG, 60 min para IgM y 120 min para IgA en estos hallazgos.
Optimización de la concentración secundaria de anticuerpos
Se probaron cinco concentraciones de anticuerpos secundarios (IgG antihumano de cabra, PE conjugado; IgA antihumano de cabra, PE conjugado; IgM antihumano de cabra, SB conjugado) (0,5, 1, 2, 4 y 8 μg/ml). Todos los anticuerpos revelaron amplios rangos de señal, sin saturación de señal obvia en ninguna condición, lo que garantiza una medición lineal para cualquiera de las concentraciones. Como ejemplo, la señal promedio generada a partir del ensayo Spike S1 utilizando IgM antihumana de cabra, SB-conjugada a 0.5 μg / mL fue el 13.2% de la IMF generada a partir de la señal máxima (8 μg / mL), mientras que la IMF generada a partir de 4 μg / mL fue el 73.3% de la IMF manifestada en la señal máxima. Los detalles del rango de señales de los otros isotipos de anticuerpos Spike S1, los anticuerpos de membrana y los anticuerpos de nucleocápside se incluyen en la Tabla 5 y la Figura 3. Como punto práctico, el impacto primario entre la concentración óptima de anticuerpos secundarios y la concentración de anticuerpos secundarios de 4 μg/ml establecida anteriormente se refleja en términos de sensibilidad del ensayo y costo del ensayo. Es decir, una concentración secundaria de anticuerpos de 8 μg/ml puede ser deseable para la aplicación con títulos de anticuerpos bajos o bajas cantidades de muestra valiosa, pero el costo asociado con estos ensayos sería considerablemente mayor que el uso de la concentración de 4 μg/ml definida anteriormente. Inversamente, los casos en los que se observaran títulos altos de anticuerpos (como individuos que han experimentado vacunas contra covid-19 o con cantidades no limitantes de sueros) verían un costo-beneficio a través de la aplicación de las cantidades más bajas de anticuerpos secundarios (por ejemplo, 1 μg / ml).
Optimización de la incubación secundaria de anticuerpos
También se investigó la influencia potencial de la duración de la incubación secundaria de anticuerpos modificando la duración de la incubación (15, 30, 60 y 120 min). En general, la diferencia en la IMF promedio presentada como el cociente de una incubación específica y el tiempo máximo de incubación, denominado %Max, entre una incubación de 15 minutos (duración mínima) y una incubación de 120 minutos (duración máxima) no superó el 30%, 55% y 50% para los anticuerpos Spike S1, Membrana y Nucleocápside, respectivamente, lo que indica un paso cinético rápido en la unión secundaria de anticuerpos y un medio para aumentar el rendimiento del ensayo. La Tabla 6 incluye detalles sobre los cambios de señal para todos los tiempos de incubación. Las ilustraciones de las señales observadas de diferentes incubaciones de este análisis se muestran en la Figura 4.
Rendimiento y especificidad de doble canal
Para cada analito, se comparó un solo formato de reportero (igG-PE solamente, igA-PE solamente o igM-SB solamente) con la señal generada para el mismo analito cuando se ejecutó en un formato de doble reportero (por ejemplo, Spike S1 IgG-PE solo versus Spike S1 IgG-PE en combinación con Spike S1 IgM-SB en el formato de doble reportero). La precisión del ensayo (expresada como %CV) para las señales creadas en los dos formatos se utilizó para analizar la relación en los hallazgos de este experimento. Los valores %CV de los ensayos Spike S1 fueron de 6,19%, 16,4% y 23% para IgM, IgG e IgA, respectivamente. Para el ensayo de membrana, los valores %CV fueron de 3,3%, 7,9% y 16,4% para IgM, IgG e IgA, respectivamente. Finalmente, el ensayo nucleocápside proporcionó valores %CV en 8.7%, 10.3% y 24.2% para IgM, IgG e IgA, respectivamente. Los valores de precisión observados para los isotipos IgM e IgA sugieren que un tiempo de incubación más largo puede conferir resultados de ensayo superiores debido a las diferencias cinéticas de unión conocidas entre estas clases de inmunoglobulinas. La Figura 4 muestra la concordancia entre los formatos de diferentes concentraciones de anticuerpos secundarios.
Para confirmar la especificidad de los canales de reporteros, se probó un solo canal de reportero a la vez, mientras que el otro canal se asignó como un espacio en blanco para preguntar sobre la señal no específica (efecto de sangrado). Estos hallazgos indican que hay una contaminación insignificante de señal cruzada entre los dos canales de reportero, dada la alta especificidad en todo el espectro de condiciones. Estos hallazgos se ilustran en la Figura 5. En general, observamos una interferencia del 6,45% a través del canal 1 al canal 2. Sin embargo, cuando se tuvo en cuenta la magnitud de las señales, observamos los siguientes niveles potenciales de interferencia en modo de reportero dual: Spike IgG / IgM en 71.98%, Spike IgA / IgM en 28.11%; Membrana IgG/ IgM al 7,41%, Membrana IgA/IgM al 134,61%; y Nucleocápside IgG/IgM al 146,03%, Nucleocápside IgA/IgM al 112,13%. En la configuración especificada, esto requeriría la medición de Spike IgM en combinación con el isotipo IgA, IgM de membrana con el isotipo IgM y mediciones de nucleocápside no realizadas en un formato de doble canal. Este hallazgo puede requerir la exploración de la inversión de la estrategia de etiquetado mediante la cual se miden IgA e IgG en el canal 2 e IgM en el canal 1.
Evaluación de eventos de seroconversión después de la vacunación contra el Covid-19
La seroconversión se monitoreó en cuatro sujetos tras la evaluación de IgA, IgM e IgG con el ensayo Spike S1 en puntos de tiempo que van desde la prevacunación hasta cuatro meses después de la finalización de la serie de vacunación contra covid-19. Las mediciones se realizaron en modo de doble canal (IgG/IgM e IgA/IgM, con valores de IgM promediados). Todos los sujetos recibieron la vacuna como una inmunización de 2 etapas, según la práctica estándar, con un intervalo de 21 días entre la primera y la segunda dosis. Las gráficas de la respuesta inmune de cada sujeto se muestran en la Figura 6A-C. Los valores de respuesta inmune para los antígenos de nucleocápside y membrana se observaron en niveles de fondo para todas las inmunoglobulinas evaluadas (datos no mostrados), lo que fue consistente con los sujetos que no tenían ninguna infección previa documentada por SARS-CoV-2 en el tiempo anterior a la vacunación. En general, los valores observados de IgA e IgM de Spike S1 fueron aproximadamente 40 veces más bajos que los títulos de isotipo de IgG, con títulos máximos que alcanzaron su punto máximo tan pronto como 14 días para los isotipos igM e IgG y el isotipo IgA alcanzó títulos máximos entre el momento de la segunda dosis (día 0) y 14 días después de la segunda dosis, dependiendo del tema. En particular, los títulos de IgG Spike S1 comienzan a descomponerse durante el transcurso de los cuatro meses posteriores a la finalización de la vacunación a una tasa altamente variable, de una manera dependiente del sujeto.
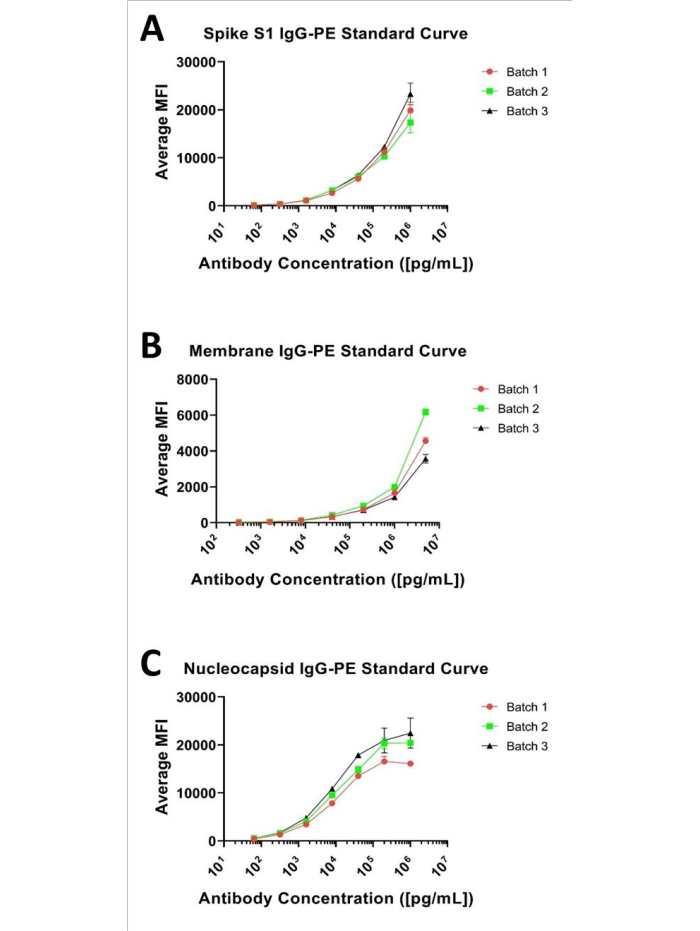
Figura 1: Curvas estándar representativas de 3 plexos. Curvas estándar representativas para los tres analitos; se presenta como una curva de dilución seriada de 7 puntos y 1:5 a partir de (A) 1 μg/mL para Spike S1, (B) 5 μg/mL para Membrane, y (C) 1 μg/mL para Nucleocapsid y anticuerpos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Optimización del tiempo de incubación de anticuerpos primarios/muestras: La señal promedio de IMF producida a partir de diferentes tiempos de incubación de anticuerpos primarios/muestras (captura de anticuerpos) que varía de 30 min a 4 h para los estándares 1-7 (como se indica en la Tabla 1). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Optimizaciones de la concentración secundaria de anticuerpos y rendimiento de doble canal. Las curvas ilustran la IMF promedio (normalizada al valor más alto registrado en la serie) producida a partir de concentraciones de anticuerpos secundarios probados, que van desde 0.5-8 μg / ml. Cada instancia se realizó como un ensayo de canal único y doble para apreciar las diferencias en el formato experimental. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Optimización del tiempo de incubación de anticuerpos secundarios, formato de doble canal. Gráficos representativos de los valores observados de IMF (normalizados al valor más alto registrado en la serie) con respecto al tiempo de incubación con anticuerpos secundarios. Los experimentos se realizaron como ensayos de doble canal como combinaciones (A-C) IgA/IgM o (D-F) IgG/IgM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Evaluaciones de especificidad para ensayos de doble canal. Resultados del ensayo del formato de ensayo de doble canal con una de cada combinación designada como espacio en blanco para ilustrar la falta de fluorescente o interferencia de canal cruzado. Haga clic aquí para ver una versión más grande de esta figura.
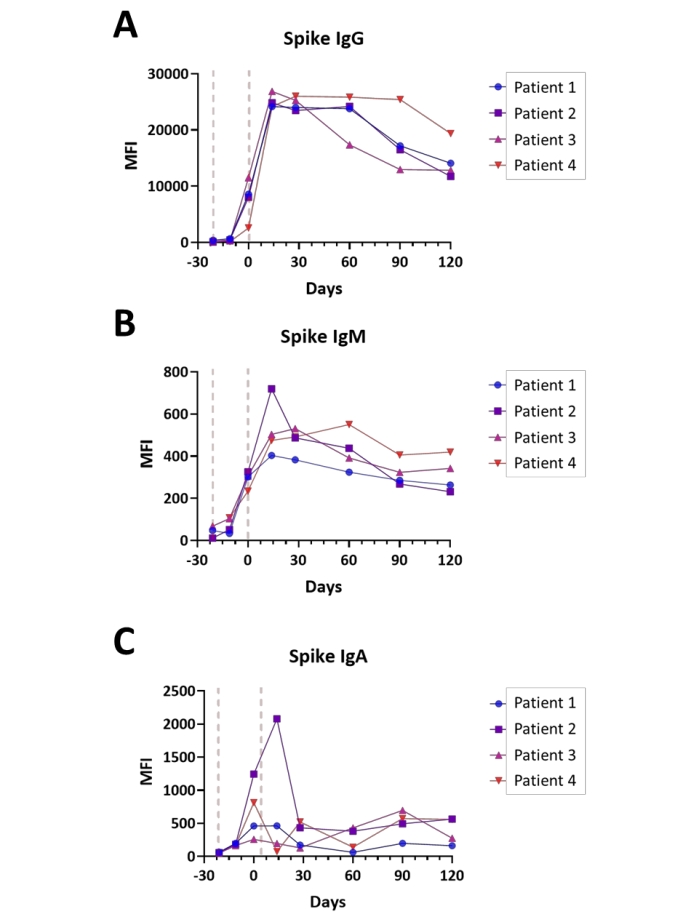
Figura 6: Ilustración de la seroconversión después de la vacunación contra el Covid-19. Gráficos que ilustran los títulos relativos de (A) anticuerpos IgG, (B) IgM y (C) IgA para el antígeno Spike S1 durante el curso de la vacunación contra el Covid-19 (Prevacunación - 4 meses después de la finalización); el tiempo se muestra en días en relación con la finalización de la serie de vacunación; se indican los puntos generales de la administración de la vacuna (líneas rojas). Los experimentos se realizaron en modo de doble canal, como se describe en el Protocolo. Haga clic aquí para ver una versión más grande de esta figura.
| Número estándar | Serie de dilución | Anti-Spike S1 o N (μg/mL) | Antimembrana (μg/mL) |
| Espacio en blanco | Espacio en blanco | - | - |
| 1 | ETS7 1:1 | 1 | 5 |
| 2 | ETS6 1:5 | 0.2 | 1 |
| 3 | ETS5 1:25 | 0.04 | 0.2 |
| 4 | STD4 1:125 | 0.008 | 0.04 |
| 5 | STD3 1:625 | 0.0016 | 0.008 |
| 6 | STD2 1:3125 | 0.00032 | 0.0016 |
| 7 | ETS1 1:15625 | 0.000064 | 0.00032 |
Tabla 1: Series de dilución para curvas estándar: Tabla de factores de dilución utilizados para las curvas estándar para el serotipo IgG; se presenta como una curva de dilución seriada de 7 puntos y 1:5 a partir de 1 μg/mL para α-Spike S1 y α-Nucleocápside y 5 μg/mL para anticuerpos de α membrana.
| Analito | Muestra | Representante 1 | Representante 2 | Representante 3 | Representante 4 | Ave | Sd | %CV |
| Espiga S1 | ETS2 | 369.4 | 356.9 | 295.2 | 271.5 | 323.3 | 47.4 | 14.6 |
| ETS5 | 3869.1 | 3437 | 3970.2 | 4240.7 | 3879.3 | 334 | 8.6 | |
| Membrana | ETS2 | 40.6 | 37.7 | 49.9 | 27.8 | 39 | 9.1 | 23.3 |
| ETS5 | 733.2 | 731.3 | 724 | 678.1 | 716.7 | 26 | 3.6 | |
| Nucleocápside | ETS2 | 1746.7 | 1790.8 | 1577.3 | 1664.8 | 1694.9 | 94.2 | 5.6 |
| ETS5 | 15598.1 | 14735.5 | 18369.5 | 17408.5 | 16527.9 | 1657.7 | 10 |
Tabla 2: Precisión intraensayo: Coeficiente porcentual de varianza (%CV) calculado a partir de cuatro réplicas de mezclas de anticuerpos estándar en el estándar 2 (STD2) y el estándar 5 (STD5) con un solo lote de ensayo en el mismo experimento. Los valores proporcionados para las réplicas y los promedios representan los valores observados de la IMF.
| Analito | Muestra | Lote 1 | Lote 2 | Lote3 | Ave | Sd | %CV |
| Espiga S1 | ETS2 | 383.2 | 424.4 | 379.9 | 395.8 | 24.8 | 6.3 |
| ETS5 | 5639.7 | 6062.5 | 6384.3 | 6028.8 | 373.4 | 6.2 | |
| Membrana | ETS2 | 39.1 | 58.5 | 59.1 | 52.2 | 11.4 | 21.8 |
| ETS5 | 732.3 | 941.4 | 701.1 | 791.6 | 130.7 | 16.5 | |
| Nucleocápside | ETS2 | 1342.6 | 1621 | 1718.2 | 1560.6 | 195 | 12.5 |
| ETS5 | 13543.9 | 14843.2 | 17883.4 | 15423.5 | 2227.2 | 14.4 |
Tabla 3: Precisión entre ensayos con muestras estándar: Porcentaje de coeficiente de varianza (%CV) calculado a partir de tres lotes distintos de ensayos, evaluados en el estándar 2 y el estándar 5 en el mismo experimento. Los valores proporcionados para las réplicas y los promedios representan los valores observados de la IMF.
| IgG-PE | IgM-SB | IgA-PE | |||||
| Ave. MFI | %CV | Ave. MFI | %CV | Ave. MFI | %CV | ||
| Espiga S1 | Tema 1 | 8002.3 | 17.7 | 1949.5 | 1.3 | 2045.8 | 5.5 |
| Tema 2 | 19155.8 | 7.3 | 918.6 | 4.1 | 1684.5 | 3.9 | |
| Tema 3 | 17865.6 | 18.0 | 549.4 | 3.8 | 961.3 | 8.1 | |
| Tema 4 | 11901.1 | 2.6 | 1603 | 4.8 | 8736.4 | 5.5 | |
| Tema 5 | 9801.8 | 4.0 | 1014.1 | 3.0 | 2747.6 | 9.3 | |
| Nucleocápside | Tema 1 | 15097.8 | 11.3 | 1049.7 | 9.9 | 5276.5 | 3.9 |
| Tema 2 | 15204.3 | 12.1 | 265.9 | 5.2 | 6761.3 | 11.9 | |
| Tema 3 | 18471.7 | 24.4 | 329.1 | 4.5 | 14308 | 2.9 | |
| Tema 4 | 16424.7 | 3.5 | 2418.1 | 0.1 | 4234.7 | 4.2 | |
| Tema 5 | 13344.9 | 3.6 | 225.6 | 10.0 | 13436.5 | 9.7 | |
| Membrana | Tema 1 | 514.6 | 8.6 | 180.6 | 14.0 | 141.2 | 9.8 |
| Tema 2 | 196.8 | 5.2 | 57 | 20.7 | 55.5 | 13.0 | |
| Tema 3 | 553.7 | 12.9 | 54.5 | 21.2 | 191.2 | 18.6 | |
| Tema 4 | 377.9 | 3.2 | 68.1 | 22.1 | 62 | 2.3 | |
| Tema 5 | 325.4 | 8.2 | 11.4 | 91.6 | 74.6 | 20.8 |
Tabla 4: Precisión entre ensayos con muestras humanas: Porcentaje medio de coeficiente de varianza (%CV) calculado a partir de tres lotes de ensayos analizados con muestras de plasma (diluidas 500 veces) de cinco sujetos humanos con infecciones por SARS-CoV-2.
| Espiga S1 | Membrana | Nucleocápside | |||||
| μg/ml | Ave. MFI | % máx. | Ave. MFI | % máx. | Ave. MFI | % máx. | |
| Igm | 0.5 | 186 | 13.2 | 32 | 25.2 | 132.7 | 13.6 |
| 1 | 304.2 | 21.6 | 45.8 | 36 | 194.4 | 19.9 | |
| 2 | 664.5 | 47.2 | 78.8 | 61.9 | 458.2 | 47 | |
| 4 | 1032.1 | 73.3 | 101.3 | 79.6 | 707.8 | 72.6 | |
| 8 | 1407.1 | 100 | 127.2 | 100 | 975 | 100 | |
| IgG | 0.5 | 809.7 | 4.9 | 27.5 | 15 | 1355.6 | 6.3 |
| 1 | 1696.9 | 10.2 | 40.6 | 22.2 | 2782.1 | 13 | |
| 2 | 4543.8 | 27.3 | 68.3 | 37.3 | 6661.2 | 31.2 | |
| 4 | 10003.5 | 60 | 110.7 | 60.5 | 12605.6 | 59 | |
| 8 | 16662.8 | 100 | 182.9 | 100 | 21360.6 | 100 | |
| IgA | 0.5 | 797.4 | 19.3 | 31.1 | 47.2 | 2056.5 | 16.1 |
| 1 | 1529.5 | 37 | 41.4 | 62.8 | 3869 | 30.4 | |
| 2 | 2261.3 | 54.7 | 48.6 | 73.3 | 6648.9 | 52.2 | |
| 4 | 2320.4 | 56.2 | 48.3 | 73.2 | 6548.1 | 51.4 | |
| 8 | 4132.2 | 100 | 65.9 | 100 | 12744.8 | 100 | |
Tabla 5: Optimización de la concentración secundaria de anticuerpos: La señal promedio de IMF producida a partir de diferentes concentraciones de anticuerpos secundarios oscila entre 0,5 μg/ml y 8 μg/ml. El valor de cada señal también se presenta como un porcentaje de la señal a 8 μg/mL ("Máx.") para demostrar la magnitud relativa de la señal.
| Espiga S1 | Membrana | Nucleocápside | |||||
| Tiempo de incubación (mín.) | Ave. MFI | % máx. | Ave. MFI | % máx. | Ave. MFI | % máx. | |
| Igm | 15 | 1185 | 72.2 | 40.4 | 48.9 | 609.5 | 53.3 |
| 30 | 1416.6 | 86.3 | 58.4 | 70.7 | 894.2 | 78.2 | |
| 60 | 1324.8 | 80.7 | 73.6 | 89.1 | 945.6 | 82.7 | |
| 120 | 1641.2 | 100 | 82.6 | 100 | 1143.2 | 100 | |
| IgG | 15 | 12917.6 | 80.5 | 244.4 | 44.9 | 15429.8 | 80.8 |
| 30 | 14915.4 | 92.9 | 434.7 | 79.9 | 18797 | 98.5 | |
| 60 | 15340.3 | 95.6 | 421.4 | 77.5 | 18694.4 | 97.9 | |
| 120 | 16050.3 | 100 | 544 | 100 | 19085.8 | 100 | |
| IgA | 15 | 3141.9 | 78.2 | 75 | 66.8 | 9103 | 86.6 |
| 30 | 3569.1 | 88.8 | 83.9 | 74.8 | 9563.8 | 91 | |
| 60 | 3539.1 | 88 | 86 | 76.6 | 9555.7 | 90.9 | |
| 120 | 4020 | 100 | 112.2 | 100 | 10512.9 | 100 |
Tabla 6: Optimización del tiempo de incubación de anticuerpos secundarios: La señal promedio de IMF producida a partir de diferentes tiempos de incubación de anticuerpos secundarios varía de 15 min a 120 min. El valor de cada señal también se representa como un porcentaje de la señal a 120 min ("Max.") para demostrar la magnitud relativa de la señal.
Discusión
La apreciación de una respuesta inmune a la exposición al SARS-CoV-2, junto con la vigilancia del estado de infección basada en RT-PCR, ha sido bien descrita como una receta para aclarar el curso de la recuperación de Covid-19, para servir como un medio para identificar plasma convaleciente con valor terapéutico potencial y para encuestar las tasas de infección a escala poblacional10,11. Diferentes ejemplos para comprender la seroconversión en sujetos humanos incluyen matrices de proteínas (antígenos)12, inmunoblots13, construcciones inmunocromatográficas rápidas14 y ensayos de inmunoabsorción ligados a enzimas (ELISA)15,16,17. Cada una de estas técnicas mencionadas anteriormente puede evaluar múltiples isotipos de inmunoglobulina individualmente con modificaciones menores. Estos procedimientos, sin embargo, no son capaces de ser reutilizados prácticamente para permitir el análisis paralelo de múltiples isotipos, como se presenta en este manuscrito, representando los factores de costo y rendimiento como limitaciones para su administración en una estrategia de prueba a escala poblacional. Varias de estas aplicaciones también brindan la oportunidad de concatenar niveles de múltiples antígenos en paralelo, ya sea tal como se presentan o en formatos alterados, como un ELISA multiplex18,19. Finalmente, la plataforma de inmunomadios ofrece la posibilidad de evaluar los niveles de múltiples antígenos en paralelo 20,21, pero se ha limitado a un solo epítopo (es decir, isotipo de inmunoglobulina) por ensayo a menos que, sin embargo, se emplee el instrumento reciente con capacidades de ensayo de "doble canal".
En este informe se enumeran protocolos que establecen la medición fiable de múltiples epítopos en un ensayo de inmunoperla utilizando el instrumento en modo 'dual-channel' en un estudio de caso de seroconversión de individuos vacunados contra el Covid-19. El método demostró una excelente precisión (valores de %CV típicamente <20%) utilizando diseños de ensayos manuales que pueden mejorarse con la integración de sistemas automatizados de laboratorio. La sensibilidad del ensayo y el rango dinámico para todos los analitos y epítopos seleccionados fueron adecuados para las evaluaciones de rutina. Aunque la falta de inmunorreactivos antiantígenos IgA e IgM disponibles comercialmente limitó la cuantificación al isotipo IgG, tal restricción no excluye la capacidad de ofrecer evaluaciones semicuantitativas o evaluaciones relativas a una muestra específica como calibrante22,23.
El ensayo de inmunoperad validado se asignó para investigar la seroconversión en una cohorte de individuos inmunizados con la vacuna Covid-19. En contraste con otras plataformas similares, la familia de instrumentación permite la prospección de la seroconversión en cientos de individuos por día en un flujo de trabajo manual y miles por día en un esquema automatizado. En general, estos hallazgos confirman que el enfoque de "doble canal" tiene una sensibilidad adecuada para la descripción de múltiples epítopos en paralelo para el ensayo idéntico y es viable en un contexto de multianalitos. Una diferencia en las sensibilidades a los canales 1 y 2, como se realiza con los fluoróforos ficoeritrina y Super Bright 436, respectivamente, puede justificar el diseño de un experimento específico para garantizar que se adquieran resultados analíticos viables para un experimento determinado. Es decir, la reserva del canal 1 para epítopos o analitos de menor prevalencia puede ser necesaria para mantener un rango dinámico del ensayo que incluya los valores observados de incógnitas. Más allá de esta consideración, el diseño del ensayo era obvio y debería ser fácilmente accesible para los laboratorios con capacidades analíticas limitadas. Ciertamente, esta consideración debe sopesarse al considerar la interferencia del canal 1 al canal 2, como señalamos para la Figura 5, por lo que la interferencia de isotipos de mayor abundancia puede causar errores analíticos engañosos para aquellos en abundancia mucho menor cuando se miden en un formato de doble canal. Este potencial de interferencia con situaciones con concentraciones de analitos muy diferentes puede representar una limitación significativa para el enfoque si no se maneja adecuadamente en la fase de diseño del ensayo.
En conclusión, se presentó un método para medir rápidamente los títulos de anticuerpos de los principales isotipos de inmunoglobulina asociados con una respuesta inmune a la infección o vacunación por Covid-19. La aplicación de este enfoque de manera longitudinal para evaluar la seroconversión puede proporcionar información que podría usarse mejor para manejar y / o monitorear el curso de la enfermedad o, alternativamente, guiar posibles programas de vacunas de refuerzo covid-19.
Divulgaciones
El Dr. Borgia es el inventor de la prueba serológica utilizada en este manuscrito que está pendiente de patente. El artículo se presenta de manera descriptiva solo sin análisis estadísticos presentados para evitar el sesgo potencial introducido por el conflicto del autor.
Agradecimientos
Los autores desean agradecer al Rush Biomarker Development Core por el uso de sus instalaciones, al Biorepositorio Rush para la inscripción de sujetos y el procesamiento de bioespecímenes, y a los números de subvención sci16 (J.R.S. y J.A.B.) de la Iniciativa de la Red de Evaluación de Coronavirus de Chicago (Chicago CAN) de la Fundación Walder SCI16 (J.R.S. y J.A.B.) y 21-00147 (J.R.S. y J.A.B.) y un premio de la Fundación Swim Across America (J.A.B.).
Materiales
| Name | Company | Catalog Number | Comments |
| 384-well black side polystyrene microtiter plates | Thermo Fisher | 12-565-346 | |
| Activation buffer (0.1 M NaH2PO4, pH 6.2) | Prepared in house | ||
| Assay buffer (PBS, 1% Bovine Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| Bovine Serum Albumin, heat shock fraction | MilliporeSigma | A-7888-50G | |
| Coupling buffer (50 mM MES, pH 5.0) | Prepared in house | ||
| COVID 19 M Coronavirus Recombinant Matrix Protein (6xHis tag) | MyBioSource | MBS8574735 | |
| Disposable pipette tips | |||
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Thermo Fisher | PIA35391 | |
| Goat Albumin, Fraction V Powder | MilliporeSigma | A2514-1G | |
| IgA Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB205009 | |
| IgG Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB204009 | |
| IgG Goat anti-Rabbit, R-PE, Polyclonal | Thermo Fisher | OB403009 | |
| IgM Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB202009 | |
| IgM Mouse anti-Human, SB 436, Clone SA-DA4 | Thermo Fisher | 62999842 | |
| Instrument Analyzer | Luminex Corp. | INTELLIFLEX-RUO | |
| Low-Bind microcentrifuge tubes (1.5 mL) | Thermo Fisher | 13-698-794 | |
| MagPlex-C Microspheres, Region XXX | Luminex Corp. | MC10XXX-01 | |
| MES hydrate (2-(N-Morpholino) ethane sulfonic acid hydrate) | MilliporeSigma | M2933 | |
| Microplate aluminum sealing tape | Thermo Fisher | 07-200-683 | |
| Polysorbate-20 | Thermo Fisher | BP337-500 | |
| Quality Biological Inc. PBS, pH 7.2 | Thermo Fisher | 50-751-7328 | |
| Quench buffer (PBS, 1% Goat Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Protein (His tag) | Sino Biologicals | 40588-V08B | |
| SARS-CoV-2 (2019-nCoV) Spike Protein (S1 Subunit, His tag) | Sino Biologicals | 40591-V08H | |
| SARS-CoV-2 (2019-nCoV) Spike RBD Antibody, Rabbit pAb | Sino Biologicals | 40592-T62 | |
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Antibody, Rabbit mAb | Sino Biologicals | 40588-R0004 | |
| SARS-CoV-2 (COVID-19) Membrane Antibody (IN), Rabbit pAb | ProSci | 10-516 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Fisher | PIA39269 | |
| Wash Buffer (PBS, 0.01% Polysorbate-20) | Prepared in house | ||
| Water, LC/MS grade | Thermo Fisher | W-64 |
Referencias
- Tighe, P. J., Ryder, R. R., Todd, I., Fairclough, L. C. ELISA in the multiplex era: potentials and pitfalls. Proteomics - Clinical Applications. 9, 406-422 (2015).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments: JoVE. (65), e4084(2012).
- Powell, R. L., et al. A multiplex microsphere-based immunoassay increases the sensitivity of siv-specific antibody detection in serum samples and mucosal specimens collected from rhesus macaques infected with SIVmac239. BioResearch Open Access. 2 (3), 171-178 (2013).
- Volpetti, F., Garcia-Cordero, J., Maerkl, S. J. A microfluidic platform for high-throughput multiplexed protein quantitation. PLoS One. 10 (2), 0117744(2015).
- Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., Al-Nasser, A. D. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens. 9 (3), 231(2020).
- Asif, M., Xu, Y., Xiao, F., Sun, Y. Diagnosis of COVID-19, vitality of emerging technologies and preventive measures. Chemical Engineering Journal. 423, Lausanne, Switzerland. 130189(2021).
- La Marca, A., Capuzzo, M., Paglia, T., Roli, L., Trenti, T., Nelson, S. M. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reproductive Biomedicine Online. 41 (3), 483-499 (2020).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews. 29, Suppl 1 49-52 (2008).
- Tarhoni, I., et al. Relationship between circulating tumor-associated autoantibodies and clinical outcomes in advanced-stage NSCLC patients receiving PD-1/-L1 directed immune checkpoint inhibition. Journal of Immunological Methods. 490, 112956(2021).
- Deeks, J. J., et al. Antibody tests for identification of current and past infection with SARS-CoV-2. The Cochrane Database of Systematic Reviews. 6, 013652(2020).
- Mahalingam, S., et al. Landscape of humoral immune responses against SARS-CoV-2 in patients with COVID-19 disease and the value of antibody testing. Heliyon. 7 (4), 06836(2021).
- Ruano-Gallego, D., et al. A multiplex antigen microarray for simultaneous IgG and IgM detection against SARS-CoV-2 reveals higher seroprevalence than reported. Microbial Biotechnology. 14 (3), 1228-1236 (2021).
- Shah, J., et al. IgG and IgM antibody formation to spike and nucleocapsid proteins in COVID-19 characterized by multiplex immunoblot assays. BMC Infectious Diseases. 21 (1), 325(2021).
- Gambino, C. M., et al. Comparison of a rapid immunochromatographic test with a chemiluminescence immunoassay for detection of anti-SARS-CoV-2 IgM and IgG. Biochemia Medica (Zagreb). 30 (3), 030901(2020).
- Algaissi, A., et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Scientific Reports. 10, 16561(2020).
- Chiereghin, A., et al. Recent advances in the evaluation of serological assays for the diagnosis of SARS-CoV-2 infection and COVID-19. Frontiers in Public Health. 8, 620222(2020).
- Nicol, T., et al. Assessment of SARS-CoV-2 serological tests for the diagnosis of COVID-19 through the evaluation of three immunoassays: Two automated immunoassays (Euroimmun and Abbott) and one rapid lateral flow immunoassay (NG Biotech). Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 129, 104511(2020).
- Butt, J., et al. From multiplex serology to serolomics-A novel approach to the antibody response against the SARS-CoV-2 proteome. Viruses. 13 (5), 749(2021).
- Byrum, J. R., et al. multiSero: open multiplex-ELISA platform for analyzing antibody responses to SARS-CoV-2 infection. medRxiv. , (2021).
- Dobano, C., et al. Highly sensitive and specific multiplex antibody assays to quantify immunoglobulins m, a, and g against SARS-CoV-2 antigens. Journal of Clinical Microbiology. 59 (2), 01731(2021).
- Schultz, J. S., et al. Development and validation of a multiplex microsphere immunoassay using dried blood spots for SARS-CoV-2 seroprevalence: Application in first responders in first responders in Colorado, USA. Journal of Clinical Microbiology. 59 (6), 00290(2021).
- Beavis, K. G., et al. Evaluation of the EUROIMMUN anti-SARS-CoV-2 ELISA assay for detection of IgA and IgG antibodies. Journal of Clinical Virology: The Official Publication of the Pan Americal Society for Clinical Virology. 129, 104468(2020).
- Jung, J., et al. Clinical performance of a semi-quantitative assay for SARS-CoV2 IgG and SARS-CoV2 IgM antibodies. Clinica Chimica Acta: International Journal of Clinical Chemistry. 510, 790-795 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados