Method Article
Covid-19の多検体免疫ビーズアッセイを使用した血清変換の動的モニタリング
* これらの著者は同等に貢献しました
要約
この記事では、SARS-CoV-2感染またはワクチン接種に対する免疫応答から生じる2つの免疫グロブリンアイソタイプ(IgA、IgM、またはIgGのいずれか)の抗体価の動的変化を同時にモニタリングするための便利な方法について説明します。この「マルチアナライトCovid-19免疫応答パネル」は、「デュアルチャネル」機能を備えたフローベースのマルチプレックスリーダーを使用して読み取られるコード化されたミクロスフェア上に構築された3つの間接イムノアッセイを採用しています。
要約
複数のバイオマーカーを協調して尋問するためのマルチプレックス技術は、数十年前から存在してきました。しかしながら、同じ分析物上の複数のエピトープを評価する方法は、依然として限定的である。この報告は、SARS-CoV-2感染またはワクチン接種に対する免疫応答に関連する一般的な免疫グロブリンアイソタイプ(例えば、IgA、IgM、およびIgG)の血清学的試験のための多重化免疫ビーズアッセイの開発および最適化について記載している。アッセイは、デュアルチャネル機能を備えたフローベースのマルチプレックス蛍光リーダーを使用して達成されました。最適化は、分析物の捕捉時間、検出抗体濃度、および検出抗体のインキュベーション時間に焦点を当てました。分析アッセイ性能特性(例えば、アッセイ範囲(定量の下限および上限を含む)、およびアッセイ内およびアッセイ間の精度)は、「デュアルチャネル」モードを使用して、IgG/IgMまたはIgA/IgM血清型の組み合わせのいずれかについて確立されました。IgG で 30 分、IgM で 60 分、IgA で 120 分という分析物の捕捉時間は、ほとんどのアプリケーションに適しており、アッセイ性能とスループットのバランスが取れていました。最適な検出抗体を 4 μg/mL で 30 分間インキュベーションすることが観察され、全体的に優れた精度 (分散係数 (%CV) ≤ 20%) および観察された感度値を考慮すると、一般的な用途に推奨されます。IgG アイソタイプのダイナミックレンジは、各アッセイ (スパイク S1、ヌクレオカプシド、およびメンブレン糖タンパク質) で数桁に及び、臨床応用のための 1:500 希釈係数での堅牢な力価評価をサポートします。最後に、最適化されたプロトコルを、SARS-CoV-2ワクチンレジメンを完了した被験者(n = 4)のスパイクS1血清変換のモニタリングに適用した。このコホート内で、スパイクS1 IgGレベルは、2回目の投与投与後14日目に、IgMまたはIgAアイソタイプよりもはるかに高い(〜40倍)シグナル強度で最大力価に達することが観察された。興味深いことに、我々は、主に被験者依存性であった高度に変動するスパイクS1 IgG力価崩壊速度が観察されたことを観察した。
概要
生物学的サンプル中の複数の疾患関連バイオマーカーの同時測定により、病理学的プロセスに関する記述的および予測的な洞察が可能になります。酵素結合免疫吸着アッセイ(ELISA)などの従来の単一分析物免疫学的手順は、臨床および研究の両方の場面で定量分析の礎石となってきましたが、これらの技術は、スループット、各測定に必要な検体の量、および疾患コース全体で頻繁に絡み合う複数の生物学的要素の研究を大幅に制限する費用対効果に関してかなりの制限を持つ可能性があります1.微小球ベースの多重化技術は、アッセイを組み合わせてラボのスループットを向上させ、サンプルの不足を軽減し、反復検査を減らしてコスト削減を最大化する能力のために、診断施設と研究施設の両方にとって不可欠なプラットフォームとなっています1,2,3,4。近年、この多重化能力のさらなる増強が、デュアルレポーター機能を有する機器によって導入されている。デュアルレポーター機能は、検出用に2つの蛍光チャネルを実装し、別の次元の多重化を提供し、同じ分析物上の複数のエピトープの検出を可能にします。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、現在のコロナウイルス病2019(COVID-19)パンデミック5の原因となる病原体です。RT-PCR検査は、疾患経過の開始時の感染確認に不可欠ですが、抗体価の血清学的検査は、以前の曝露または回復に関する個人の正確かつ完全な批判に不可欠であることが証明されています。予防接種に対する応答;および/またはCovid-19ワクチン接種の有効性の評価6,7。
このレポートでは、フローベースのマルチプレックスリーダーデュアルレポートシステムを利用する複数のSARS-CoV-2ウイルス抗原の血清変換を測定する方法を説明します。具体的には、スパイク S1、ヌクレオカプシド、およびメンブレン (別名マトリックス) 糖タンパク質のアッセイを含む 3 プレックス SARS-CoV-2 抗原パネルに対する 2 つの抗体サブタイプ (IgG/IgM または IgA/IgM として構成) の同時検出について説明します。このアプローチは、縦断的な血清変換のキャプチャに理想的な企業を提供し、Covid-19パンデミックに対する武器庫の貴重なツールに貢献します。
プロトコル
すべての被験者は、プロトコルORAの下でラッシュ大学医療センターの完全な治験審査委員会(IRB)の承認を得て、書面によるインフォームドコンセントで登録され20101207、倫理的研究実施のためのすべての機関ガイドラインが遵守された。血液は、従来の瀉血を介してラベンダー真空乾燥機(K2EDTA)に採取され、推奨されるプロトコルで処理された。得られた血漿を、評価が行われるまで-80°Cでアーカイブした。
1. 抗原結合ミクロスフェアの作製
- ユニークなビーズ領域を持つ磁気微小球の3つの異なるバイアルを選択し、使用した各バイアルのビーズIDとロット情報を記録します。
注: 以下のステップは、個別の微小球領域ごとに実行されます。微小球は光に敏感であり、長期間の光への曝露から保護されるべきである。洗浄ステップ中は、ミクロスフェアを乱さないように注意してください。邪魔された場合は、2 回目の 60 秒間の分離を許可します。 - 60秒間微小球ストックを渦巻き、凝集ビーズを解離させるために使用前に5分間超音波処理する。
- 1.0 x106 ビーズを 1.5 mL の低タンパク質結合マイクロ遠心分離管に移します。
- チューブを磁気分離器に挿入し、60秒間分離できるようにします。チューブを磁気分離器に入れたまま、ビーズペレットを乱すことなく上澄み液を慎重に取り除きます。
- 磁気分離器からチューブを取り出し、ビーズを100 μLのHPLCグレードの水で再懸濁し、30秒間渦巻きます。チューブを磁気分離器に60秒間戻し、続いて上澄み液を除去する。この洗浄プロトコルを 2 回繰り返します。
- 磁気分離器からチューブを取り出し、洗浄したミクロスフェアを90 μLの100 mM一塩基性リン酸ナトリウム、pH 6.2(活性化バッファー)に30秒間ボルテックスで再懸濁します。
- 10 μL の 50 mg/mL Sulfo-NHS (活性化バッファーで希釈) をミクロスフェアに加え、10 秒間穏やかに渦巻きます。50 mg/mL EDC 溶液 (活性化バッファーで希釈) を 10 μL 加え、10 秒間穏やかに渦巻きます。微小球を室温(RT)で20分間インキュベートし、10分ごとに穏やかな渦を巻き起こします。
- LC/MS グレードの水の代わりに 50 mM MES、pH 5.0 (カップリングバッファー) で洗浄手順 1.4 ~ 1.5 を繰り返し、合計 2 回の洗浄を行います。
- 磁気分離器からチューブを取り出し、ビーズを100μLのカップリングバッファーで30秒間ボルテックスで再懸濁し、その後すぐに所望の量のタンパク質を添加した。
- カップリングバッファーで総容量を150 μLにします。ボルテックスによるカップリング反応を30秒間混合し、RTで回転させて2時間インキュベートする。
注:本明細書に定義されるアッセイのために、コンジュゲーションは、以下のタンパク質濃度で実施した:スパイクS1:5μg;ヌクレオカプシド:5μg;メンブレン:12.5μg。 - LC/MSグレードの水の代わりにリン酸緩衝生理食塩水(PBS)-1%ヤギ血清アルブミン、0.01%ポリソルベート-20(クエンチバッファー)で洗浄ステップ1.4を繰り返し、合計2回の洗浄を行います。洗浄したミクロスフェアを、0.05%アジ化ナトリウムを含む100 μLのクエンチバッファーにボルテックスで30秒間再懸濁します。
メモ: ビーズが完全にクエンチされるまでに、少なくとも 6 時間待ってから、他の手順に進みます。 - 自動細胞カウンターまたは血球計数器を使用して回収されたミクロスフェアの数をカウントします。観察されたビーズ濃度を記録します。
- 結合微小球を暗所で4°Cで冷蔵する。
2. 手続き
- アッセイ性能(基本プロトコル)
- 結合された微小球を渦によって30秒間再懸濁し、〜60〜90秒間超音波処理する。
- 各ビーズコロイドの必要量をそれぞれのチューブから取り出し、ビーズコロイドを新しい1.5mL微量遠心チューブに結合させる。
- チューブを磁気セパレータに挿入し、60秒間分離させます。チューブを磁気分離器に入れたまま、ビーズペレットを乱すことなく上澄み液を慎重に取り除きます。
- 分離器からビーズを取り出し、ビーズを100 μLのPBS-1%ウシ血清アルブミン、0.01%ポリソルベート-20(アッセイバッファー)で再懸濁し、30秒間ボルテックスします。チューブを磁気分離器に入れ、60秒間分離を行えるようにします。この洗浄プロトコル(すなわち、ステップ2.1.3-2.1.4)を2回繰り返す
- 適切な量のアッセイバッファーを添加して、3-plex 作業ミクロスフェア混合物の濃度を調整し、各ターゲットについて 1 μL あたり 100 個のミクロスフェアの最終濃度を生成します。
- ステップ2.1.5で調製したミクロスフェア混合物12.5 μLを384ウェルプレートの各ウェルにアリコートするか、96ウェルプレートの各ウェルに25 μLをアリコートする。
- 血漿/血清検体をアッセイバッファーで500倍に希釈します。所望の滴定に従って標準標本を調製する。
- ブランクサンプルとして12.5 μLのアッセイバッファーを追加し、希釈した検体または標準品のそれぞれを384ウェル検体プレートの各指定ウェルに、またはブランク、希釈標本または標準品を96ウェル検体プレートの各ウェルに25 μL加えます。
- プレートをアルミシールまたはホイルで覆い、700rpmに設定したプレートシェーカー上でRTで1時間インキュベートします。
注: 希釈曲線の概略図を 表 1 に示します。 - 抗ヒト検出抗体の溶液(二次抗体溶液)を、ステップ2.1.11で規定されているようにアッセイバッファーを用いて4μg/mLで調製する。
- スーパーブライト436(SB)/ヤギ抗ヒトIgA、フィコエリスリン(PE)コンジュゲート検出抗体を4μg/mLで結合させたヤギ抗ヒトIgMを調製する。またはヤギ抗ヒトIgM、SBコンジュゲート/ヤギ抗ヒトIgG、PEコンジュゲートは4μg/mLで抗体を検出します。
注: 384 ウェルプレートフォーマットの場合、12.5 μL/ウェルの調製済み二次抗体溶液が必要であり、96 ウェルプレートフォーマットの場合、25 μL/ウェルが必要です。 - プレートを磁気分離器の上に置き、急速に洗浄し、バイオハザード容器上で強制的に反転させてウェルから液体を除去します。プレートを反転させたまま、厚い紙の束にプレートを強制的に叩きます。
- 各ウェルを 100 μL のアッセイバッファーで洗浄し、前述のようにバイオハザード容器上で強制的に反転させて液体を除去します。これらのステップ (2.1.12-2.1.13) を繰り返して、合計 2 回の洗浄を行います。使用済みの紙の束はすべてバイオハザード容器に捨てます。
- 384ウェルプレートの各ウェルに12.5 μLの二次抗体作用溶液を、または96ウェルプレートの各ウェルに25 μLを加える。プレートをアルミシールまたはホイルで覆い、700rpmに設定したプレートシェーカー上でRTで30分間インキュベートします。
- 洗浄手順2.1.12-2.1.13を繰り返します。
- 384ウェルプレートの各ウェルに75 μLのアッセイバッファー、または96ウェルプレートの各ウェルに100 μLを加えます。プレートをアルミシールまたはホイルで覆い、700rpmに設定したプレートシェーカー上でRTで5分間インキュベートします。
- システムマニュアルに従って、機器分析器を介して60 μLを分析します。
- 検体捕捉インキュベーション時間の最適化
- セクション 2.1 のステップは、ステップ 2.1.9 のインキュベーション時間が 30 分、60 分、および 120 分であった期間を使用して実行します。
注:インキュベーションは、別個のプレートで、またはステップ2.1.6でステップ2.1.9に進む時間まで一時停止することによって行うことができる。所望のインキュベーション時間を達成する。 - メーカーの推奨に従って、60 μL のアッセイ混合物を使用して分析装置でプレート読み取りを進めます。
- セクション 2.1 のステップは、ステップ 2.1.9 のインキュベーション時間が 30 分、60 分、および 120 分であった期間を使用して実行します。
- 二次抗体濃度の最適化
- セクション2.1で詳述されているように、この手順を実行しますが、二次抗体作用溶液(ステップ2.1.10-2.1.11で調製)中の試薬の最終濃度を以下のように変更した以外は例外です。
ヤギ抗ヒト(またはウサギ)IgM、SBコンジュゲート検出抗体(8、4、2、1および0.5μg/mL)
ヤギ抗ヒト(またはウサギ)IgA、PEコンジュゲート検出抗体(8、4、2、1および0.5μg/mL)。
ヤギ抗ヒト(またはウサギ)IgG、PEコンジュゲート検出抗体(8、4、2、1および0.5μg/mL)。
ヤギ抗ヒト(またはウサギ)IgG、PEコンジュゲート/ヤギ抗ヒト(またはウサギ)IgM、SBコンジュゲート検出抗体(8、4、2、1および0.5μg/mL)。
ヤギ-抗ヒト(またはウサギ)IgA、PE-コンジュゲート/ヤギ-抗ヒト(またはウサギ)IgM、SB-コンジュゲート検出抗体(8、4、2、1および0.5 μg/mL)。 - メーカーの推奨に従って、60 μL のアッセイ混合物を使用して分析装置でプレート読み取りを進めます。
- セクション2.1で詳述されているように、この手順を実行しますが、二次抗体作用溶液(ステップ2.1.10-2.1.11で調製)中の試薬の最終濃度を以下のように変更した以外は例外です。
- 二次抗体インキュベーション時間の最適化
- セクション 2.1 で詳述されているように、この手順を、ステップ 2.1.14 で定義した 15 分、30 分、60 分、および 120 分のインキュベーション期間で実行します。
- メーカーの推奨に従って、60 μL のアッセイ混合物を使用して分析装置でプレート読み取りを進めます。
- 最適化されたデュアルチャネルアッセイによる対象検体の評価
- Covid-19ワクチン(すなわち、2回目の投与)投与の完了に対して、-21、-11、-1/0、+14、+28、+60、+90、および+120日目に被験者血漿サンプル(n = 4)を採取する。
注:0日目は、ワクチン接種が完了した時点を表す。 - IgG/IgM または IgA/IgM デュアルチャネルアッセイのいずれかとして、ベースプロトコル (セクション 2.1.) を使用してすべてのアッセイを実行します。
- 結果を、各特異的免疫グロブリンおよびアッセイについて観察された最大中央蛍光強度(MFI)値に正規化する。
- Covid-19ワクチン(すなわち、2回目の投与)投与の完了に対して、-21、-11、-1/0、+14、+28、+60、+90、および+120日目に被験者血漿サンプル(n = 4)を採取する。
結果
典型的なアッセイ結果と性能評価
イムノビーズアッセイは、 図1に示す各パネルに示されているように、一般に、数(対数)桁にわたって評価すると、シグモイド曲線を提供します。ユーザーは、マルチプレックス内の各分析物の最適濃度範囲を実験的に定義して定量の全範囲を決定し、極端な値(定量の下限[LLOQ]または定量上限[ULOQ]に近づく領域)を過剰にサンプリングしないようにする必要があります。しかし、アッセイに必要な実際の範囲は、所定の希釈因子における生物学的マトリックス(すなわち、「未知数」)中の標的分析物の分布によって決定される。さらに、標準曲線は通常、4パラメトリックまたは5パラメトリック適合アルゴリズムを使用した線形回帰によって解釈されますが、所与の曲線の線形部分は、通常、線形(y = mx + b)定量モデルを用いて定量精度に最大の信頼を提供します。検量線を所定の希釈係数における未知物の観察値と一致させることが、定量アッセイ開発の目標であるべきです。
この点に関して、スパイクS1、ヌクレオカプシド、およびメンブレン抗体のそれぞれについて、スパイクS1およびヌクレオカプシドについては1μg/mL~0.000064μg/mL、メンブレンでは5μg/mLおよび0.00032μg/mLの範囲の1:5段階希釈系列に基づく7点標準曲線を評価しました(図1に示すように)。各アッセイの検出下限(LLOD)は、そのバックグラウンドと区別できるシグナルを生じた最低の分析物濃度として定義した。LLODは、前述の式8、9、LLOD=LoB+1.645(SD低濃度試料)により同定することができる。LoBはブランクの下限であり、ゼロ値が予想される場合にブランクから生成される分析物の「見かけ上の」濃度であり、この式LoB = 平均ブランク+ 1.645(SDブランク)8を使用して確認することができます。この方法に基づいて、スパイクS1アッセイのMFI値は134.38~20191.2の範囲であり、134.38MFIは0.00024μg/mLを表し、LLODとして定義されました。メンブレンアッセイの場合、実用的なMFI範囲は52.24~4764.9で、52.24MFIは0.004885μg/mLと計算され、LLODとして割り当てられました。ヌクレオカプシドアッセイのMFI範囲は517.9~19666.34で、517.9は0.00024μg/mLと指定されており、これはLLODでした。検出上限(ULOD)は、MFIの変化が線形でなくなり、シグナル応答が飽和した後の分析物の濃度として定義されます。これらの曲線の完全なシグモイド特性は、Nucleocapsid曲線を除いて、試験された標準では観察できないことに留意すべきである。ただし、現在までにアッセイされたすべての未知数(1:500希釈時)について観察されたMFI値は、各分析物について提示された曲線範囲内にあり、線形回帰による4または5パラメトリックフィットを使用して容易に定量化できます。
アッセイ精度
アッセイ内精度:アッセイの4回の反復を同じプレート上で実施し、%CV、または標準偏差と平均の商に100を掛けた値として計算されたアッセイ精度を評価しました。これらの表に対して標準点 2 と 5 が選択され、表 2 に値がカタログ化されています。%CV値の典型的な許容上限閾値は≤20%であり、これはMembrane IgGの標準2のそれを除いて、これらのデータについて観察されたが、これはバックグラウンドレベルに起因する可能性が高く、外れた値を排除することによって修正することができる(データは示されていない)。MFI値が<200であったメンブレンアッセイでは、読み取り値に対する明らかな不安定性が観察されたこと(IgAおよびIgMアイソタイプの場合に最も一般的であることに留意すべきである。
アッセイ間精度:各アッセイについて3つの異なるバッチのビーズセットを調製し、アッセイ内精度について定義したとおりに試験しました(上記および図1に見られるように)。アッセイ間変動性は、表3に示すように、3つのバッチの各々についての平均結果から%CVを計算することによって評価した。ここでも、許容可能な%CVの上限閾値は≤20%に設定されており、これは試験したすべての条件に対して存在する(上記のように、Membrane IgGの標準2と同様の効果を有する)。正味MFI値のバッチ間変動性は、カスタムアッセイ開発中に同じ免疫試薬の複数のバッチ内で一般的に観察されることに留意すべきである。商業的に入手した抗標的抗体(例えば、ウサギ抗スパイクS1)から構築された検量線とそれに続く抗種検出抗体の使用は、分析結果に一貫性を提供し、異なる期間における複数のバッチ間の比較を可能にすることができる。
ヒトサンプルとのアッセイ間精度:アッセイ間精度の評価は、SARS-CoV-2感染について最初に報告された症状から1ヶ月以内に収集されたヒト血漿サンプル(n = 5)を用いて繰り返した。アッセイの3つの異なるバッチ(すなわち、ビーズセットの異なる調製物)で達成される。これらの結果を表 4 に示し、%CV 値と一般的な上限値が ≤20% の精度を示しています。スパイクS1、ヌクレオカプシドおよびメンブレンIgG力価の平均%CV値は、それぞれ9.9%(範囲2.6%〜18%)、11.0%(範囲3.5%〜24.4%)、および7.6%(範囲3.2%〜12.9%)であると計算された。これら3つの分析物のIgMおよびIgA力価についても同様の観察が行われ、いずれも%CV値<20%であった。これに対する唯一の例外は、膜タンパク質に対する被験者5 IgM力価であり、その後、外れ値として除外された。ヒト被験者評価の精度値は、ウサギ抗体について上記で見られたものと一致しており、これは、アッセイの精度にほとんど影響を及ぼさずに複数の種における抗原の力価を評価するために、これらのアッセイを容易に再構成され得ることを示唆している。上記のように、MFI値が<200であったメンブレンアッセイ(IgAおよびIgMアイソタイプの場合に最も一般的)で観察された読み取り値に明らかな不安定性があった。
一次抗体濃度の最適化
分析物の「捕捉時間」を抗原結合ビーズで評価し、血漿検体または標準物質中の抗体を、一次インキュベーションの長さ(30分、1時間、2時間、および4時間)を変更することによって試験した。平均MFIの差は、特定のインキュベーションの商として表され、 図2では、30分のインキュベーション(最小持続時間)と4時間のインキュベーション(最大持続時間)の間の最大インキュベーション時間(% Max)と呼ばれる。120 分での値は、スパイク S1、メンブレン、およびヌクレオカプシド抗体の IgG 力価に最適であり、高速一次抗体結合動態を示し、アッセイスループットを向上させる柔軟性を可能にしました。しかし、IgAおよびIgM(データは示さず)アイソタイプについてより遅い動態が観察され、 図2に示すように、4時間時点におけるピーク捕捉レベルが実証された。全体として、アッセイの飽和に近づくことと、生産時に各アッセイを実行するための実用的な時間の便宜性(スループットを最大化するため)との間にはバランスがあります。これにより、これらの知見において、IgGについて30分、IgMについて60分、およびIgAについて120分の最小インキュベーション時間で定量目的に適したシグナルが観察された。
二次抗体濃度の最適化
5つの濃度の二次抗体(ヤギ抗ヒトIgG、PEコンジュゲート;ヤギ抗ヒトIgA、PEコンジュゲート;ヤギ抗ヒトIgM、SBコンジュゲート)を試験した(0.5、1、2、4、および8μg/mL)。すべての抗体は、広範囲のシグナルを明らかにし、いかなる条件においても明らかなシグナル飽和を伴わず、それによって、任意の濃度について線形測定を確実にした。一例として、0.5μg/mLでSBコンジュゲートしたヤギ抗ヒトIgMを用いたスパイクS1アッセイから生成された平均シグナルは、最大シグナル(8μg/mL)から生成されたMFIの13.2%であったのに対し、4μg/mLから生成されたMFIは、最大シグナルで発現したMFIの73.3%であった。他のスパイクS1抗体アイソタイプ、メンブレン抗体、およびヌクレオカプシド抗体からのシグナルの範囲の詳細は、 表5 および 図3に含まれる。実用的なポイントとして、最適な二次抗体濃度と前述の4μg/mL二次抗体濃度との間の主要な影響は、アッセイ感度とアッセイコストの点で反映されています。つまり、8 μg/mL の二次抗体濃度は、低い抗体価または少量の貴重なサンプルでの適用には望ましい場合がありますが、これらのアッセイに関連するコストは、以前に定義された 4 μg/mL 濃度の使用よりもかなり高くなります。逆に、高い抗体価が観察される場合(Covid-19ワクチン接種を経験した個人や非限定的な量の血清を有する個人など)は、より低い量の二次抗体(例えば、1μg/mL)の適用を通じて費用便益を得るであろう。
二次抗体インキュベーションの最適化
二次抗体インキュベーションの持続時間の潜在的な影響も、インキュベーションの長さ(15、30、60、および120分)を改変することによって調査した。一般に、15分間のインキュベーション(最小持続時間)と120分間のインキュベーション(最大持続時間)との間の、特定のインキュベーションおよび最大インキュベーション時間の商として提示される平均MFIの差は、スパイクS1、メンブレン、およびヌクレオカプシド抗体についてそれぞれ30%、55%、および50%を超えず、二次抗体結合における速い動態学的ステップを示し、アッセイスループットを増加させることを意味する。 表6は 、すべてのインキュベーション時間におけるシグナル変化の詳細を含む。この分析の異なるインキュベーションから観察されたシグナルの図を 図4に示す。
デュアルチャネル性能と特異性
各分析物について、単一のレポーターフォーマットの実行(IgG-PEのみ、IgA-PEのみ、またはIgM-SBのみ)を、デュアルレポーターフォーマット(例えば、デュアルレポーターフォーマットのスパイクS1 IgM-SBと組み合わせたスパイクS1 IgG-PEのみ対スパイクS1 IgG-PE)で実行したときに同じ分析物に対して生成されたシグナルと比較した。2つのフォーマットで作成されたシグナルのアッセイ精度(%CVとして表される)を用いて、この実験の結果における関係を分析した。スパイクS1アッセイの%CV値は、IgM、IgG、およびIgAについてそれぞれ6.19%、16.4%、および23%であった。メンブレンアッセイの場合、%CV値は、IgM、IgG、およびIgAについてそれぞれ3.3%、7.9%、および16.4%であった。最後に、ヌクレオカプシドアッセイは、IgM、IgG、およびIgAについてそれぞれ8.7%、10.3%、および24.2%の%CV値を提供しました。IgM および IgA アイソタイプについて観察された精度値は、より長いインキュベーション時間が、これらのクラスの免疫グロブリンにわたる既知の結合速度論的差異のために、優れたアッセイ結果を与える可能性があることを示唆しています。 図4 は、異なる濃度の二次抗体のフォーマット間の一致を示す。
レポーターチャネルの特異性を確認するために、単一のレポーターチャネルを一度に試験し、他方のチャネルをブランクとして割り当てて、非特異的シグナル(出血効果)について問い合わせた。これらの知見は、条件のスペクトルにわたって高い特異性を考えると、2つのレポーターチャネル間に交差シグナル汚染が無視できる程度であることを示している。これらの知見を 図5に示す。全体として、チャネル1からチャネル2にかけて6.45%の干渉が観察されました。しかし、信号の大きさを考慮すると、デュアルレポーターモードで次の潜在的な干渉レベルが観察されました:スパイクIgG / IgMは71.98%、スパイクIgA / IgMは28.11%です。膜IgG/IgMは7.41%、膜IgA/IgMは134.61%;ヌクレオカプシドIgG/IgMは146.03%、ヌクレオカプシドIgA/IgMは112.13%であった。指定された構成では、スパイク IgM を IgA アイソタイプと組み合わせて測定すること、IgM アイソタイプと膜 IgM を併用すること、およびデュアルチャネル形式では実行しないヌクレオカプシド測定が必要になります。この知見は、IgAとIgGをチャネル2で、IgMをチャネル1で測定するという標識戦略の逆転の調査を必要とする可能性がある。
Covid-19ワクチン接種後の血清変換イベントの評価
血清変換は、ワクチン接種前からCovid-19ワクチン接種シリーズの完了後4ヶ月までの時点で、スパイクS1アッセイによるIgA、IgM、およびIgGの評価時に4人の被験者でモニターされました。測定はデュアルチャネルモード(IgG/IgMおよびIgA/IgM、IgM値を平均)で行った。すべての被験者は、標準診療に従って、第1回投与と第2回投与の間に21日間の間隔で、2段階の免疫としてワクチンを受けた。各被験者の免疫応答のプロットを 図6A〜Cに示す。NucleocapsidおよびMembrane抗原に対する免疫応答値は、評価されたすべての免疫グロブリンについてバックグラウンドレベルで観察され(データは示さず)、これはワクチン接種前の時間に文書化された以前のSARS−CoV−2感染を有していない被験者と一致した。全体として、観察されたスパイクS1 IgAおよびIgM値は、IgGアイソタイプ力価よりも約40倍低く、IgMおよびIgGアイソタイプおよびIgAアイソタイプの両方についてピーク力価が14日後にピーク力価に達し、2回目の投与(0日目)から2回目の投与後14日目の間にピーク力価に達し、 主題に応じて。特に、スパイクS1 IgG力価は、ワクチン接種完了後4ヶ月間に、被験者依存的に、非常に変動する速度で減衰し始める。
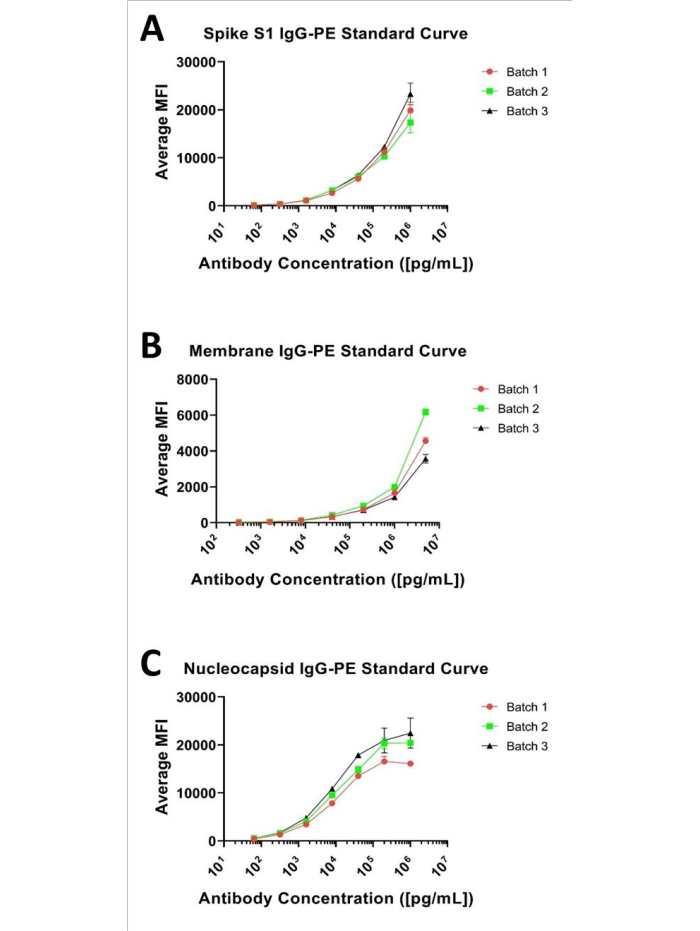
図1:代表的な3-プレックス標準曲線3つの分析物の代表的な標準曲線;スパイクS1については(A)1μg/mL、メンブレンでは5μg/mL、ヌクレオカプシドおよび抗体では1μg/mLから始まる7点、1:5の段階希釈曲線として提示した。この図の拡大版を表示するには、ここをクリックしてください。

図2:一次抗体/サンプルのインキュベーション時間の最適化:標準物質1~7について、30分から4時間の範囲の一次抗体/サンプルの異なるインキュベーション時間(抗体捕捉)から生成される平均MFIシグナル(表1に示されています)。この図の拡大版を表示するには、ここをクリックしてください。

図3:二次抗体濃度の最適化とデュアルチャネル性能 曲線は、試験済みの二次抗体濃度から生成された平均MFI(シリーズで最も高い記録値に正規化)を示しており、0.5~8μg/mLの範囲です。各インスタンスをシングルチャネルアッセイおよびデュアルチャネルアッセイの両方として実施し、実験フォーマットの違いを評価しました。 この図の拡大版を表示するには、ここをクリックしてください。

図4:二次抗体のインキュベーション時間最適化、デュアルチャネルフォーマット。 二次抗体とのインキュベーション時間に関して観察されたMFI値(シリーズで最も高い記録値に正規化された)の代表的なプロット。実験は、(A-C)IgA/IgMまたは(D-F)IgG/IgMの組み合わせとしてデュアルチャネルアッセイとして実施された。この図の拡大版を表示するには、ここをクリックしてください。

図5:デュアルチャネルアッセイの特異性評価 ブランクとして指定された各組み合わせの1つを用いたデュアルチャネルアッセイフォーマットのアッセイ結果は、クロスチャネル蛍光または干渉の欠如を例示する。 この図の拡大版を表示するには、ここをクリックしてください。
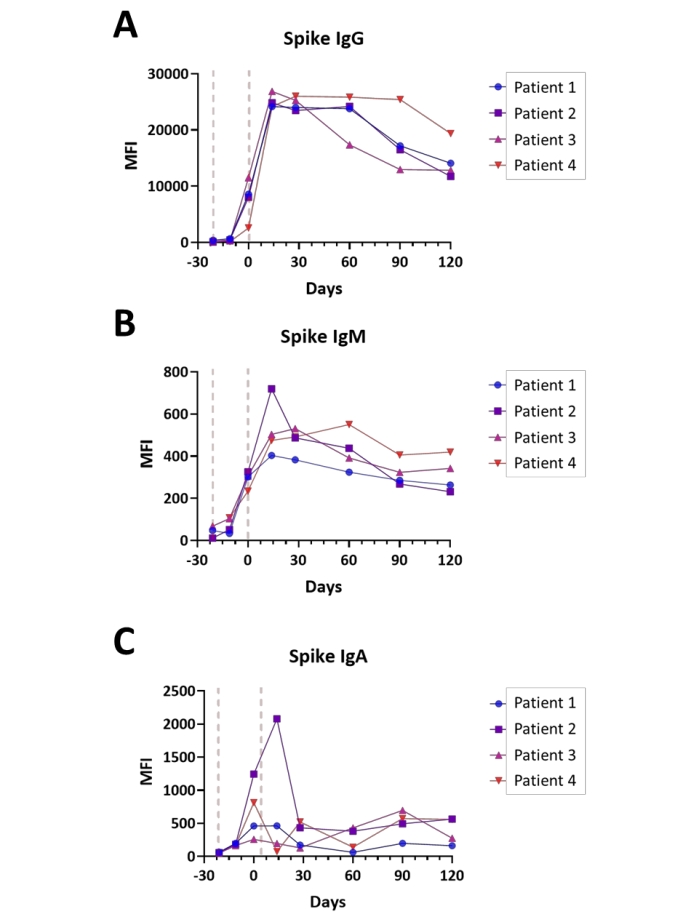
図6:Covid-19ワクチン接種後の血清変換の図。Covid-19ワクチン接種(ワクチン接種前 - 完了後4ヶ月)の期間中のスパイクS1抗原に対する(A)IgG、(B)IgM、および(C)IgA抗体の相対力価を示すプロット。時間は、ワクチン接種シリーズの完了に対して日数で示される。ワクチン投与の一般的な点が示されている(赤い線)。実験は、議定書に記載されているように、デュアルチャネルモードで実施した。この図の拡大版を表示するには、ここをクリックしてください。
| 標準番号 | 希釈シリーズ | アンチスパイク S1 または N (μg/mL) | アンチメンブレン(μg/mL) |
| 空砲 | 空砲 | - | - |
| 1 | STD7 1:1 | 1 | 5 |
| 2 | STD6 1:5 | 0.2 | 1 |
| 3 | STD5 1:25 | 0.04 | 0.2 |
| 4 | STD4 1:125 | 0.008 | 0.04 |
| 5 | STD3 1:625 | 0.0016 | 0.008 |
| 6 | STD2 1:3125 | 0.00032 | 0.0016 |
| 7 | STD1 1:15625 | 0.000064 | 0.00032 |
表1:標準曲線の希釈系列: IgG血清型の標準曲線に用いた希釈係数の表;α-スパイクS1およびα-ヌクレオカプシドでは1 μg/mL、α-メンブレン抗体では5 μg/mLから始まる7点、1:5の段階希釈曲線として提示されました。
| 分析物 | 見本 | 担当者 1 | 担当者 2 | 担当者 3 | 担当者 4 | アベニュー | ティッカー | %履歴書 |
| スパイクS1 | ティッカー | 369.4 | 356.9 | 295.2 | 271.5 | 323.3 | 47.4 | 14.6 |
| ティッカー | 3869.1 | 3437 | 3970.2 | 4240.7 | 3879.3 | 334 | 8.6 | |
| 膜 | ティッカー | 40.6 | 37.7 | 49.9 | 27.8 | 39 | 9.1 | 23.3 |
| ティッカー | 733.2 | 731.3 | 724 | 678.1 | 716.7 | 26 | 3.6 | |
| ヌクレオカプシド | ティッカー | 1746.7 | 1790.8 | 1577.3 | 1664.8 | 1694.9 | 94.2 | 5.6 |
| ティッカー | 15598.1 | 14735.5 | 18369.5 | 17408.5 | 16527.9 | 1657.7 | 10 |
表2:アッセイ内精度: 同じ実験における単一のアッセイバッチを用いた標準2(STD2)および標準5(STD5)における標準抗体混合物の4回の反復から計算されたパーセント分散係数(%CV)。反復と平均に提供される値は、観測されたMFI値を表します。
| 分析物 | 見本 | バッチ 1 | バッチ 2 | バッチ 3 | アベニュー | ティッカー | %履歴書 |
| スパイクS1 | ティッカー | 383.2 | 424.4 | 379.9 | 395.8 | 24.8 | 6.3 |
| ティッカー | 5639.7 | 6062.5 | 6384.3 | 6028.8 | 373.4 | 6.2 | |
| 膜 | ティッカー | 39.1 | 58.5 | 59.1 | 52.2 | 11.4 | 21.8 |
| ティッカー | 732.3 | 941.4 | 701.1 | 791.6 | 130.7 | 16.5 | |
| ヌクレオカプシド | ティッカー | 1342.6 | 1621 | 1718.2 | 1560.6 | 195 | 12.5 |
| ティッカー | 13543.9 | 14843.2 | 17883.4 | 15423.5 | 2227.2 | 14.4 |
表3:標準サンプルによるアッセイ間精度: パーセント分散係数(%CV)は、アッセイの3つの異なるバッチから計算し、同じ実験において標準2および標準5で評価した。反復と平均に提供される値は、観測されたMFI値を表します。
| IgG-PE | IgM-SB | IgA-PE | |||||
| アベニュー MFI | %履歴書 | アベニュー MFI | %履歴書 | アベニュー MFI | %履歴書 | ||
| スパイクS1 | 件名 1 | 8002.3 | 17.7 | 1949.5 | 1.3 | 2045.8 | 5.5 |
| 件名2 | 19155.8 | 7.3 | 918.6 | 4.1 | 1684.5 | 3.9 | |
| 科目3 | 17865.6 | 18.0 | 549.4 | 3.8 | 961.3 | 8.1 | |
| 科目4 | 11901.1 | 2.6 | 1603 | 4.8 | 8736.4 | 5.5 | |
| 科目5 | 9801.8 | 4.0 | 1014.1 | 3.0 | 2747.6 | 9.3 | |
| ヌクレオカプシド | 件名 1 | 15097.8 | 11.3 | 1049.7 | 9.9 | 5276.5 | 3.9 |
| 件名2 | 15204.3 | 12.1 | 265.9 | 5.2 | 6761.3 | 11.9 | |
| 科目3 | 18471.7 | 24.4 | 329.1 | 4.5 | 14308 | 2.9 | |
| 科目4 | 16424.7 | 3.5 | 2418.1 | 0.1 | 4234.7 | 4.2 | |
| 科目5 | 13344.9 | 3.6 | 225.6 | 10.0 | 13436.5 | 9.7 | |
| 膜 | 件名 1 | 514.6 | 8.6 | 180.6 | 14.0 | 141.2 | 9.8 |
| 件名2 | 196.8 | 5.2 | 57 | 20.7 | 55.5 | 13.0 | |
| 科目3 | 553.7 | 12.9 | 54.5 | 21.2 | 191.2 | 18.6 | |
| 科目4 | 377.9 | 3.2 | 68.1 | 22.1 | 62 | 2.3 | |
| 科目5 | 325.4 | 8.2 | 11.4 | 91.6 | 74.6 | 20.8 |
表4:ヒトサンプルとのアッセイ間精度: SARS-CoV-2感染を有する5人のヒト被験者からの血漿サンプル(500倍に希釈)で試験したアッセイの3つのバッチから計算された平均パーセント分散係数(%CV)。
| スパイクS1 | 膜 | ヌクレオカプシド | |||||
| ミリグラム/ミリリットル | アベニュー MFI | % 最大。 | アベニュー MFI | % 最大。 | アベニュー MFI | % 最大。 | |
| ティッカー | 0.5 | 186 | 13.2 | 32 | 25.2 | 132.7 | 13.6 |
| 1 | 304.2 | 21.6 | 45.8 | 36 | 194.4 | 19.9 | |
| 2 | 664.5 | 47.2 | 78.8 | 61.9 | 458.2 | 47 | |
| 4 | 1032.1 | 73.3 | 101.3 | 79.6 | 707.8 | 72.6 | |
| 8 | 1407.1 | 100 | 127.2 | 100 | 975 | 100 | |
| ティッカー | 0.5 | 809.7 | 4.9 | 27.5 | 15 | 1355.6 | 6.3 |
| 1 | 1696.9 | 10.2 | 40.6 | 22.2 | 2782.1 | 13 | |
| 2 | 4543.8 | 27.3 | 68.3 | 37.3 | 6661.2 | 31.2 | |
| 4 | 10003.5 | 60 | 110.7 | 60.5 | 12605.6 | 59 | |
| 8 | 16662.8 | 100 | 182.9 | 100 | 21360.6 | 100 | |
| イガ | 0.5 | 797.4 | 19.3 | 31.1 | 47.2 | 2056.5 | 16.1 |
| 1 | 1529.5 | 37 | 41.4 | 62.8 | 3869 | 30.4 | |
| 2 | 2261.3 | 54.7 | 48.6 | 73.3 | 6648.9 | 52.2 | |
| 4 | 2320.4 | 56.2 | 48.3 | 73.2 | 6548.1 | 51.4 | |
| 8 | 4132.2 | 100 | 65.9 | 100 | 12744.8 | 100 | |
表5:二次抗体濃度の最適化: 0.5 μg/mL ~ 8 μg/mL の範囲の異なる濃度の二次抗体から生成される平均 MFI シグナル。各信号の値は、相対的な信号の大きさを示すために、8μg/mL(「最大」)での信号の割合としても表されます。
| スパイクS1 | 膜 | ヌクレオカプシド | |||||
| インキュベーション時間(分) | アベニュー MFI | % 最大。 | アベニュー MFI | % 最大。 | アベニュー MFI | % 最大。 | |
| ティッカー | 15 | 1185 | 72.2 | 40.4 | 48.9 | 609.5 | 53.3 |
| 30 | 1416.6 | 86.3 | 58.4 | 70.7 | 894.2 | 78.2 | |
| 60 | 1324.8 | 80.7 | 73.6 | 89.1 | 945.6 | 82.7 | |
| 120 | 1641.2 | 100 | 82.6 | 100 | 1143.2 | 100 | |
| ティッカー | 15 | 12917.6 | 80.5 | 244.4 | 44.9 | 15429.8 | 80.8 |
| 30 | 14915.4 | 92.9 | 434.7 | 79.9 | 18797 | 98.5 | |
| 60 | 15340.3 | 95.6 | 421.4 | 77.5 | 18694.4 | 97.9 | |
| 120 | 16050.3 | 100 | 544 | 100 | 19085.8 | 100 | |
| イガ | 15 | 3141.9 | 78.2 | 75 | 66.8 | 9103 | 86.6 |
| 30 | 3569.1 | 88.8 | 83.9 | 74.8 | 9563.8 | 91 | |
| 60 | 3539.1 | 88 | 86 | 76.6 | 9555.7 | 90.9 | |
| 120 | 4020 | 100 | 112.2 | 100 | 10512.9 | 100 |
表6:二次抗体インキュベーション時間の最適化: 二次抗体の異なるインキュベーション時間から産生される平均MFIシグナルは、15分から120分の範囲である。各信号の値は、相対的な信号の大きさを示すために、120分における信号のパーセンテージ(「最大」)としても表されます。
ディスカッション
SARS-CoV-2曝露に対する免疫応答の評価は、RT-PCRに基づく感染状態のサーベイランスと併せて、Covid-19からの回復過程を明確にし、潜在的な治療価値を有する回復期血漿を同定し、集団規模で感染率を調査する手段として役立つ処方箋としてよく説明されている10,11。ヒト被験者における血清変換を理解するための異なる例には、タンパク質(抗原)アレイ12、イムノブロット13、迅速イムノクロマトグラフィー構築物14、および酵素結合免疫吸着アッセイ(ELISA)15、16、17が含まれる。これらの前述の技術の各々は、軽微な修飾で複数の免疫グロブリンアイソタイプを個々に評価することができる。しかし、これらの手順は、この原稿で提示されているように、複数のアイソタイプの並列分析を可能にするために実質的に再利用することができず、コストとスループットの要因を人口ベースのスケールテスト戦略におけるそれらの管理の制限としてレンダリングする。これらのアプリケーションのいくつかはまた、提示されたとおりに、または多重ELISA18、19などの改変されたフォーマットのいずれかで、複数の抗原のレベルを並列に連結する機会を提供する。最後に、イムノビーズプラットフォームは、複数の抗原のレベルを並行して評価する可能性を提供する20,21が、アッセイごとに単一のエピトープ(すなわち、免疫グロブリンアイソタイプ)に限定されていたが、「デュアルチャネル」アッセイ能力を有する最近の装置が採用されていない限り、
このレポートでは、Covid-19ワクチン接種を受けた個人の血清変換のケーススタディにおいて、「デュアルチャネル」モードで機器を使用するイムノビーズアッセイにおける複数のエピトープの信頼性の高い測定を確立するプロトコルが列挙されています。この方法は、実験室の自動化システムの統合により改善される可能性のある手動アッセイ設計を使用して、優れた精度(%CV値は通常<20%)を示しました。選択されたすべての分析物およびエピトープについてのアッセイ感度およびダイナミックレンジは、日常的な評価に適していた。市販の抗抗原IgAおよびIgM免疫試薬の欠如は、定量をIgGアイソタイプに制限したが、そのような制限は、キャリブラントとして特定の検体に対して半定量的評価または評価を提供する能力を排除するものではない22、23。
検証済みのイムノビーズアッセイは、Covid-19ワクチンで免疫された個人のコホートにおける血清変換を調査するために割り当てられました。他の同様のプラットフォームとは対照的に、インストルメンテーションファミリは、手動ワークフローで1日あたり数百人、自動スキームで1日あたり数千人の個人で血清変換の探査を可能にします。全体として、これらの知見は、「デュアルチャネル」アプローチが、同一のアッセイに対して複数のエピトープを並列に記述するための適切な感度を有し、マルチアナライトのコンテキストで実行可能であることを確認する。フィコエリスリンおよびスーパーブライト436蛍光色素でそれぞれ実施されるチャネル1およびチャネル2に対する感度の違いは、特定の実験に対して実行可能な分析結果が確実に取得されるように、特定の実験の設計を保証する可能性がある。すなわち、より低い有病率のエピトープまたは分析物に対するチャネル1の予約は、未知数の観察値を含むアッセイのダイナミックレンジを維持するために必要であり得る。この考慮事項を超えて、アッセイ設計は明白であり、分析能力が限られているラボで容易にアクセスできるはずです。図 5で述べたように、チャネル1からチャネル2への干渉を考慮する際には、この考慮事項を考慮する必要があります。したがって、存在量の多いアイソタイプからの干渉は、デュアルチャネル形式で測定した場合、存在量がはるかに低いアイソタイプに対して誤解を招く分析誤差を引き起こす可能性があります。分析物濃度が大きく異なる状況への干渉のこの可能性は、アッセイ設計段階で適切に処理されない場合、アプローチに大きな制限を表す可能性があります。
結論として、Covid-19感染またはワクチン接種に対する免疫応答に関連する主要な免疫グロブリンアイソタイプからの抗体価を迅速に測定する方法が提示された。このアプローチを縦断的に適用して血清変換を評価することで、疾患の経過を管理および/または監視したり、あるいは将来のCovid-19ブースターワクチンプログラムをガイドしたりするために、よりよく使用できる洞察が得られる可能性があります。
開示事項
ボルジア博士は、特許出願中のこの原稿で使用されている血清学的検査の発明者です。この記事は、著者の競合によってもたらされる潜在的なバイアスを避けるために統計分析が提示されていない状態でのみ記述的な方法で提示されています。
謝辞
著者らは、施設の使用に対するラッシュバイオマーカー開発コア、被験者登録と生物標本処理のためのラッシュバイオリポジトリ、ウォルダー財団のシカゴコロナウイルス評価ネットワーク(シカゴCAN)イニシアチブ助成金番号SCI16(J.R.S.およびJ.A.B.)および21-00147(J.R.S.およびJ.A.B.)およびスイムアクロスアメリカ財団(J.A.B.)からの賞に感謝したい。
資料
| Name | Company | Catalog Number | Comments |
| 384-well black side polystyrene microtiter plates | Thermo Fisher | 12-565-346 | |
| Activation buffer (0.1 M NaH2PO4, pH 6.2) | Prepared in house | ||
| Assay buffer (PBS, 1% Bovine Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| Bovine Serum Albumin, heat shock fraction | MilliporeSigma | A-7888-50G | |
| Coupling buffer (50 mM MES, pH 5.0) | Prepared in house | ||
| COVID 19 M Coronavirus Recombinant Matrix Protein (6xHis tag) | MyBioSource | MBS8574735 | |
| Disposable pipette tips | |||
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Thermo Fisher | PIA35391 | |
| Goat Albumin, Fraction V Powder | MilliporeSigma | A2514-1G | |
| IgA Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB205009 | |
| IgG Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB204009 | |
| IgG Goat anti-Rabbit, R-PE, Polyclonal | Thermo Fisher | OB403009 | |
| IgM Goat anti-Human, R-PE, Polyclonal | Thermo Fisher | OB202009 | |
| IgM Mouse anti-Human, SB 436, Clone SA-DA4 | Thermo Fisher | 62999842 | |
| Instrument Analyzer | Luminex Corp. | INTELLIFLEX-RUO | |
| Low-Bind microcentrifuge tubes (1.5 mL) | Thermo Fisher | 13-698-794 | |
| MagPlex-C Microspheres, Region XXX | Luminex Corp. | MC10XXX-01 | |
| MES hydrate (2-(N-Morpholino) ethane sulfonic acid hydrate) | MilliporeSigma | M2933 | |
| Microplate aluminum sealing tape | Thermo Fisher | 07-200-683 | |
| Polysorbate-20 | Thermo Fisher | BP337-500 | |
| Quality Biological Inc. PBS, pH 7.2 | Thermo Fisher | 50-751-7328 | |
| Quench buffer (PBS, 1% Goat Serum Albumin, 0.01% Polysorbate-20) | Prepared in house | ||
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Protein (His tag) | Sino Biologicals | 40588-V08B | |
| SARS-CoV-2 (2019-nCoV) Spike Protein (S1 Subunit, His tag) | Sino Biologicals | 40591-V08H | |
| SARS-CoV-2 (2019-nCoV) Spike RBD Antibody, Rabbit pAb | Sino Biologicals | 40592-T62 | |
| SARS-CoV-2 (2019-nCoV) Nucleocapsid Antibody, Rabbit mAb | Sino Biologicals | 40588-R0004 | |
| SARS-CoV-2 (COVID-19) Membrane Antibody (IN), Rabbit pAb | ProSci | 10-516 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Fisher | PIA39269 | |
| Wash Buffer (PBS, 0.01% Polysorbate-20) | Prepared in house | ||
| Water, LC/MS grade | Thermo Fisher | W-64 |
参考文献
- Tighe, P. J., Ryder, R. R., Todd, I., Fairclough, L. C. ELISA in the multiplex era: potentials and pitfalls. Proteomics - Clinical Applications. 9, 406-422 (2015).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments: JoVE. (65), e4084 (2012).
- Powell, R. L., et al. A multiplex microsphere-based immunoassay increases the sensitivity of siv-specific antibody detection in serum samples and mucosal specimens collected from rhesus macaques infected with SIVmac239. BioResearch Open Access. 2 (3), 171-178 (2013).
- Volpetti, F., Garcia-Cordero, J., Maerkl, S. J. A microfluidic platform for high-throughput multiplexed protein quantitation. PLoS One. 10 (2), 0117744 (2015).
- Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., Al-Nasser, A. D. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens. 9 (3), 231 (2020).
- Asif, M., Xu, Y., Xiao, F., Sun, Y. Diagnosis of COVID-19, vitality of emerging technologies and preventive measures. Chemical Engineering Journal. 423, 130189 (2021).
- La Marca, A., Capuzzo, M., Paglia, T., Roli, L., Trenti, T., Nelson, S. M. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reproductive Biomedicine Online. 41 (3), 483-499 (2020).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews. 29, 49-52 (2008).
- Tarhoni, I., et al. Relationship between circulating tumor-associated autoantibodies and clinical outcomes in advanced-stage NSCLC patients receiving PD-1/-L1 directed immune checkpoint inhibition. Journal of Immunological Methods. 490, 112956 (2021).
- Deeks, J. J., et al. Antibody tests for identification of current and past infection with SARS-CoV-2. The Cochrane Database of Systematic Reviews. 6, 013652 (2020).
- Mahalingam, S., et al. Landscape of humoral immune responses against SARS-CoV-2 in patients with COVID-19 disease and the value of antibody testing. Heliyon. 7 (4), 06836 (2021).
- Ruano-Gallego, D., et al. A multiplex antigen microarray for simultaneous IgG and IgM detection against SARS-CoV-2 reveals higher seroprevalence than reported. Microbial Biotechnology. 14 (3), 1228-1236 (2021).
- Shah, J., et al. IgG and IgM antibody formation to spike and nucleocapsid proteins in COVID-19 characterized by multiplex immunoblot assays. BMC Infectious Diseases. 21 (1), 325 (2021).
- Gambino, C. M., et al. Comparison of a rapid immunochromatographic test with a chemiluminescence immunoassay for detection of anti-SARS-CoV-2 IgM and IgG. Biochemia Medica (Zagreb). 30 (3), 030901 (2020).
- Algaissi, A., et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Scientific Reports. 10, 16561 (2020).
- Chiereghin, A., et al. Recent advances in the evaluation of serological assays for the diagnosis of SARS-CoV-2 infection and COVID-19. Frontiers in Public Health. 8, 620222 (2020).
- Nicol, T., et al. Assessment of SARS-CoV-2 serological tests for the diagnosis of COVID-19 through the evaluation of three immunoassays: Two automated immunoassays (Euroimmun and Abbott) and one rapid lateral flow immunoassay (NG Biotech). Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 129, 104511 (2020).
- Butt, J., et al. From multiplex serology to serolomics-A novel approach to the antibody response against the SARS-CoV-2 proteome. Viruses. 13 (5), 749 (2021).
- Byrum, J. R., et al. multiSero: open multiplex-ELISA platform for analyzing antibody responses to SARS-CoV-2 infection. medRxiv. , (2021).
- Dobano, C., et al. Highly sensitive and specific multiplex antibody assays to quantify immunoglobulins m, a, and g against SARS-CoV-2 antigens. Journal of Clinical Microbiology. 59 (2), 01731 (2021).
- Schultz, J. S., et al. Development and validation of a multiplex microsphere immunoassay using dried blood spots for SARS-CoV-2 seroprevalence: Application in first responders in first responders in Colorado, USA. Journal of Clinical Microbiology. 59 (6), 00290 (2021).
- Beavis, K. G., et al. Evaluation of the EUROIMMUN anti-SARS-CoV-2 ELISA assay for detection of IgA and IgG antibodies. Journal of Clinical Virology: The Official Publication of the Pan Americal Society for Clinical Virology. 129, 104468 (2020).
- Jung, J., et al. Clinical performance of a semi-quantitative assay for SARS-CoV2 IgG and SARS-CoV2 IgM antibodies. Clinica Chimica Acta: International Journal of Clinical Chemistry. 510, 790-795 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved