需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用非放射性铁同位素定量体内通过小鼠胎盘的铁转运
摘要
本文演示了如何制备和施用转铁蛋白结合的非放射性同位素铁,用于小鼠妊娠中铁转运的研究。还描述了量化胎儿胎盘区室中同位素铁的方法。
摘要
铁对怀孕期间的母体和胎儿健康至关重要,人类需要大约 1 克铁来维持健康的怀孕。胎儿铁赋完全依赖于铁在胎盘上的转移,这种转移的扰动会导致不良的妊娠结局。在小鼠中,传统上测量胎盘上的铁通量依赖于放射性铁同位素,这是一种高度敏感但繁琐的方法。稳定的铁同位素(57Fe和 58Fe)为人类妊娠研究提供了一种非放射性替代品。
在生理条件下,转铁蛋白结合的铁是胎盘吸收的主要铁形式。因此,制备 58Fe-转铁蛋白并在妊娠母体内静脉注射,以直接评估胎盘铁运输并绕过母体肠道铁吸收作为混杂变量。通过电感耦合等离子体质谱(ICP-MS)定量胎盘和小鼠胚胎组织中的同位素铁。这些方法也可以用于生理学或疾病的其他动物模型系统,以量化 体内 铁动力学。
引言
铁对各种代谢过程至关重要,包括生长发育、能量产生和氧气运输1.维持铁稳态是一个动态的协调过程。铁从十二指肠的食物中吸收,并在与铁转运蛋白转铁蛋白(Tf)结合的循环中在身体周围运输。它被每个细胞用于酶促过程,掺入新生红细胞的血红蛋白中,并通过巨噬细胞从衰老的红细胞中回收。铁过量时储存在肝脏中,并通过出血或细胞脱落从体内流失。循环中的铁量是铁的消费和供应之间平衡的结果,后者受到肝激素铁调素(HAMP)的严格调节,肝激素铁调素是铁稳态的中枢调节器1。铁调素的功能是通过阻塞或诱导泛素化和降解铁输出剂铁转运蛋白(FPN)来限制血液中铁的生物利用度2。功能性 FPN 的减少导致膳食铁吸收减少、肝脏中的铁隔离以及巨噬细胞的铁循环减少1.
铁调素受铁状态、炎症、红细胞生成驱动和妊娠的调节(综述于3)。鉴于铁稳态是高度动态的,了解和测量总铁库以及铁分布和周转非常重要。动物研究传统上依赖于放射性铁同位素,这是一种高度敏感但繁琐的方法来测量铁动力学。然而,在最近的研究中,包括这里介绍的研究4,非放射性,稳定的铁同位素(58Fe)用于测量怀孕期间的铁转运5,6,7,8,9。稳定同位素是研究营养代谢的宝贵工具(综述于10)。在人体研究中使用稳定的铁同位素表明,i)铁吸收在妊娠结束时增加5,6,ii)膳食铁向胎儿的转移取决于母体铁状态7,iii)母体摄入的血红素铁比非血红素铁更容易被胎儿吸收8,以及iv)铁转移到胎儿与母体铁调素水平8负相关,9.这些实验测量了血清中的铁同位素或其掺入红细胞;然而,单独测量红细胞中铁的测量可能会低估真正的铁吸收9。在目前的研究中,血红素和非血红素铁都在组织中测量。
在怀孕期间,需要铁来支持母体红细胞体积的扩张,并通过胎盘转移以支持胎儿的生长和发育11。胎儿铁禀赋完全依赖于铁通过胎盘的运输。在人类12和啮齿动物4,13怀孕期间,铁调素水平显着降低,增加了转移到胎儿的血浆铁的可用性。
胎盘铁转运的基本原理最初是在 1950-70 年代使用放射性示踪剂(59Fe 和 55Fe)表征的。这些研究确定铁通过胎盘的运输是单向的 14,15,并且二铁转铁蛋白是胎盘和胎儿铁的主要来源16,17。目前对胎盘铁转运的理解更为完整,尽管一些关键的铁转运蛋白和调节机制仍未知。小鼠模型对于理解铁调节和运输至关重要18,因为关键的转运蛋白和机制非常相似。人和小鼠胎盘都是血绒毛膜,即母体血液与胎儿绒毛膜直接接触19。但是,存在一些显着的结构差异。
合体滋养层是分离母体和胎儿循环并积极运输铁和其他营养物质的胎盘细胞层20。在人类中,合体滋养层是单层融合细胞。相反,小鼠胎盘由两个合体滋养层21组成,Syn-I和Syn-II。然而,Syn-I和Syn-II界面处的间隙连接允许营养物质在层22,23之间扩散。因此,这些层作为类似于人类合体滋养层的单个合胞层起作用。Rossant和Cross21回顾了人类和小鼠胎盘之间的其他异同。胎盘铁转运是由母体血液中的铁-Tf与位于合体滋养层24顶端侧的转铁蛋白受体(TfR1)结合触发的。这种相互作用通过网格蛋白介导的内吞作用诱导铁-Tf/TfR1内化25。然后,铁从酸性内体26中的Tf释放出来,通过未确定的铁还原酶还原为亚铁,并通过尚未确定的转运蛋白从内体输出到细胞质。铁如何在合体滋养层中陪伴也有待描述。铁最终由铁输出者FPN运输到胎儿侧,位于合体滋养层的基底或面向胎儿的表面上(在27中回顾)。
为了了解TfR1,FPN和铁调素的生理和病理调节如何影响胎盘铁转运,使用稳定的铁同位素定量从母体循环到体内胎盘和胚胎的铁转运4。本文介绍了制备和给予怀孕小鼠同位素铁转铁蛋白的方法,ICP-MS的组织处理以及组织中铁浓度的计算方法。体内使用稳定的铁同位素可以适用于研究铁在不同动物模型中的调节和分布,以研究生理和病理铁的调节。
研究方案
所有动物方案和实验程序均由加州大学洛杉矶分校机构动物护理和使用委员会(IACUC)批准。
1. 58Fe-Tf的制备
注意:该协议使用 58Fe;但是,相同的协议可用于 57Fe。这两种同位素都可以作为标准铁化学品使用和处理,而无需额外的预防措施。
- 将 58Fe 溶解在 12 N HCl 中,50 μL HCl/mg 的 58Fe。
- 将HCl添加到供应商提供的玻璃小瓶中的金属中,然后松散地盖上盖子。要溶解铁,请将 58Fe / HCl溶液加热至60°C1小时。如果仍未溶解,请将溶液在室温下在通风橱中放置过夜以溶解。
注意:溶解的 58Fe / HCl溶液呈黄橙色。
铁3O4 + 8HCl(水溶液) → 铁(II)氯化物 2(水溶液) + 2铁(III)氯化物 3(水溶液) + 4H2 O
- 将HCl添加到供应商提供的玻璃小瓶中的金属中,然后松散地盖上盖子。要溶解铁,请将 58Fe / HCl溶液加热至60°C1小时。如果仍未溶解,请将溶液在室温下在通风橱中放置过夜以溶解。
- 氧化任何剩余的Fe(II)Cl2 以生成Fe(III)Cl3 溶液。
- 将 58Fe / HCl溶液加热至60°C,盖上盖子以促进氧化。
- 每 50 μL 58Fe/HCl 溶液中加入 1 μL 35% H 2 O2,以进一步促进氧化。
二氯化铁2(水溶液) + O 2 + 4HCl → 4铁(III)氯化物3(水溶液) + 2H2 O
- 制备氯化铁(58Fe(III)Cl3)溶液。
- 将氯化铁溶液留在60°C的罩中,盖上盖子以蒸发样品。
注意:蒸发可能需要一到几天的时间。 - 用超纯H 2 O复溶58 Fe(III)Cl 3至100 mM,并根据步骤1.1中使用的初始金属重量(58Fe(III)Cl3的分子量为162.2)计算所需的超纯H 2O量。
- 将氯化铁溶液留在60°C的罩中,盖上盖子以蒸发样品。
- 通过在 20 mM NaHCO3 存在下以 1:5 摩尔比将 58Fe(III)Cl3 与 NTA 孵育来制备 58Fe(III)-次氮基三乙酸酯 (NTA)。
- 在 1 N NaOH 中制备 500 mM NTA。
- 制备5x转铁蛋白上样缓冲液(0.5 M HEPES,pH 7.5;0.75 M NaCl)。
- 在超纯 H2O 中制备 1 M NaHCO3。
- 向 15 mL 锥形管中加入 150 μL 100 mM 58 Fe(III)Cl3 溶液(来自步骤 1.3.2)、150 μL 在 1 N NaOH 中制备的 500 mM NTA、480 μL 超纯 H2O、200 μL 5x转铁蛋白上样缓冲液和 20 μL 1 M NaHCO3 溶液。
- 将混合物在室温下孵育5分钟。
- 用58 Fe(III)-NTA加载apo-Tf以形成58Fe-Tf。
注意:此协议改编自McCarthy和Kosman28。- 将 500 mg apo-Tf 溶解在 4 mL 的 1x Tf 上样缓冲液中。
- 在步骤1.4.4中,向含有1 mL 58Fe(III)-NTA溶液的15 mL锥形管中,加入4 mL apo-Tf溶液。
注意:这是 3:1 的摩尔比, 58Fe-NTA 与 apo-Tf。每个Tf包含2个Fe结合位点;添加了过量 的58Fe-NTA,以确保Tf满载。 - 为了允许在apo-Tf上最大负载 58Fe-NTA,请检查溶液的pH值是否为7.5,并在必要时使用NaHCO3 或HCl调节pH值。
- 在室温下孵育2.5小时。
- 去除多余的未结合 58Fe(III)-NTA并释放NTA。
- 将 58Fe-Tf溶液转移到分子量截止柱(30 kDa截止)中,并在室温下以2,500 × g 离心15分钟。
- 用 10 mL 1x 转铁蛋白上样缓冲液洗涤色谱柱,并在室温下以 2,500 × g 离心 15 分钟。重复洗涤和离心,用10mL盐水进行盐水洗涤,并在室温下以2,500× g 离心15分钟。
- 计算 58Fe-Tf的浓度。
注意:由于在步骤1.5.2中添加了过量的 58Fe,假设所有转铁蛋白都是二铁。当使用500毫克apo-Tf时,在步骤1.5.4中产生~500毫克 58Fe-Tf。- 在步骤1.6.2中测量盐水洗涤后从离心中回收的体积。
- 将500 mg除以回收的体积,以确定 58Fe-Tf溶液的浓度(以mg / mL为单位)。
- 使用0.22μm注射器过滤器对 58Fe-Tf溶液进行灭菌;储存在4°C直至准备使用。
注意:制备后1至4周使用 58Fe-Tf溶液。
2. 设置定时小鼠怀孕
- 使用6至8周龄的雌性小鼠。在交配前将动物置于低铁饮食(4 ppm铁)或标准食物(185 ppm铁)2周,并在整个怀孕期间保持动物各自的饮食。
- 选项01:通过E7.5的体重增加确认怀孕。
- 设置多个养殖笼。对于每个笼子,将 2 只雌性与 1 只雄性混合过夜;动物分离的第二天被认为是胚胎日(E)0.5。在E7.5下称量女性以确定是否怀孕。再次与体重不增的雌配雄性。
注意:在WT C57BL / 6中,E1时体重增加7.5克是怀孕的良好指标。这种方法确保植入发生在特定的16小时时间范围内,允许在同一交配期间怀孕的所有动物进行同步治疗。
- 设置多个养殖笼。对于每个笼子,将 2 只雌性与 1 只雄性混合过夜;动物分离的第二天被认为是胚胎日(E)0.5。在E7.5下称量女性以确定是否怀孕。再次与体重不增的雌配雄性。
- 选项02:通过塞子检查确认怀孕。
- 将 2 只雌性与 1 只雄性结合起来,每天检查插头以确定是否发生了交配。
注意:这种方法可能会导致交错怀孕,并且塞子的存在并不能保证怀孕。
- 将 2 只雌性与 1 只雄性结合起来,每天检查插头以确定是否发生了交配。
3.静脉内给予E17.5怀孕小鼠 58Fe-Tf
- 准备步骤1.8中的 58Fe-Tf进行注射。
- 在盐水中以35mg / mL制备 58Fe-Tf溶液;每只小鼠注射100μL。
- 用 100 μL 的 58Fe-Tf 溶液填充胰岛素注射器。
注意:每剂含有3.5毫克人58Fe-Tf(5μg58 Fe)。
- 使用异氟醚麻醉怀孕的小鼠。
- 使用带腔室的异氟醚调节剂。
- 使用以下设置:5%异氟醚,2 L / mL的O 2,2分钟。
- 通过查找对脚趾捏没有反应来确认鼠标已麻醉。
- 将眼睛润滑剂涂在眼睛表面,然后将鼠标放在加热垫上。
- 缓慢而小心地将 58Fe-Tf溶液注入眶后窦。
- 让鼠标从麻醉中恢复;在动物恢复足够的意识以维持胸骨卧位之前,不要让动物无人看管。
- 注射后六小时,通过异氟醚过量对E17.5孕妇实施安乐死。
- 进行心脏穿刺以放血小鼠作为继发性安乐死的一种形式。
- 用针将脚向下固定以稳定。
- 收集胎盘和胚胎肝脏。
- 使用无菌镊子和解剖剪刀,小心地从怀孕的小鼠身上取出子宫。切断胎盘胎盘单位,该单位包括单个胎儿和羊膜中的胎盘,羊膜囊中被子宫的一部分包围。
- 小心切开子宫和羊膜囊,不要打扰胎儿和胎盘。
- 剥开羊膜囊,取出胎儿和胎盘。
- 剪断脐带。
- 用干净的工作擦拭布吸干胎儿和胎盘,以去除多余的羊水。
- 记录整个胎盘的重量。
- 用剃须刀片将每个胎盘切成两半,将每一半放入 2.0 mL 管中,并在液氮中快速冷冻。
注意:由于 58 Fe 不需要特殊的处理预防措施和处置,因此胎盘的一半可用于 58Fe 测量,另一半可用于任何其他分析,包括通过蛋白质印迹和 qPCR 定量转铁蛋白受体 (TFR1) 和铁转运蛋白 (FPN) 表达。 - 要收集胚胎肝脏,请牺牲胚胎:使用剃须刀片迅速斩首胚胎。
注意:在E17.5中,子宫中的所有胚胎都必须单独安乐死,即使它们未用于研究。 - 将胚胎固定下来以稳定,使腹部暴露在外。
- 使用解剖剪刀,在连接脐带的地方做一个小切口,将解剖剪刀的一端插入切口,并向冠状平面进行约1/4英寸的正中平面切割。然后,进行横向平面切割以暴露胎儿肝脏。
- 用镊子取出胎肝。
- 记录整个胚胎肝脏的重量。
- 将整个胚胎肝脏放入 2 mL 管中,并在液氮中快速冷冻。
注意:或者,如果需要额外的分析,只有一部分胚胎肝脏可用于 58Fe测量。与 1.5 mL 管相比,使用 2.0 mL 管可实现更好的组织匀浆。
- 将组织无限期地储存在-80°C。
4. 通过ICP-MS进行定量铁分析的工艺组织
- 处理胎盘和胎儿肝脏以定量 非血红素铁。
- 解冻胎盘半部分和整个胎肝,并称量胎盘半部分(记录胎肝重量参见步骤3.6.12)。
- 加入 400 μL 蛋白质沉淀溶液(0.53 N HCl,5.3% TCA)。
- 使用电动均质机均质组织。
- 将样品在100°C孵育1小时。
- 将样品在室温水中冷却2分钟。
- 打开盖子以释放压力,然后再次关闭管子。
- 在室温下以17,000× g 离心10分钟以沉淀组织碎片。
- 小心地将上清液转移到新的标记管中。
- 送去样品进行 ICP-MS 分析。
- 处理胎盘和胎儿肝脏以定量 血红素铁。
注意:在步骤1中提取非血红素铁后,沉淀中剩余的铁主要是血红素。- 记录步骤4.1.7中每个颗粒的重量。
- 将沉淀在 10 mL 浓缩的 70% HNO3 中,补充有 1 mL 30% H 2 O2
注意:咨询ICP-MS核心或中心,以优化特定研究的HNO3 体积;体积将部分取决于样品重量。 - 将样品加热至200°C15分钟。
- 将样品送去进行 ICP-MS 分析。
注意:如果不需要区分血红素和非血红素铁源,并且仅测量总铁,则可以在HNO3 中消化整个组织作为第一步。
5. 数据分析
注意:ICP-MS的数据以 56铁和 58铁浓度提供,单位为ng/mL或mg,ppb(表1)。 56Fe是自然界中最丰富的铁同位素,其测量反映了整个怀孕期间胎盘/胚胎中的铁积累,而 58Fe测量反映了注射后6小时内转移的铁。
- 从测量的 58 Fe 值中减去 58Fe(占总 Fe 的 0.28%)的天然丰度。
- 计算总非血红素 58Fe。
- 计算胚胎肝脏总非血红素铁(ng),首先将步骤5.1中计算的铁浓度(ng / mL)乘以步骤4.1.2中初始处理期间的体积(mL),以估计总 58Fe。
- 通过将步骤3.6.6中测量的胎盘的总重量除以步骤4.1.1中处理的胎盘重量来计算整个胎盘中的铁量。将该值乘以步骤5.2.1中计算的总非血红素铁(ng),得到胎盘的总非血红素 58Fe含量。
- 计算总血红素 58铁。
- 首先将步骤5.1中计算的铁浓度(ng / mg)乘以步骤4.2.1中测量的颗粒重量(mg),从而计算总血红素 58Fe。
- 然后,将步骤3.5.1中测量的胎盘总重量除以步骤4.2.1中测量的胎盘沉淀的重量。将该值乘以步骤5.3.1中计算的总血红素铁(ng),得到胎盘的总血红素 58Fe含量。
- 将计算出的非血红素和血红素 58Fe值相加,以确定每个组织的总铁含量。
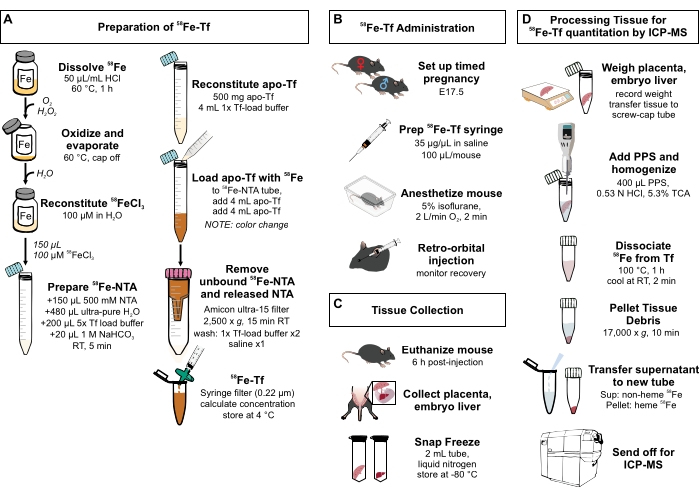
图 1:协议中步骤的可视化摘要 。 (A)制备 58铁转铁蛋白。(B) 体内 给予 58铁转铁蛋白。(三)组织采集和贮存。(D)通过ICP-MS处理胎盘和胚胎肝脏以定量金属种类。缩写:Fe = 铁;NTA = 次氮基三乙酸;Tf = 转铁蛋白;PPS = 蛋白质沉淀溶液;Sup = 上清液;TCA = 三氯乙酸;ICP-MS = 电感耦合等离子体质谱。 请点击此处查看此图的大图。
结果
早期一项使用稳定铁同位素测量铁转运的研究表明,母体缺铁导致胎盘铁输出者FPN4的下调。FPN是唯一已知的哺乳动物铁出口者,在发育过程中缺乏FPN导致胚胎在E9.529之前死亡。为了确定观察到的FPN表达降低是否在功能上转化为胎盘铁转运减少,将 58Fe-Tf静脉注射到怀孕的母亲中,并在母体缺铁的情况下量化胎盘和胚胎中的铁。
为了...
讨论
铁对许多生物过程很重要,它在体内的运动和分布是高度动态和调节的。稳定铁同位素为评估铁稳态的动力学提供了放射性同位素的一致且方便的替代方案。该方案的一个关键步骤是跟踪所有组织重量和体积。铁是一种元素,因此不能合成或分解。因此,如果仔细记录所有重量和体积,则可以通过计算来计算系统内的所有铁。如前所述,该方法可用于区分血红素和非血红素铁源。然而,如果铁形?...
披露声明
EN是Intrinsic LifeSciences和Silarus Pharma的科学联合创始人,也是Protagonist,Vifor,RallyBio,Ionis,Shield Therapeutics和Disc Medicine的顾问。VS 声明没有冲突。
致谢
作者承认在加州大学洛杉矶分校CNSI的UC纳米技术环境影响中心内使用ICP-MS设施,以协助优化 58Fe测量的协议。该研究得到了NIH国家糖尿病,消化和肾脏疾病研究所(NIDDK)(K01DK127004,至VS)和NIH国家儿童健康与人类发展研究所(NICHD)(R01HD096863,至EN)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
参考文献
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。