É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificando o transporte de ferro através da placenta de camundongo in vivo usando isótopos de ferro não radioativos
Neste Artigo
Resumo
Este artigo demonstra como preparar e administrar ferro isotópico não radioativo ligado à transferrina para estudos de transporte de ferro na gravidez de camundongos. A abordagem para quantificar o ferro isotópico em compartimentos fetoplacentários também é descrita.
Resumo
O ferro é essencial para a saúde materna e fetal durante a gravidez, com aproximadamente 1 g de ferro necessário em humanos para sustentar uma gravidez saudável. A dotação fetal de ferro é totalmente dependente da transferência de ferro através da placenta, e as perturbações dessa transferência podem levar a resultados adversos na gravidez. Em camundongos, a medição dos fluxos de ferro através da placenta tradicionalmente dependia de isótopos de ferro radioativos, uma abordagem altamente sensível, mas onerosa. Os isótopos estáveis de ferro (57Fe e 58Fe) oferecem uma alternativa não radioativa para uso em estudos de gravidez em humanos.
Sob condições fisiológicas, o ferro ligado à transferrina é a forma predominante de ferro absorvida pela placenta. Assim, 58Fe-transferrina foram preparados e injetados por via intravenosa em mães grávidas para avaliar diretamente o transporte placentário de ferro e contornar a absorção intestinal materna de ferro como uma variável de confusão. O ferro isotópico foi quantificado na placenta e nos tecidos embrionários de camundongos por espectrometria de massa plasmática indutivamente acoplada (ICP-MS). Esses métodos também podem ser empregados em outros sistemas de fisiologia ou doença de modelos animais para quantificar a dinâmica do ferro in vivo.
Introdução
O ferro é fundamental para vários processos metabólicos, incluindo crescimento e desenvolvimento, produção de energia e transporte de oxigênio1. A manutenção da homeostase do ferro é um processo dinâmico e coordenado. O ferro é absorvido dos alimentos no duodeno e transportado ao redor do corpo na circulação ligada à transferrina da proteína de transporte de ferro (Tf). É utilizado por todas as células para processos enzimáticos, incorporado à hemoglobina em eritrócitos nascentes e reciclado de eritrócitos envelhecidos por macrófagos. O ferro é armazenado no fígado quando em excesso e perdido do corpo através de hemorragia ou descamação celular. A quantidade de ferro em circulação é o resultado do equilíbrio entre o consumo e o fornecimento de ferro, sendo este último rigidamente regulado pelo hormônio hepcidina (HAMP), regulador central da homeostase do ferro1. A hepcidina funciona para limitar a biodisponibilidade de ferro no sangue, ocluindo ou induzindo ubiquitinação e degradando a ferroportina exportadora de ferro (FPN)2. A redução da NPF funcional leva à diminuição da absorção dietética de ferro, sequestro de ferro no fígado e diminuição da reciclagem de ferro dos macrófagos1.
A hepcidina é regulada pelo estado de ferro, inflamação, impulso eritropoiético e gravidez (revisada em 3). Dado que a homeostase do ferro é altamente dinâmica, é importante entender e medir o pool total de ferro e a distribuição e rotatividade de ferro. Estudos em animais tradicionalmente se baseavam em isótopos de ferro radioativos, uma abordagem altamente sensível, mas onerosa, para medir a dinâmica do ferro. Entretanto, em estudos mais recentes, incluindo o estudo aquiapresentado4, isótopos de ferro estáveis não radioativos (58Fe) são utilizados para medir o transporte de ferro durante a gestação 5,6,7,8,9. Isótopos estáveis são ferramentas valiosas para estudar o metabolismo de nutrientes (revisado em 10). O uso de isótopos estáveis de ferro em estudos em humanos demonstrou que i) a absorção de ferro aumenta no final da gestação5,6, ii) a transferência de ferro dietético para o feto é dependente do status de ferro materno7, iii) o ferro heme ingerido maternalmente é mais prontamente incorporado pelo feto do que o ferro não-heme 8, e iv) a transferência de ferro para o feto está negativamente correlacionada com os níveis maternos de hepcidina 8, 9. Esses experimentos mediram isótopos de ferro em soros ou sua incorporação em hemácias; no entanto, a medida do ferro incorporado isoladamente nas hemácias pode subestimar a verdadeira absorção de ferro9. No presente estudo, tanto o ferro heme quanto o ferro não heme são medidos nos tecidos.
Durante a gravidez, o ferro é necessário para suportar a expansão do volume de glóbulos vermelhos maternos e para a transferência através da placenta para apoiar o crescimento e desenvolvimento do feto11. A dotação fetal de ferro é totalmente dependente do transporte de ferro através da placenta. Durante a gravidez humana 12 e roedor 4,13, os níveis de hepcidina diminuem drasticamente, aumentando a disponibilidade de ferro plasmático para transferência para o feto.
Os fundamentos do transporte placentário de ferro foram inicialmente caracterizados nas décadas de 1950-70 usando traçadores radioativos (59Fe e 55Fe). Esses estudos determinaram que o transporte de ferro através da placenta é unidirecional 14,15 e que a transferrina diférrica é uma importante fonte de ferro para a placenta e o feto 16,17. A compreensão atual do transporte placentário de ferro é mais completa, embora alguns dos principais transportadores de ferro e mecanismos regulatórios permaneçam desconhecidos. Os modelos de camundongos têm sido essenciais para a compreensão da regulação e do transporte de ferro18 porque os principais transportadores e mecanismos são notavelmente semelhantes. Tanto a placenta humana quanto a de camundongo são hemocoriais, ou seja, o sangue materno está em contato direto com o córion fetal19. No entanto, existem algumas diferenças estruturais notáveis.
O sincitiotrofoblasto é a camada celular placentária que separa a circulação materna e fetal e transporta ativamente ferro e outros nutrientes20. Em humanos, o sincitiotrofoblasto é uma única camada de células fundidas. Em contraste, a placenta do rato consiste em duas camadas21 do sinciciotrofoblasto, Syn-I e Syn-II. No entanto, as junções gap na interface do Syn-I e do Syn-II permitem a difusão de nutrientes entre as camadas22,23. Assim, essas camadas funcionam como uma única camada sincicial semelhante ao sinciciotrofoblasto humano. Semelhanças e diferenças adicionais entre placentas humanas e de camundongos são revisadas por Rossant e Cross21. O transporte placentário de ferro é desencadeado pela ligação do ferro-Tf do sangue materno ao receptor de transferrina (TfR1) localizado no lado apical do sincitiotrofoblasto24. Essa interação induz a internalização ferro-Tf/TfR1 via endocitose mediada por clatrina25. O ferro é então liberado da Tf no endossomo ácido26, reduzido a ferro ferroso por uma ferrirredutase indeterminada e exportado do endossomo para o citoplasma por um transportador ainda a ser determinado. Como o ferro é acompanhado dentro do sincitiotrofoblasto também continua a ser descrito. O ferro é eventualmente transportado para o lado fetal pelo exportador de ferro, FPN, localizado na superfície basal ou voltada para o fecho do sincitiotrofoblasto (revisado em27).
Para compreender como a regulação fisiológica e patológica da TfR1, FPN e hepcidina afeta o transporte placentário de ferro, isótopos estáveis de ferro foram utilizados para quantificar o transporte de ferro da circulação materna para a placenta e embrião in vivo4. Este trabalho apresenta os métodos de preparação e administração de transferrina isotópica de ferro em ratas prenhes, processamento de tecidos para ICP-MS e cálculo das concentrações de ferro em tecidos. O uso de isótopos estáveis de ferro in vivo pode ser adaptado para investigar a regulação e distribuição de ferro em diferentes modelos animais para investigar a regulação fisiológica e patológica do ferro.
Protocolo
Todos os protocolos e procedimentos experimentais em animais foram aprovados pelo Institutional Animal Care and Use Committee (IACUC) da Universidade da Califórnia em Los Angeles.
1. Preparação de 58Fe-Tf
NOTA: O protocolo usa 58Fe; no entanto, um protocolo idêntico pode ser usado para 57Fe. Qualquer isótopo pode ser usado e descartado como um produto químico de ferro padrão sem precauções adicionais.
- Dissolver58 Fe em 12 N HCl a 50 μL de HCl/mg de 58Fe.
- Adicione HCl ao metal no frasco para injetáveis de vidro fornecido pelo vendedor e substitua a tampa frouxamente. Para dissolver o ferro, aquecer a solução de 58Fe/HCl a 60 °C durante 1 h. Se ainda não estiver dissolvido, deixe a solução durante a noite à temperatura ambiente no exaustor para se dissolver.
NOTA: A solução dissolvida de 58Fe/HCl é de cor laranja-amarelada.
Fe 3 O 4(s) + 8HCl(aq) → Fe(II)Cl 2(aq) + 2Fe(III)Cl3(aq) + 4H 2 O
- Adicione HCl ao metal no frasco para injetáveis de vidro fornecido pelo vendedor e substitua a tampa frouxamente. Para dissolver o ferro, aquecer a solução de 58Fe/HCl a 60 °C durante 1 h. Se ainda não estiver dissolvido, deixe a solução durante a noite à temperatura ambiente no exaustor para se dissolver.
- Oxidar qualquer Fe(II)Cl2 restante para gerar a solução de Fe(III)Cl3 .
- Aqueça a solução de 58Fe/HCl a 60 °C com a tampa desligada para facilitar a oxidação.
- Adicionar 1 μL de 35% H 2 O2por 50 μL de solução de 58Fe/HCl para facilitar ainda mais a oxidação.
Fe(II)Cl2(aq) + O 2 + 4HCl → 4Fe(III)Cl3(aq) + 2H2 O
- Preparar a solução de cloreto férrico (58Fe(III)Cl3).
- Deixar a solução de cloreto férrico no exaustor a 60 °C com a tampa afastada para evaporar a amostra.
NOTA: A evaporação pode demorar entre um e vários dias. - Reconstituir 58 Fe(III)Cl 3 a 100 mM com H 2 O ultrapuro e calcular a quantidade de H 2 O ultrapuro necessária com base no peso inicial do metal utilizado no passo 1.1 (o peso molecular de 58 Fe(III)Cl3 é 162.2).
- Deixar a solução de cloreto férrico no exaustor a 60 °C com a tampa afastada para evaporar a amostra.
- Preparar 58 Fe(III)-nitrilotriacetato (NTA) incubando 58Fe(III)Cl 3 com NTA numa proporção molar de 1:5 na presença de 20 mM de NaHCO3.
- Prepare NTA de 500 mM em 1 N NaOH.
- Prepare 5x tampão de carregamento de transferrina (0,5 M HEPES, pH 7,5; 0,75 M NaCl).
- Preparar 1 M NaHCO3 em ultrapuro H2O.
- A um tubo cónico de 15 ml, adicionar 150 μL de 100 mM 58 Fe(III)Cl 3 solução (a partir do passo 1.3.2), 150 μL de 500 mM NTA preparados em 1 N NaOH, 480 μL de ultrapuro H2O, 200 μL de 5xtampão de carregamento de transferrina e 20 μL de 1 M de NaHCO3 solução.
- Incubar a mistura durante 5 min à temperatura ambiente.
- Carregue apo-Tf com 58 Fe(III)-NTA para formar 58Fe-Tf.
NOTA: Este protocolo foi adaptado de McCarthy e Kosman28.- Dissolver 500 mg de apo-Tf em 4 mL de tampão de carga de 1x Tf.
- Ao tubo cónico de 15 ml no passo 1.4.4 contendo 1 ml da solução de 58Fe(III)-NTA, adicionar 4 ml de solução de apo-Tf.
NOTA: Esta é uma proporção molar de 3:1 de 58Fe-NTA com apo-Tf. Cada Tf contém 2 sítios de ligação Fe; O excesso de 58Fe-NTA foi adicionado para garantir que o Tf estivesse totalmente carregado. - Para permitir a carga máxima de 58Fe-NTA na apo-Tf, verifique se a solução está em pH 7,5 e ajuste o pH, se necessário, com NaHCO3 ou HCl.
- Incubar durante 2,5 h à temperatura ambiente.
- Remova o excesso não acoplado 58Fe(III)-NTA e liberado NTA.
- Transferir a solução de 58 Fe-Tf para uma coluna de corte de peso molecular (corte de 30 kDa) e centrifugar a 2.500× g durante 15 min à temperatura ambiente.
- Lavar a coluna com 10 mL de tampão de carga de transferrina 1x e centrifugar a 2.500 × g por 15 min à temperatura ambiente. Repetir a lavagem e centrifugação, realizar uma lavagem salina com 10 mL de solução salina e centrifugar a 2.500 × g por 15 min à temperatura ambiente.
- Calcular a concentração de 58Fe-Tf.
NOTA: Devido à adição do excesso de 58Fe no passo 1.5.2, suponha que toda a transferrina é diférrica. Como 500 mg de apo-Tf foi usado, ~ 500 mg 58Fe-Tf foi produzido na etapa 1.5.4.- Medir o volume recuperado da centrifugação após a lavagem com solução salina na etapa 1.6.2.
- Divida 500 mg pelo volume recuperado para determinar a concentração (em mg/mL) da solução de 58Fe-Tf.
- Esterilizar a solução de 58Fe-Tf utilizando um filtro de seringa de 0,22 μm; conservar a 4 °C até estarem prontas a utilizar.
NOTA: 58Fe-Tf solução foi utilizada entre 1 a 4 semanas após o preparo.
2. Configure gestações de camundongos cronometrados
- Use camundongos fêmeas de 6 a 8 semanas de idade. Coloque os animais em uma dieta pobre em ferro (4 ppm de ferro) ou ração padrão (185 ppm de ferro) por 2 semanas antes do acasalamento e mantenha os animais nas respectivas dietas durante a gravidez.
- Opção 01: Confirmar a gravidez por ganho de peso em E7.5.
- Configure várias gaiolas de reprodução. Para cada gaiola, combine 2 fêmeas com 1 macho durante a noite; o dia seguinte, quando os animais são separados, é considerado dia embrionário (E)0.5. Pesar as fêmeas em E7.5 para determinar se estão grávidas. Acasalar machos novamente com fêmeas que não ganharam peso.
NOTA: No WT C57BL/6, um ganho de peso de 1 g em E7.5 é um bom indicador de gravidez. Este método garante que a implantação ocorreu dentro de um prazo específico de 16 horas, permitindo o tratamento síncrono de todos os animais que engravidaram durante o mesmo período de acasalamento.
- Configure várias gaiolas de reprodução. Para cada gaiola, combine 2 fêmeas com 1 macho durante a noite; o dia seguinte, quando os animais são separados, é considerado dia embrionário (E)0.5. Pesar as fêmeas em E7.5 para determinar se estão grávidas. Acasalar machos novamente com fêmeas que não ganharam peso.
- Opção 02: Confirmar a gravidez por verificações de plugue.
- Combine 2 fêmeas com 1 macho e realize verificações diárias de plugue para determinar se a cópula ocorreu.
NOTA: Este método pode resultar em gravidezes escalonadas, e a presença de um plugue não garante a gravidez.
- Combine 2 fêmeas com 1 macho e realize verificações diárias de plugue para determinar se a cópula ocorreu.
3. Administrar 58Fe-Tf por via intravenosa a ratas grávidas E17.5
- Prepare 58Fe-Tf da etapa 1.8 para injeção.
- Preparar solução de 58Fe-Tf a 35 mg/mL em solução salina; injetar 100 μL por rato.
- Encha uma seringa de insulina com 100 μL da solução de 58Fe-Tf.
NOTA: Cada dose contém 3,5 mg de 58 Fe-Tf humanos (5 μg de 58Fe).
- Anestesiar uma rata grávida usando isoflurano.
- Use um regulador de isoflurano com uma câmara.
- Use as seguintes configurações: 5% de isoflurano, 2 L/mL de O 2,2 min.
- Confirme se o rato está anestesiado procurando falta de resposta a uma beliscão do dedo do pé.
- Aplique o lubrificante ocular na superfície do olho e coloque o rato numa almofada de aquecimento.
- Injete lenta e cuidadosamente a solução de 58Fe-Tf no seio retroorbital.
- Permitir que o rato se recupere da anestesia; não deixe o animal sozinho até que ele tenha recuperado a consciência suficiente para manter a retração esternal.
- Seis horas após a injeção, eutanasiar E17.5 fêmeas grávidas por overdose de isoflurano.
- Realizar uma punção cardíaca para exsanguinar o rato como uma forma de eutanásia secundária.
- Prenda os pés para baixo com agulhas para estabilização.
- Colete os fígados da placenta e do embrião.
- Usando pinça estéril e tesoura de dissecação, remova cuidadosamente o útero da rata grávida. Corte uma unidade fetal-placentária placentária, que compreende um único feto e placenta no saco amniótico cercado por uma porção do útero.
- Corte cuidadosamente o útero e o saco amniótico sem perturbar o feto e a placenta.
- Descasque o saco amniótico e remova o feto e a placenta.
- Corte o cordão umbilical.
- Limpe o feto e a placenta em uma limpeza de tarefas limpas para remover o excesso de líquido amniótico.
- Registre os pesos de toda a placenta.
- Corte cada placenta ao meio com uma lâmina de barbear, coloque cada metade em um tubo de 2,0 mL e congele rapidamente em nitrogênio líquido.
NOTA: Como o58 Fe não requer precauções especiais de manuseio e descarte, metade da placenta pode ser usada para a medição do 58Fe e a outra metade para quaisquer outras análises, incluindo a quantificação da expressão do receptor de transferrina (TFR1) e ferroportina (FPN) por western blotting e qPCR. - Para coletar fígados embrionários, sacrifique o embrião: use uma lâmina de barbear para decapitar rapidamente o embrião.
NOTA: No E17.5, todos os embriões no útero devem ser eutanasiados individualmente, mesmo que não sejam utilizados no estudo. - Prenda o embrião para estabilização, deixando o abdômen exposto.
- Usando uma tesoura de dissecção, faça uma pequena incisão onde o cordão umbilical foi anexado, insira uma extremidade da tesoura de dissecção na incisão e realize um corte plano mediano em direção ao plano coronal de cerca de 1/4 de polegada. Em seguida, realize cortes planos transversais para expor o fígado fetal.
- Use fórceps para remover o fígado fetal.
- Registre os pesos de todo o fígado embrionário.
- Coloque os fígados embrionários inteiros em tubos de 2 mL e congele-os em nitrogênio líquido.
NOTA: Alternativamente, apenas uma parte do fígado embrionário pode ser usada para a medição de 58Fe, se análises adicionais forem desejadas. O uso de tubos de 2,0 mL permite uma melhor homogeneização tecidual do que tubos de 1,5 mL.
- Conservar os tecidos indefinidamente a -80 °C.
4. Tecidos de processo para análise quantitativa de ferro por ICP-MS
- Processe a placenta e os fígados fetais para a quantificação do ferro não-heme.
- Descongele as metades placentárias e fígados fetais inteiros e pese as metades placentárias (ver passo 3.6.12 para registar os pesos hepáticos fetais).
- Adicionar 400 μL de solução de precipitação proteica (HCl 0,53 N, TCA a 5,3%).
- Homogeneize o tecido usando um homogeneizador elétrico.
- Incubar as amostras a 100 °C durante 1 h.
- Arrefecer as amostras em água à temperatura ambiente durante 2 min.
- Abra as tampas para liberar a pressão e, em seguida, feche os tubos novamente.
- Centrífuga a 17.000 × g por 10 min à temperatura ambiente para detritos de tecido de pellets.
- Transfira cuidadosamente o sobrenadante para um novo tubo rotulado.
- Envie amostras para análise ICP-MS.
- Processar a placenta e os fígados fetais para a quantificação do ferro heme.
NOTA: Após a extração de ferro não heme na etapa 1, o ferro restante no pellet é predominantemente heme.- Registar o peso de cada pellet a partir da etapa 4.1.7.
- Digerir os pellets em 10 mL de HNO3 concentrado a 70% suplementado com 1 mL de 30% H 2 O2
NOTA: Consulte o núcleo ou centro da ICP-MS para otimizar o volume de HNO3 para estudos específicos; o volume dependerá, em parte, do peso da amostra. - Aquecer as amostras a 200 °C durante 15 minutos.
- Envie as amostras para análise ICP-MS.
NOTA: Se a distinção entre fontes de ferro heme e não-heme não for necessária e apenas o ferro total for medido, o tecido inteiro pode ser digerido no HNO3 como o primeiro passo.
5. Análise dos dados
NOTA: Os dados da ICP-MS foram fornecidos como concentrações de 56Fe e 58Fe em ng/mL ou mg, ppb (Tabela 1). 56 anos Fe é o isótopo de ferro mais abundante na natureza, e sua medição reflete o acúmulo de ferro na placenta / embrião durante toda a gravidez, enquanto a medição de 58Fe reflete o ferro que foi transferido durante 6 h após a injeção.
- Subtraia a abundância natural de 58 Fe (0,28% do Fe) dos valores medidos de 58Fe.
- Calcule o total de não-heme 58Fe.
- Calcular o fígado embrionário total de ferro não-heme (ng) multiplicando primeiro a concentração de ferro (ng/mL) calculada na etapa 5.1 pelo volume (mL) durante o processamento inicial na etapa 4.1.2 para estimar o total de 58Fe.
- Calcular a quantidade de ferro em toda a placenta tomando o peso total da placenta medido no passo 3.6.6 e dividindo-o pelo peso da placenta processada no passo 4.1.1. Multiplique este valor pelo ferro não-heme total (ng) calculado no passo 5.2.1 para obter o teor total de nonheme 58Fe da placenta.
- Calcule o total de heme 58Fe.
- Calcular o heme total 58Fe multiplicando primeiro a concentração de ferro (ng/mg) calculada na etapa 5.1 pelo peso do pellet (em mg) medido na etapa 4.2.1.
- Em seguida, dividir o peso total da placenta medido na etapa 3.5.1 pelo peso do pellet de placenta medido na etapa 4.2.1. Multiplique este valor pelo ferro heme total (ng) calculado no passo 5.3.1 para obter o teor total de heme 58Fe da placenta.
- Somar os valores calculados de não-heme e heme 58Fe para determinar o teor total de ferro para cada tecido.
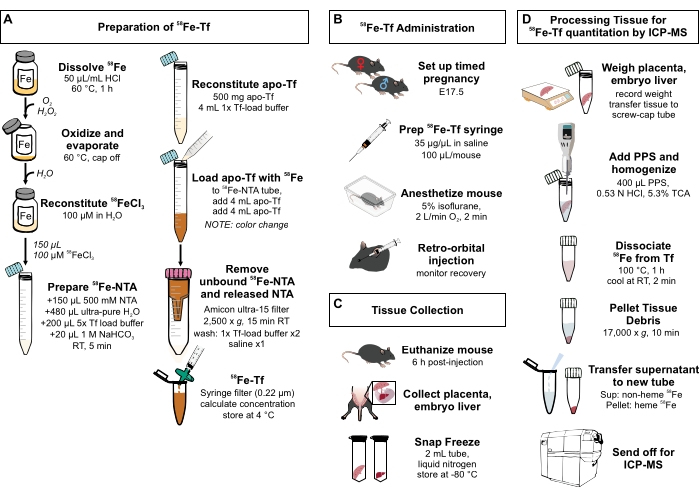
Figura 1: Resumo visual das etapas do protocolo . (A) Preparação de 58Fe-transferrina. (B) Administração in vivo de 58Fe-transferrina. (C) Coleta e armazenamento de tecidos. (D) Processamento da placenta e do fígado embrionário para quantificação de espécies metálicas por ICP-MS. Abreviaturas: Fe = ferro; NTA = ácido nitrilotriacético; Tf = transferrina; PPS = solução de precipitação proteica; Sup = sobrenadante; TCA = ácido tricloroacético; ICP-MS = espectrometria de massa de plasma indutivamente acoplado. Por favor, clique aqui para ver uma versão maior desta figura.
Resultados
Um estudo anterior usando isótopos de ferro estáveis para medir o transporte de ferro demonstrou que a deficiência materna de ferro resultou na regulação negativa do exportador de ferro da placenta, FPN4. O FPN é o único exportador de ferro de mamíferos conhecido, e a ausência de FPN durante o desenvolvimento resulta em morte embrionária antes de E9,529. Para determinar se a diminuição observada na expressão de NPF se traduziu funcionalmente em diminuição do ...
Discussão
O ferro é importante para muitos processos biológicos, e seu movimento e distribuição dentro do corpo são altamente dinâmicos e regulados. Os isótopos estáveis de ferro fornecem uma alternativa consistente e conveniente aos isótopos radioativos para a avaliação da dinâmica da homeostase do ferro. Um passo crítico no protocolo é manter o controle de todos os pesos e volumes de tecido. O ferro é um elemento e, portanto, não pode ser sintetizado nem quebrado. Assim, se todos os pesos e volumes forem cuidados...
Divulgações
EN é co-fundador científico da Intrinsic LifeSciences e da Silarus Pharma e consultor da Protagonist, Vifor, RallyBio, Ionis, Shield Therapeutics e Disc Medicine. VS declara não conflitos.
Agradecimentos
Os autores reconhecem o uso da instalação ICP-MS dentro do Centro de Implicações Ambientais da Nanotecnologia da UC no CNSI da UCLA por sua assistência na otimização do protocolo para medições de 58Fe. O estudo foi apoiado pelo NIH National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (K01DK127004, to VS) e pelo NIH National Institute of Child Health and Human Development (NICHD) (R01HD096863, to EN).
Materiais
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
Referências
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados