Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка транспорта железа через плаценту мыши In Vivo с использованием нерадиоактивных изотопов железа
В этой статье
Резюме
В данной статье показано, как получать и вводить трансферрин-связанное нерадиоактивное изотопное железо для исследований транспорта железа при беременности мышей. Описан также подход к количественной оценке изотопного железа в фетоплацентарных компартментах.
Аннотация
Железо необходимо для здоровья матери и плода во время беременности, причем примерно 1 г железа необходим людям для поддержания здоровой беременности. Обогащение железа плодом полностью зависит от переноса железа через плаценту, и возмущения этого переноса могут привести к неблагоприятным исходам беременности. У мышей измерение потоков железа через плаценту традиционно основывалось на радиоактивных изотопах железа, что является очень чувствительным, но обременительным подходом. Стабильные изотопы железа (57Fe и 58Fe) предлагают нерадиоактивную альтернативу для использования в исследованиях беременности человека.
В физиологических условиях железо, связанное с трансферрином, является преобладающей формой железа, поглощаемой плацентой. Таким образом, 58Fe-трансферрин был приготовлен и введен внутривенно беременным дамам для непосредственной оценки плацентарного транспорта железа и обхода материнской кишечной абсорбции железа в качестве смешивающей переменной. Изотопное железо количественно оценивали в эмбриональных тканях плаценты и мыши с помощью масс-спектрометрии индуктивно связанной плазмы (ICP-MS). Эти методы также могут быть использованы в других модельных системах физиологии или заболевания животных для количественной оценки динамики железа in vivo .
Введение
Железо имеет решающее значение для различных метаболических процессов, включая рост и развитие, производство энергии и транспорт кислорода1. Поддержание гомеостаза железа является динамичным, скоординированным процессом. Железо всасывается из пищи в двенадцатиперстной кишке и транспортируется по всему телу в циркуляции, связанной с транспортным белком железа трансферрином (Tf). Он используется каждой клеткой для ферментативных процессов, включается в гемоглобин в зарождающихся эритроцитах и рециркулируется из стареющих эритроцитов макрофагами. Железо хранится в печени при избытке и теряется из организма в результате кровоизлияния или шелушения клеток. Количество железа в обращении является результатом баланса между потреблением и поступлением железа, причем последнее жестко регулируется печеночным гормоном гепцидином (HAMP), центральным регулятором гомеостаза железа1. Гепцидин функционирует для ограничения биодоступности железа в крови путем закупорки или индуцирования убиквитинирования и деградации ферропортина экспортера железа (FPN)2. Снижение функционального FPN приводит к снижению всасывания железа с пищей, секвестрации железа в печени и снижению рециркуляции железа из макрофагов1.
Гепцидин регулируется статусом железа, воспалением, эритропоэтическим драйвом и беременностью (рассмотрено в 3). Учитывая, что гомеостаз железа очень динамичен, важно понимать и измерять общий пул железа, а также распределение и оборот железа. Исследования на животных традиционно опирались на радиоактивные изотопы железа, очень чувствительный, но обременительный подход к измерению динамики железа. Однако в более поздних исследованиях, включая представленное здесьисследование 4, нерадиоактивные, стабильные изотопы железа (58Fe) используются для измерения транспорта железа во время беременности 5,6,7,8,9. Стабильные изотопы являются ценными инструментами для изучения метаболизма питательных веществ (рассмотрено в 10). Использование стабильных изотопов железа в исследованиях на людях показало, что i) абсорбция железа увеличивается к концу беременности 5,6, ii) перенос пищевого железа плоду зависит от материнского статуса железа7, iii) гемовое железо, принимаемое матерью, легче включается плодом, чем негемовое железо8, и iv) перенос железа плоду отрицательно коррелирует с материнскими уровнями гепцидина8, См. 9. В ходе этих экспериментов измеряли изотопы железа в сыворотках или их включение в эритроциты; однако измерение железа, включенного только в эритроциты, может недооценивать истинное поглощение железа9. В текущем исследовании в тканях измеряется как гемовое, так и негемовое железо.
Во время беременности железо требуется для поддержки расширения объема материнских эритроцитов и для передачи через плаценту для поддержки роста и развития плода11. Содержание железа у плода полностью зависит от транспорта железа через плаценту. Во время12-летней беременности человека игрызуна 4,13 уровень гепцидина резко снижается, повышая доступность железа в плазме для передачи плоду.
Основы переноса плацентарного железа были первоначально охарактеризованы в 1950-70-х годах с использованием радиоактивных индикаторов (59Fe и 55Fe). Эти исследования определили, что транспорт железа через плаценту однонаправленный14,15 и что диферрический трансферрин является основным источником железа для плаценты и плода16,17. Нынешнее понимание переноса плацентарного железа является более полным, хотя некоторые ключевые транспортеры железа и регулирующие механизмы остаются неизвестными. Мышиные модели были важны для понимания регулирования и транспортировки железа18, потому что ключевые транспортеры и механизмы удивительно похожи. И человеческие, и мышиные плаценты гемохориальные, то есть материнская кровь находится в непосредственном контакте с хорионом плода19. Тем не менее, есть некоторые заметные структурные различия.
Синцитиотрофобласт представляет собой слой плацентарных клеток, который разделяет материнский и фетальный кровоток и активно транспортирует железо и другие питательные вещества20. У человека синцитиотрофобласт представляет собой один слой сросшихся клеток. Напротив, плацента мыши состоит из двух синцитиотрофобластных слоев21, Syn-I и Syn-II. Однако щелевые соединения на границе раздела Syn-I и Syn-II позволяют диффузию питательных веществ между слоями 22,23. Таким образом, эти слои функционируют как единый синцитиальный слой, похожий на синцитиотрофобласт человека. Дополнительные сходства и различия между плацентами человека и мыши рассматриваются Rossant и Cross21. Плацентарный транспорт железа запускается связыванием железа-Tf из материнской крови с рецептором трансферрина (TfR1), локализованным на апикальной стороне синцитиотрофобласта24. Это взаимодействие индуцирует интернализацию железа-Tf/TfR1 через клатрин-опосредованный эндоцитоз25. Затем железо высвобождается из Tf в кислой эндосоме26, восстанавливается до двухвалентного железа неопределенной ферриредуктазой и экспортируется из эндосомы в цитоплазму еще не определенным транспортером. Как железо сопровождается синцитиотрофобластом, также еще предстоит описать. Железо в конечном итоге транспортируется на сторону плода экспортером железа, FPN, локализованным на базальной или обращенной к плоду поверхности синцитиотрофобласта (рассмотрено в27).
Чтобы понять, как физиологическая и патологическая регуляция TfR1, FPN и гепцидина влияет на плацентарный транспорт железа, были использованы стабильные изотопы железа для количественного определения транспорта железа из материнского кровообращения в плаценту и эмбрион in vivo4. В данной работе представлены методы получения и введения изотопного железа-трансферрина беременным мышам, обработки тканей для ICP-MS и расчета концентраций железа в тканях. Использование стабильных изотопов железа in vivo может быть адаптировано для исследования регуляции и распределения железа на различных животных моделях для изучения физиологической и патологической регуляции железа.
протокол
Все протоколы и экспериментальные процедуры для животных были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Калифорнийского университета в Лос-Анджелесе.
1. Подготовка 58Fe-Tf
ПРИМЕЧАНИЕ: Протокол использует 58Fe; однако идентичный протокол может быть использован для 57Fe. Любой изотоп может быть использован и утилизирован в качестве стандартного химического вещества железа без дополнительных мер предосторожности.
- Растворить 58Fe в 12 N HCl при 50 мкл HCl/мг 58Fe.
- Добавьте HCl к металлу в стеклянном флаконе, поставляемом продавцом, и замените колпачок свободно. Для растворения железа нагревают раствор 58Fe/HCl до 60 °C в течение 1 ч. Если раствор еще не растворен, оставьте раствор на ночь при комнатной температуре в вытяжке для растворения.
ПРИМЕЧАНИЕ: Растворенный раствор 58Fe/HCl желтовато-оранжевого цвета.
Fe3O4(s) + 8HCl(aq) → Fe(II)Cl2(aq) + 2Fe(III)Cl3(aq) + 4H2O
- Добавьте HCl к металлу в стеклянном флаконе, поставляемом продавцом, и замените колпачок свободно. Для растворения железа нагревают раствор 58Fe/HCl до 60 °C в течение 1 ч. Если раствор еще не растворен, оставьте раствор на ночь при комнатной температуре в вытяжке для растворения.
- Окисляют любые оставшиеся Fe(II)Cl2 для получения раствора Fe(III)Cl3.
- Разогрейте раствор 58Fe/HCl до 60 °C с выключенным колпачком для облегчения окисления.
- Добавьте 1 мкл 35% H2O2 на 50 мкл раствора 58Fe/HCl для дальнейшего облегчения окисления.
Fe(II)Cl2(aq) + O2 + 4HCl → 4Fe(III)Cl3(aq) + 2H2O
- Готовят раствор хлорида железа (58Fe(III)Cl3).
- Оставьте раствор хлорида железа в вытяжке при температуре 60 °C, сняв крышку, чтобы испарить образец.
ПРИМЕЧАНИЕ: Испарение может занять от одного до нескольких дней. - Восстановите 58Fe(III)Cl3 до 100 мМ со сверхчистымH2O и рассчитайте необходимое количество сверхчистогоH2O на основе исходной массы металла, используемой на этапе 1.1 (молекулярная масса 58Fe(III)Cl3 составляет 162,2).
- Оставьте раствор хлорида железа в вытяжке при температуре 60 °C, сняв крышку, чтобы испарить образец.
- Получают 58Fe(III)-нитрилотриацетат (NTA) путем инкубации 58Fe(III)Cl3 с NTA при молярном соотношении 1:5 в присутствии 20 мМ NaHCO3.
- Приготовьте 500 мМ NTA в 1 N NaOH.
- Подготовьте 5-кратный буфер трансферрин-нагрузки (0,5 М HEPES, рН 7,5; 0,75 М NaCl).
- Готовят 1 М NaHCO3 в сверхчистомH2O.
- К конической трубке объемом 15 мл добавляют 150 мкл 100 мМ 58Fe(III)Cl3 раствора (со стадии 1,3.2), 150 мкл 500 мМ НТА, приготовленного в 1 Н NaOH, 480 мкл сверхчистогоH2O, 200 мкл 5x трансферринового нагрузочного буфера и 20 мкл 1 М Раствор NaHCO3 .
- Инкубировать смесь в течение 5 мин при комнатной температуре.
- Загрузите апо-Tf с 58Fe(III)-NTA с образованием 58Fe-Tf.
ПРИМЕЧАНИЕ: Этот протокол был адаптирован из McCarthy and Kosman28.- Растворить 500 мг апо-Tf в 4 мл 1x Tf-нагрузочного буфера.
- К конической трубке объемом 15 мл на стадии 1.4.4, содержащей 1 мл раствора 58Fe(III)-NTA, добавляют 4 мл раствора апо-Tf.
ПРИМЕЧАНИЕ: Это молярное соотношение 3:1 58Fe-NTA с апо-Tf. Каждый Tf содержит 2 сайта связывания Fe; избыток 58Fe-NTA был добавлен для обеспечения полной загрузки Tf. - Чтобы обеспечить максимальную нагрузку 58Fe-NTA на apo-Tf, проверьте, что раствор находится при pH 7,5, и при необходимости отрегулируйте pH с помощью NaHCO3 или HCl.
- Инкубировать в течение 2,5 ч при комнатной температуре.
- Удалите избыток несвязанного 58Fe(III)-NTA и освободите NTA.
- Перенесите раствор 58Fe-Tf в отсечную колонну с молекулярной массой (отсечка 30 кДа) и центрифугу при 2 500 × г в течение 15 мин при комнатной температуре.
- Промывайте колонну 10 мл 1x трансферрин-нагрузочного буфера и центрифуги при 2 500 × г в течение 15 мин при комнатной температуре. Повторите промывку и центрифугирование, выполните солевой промывкой с 10 мл физиологического раствора и центрифугируйте при 2 500 × г в течение 15 мин при комнатной температуре.
- Рассчитывают концентрацию 58Fe-Tf.
ПРИМЕЧАНИЕ: В связи с добавлением превышения 58Fe на этапе 1.5.2 предположим, что весь трансферрин является диферерным. Поскольку использовалось 500 мг апо-Tf, на стадии 1.5.4 было получено ~ 500 мг 58Fe-Tf.- Измерьте объем, полученный в результате центрифугирования после солевой промывки на этапе 1.6.2.
- Разделите 500 мг на восстановленный объем, чтобы определить концентрацию (в мг/мл) раствора 58Fe-Tf.
- Стерилизовать раствор 58Fe-Tf с помощью шприцевого фильтра 0,22 мкм; хранить при температуре 4 °C до готовности к использованию.
ПРИМЕЧАНИЕ: 58растворОв Fe-Tf использовали через 1-4 недели после подготовки.
2. Настройка приуроченной мышиной беременности
- Используйте 6-8-недельных самок мышей. Поместите животных на диету с низким содержанием железа (4 ppm железа) или стандартный чау (185 ppm железа) в течение 2 недель до спаривания и поддерживайте животных на соответствующих диетах на протяжении всей беременности.
- Вариант 01: Подтвердить беременность по увеличению веса при Е7,5.
- Установите несколько гнездовых клеток. Для каждой клетки объедините 2 самки с 1 самцом на ночь; следующий день, когда животные разделены, считается эмбриональным днем (E)0,5. Взвешивайте самок на E7.5, чтобы определить, беременна ли она. Спаривайте самцов снова с самками, которые не набрали вес.
ПРИМЕЧАНИЕ: При WT C57BL/6 увеличение веса на 1 г при E7.5 является хорошим показателем беременности. Этот метод гарантирует, что имплантация произошла в течение определенного 16-часового периода времени, что позволяет синхронно лечить всех животных, которые забеременели в течение одного и того же периода спаривания.
- Установите несколько гнездовых клеток. Для каждой клетки объедините 2 самки с 1 самцом на ночь; следующий день, когда животные разделены, считается эмбриональным днем (E)0,5. Взвешивайте самок на E7.5, чтобы определить, беременна ли она. Спаривайте самцов снова с самками, которые не набрали вес.
- Вариант 02: Подтвердите беременность с помощью проверок штепсельной вилки.
- Объедините 2 самки с 1 самцом и выполняйте ежедневные проверки пробок, чтобы определить, произошло ли совокупление.
ПРИМЕЧАНИЕ: Этот метод может привести к ступенчатой беременности, а наличие пробки не гарантирует беременность.
- Объедините 2 самки с 1 самцом и выполняйте ежедневные проверки пробок, чтобы определить, произошло ли совокупление.
3. Вводите 58Fe-Tf внутривенно беременным мышам E17.5
- Подготовьте 58Fe-Tf из шага 1.8 для инъекций.
- Приготовить 58fe-Tf раствора по 35 мг/мл в физиологическом растворе; ввести 100 мкл на мышь.
- Заполните инсулиновый шприц 100 мкл раствора 58Fe-Tf.
ПРИМЕЧАНИЕ: Каждая доза содержит 3,5 мг человеческого 58Fe-Tf (5 мкг 58Fe).
- Обезболить беременную мышь с помощью изофлурана.
- Используйте изофлурановый регулятор с камерой.
- Используйте следующие настройки: 5% изофлурана, 2 л/мл O2, 2 мин.
- Убедитесь, что мышь обезболена, выполнив поиск отсутствия реакции на защемление пальца ноги.
- Нанесите глазную смазку на поверхность глаза и поместите мышь на грелку.
- Медленно и осторожно вводят раствор 58Fe-Tf в ретроорбитальный синус.
- Дайте мыши восстановиться после анестезии; не оставляйте животное без присмотра до тех пор, пока оно не придет в достаточное сознание для поддержания грудинного покоя.
- Через шесть часов после инъекции усыпляют беременных женщин Е17,5 путем передозировки изофлурана.
- Выполните пункцию сердца, чтобы обесценить мышь как форму вторичной эвтаназии.
- Прижмите стопы вниз иглами для стабилизации.
- Соберите плаценту и эмбрион печени.
- Используя стерильные щипцы и рассеченные ножницы, осторожно удалите матку у беременной мыши. Отрежьте плацентарную фетально-плацентарную единицу, которая состоит из одного плода и плаценты в амниотическом мешке, окруженном частью матки.
- Тщательно прорежьте матку и околоплодный мешок, не нарушая плод и плаценту.
- Очистите околоплодный мешок и удалите плод и плаценту.
- Перережьте пуповину.
- Промокните плод и плаценту на чистой салфетке, чтобы удалить лишнюю амниотическую жидкость.
- Запишите веса всей плаценты.
- Разрежьте каждую плаценту пополам лезвием бритвы, поместите каждую половинку в пробирку объемом 2,0 мл и заморозьте в жидком азоте.
ПРИМЕЧАНИЕ: Поскольку 58Fe не требует особых мер предосторожности при обращении и утилизации, половина плаценты может быть использована для измерения 58Fe, а другая половина для любых других анализов, включая количественное определение экспрессии рецептора трансферрина (TFR1) и ферропортина (FPN) путем вестерн-блоттинга и qPCR. - Чтобы собрать печень эмбриона, принесите эмбрион в жертву: используйте лезвие бритвы, чтобы быстро обезглавить эмбрион.
ПРИМЕЧАНИЕ: При E17.5 все эмбрионы в матке должны быть усыплены индивидуально, даже если они не используются в исследовании. - Зафиксируйте эмбрион для стабилизации, оставив брюшную полость открытой.
- Используя ножницы для рассечения, сделайте небольшой разрез, где была прикреплена пуповина, вставьте один конец ножниц для рассечения в разрез и выполните средний разрез плоскости к корональной плоскости примерно на 1/4 дюйма. Затем выполните поперечные плоские разрезы, чтобы обнажить печень плода.
- Используйте щипцы для удаления печени плода.
- Запишите вес всей печени эмбриона.
- Поместите всю печень эмбриона в пробирки по 2 мл и заморозьте их в жидком азоте.
ПРИМЕЧАНИЕ: Альтернативно, только часть печени эмбриона может быть использована для измерения 58Fe, если требуется дополнительный анализ. Использование пробирок объемом 2,0 мл позволяет лучше гомогенизировать ткани, чем пробирки объемом 1,5 мл.
- Хранить ткани неограниченное время при -80 °C.
4. Технологические ткани для количественного анализа железа методом ICP-MS
- Обработайте плаценты и печень плода для количественного определения негемового железа.
- Разморозьте плацентарные половинки и целую печень плода, а также взвесьте половинки плаценты (см. шаг 3.6.12 для регистрации веса печени плода).
- Добавьте 400 мкл раствора осаждения белка (0,53 N HCl, 5,3% TCA).
- Гомогенизировать ткань с помощью электрического гомогенизатора.
- Инкубируйте образцы при температуре 100 °C в течение 1 ч.
- Охладите образцы в воде комнатной температуры в течение 2 мин.
- Откройте колпачки, чтобы снять давление, затем снова закройте трубки.
- Центрифуга на 17 000 × г в течение 10 мин при комнатной температуре до гранулированного тканевого мусора.
- Осторожно перенесите супернатант на новую маркированную трубку.
- Отправляйте образцы на анализ ICP-MS.
- Обработайте плаценты и печень плода для количественного определения гем-железа.
ПРИМЕЧАНИЕ: После экстракции негемового железа на стадии 1 железо, оставшееся в окатыше, представляет собой преимущественно гем.- Запишите вес каждой гранулы с этапа 4.1.7.
- Переварить гранулы в 10 мл концентрированного 70% HNO3 с добавлением 1 мл 30% H2O2
ПРИМЕЧАНИЕ: Проконсультируйтесь с ядром или центром МСП-МС для оптимизации объема HNO3 для конкретных исследований; объем будет частично зависеть от веса образца. - Нагревайте образцы до 200 °C в течение 15 мин.
- Отправьте образцы на анализ ICP-MS.
ПРИМЕЧАНИЕ: Если различие между гемовыми и негемовыми источниками железа не требуется и измеряется только общее количество железа, вся ткань может быть переварена в HNO3 в качестве первого шага.
5. Анализ данных
ПРИМЕЧАНИЕ: Данные МСП-МС были представлены в виде концентраций 56Fe и 58Fe в нг/мл или мг, ppb (таблица 1). 56 См. Fe является наиболее распространенным изотопом железа в природе, и его измерение отражает накопление железа в плаценте / эмбрионе в течение всей беременности, тогда как измерение 58Fe отражает железо, которое было перенесено в течение 6 ч после инъекции.
- Вычтите естественное содержание 58Fe (0,28% от общего Fe) из измеренных 58значений Fe.
- Вычислить общее число негемов 58Fe.
- Рассчитайте общее количество негемового железа в печени эмбриона (нг) путем предварительного умножения концентрации железа (нг/мл), рассчитанной на стадии 5.1, на объем (мл) во время первоначальной обработки на стадии 4.1.2 для оценки общего числа 58Fe.
- Рассчитайте количество железа во всей плаценте, взяв общую массу плаценты, измеренную на этапе 3.6.6, и разделив ее на вес плаценты, обработанной на этапе 4.1.1. Умножьте это значение на общее содержание негемового железа (нг), рассчитанное на этапе 5.2.1, чтобы получить общее содержание негемы 58Fe в плаценте.
- Рассчитайте общий гем 58Fe.
- Рассчитать общий гем 58Fe путем предварительного умножения концентрации железа (нг/мг), рассчитанной на стадии 5.1, на массу окатыша (в мг), измеренную на стадии 4.2.1.
- Затем разделите общую массу плаценты, измеренную на этапе 3.5.1, на массу гранул плаценты, измеренную на стадии 4.2.1. Умножьте это значение на общее содержание гемового железа (нг), рассчитанное на этапе 5.3.1, чтобы получить общее содержание гема 58Fe в плаценте.
- Суммируйте рассчитанные значения nonheme и heme 58Fe, чтобы определить общее содержание железа для каждой ткани.
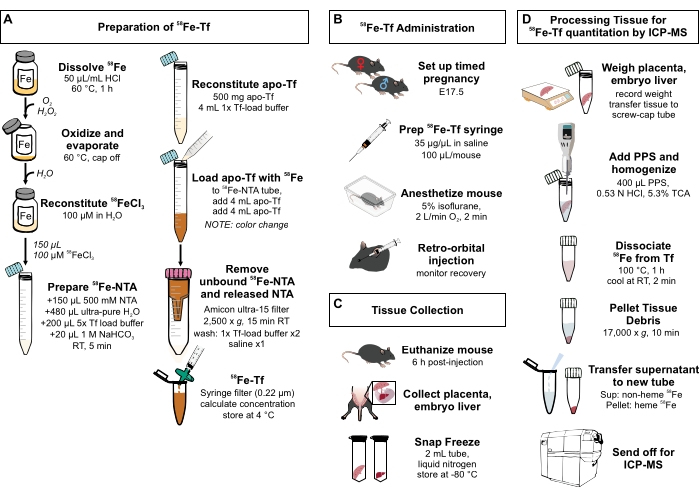
Рисунок 1: Визуальное резюме шагов в протоколе. (A) Подготовка 58Fe-трансферрина. (B) In vivo введение 58Fe-трансферрина. (C) Сбор и хранение тканей. D) обработка печени плаценты и эмбриона для количественного определения видов металлов с помощью МСП-МС. Сокращения: Fe = железо; NTA = нитрилотриацетовая кислота; Tf = трансферрин; PPS = раствор осаждения белка; Sup = супернатант; TCA = трихлоруксусная кислота; ICP-MS = масс-спектрометрия плазменной с индуктивной связью. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Более раннее исследование с использованием стабильных изотопов железа для измерения переноса железа показало, что дефицит железа у матери приводит к снижению регуляции экспортера плацентного железа, FPN4. FPN является единственным известным экспортером железа млекопитающи...
Обсуждение
Железо важно для многих биологических процессов, а его движение и распределение в организме очень динамичны и регулируются. Стабильные изотопы железа обеспечивают последовательную и удобную альтернативу радиоактивным изотопам для оценки динамики гомеостаза железа. Критическим шаго...
Раскрытие информации
EN является научным соучредителем Intrinsic LifeSciences и Silarus Pharma и консультантом Protagonist, Vifor, RallyBio, Ionis, Shield Therapeutics и Disc Medicine. VS объявляет об отсутствии конфликтов.
Благодарности
Авторы признают использование объекта ICP-MS в Центре экологических последствий нанотехнологий Калифорнийского университета в CNSI в UCLA для их помощи в оптимизации протокола для измерений 58Fe. Исследование было поддержано Национальным институтом диабета и заболеваний пищеварительной системы и почек NIH (NIDDK) (K01DK127004, для VS) и Nih National Institute of Child Health and Human Development (NICHD) (R01HD096863, to EN).
Материалы
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
Ссылки
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены