Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación del transporte de hierro a través de la placenta del ratón in vivo utilizando isótopos de hierro no radiactivos
En este artículo
Resumen
Este artículo demuestra cómo preparar y administrar hierro isotópico no radiactivo unido a transferrina para estudios de transporte de hierro en el embarazo de ratón. También se describe el enfoque para cuantificar el hierro isotópico en compartimentos fetoplacentarios.
Resumen
El hierro es esencial para la salud materna y fetal durante el embarazo, con aproximadamente 1 g de hierro necesario en los seres humanos para mantener un embarazo saludable. La dotación de hierro fetal depende completamente de la transferencia de hierro a través de la placenta, y las perturbaciones de esta transferencia pueden conducir a resultados adversos del embarazo. En ratones, la medición de los flujos de hierro a través de la placenta tradicionalmente se basó en isótopos radiactivos de hierro, un enfoque altamente sensible pero oneroso. Los isótopos estables de hierro (57Fe y 58Fe) ofrecen una alternativa no radiactiva para su uso en estudios de embarazo humano.
En condiciones fisiológicas, el hierro unido a transferrina es la forma predominante de hierro absorbido por la placenta. Por lo tanto, 58Fe-transferrina se preparó e inyectó por vía intravenosa en madres embarazadas para evaluar directamente el transporte de hierro placentario y evitar la absorción intestinal materna de hierro como una variable de confusión. El hierro isotópico se cuantificó en la placenta y los tejidos embrionarios de ratón mediante espectrometría de masas de plasma acoplado inductivamente (ICP-MS). Estos métodos también se pueden emplear en otros sistemas modelo animales de fisiología o enfermedad para cuantificar la dinámica del hierro in vivo .
Introducción
El hierro es crítico para diversos procesos metabólicos, incluyendo el crecimiento y el desarrollo, la producción de energía y el transporte de oxígeno1. El mantenimiento de la homeostasis del hierro es un proceso dinámico y coordinado. El hierro se absorbe de los alimentos en el duodeno y se transporta por todo el cuerpo en la circulación unida a la proteína transportadora de hierro transferrina (Tf). Es utilizado por cada célula para procesos enzimáticos, incorporado a la hemoglobina en eritrocitos nacientes, y reciclado de eritrocitos envejecidos por macrófagos. El hierro se almacena en el hígado cuando está en exceso y se pierde del cuerpo a través de hemorragia o desprendimiento celular. La cantidad de hierro en circulación es el resultado del equilibrio entre el consumo y el suministro de hierro, este último estrechamente regulado por la hormona hepática hepcidina (HAMP), el regulador central de la homeostasis del hierro1. La hepcidina funciona para limitar la biodisponibilidad del hierro en la sangre al ocluir o inducir ubiquitinación y degradar el ferroportina exportadora de hierro (FPN)2. La reducción de la FPN funcional conduce a una disminución de la absorción de hierro en la dieta, el secuestro de hierro en el hígado y la disminución del reciclaje de hierro de los macrófagos1.
La hepcidina está regulada por el estado del hierro, la inflamación, el impulso eritropoyético y el embarazo (revisado en 3). Dado que la homeostasis del hierro es altamente dinámica, es importante comprender y medir la reserva total de hierro y la distribución y rotación del hierro. Los estudios en animales tradicionalmente se basaban en isótopos radiactivos de hierro, un enfoque altamente sensible pero oneroso para medir la dinámica del hierro. Sin embargo, en estudios más recientes, incluyendo el estudio presentado aquí4, se utilizan isótopos de hierro estables y no radiactivos (58Fe) para medir el transporte de hierro durante el embarazo 5,6,7,8,9. Los isótopos estables son herramientas valiosas para estudiar el metabolismo de los nutrientes (revisado en 10). El uso de isótopos estables de hierro en estudios en humanos demostró que i) la absorción de hierro aumenta hacia el final de la gestación5,6, ii) la transferencia de hierro en la dieta al feto depende del estado de hierro materno7, iii) el hierro hemo ingerido maternamente es más fácilmente incorporado por el feto que el hierro no hemo 8, y iv) la transferencia de hierro al feto se correlaciona negativamente con los niveles de hepcidina materna 8, 9. Estos experimentos midieron isótopos de hierro en sueros o su incorporación en glóbulos rojos; sin embargo, la medición del hierro incorporado en los glóbulos rojos por sí sola puede subestimar la verdadera absorción de hierro9. En el estudio actual, tanto el hierro hemo como el no hemo se miden en los tejidos.
Durante el embarazo, el hierro es necesario para apoyar la expansión del volumen de glóbulos rojos maternos y para la transferencia a través de la placenta para apoyar el crecimiento y desarrollo del feto11. La dotación de hierro fetal depende totalmente del transporte de hierro a través de la placenta. Durante el embarazo humano 12 y roedor 4,13, los niveles de hepcidina disminuyen drásticamente, aumentando la disponibilidad de hierro plasmático para la transferencia al feto.
Los fundamentos del transporte de hierro placentario se caracterizaron inicialmente en los años 1950-70 utilizando trazadores radiactivos (59Fe y 55Fe). Estos estudios determinaron que el transporte de hierro a través de la placenta es unidireccional 14,15 y que la transferrina diférrica es una fuente importante de hierro para la placenta y el feto 16,17. La comprensión actual del transporte de hierro placentario es más completa, aunque algunos transportadores de hierro clave y mecanismos reguladores siguen siendo desconocidos. Los modelos de ratón han sido esenciales para comprender la regulación y el transporte del hierro18 porque los transportadores y mecanismos clave son notablemente similares. Tanto la placenta humana como la del ratón son hemocoriales, es decir, la sangre materna está en contacto directo con el corion fetal19. Sin embargo, hay algunas diferencias estructurales notables.
El sincitiotrofoblasto es la capa celular placentaria que separa la circulación materna y fetal y transporta activamente hierro y otros nutrientes20. En los seres humanos, el sincitiotrofoblasto es una sola capa de células fusionadas. En contraste, la placenta del ratón consiste en dos capas21 de sincitiotrofoblasto, Syn-I y Syn-II. Sin embargo, las uniones de brecha en la interfaz de Syn-I y Syn-II permiten la difusión de nutrientes entre las capas22,23. Por lo tanto, estas capas funcionan como una sola capa sincitial similar al sincitiotrofoblasto humano. Las similitudes y diferencias adicionales entre la placenta humana y la de ratón son revisadas por Rossant y Cross21. El transporte placentario de hierro es desencadenado por la unión de hierro-Tf de la sangre materna al receptor de transferrina (TfR1) localizado en el lado apical del sincitiotrofoblasto24. Esa interacción induce la internalización hierro-Tf/TfR1 por vía endocitosis mediada por clatrina25. El hierro se libera de Tf en el endosomaácido 26, se reduce a hierro ferroso por una ferrireductasa indeterminada, y se exporta del endosoma al citoplasma por un transportador aún por determinar. También queda por describir cómo se acompaña el hierro dentro del sincitiotrofoblasto. El hierro es finalmente transportado al lado fetal por el exportador de hierro, FPN, localizado en la superficie basal o fetal del sincitiotrofoblasto (revisado en27).
Para comprender cómo la regulación fisiológica y patológica de TfR1, FPN y hepcidina afecta el transporte de hierro placentario, se utilizaron isótopos estables de hierro para cuantificar el transporte de hierro desde la circulación materna hasta la placenta y el embrión in vivo4. Este artículo presenta los métodos para preparar y administrar transferrina de hierro isotópica a ratones preñados, procesamiento de tejidos para ICP-MS y cálculo de concentraciones de hierro en tejidos. El uso de isótopos estables de hierro in vivo se puede adaptar para investigar la regulación y distribución del hierro en diferentes modelos animales para investigar la regulación fisiológica y patológica del hierro.
Protocolo
Todos los protocolos y procedimientos experimentales con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de California en Los Ángeles.
1. Preparación de 58Fe-Tf
NOTA: El protocolo utiliza 58Fe; sin embargo, se puede utilizar un protocolo idéntico para 57Fe. Cualquiera de los isótopos se puede usar y eliminar como un producto químico de hierro estándar sin precauciones adicionales.
- Disolver 58 Fe en 12 N HCl a 50 μL de HCl/mg de 58Fe.
- Agregue HCl al metal en el vial de vidrio suministrado por el proveedor y vuelva a colocar la tapa flojamente. Para disolver el hierro, caliente la solución de 58Fe/HCl a 60 °C durante 1 h. Si aún no se disuelve, deje la solución durante la noche a temperatura ambiente en la campana extractora para que se disuelva.
NOTA: La solución disuelta de 58Fe/HCl es de color naranja amarillento.
Fe 3 O 4(s) + 8HCl(aq) → Fe(II)Cl 2(aq) + 2Fe(III)Cl3(aq) +4H 2 O
- Agregue HCl al metal en el vial de vidrio suministrado por el proveedor y vuelva a colocar la tapa flojamente. Para disolver el hierro, caliente la solución de 58Fe/HCl a 60 °C durante 1 h. Si aún no se disuelve, deje la solución durante la noche a temperatura ambiente en la campana extractora para que se disuelva.
- Oxide cualquier resto de Fe(II)Cl2 para generar la solución de Fe(III)Cl3 .
- Calentar la solución de 58Fe/HCl a 60 °C con la tapa fuera para facilitar la oxidación.
- Añadir 1 μL de H2O2al 35% por 50 μL de solución de 58Fe/HCl para facilitar aún más la oxidación.
Fe(II)Cl2(aq) + O 2 + 4HCl → 4Fe(III)Cl3(aq) + 2H2 O
- Preparar la solución de cloruro férrico (58Fe(III)Cl3).
- Dejar la solución de cloruro férrico en la campana a 60 °C con la tapa quitada para evaporar la muestra.
NOTA: La evaporación puede tardar entre uno y varios días. - Reconstituir 58 Fe(III)Cl 3 a 100 mM con H 2 O ultrapuro y calcular la cantidad de H 2 O ultrapuro requerido en función del peso inicial del metal utilizado en el paso 1.1 (peso molecular de 58 Fe(III)Cl3 es 162.2).
- Dejar la solución de cloruro férrico en la campana a 60 °C con la tapa quitada para evaporar la muestra.
- Preparar 58 Fe(III)-nitrilotriacetato (NTA) incubando 58Fe(III)Cl 3 con NTA en una relación molar de 1:5 en presencia de 20 mM de NaHCO3.
- Preparar 500 mM NTA en 1 N NaOH.
- Preparar 5x tampón de carga de transferrina (0,5 M HEPES, pH 7,5; 0,75 M NaCl).
- Preparar 1 M NaHCO3 en H2O ultrapuro.
- A un tubo cónico de 15 ml, añadir 150 μL de solución de 100 mM de 58 Fe(III)Cl 3 (a partir de la etapa 1.3.2), 150 μL de NTA de 500 mM preparados en 1 N NaOH, 480 μL deH2Oultrapuro, 200 μL de tampón de carga de transferrina 5xy 20 μL de solución de NaHCO3 de 1 M.
- Incubar la mezcla durante 5 min a temperatura ambiente.
- Cargue apo-Tf con 58 Fe(III)-NTA para formar 58Fe-Tf.
NOTA: Este protocolo fue adaptado de McCarthy y Kosman28.- Disolver 500 mg de apo-Tf en 4 ml de 1x tampón de carga de Tf.
- Al tubo cónico de 15 ml en el paso 1.4.4 que contiene 1 ml de la solución de 58Fe(III)-NTA, añadir 4 ml de solución de apo-Tf.
NOTA: Esta es una relación molar de 3:1 de 58Fe-NTA con apo-Tf. Cada Tf contiene 2 sitios de unión de Fe; se agregó un exceso de 58Fe-NTA para garantizar que Tf estuviera completamente cargado. - Para permitir una carga máxima de 58Fe-NTA en apo-Tf, compruebe que la solución esté a pH 7,5 y ajuste el pH, si es necesario, con NaHCO3 o HCl.
- Incubar durante 2,5 h a temperatura ambiente.
- Eliminar el exceso de 58Fe(III)-NTA sin consolidar y el NTA liberado.
- Transfiera la solución de 58Fe-Tf a una columna de corte de peso molecular (corte de 30 kDa) y centrifugar a 2.500 × g durante 15 min a temperatura ambiente.
- Lave la columna con 10 ml de 1x tampón de carga de transferrina y centrífugo a 2.500 × g durante 15 min a temperatura ambiente. Repetir el lavado y la centrifugación, realizar un lavado salino con 10 mL de solución salina, y centrifugar a 2.500 × g durante 15 min a temperatura ambiente.
- Calcular la concentración de 58Fe-Tf.
NOTA: Debido a la adición de un exceso de 58Fe en el paso 1.5.2, supongamos que toda la transferrina es diférrica. Como se utilizaron 500 mg de apo-Tf, se produjeron ~500 mg de 58Fe-Tf en el paso 1.5.4.- Medir el volumen recuperado de la centrifugación tras el lavado salino en el paso 1.6.2.
- Dividir 500 mg por el volumen recuperado para determinar la concentración (en mg/ml) de la solución de 58Fe-Tf.
- Esterilizar la solución de 58Fe-Tf utilizando un filtro de jeringa de 0,22 μm; conservar a 4 °C hasta que esté listo para usar.
NOTA: Se utilizó una solución de 58Fe-Tf entre 1 y 4 semanas después de la preparación.
2. Configurar embarazos de ratón cronometrados
- Use ratones hembra de 6 a 8 semanas de edad. Coloque a los animales en una dieta baja en hierro (4 ppm de hierro) o comida estándar (185 ppm de hierro) durante 2 semanas antes del apareamiento y mantenga a los animales en las dietas respectivas durante todo el embarazo.
- Opción 01: Confirmar el embarazo por aumento de peso en E7.5.
- Establezca múltiples jaulas de cría. Para cada jaula, combine 2 hembras con 1 macho durante la noche; al día siguiente, cuando los animales están separados, se considera embrionario el día (E)0.5. Pesar a las hembras en E7.5 para determinar si están embarazadas. Aparearse machos de nuevo con hembras que no aumentaron de peso.
NOTA: En WT C57BL/6, un aumento de peso de 1 g en E7.5 es un buen indicador de embarazo. Este método garantiza que la implantación se produzca dentro de un plazo específico de 16 horas, lo que permite el tratamiento sincrónico de todos los animales que quedaron embarazadas durante el mismo período de apareamiento.
- Establezca múltiples jaulas de cría. Para cada jaula, combine 2 hembras con 1 macho durante la noche; al día siguiente, cuando los animales están separados, se considera embrionario el día (E)0.5. Pesar a las hembras en E7.5 para determinar si están embarazadas. Aparearse machos de nuevo con hembras que no aumentaron de peso.
- Opción 02: Confirmar el embarazo mediante comprobaciones de enchufes.
- Combine 2 hembras con 1 macho y realice controles diarios del tapón para determinar si se ha producido una cópula.
NOTA: Este método puede resultar en embarazos escalonados, y la presencia de un tapón no garantiza el embarazo.
- Combine 2 hembras con 1 macho y realice controles diarios del tapón para determinar si se ha producido una cópula.
3. Administrar 58Fe-Tf por vía intravenosa a ratones preñados E17.5
- Prepare 58Fe-Tf del paso 1.8 para inyección.
- Preparar 58solución de Fe-Tf a 35 mg/ml en solución salina; inyectar 100 μL por ratón.
- Llene una jeringa de insulina con 100 μL de la solución de 58Fe-Tf.
NOTA: Cada dosis contiene 3,5 mg de 58 Fe-Tf humano (5 μg de 58Fe).
- Anestesiar a una ratona preñada con isoflurano.
- Use un regulador de isoflurano con una cámara.
- Utilice los siguientes ajustes: 5% de isoflurano, 2 L/ml deO2, 2 min.
- Confirme que el ratón está anestesiado buscando falta de respuesta a un pellizco en el dedo del pie.
- Aplique lubricante para los ojos en la superficie del ojo y coloque el ratón sobre una almohadilla térmica.
- Inyecte lenta y cuidadosamente la solución de 58Fe-Tf en el seno retroorbital.
- Permita que el ratón se recupere de la anestesia; No deje al animal desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal.
- Seis horas después de la inyección, eutanasia E17.5 hembras embarazadas por sobredosis de isoflurano.
- Realizar una punción cardíaca para desangrar al ratón como una forma de eutanasia secundaria.
- Sujete los pies hacia abajo con agujas para la estabilización.
- Recoger la placenta y los hígados embrionarios.
- Usando fórceps estériles y tijeras de disección, retire cuidadosamente el útero de la ratona preñada. Cortar una unidad placentaria fetal-placentaria, que comprende un solo feto y placenta en el saco amniótico rodeado por una porción del útero.
- Corte cuidadosamente a través del útero y el saco amniótico sin alterar el feto y la placenta.
- Despegue el saco amniótico y retire el feto y la placenta.
- Cortar el cordón umbilical.
- Seque el feto y la placenta en una limpieza de tareas para eliminar el exceso de líquido amniótico.
- Registre los pesos de toda la placenta.
- Corte cada placenta por la mitad con una cuchilla de afeitar, coloque cada mitad en un tubo de 2.0 ml y congele rápidamente en nitrógeno líquido.
NOTA: Debido a que el 58 Fe no requiere precauciones especiales de manipulación y eliminación, la mitad de la placenta se puede utilizar para la medición de 58Fe y la otra mitad para cualquier otro análisis, incluida la cuantificación de la expresión del receptor de transferrina (TFR1) y ferroportina (FPN) mediante western blot y qPCR. - Para recolectar hígados de embriones, sacrifique el embrión: use una hoja de afeitar para decapitar rápidamente el embrión.
NOTA: En E17.5, todos los embriones en el útero deben ser sacrificados individualmente, incluso si no se utilizan en el estudio. - Fijar el embrión para la estabilización, dejando el abdomen expuesto.
- Usando tijeras de disección, haga una pequeña incisión donde se unió el cordón umbilical, inserte un extremo de las tijeras de disección en la incisión y realice un corte plano mediano hacia el plano coronal aproximadamente 1/4 de pulgada. Luego, realice cortes planos transversales para exponer el hígado fetal.
- Use fórceps para extirpar el hígado fetal.
- Registre los pesos de los hígados de todo el embrión.
- Coloque los hígados de todo el embrión en tubos de 2 ml y congélelos en nitrógeno líquido.
NOTA: Alternativamente, solo se puede usar una porción del hígado del embrión para la medición de 58Fe si se desean análisis adicionales. El uso de tubos de 2,0 ml permite una mejor homogeneización del tejido que los tubos de 1,5 ml.
- Conservar los tejidos indefinidamente a -80 °C.
4. Tejidos de proceso para el análisis cuantitativo de hierro por ICP-MS
- Procesar la placenta y los hígados fetales para la cuantificación de hierro no hemo.
- Descongele las mitades placentarias y todo el hígado fetal, y pese las mitades placentarias (ver paso 3.6.12 para registrar el peso del hígado fetal).
- Añadir 400 μL de solución de precipitación proteica (0,53 N HCl, 5,3% TCA).
- Homogeneizar el tejido utilizando un homogeneizador eléctrico.
- Incubar las muestras a 100 °C durante 1 h.
- Enfriar las muestras en agua a temperatura ambiente durante 2 min.
- Abra las tapas para liberar la presión y, a continuación, vuelva a cerrar los tubos.
- Centrifugar a 17.000 × g durante 10 min a temperatura ambiente para granular restos de tejido.
- Transfiera cuidadosamente el sobrenadante a un nuevo tubo etiquetado.
- Enviar muestras para el análisis ICP-MS.
- Procesar la placenta y los hígados fetales para la cuantificación del hemo-hierro.
NOTA: Después de la extracción del hierro no hemo en el paso 1, el hierro que queda en el pellet es predominantemente hemo.- Anotar el peso de cada pellet a partir del paso 4.1.7.
- Digerir los pellets en 10 mL de concentrado 70% HNO3 suplementado con 1 mL de 30%H2O2
NOTA: Consulte con el núcleo o centro ICP-MS para optimizar el volumen de HNO3 para estudios específicos; El volumen dependerá en parte del peso de la muestra. - Calentar las muestras a 200 °C durante 15 min.
- Envíe las muestras para el análisis ICP-MS.
NOTA: Si no se requiere distinguir entre fuentes de hierro hemo y no hemo y solo se mide el hierro total, todo el tejido se puede digerir en HNO3 como primer paso.
5. Análisis de datos
NOTA: Los datos de ICP-MS se han proporcionado como concentraciones de 56Fe y 58Fe en ng / ml o mg, ppb (Tabla 1). 56 La fe es el isótopo de hierro más abundante en la naturaleza, y su medición refleja la acumulación de hierro en la placenta / embrión durante todo el embarazo, mientras que la medición de 58fe refleja el hierro que se transfirió durante 6 h después de la inyección.
- Reste la abundancia natural de 58 Fe (0,28% del Fe total) de los valores de 58Fe medidos.
- Calcule el total de no hemo 58Fe.
- Calcular el hierro no hemo (ng) total del hígado embrionario multiplicando primero la concentración de hierro (ng/ml) calculada en el paso 5.1 por el volumen (ml) durante el procesamiento inicial en el paso 4.1.2 para estimar el total de 58Fe.
- Calcular la cantidad de hierro en toda la placenta tomando el peso total de la placenta medido en el paso 3.6.6 y dividiéndolo por el peso de la placenta procesada en el paso 4.1.1. Multiplique este valor por el hierro no hemo (ng) total calculado en el paso 5.2.1 para obtener el contenido total de Fe no hemo 58de la placenta.
- Calcule el hemo total 58Fe.
- Calcular el hemo total 58Fe multiplicando primero la concentración de hierro (ng/mg) calculada en el paso 5.1 por el peso del pellet (en mg) medido en el paso 4.2.1.
- A continuación, divida el peso total de la placenta medido en el paso 3.5.1 por el peso del pellet de placenta medido en el paso 4.2.1. Multiplique este valor por el hierro hemo (ng) total calculado en el paso 5.3.1 para obtener el contenido total de hemo 58Fe de la placenta.
- Suma los valores calculados de 58Fe no hemo y hemo para determinar el contenido total de hierro para cada tejido.
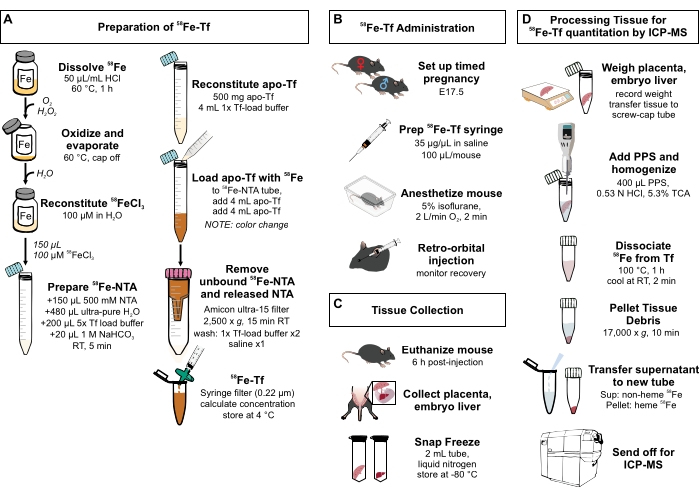
Figura 1: Resumen visual de los pasos del protocolo . (A) Preparación de 58Fe-transferrina. (B) Administración in vivo de 58Fe-transferrina. (C) Recolección y almacenamiento de tejidos. (D) Procesamiento de la placenta y el hígado embrionario para la cuantificación de especies metálicas por ICP-MS. Abreviaturas: Fe = hierro; NTA = ácido nitrilotriacético; Tf = transferrina; PPS = solución de precipitación de proteínas; Sup = sobrenadante; ATC = ácido tricloroacético; ICP-MS = espectrometría de masas de plasma acoplado inductivamente. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Un estudio anterior que utilizó isótopos estables de hierro para medir el transporte de hierro demostró que la deficiencia de hierro materna resultó en la regulación negativa del exportador de hierro de la placenta, FPN4. La FPN es el único exportador de hierro de mamíferos conocido, y la ausencia de FPN durante el desarrollo da lugar a la muerte embrionaria antes de E9.529. Para determinar si la disminución observada en la expresión de FPN se tradujo funcionalment...
Discusión
El hierro es importante para muchos procesos biológicos, y su movimiento y distribución dentro del cuerpo son altamente dinámicos y regulados. Los isótopos estables de hierro proporcionan una alternativa consistente y conveniente a los isótopos radiactivos para la evaluación de la dinámica de la homeostasis del hierro. Un paso crítico en el protocolo es realizar un seguimiento de todos los pesos y volúmenes de los tejidos. El hierro es un elemento y, por lo tanto, no se puede sintetizar ni descomponer. Por lo ta...
Divulgaciones
EN es cofundador científico de Intrinsic LifeSciences y Silarus Pharma y consultor de Protagonist, Vifor, RallyBio, Ionis, Shield Therapeutics y Disc Medicine. VS no declara conflictos.
Agradecimientos
Los autores reconocen el uso de la instalación ICP-MS dentro del Centro de Implicaciones Ambientales de la Nanotecnología de la UC en CNSI en UCLA por su asistencia con la optimización del protocolo para mediciones de 58Fe. El estudio fue apoyado por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK) de los NIH (K01DK127004, a VS) y el Instituto Nacional de Salud Infantil y Desarrollo Humano (NICHD) de los NIH (R01HD096863, a EN).
Materiales
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
Referencias
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados