Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung des Eisentransports über die Mausplazenta in vivo unter Verwendung nichtradioaktiver Eisenisotope
In diesem Artikel
Zusammenfassung
Dieser Artikel zeigt, wie transferringebundenes nichtradioaktives Isotopeneisen für Studien zum Eisentransport in der Mausschwangerschaft vorbereitet und verabreicht wird. Der Ansatz zur Quantifizierung von isotopischem Eisen in fetoplazentaren Kompartimenten wird ebenfalls beschrieben.
Zusammenfassung
Eisen ist essentiell für die Gesundheit von Mutter und Fötus während der Schwangerschaft, wobei etwa 1 g Eisen beim Menschen benötigt wird, um eine gesunde Schwangerschaft aufrechtzuerhalten. Die fetale Eisenausstattung hängt vollständig vom Eisentransfer über die Plazenta ab, und Störungen dieses Transfers können zu nachteiligen Schwangerschaftsergebnissen führen. Bei Mäusen beruhte die Messung des Eisenflusses über die Plazenta traditionell auf radioaktiven Eisenisotopen, ein hochempfindlicher, aber belastender Ansatz. Stabile Eisenisotope (57Fe und 58Fe) bieten eine nichtradioaktive Alternative für den Einsatz in Schwangerschaftsstudien beim Menschen.
Unter physiologischen Bedingungen ist transferringebundenes Eisen die vorherrschende Form von Eisen, das von der Plazenta aufgenommen wird. So wurde 58Fe-Transferrin hergestellt und intravenös in schwangere Muttertiere injiziert, um den Plazenta-Eisentransport direkt zu beurteilen und die mütterliche Eisenabsorption im Darm als Störvariable zu umgehen. Isotopisches Eisen wurde in den embryonalen Geweben der Plazenta und der Maus mittels Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) quantifiziert. Diese Methoden können auch in anderen Tiermodellsystemen der Physiologie oder Krankheit eingesetzt werden, um die Eisendynamik in vivo zu quantifizieren.
Einleitung
Eisen ist entscheidend für verschiedene Stoffwechselprozesse, einschließlich Wachstum und Entwicklung, Energieproduktion und Sauerstofftransport1. Die Aufrechterhaltung der Eisenhomöostase ist ein dynamischer, koordinierter Prozess. Eisen wird aus der Nahrung im Zwölffingerdarm aufgenommen und im Kreislauf, der an das Eisentransportprotein Transferrin (Tf) gebunden ist, durch den Körper transportiert. Es wird von jeder Zelle für enzymatische Prozesse verwendet, in Hämoglobin in entstehende Erythrozyten eingebaut und von Makrophagen aus gealterten Erythrozyten recycelt. Eisen wird in der Leber gespeichert, wenn es im Übermaß ist und durch Blutungen oder Zellablösung aus dem Körper verloren geht. Die Menge an zirkulierendem Eisen ist das Ergebnis des Gleichgewichts zwischen dem Verbrauch und der Versorgung mit Eisen, wobei letzteres durch das Leberhormon Hepcidin (HAMP), den zentralen Regulator der Eisenhomöostase1, streng reguliert wird. Hepcidin begrenzt die Bioverfügbarkeit von Eisen im Blut, indem es die Ubiquitinierung verdeckt oder induziert und den Eisenexporteur Ferroportin (FPN) abbaut2. Die Verringerung des funktionellen FPN führt zu einer verminderten Eisenaufnahme in der Nahrung, Eisensequestrierung in der Leber und vermindertem Eisenrecycling aus Makrophagen1.
Hepcidin wird durch Eisenstatus, Entzündung, erythropoetischen Antrieb und Schwangerschaft reguliert (überprüft in 3). Da die Eisenhomöostase sehr dynamisch ist, ist es wichtig, den gesamten Eisenpool und die Eisenverteilung und den Eisenumsatz zu verstehen und zu messen. Tierstudien stützten sich traditionell auf radioaktive Eisenisotope, ein hochempfindlicher, aber belastender Ansatz zur Messung der Eisendynamik. In neueren Studien, einschließlich der hier vorgestellten Studie4, werden jedoch nichtradioaktive, stabile Eisenisotope (58Fe) verwendet, um den Eisentransport während der Schwangerschaft zu messen 5,6,7,8,9. Stabile Isotope sind wertvolle Werkzeuge für die Untersuchung des Nährstoffstoffwechsels (überprüft in 10). Die Verwendung stabiler Eisenisotope in Humanstudien zeigte, dass i) die Eisenabsorption gegen Ende der Schwangerschaft zunimmt5,6, ii) die Übertragung von Eisen in die Nahrung zum Fötus vom mütterlichen Eisenstatus abhängt7, iii) mütterlich aufgenommenes Hämeisen vom Fötus leichter aufgenommen wird als Nicht-Häm-Eisen 8 und iv) der Eisentransfer zum Fötus negativ mit dem mütterlichen Hepcidinspiegel 8 korreliert, 9. Diese Experimente maßen Eisenisotope in Seren oder deren Einbau in Erythrozyten; Die Messung von Eisen, das allein in Erythrozyten eingebaut ist, kann jedoch die tatsächliche Eisenabsorption unterschätzen9. In der aktuellen Studie werden sowohl Häm- als auch Nicht-Häm-Eisen in Geweben gemessen.
Während der Schwangerschaft wird Eisen benötigt, um die Ausdehnung des mütterlichen Volumens der roten Blutkörperchen zu unterstützen und über die Plazenta zu übertragen, um das Wachstum und die Entwicklung des Fötuszu unterstützen 11. Die fetale Eisenausstattung hängt vollständig vom Eisentransport über die Plazenta ab. Während der Schwangerschaft von12 und Nagetieren 4,13 sinkt der Hepcidinspiegel dramatisch ab, wodurch die Verfügbarkeit von Plasmaeisen für den Transfer zum Fötus erhöht wird.
Die Grundlagen des Plazenta-Eisentransports wurden erstmals in den 1950er-70er Jahren mit radioaktiven Tracern (59Fe und 55Fe) charakterisiert. Diese Studien ergaben, dass der Eisentransport durch die Plazenta unidirektionalist 14,15 und dass Diferric Transferrin eine Hauptquelle für Eisen für die Plazenta und den Fötus16,17 ist. Das derzeitige Verständnis des Plazenta-Eisentransports ist vollständiger, obwohl einige wichtige Eisentransporter und Regulationsmechanismen unbekannt sind. Mausmodelle waren für das Verständnis der Eisenregulation und des Eisentransports unerlässlich18, da die wichtigsten Transporter und Mechanismen bemerkenswert ähnlich sind. Sowohl menschliche als auch Mausplazenta sind hämochororisch, dh mütterliches Blut steht in direktem Kontakt mit dem fetalen Chorion19. Es gibt jedoch einige bemerkenswerte strukturelle Unterschiede.
Der Synzytiotrophoblast ist die Plazentazellschicht, die den mütterlichen und fetalen Kreislauf trennt und aktiv Eisen und andere Nährstoffe transportiert20. Beim Menschen ist der Synzytiotrophoblast eine einzelne Schicht verschmolzener Zellen. Im Gegensatz dazu besteht die Mausplazenta aus zwei Synzytiotrophoblastschichten21, Syn-I und Syn-II. Gap Junctions an der Grenzfläche von Syn-I und Syn-II ermöglichen jedoch die Diffusion von Nährstoffen zwischen den Schichten22,23. Somit funktionieren diese Schichten als eine einzige Synzytialschicht, ähnlich dem menschlichen Synzytiotrophoblasten. Weitere Ähnlichkeiten und Unterschiede zwischen menschlichen und Maus-Plazenta werden von Rossant und Cross21 überprüft. Der plazentale Eisentransport wird durch die Bindung von Eisen-Tf aus dem mütterlichen Blut an den Transferrinrezeptor (TfR1) ausgelöst, der auf der apikalen Seite des Synzytiotrophoblasten24 lokalisiert ist. Diese Wechselwirkung induziert eine Eisen-Tf/TfR1-Internalisierung über Clathrin-vermittelte Endozytose25. Eisen wird dann aus Tf im sauren Endosom26 freigesetzt, durch eine unbestimmte Ferrireduktase zu Eisen reduziert und durch einen noch zu bestimmenden Transporter aus dem Endosom in das Zytoplasma exportiert. Wie Eisen innerhalb des Synzytiotrophoblasten begleitet wird, muss ebenfalls noch beschrieben werden. Eisen wird schließlich vom Eisenexporteur FPN auf die fetale Seite transportiert, lokalisiert auf der basalen oder fötalen Oberfläche des Synzytiotrophoblasten (überprüft in27).
Um zu verstehen, wie die physiologische und pathologische Regulation von TfR1, FPN und Hepcidin den Plazenta-Eisentransport beeinflusst, wurden stabile Eisenisotope verwendet, um den Eisentransport vom mütterlichen Kreislauf zur Plazenta und zum Embryo in vivo zu quantifizieren 4. In diesem Artikel werden die Methoden zur Herstellung und Verabreichung von isotopischem Eisentransferrin an trächtige Mäuse, zur Verarbeitung von Geweben für ICP-MS und zur Berechnung der Eisenkonzentrationen in Geweben vorgestellt. Die Verwendung stabiler Eisenisotope in vivo kann angepasst werden, um die Eisenregulation und -verteilung in verschiedenen Tiermodellen zu untersuchen, um die physiologische und pathologische Eisenregulation zu untersuchen.
Protokoll
Alle Tierprotokolle und experimentellen Verfahren wurden vom Institutional Animal Care and Use Committee (IACUC) der University of California Los Angeles genehmigt.
1. Vorbereitung von 58Fe-TF
HINWEIS: Das Protokoll verwendet 58Fe; Ein identisches Protokoll kann jedoch für 57Fe verwendet werden. Beide Isotope können als Standard-Eisenchemikalie ohne zusätzliche Vorsichtsmaßnahmen verwendet und entsorgt werden.
- 58Fe werden in 12 N HCl bei 50 μL HCl/mg 58Fe gelöst.
- Fügen Sie HCl zu dem Metall in der vom Verkäufer gelieferten Durchstechflasche hinzu und setzen Sie die Kappe lose wieder auf. Um das Bügeleisen aufzulösen, erwärmen Sie die 58Fe/HCl-Lösung 1 h lang auf 60 °C. Wenn immer noch nicht aufgelöst, lassen Sie die Lösung über Nacht bei Raumtemperatur im Abzug auflösen.
HINWEIS: Die gelöste 58Fe/HCl-Lösung hat eine gelblich-orange Farbe.
Fe3O4(s) + 8HCl(aq) → Fe(II)Cl 2(aq) + 2Fe(III)Cl 3(aq) + 4H2 O
- Fügen Sie HCl zu dem Metall in der vom Verkäufer gelieferten Durchstechflasche hinzu und setzen Sie die Kappe lose wieder auf. Um das Bügeleisen aufzulösen, erwärmen Sie die 58Fe/HCl-Lösung 1 h lang auf 60 °C. Wenn immer noch nicht aufgelöst, lassen Sie die Lösung über Nacht bei Raumtemperatur im Abzug auflösen.
- Oxidieren Sie alle verbleibenden Fe(II)Cl2 , um die Fe(III)Cl3-Lösung zu erzeugen.
- Die 58Fe/HCl-Lösung mit abgenommener Kappe auf 60 °C erwärmen, um die Oxidation zu erleichtern.
- 1 μL 35%H2O2pro 50 μL 58Fe/HCl-Lösung zugeben, um die Oxidation weiter zu erleichtern.
Fe(II)Cl2(aq) + O2 + 4HCl → 4Fe(III)Cl3(aq) +2H2O
- Eisenchlorid (58Fe(III)Cl3)-Lösung wird hergestellt.
- Lassen Sie die Eisenchloridlösung bei 60 °C mit abgenommener Kappe in der Haube, um die Probe zu verdampfen.
HINWEIS: Die Verdunstung kann zwischen einem und mehreren Tagen dauern. - Rekonstituieren Sie 58 Fe(III)Cl3 bis 100 mM mit hochreinem H2O und berechnen Sie die erforderliche Menge an hochreinem H2O basierend auf dem in Schritt 1.1 verwendeten Anfangsmetallgewicht (Molekulargewicht von 58Fe(III)Cl3 ist 162,2).
- Lassen Sie die Eisenchloridlösung bei 60 °C mit abgenommener Kappe in der Haube, um die Probe zu verdampfen.
- Herstellung von 58 Fe(III)-nitrilotriacetat (NTA) durch Inkubation von 58Fe(III)Cl3 mit NTA im Verhältnis 1:5 in Gegenwart von 20 mM NaHCO3.
- 500 mM NTA in 1 N NaOH vorbereiten.
- 5x Transferrin-Ladepuffer (0,5 M HEPES, pH 7,5; 0,75 M NaCl) vorbereiten.
- 1 MNaHCO3 in hochreinemH2Oherstellen.
- Zu einem 15-ml-konischen Röhrchen werden 150 μL 100 mM 58 Fe(III)Cl3-Lösung (aus Schritt 1.3.2), 150 μL 500 mM NTA in 1 N NaOH, 480 μL hochreinesH2O, 200 μL 5xTransferrin-Ladepuffer und 20 μL 1 M NaHCO3-Lösung gegeben.
- Inkubieren Sie die Mischung für 5 min bei Raumtemperatur.
- Laden Sie apo-Tf mit 58Fe(III)-NTA zu 58Fe-Tf.
HINWEIS: Dieses Protokoll wurde von McCarthy und Kosman28 übernommen.- 500 mg apo-Tf in 4 mL 1x Tf-Ladepuffer auflösen.
- Zu dem 15-ml-konischen Röhrchen in Schritt 1.4.4, das 1 ml der 58Fe(III)-NTA-Lösung enthält, werden 4 ml apo-Tf-Lösung hinzugefügt.
HINWEIS: Dies ist ein 3:1 molares Verhältnis von 58Fe-NTA mit apo-Tf. Jede Tf enthält 2 Fe-Bindungsstellen; mehr als 58Fe-NTA wurde hinzugefügt, um sicherzustellen, dass Tf vollständig geladen war. - Um eine maximale Beladung von 58Fe-NTA auf apo-TF zu ermöglichen, überprüfen Sie, ob die Lösung einen pH-Wert von 7,5 aufweist, und stellen Sie den pH-Wert gegebenenfalls mit NaHCO3 oder HCl ein.
- Inkubieren Sie für 2,5 h bei Raumtemperatur.
- Entfernen Sie überschüssiges ungebundenes 58Fe(III)-NTA und freigegebenes NTA.
- Die 58 Fe-Tf-Lösung wird in eine Molekulargewichts-Cutoff-Säule (30 kDa-Cutoff) überführt und bei 2.500× g für 15 min bei Raumtemperatur zentrifugiert.
- Waschen Sie die Säule mit 10 mL 1x Transferrin-Ladepuffer und zentrifugieren Sie sie bei 2.500 × g für 15 min bei Raumtemperatur. Wiederholen Sie das Waschen und Zentrifugieren, führen Sie eine Kochsalzwäsche mit 10 ml Kochsalzlösung durch und zentrifugieren Sie bei 2.500 × g für 15 min bei Raumtemperatur.
- Berechnen Sie die Konzentration von 58Fe-Tf.
HINWEIS: Aufgrund der Zugabe von überschüssigem 58Fe in Schritt 1.5.2 ist davon auszugehen, dass das gesamte Transferrin diferrisch ist. Da 500 mg Apo-Tf verwendet wurden, wurden ~500 mg 58Fe-Tf in Schritt 1.5.4 hergestellt.- Messen Sie das Volumen, das nach der Salzwäsche nach der Salzwäsche aus der Zentrifugation gewonnen wird.
- 500 mg werden durch das gewonnene Volumen dividiert, um die Konzentration (in mg/ml) der 58Fe-Tf-Lösung zu bestimmen.
- Die 58Fe-Tf-Lösung wird mit einem 0,22-μm-Spritzenfilter sterilisiert. Bei 4 °C lagern, bis sie gebrauchsfertig sind.
HINWEIS: 58Fe-Tf-Lösung wurde 1 bis 4 Wochen nach der Zubereitung verwendet.
2. Zeitgesteuerte Mausschwangerschaften einrichten
- Verwenden Sie 6 bis 8 Wochen alte weibliche Mäuse. Setzen Sie die Tiere 2 Wochen vor der Paarung auf eine eisenarme Diät (4 ppm Eisen) oder Standardfutter (185 ppm Eisen) und halten Sie die Tiere während der gesamten Trächtigkeit auf den entsprechenden Diäten.
- Option 01: Bestätigen Sie die Schwangerschaft durch Gewichtszunahme bei E7,5.
- Richten Sie mehrere Zuchtkäfige ein. Kombinieren Sie für jeden Käfig 2 Weibchen mit 1 Männchen über Nacht; der folgende Tag, an dem die Tiere getrennt werden, gilt als embryonaler Tag (E)0,5. Wiegen Sie Weibchen bei E7,5, um festzustellen, ob sie schwanger sind. Verpaaren Sie Männchen wieder mit Weibchen, die nicht zugenommen haben.
HINWEIS: In WT C57BL/6 ist eine Gewichtszunahme von 1 g bei E7,5 ein guter Indikator für eine Schwangerschaft. Diese Methode stellt sicher, dass die Implantation innerhalb eines bestimmten Zeitrahmens von 16 Stunden erfolgte, was eine synchrone Behandlung aller Tiere ermöglicht, die während derselben Paarungszeit trächtig wurden.
- Richten Sie mehrere Zuchtkäfige ein. Kombinieren Sie für jeden Käfig 2 Weibchen mit 1 Männchen über Nacht; der folgende Tag, an dem die Tiere getrennt werden, gilt als embryonaler Tag (E)0,5. Wiegen Sie Weibchen bei E7,5, um festzustellen, ob sie schwanger sind. Verpaaren Sie Männchen wieder mit Weibchen, die nicht zugenommen haben.
- Option 02: Bestätigen Sie die Schwangerschaft durch Steckerprüfungen.
- Kombinieren Sie 2 Weibchen mit 1 Männchen und führen Sie tägliche Plug-Checks durch, um festzustellen, ob eine Kopulation stattgefunden hat.
HINWEIS: Diese Methode kann zu gestaffelten Schwangerschaften führen, und das Vorhandensein eines Plugs garantiert keine Schwangerschaft.
- Kombinieren Sie 2 Weibchen mit 1 Männchen und führen Sie tägliche Plug-Checks durch, um festzustellen, ob eine Kopulation stattgefunden hat.
3. 58Fe-Tf intravenös an E17,5 trächtige Mäuse verabreichen
- Bereiten Sie 58Fe-Tf aus Schritt 1.8 für die Injektion vor.
- 58Fe-Tf-Lösung bei 35 mg/ml in Kochsalzlösung herstellen; injizieren Sie 100 μL pro Maus.
- Füllen Sie eine Insulinspritze mit 100 μL der 58Fe-Tf-Lösung.
HINWEIS: Jede Dosis enthält 3,5 mg 58 Fe-Tf beim Menschen (5 μg 58Fe).
- Betäuben Sie eine schwangere Maus mit Isofluran.
- Verwenden Sie einen Isofluran-Regulator mit einer Kammer.
- Verwenden Sie die folgenden Einstellungen: 5% Isofluran, 2 L/mlO2, 2 min.
- Bestätigen Sie, dass die Maus betäubt ist, indem Sie nach mangelnder Reaktion auf ein Zehenklemmen suchen.
- Tragen Sie Augengleitmittel auf die Augenoberfläche auf und legen Sie die Maus auf ein Heizkissen.
- Injizieren Sie die 58Fe-Tf-Lösung langsam und vorsichtig in den retroorbitalen Sinus.
- Lassen Sie die Maus von der Anästhesie erholen; Lassen Sie das Tier nicht unbeaufsichtigt, bis es wieder ausreichend Bewusstsein erlangt hat, um das sternale Liegen aufrechtzuerhalten.
- Sechs Stunden nach der Injektion Euthanasieren Sie E17,5 schwangere Frauen durch Isofluran-Überdosierung.
- Führen Sie eine Herzpunktion durch, um die Maus als eine Form der sekundären Euthanasie zu entbluten.
- Stecken Sie die Füße zur Stabilisierung mit Nadeln fest.
- Sammeln Sie die Plazenta und die Embryoleber.
- Entfernen Sie mit steriler Pinzette und Sezierschere vorsichtig die Gebärmutter von der schwangeren Maus. Schneiden Sie eine plazentare fetale Plazentaeinheit ab, die einen einzelnen Fötus und eine Plazenta in der Fruchtblase umfasst, die von einem Teil der Gebärmutter umgeben ist.
- Schneiden Sie vorsichtig durch die Gebärmutter und die Fruchtblase, ohne den Fötus und die Plazenta zu stören.
- Schälen Sie die Fruchtblase zurück und entfernen Sie den Fötus und die Plazenta.
- Schneiden Sie die Nabelschnur durch.
- Tupfen Sie den Fötus und die Plazenta auf einem sauberen Abwischtuch ab, um das überschüssige Fruchtwasser zu entfernen.
- Notieren Sie die Gewichte der gesamten Plazenta.
- Schneiden Sie jede Plazenta mit einer Rasierklinge in zwei Hälften, legen Sie jede Hälfte in ein 2,0-ml-Röhrchen und frieren Sie in flüssigem Stickstoff ein.
HINWEIS: Da 58 Fe keine besonderen Vorsichtsmaßnahmen und Entsorgung erfordert, kann die eine Hälfte der Plazenta für die Messung von 58Fe und die andere Hälfte für alle anderen Analysen verwendet werden, einschließlich der Quantifizierung der Transferrinrezeptor- (TFR1) und Ferroportinexpression (FPN) durch Western Blotting und qPCR. - Um embryonale Lebern zu sammeln, opfern Sie den Embryo: Verwenden Sie eine Rasierklinge, um den Embryo schnell zu enthaupten.
HINWEIS: Bei E17.5 müssen alle Embryonen in der Gebärmutter einzeln eingeschläfert werden, auch wenn sie nicht in der Studie verwendet werden. - Fixieren Sie den Embryo zur Stabilisierung und lassen Sie den Bauch frei.
- Machen Sie mit einer Dissektionsschere einen kleinen Einschnitt, an dem die Nabelschnur befestigt war, führen Sie ein Ende der Dissektionsschere in den Einschnitt ein und führen Sie einen mittleren Schnitt in Richtung der koronalen Ebene von etwa 1/4 Zoll durch. Führen Sie dann transversale Ebenenschnitte durch, um die fetale Leber freizulegen.
- Verwenden Sie eine Pinzette, um die fetale Leber zu entfernen.
- Notieren Sie das Gewicht der gesamten embryonalen Leber.
- Legen Sie die gesamte Embryonenleber in 2 ml Röhrchen und frieren Sie sie in flüssigem Stickstoff ein.
HINWEIS: Alternativ kann nur ein Teil der embryonalen Leber für die Messung von 58Fe verwendet werden, wenn zusätzliche Analysen gewünscht werden. Die Verwendung von 2,0-ml-Röhrchen ermöglicht eine bessere Gewebehomogenisierung als 1,5-ml-Röhrchen.
- Lagern Sie das Gewebe unbegrenzt bei -80 °C.
4. Prozessgewebe für die quantitative Eisenanalyse mittels ICP-MS
- Verarbeiten Sie die Plazenta und die fetale Leber für die Quantifizierung von Nichthämeisen.
- Plazentahälften und ganze fetale Lebern auftauen und Plazentahälften wiegen (siehe Schritt 3.6.12 zur Erfassung des fetalen Lebergewichts).
- 400 μL Proteinfällungslösung (0,53 N HCl, 5,3% TCA) zugeben.
- Homogenisieren Sie das Gewebe mit einem elektrischen Homogenisator.
- Die Proben werden 1 h lang bei 100 °C inkubiert.
- Kühlen Sie die Proben in Wasser bei Raumtemperatur für 2 min.
- Öffnen Sie die Kappen, um den Druck abzubauen, und schließen Sie die Röhrchen wieder.
- Bei 17.000 × g für 10 min bei Raumtemperatur auf Pelletgewebereste zentrifugieren.
- Übertragen Sie den Überstand vorsichtig in ein neues beschriftetes Röhrchen.
- Senden Sie Proben zur ICP-MS-Analyse.
- Verarbeiten Sie die Plazenten und fetalen Lebern für die Quantifizierung von Häm-Eisen.
HINWEIS: Nach der Extraktion von Nichthämeisen in Schritt 1 ist das im Pellet verbleibende Eisen überwiegend Häm.- Notieren Sie das Gewicht jedes Pellets aus Schritt 4.1.7.
- Aufschluss der Pellets in 10 mL konzentriertem 70% HNO3, ergänzt mit 1 mL 30%H2O2
HINWEIS: Wenden Sie sich an den ICP-MS-Kern oder das ICP-MS-Zentrum, um das Volumen von HNO3 für bestimmte Studien zu optimieren. Das Volumen hängt teilweise vom Probengewicht ab. - Die Proben 15 min lang auf 200 °C erhitzen.
- Senden Sie die Proben zur ICP-MS-Analyse.
HINWEIS: Wenn keine Unterscheidung zwischen Häm- und Nicht-Häm-Eisenquellen erforderlich ist und nur das Gesamteisen gemessen wird, kann im ersten Schritt das gesamte Gewebe in HNO3 verdaut werden.
5. Datenanalyse
ANMERKUNG: Die Daten von ICP-MS wurden als 56Fe- und 58Fe-Konzentrationen in ng/ml oder mg, ppb angegeben (Tabelle 1). 56 Fe ist das am häufigsten vorkommende Eisenisotop in der Natur, und seine Messung spiegelt die Eisenakkumulation in der Plazenta / im Embryo über die gesamte Schwangerschaft wider, während die 58-Fe-MessungEisen widerspiegelt, das während 6 Stunden nach der Injektion übertragen wurde.
- Subtrahieren Sie die natürliche Häufigkeit von 58 Fe (0,28% des gesamten Fe) von den gemessenen 58Fe-Werten.
- Berechnen Sie die Gesamtmenge von 58Fe.
- Berechnen Sie das Gesamteiseneisen (ng) der Embryoleber, indem zunächst die in Schritt 5.1 berechnete Eisenkonzentration (ng/ml) mit dem Volumen (ml) während der Erstverarbeitung in Schritt 4.1.2 multipliziert wird, um die Gesamtmenge 58Fe zu schätzen.
- Die Eisenmenge in der gesamten Plazenta wird berechnet, indem Sie das in Schritt 3.6.6 gemessene Gesamtgewicht der Plazenta durch das Gewicht der in Schritt 4.1.1 verarbeiteten Plazenta dividieren. Multiplizieren Sie diesen Wert mit dem in Schritt 5.2.1 berechneten Gesamteisen (ng), um den Gesamtgehalt der Plazenta an Nichthäm von 58Fe zu erhalten.
- Berechnen Sie das Gesamthäm 58Fe.
- Die Gesamthämmenge 58Fe wird berechnet, indem zunächst die in Schritt 5.1 berechnete Eisenkonzentration (ng/mg) mit dem Gewicht des in Schritt 4.2.1 gemessenen Pellets (in mg) multipliziert wird.
- Dann wird das in Schritt 3.5.1 gemessene Gesamtgewicht der Plazenta durch das in Schritt 4.2.1 gemessene Gewicht des Plazentapellets dividiert. Multiplizieren Sie diesen Wert mit dem in Schritt 5.3.1 berechneten Gesamthämeisen (ng), um den Gesamthäm-Gehalt der Plazenta von 58Fe zu erhalten.
- Summieren Sie die berechneten Werte für Nichthäm und Häm 58Fe, um den Gesamteisengehalt für jedes Gewebe zu bestimmen.
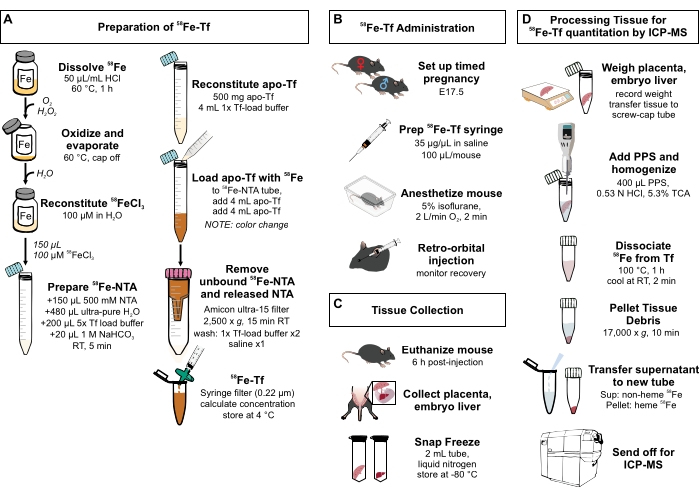
Abbildung 1: Visuelle Zusammenfassung der Schritte im Protokoll. (A) Herstellung von 58Fe-Transferrin. (B) In-vivo-Verabreichung von 58 Fe-Transferrin. c) Gewebeentnahme und -lagerung. (D) Verarbeitung der Plazenta und der embryonalen Leber zur Quantifizierung von Metallspezies mittels ICP-MS. Abkürzungen: Fe = Eisen; NTA = Nitrilotriessigsäure; Tf = Transferrin; PPS = Proteinfällungslösung; Sup = Überstand; TCA = Trichloressigsäure; ICP-MS = Massenspektrometrie mit induktiv gekoppeltem Plasma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Eine frühere Studie mit stabilen Eisenisotopen zur Messung des Eisentransports zeigte, dass mütterlicher Eisenmangel zur Herunterregulierung des Plazenta-Eisenexporteurs FPN4 führte. FPN ist der einzige bekannte Eisenexporteur von Säugetieren, und das Fehlen von FPN während der Entwicklung führt zum Embryonaltod vor E9.529. Um festzustellen, ob die beobachtete Abnahme der FPN-Expression funktionell zu einem verminderten Plazenta-Eisentransport führte, wurde 58
Diskussion
Eisen ist wichtig für viele biologische Prozesse, und seine Bewegung und Verteilung im Körper sind hochdynamisch und reguliert. Stabile Eisenisotope bieten eine konsistente und bequeme Alternative zu radioaktiven Isotopen zur Beurteilung der Dynamik der Eisenhomöostase. Ein kritischer Schritt im Protokoll ist die Verfolgung aller Gewebegewichte und -volumina. Eisen ist ein Element und kann daher weder synthetisiert noch abgebaut werden. Wenn also alle Gewichte und Volumina sorgfältig protokolliert werden, kann das ge...
Offenlegungen
EN ist wissenschaftlicher Mitbegründer von Intrinsic LifeSciences und Silarus Pharma und Berater für Protagonist, Vifor, RallyBio, Ionis, Shield Therapeutics und Disc Medicine. VS deklariert keine Konflikte.
Danksagungen
Die Autoren würdigen die Nutzung der ICP-MS-Einrichtung innerhalb des UC Center for Environmental Implications of Nanotechnology in CNSI an der UCLA für ihre Unterstützung bei der Optimierung des Protokolls für 58Fe-Messungen. Die Studie wurde vom NIH National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (K01DK127004, bis VS) und NIH National Institute of Child Health and Human Development (NICHD) (R01HD096863, bis EN) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
Referenzen
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten