Method Article
对胚胎鸡听觉脑干进行切片以评估异位梯度和微电路
摘要
在这里,我们提出了一种获得鸡胚胎的非冠状听觉脑干切片的协议,用于研究一个脑干切片内的异位特性和发育轨迹。这些切片包括矢状面、水平面和水平/横向切片,包括单个切片平面内较大的单位区域,而不是传统的冠状切片。
摘要
鸡胚是一种被广泛接受的用于研究听觉脑干的动物模型,由高度专业化的微电路和神经元拓扑组成,沿异位(即频率)轴差分定向。单位轴允许在喙内侧平面对高频声音进行隔离编码,在尾侧区域对低频编码进行隔离编码。传统上,胚胎组织的冠状脑干切片允许研究相对个体等频薄片。虽然足以研究与单个等频区域有关的解剖学和生理学问题,但对异位变异及其在较大听觉脑干区域的发展的研究有限。该协议报告了来自鸡胚胎的脑干切片技术,其中包括下听脑干中频率区域的较大梯度。鸡听觉脑干组织使用不同的切片方法允许在一个脑干切片中进行电生理和解剖学实验,其中比冠状切片更好地保存了更大的肌张力和发育轨迹梯度。多种切片技术可以改进对听觉脑干微电路的各种解剖学、生物物理和负直位特性的研究。
引言
鸡胚是一种有价值的研究模型,可以研究细胞生物学、免疫学、病理学和发育神经生物学等众多不同科学领域的基本生物学问题。鸡听觉脑干的微电路是高度专业化回路的一个很好的例子,可以从听觉形态和生理学的角度来理解。例如,Rubel和Parks(1975)首先将鸡核Magnocellularis(NM)和核层流(NL)的异位取向(即频率梯度)描述为横跨细胞核轴的线性函数,相对于矢状面定向~30°。NM和NL中的单个神经元编码其最佳声音频率 - 称为其特征频率(CF) - 沿着口内侧平面到尾外侧区域。高频敏感神经元位于口内侧区域,低频敏感神经元位于尾侧。因此,传统的听觉脑干组织解剖方法来研究异位特性,利用了连续的冠状切片。事实上,几十年来,发育中的鸡胚胎的听觉微电路已被建立为研究通过连续尾部到喙冠平面脑干切片研究异位听觉功能的信号处理的模型系统1,2,3,4,5,6。
然而,NM和NL的异位组织在拓扑和形态上是复杂的。听觉神经输入的分布使得高 CF 输入终止于覆盖至少四分之一的 NM 细胞体周长的球内膜样结构。相反,低CF输入不是用末端球状终端组织的,而是在NM神经元的树突上具有多个布顿突触。中间CF输入终止为末端灯泡和布顿样突触4,7,8,9,10,11,12。在NL中,高度刻板的树枝状梯度不仅在树枝状长度上很明显,而且在树枝状宽度上也很明显。这种独特的树枝状梯度与轴缘紧密相连。从高CF神经元到低CF神经元,树突的长度分别增加了11倍,宽度增加了5倍6。为了克服这些细胞核在冠状切片中的这种复杂分布,该协议描述了矢状面、水平面和水平/横向平面中的解剖方法。这些切片技术提供了听觉脑干组织的例子,这些组织在单个切片平面中表现出最大的异位特性。
研究方案
所有程序均由西北大学机构动物护理和使用委员会(IACUC)批准,并按照美国国立卫生研究院实验动物护理和使用指南进行。用于解剖和制备脑干组织的方案符合先前的方案5,13。
1. 鸡蛋处理
- 从IACUC批准的当地动物供应商处购买受精卵(Gallus gallus homeus)。
- 到达后立即将鸡蛋储存在14°C的冰箱中,并在5天内孵化。
注意:胚胎活力在1周后显着下降。 - 在38±1°C和~50%湿度下孵育之前,用70%乙醇对鸡蛋进行灭菌。
2. 人工脑脊液(ACSF)组成及制备
- 在 1 L 的 18.2 MΩcm dH2O 中混合以下化学物质以创建 10x ACSF 储备溶液:NaCl(氯化钠)130 mM、NaHCO3 (碳酸氢钠)26 mM、KCl(氯化钾)2.5 mM、NaH2PO4 (磷酸二氢钠)1.25 mM、葡萄糖 (D-(+)-葡萄糖) 10 mM。将储备溶液保存在冰箱中。
- 在18.2MΩcm dH 2 O中分别制备MgCl 2(氯化镁)1M和CaCl2(氯化钙)1M溶液并储存在冰箱中。
- 使用前立即将 10x ACSF 稀释至 1x,并用 95% O 2/5% CO 2 连续鼓泡 15-20 分钟,然后加入 MgCl 2 和 CaCl 2。为了制备ACSF和dACSF(解剖ACSF),分别调整至Mg 2 + 1 mM,Ca 2 + 3 mM和Mg 2 + 3 mM,Ca 2 + 1 mM的最终浓度。
- 设置ACSF的鼓泡速率,使pH值为7.2-7.4,渗透压在300和310 mOsm / L之间。
注意:在鼓泡时将ACSF置于冰浴中有利于保持较低的溶液温度,这将在解剖时支持组织结构完整性。
3. 琼脂糖(5%)嵌段制备
- 将 5 g 琼脂糖与 100 mL dACSF 混合。使用100°C水浴或微波炉2-3分钟,每30秒搅拌一次以防止结块,直到琼脂糖完全溶解并开始冒泡。
- 将融化的琼脂糖倒入厚达5毫米的空培养皿中,并在室温下保持凝固。凝固后,使用封口膜密封培养皿并储存在4°C。
- 用锋利的刀片将琼脂糖切成立方块,并在解剖时使用。
4.解剖方案和分离听觉脑干
- 使用70%乙醇溶液喷雾清洁解剖区域。
- 将支撑或倾斜的琼脂糖块粘在振动切片机托盘上。
- 选择所需年龄的卵子(本协议中的E20和E21)。按照上述步骤1中列出的方案处理和孵育种蛋。
- 通过将鸡蛋放在明亮的光线下(烛光)并在鸡蛋的较大或更圆的一侧寻找这个空间来定位充满空气的空间。
- 使种蛋适应室温,在充满空气的空间上裂开壳,并露出膜囊。
- 在囊中轻轻切开以露出喙。
- 用手术刀轻轻地将脖子和头从鸡蛋中拉出来。
- 快速用锋利的剪刀斩首头部。
- 斩首后,用冰冷的dACSF清洁头部,以清除解剖垫上多余的血液。
- 将头部稳定地放在冰冷的dACSF中,并做一个前尾切口。从眼睛后面和眼睛之间的切口开始,并沿着收获的颈部的长度。
注意:较年轻的胚胎在切口时可能需要较小的压力。 - 分离皮肤以暴露头骨。
- 将眼睛后面的头骨从中线切到横向。对两个半球都执行此操作。
注意:此步骤有助于将颅骨的喙部与附着的大脑分开,同时保持脑组织完整5. - 切开头骨的喙部。将刀片放在眼睛后面并进行快速切割。
注意:可能需要努力干净地切割附着的头骨。 - 将头部浸入冷dACSF的盘中。
- 使用一把小剪刀,在颅骨尾部区域做中线到侧切口,试图在不造成组织损伤的情况下将大脑与颅骨分开。
- 轻轻暴露脑干和小脑。缩回整个颅骨的背侧区域,小心地去除脑干,并借助带有轻度雪橇的细画笔将其暴露出来。使用弯曲的镊子清洁连接组织和血管的脑干。特别注意第 8 颅 神经区域,并确保在两侧留下一小段完整的神经纤维。
- 通过切开花梗并小心地去除血管,将脑干与小脑分开。修剪其他血管的脑干。
注意:确保整个过程在用碳氧(95%O 2/5%CO2)连续鼓泡的冰冷dACSF中进行。
5. 振动切片
注意:在以下步骤中,组织背面必须用一块立方体琼脂糖支撑。
- 将振动切片机刀片沿水平轴放置,并将脑干粘在切片托盘上。粘合嘴侧,保持喙尾轴垂直以形成冠状切片。
- 保持矢状切片的外侧-内侧轴垂直。
- 粘合腹侧,保持背腹轴垂直以进行水平切片。
- 为了达到锐角矢状水平面,粘合脑干的腹侧,保持腹背轴垂直于琼脂糖块的斜边表面,以 45° 角切割。将琼脂糖块的相对表面粘向切片托盘,并保持喙尾轴与刀片边缘平行。
6. 处理易碎或大块的脑干组织
- 在步骤5的替代方法中,将分离的脑干浸入~40°C的35mm x 10mm培养皿中的4%低熔点(LMP)琼脂糖中。
- 将琼脂糖倒在浸入的脑干上后,将培养皿放在冰上凝固。使用锋利的剃须刀片切割嵌入脑干的立方体琼脂糖块。
- 将LMP琼脂糖块粘在其嘴侧,保持脑干的嘴部-尾轴垂直。
- 取冠状切片,直到可以看到 NM 区域。
- 用锋利的刀片从胶水中取出琼脂糖块。要点斑细胞核,请用细针轻轻将 0.5 μL 染料(甲苯胺蓝或橙色 G)放在 NM 上。
- 将此块重新安装在切片托盘上以进行矢状切片或水平切片,并相对于染色区域识别细胞核。
- 为获得最佳性能,请将颤音切片机切片速度设置为 4 - 5 (~30 ± 4 mm/min),振动频率为 85-87 Hz,切片幅度设置为 4-6 (~1 ± 0.2 mm)。
- 脑干切片后,将200-300μm顺序收集的切片置于市售切片室中,在ACSF中室温下平衡1小时,连续鼓泡95%O 2 / 5%CO 2(pH 7.2-7.4,渗透压300-310mOsm / L)。在这些条件下,切片在5-6小时内保持活力。
7. 电生理学:膜片钳手术
- 将脑干切片转移到记录室,连续灌注含碳氧ACSF ~1.5 ± 0.5 mL/min。
- 用吸头直径为1-2μm的微量移液器拉动贴片移液器,电阻在3-6MΩ范围内。
- 用基于K-葡萄糖酸的内部溶液填充移液器(用于电流钳记录)。
- 要测试切片内不同异位区域的神经元特性,请将神经元定位在切片平面的两端,并使用记录电极接近。
- 在接近神经元时保持移液器尖端的正气压。
- 向体细胞移动,直到在神经元上看到压痕。快速执行接下来的两个步骤。
- 通过释放正气压进行千兆欧(1 GΩ)密封。
- 将放大器设置保持在电压钳模式,并将移液器偏移校正为零pA。运行密封测试(100 Hz 时的 10 mV 测试脉冲)。施加负气压以破坏神经元膜的一小块。
- 为了测试听觉神经元的活性内在特性,请应用超极化和去极化体细胞电流注入。
注意:此过程的示例可以在补充视频 S1、S2 中可视化。视频图例中提供了此过程的详细信息。
结果
此处显示的所有脑干切片均取自脑干组织(~200-300μm),并使用5倍物镜和微分干涉对比(DIC)光学器件成像。相机安装在解剖显微镜上,并通过图像采集软件连接到计算机(见材料表)。这些图的卫星插图(右图)使用60倍放大水浸物镜成像。注意确保在获得数字图像时脑干切片的所有区域均等放大。照片以最佳亮度和焦点拍摄。脑干切片的数字图像基于重叠区域以平面方式缝合并导入台式计算机以进一步调整亮度、对比度和灰度。根据先前的工作1,2,5,13鉴定了鸡听觉脑干的基本微电路。在显微镜下(5倍物镜),听觉核被确定为与沿着切片背侧区域沿同侧和对侧围绕每个核流动的重髓鞘神经纤维相邻的区域。
图1显示了来自E21鸡胚的传统脑干组织冠状切片(200-300μm)。这里显示的四个冠状切片代表听觉脑干核的相对等频区域,从最低CF听觉区域(图1A,尾外侧)发展到最高CF听觉区域(图1D,口内侧)。对于图1A-D中的所有四个冠状切片,标记的NM和NL的放大区域显示在中间列中,并在图面板的右视线上放大(60倍物镜)(分别为卫星插图中的a和b)。图1A,B中的箭头表示听觉神经纤维的输入,箭头显示切片左侧NM轴突的分叉。图1C显示了另一种鸟类耳蜗核结构,称为角核(NA,左边箭头,右边箭头)。两个最喙状的冠状切片显示位于冠状切片腹侧区域的上寡核(SON)(图1C,D,白色虚线圆圈)。
图2显示了来自E21鸡胚的脑干组织矢状切片(200-300μm)。对于所有三个矢状切片(图2A-C),标记的NM和NL的放大区域显示在中间列中,并在图面板的右视线上放大(60倍物镜)(卫星图像中的a和b)。NM和NL被鉴定为听觉神经纤维(图2A,中间箭头)进入在较高放大倍率下观察到的神经元簇(图2A,中间,小,白色虚线圆圈和箭头)并突出显示听觉区域的起点(图2A,左,大的白色虚线圆圈和箭头)。在最侧切的前侧区域鉴定出SON(图2A,小的白色虚线圆圈)。图2B显示了扩展的负位区域,其中包含沿喙尾轴的NM和NL的相对低CF和高CF听觉区域(白色轮廓区域,另见卫星插图)。图2C显示了最内侧切片和听觉区域的终点(左箭头和中间箭头)中的同侧和对侧轴突簇。此处显示的切片方向与图1所示的传统切片方向(即冠状)形成鲜明对比。这样做是为了显示最适合电生理记录所需的玻璃移液器接近的方向。
为了确认图2B中表示了异位轴的大区域,对NM神经元进行了电流钳电生理学记录。 图3显示了从冠状切片(图3A,B)和矢状切片(图3C,D,补充视频S1,S2)记录的成熟(E21)NM神经元的功能异同。从冠状切片的内侧和外侧端(类似于图1B所示的切片)中选择两个NM神经元,从矢状切片中NM的喙端和尾端选择两个NM神经元(如图2B所示的切片所示)。图3A,B显示了与体细胞电流注入相似的电生理响应特性(−100 pA至+200 pA,+10 pA增量,持续时间为100 ms)。这两个NM神经元的放电模式在这个切片平面上表现出细微的差异,表明中频NM神经元的相对等频层。图3C,D显示,放电模式在喙尾轴上具有实质性差异,表明从低频NM神经元(图3C)到高频NM神经元(图3D)的单位梯度相对较高。两个神经元都表现出它们之前报道的刻板放电模式14,15。
图4显示了E21鸡胚的脑干组织水平切片(200-300μm)。对于两个水平切片(图4A,B),标记的NM和NL的放大区域显示在中间列中,并在图面板的右视线上放大(60倍物镜)(分别为卫星插图中的a和b)。在水平切片中,NM和NL被鉴定为中线,神经元沿外侧 - 内侧轴分布(图4A,B,中间,白色,虚线轮廓区域)。放大的图像显示了异位梯度的大范围。低频神经元位于尾外侧区域,高频神经元位于口内侧区域(图4A,B,右,卫星)。沿着口尾轴穿过中线的纤维显示了听觉核的对侧连接,但这些纤维的组织不是在一个简单的平面上。然而,来自水平/横向截面的急性角切片可以沿着这些轴突纤维朝向矢状面。图5显示了从水平面以锐角(45°)的200-300μM厚的脑干组织切片。听觉脑干核可以在从最侧切开始到最内侧切片结束的大对角线扩散中看到(图 5A-C,标记中间面板,白色轮廓区域)。此外,NM和NL区域的角度方向也可以在连续的不对称切片中可视化(图5A-C,标记的中间面板,白色,虚线轮廓区域)。放大图像(60倍物镜)显示了听觉核的负直轴,因为它沿着口内侧轴向尾外侧轴运动(图5A-C,右,卫星插图)。图 5 中的切片方向与图 2 中的类似。它们与传统的图像呈现方式形成鲜明对比,但更适合电生理实验。
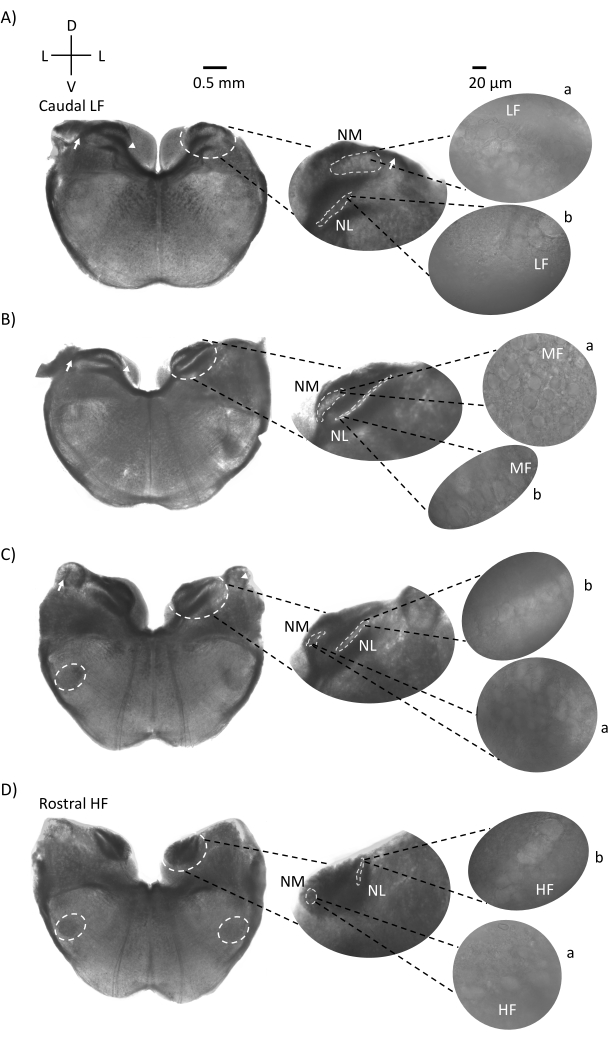
图1:具有代表性的脑干冠状序列切片。 (A-D) 左:从尾轴到喙轴的切片,听觉核和连接纤维用白色虚线圆圈标记。中间插入的是听觉区域的较大视图,其中细胞核显示在白色虚线圆圈 a:NM 和 b:NL 内。箭头显示听觉神经传入纤维,箭头显示 A,B 中的 NM 轴突分叉。箭头显示 C 中的 NA。横向白色虚线圆圈以 C,D 表示 SON。右图:卫星插页显示了这些原子核在60倍物镜下:a:NM和b:NL。缩写:NM = 大细胞核;NL = 海带核;NA = 角核;SON = 上寡核;LF = 相对低频的神经元;MF = 中频神经元;HF = 高频神经元;D = 背侧;L = 横向;V = 腹侧。请点击此处查看此图的大图。
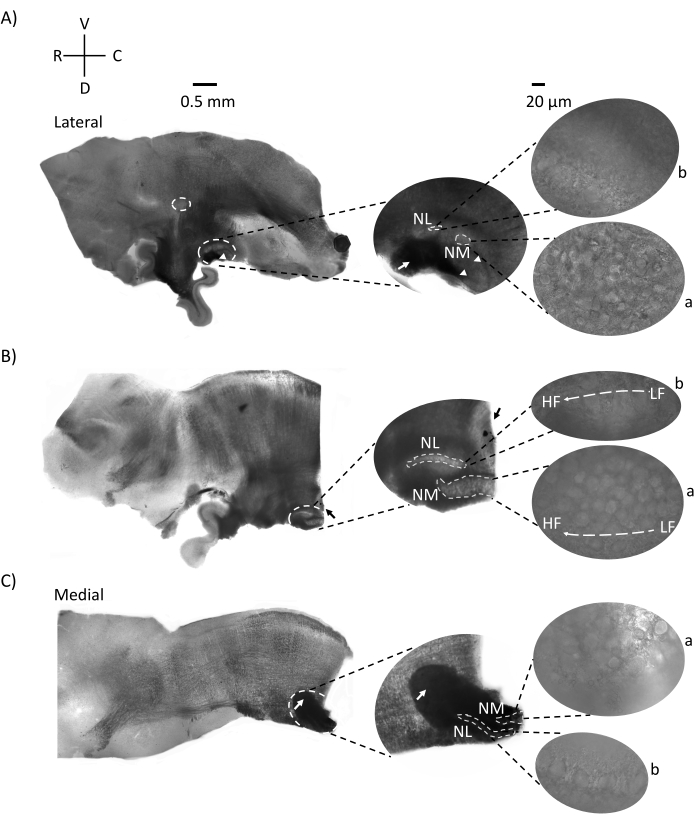
图2:代表性的脑干矢状连续切片。 (A-C) 左:从外侧轴到内侧轴的切片,听觉核用白色虚线圆圈标记。中间的插入物在较大的视图中显示了相同的听觉核区域,在白色虚线圆圈内标记。(A) 切片中心的白色虚线圆圈突出显示 SON;箭头显示听觉神经纤维,箭头显示NA。切片右侧尖端的深黑色斑点是成像伪影。在左图的切片A和B中,可以看到小脑区域在听觉区域的背侧。(B)矢状切片,其方向更改为冠状面(切片期间)。用蓝色染料(黑色箭头)识别听觉区域,并再次在矢状面上切片。(A-C)中间插入 NM 和 NL 区域,标记在白虚线下。右图:卫星视图显示了在60倍物镜放大倍率下观察到的a:NM和b:NL。听觉核中的LF和HF异位梯度沿前尾轴显示。指向(C)中暗区的箭头显示通过内侧轴穿过中线的重髓鞘NM纤维。纤维连接听觉核的两侧。缩写:NM = 大细胞核;NL = 海带核;NA = 角核;SON = 上寡核;LF = 相对低频的神经元;HF = 高频神经元;D = 背侧;V = 腹侧;R = 噗噗;C = 尾部。请点击此处查看此图的大图。
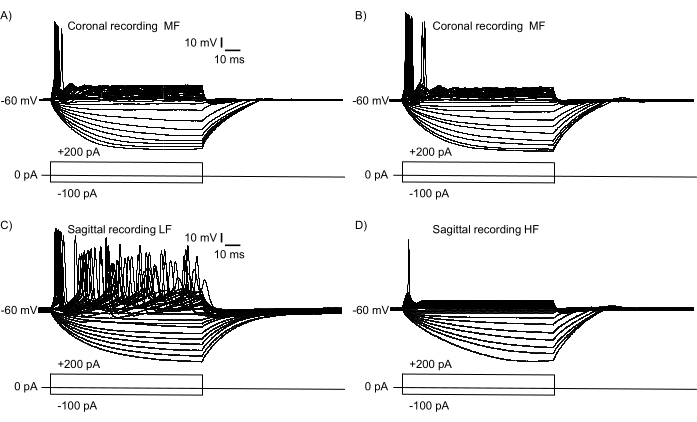
图 3:电流钳位模式下神经元对体细胞电流注入(−100 pA 至 +200 pA,+10 pA 增量,100 ms 持续时间)的电生理记录。 选择神经元在同一切片中记录,但在NM的极端相反区域。(一,二)单个冠状切片中的代表性神经元反应表明具有细微差异的相对等频特性。响应特性代表从冠状切片中NM的最内侧(A)和外侧(B)区域记录的两个不同的MF神经元。(中,四)来自单个矢状切片的代表性神经元记录。记录显示相对的LF NM反应(C)和HF NM反应(D),突出了单个矢状切片内肌张力梯度的实质性差异。缩写:NM = 大细胞核;LF = 相对低频的神经元;MF = 中频神经元;HF = 高频神经元。 请点击此处查看此图的大图。
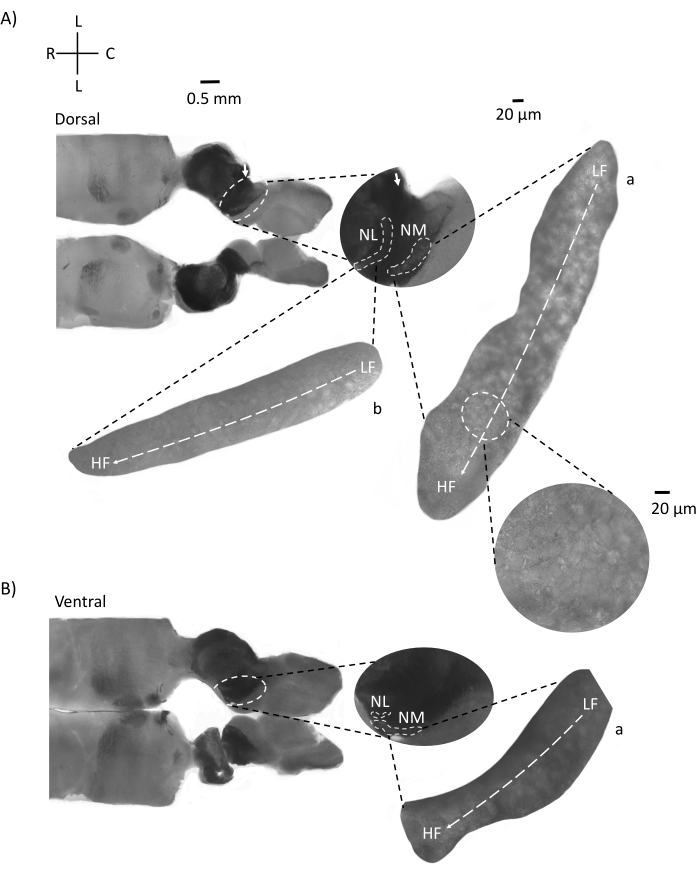
图 4:脑干的代表性水平序列切片。 (一,二)左:沿背侧至腹轴切片,听核用白色虚线圆圈标记。第 8 颅 神经传入纤维连接标有箭头的听觉核。中间插入的是听觉核区域的较大视图,听觉核用白色虚线标记NM和NL区域。在 A,B中可以看到听核的明显拓扑运动。(一,二)右图:显示 a:NM和 b:NL的大型卫星视图。右插页显示了在 60 倍物镜放大倍率下观察到的听核,以及沿尾外侧到喙内侧轴从 LF 到 HF 的弯曲拓扑轴。缩写:NM = 大细胞核;NL = 海带核;LF = 相对低频的神经元;HF = 高频神经元;L = 横向;R = 噗噗;C = 尾部。 请点击此处查看此图的大图。
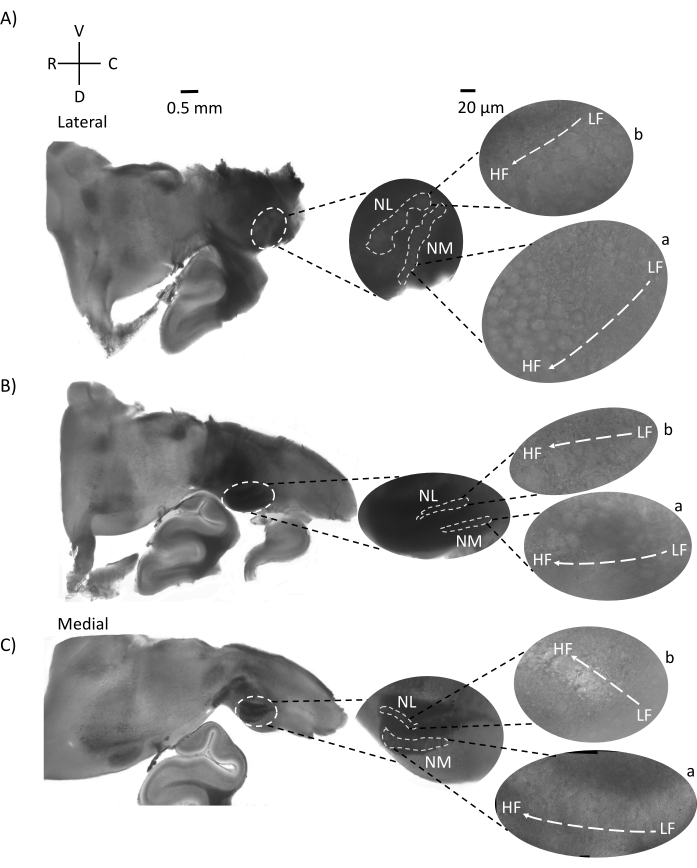
图 5:代表性的水平/横向锐角 (45°) 系列切片。 (A-C) 左:脑干的连续切片,用白色虚线圆圈标记的听觉核。中间插入是听觉区域的较大视图。(A)中间插入显示NM和NL神经元在这些切片中的最大分布。(乙,丙)中间插入:用白色虚线标记的听觉核与(A-C)相比显示出逐渐的拓扑变化。右:卫星插页显示60倍物镜放大倍率下的听觉核a:NM和b:NL。NM和NL中从LF到HF区域的异位轴从侧切到内侧切片成角度旋转。缩写:NM = 大细胞核;NL = 海带核;LF = 相对低频的神经元;HF = 高频神经元;V = 腹侧;R = 噗噗;D = 背侧;C = 尾部。请点击此处查看此图的大图。
补充视频S1:超极化和去极化体细胞电流注入。 在电流钳位模式下,从低频和高频神经元到100 ms体细胞电流注入的响应特性。神经元选自相同的矢状脑干切片。进样范围为 -100 至 +200 pA,增量为 +10 pA,持续时间为 100 ms。动作电位响应于足够的去极化电流阶跃。该视频对应于 图3C所示的最终迹线。 请点击此处下载此文件。
补充视频S2:超极化和去极化体细胞电流注入。 与 补充视频S1类似,该视频显示了在电流钳位模式下从低频和高频神经元到100 ms体细胞电流注入的响应特性。神经元选自相同的矢状脑干切片。进样范围为 -100 至 +200 pA,增量为 +10 pA,持续时间为 100 ms。动作电位响应于足够的去极化电流阶跃。该视频对应于 图3D所示的最终迹线。 请点击此处下载此文件。
讨论
几十年来,鸡胚胎脑干组织的冠状切片允许研究相对个体等频薄片1,2,5。然而,鸡听觉脑干的异位(即频率)组织在拓扑上是复杂的,并且根据具体的研究问题在其他解剖轴上可能更容易获得。虽然足以研究与单个等频区域有关的解剖学和生理学问题,但对肌张力变化及其在较大听觉脑干区域的发展的研究在一定程度上受到冠状部分的限制。为了克服这一限制,该协议描述了矢状面,水平面和水平/横向平面的方法,以提供听觉脑干组织的其他示例,这些组织在单个脑干部分中表现出最大的异位特性和梯度。
听觉脑干区域的矢状面显示,与冠状切片相比,不同的肌张力区域分布在切片内的较大区域(矢状听觉面积= ~300-600μm,冠状听觉面积= ~200-350μm)。例如,NM和NL区域在矢状切片中沿前尾轴的较大区域上可视化(例如,图2B),并且沿该解剖轴延伸的功能异位梯度主要包含在单个矢状切片中。这进一步证实了这一点,电流钳记录了沿口尾梯度变化的内在神经元差异,如先前报道的14,15所示(例如,图3C,D)。未来突出沿肌腈轴的解剖学和免疫组织化学特性的实验可以进一步研究单个矢状切片平面内已知的听觉特性梯度。这些包括但不限于MAP2染色和钾通道表达模式,它们是树突结构的已知梯度以及NM和NL的内在特性,先前已在连续的冠状部分16中显示。
听觉脑干区域的水平部分显示NM和NL位于中线。一部分听觉轴索纤维对角线或垂直于水平面(图4)。这些纤维之后可以通过在矢状面上制作45°的急性角切片。由此产生的水平/横向切片大于矢状或水平切片,并且长轴突纤维穿过同侧和对侧的前尾轴。NM和NL都可以在较大的对角线区域(~400-700μm)中可视化,以便可以沿外侧 - 内侧轴观察对侧连接。此外,水平/横向切片平面还显示了听觉区域和由此产生的斜面梯度如何进行角度转弯(图 5)。对侧连接在更大区域内的角度暴露使得这些切片比传统的冠状切片更适合电生理刺激和微电路研究。
其他优势
听觉微电路的形成需要促进神经元存活、突触发生、轴突分化、树突结构和成熟的线索的时空协调。因此,鸡胚胎听觉微电路的替代脑干部分可用于以下研究课题:地形不同维度上神经元的形态组织;组织和绘制所有听觉和前庭核的连接体;识别和表征等频和异位平面中电路成分的活动模式;兴奋性与抑制性微电路的地形组织以及与特殊神经元群(细胞核)的关系;听觉核神经元的空间位置及其预测CF17;系统靶向特定的异位神经元类型;跟踪祖细胞及其发育为保守细胞核;细胞遗传谱系到神经元回路进化18;物种间脑干解剖学比较;研究前庭回路,如戴特前庭复合体(DC)19;以及前庭核之间的同步和串扰。
使用不同切片平面的多方面方法可能有助于回答有关脑干微电路未知解剖学和生物物理特性的基本问题。一个很好的例子是主要听觉核(NM、NA、NL 和 SON)和前庭核之间的关系,包括侧侧核 (LLDp)、半月核 (SLu)20 和切向核 (TN)3。然而,该协议和这些基于切片的研究确实存在一些局限性。
注意事项和限制
根据进行实验的机构,道德准则和鸡胚胎的处理可能会有所不同。虽然美国国立卫生研究院实验动物护理和使用指南允许快速斩首,但鸡胚胎安乐死还有其他方法21。与较老的胚胎相比,早期发育的鸡胚脑干组织柔软而脆弱。它的表面有几个连接和血管,在移除它们时需要格外小心。组织应保存在冰冷的dACSF中,并灌注95%O 2/5%CO2以增加活力。
矢状切片方法仅对同侧肌膜切除术有用。这种切片方法提供的切片比冠状切片更大,其处理可能不稳定。然而,人们可以使用在其他地方详细描述的十字针方法修剪切片22。使用4%LMP琼脂糖嵌段嵌入脑干可以保存切片中的精细结构,但必须注意不要倒入过热的琼脂糖。通过将琼脂糖阻断的脑干置于冷藏环境中~1分钟来快速设置它,使切片更适合电生理记录。
过量使用强力胶可能有毒。必须尽量减少使用,并且应通过更换dACSF立即清洗多余的量。对于急性角(45°)切片,切割琼脂糖块的角度至关重要;人们可以使用镜子看到前角,同时用锋利的刀片切割琼脂糖块。市售刀片可能具有蜡涂层,应在使用前用酒精擦拭并干燥。需要优化振动切片机切割速度和频率,因为轴突纤维簇比皮质或基质组织更硬。保持高振幅并使用冷冻解剖液可以防止组织损伤。
所有溶液应新鲜制备,在鼓泡95%O 2/5%CO2后,应将Ca 2+和Mg2+加入ACSF中。 否则,可能会有Ca2+的沉淀。应使用画笔轻轻处理振动切片机内的切片。如果可能,将总切片时间保持在 15 分钟以内。玻璃巴斯德移液器可用于操纵脑干切片。
请勿对接触电生理学切片的玻璃器皿和设备使用洗涤剂或腐蚀性清洗剂。拍摄的图像代表了微分干涉对比(DIC)光学器件下200-300μM厚组织的外观。视觉质量将比免疫组织化学或电子显微镜差,但它准确地反映了实验者在进行电生理记录时将看到的内容。
有关沿替代解剖轴的微电路早期发展的研究,无论是背-腹侧、口-尾还是同侧-对侧,都仅限于鸡听觉脑干。其中一个原因是转录代码的作用和脑干中异位发育的调节仍未完全了解。在 体外观察活动时,自上而下的调节和自发活动等功能现象经常丢失。然而, 体内 研究得到了仅在这些切片条件下才可能的特定和直接单神经元记录的补充。沿不同方向获得脑干组织的细化可以为鸡听觉脑干微回路中异位梯度的发展和复杂性提供有见地的信息。
披露声明
所有作者都声明,该研究是在没有任何商业或经济利益的情况下进行的,并且他们没有任何利益冲突。
致谢
这项工作得到了NIH / NIDCD R01 DC017167资助的支持。我们感谢克里斯汀·麦克莱伦(Kristine McLellan)对手稿的早期版本提供编辑评论。
材料
| Name | Company | Catalog Number | Comments |
| Adobe photoshop 2021 | Adobe | ||
| Anti-vibration table 30"x 36" - OTMC - 63533 | TMC | ||
| Cell sens standard software | OLYMPUS | ||
| Digidata 1440A | MOLECULAR DEVICES | ||
| Digital amplifier multiclamp 700B | MOLECULAR DEVICES | ||
| DSK line-up linearslicer pro7 | TED PELLA, INC | ||
| Micromanipulator MPC-385 / OSI-MPC-385-2 | OLYMPUS AMERICA INC | ||
| Micropipette puller P-97 | SUTTER INSTRUMENTS | ||
| Microscope BX51W1 | OLYMPUS AMERICA INC | ||
| MS ICE software | Microsoft Corporation | ||
| Ohaus balance model AV212 | Ohaus Adventurer | ||
| Olympus DPSI0 /DPS80 camera | OLYMPUS | ||
| pClamp and Axoclamp data Acquisition Softwares | MOLECULAR DEVICES | ||
| pH meter lab 850 benchtop | SCHOTT INSTRUMENTS | ||
| Sharp stainless blade | Dorco/Personna | ||
| Vapor pressure osmometer model 5600 | WESCOR INC | ||
| Water purification systems Smart2pure 6UV/UF | Thermo Scientific | ||
| Chemicals- list | |||
| Agrose Low melt IB70051 | IBI SCIENTIFIC | ||
| CaCl2 (Calcium Chloride) | ACROS organics | ||
| Cynergy instant adhesive CA6001 | Resinlab | ||
| Dextrose (D-(+)-glucose) | VWR Life Science | ||
| Ethyl alcohol | IBI SCIENTIFIC | ||
| KCl (Potassium Chloride) | Amresco.Inc | ||
| MgCl2 (Magnesium Chloride) | Sigma-Aldrich | ||
| NaCl (Sodium Chloride) | Amresco.Inc | ||
| NaH2PO4 (Sodium Dihydrogen Phosphate) | Amresco.Inc | ||
| NaHCO3 (Sodium Bicarbonate) | Amresco.Inc |
参考文献
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 164 (4), 411-433 (1975).
- Rubel, E. W., et al. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 166 (4), 469-489 (1976).
- Shao, M., et al. Spontaneous synaptic activity in chick vestibular nucleus neurons during the perinatal period. Neuroscience. 127 (1), 81-90 (2004).
- Fukui, I., Ohmori, H. Tonotopic gradients of membrane and synaptic properties for neurons of the chicken nucleus magnocellularis. Journal of Neuroscience. 24 (34), 7514-7523 (2004).
- Sanchez, J. T., Seidl, A. H., Rubel, E. W., Barria, A. Preparation and culture of chicken auditory brainstem slices. Journal of Visualized Experiments. (49), e2527(2011).
- Sanchez, J. T., Lu, Y. Glutamate signaling in the auditory brainstem. Auditory Development and Plasticity: Springer Handbook of Auditory Research. Fay, R. R., Popper, A. N., Cramer, K., Coffin, A. 64 (4), Springer. New York, NY. 75-108 (2017).
- Parks, T. N. Morphology of axosomatic endings in an avian cochlear nucleus: nucleus magnocellularis of the chicken. Journal of Comparative Neurology. 203 (3), 425-440 (1981).
- Jhaveri, S., Morest, D. K. Sequential alterations of neuronal architecture in nucleus magnocellularis of the developing chicken: a Golgi study. Neuroscience. 7 (4), 837-853 (1982).
- Carr, C. E., Boudreau, R. E. Central projections of auditory nerve fibers in the barn owl. Journal of Comparative Neurology. 314 (2), 306-318 (1991).
- Köppl, C. Auditory nerve terminals in the cochlear nucleus magnocellularis: differences between low and high frequencies. Journal of Comparative Neurology. 339 (3), 438-446 (1994).
- Fukui, I., et al. Improvement of phase information at low sound frequency in nucleus magnocellularis of the chicken. Journal of Neurophysiology. 96 (2), 633-641 (2006).
- Wang, X., et al. Postsynaptic FMRP regulates synaptogenesis in vivo in the developing cochlear nucleus. Journal of Neuroscience. 38 (29), 6445-6460 (2018).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments. (124), e55628(2017).
- Hong, H., Sanchez, J. T. Need for speed and precision: structural and functional specialization in the cochlear nucleus of the avian auditory system. Journal of Experimental Neuroscience. (12), 1-16 (2018).
- Hong, H., et al. Diverse intrinsic properties shape functional phenotype of low-frequency neurons in the auditory brainstem. Frontiers in Cellular Neuroscience. 12, 1-24 (2018).
- Wang, X., Hong, H., Brown, D. H., Sanchez, J. T., Wang, Y. Distinct neural properties in the low-frequency region of the chicken cochlear nucleus magnocellularis. eNeuro. 4 (2), 1-26 (2017).
- Tabor, K. M., et al. Tonotopic organization of the superior olivary nucleus in the chicken auditory brainstem. Journal of Comparative Neurology. 520 (7), 1493-1508 (2012).
- Lipovsek, M., Wingate, R. J. Conserved and divergent development of brainstem vestibular and auditory nuclei. Elife. 7, 40232(2018).
- Passetto, M. F., et al. Morphometric analysis of the AMPA-type neurons in the Deiter's vestibular complex of the chick brain. Journal of Chemical Neuroanatomy. 35 (4), 334-345 (2008).
- Curry, R. J., Lu, Y. Intrinsic properties of avian interaural level difference sound localizing neurons. Brain Research. 1752, 147258(2021).
- Aleksandrowicz, E., Herr, I. Ethical euthanasia and short-term anesthesia of the chick embryo. ALTEX - Alternatives to Animal Experimentation. 32 (2), 143-147 (2015).
- Palkovits, M. Isolated removal of hypothalamic or other brain nuclei of the rat. Brain Research. 14 (59), 449-450 (1973).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。