Method Article
Schneiden des embryonalen Hühnerhirnstamms zur Bewertung tonotopischer Gradienten und Mikroschaltkreise
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Gewinnung nicht-koronaler auditorischer Hirnstammschnitte des Hühnerembryos zur Untersuchung von tonotopischen Eigenschaften und Entwicklungsverläufen innerhalb einer Hirnstammscheibe. Diese Schnitte umfassen sagittale, horizontale und horizontale / transversale Abschnitte, die größere tonotopische Regionen innerhalb einer einzelnen Schichtebene umfassen als die traditionellen koronalen Abschnitte.
Zusammenfassung
Der Hühnerembryo ist ein weithin akzeptiertes Tiermodell zur Untersuchung des auditorischen Hirnstamms, bestehend aus hochspezialisierten Mikroschaltkreisen und neuronaler Topologie, die differentiell entlang einer tonotopen (dh Frequenz) Achse orientiert sind. Die tonotopische Achse erlaubt die segregierte Kodierung von hochfrequenten Klängen in der rostral-medialen Ebene und niederfrequenter Kodierung in caudo-lateralen Regionen. Traditionell erlauben koronale Hirnstammschnitte von embryonalem Gewebe die Untersuchung relativer individueller iso-Frequenzlamina. Obwohl ausreichend, um anatomische und physiologische Fragen in Bezug auf einzelne iso-Frequenzregionen zu untersuchen, ist die Untersuchung der tonotopischen Variation und ihrer Entwicklung über größere auditorische Hirnstammbereiche hinweg etwas begrenzt. Dieses Protokoll berichtet über Hirnstammschnitttechniken aus Hühnerembryonen, die größere Gradienten von Frequenzbereichen im unteren auditorischen Hirnstamm umfassen. Die Verwendung verschiedener Schnittmethoden für Hühner-Hirnstammgewebe ermöglicht elektrophysiologische und anatomische Experimente innerhalb einer Hirnstammscheibe, bei denen größere Gradienten von tonotopischen Eigenschaften und Entwicklungsverläufen besser erhalten sind als koronale Abschnitte. Mehrere Slicing-Techniken ermöglichen eine verbesserte Untersuchung der vielfältigen anatomischen, biophysikalischen und tonotopischen Eigenschaften von auditorischen Hirnstamm-Mikroschaltkreisen.
Einleitung
Der Hühnerembryo ist ein wertvolles Forschungsmodell, um grundlegende biologische Fragen in zahlreichen und vielfältigen wissenschaftlichen Bereichen wie Zellbiologie, Immunologie, Pathologie und Entwicklungsneurobiologie zu untersuchen. Die Mikroschaltung des Hörhirnstamms des Huhns ist ein hervorragendes Beispiel für einen hochspezialisierten Schaltkreis, der in Bezug auf die auditive Morphologie und Physiologie verstanden werden kann. Zum Beispiel beschrieben Rubel und Parks (1975) erstmals die tonotopische Orientierung (d.h. Frequenzgradient) des Hühnerkerns magnocellularis (NM) und des Nucleus laminaris (NL) als lineare Funktion über die Achse der Kerne, die ~30° in Bezug auf die sagittale Ebene orientiert ist. Einzelne Neuronen in NM und NL kodieren ihre beste Schallfrequenz - bekannt als ihre charakteristische Frequenz (CF) - entlang der rostral-medialen Ebene zur caudo-lateralen Region. Hochfrequente Neuronen befinden sich im rostral-medialen Bereich und niederfrequente Neuronen caudo-lateral. Daher haben traditionelle Dissektionsmethoden von auditorischem Hirnstammgewebe zur Untersuchung onotopischer Eigenschaften aufeinanderfolgende koronale Schnitte verwendet. Tatsächlich haben sich auditive Mikroschaltkreise von sich entwickelnden Hühnerembryonen als Modellsystem für die Untersuchung der Signalverarbeitung von tonotopischen Hörfunktionen durch aufeinanderfolgende kaudale bis rostrale koronale Hirnstammschnitte für Jahrzehnte etabliert 1,2,3,4,5,6.
Die tonotopische Organisation von NM und NL ist jedoch topologisch und morphologisch verworren. Hörnerveninputs sind so verteilt, dass hohe CF-Inputs in endbulbartigen Strukturen enden, die mindestens ein Viertel des somatischen Umfangs einer adendritischen NM-Zelle bedecken. Umgekehrt sind niedrige CF-Eingänge nicht mit glühbirnenartigen Endanschlüssen organisiert, sondern mit mehreren Boutonsynapsen auf Dendriten von NM-Neuronen. Mittlere CF-Eingänge enden sowohl als Endkolben als auch als Bouton-ähnliche Synapsen 4,7,8,9,10,11,12. In NL zeigt sich der stark stereotype dendritische Gradient nicht nur in der dendritischen Länge, sondern auch in der dendritischen Breite. Dieser einzigartige dendritische Gradient entspricht eng der tonotopischen Achse. Die Dendriten erfahren eine 11-fache Längen- und Fünffache Zunahme der Breite von High- zu Low-CF-Neuronen bzw.6. Um solche verworrenen Verteilungen dieser Kerne in koronalen Schnitten zu überwinden, beschreibt dieses Protokoll Dissektionsansätze in der sagittalen, horizontalen und horizontalen/transversalen Ebene. Diese Schnitttechniken liefern Beispiele für auditorisches Hirnstammgewebe, das maximale tonotopische Eigenschaften in einer einzelnen Schnittebene aufweist.
Protokoll
Alle Verfahren wurden von den Northwestern University Institutional Animal Care and Use Committees (IACUC) genehmigt und in Übereinstimmung mit den Richtlinien der National Institutes of Health für die Pflege und Verwendung von Labortieren durchgeführt. Die Protokolle für die Dissektion und Präparation von Hirnstammgewebe entsprechen den früheren Protokollen 5,13.
1. Umgang mit Eiern
- Kaufen Sie befruchtete Eier (Gallus gallus domesticus) von einem von der IACUC zugelassenen lokalen Tierlieferanten.
- Die Eier sofort nach ihrer Ankunft im Kühlschrank bei 14 °C lagern und innerhalb von 5 Tagen inkubieren.
HINWEIS: Die Lebensfähigkeit des Embryos nimmt nach 1 Woche erheblich ab. - Sterilisieren Sie die Eier mit 70% Ethanol vor der Inkubation bei 38 ± 1 °C und ~50% Feuchtigkeit.
2. Zusammensetzung und Zubereitung künstlicher Rückenmarksflüssigkeit (ACSF)
- Mischen Sie die folgenden Chemikalien in 1 L von 18,2 MΩcm dH2O, um eine 10x ACSF-Stammlösung zu erhalten: NaCl (Natriumchlorid) 130 mM, NaHCO3 (Natriumbicarbonat) 26 mM, KCl (Kaliumchlorid) 2,5 mM,NaH2PO4(Natriumdihydrogenphosphat) 1,25 mM, Dextrose (D-(+)-Glucose) 10 mM. Bewahren Sie die Stammlösung im Kühlschrank auf.
- MgCl2 (Magnesiumchlorid) 1 M und CaCl2 (Calciumchlorid) 1 M Lösungen getrennt in 18,2 MΩcmdH2Oherstellen und im Kühlschrank aufbewahren.
- Unmittelbar vor Gebrauch 10x ACSF auf 1x verdünnen und kontinuierlich mit 95% O2/5% CO2 für 15-20 min blubbern und MgCl2 und CaCl2 hinzufügen. Zur Herstellung von ACSF und dACSF (Dissektion von ACSF) auf eine Endkonzentration von Mg 2+ 1 mM, Ca 2+ 3 mM bzw. Mg 2+ 3 mM, Ca 2+ 1 mM einstellen.
- Stellen Sie die Sprudelrate für die ACSF so ein, dass der pH-Wert 7,2-7,4 mit einer Osmolalität zwischen 300 und 310 mOsm / L beträgt.
HINWEIS: Wenn das ACSF während des Blubberns in ein Eisbad gelegt wird, ist dies vorteilhaft für die Aufrechterhaltung einer niedrigen Lösungstemperatur, die die strukturelle Integrität des Gewebes während des Sezierens unterstützt.
3. Agarose (5%) Blockzubereitung
- Mischen Sie 5 g Agarose in 100 ml dACSF. Verwenden Sie ein 100 °C warmes Wasserbad oder eine Mikrowelle für 2-3 min und rühren Sie alle 30 s, um Klumpen zu vermeiden, bis sich die Agarose vollständig auflöst und zu sprudeln beginnt.
- Die geschmolzene Agarose in eine leere Petrischale mit einer Dicke von bis zu 5 mm gießen und bei Raumtemperatur festhalten. Nach dem Abbinden die Petrischale mit Parafilm verschließen und bei 4 °C lagern.
- Schneiden Sie die Agarose mit einer scharfen Klinge in kubische Blöcke und verwenden Sie sie zum Zeitpunkt der Zerlegung.
4. Dissektionsprotokoll und Isolierung des auditorischen Hirnstamms
- Reinigen Sie den Sezierbereich mit 70% Ethylalkohollösungsspray.
- Kleben Sie den tragenden oder abgewinkelten Agaroseblock auf die Vibratomschale.
- Wählen Sie Eier des gewünschten Alters (E20 und E21 im vorliegenden Protokoll). Behandeln und inkubieren Sie die Eier gemäß den oben aufgeführten Protokollen wie in Schritt 1.
- Suchen Sie den luftgefüllten Raum, indem Sie das Ei unter ein helles Licht (Durchleuchtung) legen und diesen Raum auf der größeren oder runderen Seite des Eies suchen.
- Akklimatisieren Sie die Eier auf Raumtemperatur, knacken Sie die Schale über dem luftgefüllten Raum und legen Sie den Membransack frei.
- Machen Sie einen sanften Schnitt in den Sack, um den Schnabel freizulegen.
- Ziehen Sie mit einem Skalpell Hals und Kopf vorsichtig aus dem Ei.
- Schnell den Kopf mit einer scharfen Schere enthaupten.
- Reinigen Sie den Kopf nach der Enthauptung mit eisgekühltem dACSF, um überschüssiges Blut aus dem Präparierpad zu entfernen.
- Halten Sie den Kopf in eisgekühltem dACSF ruhig und machen Sie einen rostro-kaudalen Einschnitt. Beginnen Sie den Schnitt hinter und zwischen den Augen und folgen Sie der Länge des geernteten Halses.
HINWEIS: Jüngere Embryonen benötigen möglicherweise weniger Druck während des Schnitts. - Trennen Sie die Haut, um den Schädel freizulegen.
- Schneiden Sie den Schädel hinter dem Auge in eine Mittellinie bis seitliche Richtung. Tun Sie dies für beide Hemisphären.
HINWEIS: Dieser Schritt hilft, den rostralen Teil des Schädels vom angeschlossenen Gehirn zu trennen, während das Hirngewebe intakt bleibt5. - Schneiden Sie den rostralen Teil des Schädels. Legen Sie die Klinge hinter die Augen und machen Sie einen schnellen Schnitt.
HINWEIS: Es kann erforderlich sein, den angebrachten Schädel sauber zu schneiden. - Tauchen Sie den Kopf in eine Schüssel mit kaltem dACSF.
- Machen Sie mit einer kleinen Schere Mittellinien- bis Seitenschnitte in der kaudalen Region des Schädels, um zu versuchen, das Gehirn vom Schädel zu trennen, ohne Gewebeschäden zu verursachen.
- Legen Sie den Hirnstamm und das Kleinhirn vorsichtig frei. Ziehen Sie den dorsalen Bereich des gesamten Schädels zurück, entfernen Sie den Hirnstamm vorsichtig und legen Sie ihn mit Hilfe eines feinen Pinsels mit leichtem Schlittenfahren frei. Verwenden Sie gebogene Pinzetten, um den Hirnstamm von Verbindungsgewebe und Blutgefäßen zu reinigen. Achten Sie besonders auf den 8. Hirnnervenbereich und achten Sie darauf, auf beiden Seiten eine kurze Länge intakter Nervenfasern zu hinterlassen.
- Trennen Sie den Hirnstamm vom Kleinhirn, indem Sie die Stiele schneiden und die Blutgefäße vorsichtig entfernen. Schneiden Sie den Hirnstamm zusätzlicher Blutgefäße ab.
HINWEIS: Stellen Sie sicher, dass das gesamte Verfahren in eisgekühltem dACSF durchgeführt wird, das kontinuierlich mit Kohlenhydratsauerstoff (95% O 2/5% CO2) geblasen wird.
5. Vibratome Slicing
HINWEIS: In den folgenden Schritten muss die Rückseite des Gewebes mit einem kubischen Stück Agarose gestützt werden.
- Platzieren Sie die Vibratomklinge entlang der horizontalen Achse und kleben Sie den Hirnstamm auf eine Schneideschale. Kleben Sie die rostrale Seite und halten Sie die rostral-kaudale Achse vertikal für koronale Scheiben.
- Halten Sie die lateral-mediale Achse vertikal für sagittale Schnitte.
- Kleben Sie die ventrale Seite und halten Sie die dorsal-ventrale Achse vertikal für horizontale Scheiben.
- Um die akute winkelförmige sagittal-horizontale Ebene zu erreichen, kleben Sie die ventrale Seite des Hirnstamms und halten Sie die ventral-dorsale Achse vertikal auf der Hypotenusenoberfläche des Agaroseblocks, die in einem Winkel von 45 ° geschnitten ist. Kleben Sie die gegenüberliegende Oberfläche des Agaroseblocks zur Schneideschale hin und halten Sie die rostral-kaudale Achse parallel zur Klingenkante.
6. Umgang mit zerbrechlichen oder großen Hirnstammgewebestücken
- In einem alternativen Ansatz zu Schritt 5 tauchen Sie den isolierten Hirnstamm in 4% niedrige Schmelzpunktagarose (LMP) bei ~ 40 ° C in eine 35 mm x 10 mm große Petrischale ein.
- Nachdem Sie Agarose auf den eingetauchten Hirnstiel gegossen haben, legen Sie die Petrischale auf Eis, um sich zu verfestigen. Schneiden Sie den kubischen Agaroseblock mit eingebettetem Hirnstiel mit einer scharfen Rasierklinge.
- Kleben Sie den LMP-Agaroseblock auf seine rostrale Seite und halten Sie die rostral-kaudale Achse des Hirnstamms vertikal.
- Nehmen Sie koronale Schnitte, bis die NM-Region sichtbar gemacht werden kann.
- Entfernen Sie den Agaroseblock mit einer scharfen Klinge vom Kleber. Um die Kerne zu erkennen, geben Sie vorsichtig 0,5 μL Farbstoff (Toluidinblau oder Orange G) mit einer feinen Nadel auf die NM.
- Montieren Sie diesen Block wieder auf der Schneidschale für sagittale oder horizontale Scheiben und identifizieren Sie die Kerne in Bezug auf den gefärbten Bereich.
- Für die beste Leistung stellen Sie die Vibratom-Schneidgeschwindigkeit auf 4 - 5 (~ 30 ± 4 mm / min), die Vibrationsfrequenz auf 85-87 Hz und die Schneidamplitude auf 4-6 (~ 1 ± 0,2 mm) ein.
- Nach dem Hirnstammschnitt die 200-300 μm sequentiell gesammelten Scheiben in eine handelsübliche Scheibenkammer geben, um 1 h bei Raumtemperatur in ACSF auszugleichen, kontinuierlich mit einer Mischung aus 95% O 2/5%CO2 (pH 7,2-7,4, Osmolarität 300-310 mOsm/L) geblasen. Unter diesen Bedingungen bleiben die Scheiben bis zu 5-6 h lebensfähig.
7. Elektrophysiologie: Patch-Clamp-Verfahren
- Übertragen Sie eine Hirnstammscheibe in die Aufnahmekammer mit kontinuierlicher Perfusion von kohlenhydratoxygeniertem ACSF ~ 1,5 ± 0,5 ml / min.
- Ziehen Sie Patchpipetten mit einem Mikropipettenzieher mit einem Spitzendurchmesser von 1-2 μm und einem Widerstand im Bereich von 3-6 MΩ.
- Füllen Sie die Pipetten mit einer internen Lösung auf K-Gluconat-Basis (zur Stromzangenaufzeichnung).
- Um die neuronalen Eigenschaften über die verschiedenen tonotopischen Regionen innerhalb einer Scheibe zu testen, lokalisieren Sie Neuronen an beiden Enden der Schichtebene und nähern Sie sich mit der Aufzeichnungselektrode.
- Halten Sie den positiven Luftdruck an der Pipettenspitze aufrecht, während Sie sich einem Neuron nähern.
- Bewegen Sie sich in Richtung Soma, bis eine Vertiefung auf dem Neuron sichtbar ist. Führen Sie die nächsten beiden Schritte schnell aus.
- Stellen Sie eine Gigaohm (1 GΩ) Dichtung her, indem Sie positiven Luftdruck freigeben.
- Halten Sie die Verstärkereinstellung im Spannungsklemmmodus und korrigieren Sie den Pipettenversatz auf null pA. Führen Sie einen Dichtungstest durch (10 mV Prüfimpuls bei 100 Hz). Wenden Sie negativen Luftdruck an, um einen kleinen Fleck der neuronalen Membran zu zerreißen.
- Um die aktiven intrinsischen Eigenschaften von Hörneuronen zu testen, wenden Sie hyperpolarisierende und depolarisierende somatische Strominjektionen an.
HINWEIS: Beispiele für dieses Verfahren können in Supplementary Video S1, S2 visualisiert werden. Details zu diesem Verfahren finden Sie in den Videolegenden.
Ergebnisse
Alle hier gezeigten Hirnstammschnitte wurden aus Hirnstammgewebe (~200-300 μm) entnommen und mit einem 5-fachen Objektiv und einer DIC-Optik (Differential Interference Contrast) abgebildet. Die Kamera wurde auf dem Seziermikroskop montiert und mit einem Computer mit Bildaufnahmesoftware verbunden (siehe Materialtabelle). Der Satelliteneinschub für diese Abbildungen (rechte Felder) wurde mit einem Wasserimmersionsobjektiv mit 60-facher Vergrößerung aufgenommen. Es wurde darauf geachtet, dass alle Bereiche der Hirnstammscheibe gleichmäßig vergrößert wurden, während digitale Bilder gewonnen wurden. Die Fotos wurden mit optimaler Helligkeit und Fokussierung aufgenommen. Die digitalen Bilder von Hirnstammschnitten wurden planar basierend auf überlappenden Bereichen zusammengefügt und zur weiteren Anpassung von Helligkeit, Kontrast und Graustufen auf einen Desktop-Computer importiert. Die grundlegenden Mikroschaltkreise des Hörhirnstamms des Huhns wurden gemäß früheren Arbeiten 1,2,5,13 identifiziert. Unter dem Mikroskop (5x Objektiv) wurden Hörkerne als der Bereich identifiziert, der an die stark myelinisierten Nervenfasern angrenzt, die sowohl ipsilateral als auch kontralateral entlang der dorsalen Regionen der Scheibe um jeden Kern verlaufen.
Abbildung 1 zeigt die traditionellen koronalen Schnitte des Hirnstammgewebes (200-300 μm) eines E21-Hühnerembryos. Die vier hier gezeigten koronalen Schnitte repräsentieren die relativen isofrequenten Regionen der auditorischen Hirnstammkerne, von der untersten CF-Hörregion (Abbildung 1A, caudo-lateral) bis zur höchsten CF-Hörregion (Abbildung 1D, rostral-medial). Für alle vier koronalen Schnitte in Abbildung 1A-D sind vergrößerte Regionen der markierten NM und NL in der mittleren Spalte dargestellt und vergrößert (60-faches Objektiv) auf der rechten Sicht des Abbildungsfelds (a bzw. b in Satelliteneinsätzen). Der Pfeil in Abbildung 1A,B zeigt die Eingabe von Hörnervenfasern, und die Pfeilspitze zeigt die Gabelung der NM-Axone auf der linken Seite der Scheibe. Abbildung 1C zeigt eine weitere Cochlea-Kernstruktur des Vogels, die als Nucleus angularis bekannt ist (NA, Pfeil links und Pfeilspitze rechts). Die beiden rostralsten koronalen Schnitte zeigen den oberen Olivarkern (SON), der sich entlang der ventral-lateralen Region der koronalen Scheibe befindet (Abbildung 1C,D, weiße gestrichelte Kreise).
Abbildung 2 zeigt sagittale Schnitte von Hirnstammgewebe (200-300 μm) eines E21-Hühnerembryos. Für alle drei sagittalen Schnitte (Abbildung 2A-C) werden vergrößerte Regionen der markierten NM und NL in der mittleren Spalte und vergrößert (60x objektiv) auf der rechten Sicht des Abbildungsfeldes (a bzw. b in Satellitenbildern). NM und NL wurden dort identifiziert, wo die Hörnervenfasern (Abbildung 2A, mittlerer Pfeil) in die Gruppe von Neuronen eintraten, die bei höherer Vergrößerung beobachtet wurden (Abbildung 2A, mittlere, kleine, weiß gestrichelte Kreise und Pfeilspitzen) und den Ausgangspunkt der Hörregion hervorheben (Abbildung 2A, links, großer, weiß gestrichelter Kreis und Pfeilspitze). SON wurde in der rostro-lateralen Region der lateralsten Scheibe identifiziert (Abbildung 2A, kleiner, weißer, gestrichelter Kreis). Abbildung 2B zeigt ausgedehnte tonotopische Regionen, die sowohl relativ niedrig- als auch hoch-CF-Hörregionen aus NM und NL entlang der rostral-kaudalen Achse enthalten (weiß umrandete Regionen, siehe auch Satelliteneinschub). Abbildung 2C zeigt die ipsilateralen und kontralateralen axonalen Büschel in der medialsten Scheibe und den Endpunkt der Hörregion (linke und mittlere Pfeile). Die Ausrichtung der hier gezeigten Scheiben steht im Gegensatz zur traditionellen Ausrichtung der Scheiben, wie in Abbildung 1 (d. h. koronal) dargestellt. Dies wurde durchgeführt, um die Ausrichtung anzuzeigen, die dem Ansatz einer Glaspipette am besten entspricht, der für elektrophysiologische Aufnahmen erforderlich ist.
Um zu bestätigen, dass ein großer Bereich der tonotopischen Achse in Abbildung 2B dargestellt war, wurden Stromzangen-Elektrophysiologie-Aufnahmen von NM-Neuronen durchgeführt. Abbildung 3 zeigt funktionelle Ähnlichkeiten und Unterschiede von reifen (E21) NM-Neuronen, die aus einer koronalen Scheibe (Abbildung 3A,B) und einer sagittalen Scheibe (Abbildung 3C,D, Supplementary Video S1, S2) aufgezeichnet wurden. Zwei NM-Neuronen wurden aus den medialen und lateralen Enden einer koronalen Scheibe ausgewählt (ähnlich der in Abbildung 1B gezeigten Scheibe), und zwei NM-Neuronen wurden aus den rostralen und kaudalen Enden von NM in einer sagittalen Scheibe ausgewählt (wie in der in Abbildung 2B gezeigten Scheibe). Abbildung 3A,B zeigt ähnliche elektrophysiologische Reaktionseigenschaften wie somatische Strominjektionen (−100 pA bis +200 pA, +10 pA-Schritte, 100 ms Dauer). Das Feuermuster dieser beiden NM-Neuronen zeigt subtile Unterschiede in dieser Schichtebene, was auf eine relative Isofrequenzlamina für mittelfrequente NM-Neuronen hinweist. Abbildung 3C,D zeigt, dass die Feuermuster wesentliche Unterschiede über die rostral-kaudale Achse aufweisen, was auf einen relativ höheren tonotopischen Gradienten von einem niederfrequenten NM-Neuron (Abbildung 3C) zu einem hochfrequenten NM-Neuron hinweist (Abbildung 3D). Beide Neuronen zeigten ihre stereotypen Feuermuster, wie zuvor berichtet14,15.
Abbildung 4 zeigt horizontale Schnitte des Hirnstammgewebes (200-300 μm) eines E21-Hühnerembryos. Für beide horizontalen Scheiben (Abbildung 4A,B) werden vergrößerte Bereiche von beschrifteten NM und NL in der mittleren Spalte und vergrößert (60-faches Objektiv) auf der rechten Sicht des Abbildungsfelds (a bzw. b in Satelliteneinsätzen) angezeigt. In den horizontalen Schnitten wurden NM und NL zur Mittellinie hin identifiziert und Neuronen entlang der lateral-medialen Achse verteilt (Abbildung 4A,B, mittlere, weiße, gestrichelte Umrissregionen). Die vergrößerten Bilder zeigen die große Ausdehnung des tonotopischen Gradienten. Niederfrequente Neuronen befinden sich in den caudo-lateralen Regionen und hochfrequente Neuronen in den rostral-medialen Bereichen (Abbildung 4A,B, rechts, Satelliten). Die Fasern, die entlang der rostral-kaudalen Achse durch die Mittellinie verlaufen, zeigen die kontralateralen Verbindungen der Hörkerne, aber die Organisation dieser Fasern ist nicht in einer einfachen Ebene. Akute Winkelschnitte aus einem horizontalen / transversalen Abschnitt können diesen axonalen Fasern jedoch in Richtung sagittaler Ebene folgen. Schnitte von 200-300 μM dickem Hirnstammgewebe in einem spitzen Winkel (45°) von einer horizontalen Ebene sind in Abbildung 5 dargestellt. Auditorische Hirnstammkerne sind über eine große diagonale Ausbreitung zu sehen, beginnend mit der lateralsten Scheibe und endend bei der medialsten Scheibe (Abbildung 5A-C, beschriftete mittlere Felder, weiß umrandeter Bereich). Darüber hinaus kann die Winkelorientierung von NM- und NL-Bereichen auch in aufeinanderfolgenden asymmetrischen Scheiben visualisiert werden (Abbildung 5A-C, beschriftete Mittelfelder, weißer, gestrichelter umrandeter Bereich). Vergrößerte Bilder (60x Objektiv) zeigen die tonotopische Achse der Hörkerne, wie sie entlang der rostral-medialen bis caudo-lateralen Achse verläuft (Abbildung 5A-C, rechts, Satelliteneinschub). Die Ausrichtung der Segmente in Abbildung 5 ähnelt der in Abbildung 2. Sie kontrastieren die traditionelle Darstellung von Bildern, eignen sich aber besser für elektrophysiologische Experimente.
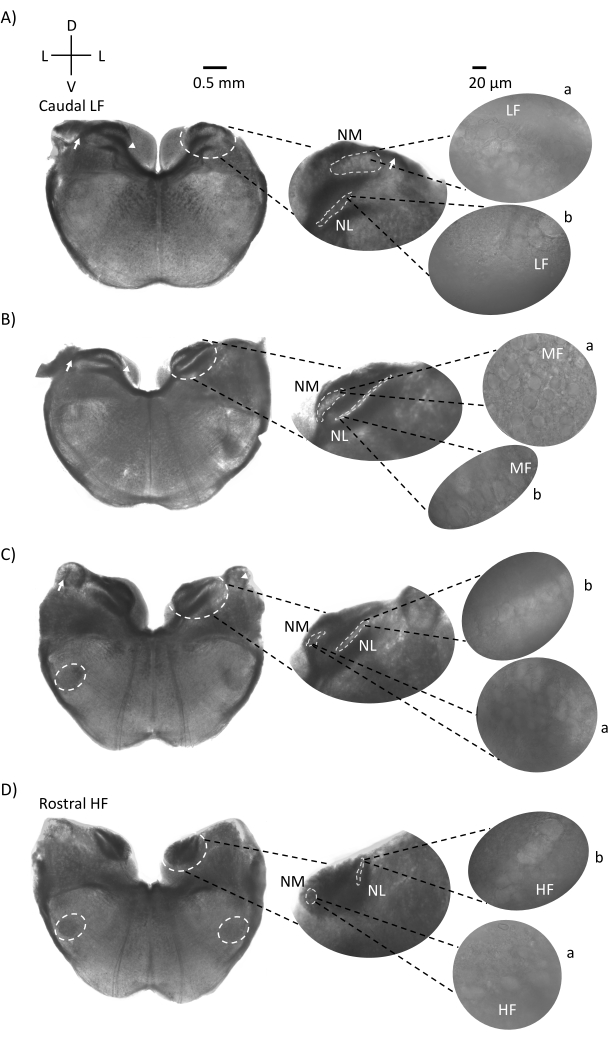
Abbildung 1: Repräsentative koronale serielle Schnitte des Hirnstamms. (A-D) Links: Scheiben von der kaudalen bis zur rostralen Achse, die Gehörkerne und Verbindungsfasern, die mit einem weiß gestrichelten Kreis markiert sind. Der mittlere Einsatz ist eine größere Ansicht der Hörregion, wo Kerne in weiß gestrichelten Kreisen a: NM und b: NL dargestellt sind. Pfeile zeigen afferente Hörnervenfasern, und Pfeilspitze zeigt NM-Axon-Bifurkation in A, B. Pfeil zeigt NA in C. Seitlicher weißer gestrichelter Kreis zeigt SON in C,D. Rechts: Der Satelliteneinsatz zeigt diese Kerne mit einem 60-fachen Objektiv: a: NM und b: NL. Abkürzungen: NM = nucleus magnocellularis; NL = Nucleus laminaris; NA = Nucleus angularis; SON = oberer Olivarkern; LF = relativ niederfrequente Neuronen; MF = mittelfrequente Neuronen; HF = hochfrequente Neuronen; D = dorsal; L = seitlich; V = ventral. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
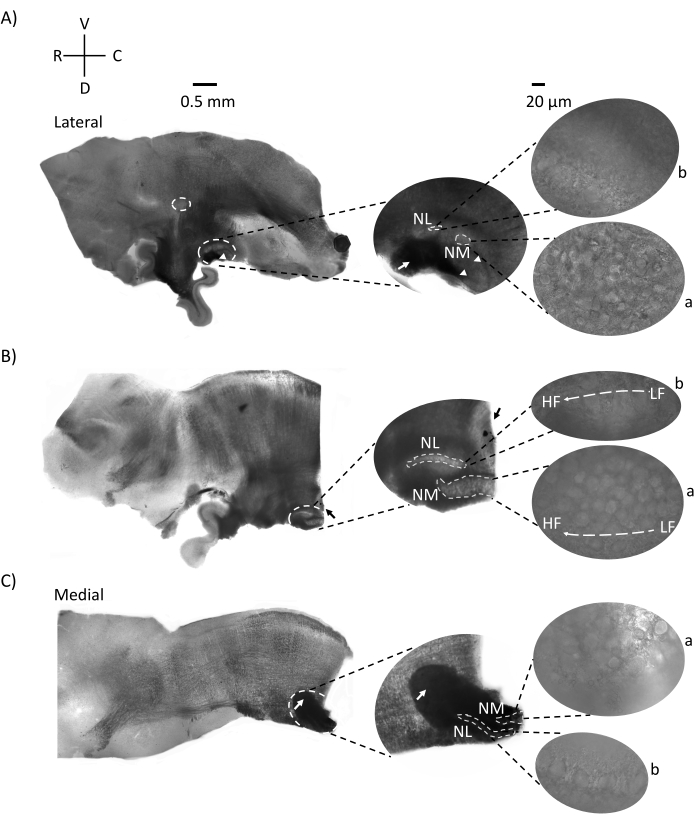
Abbildung 2: Repräsentative sagittale serielle Abschnitte des Hirnstamms. (A-C) Links: Schnitte von der lateralen zur medialen Achse, wobei die Hörkerne in einem weiß gestrichelten Kreis markiert sind. Der mittlere Einsatz zeigt die gleiche Hörkernregion in größerer Ansicht, markiert in weiß gestrichelten Kreisen. (A) Weißer gestrichelter Kreis in der Mitte der Scheibe hebt den SOHN hervor; Pfeil zeigt Hörnervenfasern und Pfeilspitze zeigt NA. Ein dunkler schwarzer Fleck an der rechten Spitze der Scheibe ist ein bildgebendes Artefakt. Regionen des Kleinhirns sind dorsal zur Hörregion in beiden Schnitten A und B im linken Bild zu sehen. (B) Eine sagittale Scheibe, deren Ausrichtung auf die koronale Ebene (während des Schneidens) geändert wurde. Die Hörregion wurde mit blauem Farbstoff (schwarzer Pfeil) identifiziert und erneut in die sagittale Ebene geschnitten. (A-C) Mittlerer NM- und NL-Bereich unter gestrichelten weißen Linien markiert. Rechts: Satellitenansicht zeigt a: NM und b: NL in 60-facher Objektivvergrößerung. Der LF- und HF-tonotopische Gradient in Hörkernen wird entlang der rostro-kaudalen Achse gezeigt. Pfeile, die auf den dunklen Bereich in (C) zeigen, zeigen stark myelinisierte NM-Fasern, die über die Mittellinie durch die mediale Achse verlaufen. Die Fasern verbinden beide Seiten der Hörkerne. Abkürzungen: NM = nucleus magnocellularis; NL = Nucleus laminaris; NA = Nucleus angularis; SON = oberer Olivarkern; LF = relativ niederfrequente Neuronen; HF = hochfrequente Neuronen; D = dorsal; V = ventral; R = rostral; C = kaudal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
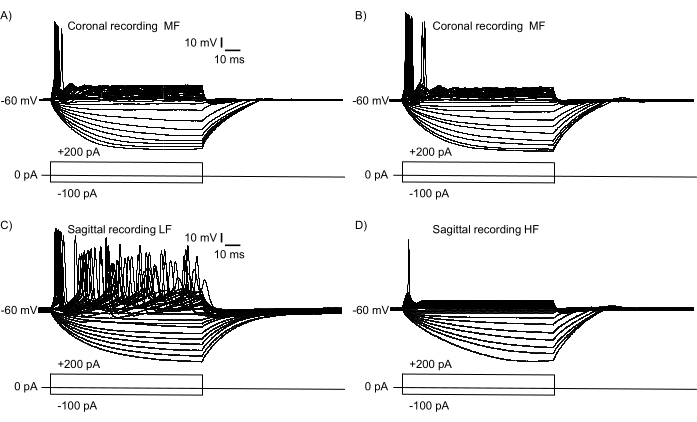
Abbildung 3: Elektrophysiologische Aufzeichnungen der neuronalen Reaktion auf somatische Strominjektionen (−100 pA bis +200 pA, +10 pA-Schritte, 100 ms Dauer) im Stromzangenmodus. Neuronen wurden für Aufnahmen in derselben Scheibe ausgewählt, aber in extrem entgegengesetzten Regionen von NM. (A,B) Repräsentative neuronale Reaktionen in einer einzelnen koronalen Scheibe, die relative Isofrequenzeigenschaften mit subtilen Unterschieden anzeigen. Die Antworteigenschaften repräsentieren zwei verschiedene MF-Neuronen, die aus den medialsten (A) und lateralen (B) Regionen der NM in einer koronalen Scheibe aufgezeichnet wurden. (C,D) Repräsentative neuronale Aufnahmen aus einer einzelnen sagittalen Scheibe. Die Aufnahmen zeigen eine relativ LF-NM-Antwort (C) und eine HF-NM-Antwort (D), was die inhaltlichen Unterschiede im tonotopischen Gradienten innerhalb eines einzelnen sagittalen Abschnitts hervorhebt. Abkürzungen: NM = nucleus magnocellularis; LF = relativ niederfrequente Neuronen; MF = mittelfrequente Neuronen; HF = hochfrequente Neuronen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
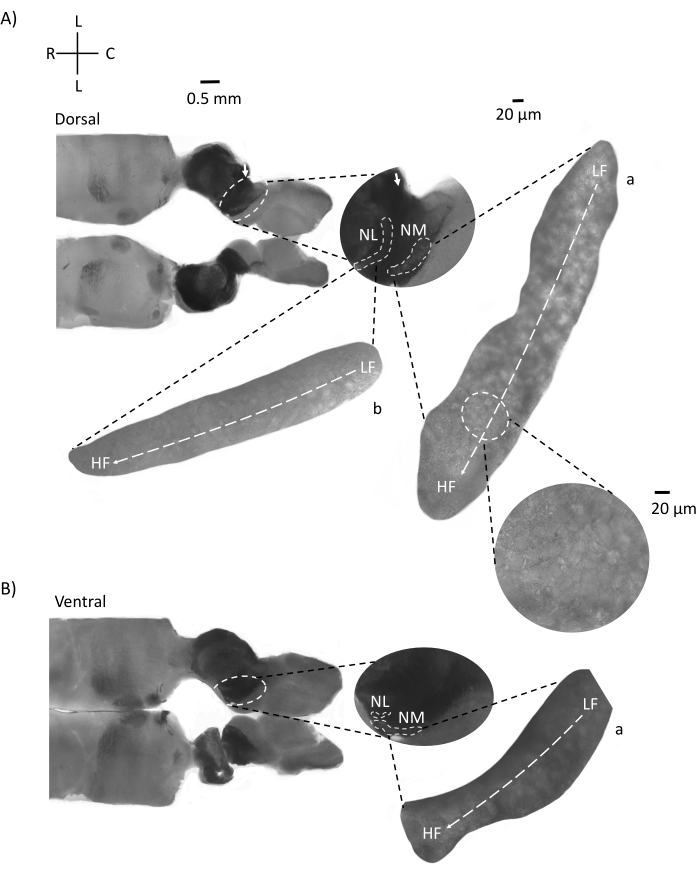
Abbildung 4: Repräsentative horizontale serielle Schnitte des Hirnstamms. (A,B) Links: Schnitte entlang der dorsalen bis ventralen Achse, Gehörkerne sind mit weiß gestrichelten Kreisen markiert. Die afferenten Fasern des 8. Hirnnervs verbinden Hörkerne, die mit Pfeilen markiert sind. Der mittlere Einsatz ist eine größere Ansicht der Hörkernregion mit Hörkernen, die unter weiß gestrichelten Linien markiert sind, NM- und NL-Regionen. Eine klare topologische Bewegung der Hörkerne ist in A,B zu sehen. (A,B) Rechts: große Satellitenansicht mit a: NM und b: NL. Der rechte Einsatz zeigt Hörkerne, die in 60-facher Objektivvergrößerung beobachtet wurden, und die gekrümmte topologische Achse von LF nach HF entlang einer caudo-lateralen bis rostral-medialen Achse. Abkürzungen: NM = nucleus magnocellularis; NL = Nucleus laminaris; LF = relativ niederfrequente Neuronen; HF = hochfrequente Neuronen; L = seitlich; R = rostral; C = kaudal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
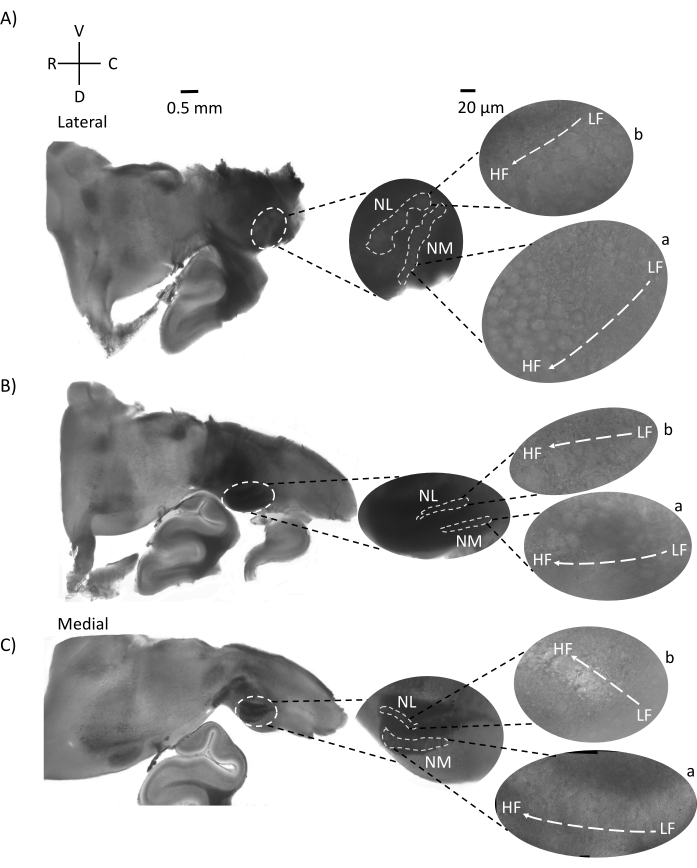
Abbildung 5: Repräsentative horizontale/transversale akute Winkelschnitte (45°). (A-C) Links: serielle Abschnitte des Hirnstamms, Gehörkerne markiert in einem weiß gestrichelten Kreis. Der mittlere Einsatz ist eine größere Ansicht der Hörregion. (A) Der mittlere Einsatz zeigt die größte Ausbreitung von NM- und NL-Neuronen in diesen Schnitten. (B,C) Mittlerer Einsatz: Gehörkerne, die in weiß gestrichelten Linien markiert sind, zeigen im Vergleich zu (A-C) eine allmähliche topologische Veränderung. Rechts: Satelliteneinsatz mit Hörkernen a:NM und b:NL in 60-facher Objektivvergrößerung. Die tonotopische Achse von LF- zu HF-Bereichen in NM und NL dreht sich winkelförmig von lateralen zu medialen Schnitten. Abkürzungen: NM = nucleus magnocellularis; NL = Nucleus laminaris; LF = relativ niederfrequente Neuronen; HF = hochfrequente Neuronen; V = ventral; R = rostral; D = dorsal; C = kaudal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzendes Video S1: Hyperpolarisierende und depolarisierende somatische Strominjektionen. Reaktionseigenschaften von einem niederfrequenten und hochfrequenten Neuron auf 100 ms somatische Strominjektionen im Stromzangenmodus. Neuronen wurden aus derselben sagittalen Hirnstammscheibe ausgewählt. Die Injektionen reichen von -100 bis +200 pA in Schritten von +10 pA-Schritten, 100 ms Zeitdauer. Aktionspotentiale werden als Reaktion auf ausreichend depolarisierende Strömungsschritte gesehen. Das Video entspricht den letzten Spuren in Abbildung 3C. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video S2: Hyperpolarisierende und depolarisierende somatische Strominjektionen. Ähnlich wie bei Supplementary Video S1 zeigt dieses Video die Reaktionseigenschaften eines niederfrequenten und hochfrequenten Neurons auf 100 ms somatische Strominjektionen im Stromzangenmodus. Neuronen wurden aus derselben sagittalen Hirnstammscheibe ausgewählt. Die Injektionen reichen von -100 bis +200 pA in Schritten von +10 pA-Schritten, 100 ms Zeitdauer. Aktionspotentiale werden als Reaktion auf ausreichend depolarisierende Strömungsschritte gesehen. Das Video entspricht den letzten Spuren in Abbildung 3D. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Koronale Abschnitte des embryonalen Hirnstammgewebes von Hühnern ermöglichen seit Jahrzehnten die Untersuchung relativer individueller Isofrequenzlamina 1,2,5. Die tonotope (dh Häufigkeit) Organisation des Hörhirnstamms des Hühners ist jedoch topologisch verworren und kann in anderen anatomischen Achsen je nach spezifischer Forschungsfrage leichter zugänglich sein. Obwohl dies ausreicht, um anatomische und physiologische Fragen in Bezug auf einzelne iso-Frequenzregionen zu untersuchen, sind die Untersuchung tonotopischer Variationen und ihre Entwicklung über größere auditorische Hirnstammbereiche hinweg durch koronale Abschnitte etwas eingeschränkt. Um diese Einschränkung zu überwinden, beschreibt dieses Protokoll Ansätze in der sagittalen, horizontalen und horizontalen / transversalen Ebene, um zusätzliche Beispiele für auditives Hirnstammgewebe zu liefern, das maximale tonotopische Eigenschaften und Gradienten in einem einzelnen Hirnstammabschnitt aufweist.
Sagittale Abschnitte von auditorischen Hirnstammregionen zeigen, dass verschiedene tonotopische Bereiche im Vergleich zu koronalen Abschnitten über eine größere Region innerhalb der Scheibe verteilt sind (sagittaler Hörbereich = ~300-600 μm, koronaler Hörbereich = ~200-350 μm). Zum Beispiel wurden NM- und NL-Regionen über einen größeren Bereich entlang der rostro-kaudalen Achse in sagittalen Abschnitten visualisiert (z. B. Abbildung 2B), und der funktionelle tonotopische Gradient, der entlang dieser anatomischen Achse verläuft, war weitgehend in einer einzigen sagittalen Scheibe enthalten. Dies wurde weiter durch Strom-Clamp-Aufnahmen von intrinsischen neuronalen Unterschieden bestätigt, die entlang des rostral-kaudalen Gradienten variieren, wie zuvor berichtet14,15 (z. B . Abbildung 3C,D). Zukünftige Experimente, die anatomische und immunhistochemische Eigenschaften entlang der tonotopischen Achse hervorheben, könnten bekannte Gradienten auditiver Eigenschaften innerhalb einer einzelnen sagittalen Schichtebene weiter untersuchen. Dazu gehören unter anderem MAP2-Färbungs- und Kaliumkanalexpressionsmuster, bei denen es sich um bekannte Gradienten der dendritischen Architektur und intrinsische Eigenschaften von NM und NL handelt, die zuvor in aufeinanderfolgenden koronalen Abschnitten gezeigt wurden16.
Horizontale Abschnitte von auditorischen Hirnstammregionen zeigen, dass NM und NL in Richtung Mittellinie liegen. Ein Teil der auditorischen axonalen Fasern verläuft diagonal oder senkrecht zur horizontalen Ebene (Abbildung 4). Diesen Fasern kann gefolgt werden, indem eine spitze Winkelscheibe 45° zur sagittalen Ebene gemacht wird. Die resultierenden horizontalen / transversalen Scheiben waren größer als die sagittalen oder horizontalen Scheiben, und lange axonale Fasern verliefen durch die rostro-kaudale Achse sowohl für ipsilaterale als auch für kontralaterale Seiten. Sowohl NM als auch NL können in einem größeren diagonalen Bereich (~400-700 μm) sichtbar gemacht werden, so dass kontralaterale Verbindungen entlang einer lateral-medialen Achse sichtbar gemacht werden können. Darüber hinaus zeigt die horizontale/transversale Schichtebene, wie die Gehörregionen und der resultierende tonotopische Gradient eine Winkelkurve machen (Abbildung 5). Durch die Winkelexposition kontralateraler Verbindungen in einem größeren Bereich eignen sich diese Schnitte besser für elektrophysiologische Stimulations- und Mikroschaltungsstudien als herkömmliche koronale Schnitte.
Weitere Vorteile
Die Bildung auditiver Mikroschaltkreise erfordert eine raumzeitliche Koordination von Hinweisen, die das neuronale Überleben, die Synaptogenese, die axonale Differenzierung, die dendritische Architektur und die Reifung fördern. So kann ein alternativer Hirnstammschnitt des Hörmikroschaltkreises des Hühnerembryos für folgende Forschungsthemen verwendet werden: morphologische Organisation von Neuronen in topographisch unterschiedlichen Dimensionen; Organisation und Kartierung der Konnektome aller auditorischen und vestibulären Kerne; Identifizierung und Charakterisierung der Aktivitätsmuster von Schaltungsbestandteilen in iso-Frequenz- und tonotopischen Ebenen; die topographische Organisation von exzitatorischen versus inhibitorischen Mikroschaltkreisen und Beziehungen zu spezialisierten Neuronenpopulationen (Kernen); räumliche Lokalisierung von Hörkernneuronen und ihre prädiktive CF17; systematisches Targeting spezifischer onotopischer neuronaler Typen; Verfolgung von Vorläuferzellen und ihrer Entwicklung zu konservierten Kernen; genetische Abstammung von Zellen zur Evolution neuronaler Schaltkreise18; vergleichende Hirnstammanatomie zwischen Arten; Untersuchung von vestibulären Schaltkreisen wie Deiters vestibulärem Komplex (DC)19; und Synchronie und Übersprechen zwischen vestibulären Kernen.
Ein facettenreicher Ansatz mit verschiedenen Schichtebenen kann helfen, grundlegende Fragen zu unbekannten anatomischen und biophysikalischen Eigenschaften von Hirnstamm-Mikroschaltkreisen zu beantworten. Ein gutes Beispiel ist die Beziehung zwischen den wichtigsten Hörkernen (NM, NA, NL und SON) und den vestibulären Kernen, einschließlich des dorsalen Kerns des lateralen Lemniscus (LLDp), des Halbmondkerns (SLu)20 und des Tangentialkerns (TN)3. Dieses Protokoll und diese Slice-basierten Studien haben jedoch einige Einschränkungen.
Vorsichtsmaßnahmen und Einschränkungen
Je nach Institution, die die Experimente durchführt, können sich die ethischen Richtlinien und der Umgang mit Hühnerembryonen unterscheiden. Während die National Institutes of Health Guidelines for the Care and Use of Laboratory Animals eine schnelle Enthauptung erlauben, gibt es alternative Methoden zur Euthanasie von Hühnerembryonen21. Früh entwickelndes Hirnstammgewebe des Hühnerembryos ist im Vergleich zu älteren Embryonen weich und empfindlich. Es hat mehrere Verbindungen und Blutgefäße auf der Oberfläche, die beim Entfernen besonders vorsichtig sind. Das Gewebe sollte in eiskaltem dACSF aufbewahrt und mit 95% O 2/5% CO2 perfundiert werden, um die Lebensfähigkeit zu erhöhen.
Die sagittale Schnittmethode ist nur für die ipsilaterale Tonotopie nützlich. Diese Schneidemethode liefert größere Scheiben als koronale Scheiben, deren Handhabung prekär sein könnte. Man kann die Scheiben jedoch mit Kreuznadelmethoden trimmen, die an anderer Stelle ausführlich beschriebensind 22. Die Verwendung von 4% LMP-Agaroseblock eingebetteter Hirnstamm kann empfindliche Strukturen in Scheiben retten, aber es muss darauf geachtet werden, dass keine übermäßig heiße Agarose gegossen wird. Das schnelle Einstellen durch Platzieren des agaroseblockierten Hirnstamms in einer gekühlten Umgebung für ~ 1 min macht Scheiben für elektrophysiologische Aufnahmen lebensfähiger.
Die Anwendung von Sekundenkleber in überschüssigen Mengen kann giftig sein. Es muss minimal aufgetragen werden, und überschüssige Mengen sollten sofort durch Wechseln des dACSF gewaschen werden. Bei spitzen Winkelscheiben (45°) ist das Schneiden des Winkels des Agaroseblocks entscheidend. Man kann einen Spiegel verwenden, um den vorderen Winkel zu sehen, während man den Agaroseblock mit einer scharfen Klinge schneidet. Handelsübliche Klingen können eine Wachsbeschichtung aufweisen, die vor Gebrauch mit Alkohol abgewischt und getrocknet werden sollte. Eine Optimierung ist für die Schnittgeschwindigkeit und -häufigkeit des Vibratoms erforderlich, da axonale Faserbüschel härter sind als kortikales oder Matrixgewebe. Die Beibehaltung einer hohen Amplitude und die Verwendung einer gekühlten Dissektionslösung können Gewebeschäden verhindern.
Alle Lösungen sollten frisch zubereitet werden, und Ca 2+ und Mg2+ sollten dem ACSF zugegeben werden, nachdem 95% O 2/5% CO2 gespritzt wurden. Andernfalls kann es zu Niederschlägen von Ca2+ kommen. Ein Pinsel sollte verwendet werden, um die Scheiben sanft innerhalb des Vibratoms zu behandeln. Halten Sie die gesamte Schneidezeit nach Möglichkeit unter 15 Minuten. Eine Pasteur-Pipette aus Glas kann verwendet werden, um Hirnstammscheiben zu manövrieren.
Verwenden Sie keine Reinigungsmittel oder ätzenden Waschmittel für Gläser und Geräte, die mit den in der Elektrophysiologie verwendeten Scheiben in Kontakt kommen. Die aufgenommenen Bilder zeigen das Aussehen von 200-300 μM dickem Gewebe unter Differential Interference Contrast (DIC) Optik. Die visuelle Qualität wird schlechter sein als die Immunhistochemie oder Elektronenmikroskopie, aber sie spiegelt genau wider, was ein Experimentator bei der Durchführung elektrophysiologischer Aufnahmen sehen wird.
Studien zur frühen Entwicklung von Mikroschaltkreisen entlang einer alternativen anatomischen Achse, sei es dorsal-ventral, rostral-kaudal oder ipsilateral-kontralateral, sind im Hörhirnstamm des Huhns begrenzt. Ein Grund dafür ist, dass die Rolle von Transkriptionscodes und die Regulation der tonotopischen Entwicklung im Hirnstamm noch nicht vollständig verstanden ist. Funktionelle Phänomene wie Top-Down-Modulation und spontane Aktivität gehen bei der Beobachtung der Aktivität in vitro oft verloren. Die In-vivo-Forschung wird jedoch durch spezifische und direkte Einzelneuronenaufnahmen ergänzt, die nur unter diesen Schnittbedingungen möglich sind. Die Verfeinerung der Gewinnung von Hirnstammgewebe entlang verschiedener Orientierungen könnte aufschlussreiche Informationen über die Entwicklung und Komplexität von tonotopischen Gradienten in den auditorischen Hirnstamm-Mikroschaltkreisen des Huhns liefern.
Offenlegungen
Alle Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Interessen durchgeführt wurde und dass sie keine Interessenkonflikte haben.
Danksagungen
Diese Arbeit wird durch den NIH / NIDCD R01 DC017167 Zuschuss unterstützt. Wir danken Kristine McLellan für die redaktionellen Kommentare zu einer früheren Version des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Adobe photoshop 2021 | Adobe | ||
| Anti-vibration table 30"x 36" - OTMC - 63533 | TMC | ||
| Cell sens standard software | OLYMPUS | ||
| Digidata 1440A | MOLECULAR DEVICES | ||
| Digital amplifier multiclamp 700B | MOLECULAR DEVICES | ||
| DSK line-up linearslicer pro7 | TED PELLA, INC | ||
| Micromanipulator MPC-385 / OSI-MPC-385-2 | OLYMPUS AMERICA INC | ||
| Micropipette puller P-97 | SUTTER INSTRUMENTS | ||
| Microscope BX51W1 | OLYMPUS AMERICA INC | ||
| MS ICE software | Microsoft Corporation | ||
| Ohaus balance model AV212 | Ohaus Adventurer | ||
| Olympus DPSI0 /DPS80 camera | OLYMPUS | ||
| pClamp and Axoclamp data Acquisition Softwares | MOLECULAR DEVICES | ||
| pH meter lab 850 benchtop | SCHOTT INSTRUMENTS | ||
| Sharp stainless blade | Dorco/Personna | ||
| Vapor pressure osmometer model 5600 | WESCOR INC | ||
| Water purification systems Smart2pure 6UV/UF | Thermo Scientific | ||
| Chemicals- list | |||
| Agrose Low melt IB70051 | IBI SCIENTIFIC | ||
| CaCl2 (Calcium Chloride) | ACROS organics | ||
| Cynergy instant adhesive CA6001 | Resinlab | ||
| Dextrose (D-(+)-glucose) | VWR Life Science | ||
| Ethyl alcohol | IBI SCIENTIFIC | ||
| KCl (Potassium Chloride) | Amresco.Inc | ||
| MgCl2 (Magnesium Chloride) | Sigma-Aldrich | ||
| NaCl (Sodium Chloride) | Amresco.Inc | ||
| NaH2PO4 (Sodium Dihydrogen Phosphate) | Amresco.Inc | ||
| NaHCO3 (Sodium Bicarbonate) | Amresco.Inc |
Referenzen
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 164 (4), 411-433 (1975).
- Rubel, E. W., et al. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 166 (4), 469-489 (1976).
- Shao, M., et al. Spontaneous synaptic activity in chick vestibular nucleus neurons during the perinatal period. Neuroscience. 127 (1), 81-90 (2004).
- Fukui, I., Ohmori, H. Tonotopic gradients of membrane and synaptic properties for neurons of the chicken nucleus magnocellularis. Journal of Neuroscience. 24 (34), 7514-7523 (2004).
- Sanchez, J. T., Seidl, A. H., Rubel, E. W., Barria, A. Preparation and culture of chicken auditory brainstem slices. Journal of Visualized Experiments. (49), e2527 (2011).
- Sanchez, J. T., Lu, Y., Fay, R. R., Popper, A. N., Cramer, K., Coffin, A. Glutamate signaling in the auditory brainstem. Auditory Development and Plasticity: Springer Handbook of Auditory Research. 64 (4), 75-108 (2017).
- Parks, T. N. Morphology of axosomatic endings in an avian cochlear nucleus: nucleus magnocellularis of the chicken. Journal of Comparative Neurology. 203 (3), 425-440 (1981).
- Jhaveri, S., Morest, D. K. Sequential alterations of neuronal architecture in nucleus magnocellularis of the developing chicken: a Golgi study. Neuroscience. 7 (4), 837-853 (1982).
- Carr, C. E., Boudreau, R. E. Central projections of auditory nerve fibers in the barn owl. Journal of Comparative Neurology. 314 (2), 306-318 (1991).
- Köppl, C. Auditory nerve terminals in the cochlear nucleus magnocellularis: differences between low and high frequencies. Journal of Comparative Neurology. 339 (3), 438-446 (1994).
- Fukui, I., et al. Improvement of phase information at low sound frequency in nucleus magnocellularis of the chicken. Journal of Neurophysiology. 96 (2), 633-641 (2006).
- Wang, X., et al. Postsynaptic FMRP regulates synaptogenesis in vivo in the developing cochlear nucleus. Journal of Neuroscience. 38 (29), 6445-6460 (2018).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments. (124), e55628 (2017).
- Hong, H., Sanchez, J. T. Need for speed and precision: structural and functional specialization in the cochlear nucleus of the avian auditory system. Journal of Experimental Neuroscience. (12), 1-16 (2018).
- Hong, H., et al. Diverse intrinsic properties shape functional phenotype of low-frequency neurons in the auditory brainstem. Frontiers in Cellular Neuroscience. 12, 1-24 (2018).
- Wang, X., Hong, H., Brown, D. H., Sanchez, J. T., Wang, Y. Distinct neural properties in the low-frequency region of the chicken cochlear nucleus magnocellularis. eNeuro. 4 (2), 1-26 (2017).
- Tabor, K. M., et al. Tonotopic organization of the superior olivary nucleus in the chicken auditory brainstem. Journal of Comparative Neurology. 520 (7), 1493-1508 (2012).
- Lipovsek, M., Wingate, R. J. Conserved and divergent development of brainstem vestibular and auditory nuclei. Elife. 7, 40232 (2018).
- Passetto, M. F., et al. Morphometric analysis of the AMPA-type neurons in the Deiter's vestibular complex of the chick brain. Journal of Chemical Neuroanatomy. 35 (4), 334-345 (2008).
- Curry, R. J., Lu, Y. Intrinsic properties of avian interaural level difference sound localizing neurons. Brain Research. 1752, 147258 (2021).
- Aleksandrowicz, E., Herr, I. Ethical euthanasia and short-term anesthesia of the chick embryo. ALTEX - Alternatives to Animal Experimentation. 32 (2), 143-147 (2015).
- Palkovits, M. Isolated removal of hypothalamic or other brain nuclei of the rat. Brain Research. 14 (59), 449-450 (1973).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten