Method Article
Fatiando o tronco auditivo de frango embrionário para avaliar gradientes tonotópicos e microcircuitos
Neste Artigo
Resumo
Aqui apresentamos um protocolo para a obtenção de fatias de tronco cerebral auditiva não coronal do embrião de frango para a investigação de propriedades tonotópicas e trajetórias de desenvolvimento dentro de uma fatia de tronco cerebral. Essas fatias incluem seções sagita, horizontal e horizontal/transversal que abrangem regiões tonotópicas maiores dentro de um plano de fatia individual que as seções coronais tradicionais.
Resumo
O embrião de frango é um modelo animal amplamente aceito para estudar o brainstem auditivo, composto por microcircuito altamente especializado e topologia neuronal orientada diferencialmente ao longo de um eixo tonotópico (ou seja, frequência). O eixo tonotópico permite a codificação segregada de sons de alta frequência no plano rostral-medial e codificação de baixa frequência em regiões caudo-laterais. Tradicionalmente, as fatias de tronco cerebral coronal de tecido embrionário permitem o estudo de lamina de iso-frequência individual relativa. Embora suficiente para investigar questões anatômicas e fisiológicas relativas a regiões individuais de iso-frequência, o estudo da variação tonotópica e seu desenvolvimento em áreas maiores auditivas do tronco cerebral é um pouco limitado. Este protocolo relata técnicas de corte cerebral de embriões de frango que englobam gradientes maiores de regiões de frequência no tronco cerebral auditivo inferior. A utilização de diferentes métodos de corte para tecido cerebral auditivo de frango permite experimentos eletrofisiológicos e anatômicos dentro de uma fatia do tronco cerebral, onde gradientes maiores de propriedades tonotópicas e trajetórias de desenvolvimento são melhor preservados do que seções coronais. Múltiplas técnicas de corte permitem uma melhor investigação das diversas propriedades anatômicas, biofísicas e tonotópicas dos microcircuitos do tronco cerebral auditivo.
Introdução
O embrião de frango é um modelo de pesquisa valioso para estudar questões biológicas básicas em inúmeras e diversas áreas científicas, incluindo biologia celular, imunologia, patologia e neurobiologia do desenvolvimento. O microcircuito do brainstem auditivo de frango é um excelente exemplo de um circuito altamente especializado que pode ser entendido em termos de morfologia auditiva e fisiologia. Por exemplo, Rubel e Parks (1975) descreveram pela primeira vez a orientação tonotópica (ou seja, gradiente de frequência) do núcleo de frango magnocelularis (NM) e núcleo laminaris (NL) como uma função linear através do eixo dos núcleos, orientada ~30° em relação ao plano sagital. Neurônios individuais em NM e NL codificam sua melhor frequência sonora conhecida como sua frequência característica (CF)-ao longo do plano rostral-medial para a região caudo-lateral. Neurônios sensíveis à alta frequência estão na região rostral-medial e neurônios sensíveis à baixa frequência estão localizados de forma lateral. Como tal, os métodos tradicionais de dissecção do tecido cerebral auditivo para estudar propriedades tonotópicas têm utilizado sucessivas fatias coronais. De fato, microcircuitos auditivos de embriões de frango em desenvolvimento foram estabelecidos como um sistema modelo para o estudo do processamento de sinais de funções auditivas tonotópicas através de sucessivas fatias de tronco cerebral coronal caudal-to-rostral por décadas 1,2,3,4,5,6.
No entanto, a organização tonotópica de NM e NL é topologicamente e morfologicamente complicada. As entradas nervosas auditivas são distribuídas de tal forma que as entradas de CF altas terminam em estruturas semelhantes a pontas que cobrem pelo menos um quarto da circunferência somática de uma célula de NM adendritic. Por outro lado, as entradas de CF baixas não são organizadas com terminais finais semelhantes a lâmpadas, mas com múltiplas sinapses bouton em dendritos de neurônios NM. As entradas de CF médio terminam como lâmpada final e sinapses semelhantes a bouton 4,7,8,9,10,11,12. Em NL, o gradiente dendrótico altamente estereotipado é evidente não apenas no comprimento dendrático, mas também na largura dendrítica. Este gradiente dendrótico único está intimamente de acordo com o eixo tonotópico. Os dendritos sofrem um aumento de 11 vezes no comprimento e aumento de cinco vezes na largura de neurônios de alta a baixa CF, respectivamente6. Para superar tais distribuições complicadas desses núcleos em fatias coronais, este protocolo descreve abordagens de dissecção nos planos sagitos, horizontais e horizontais/transversais. Essas técnicas de corte fornecem exemplos de tecido cerebral auditivo que exibem propriedades tonotópicas máximas em um plano de fatia individual.
Protocolo
Todos os procedimentos foram aprovados pelos Comitês Institucionais de Atenção e Uso de Animais da Universidade northwestern (IACUC) e foram realizados de acordo com os Institutos Nacionais de Diretrizes de Saúde para o Cuidado e Uso de Animais de Laboratório. Os protocolos de dissecção e preparação do tecido cerebral estão em adesão aos protocolos anteriores 5,13.
1. Manuseio de ovos
- Compre ovos fertilizados (Gallus gallus domesticus) de um fornecedor local de animais aprovado pela IACUC.
- Armazene os ovos imediatamente após a chegada em uma geladeira a 14 °C e incubar dentro de 5 dias.
NOTA: A viabilidade do embrião diminui consideravelmente após 1 semana. - Esterilize os ovos com 70% de etanol antes da incubação a 38 ± 1 °C e ~50% de umidade.
2. Composição e preparação do fluido cerebral-espinhal artificial (ACSF)
- Misture os seguintes produtos químicos em 1 L de 18,2 MΩcm dH2O para criar uma solução de estoque ACSF 10x: NaCl (cloreto de sódio) 130 mM, NaHCO3 (bicarbonato de sódio) 26 mM, KCl (cloreto de potássio) 2,5 mM, NaH2PO4 (fosfato de dihidrogênio de sódio) 1,25 mM, dextrose (D-(+)-glicose) 10 mM. Mantenha a solução de estoque na geladeira.
- Prepare as soluções MgCl2 (cloreto de magnésio) 1 M e CaCl2 (cloreto de cálcio) 1 M separadamente em 18,2 MΩcm dH2O e armazene na geladeira.
- Imediatamente antes do uso, diluir 10x ACSF a 1x e bolha continuamente com 95% de CO2/5% de CO2 por 15-20 min e adicionar MgCl2 e CaCl2. Para preparar ACSF e dACSF (dissecando ACSF), ajuste a uma concentração final de Mg2+ 1 mM, Ca2+ 3 mM e Mg2+ 3 mM, Ca2+ 1 mM, respectivamente.
- Defina a taxa de borbulha para o ACSF de modo que o pH seja 7,2-7,4 com uma osmolalidade entre 300 e 310 mOsm/L.
NOTA: Ter o ACSF colocado em um banho de gelo enquanto borbulha é benéfico para manter uma baixa temperatura da solução, que suportará a integridade estrutural do tecido durante a dissecação.
3. Agarose (5%) preparação do bloco
- Misture 5 g de agarose em 100 mL de dACSF. Use um banho de água de 100 °C ou micro-ondas por 2-3 min, mexendo a cada 30 s para evitar caroços até que a agarose se dissolva completamente e comece a borbulhar.
- Despeje a agarose derretida em uma placa de Petri vazia até 5 mm de espessura e mantenha em temperatura ambiente para definir. Após a configuração, sele a placa de Petri usando parafilm e armazene a 4 °C.
- Corte a agarose em blocos cúbicos com uma lâmina afiada e use-as no momento da dissecação.
4. Protocolo de dissecação e isolamento do tronco cerebral auditivo
- Limpe a área de dissecção usando spray de solução de álcool etílico de 70%.
- Cole o suporte ou o bloco de agarose em ângulo na bandeja vibratome.
- Escolha os ovos da idade desejada (E20 e E21 no presente protocolo). Manuseie e incuba os ovos seguindo os protocolos listados acima como na etapa 1.
- Localize o espaço cheio de ar colocando o ovo sob uma luz brilhante (candling) e procurando por este espaço no lado maior ou mais redondo do ovo.
- Aclimesse os ovos à temperatura ambiente, quebre a casca sobre o espaço cheio de ar e exponha o saco de membrana.
- Faça uma incisão suave no saco para expor o bico.
- Com um bisturi, puxe suavemente o pescoço e a cabeça para fora do ovo.
- Decapite rapidamente a cabeça usando uma tesoura afiada.
- Após a decapitação, limpe a cabeça com dACSF refrigerado ao gelo para remover o excesso de sangue da almofada de dissecção.
- Mantenha a cabeça firme em dACSF gelada e faça uma incisão rostro-caudal. Inicie a incisão atrás e entre os olhos e siga o comprimento do pescoço colhido.
NOTA: Embriões mais jovens podem exigir menos pressão ao fazer a incisão. - Separe a pele para expor o crânio.
- Corte o crânio atrás do olho em uma linha média para direção lateral. Faça isso pelos dois hemisférios.
NOTA: Este passo ajuda a separar a porção rostral do crânio do cérebro conectado, mantendo o tecido cerebral intacto5. - Corte a porção rostral do crânio. Coloque a lâmina atrás dos olhos e faça um corte rápido.
NOTA: Pode-se exigir esforço para cortar o crânio conectado de forma limpa. - Mergulhe a cabeça em um prato de dACSF frio.
- Utilizando um pequeno par de tesouras, faça linha média para incisões laterais na região caudal do crânio para tentar separar o cérebro do crânio sem causar danos teciduais.
- Exponha suavemente o tronco cerebral e o cerebelo. Retraia a área dorsal de todo o crânio, remova o tronco cerebral cuidadosamente, e exponha-o com a ajuda de um pincel fino com trenó leve. Use fórceps curvos para limpar o tronco cerebral da conexão de tecidos e vasos sanguíneos. Preste atenção extra à área donervo craniano 8 e certifique-se de deixar um curto comprimento de fibras nervosas intactas em ambos os lados.
- Separe o tronco cerebral do cerebelo cortando os peduncles e removendo os vasos sanguíneos cuidadosamente. Corte o tronco cerebral de vasos sanguíneos adicionais.
NOTA: Certifique-se de que todo o procedimento seja realizado em dACSF refrigerado ao gelo continuamente borbulhado com carboxígeno (95% O2/5% CO2).
5. Fatiamento de vibratome
NOTA: Nas etapas a seguir, a parte de trás do tecido deve ser apoiada com um pedaço cúbico de agarose.
- Coloque a lâmina vibratome ao longo do eixo horizontal e cole o tronco cerebral em uma bandeja de corte. Cole o lado rostral, mantendo o eixo rostral-caudal vertical para fatias coronais.
- Mantenha o eixo lateral-medial vertical para fatias sagilas.
- Cole o lado ventral, mantendo o eixo dorsal-ventral vertical para fatias horizontais.
- Para alcançar o plano sagital-horizontal angular agudo, cole o lado ventral do tronco cerebral, mantendo o eixo ventral-dorsal vertical na superfície hipotenusa do bloco agarose, que é cortado em um ângulo de 45°. Cole a superfície oposta do bloco de agarose de frente para a bandeja de corte e mantenha o eixo rostral-caudal paralelo à borda da lâmina.
6. Manuseando pedaços frágeis ou grandes de tecido cerebral
- Em uma abordagem alternativa ao passo 5, mergulhe o tronco cerebral isolado em 4% de baixo ponto de fusão (LMP) agarose a ~40 °C em uma placa de Petri de 35 mm x 10 mm.
- Depois de derramar agarose no tronco cerebral imerso, coloque a placa de Petri no gelo para solidificar. Corte o bloco de agarose cúbico com tronco cerebral embutido usando uma lâmina afiada.
- Cole o bloco de agarose LMP em seu lado rostral, mantendo o eixo rostral-caudal do cérebro vertical.
- Tome fatias coronais até que a região NM possa ser visualizada.
- Remova o bloco de agarose da cola com uma lâmina afiada. Para detectar os núcleos, coloque suavemente 0,5 μL de corante (azul toluidina ou laranja G) no NM com uma agulha fina.
- Remonte este bloco na bandeja de corte para fatias sagitas ou horizontais e identifique os núcleos em relação à região manchada.
- Para o melhor desempenho, ajuste a velocidade de corte de vibratome em 4 - 5 (~30 ± 4 mm/min), a frequência vibratória em 85-87 Hz e a amplitude de corte em 4-6 (~1 ± 0,2 mm).
- Após a seção do tronco cerebral, coloque as fatias coletadas sequencialmente de 200-300 μm em uma câmara de fatias comercialmente disponível para equilibrar por 1h à temperatura ambiente em ACSF, continuamente borbulhada com uma mistura de 95% O2/5% CO2 (pH 7.2-7.4, osmolaridade 300-310 mOsm/L). Nessas condições, as fatias permanecem viáveis até 5-6 h.
7. Eletrofisiologia: procedimento de grampo de remendo
- Transfira uma fatia de tronco cerebral para a câmara de gravação com perfusão contínua de ACSF carboxígenado ~1,5 ± 0,5 mL/min.
- Puxe pipetas de remendo com um puxador de micropipette de diâmetro de ponta 1-2 μm e resistência na faixa de 3-6 MΩ.
- Encha as pipetas com uma solução interna baseada em K-Gluconate (para gravação atual do grampo).
- Para testar as propriedades neuronais nas diferentes regiões tonotópicas dentro de uma fatia, localize neurônios em cada extremidade do plano de corte e se aproxime com o eletrodo de gravação.
- Mantenha a pressão positiva do ar na ponta da pipeta enquanto se aproxima de um neurônio.
- Mova-se para a soma até que um recuo seja visualizado no neurônio. Execute os próximos dois passos rapidamente.
- Faça uma vedação gigaohm (1 GΩ) liberando pressão de ar positiva.
- Mantenha a configuração do amplificador no modo de tensão-fixação e corrija a compensação da pipeta como zero pA. Execute um teste de vedação (pulso de teste de 10 mV a 100 Hz). Aplique pressão negativa do ar para romper um pequeno pedaço da membrana neuronal.
- Para testar as propriedades intrínsecas ativas dos neurônios auditivos, aplique injeções de corrente somática hiperpolarizantes e despolarizantes.
NOTA: Exemplos deste procedimento podem ser visualizados em Vídeo Suplementar S1, S2. Detalhes deste procedimento são fornecidos nas lendas do vídeo.
Resultados
Todas as fatias de tronco cerebral mostradas aqui foram adquiridas a partir de tecido cerebral (~200-300 μm) e imagens usando uma óptica de contraste de interferência objetiva e diferencial (DIC) de 5x. A câmera foi montada no microscópio de dissecação e conectada a um computador com software de aquisição de imagens (ver Tabela de Materiais). O conjunto de satélites para essas figuras (painéis certos) foi imageado usando um objetivo de imersão de água de ampliação de 60x. Foi tomado cuidado para garantir que todas as áreas da fatia do tronco cerebral fossem igualmente ampliadas durante a obtenção de imagens digitais. As fotografias foram tiradas com brilho e foco ideais. As imagens digitais das fatias do tronco cerebral foram costuradas de forma planar baseadas na área sobreposta e importadas para um computador desktop para ajustes adicionais de brilho, contraste e escala de cinza. Os microcircuitos básicos do cérebro auditivo da galinha foram identificados de acordo com o trabalho anterior 1,2,5,13. Sob o microscópio (objetivo 5x), núcleos auditivos foram identificados como a área adjacente às fibras nervosas fortemente mielinadas que coram em torno de cada núcleo, tanto ipsilateralmente quanto contralateralmente ao longo das regiões dorsais da fatia.
A Figura 1 mostra as seções coronais tradicionais do tecido cerebral (200-300 μm) de um embrião de frango E21. As quatro fatias coronais aqui mostradas representam as regiões de iso-frequência relativas dos núcleos auditivos do tronco cerebral, da região auditiva mais baixa da CF (Figura 1A, caudo-lateral) progredindo para a região auditiva mais alta da CF (Figura 1D, rostral-medial). Para todas as quatro fatias coronais na Figura 1A-D, regiões ampliadas de NM e NL rotulados são mostradas na coluna do meio e ampliadas (objetivo de 60x) na visão correta do painel de figuras (a e b, respectivamente, em insets de satélite). A seta na Figura 1A,B mostra a entrada de fibras nervosas auditivas, e a ponta da flecha mostra bifurcação de axônios NM à esquerda da fatia. A Figura 1C mostra outra estrutura do núcleo coclear aviário conhecida como núcleo angularis (NA, seta à esquerda e ponta de flecha à direita). As duas fatias coronais mais rostrais mostram o núcleo olivary superior (SON) localizado ao longo da região ventral-lateral da fatia coronal (Figura 1C,D, círculos brancos tracejados).
A Figura 2 mostra seções sagitárias de tecido cerebral (200-300 μm) de um embrião de frango E21. Para todas as três fatias sagiais (Figura 2A-C), regiões ampliadas de NM e NL rotuladas são mostradas na coluna do meio e ampliadas (objetivo de 60x) na visão correta do painel de figuras (a e b, respectivamente em imagens de satélite). NM e NL foram identificados onde as fibras nervosas auditivas (Figura 2A, seta média) entraram no aglomerado de neurônios observados em ampliação mais alta (Figura 2A, círculos médios, pequenos, brancos e pontas de flecha) e destaca o ponto de partida da região auditiva (Figura 2A, esquerda, círculo grande, branco tracejado e ponta de flecha). O FILHO foi identificado na região rostro-lateral da fatia mais lateral (Figura 2A, pequeno, branco, círculo tracejado). A Figura 2B mostra regiões tonotópicas estendidas que contêm regiões auditivas relativamente baixas e altas cf da NM e NL ao longo do eixo rostral-caudal (regiões delineadas brancas, ver também entrada de satélite ). A Figura 2C mostra os tufos axonal ipsilaterais e contralaterais na fatia mais medial e no ponto final da região auditiva (setas esquerda e média). A orientação das fatias aqui mostradas contrasta com a orientação tradicional das fatias, como visto na Figura 1 (ou seja, coronal). Isso foi realizado para mostrar a orientação que melhor acomoda a aproximação de uma pipeta de vidro necessária para gravações eletrofisiológicas.
Para confirmar que uma grande região do eixo tonotópico foi representada na Figura 2B, foram realizadas gravações de eletrofisiologia de grampos atuais a partir de neurônios NM. A Figura 3 mostra semelhanças funcionais e diferenças de neurônios NM maduros (E21) registrados a partir de uma fatia coronal (Figura 3A,B) e uma fatia sagital (Figura 3C,D, Vídeo Suplementar S1, S2). Dois neurônios NM foram selecionados das extremidades medial e lateral de uma fatia coronal (semelhante à fatia mostrada na Figura 1B), e dois neurônios NM foram selecionados das extremidades rostral e caudal do NM em uma fatia sagital (como na fatia mostrada na Figura 2B). A Figura 3A,B mostra propriedades de resposta eletrofisiológica semelhantes às injeções de corrente somática (−100 pA a +200 pA, +10 pA incrementos, 100 ms de duração). O padrão de disparo desses dois neurônios NM apresenta diferenças sutis neste plano de corte, indicando lamina iso-freqüência relativa para neurônios NM de média frequência. Figura 3C,D mostram que os padrões de disparo têm diferenças substantivas em todo o eixo rostral-caudal, indicando um gradiente tonotópico relativamente maior de um neurônio NM de baixa frequência (Figura 3C) para um neurônio NM de alta frequência (Figura 3D). Ambos os neurônios apresentaram seus padrões de disparo estereotipados como relatado anteriormente14,15.
A Figura 4 mostra seções horizontais do tecido do tronco cerebral (200-300 μm) de um embrião de frango E21. Para ambas as fatias horizontais (Figura 4A,B), regiões ampliadas de NM e NL rotuladas são mostradas na coluna do meio e ampliadas (objetivo de 60x) na visão correta do painel de figuras (a e b, respectivamente, em insets de satélite). Nas fatias horizontais, NM e NL foram identificados em direção à linha média e os neurônios foram espalhados ao longo do eixo lateral-medial (Figura 4A,B, regiões de contorno médio, branco e traço). As imagens ampliadas mostram a grande extensão do gradiente tonotópico. Neurônios de baixa frequência estão nas regiões caudo-laterais e neurônios de alta frequência estão nas áreas rostral-medial (Figura 4A,B, direita, satélites). As fibras que atravessam a linha média ao longo do eixo rostral-caudal mostram as conexões contralaterais dos núcleos auditivos, mas a organização dessas fibras não está em um plano simples. No entanto, fatias angulares agudas de uma seção horizontal/transversal podem seguir essas fibras axonais em direção ao plano sagital. Fatias de tecido cerebral de 200-300 μM de espessura em um ângulo agudo (45°) de um plano horizontal são mostradas na Figura 5. Núcleos de tronco cerebral auditivo podem ser vistos através de uma grande propagação diagonal começando da fatia mais lateral e terminando na fatia mais medial (Figura 5A-C, painéis médios rotulados, área delineada branca). Além disso, a orientação angular das regiões NM e NL também pode ser visualizada em sucessivas fatias assimétricas (Figura 5A-C, painéis médios rotulados, branco, área delineada tracejada). Imagens ampliadas (objetivo 60x) mostram o eixo tonotópico dos núcleos auditivos à medida que se projeta ao longo do rostral-medial ao eixo caudo-lateral (Figura 5A-C, à direita, conjunto satélite). A orientação das fatias na Figura 5 é semelhante à da Figura 2. Eles contrastam com a apresentação tradicional de imagens, mas são mais adequados para experimentos eletrofisiológicos.
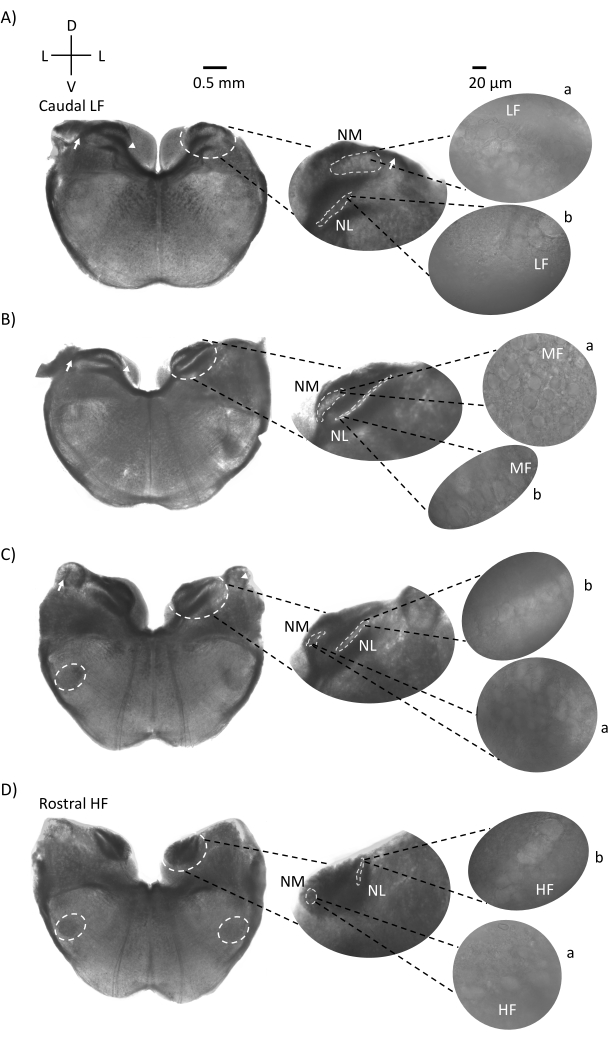
Figura 1: Seções representativas de série coronal do tronco cerebral. (A-D) Esquerda: fatias do eixo caudal ao rostral, os núcleos auditivos e fibras de conexão marcadas com um círculo branco tracejado. A inserção do meio é uma visão maior da região auditiva, onde núcleos são mostrados dentro de círculos brancos tracejados a: NM e b: NL. Setas mostram fibras diferentes do nervo auditivo, e a ponta de flecha mostra bifurcação de axão NM em A,B. Arrow mostra NA em C. Círculo branco lateral mostra SON em C,D. Direito: a inserção por satélite mostra esses núcleos em 60x objetivo: a: NM e b: NL. Abreviaturas: NM = núcleo magnocelularis; NL = núcleo laminaris; NA = núcleo angularis; SON = núcleo olivary superior; LF = neurônios relativamente de baixa frequência; MF = neurônios de média frequência; HF = neurônios de alta frequência; D = dorsal; L = lateral; V = ventral. Clique aqui para ver uma versão maior desta figura.
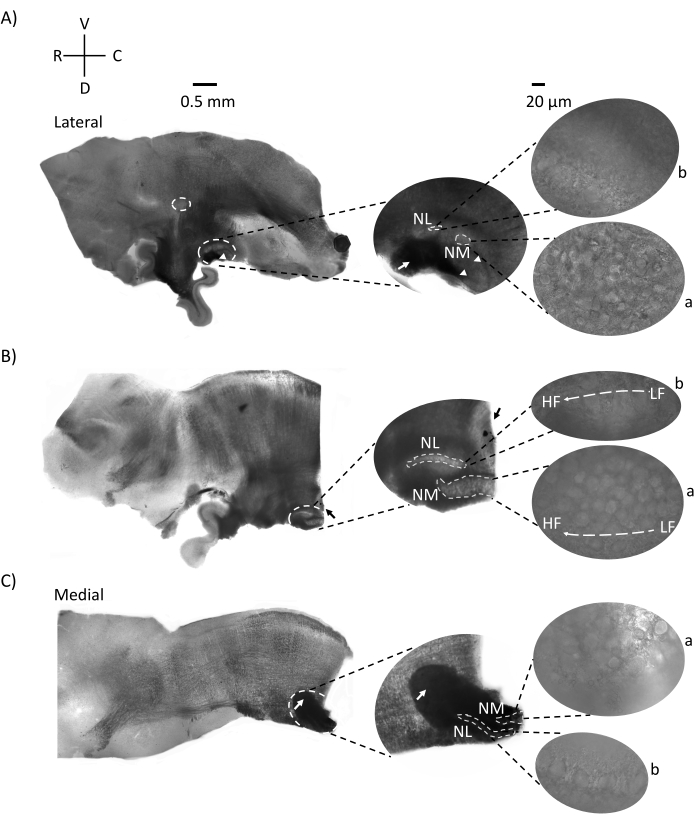
Figura 2: Seções representativas de série sagital do tronco cerebral. (A-C) Esquerda: fatias do eixo lateral ao medial com os núcleos auditivos rotulados em um círculo branco tracejado. A inserção do meio mostra a mesma região de núcleos auditivos em vista maior, marcada dentro de círculos brancos tracejados. (A) Círculo branco tracejado no centro da fatia destaca o SON; seta mostrando fibras nervosas auditivas e ponta de flecha mostrando NA. Uma mancha preta escura na ponta direita da fatia é um artefato de imagem. Regiões do cerebelo podem ser vistas dorsais para a região auditiva nas duas fatias A e B no painel esquerdo. (B) Uma fatia sagital cuja orientação foi alterada para o plano coronal (durante o corte). A região auditiva foi identificada com corante azul (seta preta) e novamente fatiada no plano sagital. (A-C) Inserção média NM e região NL marcadas sob linhas brancas tracejadas. Direito: a visualização do satélite mostra a: NM e b: NL observada em ampliação objetiva de 60x. O gradiente tonotópico LF e HF em núcleos auditivos é mostrado ao longo do eixo rostro-caudal. Setas apontando para a área escura em (C) mostram fibras NM fortemente myeliadas que atravessam a linha média através do eixo medial. As fibras conectam ambos os lados dos núcleos auditivos. Abreviaturas: NM = núcleo magnocelularis; NL = núcleo laminaris; NA = núcleo angularis; SON = núcleo olivary superior; LF = neurônios relativamente de baixa frequência; HF = neurônios de alta frequência; D = dorsal; V = ventral; R = rostral; C = caudal. Clique aqui para ver uma versão maior desta figura.
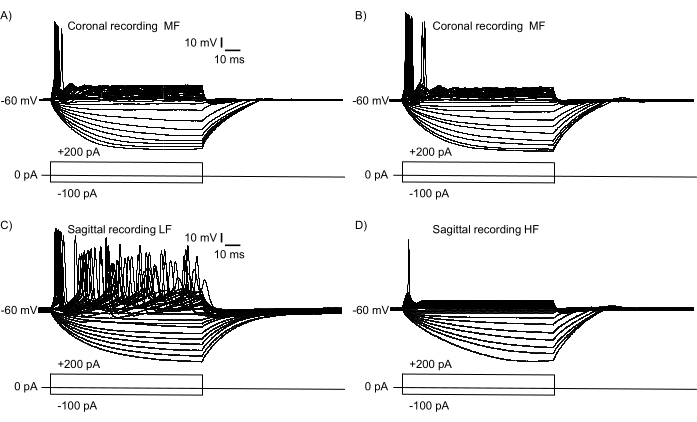
Figura 3: Gravações eletrofisiológicas de resposta neuronal a injeções de corrente somática (−100 pA a +200 pA, +incrementos de 10 pA, duração de 100 ms) no modo de fixação atual. Os neurônios foram selecionados para gravações na mesma fatia, mas em regiões extremas opostas da NM. (A,B) Respostas neuronais representativas em uma única fatia coronal indicando propriedades relativas de isoquência com diferenças sutis. As propriedades de resposta representam dois neurônios MF diferentes registrados das regiões mais medial (A) e lateral (B) de NM em uma fatia coronal. (C,D) Gravações neuronais representativas de uma única fatia sagital. As gravações mostram uma resposta relativamente LF NM (C) e uma resposta HF NM (D), destacando as diferenças substantivas no gradiente tonotópico ao longo de uma única seção sagital. Abreviaturas: NM = núcleo magnocelularis; LF = neurônios relativamente de baixa frequência; MF = neurônios de meia-frequência; HF = neurônios de alta frequência. Clique aqui para ver uma versão maior desta figura.
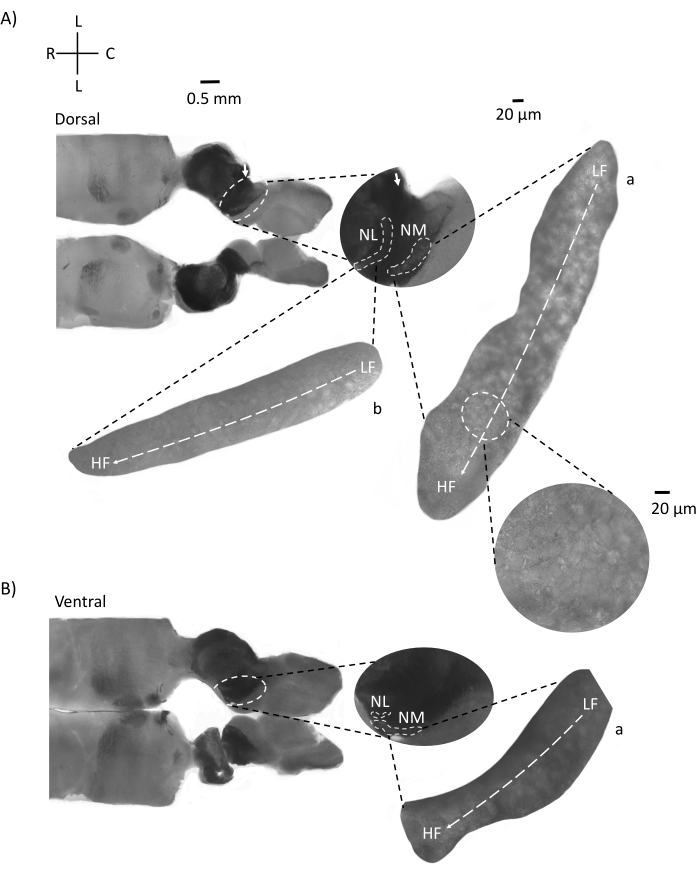
Figura 4: Seções de série horizontais representativas do tronco cerebral. (A,B) Esquerda: fatias ao longo do dorsal ao eixo ventral, núcleos auditivos são marcados com círculos brancos tracejados. O nervo8º das fibras aferentes do nervo craniano conectam núcleos auditivos marcados com seta. A inserção do meio é uma visão maior da região dos núcleos auditivos com núcleos auditivos marcados sob linhas brancas NM e NL regionais são mostradas. Um claro movimento topológico de núcleos auditivos pode ser visto em A,B. (A,B) Direito: grande visão de satélite mostrando a: NM e b: NL. A inserção direita mostra núcleos auditivos observados em ampliação objetiva de 60x e o eixo topológico curvo de LF para HF ao longo de um eixo caudo-lateral ao rostral-medial. Abreviaturas: NM = núcleo magnocelularis; NL = núcleo laminaris; LF = neurônios relativamente de baixa frequência; HF = neurônios de alta frequência; L = lateral; R = rostral; C = caudal. Clique aqui para ver uma versão maior desta figura.
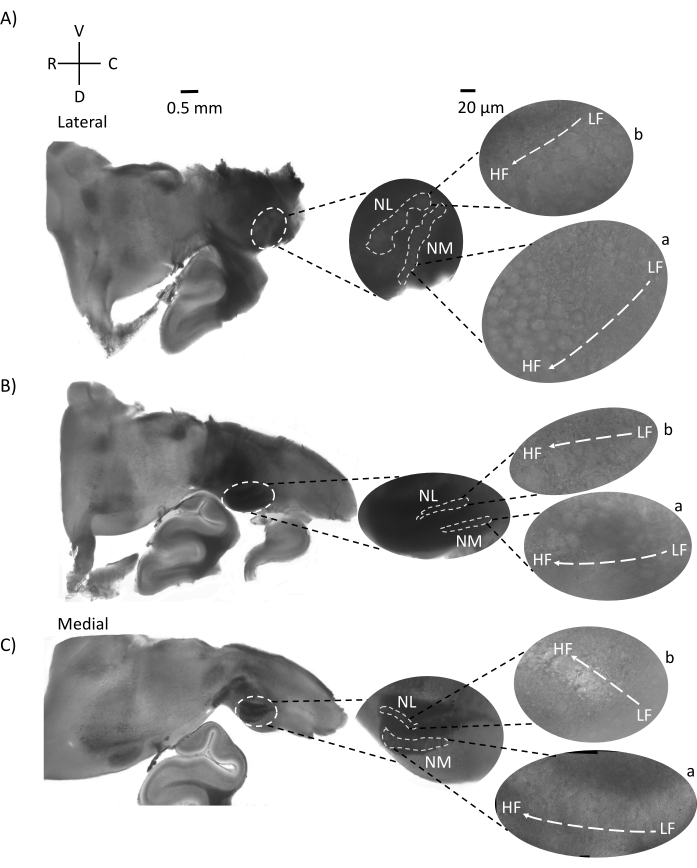
Figura 5: Seções angulares agudas horizontais/transversais representativas (45°) seções de série( A-C) Esquerda: seções seriais do tronco cerebral, núcleos auditivos marcados em círculo branco tracejado. A inserção do meio é uma visão maior da região auditiva. (A) A inserção média mostra a maior disseminação de neurônios NM e NL nessas fatias. (B,C) Inserção média: núcleos auditivos marcados em linhas brancas tracejadas apresentam mudanças topológicas graduais quando comparados com (A-C). Direito: inserção de satélite mostrando núcleos auditivos a: NM e b: NL em ampliação objetiva de 60x. O eixo tonotópico de LF para regiões HF em NM e NL gira angularmente de fatias laterais para medial. Abreviaturas: NM = núcleo magnocelularis; NL = núcleo laminaris; LF = neurônios relativamente de baixa frequência; HF = neurônios de alta frequência; V = ventral; R = rostral; D = dorsal; C = caudal. Clique aqui para ver uma versão maior desta figura.
Vídeo suplementar S1: Hiperpolarizando e despolarizando injeções de corrente somática. Propriedades de resposta de um neurônio de baixa frequência e alta frequência a injeções de corrente somática de 100 ms no modo de fixação atual. Os neurônios foram selecionados da mesma fatia do tronco cerebral sagital. As injeções variam de -100 a +200 pA em etapas de +10 pA incrementos, duração de tempo de 100 ms. Os potenciais de ação são vistos em resposta a etapas atuais suficientes despolarizantes. O vídeo corresponde aos traços finais mostrados na Figura 3C. Clique aqui para baixar este Arquivo.
Vídeo suplementar S2: Hiperpolarizando e despolarizando injeções de corrente somática. Semelhante ao Vídeo Suplementar S1, este vídeo mostra propriedades de resposta de um neurônio de baixa frequência e alta frequência a injeções de corrente somática de 100 ms no modo de fixação atual. Os neurônios foram selecionados da mesma fatia do tronco cerebral sagital. As injeções variam de -100 a +200 pA em etapas de +10 pA incrementos, duração de tempo de 100 ms. Os potenciais de ação são vistos em resposta a etapas atuais suficientes despolarizantes. O vídeo corresponde aos traços finais mostrados na Figura 3D. Clique aqui para baixar este Arquivo.
Discussão
Seções coronais de tecido cerebral embrionário de frango permitiram o estudo de lamina iso-freqüência individual relativa por décadas 1,2,5. No entanto, a organização tonotópica (ou seja, frequência) do tronco auditivo da galinha é topologicamente complicada e pode ser mais acessível em outros eixos anatômicos, dependendo da questão específica da pesquisa. Embora suficiente para investigar questões anatômicas e fisiológicas relativas a regiões individuais de isoquência, o estudo de variações tonotópicas e seu desenvolvimento em áreas maiores do tronco cerebral auditivo são um pouco limitados por seções coronais. Para superar essa limitação, este protocolo descreve abordagens nos planos sagital, horizontal e horizontal/transverso para fornecer exemplos adicionais de tecido cerebral auditivo que exibem propriedades tonotópicas máximas e gradientes em uma seção individual do tronco cerebral.
Seções sagilas de regiões auditivas do tronco cerebral mostram que diferentes áreas tonotópicas estão distribuídas em uma região maior dentro da fatia em comparação com seções coronais (área auditiva sagital = ~300-600 μm, área auditiva coronal = ~200-350 μm). Por exemplo, as regiões NM e NL foram visualizadas sobre uma área maior ao longo do eixo rostro-caudal em seções sagitárias (por exemplo, Figura 2B), e o gradiente tonotópico funcional que corre ao longo deste eixo anatômico foi em grande parte contido dentro de uma única fatia sagital. Isso foi confirmado ainda com registros atuais de diferenças neuronais intrínsecas que variam ao longo do gradiente rostral-caudal como relatado anteriormente14,15 (por exemplo, Figura 3C,D). Experimentos futuros que destacam propriedades anatômicas e imunohistoquímicas ao longo do eixo tonotópico poderiam investigar ainda mais gradientes conhecidos de propriedades auditivas dentro de um único plano de fatia sagital. Estes incluem, mas não se limitam a, padrões de coloração map2 e padrões de expressão de canais de potássio, que são gradientes conhecidos de arquitetura dendrítica e propriedades intrínsecas de NM e NL que foram previamente mostrados em sucessivas seções coronais16.
Seções horizontais de regiões auditivas do tronco cerebral mostram que o NM e o NL estão localizados em direção à linha média. Uma porção de fibras axonais auditivas corre diagonalmente ou perpendicularmente ao plano horizontal (Figura 4). Estas fibras podem ser seguidas fazendo uma fatia angular aguda de 45° para o plano sagital. As fatias horizontais/transversais resultantes foram maiores que as fatias sagiais ou horizontais, e fibras longas axonascidas perdulicadas através do eixo rostro-caudal para ambos os lados ipsilaterais e contralaterais. Tanto nm quanto NL podem ser visualizados em uma região diagonal maior (~400-700 μm) de modo que as conexões contralaterais possam ser visualizadas ao longo de um eixo lateral-medial. Além disso, o plano de fatia horizontal/transversal também mostra como as regiões auditivas e o gradiente tonotópico resultante fazem uma curva angular (Figura 5). A exposição angular de conexões contralaterais em uma área maior torna essas fatias mais adequadas para estimulação eletrofisiológica e estudos microcircuários do que as tradicionais fatias coronais.
Vantagens adicionais
A formação de microcircuitos auditivos requer coordenação espostetemporal de pistas que promovam a sobrevivência neuronal, a sinápgeno, a diferenciação axonal, a arquitetura dendrítica e o amadurecimento. Assim, uma seção alternativa do cérebro do microcircuito auditivo do embrião de frango pode ser usada para os seguintes tópicos de pesquisa: organização morfológica de neurônios em dimensões topograficamente diferentes; organização e mapeamento dos conectomes de todos os núcleos auditivos e vestibulares; identificação e caracterização dos padrões de atividade dos constituintes do circuito em planos iso-freqüência e tonotópicos; a organização topográfica de microcircuitos excitatórios versus inibitórios e relações com populações especializadas de neurônios (núcleos); localização espacial dos neurônios dos núcleos auditivos e sua CF17 preditiva; segmentação sistemática de tipos neuronais tonotópicos específicos; rastreamento de células progenitoras e seu desenvolvimento em núcleos conservados; linhagem genética das células à evolução dos circuitos neuronais18; anatomia do tronco cerebral comparativo entre espécies; investigação de circuitos vestibulares como o complexo vestibular de Deiter (DC)19; e sincronia e conversa cruzada entre núcleos vestibulares.
Uma abordagem multifacetada usando diferentes planos de fatias pode ajudar a responder perguntas fundamentais sobre propriedades anatômicas e biofísicas desconhecidas de microcircuitos do tronco cerebral. Um bom exemplo é a relação entre os principais núcleos auditivos (NM, NA, NL e SON) e os núcleos vestibulares, incluindo o núcleo dorsal do lemniscus lateral (LLDp), o núcleo semilunar (SLu)20 e o núcleo tangencial (TN)3. No entanto, este protocolo e esses estudos baseados em fatias têm algumas limitações.
Precauções e limitações
Dependendo da instituição que realiza os experimentos, as diretrizes éticas e o manuseio de embriões de frango podem diferir. Enquanto os Institutos Nacionais de Diretrizes de Saúde para o Cuidado e Uso de Animais de Laboratório permitem a decapitação rápida, existem métodos alternativos para a eutanásia de embrião de frango21. O tecido cerebral de embrião de frango é macio e delicado comparado com embriões mais antigos. Tem várias conexões e vasos sanguíneos na superfície que precisam de cuidado extra ao removê-los. O tecido deve ser mantido em dACSF gelado e perfumado com 95% de O2/5% de CO2 para aumentar a viabilidade.
O método de corte sagital só é útil para tonotopy ipsilateral. Este método de corte fornece fatias maiores do que fatias coronais, o manuseio pode ser precário. No entanto, pode-se cortar as fatias usando métodos de agulha cruzada descritos em detalhes em outros lugares22. O uso de 4% de LMP agarose block embedded brainstem pode salvar estruturas delicadas em fatias, mas deve-se tomar cuidado para não derramar agarose excessivamente quente. Defini-lo rapidamente colocando o tronco cerebral bloqueado por agarose em um ambiente refrigerado por ~1 min torna as fatias mais viáveis para gravações eletrofisiológicas.
A aplicação de supercola em quantidades em excesso pode ser tóxica. Deve ser aplicado minimamente, e os valores excedentes devem ser lavados imediatamente alterando o dACSF. Para fatias angulares agudas (45°), cortar o ângulo do bloco de agarose é fundamental; pode-se usar um espelho para ver o ângulo frontal enquanto corta o bloco de agarose com uma lâmina afiada. As lâminas disponíveis comercialmente podem ter um revestimento de cera que deve ser limpo com álcool e seco antes do uso. A otimização é necessária para a velocidade e frequência de corte de vibratome, pois tufos de fibra axonal são mais difíceis do que tecido cortical ou matricial. Manter uma alta amplitude e usar a solução de dissecção refrigerada pode evitar danos teciduais.
Todas as soluções devem ser preparadas frescas, e Ca2+ e Mg2+ devem ser adicionados ao ACSF depois de borbulhar 95% O2/5% CO2 . Caso contrário, pode haver precipitação de Ca2+. Um pincel deve ser usado para manusear as fatias suavemente dentro do vibratome. Mantenha o tempo total de corte abaixo de 15 minutos, se possível. Uma pipeta pasteur de vidro pode ser usada para manobrar fatias de tronco cerebral.
Não utilize detergentes ou agentes de lavagem corrosivos para vidros e equipamentos que entrem em contato com as fatias utilizadas na eletrofisiologia. As imagens tiradas representam o aparecimento de tecido de 200-300 μM de espessura sob a óptica de contraste de interferência diferencial (DIC). A qualidade visual será mais pobre do que a imunohistoquímica ou microscopia eletrônica, mas reflete com precisão o que um experimentador verá ao realizar gravações eletrofisiológicas.
Estudos relativos ao desenvolvimento precoce de microcircuitos ao longo de um eixo anatômico alternativo, sejam eles dorsais-ventral, rostral-caudal ou ipsilateral-contralateral, são limitados no tronco auditivo da galinha. Uma das razões para isso é porque o papel dos códigos transcricionais e da regulação do desenvolvimento tonotópico no tronco cerebral ainda não é totalmente compreendido. Fenômenos funcionais como modulação de cima para baixo e atividade espontânea são muitas vezes perdidos ao observar a atividade in vitro. No entanto, a pesquisa in vivo é complementada por gravações específicas e diretas de neurônios únicos somente possíveis nessas condições de fatia. O refinamento da obtenção de tecido cerebral ao longo de diferentes orientações poderia fornecer informações perspicazes sobre o desenvolvimento e a complexidade dos gradientes tonotópicos no microcircuito do tronco cerebral auditivo da galinha.
Divulgações
Todos os autores declaram que a pesquisa foi realizada sem qualquer interesse comercial ou financeiro e que não possuem conflitos de interesse.
Agradecimentos
Este trabalho é suportado pela subvenção NIH/NIDCD R01 DC017167. Agradecemos a Kristine McLellan por fornecer comentários editoriais sobre uma versão anterior do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Adobe photoshop 2021 | Adobe | ||
| Anti-vibration table 30"x 36" - OTMC - 63533 | TMC | ||
| Cell sens standard software | OLYMPUS | ||
| Digidata 1440A | MOLECULAR DEVICES | ||
| Digital amplifier multiclamp 700B | MOLECULAR DEVICES | ||
| DSK line-up linearslicer pro7 | TED PELLA, INC | ||
| Micromanipulator MPC-385 / OSI-MPC-385-2 | OLYMPUS AMERICA INC | ||
| Micropipette puller P-97 | SUTTER INSTRUMENTS | ||
| Microscope BX51W1 | OLYMPUS AMERICA INC | ||
| MS ICE software | Microsoft Corporation | ||
| Ohaus balance model AV212 | Ohaus Adventurer | ||
| Olympus DPSI0 /DPS80 camera | OLYMPUS | ||
| pClamp and Axoclamp data Acquisition Softwares | MOLECULAR DEVICES | ||
| pH meter lab 850 benchtop | SCHOTT INSTRUMENTS | ||
| Sharp stainless blade | Dorco/Personna | ||
| Vapor pressure osmometer model 5600 | WESCOR INC | ||
| Water purification systems Smart2pure 6UV/UF | Thermo Scientific | ||
| Chemicals- list | |||
| Agrose Low melt IB70051 | IBI SCIENTIFIC | ||
| CaCl2 (Calcium Chloride) | ACROS organics | ||
| Cynergy instant adhesive CA6001 | Resinlab | ||
| Dextrose (D-(+)-glucose) | VWR Life Science | ||
| Ethyl alcohol | IBI SCIENTIFIC | ||
| KCl (Potassium Chloride) | Amresco.Inc | ||
| MgCl2 (Magnesium Chloride) | Sigma-Aldrich | ||
| NaCl (Sodium Chloride) | Amresco.Inc | ||
| NaH2PO4 (Sodium Dihydrogen Phosphate) | Amresco.Inc | ||
| NaHCO3 (Sodium Bicarbonate) | Amresco.Inc |
Referências
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 164 (4), 411-433 (1975).
- Rubel, E. W., et al. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. Journal of Comparative Neurology. 166 (4), 469-489 (1976).
- Shao, M., et al. Spontaneous synaptic activity in chick vestibular nucleus neurons during the perinatal period. Neuroscience. 127 (1), 81-90 (2004).
- Fukui, I., Ohmori, H. Tonotopic gradients of membrane and synaptic properties for neurons of the chicken nucleus magnocellularis. Journal of Neuroscience. 24 (34), 7514-7523 (2004).
- Sanchez, J. T., Seidl, A. H., Rubel, E. W., Barria, A. Preparation and culture of chicken auditory brainstem slices. Journal of Visualized Experiments. (49), e2527(2011).
- Sanchez, J. T., Lu, Y. Glutamate signaling in the auditory brainstem. Auditory Development and Plasticity: Springer Handbook of Auditory Research. Fay, R. R., Popper, A. N., Cramer, K., Coffin, A. 64 (4), Springer. New York, NY. 75-108 (2017).
- Parks, T. N. Morphology of axosomatic endings in an avian cochlear nucleus: nucleus magnocellularis of the chicken. Journal of Comparative Neurology. 203 (3), 425-440 (1981).
- Jhaveri, S., Morest, D. K. Sequential alterations of neuronal architecture in nucleus magnocellularis of the developing chicken: a Golgi study. Neuroscience. 7 (4), 837-853 (1982).
- Carr, C. E., Boudreau, R. E. Central projections of auditory nerve fibers in the barn owl. Journal of Comparative Neurology. 314 (2), 306-318 (1991).
- Köppl, C. Auditory nerve terminals in the cochlear nucleus magnocellularis: differences between low and high frequencies. Journal of Comparative Neurology. 339 (3), 438-446 (1994).
- Fukui, I., et al. Improvement of phase information at low sound frequency in nucleus magnocellularis of the chicken. Journal of Neurophysiology. 96 (2), 633-641 (2006).
- Wang, X., et al. Postsynaptic FMRP regulates synaptogenesis in vivo in the developing cochlear nucleus. Journal of Neuroscience. 38 (29), 6445-6460 (2018).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments. (124), e55628(2017).
- Hong, H., Sanchez, J. T. Need for speed and precision: structural and functional specialization in the cochlear nucleus of the avian auditory system. Journal of Experimental Neuroscience. (12), 1-16 (2018).
- Hong, H., et al. Diverse intrinsic properties shape functional phenotype of low-frequency neurons in the auditory brainstem. Frontiers in Cellular Neuroscience. 12, 1-24 (2018).
- Wang, X., Hong, H., Brown, D. H., Sanchez, J. T., Wang, Y. Distinct neural properties in the low-frequency region of the chicken cochlear nucleus magnocellularis. eNeuro. 4 (2), 1-26 (2017).
- Tabor, K. M., et al. Tonotopic organization of the superior olivary nucleus in the chicken auditory brainstem. Journal of Comparative Neurology. 520 (7), 1493-1508 (2012).
- Lipovsek, M., Wingate, R. J. Conserved and divergent development of brainstem vestibular and auditory nuclei. Elife. 7, 40232(2018).
- Passetto, M. F., et al. Morphometric analysis of the AMPA-type neurons in the Deiter's vestibular complex of the chick brain. Journal of Chemical Neuroanatomy. 35 (4), 334-345 (2008).
- Curry, R. J., Lu, Y. Intrinsic properties of avian interaural level difference sound localizing neurons. Brain Research. 1752, 147258(2021).
- Aleksandrowicz, E., Herr, I. Ethical euthanasia and short-term anesthesia of the chick embryo. ALTEX - Alternatives to Animal Experimentation. 32 (2), 143-147 (2015).
- Palkovits, M. Isolated removal of hypothalamic or other brain nuclei of the rat. Brain Research. 14 (59), 449-450 (1973).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados