Method Article
心肌缺血再灌注损伤的改进啮齿动物模型
* 这些作者具有相同的贡献
Erratum Notice
摘要
通过使用自制的牵开器,聚氯乙烯管和独特的打结方法,改善了大鼠心脏的心肌缺血再灌注模型。心电图、三苯基氯化四唑鎓和组织学染色以及生存百分比分析结果表明,改进的模型组比已有的模型组具有更高的成功率和存活率。
摘要
冠心病 (CHD) 诱导的心肌缺血和再灌注损伤 (MIRI) 会对心肌细胞造成损害。此外,有证据表明,溶栓治疗或一期经皮冠状动脉介入治疗 (PPCI) 并不能预防再灌注损伤。MIRI仍然没有理想的动物模型。本研究旨在改进大鼠的MIRI模型,使手术更容易,更可行。通过在缺血期的关键步骤中使用软管来开发建立MIRI的独特方法。为了探索这种方法,将三十只大鼠随机分为三组:假组(n = 10);实验模型组(n = 10);和现有模型组 (n = 10)。比较三苯基氯化四唑染色、心电图和生存百分比的结果,以确定手术的准确性和存活率。根据研究结果,已经得出结论,改进的手术方法与更高的存活率,升高的ST-T段和更大的梗死尺寸有关,这有望更好地模仿MIRI的病理学。
引言
缺血性心脏病是全球死亡的主要原因。心血管死亡率在全球公共卫生和流行病学中起着至关重要的作用1.心肌缺血和再灌注损伤在缺血性心脏病中起着重要作用,缺血性心脏病是指一个复杂的病理生理学过程,包括三磷酸腺苷2的消耗,活性氧3的过度产生,炎症反应4和由于钙超负荷引起的线粒体功能障碍5,其 通过 代谢功能障碍和结构损伤引发急性心肌梗死6。
然而,心肌缺血和再灌注损伤 (MIRI) 的详细机制仍不得而知。本工作旨在开发一种独特的动物模型,以充分模拟MIRI的临床表现和治疗。否则,在MIRI模型研究过程中,大型动物7 (如猪)需要介入手术,这是昂贵的。小动物(如兔子8、小鼠9、10、11、12和大鼠13)需要在显微镜下进行精细手术10、遥控囊8、11或将心脏挤出腔9,这需要高水平的技术,并可能导致几种术后并发症,扰乱发现的准确性。具有较高存活率和较低成本的理想MIRI模型将在病理学研究中起到至关重要的作用。
这项研究旨在通过建立一个更容易获得和可行的MIRI大鼠模型来解决这些问题,以促进对MIRI病理学的研究,这可能导致发现MIRI的临床疗法。
研究方案
该研究已获得南京中医药大学动物护理与使用委员会的批准(许可号:202004A002)。该研究严格遵循美国国立卫生研究院(NIH)关于使用实验动物的指南(NIH出版物第85-23号,2011年修订)。这项工作使用了30只雄性Sprague-Dawley大鼠(体重,300±50克;年龄,12±14周)。
1. 动物准备
- 在手术前剥夺大鼠的食物和水12小时。术前禁食旨在预防肺误吸14.
- 手术前使用高压蒸汽灭菌器对所有器械进行灭菌。
- 通过腹腔注射施用戊巴比妥钠(1.5%,75mg / kg) 麻醉 大鼠(见 材料表)。
- 通过进行捏脚趾测试来评估麻醉的有效性。
注意:如果大鼠的后爪被镊子握住时没有观察到反射,则认为大鼠已充分麻醉。 - 拉直两个回形针的中间部分以形成"S"形。拉下每个"S"的宽截面以形成一个小的收紧器。
- 将直径为 2 mm 的聚氯乙烯 (PVC) 管切割成 7 mm 长的管。将10厘米长的4-0缝合线插入PVC管中,并将其末端绑住。
- 使用6-0缝线将左前降(LAD)冠状动脉和PVC管连接在一起。用眼科剪刀在PVC管的中间切一个凹槽,并用凹槽将6-0缝线穿过管子,以防止脱落。
注:PVC管和"S"形引头如图 1所示。
2. 手术程序
- 按照以下步骤进行手术以生成改进的MIRI大鼠模型。
注意:由改进的MIRI方法生成的动物模型组在整篇文章中称为实验模型组。- 麻醉后(步骤1.2),通过将大鼠以仰卧姿势放在手术板上,用胶带固定大鼠的四肢。用脱毛霜剃除颈部和左侧前胸部区域,并用75%酒精和碘伏磨砂膏清洁皮肤。
- 使用眼科剪刀沿正中颈线纵向切割颈部皮肤。
- 使用眼科镊子分离颈部肌肉,并在每侧放置一个牵开器(步骤1.4)以进一步缩回它们。
注意:有必要充分暴露气管,因为它对于在此步骤中防止甲状腺出血至关重要。 - 暴露气管后,确定第四和第五气管环之间的空间。这个空间是穿刺点。
- 使用针尖的钝边标记此点。此时,做一个平行于环状软骨的3mm切口。
- 通过切口(步骤2.1.5)将吸入套管(见材料表)插入气管,并机械通气大鼠以80次呼吸/分钟的速率和8mL / kg的潮气量维持正常呼吸。
- 接下来,从xiphoid到第二个左肋间间隙的中间做一个4-5厘米的切口,同时以45°角握住手术刀。轻轻而缓慢地分开胸大肌和锯齿前肌,使用眼用镊子进入肋间间隙。
- 使用眼科剪刀在左第三和第四肋骨之间横向切一个1.5厘米的切口。
- 如果需要,切除第四根肋骨以暴露被左肺覆盖的心脏。这样可以提供更好的可见性。
- 为了防止受伤,将浸泡在胸腔肺部上方生理盐水溶液中的棉球。使用眼用镊子切除心包,用镊子抬起左心耳,并识别主动脉根部存在的冠状动脉口。
- 在左肺和耳廓之间的部分,使用6-0手术缝合线将LAD和预先准备好的短管(步骤1.6)连接在一起,并使用滑结将其绑住。将滑结放在PVC管的凹槽中,并使用第二个滑结拧紧连接管和LAD 45分钟15(图1A,B)。
- 记录缺血期间心电图(ECG)左心室前部的颜色变化和ST段抬高。
注意:在缺血期间,左心室的前部变得苍白。 - 用动脉夹夹住胸部肌肉和皮肤,用湿润的盐水纱布覆盖伤口。
- 松开滑结,并在45分钟15后取出预先准备好的短管(图1C)。
- 在再灌注期间保持大鼠麻醉2小时。
- 按照先前公布的程序16进行手术以生成大鼠模型。
注意:此动物模型组在整篇文章中称为现有模型组。- 在结扎LAD冠状动脉之前,执行与实验模型组相同的步骤。
- 在缺血期间,仅在与实验模型组相同的位置使用6-0手术缝合线,并用滑结连接每只大鼠的近端LAD冠状动脉,并扎上滑结45分钟。
- 结扎后,用镊子松开滑结,用缝合针和镊子缝合大鼠的切口,并在再灌注17,18,19期间将动物保持在1.5%戊巴比妥钠的深度麻醉中2小时,然后收获大鼠的心脏。
3. 三苯基氯化四氮唑染色的评估
- 在再灌注结束时,大鼠在仍然深度麻醉的同时进行真化。牺牲老鼠并立即收获他们的心脏16,20。在PBS溶液中洗涤心脏,并将其在-20°C下储存约20分钟以使组织硬化。
- 随后,用切片机刀片将心脏切成2mm切片,将其与2%三苯基氯化四唑铯(TTC)(参见 材料表)在37°C下孵育约30分钟,并将其固定在10%中性福尔马林中。
- 拍摄心脏切片,并使用ImageJ软件的图像处理程序计算梗死区域(参见 材料表)。
注意:由于染色,梗死部位呈现淡白色,而正常组织显示为深红色。
4. 组织学染色
- 在再灌注期结束时,在1.5%戊巴比妥钠的深度麻醉下收获心脏。
- 将心脏在4°C下固定在10%福尔马林中48小时。
- 随后,用切片机将心脏切片成至少6片(5μm厚),并确保至少三片用于苏木精和曙红(H&E)和Masson染色20,21。
- 在光学显微镜下观察载玻片,并拍摄它们。
5. 心电图评估
- 将动物随机分为实验性或现有的MIRI模型组或假组,以评估心电图变化。
- 在手术结扎期间麻醉所有大鼠,并评估标准肢体导联II示踪20,21以识别心电图变化并确认心肌缺血。
- 将所有图像存储在数字库中。
6. 统计分析
- 使用科学绘图和统计软件进行统计分析(见 材料表)。
- 将所有数据表示为均值±均值的标准误差。在每个组的正态性和对数正态性检验之后,对方差和t检验22进行单向分析以确定各组之间的显著差异。将 p 值 <0.05 视为具有统计显著性。
结果
TTC染色
用TTC染色接受现有或改进的MIRI手术或假手术的大鼠的心脏切片,并以数字方式存储图像并使用ImageJ进行分析。接受已经存在或改进的MIRI手术的大鼠有心肌梗塞,而假组的大鼠没有(图2B)。与假大鼠组相比,现有(p <0.0001)和实验(p <0.0001)MIRI模型组的大鼠心肌梗死大小差异显著,实验模型组心肌梗死大小大于现有模型组(p=0.0176)(图3B)。
组织学染色
对使用H&E和Masson染色22,23染色的标本的分析表明,与假组相比,实验组和现有模型组的心肌细胞都经历了严重的损伤和核解,并被许多嗜中性粒细胞浸润(图3)。
心电图检查
现有和实验MIRI模型组大鼠的心电图ST-T段与假组大鼠相比升高(图4A),实验模型与假组(p <0.0001)或现有模型与假组(p <0.0001)的差异显著(图4B)。此外,实验模型组的ST-T段比现有模型组高(p = 0.0274)(图4C)。
生存百分比
两个MIRI模型组之间的存活率显着不同(图4D)。十只大鼠中有四只在现有的模型组中死亡。再灌注期间的死亡率为40%。相比之下,实验模型组没有一只大鼠在手术过程中死亡,证明当前改进的模型具有更高的存活率(p = 0.0291)。
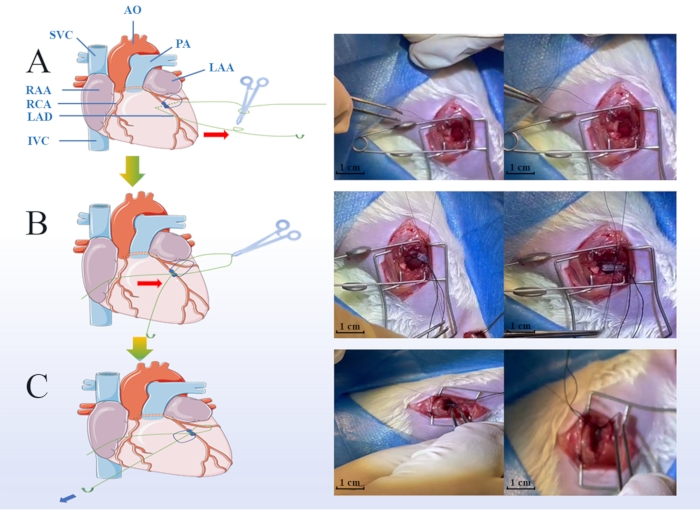
图1:心肌缺血和再灌注损伤(MIRI)模型手术的关键步骤。 绿点表示缺血期结扎方案,包括将软管放在冠状动脉(A)上,将缝合线钩入预先准备好的软管(B)的凹槽中,松开滑结,并在再灌注期开始时取出软管(鳞片条= 1cm)(C).LAA:左心耳,RAA:右心耳,LAD:左前下垂,RCA:右冠状动脉,IVC:下腔静脉,SVC:上腔静脉,AO:主动脉,PA:肺动脉。 请点击此处查看此图的大图。
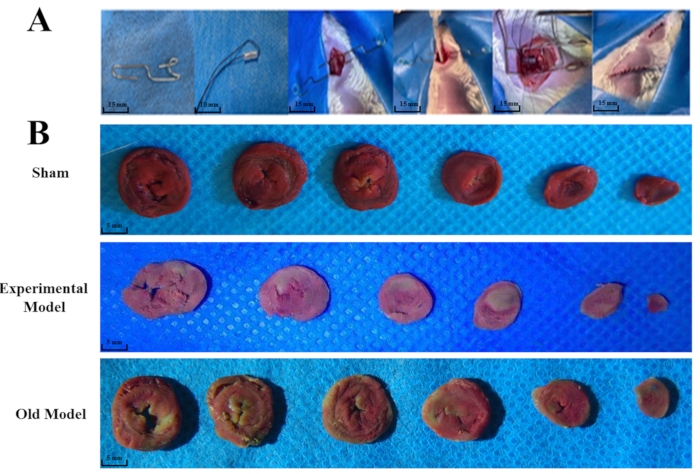
图2:整个手术过程和不同组间三苯基氯化四氮唑(TTC)染色的差异。 图中显示了预先准备好的小牵开器(比例尺= 15 mm),软管(比例尺= 10 mm)和整个手术(比例尺= 15 mm)(A)。将30只大鼠随机分为实验组(n = 10),假组(n = 10)和现有模型(n = 10)组。TTC染色表明,与假模型组(B)相比,实验组和现有模型组均有显着变化。实验中心肌的前壁和现有模型组中的侧壁变为淡白色,确认缺血区的位置(比例尺= 5 mm)。图中"现有模型"被描绘为"旧模型"。 请点击此处查看此图的大图。
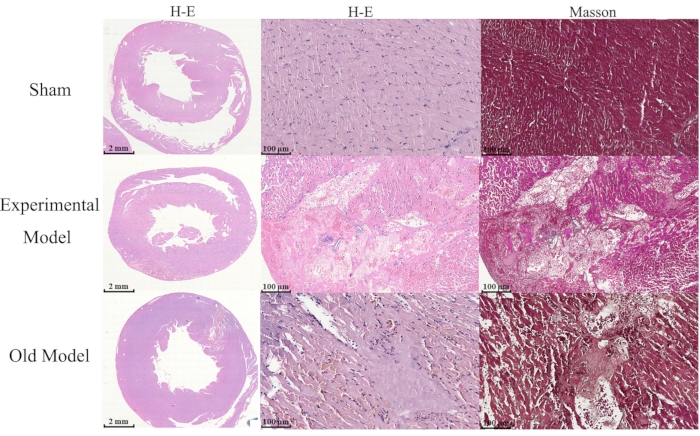
图3:组间H&E和Masson染色的差异。 将30只雄性Sprague Dawley大鼠随机分为实验组(n = 10),假组(n = 10)和现有模型(n = 10)组,并显示组间细胞形态变化的比较(比例尺= 2 mm)。苏木精和曙红(H&E)以及Masson染色表明,实验模型和现有模型组的心肌细胞具有临界损伤,核解,并且与假组相比,被许多嗜中性粒细胞浸润(比例尺= 100μm)。图中"现有模型"被描绘为"旧模型"。 请点击此处查看此图的大图。
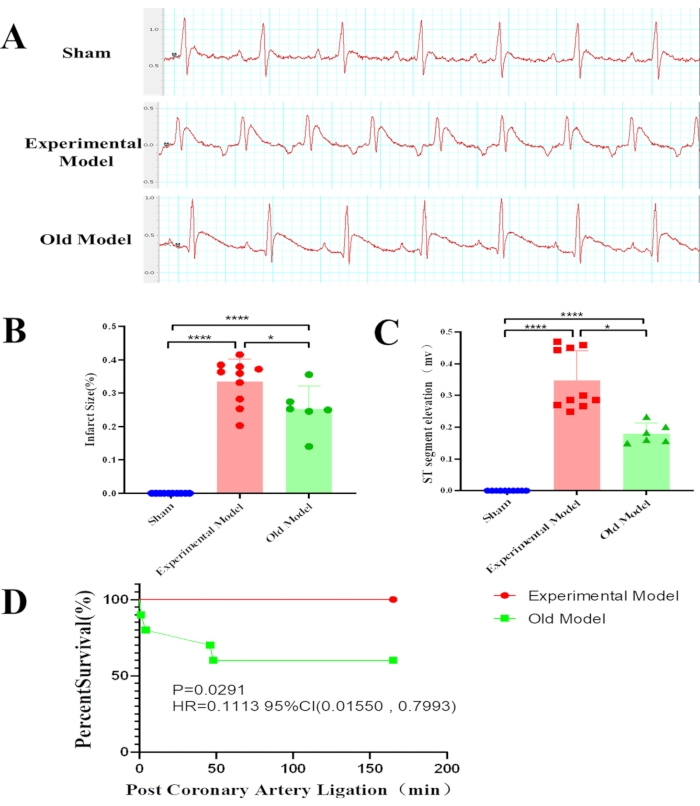
图4:各组之间统计结果的差异。将30只雄性Sprague Dawley大鼠随机分为实验组(n = 10),假组(n = 10)和现有模型(n = 10)组。心电图结果显示,与已有的模型组相比,实验模型组具有较大的心肌梗死大小(****p <0.0001,*p = 0.0176)(A),较高的ST段抬高(****p <0.0001,*p = 0.0274)(B),存活率较高(p = 0.0291)(C).特别是,现有模型组的大鼠更有可能在缺血期开始和再灌注期开始时死亡(D)。图中"现有模型"被描绘为"旧模型"。 请点击此处查看此图的大图。
补充图1:预制的引子和PVC管的细节。 图中显示了预先准备好的牵开器(A)和PVC管(B)。 请点击此处下载此文件。
讨论
现有方法和改进方法之间的主要区别在于在连接过程中使用PVC管。在现有的手术方法中,仅使用6-0丝缝线连接心肌组织,这在结扎过程中引起心肌损伤,导致术中死亡。此外,心脏的脉动会松开滑结。相反,在用PVC管改进的方法中,可以收紧放置在管槽中的滑结,并且受结扎影响的心肌面积增加。在实验过程中观察到这些益处,并通过TTC染色和百分比生存结果证实。
改进手术方法的关键步骤是将软管放在LAD冠状动脉近端,在缺血期结扎期间伴有神经,淋巴管和心肌组织。这种预先准备好的软管可以作为缓冲,保护外周组织(神经,心肌和淋巴管),并降低冠状动脉结扎期间的死亡率。用已经存在的方法进行的手术类似于心肌梗塞的手术。生存百分比结果表明,现有模型组中的大鼠主要在缺血期间死亡(两只大鼠在结扎后2分钟死亡,两只大鼠在结扎后45分钟死亡)。否则,死亡的根本原因尚不清楚,并且有一系列假设,包括对神经结构23,淋巴管和心肌的额外损伤。
关于神经损伤,先前的研究表明,在动物模型中的缺血期间,除了缺血对神经结构的直接局部影响外,神经肽Y(NPY)水平也可能显着降低,导致交感神经支配中轴质转运紊乱24。这一发现与Han等人25报告的结果一致,他们揭示了在大鼠结扎LAD冠状动脉后梗死心肌内发生NPY的逐渐消失。然而,NPY在这方面的作用尚不清楚。其缺失在急性心肌梗死26期间减弱心功能不全和细胞凋亡,并与心律失常27,高血压和冠状动脉微血管功能28有关。
此外,缺血期间发生心脏淋巴流动不良梗阻,导致严重的心肿,左功能障碍和出血29,这可能是大鼠死亡的另一个原因。在此病理过程中,LAD 冠状动脉的结扎可能归因于冠状动脉阻塞或梗死区域内的心脏淋巴运输,这可能导致其他并发症,例如心外膜收集器淋巴管的不良重塑、淋巴流量减少和持续性水肿30。
因此,淋巴管循环在心脏稳态31和伤口愈合32中起功能性作用,本研究中的生存率结果表明,改进的MIRI外科手术可以通过在结扎期间将软管放在LAD冠状动脉上来避免淋巴损伤并促进淋巴再灌注。相比之下,现有的手术方法更容易撕裂心肌,并在LAD冠状动脉结扎期间引起大量出血,而没有软管的缓冲作用。此外,预先制备的软管直径远大于6-0丝缝合线,并且在缺血期间滑结与管子结合时,管子可能已经收缩并诱导了更大的梗塞尺寸。
这项研究有一些局限性。在初步实验中分析了心脏的梗死大小。替换公式(N = 7.75)是使用先前报告的等式33计算的。考虑到大鼠在手术过程中可能死亡,N提高了25%;因此,决定n = 10(每组10只大鼠)。否则,已经存在的生成MIRI模型的方法死亡率很高。因此,实验模型组中的少数案例(低样本量)影响了统计结果。包括超声心动图30,Evans蓝染色34和心肌酶测量35在内的几种评估对于心脏功能评估和分析至关重要。由于这项工作的样本量小,没有进行这些评估,并将在今后的MIRI药效学研究中加以描述。然而,考虑到现有的生成MIRI模型的外科手术与广泛的心肌损伤有关,值得报告本方法以改善MIRI在大鼠中的建模,并为这种正确模拟缺血性心脏病的临床前模型带来启示。
综上所述,与现有的MIRI模型生成方法相比,改进的手术方法生成MIRI模型具有更高的存活率,升高的ST-T段和更大的梗死尺寸,这表明改进的模型更好地模拟了MIRI病理。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了中医药管理局[SLJ0204],江苏省中医院(Y21017),国家自然科学基金[81973763,81973824,82004239]的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10% Neutral Formalin | Chunyu, China | _ | |
| 2,3,5-Triphenyl-2H-Tetrazolium Chloride | Solarbio, China | T8107 | |
| 75% Alchol | SCR, China | 10009261 | |
| Artery Clip | Zhonglin Dongsheng, China | 6.5cm | |
| Camera | Olympus Corporation, Japan | EPL5 | |
| Cotton ball | Huachen, China | _ | |
| Dpilatory cream | Veet, China | _ | |
| Eye speculum | Shanghai Jingzhong, China | _ | |
| Gauze | Zhonggan, China | _ | |
| GraphPad | GraphPad Software, USA | 8.0 | |
| H&E Kit | Solarbio, China | G1120 | |
| High-pressure steam sterilizer | TOMY, Japan | SX-500 | |
| ImageJ | NIH, USA | _ | |
| Masson Kit | Solarbio, China | G1340 | |
| Medical Tape | Mr.Song, China | _ | |
| Microscope | Olympus Corporation, Japan | CKX31 | |
| Microscopy | TEKSQRAY, China | _ | |
| Microtome | Leica, Germany | RM2235 | |
| Microtome Blade | Leica, Germany | 819 | |
| Needle holder | Shanghai Jingzhong, China | _ | |
| Ophthalmic scissors | Shanghai Jingzhong, China | _ | |
| Ophthalmic tweezers | Shanghai Jingzhong, China | _ | |
| Paper clip | Chenguang, China | ABS91613 | |
| Physiological saline solution | Kelun, China | _ | |
| Powerlab ECG | ADINSTRUMENTS ,China | 4/35 | |
| PVC tube | Guanzhijia, China | _ | |
| Small animal ventilator | TECHMAN, China | HX-101E | |
| Sodium Pentobarbital | SIGEMA, USA | 1030001 | |
| Suction trocar | TECHMAN, China | HX-101E | |
| Suture line | Lingqiao, China | 4-0 | |
| Suture needle with thread | Shanghai Pudong Jinhua Medical Products Co LTD, China | 6-0 |
参考文献
- Mozaffarian, D., et al. Heart disease and stroke statistics-2016 update: a report from the American heart association. Circulation. 133 (4), 38 (2016).
- Allen, D. G., Orchard, C. H. Myocardial contractile function during ischemia and hypoxia. Circulation Research. 60 (2), 153-168 (1987).
- Ashraf, M. I., et al. A p38MAPK/MK2 signaling pathway leading to redox stress, cell death and ischemia/reperfusion injury. Cell Communication and Signaling. 12, 6 (2014).
- Hernandez-Resendiz, S., et al. The role of redox dysregulation in the inflammatory response to acute myocardial ischaemia-reperfusion injury - adding fuel to the fire. Current Medicinal Chemistry. 25 (11), 1275-1293 (2018).
- Heidrich, F., et al. The role of phospho-adenosine monophosphate-activated protein kinase and vascular endothelial growth factor in a model of chronic heart failure. Artificial Organs. 34 (11), 969-979 (2010).
- Shen, Y., Liu, X., Shi, J., Wu, X. Involvement of Nrf2 in myocardial ischemia and reperfusion injury. International Journal of Biological Macromolecules. 125, 496-502 (2019).
- Hinkel, R., et al. AntimiR-21 prevents myocardial dysfunction in a pig model of ischemia/reperfusion injury. Journal of the American College of Cardiology. 75 (15), 1788-1800 (2020).
- Torrado, J., et al. Sacubitril/Valsartan averts adverse post-infarction ventricular remodeling and preserves systolic function in rabbits. Journal of the American College of Cardiology. 72 (19), 2342-2356 (2018).
- Guan, L., et al. MCU Up-regulation contributes to myocardial ischemia-reperfusion Injury through calpain/OPA-1-mediated mitochondrial fusion/mitophagy Inhibition. Journal of Cellular and Molecular Medicine. 23 (11), 7830-7843 (2019).
- Fan, Q., et al. Dectin-1 contributes to myocardial ischemia/reperfusion injury by regulating macrophage polarization and neutrophil infiltration. Circulation. 139 (5), 663-678 (2019).
- Huang, C., et al. Effect of myocardial ischemic preconditioning on ischemia-reperfusion stimulation-induced activation in rat thoracic spinal cord with functional MRI. International Journal of Cardiology. 285, 59-64 (2019).
- Li, D., et al. Cardioprotection of CAPE-oNO2 against myocardial ischemia/reperfusion induced ROS generation via regulating the SIRT1/eNOS/NF-κB pathway in vivo and in vitro. Redox Biology. 15, 62-73 (2018).
- Cui, Y., Wang, Y., Liu, G. Protective effect of Barbaloin in a rat model of myocardial ischemia reperfusion injury through the regulation of the CNPY2PERK pathway. International Journal of Molecular Medicine. 43 (5), 2015-2023 (2019).
- Lin, M. W., et al. Prolonged preoperative fasting induces postoperative insulin resistance by ER-stress mediated Glut4 down-regulation in skeletal muscles. Int J Med Sci. 11 (5), 1189-1197 (2021).
- Wu, J., et al. Sevoflurane alleviates myocardial ischemia reperfusion injury by inhibiting P2X7-NLRP3 mediated pyroptosis. Frontiers in Molecular Biosciences. 26 (8), 768594 (2021).
- Wu, Y., Yin, X., Wijaya, C., Huang, M. H., McConnell, B. K. Acute myocardial infarction in rats. Journal of Visualized Experiments. (48), e2464 (2011).
- Zhang, C. X., et al. Mitochondria-targeted cyclosporin: A delivery system to treat myocardial ischemia reperfusion injury of rats. Journal of Nanobiotechnology. 17 (1), 18 (2019).
- Liu, X. M., et al. Long non-coding RNA MALAT1 modulates myocardial ischemia-reperfusion injury through the PI3K/Akt/eNOS pathway by sponging miRNA-133a-3p to target IGF1R expression. European Journal of Pharmacology. 916, 174719 (2022).
- Li, L., et al. Ginsenoside Rg3-loaded, reactive oxygen species-responsive polymeric nanoparticles for alleviating myocardial ischemia-reperfusion injury. Journal of Controlled Release. 317, 259-272 (2020).
- Mickelson, J. K., et al. Streptokinase improves reperfusion blood flow after coronary artery occlusion. International Journal of Cardiology. 23 (3), 373-384 (1989).
- Verscheure, Y., Pouget, G., De Courtois, F., Le Grand, B., John, G. W. Attenuation by R 56865, a novel cytoprotective drug, of regional myocardial ischemia- and reperfusion-induced electrocardiographic disturbances in anesthetized rabbits. Journal of Cardiovascular Pharmacology. 25 (1), 126-133 (1995).
- Fan, M. L., et al. Animal model of coronary microembolization under transthoracic echocardiographic guidance in rats. Biochemical and Biophysical Research Communications. 568 (3), 174-179 (2021).
- Lim, M., et al. Intravenous injection of allogeneic umbilical cord-derived multipotent mesenchymal stromal cells reduces the infarct area and ameliorates cardiac function in a porcine model of acute myocardial infarction. Stem Cell Research & Therapy. 9 (1), 129 (2018).
- Trautner, H., et al. Heart innervation after ligation of the left anterior descending coronary artery (LAD). Histochemistry. 92 (2), 103-108 (1989).
- Han, C., Wang, X. A., Fiscus, R. R., Gu, J., McDonald, J. K. Changes in cardiac neuropeptide Y after experimental myocardial infarction in rat. Neuroscience Letters. 104 (1-2), 141-146 (1989).
- Huang, W., et al. Deletion of neuropeptide Y attenuates cardiac dysfunction and apoptosis during acute myocardial infarction. Frontiers in Pharmacology. 10, 1268 (2019).
- Kalla, M., et al. The cardiac sympathetic co-transmitter neuropeptide Y is pro-arrhythmic following ST-elevation myocardial infarction despite beta-blockade. European Heart Journal. 41 (23), 2168-2179 (2020).
- Cuculi, F., et al. Relationship of plasma neuropeptide Y with angiographic, electrocardiographic and coronary physiology indices of reperfusion during ST elevation myocardial infarction. Heart (British Cardiac Society). 99 (16), 1198-1203 (2013).
- Vuorio, T., Tirronen, A., Ylä-Herttuala, S. Cardiac Lymphatics - a new avenue for therapeutics. Trends in Endocrinology and Metabolism: TEM. 28 (4), 285-296 (2017).
- Henri, O., et al. Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction. Circulation. 133 (15), 1484-1497 (2016).
- Oliver, G., Kipnis, J., Randolph, G. J., Harvey, N. L. The lymphatic vasculature in the 21st century: novel functional roles in homeostasis and disease. Cell. 182 (2), 270-296 (2020).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLoS Biology. 18 (7), 3000411 (2020).
- Miller, D. L., Li, P., Dou, C., Armstrong, W. F., Gordon, D. Evans blue staining of cardiomyocytes induced by myocardial contrast echocardiography in rats: evidence for necrosis instead of apoptosis. Ultrasound in Medicine & Biology. 33 (12), 1988-1996 (2007).
- Deng, C., et al. α-Lipoic acid reduces infarct size and preserves cardiac function in rat myocardial ischemia/reperfusion injury through activation of PI3K/Akt/Nrf2 pathway. PLoS ONE. 8 (3), 58371 (2013).
Erratum
Formal Correction: Erratum: Improved Rodent Model of Myocardial Ischemia and Reperfusion Injury
Posted by JoVE Editors on 7/27/2022. Citeable Link.
An erratum was issued for: Improved Rodent Model of Myocardial Ischemia and Reperfusion Injury. The Authors section was updated.
The Authors section was updated from:
Hua-Qin Tong*1
Man-Lu Fan*1
Tong Sun1
Hao-Wen Zhang2
Jie Han3
Meng-Xi Wang1
Jian-Dong Chen3
Wei-Xin Sun4
Xiao-Hu Chen3
Mian-Hua Wu5
1First College of Clinical Medicine, Biological Technology Center for Innovation in Chinese Medicine, Nanjing University of Chinese Medicine
2School of Health Preservation and Rehabilitation, Key Laboratory of Acupuncture and Medicine Research of Ministry of Education
3Department of Cardiology, Jiangsu Provincial Hospital of Chinese Medicine
4Department of Cardiology, Yancheng TCM Hospital Affiliated to Nanjing University of Chinese Medicine
5Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine (TCM) Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine
* These authors contributed equally
to:
Hua-Qin Tong*1,2,3
Man-Lu Fan*3
Tong Sun3
Hao-Wen Zhang4
Jie Han5
Meng-Xi Wang3
Jian-Dong Chen5
Wei-Xin Sun6
Xiao-Hu Chen1,2
Mian-Hua Wu7
1Department of Cardiology, Affiliated Hospital of Nanjing University of Chinese Medicine
2Department of Cardiology, Jiangsu Province Hospital of Chinese Medicine
3First College of Clinical Medicine, Biological Technology Center for Innovation in Chinese Medicine, Nanjing University of Chinese Medicine
4School of Health Preservation and Rehabilitation, Key Laboratory of Acupuncture and Medicine Research of Ministry of Education
5Department of Cardiology, Jiangsu Provincial Hospital of Chinese Medicine
6Department of Cardiology, Yancheng TCM Hospital Affiliated to Nanjing University of Chinese Medicine
7Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine (TCM) Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine
* These authors contributed equally
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。