Method Article
通过乙二胺四乙酸介导的脱粘性快速、经济高效、无酶地传代人多能干细胞在饲养细胞上
摘要
为了避免与在饲养细胞上培养的人胚胎干细胞 (hESC) 和人诱导多能干细胞 (hiPSC) 的酶促或机械传代相关的限制,我们建立了一种快速、有效、经济高效、高产的方法,用于使用 EDTA 介导的脱粘性收获维持在人包皮成纤维细胞的饲养细胞层上的 hESC 或 hiPSC 集落。
摘要
人类多能干细胞(人类胚胎干细胞、hESCs和人类诱导多能干细胞、hiPSCs)最初是在不同类型的饲养细胞上培养的,以便在长期培养中维持在未分化状态。这种方法在很大程度上已被无饲养层培养方案所取代,但这些方案涉及更昂贵的试剂,并且会促进向引发状态的转变,从而限制细胞的分化能力。在饲养层和无饲养层条件下,收获 hESC 或 hiPSC 菌落进行传代是扩增培养物的必要程序。
为了为传代在饲养层细胞上培养的 hESC/hiPSC 提供一种简单且高产量的程序,我们建立了一种使用钙螯合剂乙二胺四乙酸 (EDTA) 引起的脱粘的收获方法。我们通过将这种方法与原始机械收获方法进行比较来评估所得传代细胞的产量和质量,在原始机械收获方法中,在显微镜下用手术刀分离菌落(选择机械收获作为比较,以避免与酶收获相关的试剂变异性)。
在一组实验中,在人包皮成纤维细胞的饲养细胞层上维持两种不同的hESC系。使用基于EDTA或机械收获的每株细胞系进行多次传代,并评估菌落大小和形态、细胞密度、干性标记物表达、胚状体中三个胚层的分化以及基因组畸变。在另一组实验中,我们在两个不同的hiPSC系上使用基于EDTA的收获,并获得了类似的结果。与机械收获相比,EDTA诱导的脱粘节省了时间,并提供了更高的菌落产量,具有更有利的大小和更均匀的形态。它也比酶收获更快,并且不容易出现酶批次变异。EDTA诱导的脱粘方法还有助于将hESC/hiPSC系从基于饲养层细胞的培养物转移到无饲养层条件(如果需要用于下游使用和分析)。
引言
体外 hESC 和 hiPSC 的适当维持是人类细胞和发育生物学研究的多种途径的基本且方便的方法。由于 hESC 和 hiPSC 分化的内在驱动力,在体外保持未分化状态需要特别小心和注意。因此,开发具有成本效益的方案来维持和传代 hESC 和 hiPSC,同时尽可能减少方法学上的变异性,具有很大的普遍实用性。
最初,hESCs 和 hiPSC 在不同类型的饲养细胞上培养,以帮助长期培养和维持未分化状态 1,2,3。最近,在无饲养层条件下培养已成为常态,因为它完全避免了与饲养层细胞打交道4.然而,一些实验室和核心设施仍在饲养细胞上培养 hESC 或 hiPSC。无饲养层培养物更昂贵,因为它需要使用特殊成分的培养基和某种形式的培养表面涂层以确保菌落粘附(主要细胞外基质 [ECM] 成分或商业 ECM 化合物,或使用市售包被板)。这笔费用并非微不足道,对于一些有兴趣进行基于hESC或hiPSC的研究和开发的实验室来说,这是一个潜在的财务障碍。此外,在无饲养层条件下的培养往往会使 hESC 和 hiPSC 达到比饲养层细胞上维持的更不幼稚的状态5,这可能会影响随后的分化并导致遗传变异6。
从历史上看,在饲养细胞上培养的 hESC 和 hiPSC 的传代涉及机械收获——使用手术刀在显微镜下切除菌落7——但后来这在很大程度上被酶消化所取代,有或没有轻柔的刮擦以分离菌落或解离的细胞。机械采集是繁琐的,需要精确的显微外科手术。由于批次间酶的差异,酶促收获的效率可能会有所不同,并且倾向于完全解离,除非被 ROCK 抑制剂抵消,否则会促进细胞死亡 8,9 并增加异常核型9 的发生率。
为了利用在饲养层细胞上培养 hESC 和 hiPSC 的较低费用和更大的分化潜力,同时避免机械和酶促收获的缺点,我们建立了一种快速、有效、经济、高产的方法,用于使用 EDTA 介导的脱粘性来收获维持在人包皮成纤维细胞饲养层上的 hESC 和 hiPSC 集落。我们将产量、变异性和干细胞质量与机械收获获得的产量、变异性和干细胞质量进行了比较(我们没有与酶消化进行比较,因为这种方法需要额外的变异性)。我们注意到,EDTA介导的脱粘也适用于将菌落从基于饲养层的培养物转移到无饲养层的条件下,如果需要用于下游使用和分析。该方法提供了具有一致传代方法的过渡,因为EDTA诱导的脱粘是用于无饲养层培养物的常用方法。
研究方案
有关本协议中使用的所有材料、试剂和仪器的详细信息 ,请参阅材料表 。
1.人成纤维细胞的培养和饲养细胞层的制备
- 每个 T-75 培养瓶(所需烧瓶数量)接种 0.5 ×10 6 个人包皮成纤维细胞(以下简称"饲养层细胞"),加入 20 mL Iscove 改良 Dulbecco 培养基 (IMDM) 和 (w/) 10% 胎牛血清 (FBS),以下简称"饲养细胞培养基"。
- 当饲养层细胞达到 90% 汇合时,取出培养基,并在每个烧瓶中用 10 mL Dulbecco 磷酸盐缓冲盐水 (DPBS) 洗涤 3 次,以避免培养基中的因子抑制胰蛋白酶。向每个烧瓶中加入 2 mL 胰蛋白酶-EDTA,并将烧瓶置于 37 °C/5% CO2 培养箱中 5 分钟或直到饲养细胞从烧瓶中分离。在显微镜下观察细胞的分离,作为细胞或单个细胞的漂浮聚集体。
- 向每个烧瓶中加入 5 mL 新鲜预热的饲养层细胞培养基以灭活胰蛋白酶-EDTA,并通过移液轻轻悬浮饲养层细胞。
- 将饲养细胞转移到 15 mL 离心管中。盖上管盖,并通过以200× g 离心5分钟来沉淀饲养细胞。
- 小心地除去上清液,不要干扰饲养细胞沉淀。然后,小心地将沉淀重悬于 4 mL 新鲜饲养细胞培养基中。在使用细胞计数室或其他细胞计数设备进行计数之前,确保将饲养细胞彻底重悬。
- 将 0.5 × 106 个饲养层细胞加入所需数量的新 T-75 培养瓶中进行扩增,并向每个培养瓶中加入 20 mL 新鲜饲养层细胞培养基。将培养瓶在 37 °C/5% CO2 培养箱中孵育,直到饲养细胞达到 90% 汇合度。
注意:馈线电池至少可以使用第 25 代。 - 计算将用于培养 hESC/hiPSC 的 35 mm 组织培养皿数量所需的饲养细胞数。
注意:通常,每个组织培养皿 3.0 ×10 5 个 饲养层细胞足以产生饲养层细胞的汇合层。 - 为避免饲养层细胞的增殖,请确保它们以两种方式之一被有丝分裂阻滞。
注意:对于这两种方法,都可以生成大量有丝分裂阻滞的饲养细胞并将其冷冻成等分试样以备后用。- 通过伽马辐照进行有丝分裂阻滞,将所需的所有饲养层细胞转移到 50 mL 离心管中,并用饲养层细胞培养基充足至总体积为 5 mL。在室温下立即运输到伽马辐照机,并辐照以有丝分裂阻滞饲养细胞(300 kV和10 mA,持续20分钟)。
注意:运输延迟可能导致饲养池意外附着在 50 mL 离心管壁上。如果运输需要几分钟以上,请通过不断搅拌管子来确保饲养池在运输过程中保持悬浮状态。 - 使用丝裂霉素C进行有丝分裂阻滞,将5mL饲养层细胞培养基中所需的所有饲养层细胞转移到50mL离心管中,然后加入15mL含有20μg/ mL丝裂霉素C的饲养层细胞培养基,并在37°C / 5%CO 2培养箱中孵育3小时。加入 20 mL 37 °C PBS,通过以 200 × g 离心 5 分钟的方式沉淀细胞,再重复 PBS 洗涤两次,然后重悬于饲养细胞培养基中。
- 通过伽马辐照进行有丝分裂阻滞,将所需的所有饲养层细胞转移到 50 mL 离心管中,并用饲养层细胞培养基充足至总体积为 5 mL。在室温下立即运输到伽马辐照机,并辐照以有丝分裂阻滞饲养细胞(300 kV和10 mA,持续20分钟)。
- 在饲养层细胞有丝分裂阻滞后,返回组织培养罩,并以每35mm组织培养皿3.0×105 个细胞铺平饲养层细胞,如下所示。确保饲养层细胞完全重悬,加入饲养层细胞培养基以达到每毫升 1.5 × 105 的 饲养层细胞浓度,并向每个 35 mm 组织培养皿中加入 2 mL 该饲养层细胞悬浮液。
- 将培养皿转移到37°C / 5%CO2 培养箱中。为确保饲养细胞的均匀分布,在培养箱架上缓慢但牢固地向前和向后移动培养皿 3 次,然后暂停,然后从左到右执行相同的动作 3 次。不要再移动盘子,轻轻关闭培养箱门。
- 24 小时后,从饲养细胞培养基切换到具有 10% 血清替代 (SR) 的 IMDM。此后每三天更换一次。饲养层电池在前 3 天后即可使用。
2. hESC或hiPSC菌落的机械收获
- 预热 hESC 培养基,包括 80% Dulbecco 改良 Eagle 培养基 (DMEM)、20% SR、1 mM 谷氨酰胺替代品 100x、1 mM 非必需氨基酸 (NEAA)、1 mM 青霉素/链霉素 (P/S)、0.1 mM 2-巯基乙醇和 10 ng/mL 碱性成纤维细胞生长因子 (bFGF)。hESC 培养基用于在饲养层细胞上培养 hESC 或 hiPSC。
- 取含有有丝分裂阻滞的饲养细胞的新鲜 35 mm 组织培养皿,并在转移 hESC/hiPSC 菌落前至少 30 分钟用含有 bFGF 的 1.2 mL hESC 培养基替换饲养细胞培养基。
- 将含有hESC / hiPSC菌落的培养皿放在有丝分裂阻滞的饲养细胞上,在显微镜下以10倍放大倍数放置在层流罩内。使用无菌手术刀小心地围绕每个菌落的圆周切割,然后将每个菌落切成 5-6 个大致相等的块。用手术刀刀片的尖端小心地提起菌落碎片,使它们从饲养细胞层中分离并自由漂浮在培养基中。
- 尽量避免含有分化细胞的菌落区域,与菌落内的 hESC/hiPSC 相比,这些细胞表现为较小细胞的岛屿,细胞核不太明显。
- 用 1 mL 移液管将自由漂浮的菌落转移到含有饲养细胞的新培养皿中。尽量将菌落分开,以免它们以后相互生长。小心地将培养皿移至细胞培养箱中,避免在第二天之前打扰培养皿。
- 第二天,小心地加入 600 μL 含有 bFGF 的 hESC 培养基,最终体积为 1.8 mL。此后每天更换 hESC + bFGF 培养基,直到下一次传代(通常在 1 周后)。
3. 使用 EDTA 介导的脱粘附收获 hESC 或 hiPSC 菌落
- 取具有有丝分裂阻滞的饲养细胞的新鲜培养皿,并在菌落转移前至少 30 分钟从 IMDM w/ 10% SR 切换到 1.2 mL 预热的 hESC + bFGF 培养基。
- 一次处理一个含有 hESC 或 hiPSC 菌落的培养皿。去除 hESC + bFGF 培养基,并用 1 mL 室温 DPBS 洗涤菌落,以消除任何可能的未连接细胞和细胞碎片。加入 1 mL 0.5 mM EDTA,并在 37 °C 下孵育 1 分钟。 如果层流罩有加热板,请在加热板上执行此步骤和第 4 节中的步骤,以更好地脱粘。
- 孵育 1 分钟后,取出 EDTA 溶液,并使用 1 mL 移液管小心加入 1 mL hESC + bFGF 培养基。用相同的移液管轻轻研磨,以从饲养层细胞层中释放菌落。继续小心研磨,直到饲养层细胞层松动并折叠成单独的团块。用移液器吸头拉开饲养层细胞层。
- 用新的 1 mL 移液管将悬浮的 hESC/hiPSC 菌落转移到含有饲养细胞和 hESC + bFGF 培养基的新培养皿中,以 1:5 的比例分裂。菌落倾向于在每个新的培养皿中均匀分布,但通过轻轻地将培养皿从一侧移动到另一侧来促进这一点。此后每天更换 hESC + bFGF 培养基,直到下一次传代(通常在 1 周后)。
结果
在下面记录的检测和比较中,我们使用了两个hESC系(分别来自WiCell和卡罗林斯卡研究所的H9和HS429)和两个hiPSC系(NCS001和NCS002,均由挪威人多能干细胞核心设施生成)。图和表中显示的数据来自hESC系,但从hiPSC系获得了完全相似的结果。
在我们的手中,机械收获导致菌落分裂成大约五到六个直径~200-250μm的团块,而EDTA诱导的脱粘随后研磨,每个菌落分裂成~10-20个直径~60μm的团块。我们估计每个EDTA收获的团块中的细胞数为~20。由于用手术刀将菌落分成这种大小的团块是不切实际的,因此在这方面,EDTA诱导的脱粘性更优越,因为它产生的团块的大小更有利于菌落细胞存活10,11。
与机械收获的菌落相比,使用EDTA收获的hESC/hiPSC菌落在大小和形状上也更均匀(图1A-F)。这是因为机械收割所需的切割会产生不均匀的边缘和不同的团块大小。为了定量评估这一点,我们使用 ImageJ-win64 协议12 评估了传代后 5 天的菌落圆度(作为衡量菌落边缘圆度的量度;值为 1 表示完美的圆)。机械收获菌落的菌落圆度显著降低(机械收获:0.61±0.10;基于EDTA的收获:0.84±0.01;n = 10,p < 0.001,Mann-Whitney U 检验,U = 10)。
收获和重新铺板菌落中的细胞密度是集落形成过程中收获后细胞-细胞相互作用的量度,与基于EDTA的收获和机械收获相似(表1和图1G,H)。机械收获的菌落在其中心区域有更大的坏死倾向(图1J)。这可能是由于形状的可变性,特别是机械分离的细胞团块的大小,因为当这些团块太大时,它们在转移到新的培养皿中时很容易折叠起来。使用EDTA收获的菌落并非如此,EDTA均匀地表现出具有明显边缘的半透明外观(图1I)。
使用基于EDTA的收获,我们能够在2-3分钟内收集到井中建立的所有菌落。使用机械收割,将所有菌落收集在井中既繁琐又耗时。我们通常只收集~30%或~20-25个菌落,使用机械收获,这需要~20分钟。同样,使用胶原酶消化,然后轻轻刮擦,通常很难收获所有菌落,尽管整个过程只需要几分钟。因此,基于EDTA的收获与酶收获一样快或更快,并且比机械或酶收获更有效。
为了评估不同收获方法对茎性和多能性的影响,我们首先使用基于EDTA或机械收获的20次传代后获得的菌落进行qPCR分析(图2)和免疫细胞化学染色(图3 和 图4)作为茎性标记。使用任何一种方法获得的菌落在mRNA和蛋白质水平上都表现出稳定的干性标志物表达。然后,我们通过分化到胚状体中的三个胚层来评估多能性(图5 和 图6)。使用任何一种方法在20次传代后获得的hESC或hiPSCs产生的胚状体含有表达通常评估的外胚层、中胚层和内胚层标志物的细胞混合物。
最后,我们使用基于qPCR的遗传分析评估了每种方法传代的hESC和hiPSCs中基因组畸变的发生率(见 材料表)。使用任一收获方法在20次传代后获得的菌落显示出一些与参考二倍体染色体模式适度偏差的例子(评估的异常通常与hiPSC的重编程有关,但也可以在hESC中获得)(图7)。然而,在两种收获方法后获得的菌落中,这些偏差的模式基本相同,表明它们与收获方法无关。
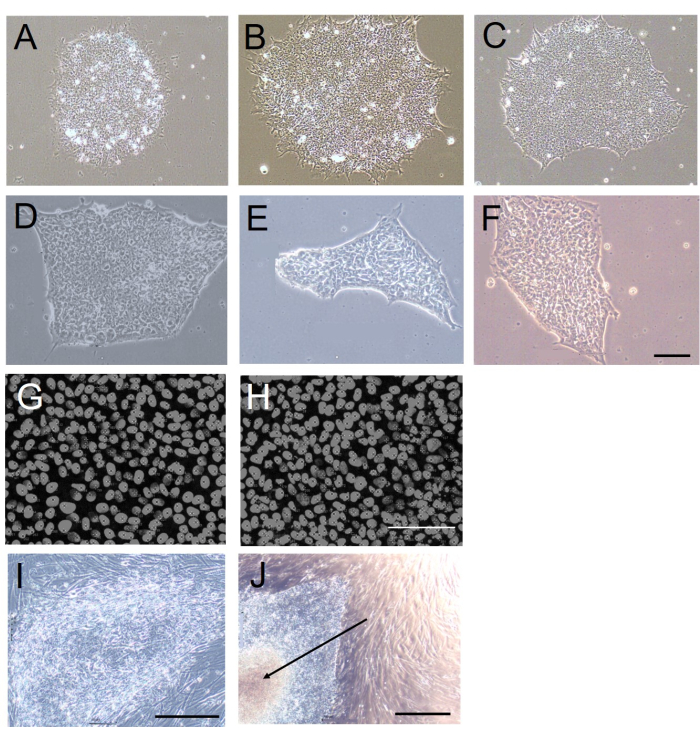
图 1:基于 EDTA 或机械收获后的菌落形态和细胞密度。 (A-F) 使用 (A-C) 基于 EDTA 或 (D-F) 机械收获 20 次传代后在无饲养层培养物中建立 5 天的 H9 hESC 菌落的代表性明场图像。(G,H)使用 (G) 基于 EDTA 或 (H) 机械收获 20 次传代后建立的 H9 hESC 菌落中细胞密度的代表性荧光图像。细胞核用DAPI染色。(一、J)使用 (I) 基于 EDTA 或 (J) 机械收获的 20 次传代后建立的 H9 hESC 集落的代表性明场图像。注意机械收获的菌落中坏死的中心区域(J中的箭头)。所有图像都是在第 20 次通过后 5 天采集的。比例尺 = 100 μm。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸;DAPI = 4',6-二脒基-2-苯基吲哚。请点击这里查看此图的较大版本.
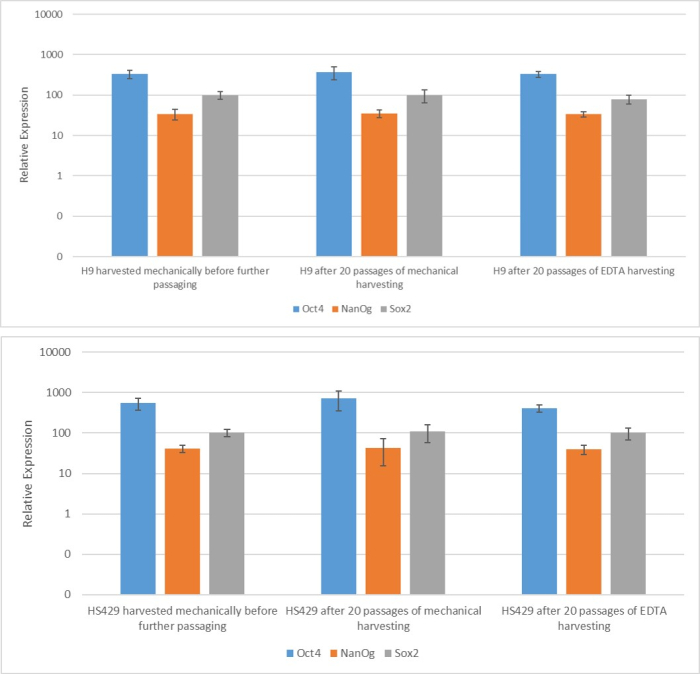
图 2:基于 EDTA 或机械收获后产生的两个 hESC 系(H9 和 HS429)中干性标记物 mRNA 的表达。 使用机械收获单次传代后、使用机械收获 20 次传代后和使用基于 EDTA 的收获(1:5 稀释)对 H9(上图)和 HS429(下图)hESC 中指示标记物的指定标记物进行定量实时聚合酶链反应。表达水平与管家基因 ACTB (β-肌动蛋白)的表达水平有关。误差线表示标准偏差。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸。 请点击这里查看此图的较大版本.
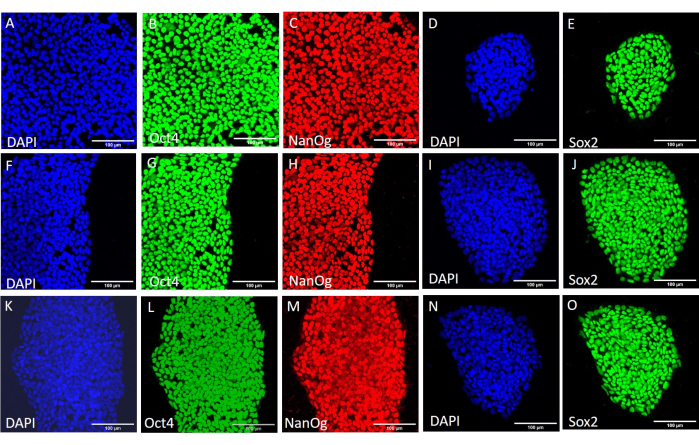
图 3:不同收获条件下 H9 hESC 细胞系中干性标记蛋白的表达。 在进一步传代前机械收获 (A-E)、使用机械收获 20 次传代后 (F-J) 和使用基于 EDTA 的收获 20 次传代后 (K-O) 对 H9 hESC 菌落的代表性免疫荧光染色。比例尺 = 100 μm。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸;DAPI = 4',6-二脒基-2-苯基吲哚。请点击这里查看此图的较大版本.
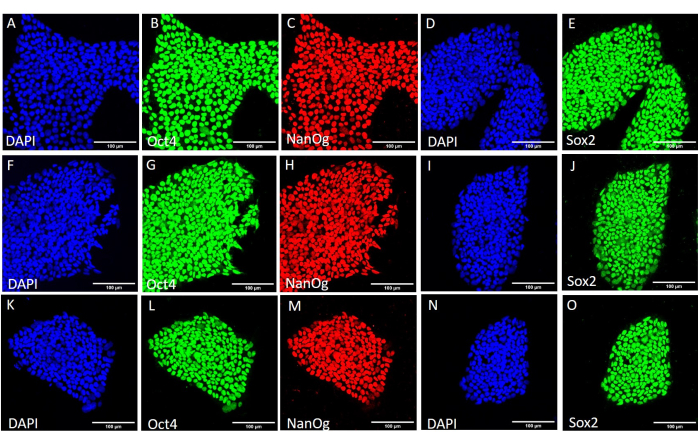
图 4:不同收获条件下 HS429 hESC 系中干性标记蛋白的表达。 在进一步传代前机械收获 (A-E)、使用机械收获 20 次传代后 (F-J) 和使用基于 EDTA 的收获 20 次传代后 (K-O) 对 HS429 hESC 菌落进行代表性免疫荧光染色。比例尺 = 100 μm。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸;DAPI = 4',6-二脒基-2-苯基吲哚。请点击这里查看此图的较大版本.
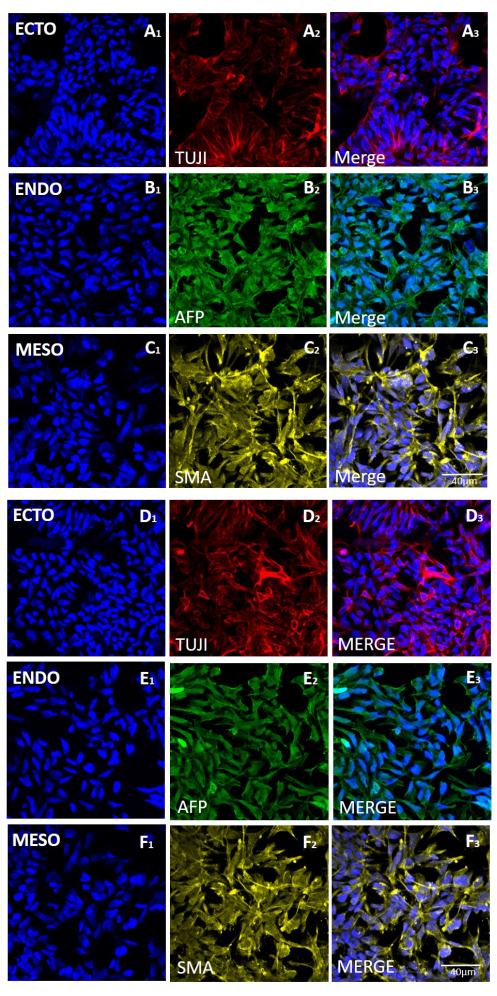
图 5:机械或基于 EDTA 的收获后,H9 hESC 系产生的胚状体中三个胚层标记物的表达。(A 和 D 行)外胚层(ECTO、TUJI)、(B 和 E 行)内胚层(ENDO、AFP)和(C 和 F 行)中胚层(MESO、SMA)标志物的代表性免疫荧光染色。机械收获 20 次传代后产生的 EB (A-C) 或基于 EDTA 的收获 20 次传代后产生的 (D-F)。比例尺 = 40 μm。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸;EBs = 胚状体。请点击这里查看此图的较大版本.
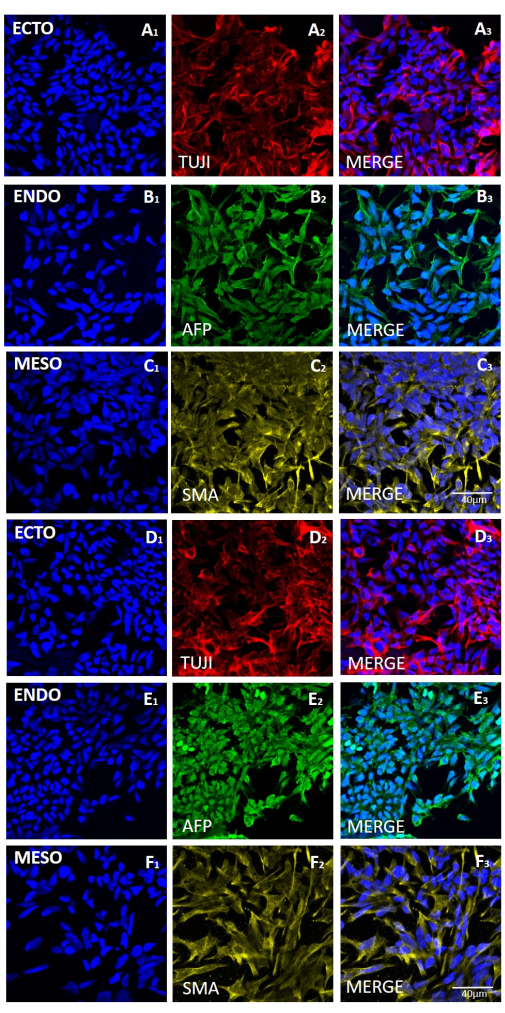
图 6:机械或基于 EDTA 的收获后,HS429 hESC 系产生的胚状体中三个胚层标记物的表达。 (A 和 D 行)外胚层(ECTO、TUJI)、(B 和 E 行)内胚层(ENDO、AFP)和(C 和 F 行)中胚层(MESO、SMA)标志物的代表性免疫荧光染色。机械收获 (A-C) 20 次后产生的 EB (A-C) 或基于 EDTA 的收获 20 次后产生的 (D-F)。比例尺 = 40 μm。缩写:hESC=人胚胎干细胞;EDTA = 乙二胺四乙酸;EBs = 胚状体。请点击这里查看此图的较大版本.
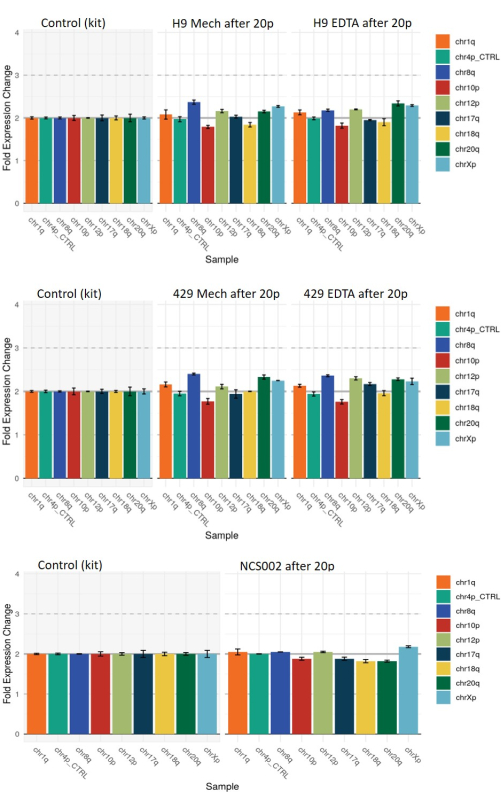
图 7:基于 qPCR 的遗传分析,使用机械或基于 EDTA 的收获对 HS9 和 HS429 ESC 系以及 NCS002 iPSC 系在 20 次传代后出现的常见基因组畸变进行遗传分析。 值 2 处的基线表示所有染色体标记处的正常二倍体。值 1 或 3 分别表示所有细胞中指示的染色体标记的丢失或增加。介于 1 和 2 之间或介于 2 和 3 之间的中间值表示在一部分细胞中存在指示标记物的丢失或增益。请注意,在两种收获条件下,像差模式是相似的。缩写:ESC = 胚胎干细胞;EDTA = 乙二胺四乙酸;iPSC = 诱导多能干细胞。 请点击这里查看此图的较大版本.
| 细胞密度(细胞/mm2) | ||
| H9型 | 意味 着 | 标准开发 |
| 进一步传代前的机械收获 | 3918 | 263.3 |
| 机械收割 20 次 | 3868 | 197.7 |
| EDTA收获20倍 | 4080 | 127.8 |
| HS429型 | 意味 着 | 标准开发 |
| 进一步传代前的机械收获 | 5249 | 565.4 |
| 机械收割 20 次 | 5247 | 726.3 |
| EDTA收获20倍 | 4963 | 448.8 |
表 1:基于 EDTA 或机械收获后产生的两种 hESC 系(H9 和 HS429)菌落中细胞密度的比较。 使用机械收获单次传代后,使用机械收获 20 次传代后或使用基于 EDTA 的收获(1:5 稀释度)传代 20 次后评估细胞密度。在所有情况下,n = 5 个菌落。
讨论
我们已经描述了一种使用EDTA介导的脱粘性收获在饲养细胞上培养的hESCs和hiPSCs的快速且具有成本效益的方法,并将其主要与使用手术刀机械收获的传统方法进行了比较。我们还比较了基于EDTA的收获与酶促收获的方法速度,而不是最终菌落质量的各个方面。其原因是酶收获本质上更具可变性,并且与基因组畸变的较高患病率有关5,这可能会掩盖方法间的差异。
我们证明,基于EDTA的收获比其他任何一种方法都更快、更有效,并且比机械收获产生更小、形态更均匀的菌落。后一个特征对细胞存活是有益的,因为通过机械收获获得的较大团块容易发生中央坏死,而酶消化往往会产生分离的 hESC 和 hiPSC,它们更容易细胞凋亡,需要额外的处理,例如使用 ROCK 抑制剂,才能存活。基于EDTA的收获可用于至少20次传代。基于EDTA的机械收获方法在菌落细胞密度、干性基因的mRNA和蛋白质表达、胚状体中三个胚层的分化以及基因组异常方面具有可比性。如果目标是高效、提高产量、减少变异性以及更温和地处理 hESC 和 hiPSC,则首选基于 EDTA 的收获。
我们还注意到,基于EDTA的饲养层细胞上培养的hESCs和hiPSCs的收获是一种维持更幼稚状态的廉价方法,并在需要的情况下提供了从饲养层培养到无饲养层培养的平稳过渡。
协议中的关键步骤
EDTA介导的脱粘的最关键步骤是方案第3部分(在EDTA溶液中孵育)和第4部分(研磨)。如果暴露于EDTA溶液超过1分钟,则完全解离为单个细胞的风险增加。如果磨练时间太长或太苛刻,也会发生这种情况。后者受移液器吸头尺寸的影响。使用此处所述的 1 mL 细胞培养移液器是理想的选择。使用吸头直径较小的不同类型的移液器是有风险的。
故障 排除
如果饲养细胞继续增殖,则有丝分裂阻滞无效,必须取新一批并重新开始手术。如果菌落没有从饲养层细胞层上松动,则必须确保EDTA中没有Ca2+ ,并且在添加EDTA之前,用PBS充分冲洗含有菌落的培养皿以除去任何剩余的细胞培养基。过度的解离会产生过小的分离细胞或细胞团块,这可能是由于过度研磨而产生的,并损害了新菌落的建立。研磨程度应在方案的试运行中凭经验确定,以确认所得细胞团块的直径为~60μm。如果饲养层自发地从培养皿中分离,特别是在 hESC/hiPSC 准备收获之前,这可能是因为饲养层细胞在制备后 ~7 天内未使用。因此,应仔细监测馈线电池的使用时间范围。如果饲养层在EDTA暴露期间解离(我们从未在这里使用的饲养层细胞中观察到这种情况),则必须改变饲养层细胞的类型或其培养方法。
技术的局限性
该技术的主要局限性在于需要目视检查脱粘过程才能获得成功的结果。这意味着用户必须学习如何识别菌落何时从饲养层细胞层释放以及饲养层细胞层何时从基质上松动。然而,这并不难,根据我们的经验,该技术的新用户可以在几次试验中掌握它。
收获的 hESC 或 hiPSC 也可能被少数饲养细胞污染。如果打算转移到非饲养条件或分离 hESC 或 hiPSC 进行检测,则此类污染会损害纯度。我们注意到,对于这里使用的饲养细胞(人包皮成纤维细胞),即使进行酶消化(未显示),也很难解离饲养细胞层。由于未解离的饲养层细胞层 被彻底去除,因此收获的 hESC 或 hiPSC 的污染可能可以忽略不计。此外,由于饲养细胞被有丝分裂阻滞,任何污染最终都会随着 hESC 或 hiPSC 的进一步传代而减少到零。
对现有方法的意义
目前培养 hESC 和 hiPSC 的标准是在无饲养层条件下进行,其中广泛使用 EDTA 进行传代。无饲养层培养取决于使用特殊配方的培养基和培养基质,以确保粘附性。这些试剂需要额外的费用,可能会超过一些实验室的预算。此外,由于无饲养层培养基中缺乏特定因素,因此在无饲养层条件下的培养与扰动的分化潜力有关,并且由此导致从幼稚状态过渡到引发状态。有丝分裂阻滞的饲养细胞的生长避免了这种转变,可以将总体成本降低到可控的水平,从而促进多能干细胞在实验室研究中的更广泛使用。
披露声明
乔尔·格洛弗(Joel C. Glover)是挪威人类多能干细胞核心设施的主任,海格·布林克·费丁斯塔德(Hege Brincker Fjerdingstad)是挪威人类多能干细胞核心设施的日常经理。作者没有相互竞争的经济利益或其他利益冲突需要披露。
致谢
我们感谢Lars Moen在初步实验期间提供的帮助,并感谢奥斯陆大学医院挪威干细胞研究中心的挪威人类多能干细胞核心设施的使用。H9 hESC系购自WiCell,HS429 hESC系购自卡罗林斯卡学院的Outi Hovatta。两者都是按照材料转让协议使用的。NCS001 和 NCS002 hiPSC 细胞系由挪威人多能干细胞核心设施生成。重新编程和此处报告的所有工作都是在挪威东南部地区伦理委员会(批准 REK 2017/110)的批准下进行的。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA pH 8.0 | Invitrogen | 15575020 | |
| 15 mL centrifuge tubes | Sarstedt | 62.554.502 | |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| 50 mL centrifuge tubes | Sarstedt | 62.547.254 | |
| Basic fibroblast growth factor (bFGF) | PeproTech | AF-100-18B-250UG | |
| Brand Bürker Chamber | Fisher Scientific | 10628431 | |
| Disposable scalpels no.15 | Susann-Morton | 505 | |
| DPBS (1x) without Ca/Mg | Gibco | 14190-094 | |
| Easy Grip tissue culture dish, 35 x 10 mm | Falcon | 353001 | |
| Eppendorf pipette 1 mL | Eppendorf | ||
| Eppendorf pipette 200 μL | Eppendorf | ||
| FBS (Fetal Bovine Serum) | Gibco | 10270-106 | |
| Filter tip 1,000 μL | Sarstedt | 70.1186.210 | |
| Filter tip 200 μL | Sarstedt | 70.760.211 | |
| Gamma Cell 3000 ELAN irradiation machine (alternatively, use Mitomycin C to arrest proliferation) | Best Theratronics | BT/MTS 8007 GC3000E | |
| Glutamax 100x | Gibco | 35050-038 | |
| Growth Factor Reduced Matrixgel | Corning | 734-0269 | |
| H9 hESC line | WiCell | WAe009-A | |
| hPSC Genetic Analysis Kit | Stem Cell Technologies | #07550 | |
| HS429 hESC line | ECACC | KIe024-A | |
| Human Foreskin Fibroblasts -CRL2429 line | ATTC | CRL2429 | |
| IMDM (1x) | Gibco | 21980-032 | |
| iPSC lines | Norwegian Core Facility for Human Pluripotent Stem Cells | NCS001 & NCS002 | |
| Knockout DMEM | Gibco | 10829-018 | |
| Laser Scanning Confocal Microscope or equivalent (we use the LSM 700 from Zeiss) | Zeiss | ||
| Microscope | CETI | ||
| Mitomycin C | Sigma Aldrich | M4287 | |
| Non-essential amino acids (NEAA) | Gibco | 11140.035 | |
| Pipettes, plastic 10 mL | Sarstedt | 86.1254.001 | |
| Pipettes, plastic, 5 mL | Sarstedt | 86.1253.001 | |
| Serum Replacement (SR) | Gibco | 10828-028 | |
| Sterile filters 0.22 um | Sarstedt | 83.1826.102 | |
| T-75 culture flask | ThermoScientific | 156499 | |
| Trypan Blue Stain (0.4 %) | Gibco | 15250-061 | |
| Trypsin-EDTA, 500 mL | Gibco | 25300062 |
参考文献
- Skottman, H., Hovet, O. Culture conditions for human embryonic stem cells. Reproduction. 132 (5), 691-698 (2006).
- Hovatta, O., et al. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Human Reproduction. 18 (7), 1404-1409 (2003).
- Desai, N., Rambhia, P., Gishto, A. Human embryonic stem cell cultivation: historical perspective and evolution of xeno-free culture systems. Reproductive Biology and Endocrinology. 13, 9 (2015).
- Villa-Diaz, L. G., et al. Synthetic polymer coatings for long-term growth of human embryonic stem cells. Nature Biotechnology. 28 (6), 581-583 (2010).
- Watanabe, M., et al. TGFb superfamily signaling regulates the state of human stem cell pluripotency and capacity to create well-structured telencephalic organoids. Stem Cell Reports. 17 (10), 2220-2238 (2022).
- Garitaonandia, I., et al. Increased risk of genetic and epigenetic instability in human embryonic stem cells associated with specific culture conditions. PLoS One. 10 (2), e0118307 (2015).
- Inzunza, J., et al. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Rivera, T., Zhao, Y., Ni, Y., Wang, J. Human-induced pluripotent stem cell culture methods under cGMP conditions. Current Protocols in Stem Cell Biology. 54 (1), 117 (2020).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Molecular Therapy. Methods & Clinical Development. 23, 569-581 (2021).
- Meng, G., Rancourt, D. E. Derivation and maintenance of undifferentiated human embryonic stem cells. Methods in Molecular Biology. 873, 69-90 (2012).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。